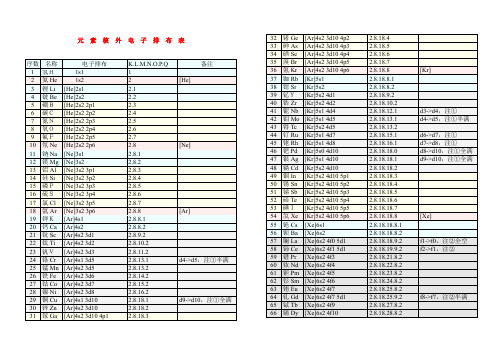
化学元素核外电子排布表
化学元素核外电子排布表

元素核外电子排布表1 / 378 铂Pt [Xe]6s1 4f14 5d9 2.8.18.32.17.1 d8->d9,注①79 金Au [Xe]6s1 4f14 5d10 2.8.18.32.18.1 d9->d10,注①全满80 汞Hg [Xe]6s2 4f14 5d10 2.8.18.32.18.281 铊Tl [Xe]6s2 4f14 5d10 6p1 2.8.18.32.18.382 铅Pb [Xe]6s2 4f14 5d10 6p2 2.8.18.32.18.483 铋Bi [Xe]6s2 4f14 5d10 6p3 2.8.18.32.18.584 钋Po [Xe]6s2 4f14 5d10 6p4 2.8.18.32.18.6 红色为放射性元素85 砹At [Xe]6s2 4f14 5d10 6p5 2.8.18.32.18.786 氡Rn [Xe]6s2 4f14 5d10 6p6 2.8.18.32.18.8 [Rn]87 钫Fr [Rn]7s1 2.8.18.32.18.8.188 镭Ra [Rn]7s2 2.8.18.32.18.8.289 锕Ac [Rn]7s2 5f0 6d1 2.8.18.32.18.9.2 f1->f0,注②全空90 钍Th [Rn]7s2 5f0 6d2 2.8.18.32.18.10.2 f2->f0,注②全空91 镤Pa [Rn]7s2 5f2 6d1 2.8.18.32.20.9.2 f3->f2,注②92 铀U[Rn]7s2 5f3 6d1 2.8.18.32.21.9.2 f4->f3,注②93 镎Np [Rn]7s2 5f4 6d1 2.8.18.32.22.9.2 f5->f4,注②94 钚Pu [Rn]7s2 5f6 2.8.18.32.24.8.295 镅Am [Rn]7s2 5f7 2.8.18.32.25.8.2 加粗为人造元素96 锔Cm [Rn]7s2 5f7 6d1 2.8.18.32.25.9.2 f8->f7,注②半满97 锫Bk [Rn]7s2 5f9 2.8.18.32.27.8.298 锎Cf [Rn]7s2 5f10 2.8.18.32.28.8.299 锿Es [Rn]7s2 5f11 2.8.18.32.29.8.2100 镄Fm [Rn]7s2 5f12 2.8.18.32.30.8.2101 钔Md [Rn]7s2 5f13 2.8.18.32.31.8.2 兰色为估计排布式102 锘No [Rn]7s2 5f14 2.8.18.32.32.8.2103 铹Lr [Rn]7s2 5f14 6d1 2.8.18.32.32.9.2104 Rf [Rn]7s2 5f14 6d2 2.8.18.32.32.10.2105 Ha [Rn]7s2 5f14 6d3 2.8.18.32.32.11.2106 [Rn]7s2 5f14 6d4 2.8.18.32.32.12.2107 [Rn]7s2 5f14 6d5 2.8.18.32.32.13.2108 [Rn]7s2 5f14 6d6 2.8.18.32.32.14.2109 [Rn]7s2 5f14 6d7 2.8.18.32.32.15.2110 [Rn]7s1 5f14 6d9 2.8.18.32.32.17.1 d8->d9,注①111 [Rn]7s1 5f14 6d10 2.8.18.32.32.18.1 d9->d10,注①全满112 [Rn]7s2 5f14 6d10 2.8.18.32.32.18.2113 [Rn]7s2 5f14 6d10 7p1 2.8.18.32.32.18.3114 [Rn]7s2 5f14 6d10 7p2 2.8.18.32.32.18.4115 [Rn]7s2 5f14 6d10 7p3 2.8.18.32.32.18.5116 [Rn]7s2 5f14 6d10 7p4 2.8.18.32.32.18.6117 [Rn]7s2 5f14 6d10 7p5 2.8.18.32.32.18.7 灰色为未发现元素118 [Rn]7s2 5f14 6d10 7p6 2.8.18.32.32.18.8注:①d亚层在s亚层外,常多填d亚层(使之趋于全满/半满),少填s亚层②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满)2 / 33 / 3。
核外电子排布与元素周期表
探究整合应用
假定元素周期表是有限的,根据已知的元素周期 表的某些事实和理论可归纳出一些假说。 (1)已知元素周期表中的各周期可排元素种数如下:
周期 1 2 3 4 5 6 7 元素种数 2 8 8 18 18 32 32
人们预测元素周期表第8周期将来也会排满,那么
2.原子半径的周期性变化
(1)同周期:左→右,有效核电荷增加, r减小
(2)同主族:上→下,。。。。。减小, r增大
(3)过渡元素:左→右 ,…变化幅度不 大, r稍减
1.电子构型为[Ar]3d104s2的元素是( )
A.稀有气体
B.过渡元素
C.主族元素
D.卤族元素
选B。该元素的价电子排布式中出现d轨道,应为ⅡB 族
解析:M2+3d轨道上有5个电子则电子排布式为 1s22s22p63s23p63d5。故M原子的电子排布式为: 1s22s22p63s23p63d54s2。 该元素的价电子排布式为:3d54s2,所以该元素在周期表 中的位置为第4周期ⅦB族,因最后一个电子进入d轨道所 以该元素位于d区。 答案:(1)1s22s22p63s23p63d54s2 (2)4 ⅦB d
元素,而副族元素属于过渡元素,故B正确。
2.按原子半径由大到小排列顺序正确的是( )
A.Mg、B、Si
B.Si、Mg、B
C.Mg、Si、B
D.B、Si、Mg
选C。
3.某元素M2+的3d轨道上有5个电子,则 (1)M原子的核外电子排布式为________________。 (2)M元素在元素周期表中的位置为第__________周期 ________族,________区。
核外电子排布
氯(Cl)
氩(Ar)
稀有气体元素、金 属元素和非金属元素的 原子最外层的电子数都 各有特点:
1.稀有气体元素。 • 原子的最外层都有8个电子(氦是 2个)。 • 稀有气体元素也曾叫过惰性气体元 素,它们的化学性质比较稳定,一 般不跟其他物质发生化学反应。 • 通常认为这种最外层有8个电子 (最外层是第一层时有2个电子) 的结构,是一种稳定结构。(相对 的稳定,不是绝对的稳定)
2.金属元素。像镁、铁、铝等,它们原子的 最外层电子的数目一般少于4个。 3.非金属元素。像氟、氯、硫、磷、碳等, 它们原子的最外层电子的数目一般多于或 等于4个。
在化学反应中,金属 Cl 元素的原子比较容易失 Na +17 去最外层电子而使次外 +11 层变成最外层,通常达 到8个电子的稳定机构; - 非金属元素的原子比较 Cl Na+ 容易获得电子,也使最 +17 +11 外层通常达到8个电子 的稳定结构。所以,元 素的性质,特别是化学 性质,跟它的原子的最 Na+ Cl 外层电子数目关系非常 化合物——氯化钠 密切。
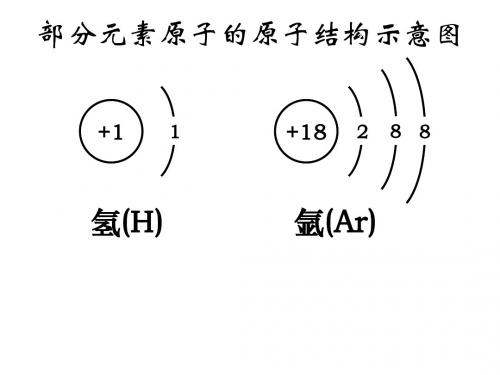
部分元素原子的原子结构示意图
+1
1
+18
2
8 8
氢(H)
氩(Ar)
+1
+2
氢(H)
+3 +4 +5 +6 +7 +8 +9
氦(He)
+10
锂(Li)
铍(Be)
+12
硼(B)
碳(C)
+14
氮(N)
氧(O)
&8
+11
+13
+15
核外电子排布和化合价

示意图为 +7 2 5 。则氮化镓的化学式是
(
C
)
A Ga3N2
B Ga2N3
C GaN
D Ga5N3
练习
请按顺序写出 S 的各种符号:
练习
判断下列化合物中氯元素化合价:
HCl
HClO HClO3 HClO4 Cl2 NaCl
(+1×1)+X+(-2×1)=0 X= +1
HCl和NaCl中氯元素化合价都是-1价,两者意义
相同吗?
练习
1998年中国十大科技成果之一是合成纳米氮化镓。已知镓
(Ga)原子结构示意图为 &交叉,约分。
三、数字在不同位置的意义
1、前 xM
2、右下角
3、右上角
Mx
M
+x
x+
4、正上方
M
练习
指出下列符号周围数字“2”的意义
2H Mg2+
H2S
-2
CO
小
结
一、核外电子排布与化合价
二、化合价与化学式
三、数字在不同位置的意义
练习
1、钠原子的结构示意图为
+11 2 8 1 ,钠的相对原子质
量为23,失去一个电子后,发生的改变是 A 核内质子数 C 电子层数
(
C
化学元素核外电子排布表.doc

104 Rf [Rn]7s2 5f14 6d2
105 Ha [Rn]7s2 5f14 6d3
106
[Rn]7s2 5f14 6d4
107
[Rn]7s2 5f14 6d5
108
[Rn]7s2 5f14 6d6
109
[Rn]7s2 5f14 6d7
110
[Rn]7s1 5f14 6d9
111
[Rn]7s1 5f14 6d10
37 铷 Rb 38 锶 Sr
电子排布
1s1 1s2
[He]2s1 [He]2s2 [He]2s2 2p1 [He]2s2 2p2 [He]2s2 2p3 [He]2s2 2p4 [He]2s2 2p5 [He]2s2 2p6 [Ne]3s1 [Ne]3s2 [Ne]3s2 3p1 [Ne]3s2 3p2 [Ne]3s2 3p3 [Ne]3s2 3p4 [Ne]3s2 3p5 [Ne]3s2 3p6 [Ar]4s1 [Ar]4s2 [Ar]4s2 3d1 [Ar]4s2 3d2 [Ar]4s2 3d3 [Ar]4s1 3d5 [Ar]4s2 3d5 [Ar]4s2 3d6 [Ar]4s2 3d7 [Ar]4s2 3d8 [Ar]4s1 3d10 [Ar]4s2 3d10 [Ar]4s2 3d10 4p1 [Ar]4s2 3d10 4p2 [Ar]4s2 3d10 4p3 [Ar]4s2 3d10 4p4 [Ar]4s2 3d10 4p5 [Ar]4s2 3d10 4p6
2.8.18.9.2 2.8.18.10.2 2.8.18.12.1 2.8.18.13.1 2.8.18.13.2 2.8.18.15.1 2.8.18.16.1 2.8.18.18.0 2.8.18.18.1 2.8.18.18.2 2.8.18.18.3 2.8.18.18.4 2.8.18.18.5 2.8.18.18.6 2.8.18.18.7 2.8.18.18.8 2.8.18.18.8.1 2.8.18.18.8.2 2.8.18.18.9.2 2.8.18.19.9.2 2.8.18.21.8.2 2.8.18.22.8.2 2.8.18.23.8.2 2.8.18.24.8.2 2.8.18.25.8.2 2.8.18.25.9.2 2.8.18.27.8.2 2.8.18.28.8.2 2.8.18.29.8.2 2.8.18.30.8.2 2.8.18.31.8.2 2.8.18.32.8.2 2.8.18.32.9.2 2.8.18.32.10.2 2.8.18.32.11.2 2.8.18.32.12.2 2.8.18.32.13.2 2.8.18.32.14.2 2.8.18.32.15.2 2.8.18.32.17.1
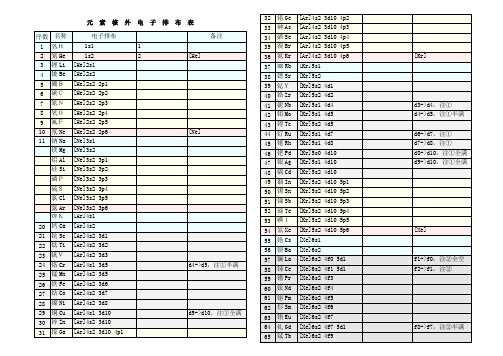
化学元素核外电子排布表
41
铌Nb
[Kr]5s1 4d4
2.8.18.12.1
d3->d4,注①
42
钼Mo
[Kr]5s1 4d5
2.8.18.13.1
d4->d5,注①半满
43
锝Tc
[Kr]5s2 4d5
2.8.18.13.2
44
钌Ru
[Kr]5s1 4d7
2.8.18.15.1
d6->d7,注①
45
2.8.18.32.11.2
74
钨W
[Xe]6s2 4f14 5d4
2.8.18.32.12.2
75
铼Re
[Xe]6s2 4f14 5d5
2.8.18.32.13.2
76
锇Os
[Xe]6s2 4f14 5d6
2.8.18.32.14.2
77
铱Ir
[Xe]6s2 4f14 5d7
2.8.18.32.15.2
69
铥Tm
[Xe]6s2 4f13
2.8.18.31.8.2
70
镱Yb
[Xe]6s2 4f14
2.8.18.32.8.2
71
镥Lu
[Xe]6s2 4f14 5d1
2.8.18.32.9.2
72
铪Hf
[Xe]6s2 4f14 5d2
2.8.18.32.10.2
73
钽Ta
[Xe]6s2 4f14 5d3
2.8.18.32.32.18.7
灰色为未发现元素
118
[Rn]7s2 5f14 6d10 7p6
2.8.18.32.32.18.8
注:①d亚层在s亚层外,常多填d亚层(使之趋于全满/半满),少填s亚层
化学元素核外电子排布表

d7->d8,注①
46
钯Pd
[Kr]5s0 4d10
2.8.18.18.0
d8->d10,注①全满
47
银Ag
[Kr]5s1 4d10
2.8.18.18.1
d9->d10,注①全满
48
镉Cd
[Kr]5s2 4d10
2.8.18.18.2
49
铟In
[Kr]5s2 4d10 5p1
2.8.18.18.3
41
铌Nb
[Kr]5s1 4d4
2.8.18.12.1
d3->d4,注①
42
钼Mo
[Kr]5s1 4d5
2.8.18.13.1
d4->d5,注①半满
43
锝Tc
[Kr]5s2 4d5
2.8.18.13.2
44
钌Ru
[Kr]5s1 4d7
2.8.18.15.1
d6->d7,注①
45
铑Rh
[Kr]5s1 4d8
35
溴Br
[Ar]4s2 3d10 4p5
2.8.18.7
36
氪Kr
[Ar]4s2 3d10 4p6
2.8.18.8
[Kr]
37
铷Rb
[Kr]5s1
2.8.18.8.1
38
锶Sr
[Kr]5s2
2.8.18.8.2
39
钇Y
[Kr]5s2 4d1
2.8.18.9.2
40
锆Zr
[Kr]5s2 4d2
2.8.18.10.2
24
铬Cr
[Ar]4s1 3d5
化学元素核外电子排布表

96
锔Cm
[Rn]7s2 5f7 6d1
f8->f7,注②半满
97
锫Bk
[Rn]7s2 5f9
98
锎Cf
[Rn]7s2 5f10
99
锿Es
[Rn]7s2 5f11
100
镄Fm
[Rn]7s2 5f12
101
钔Md
[Rn]7s2 5f13
兰色为估计排布式
102
锘No
[Rn]7s2 5f14
元素核外电子排布表
序数
名称
电子排布
备注
1
氢H
1s1
1
2
氦He
1s2
2
[He]
3
锂Li
[He]2s1
4
铍Be
[He]2s2
5
硼B
[He]2s2 2p1
6
碳C
[He]2s2 2p2
7
氮N
[He]2s2 2p3
8
氧O
[He]2s2 2p4
9
氟F
[He]2s2 2p5
10
氖Ne
[He]2s2 2p6
[Ne]
23
钒V
[Ar]4s2 3d3
24
铬Cr
[Ar]4s1 3d5
d4->d5,注①半满
25
锰Mn
[Ar]4s2 3d5
26
铁Fe
[Ar]4s2 3d6
27
钴Co
[Ar]4s2 3d7
28
镍Ni
[Ar]4s2 3d8
29
铜Cu
[Ar]4s1 3d10
d9->d10,注①全满
化学元素核外电子排布表

[Rn]7s2 5f12
钔Md
[Rn]7s2 5f13
兰色为估计排布式
102
锘No
[Rn]7s2 5f14
铹Lr
[Rn]7s2 5f14 6d1
Rf
[Rn]7s2 5f14 6d2
Ha
[Rn]7s2 5f14 6d3
5f14 6d4
5f14 6d5
5f14 6d6
5f14 6d7
5f14 6d9
,注①
111
[Rn]7sபைடு நூலகம் 5f14 6d10
,注①全满
112
[Rn]7s2 5f14 6d10
5f14 6d10 7p1
5f14 6d10 7p2
5f14 6d10 7p3
5f14 6d10 7p4
5f14 6d10 7p5
灰色为未发现元素
118
[Rn]7s2 5f14 6d10 7p6
注:①d亚层在s亚层外,常多填d亚层(使之趋于全满/半满),少填s亚层
红色为放射性元素
85
砹At
[Xe]6s2 4f14 5d10 6p5
氡Rn
[Xe]6s2 4f14 5d10 6p6
钫Fr
[Rn]7s1
镭Ra
[Rn]7s2
锕Ac
[Rn]7s2 5f0 6d1
,注②全空
90
钍Th
[Rn]7s2 5f0 6d2
,注②全空
91
镤Pa
[Rn]7s2 5f2 6d1
,注②
92
元素核外电子排布表
序数
名称
电子排布
备注
1
氢H
1s1
1
2
氦He
核外电子排布与元素周期表

各族元素原子的价电子排布
族
第一主族 第二主族 第三副族 第四副族 第五副族 第六副族 第七副族 第八族
价电子 排布
价电子数
族
第一副族 第二副族 第三主族 第四主族 第五主族 第六主族 第七主族
零族
价电子排 布
价电子数
二、核外电子排布与族的划分
1)外围电子结构一般相同 2)元素所在族的判断:
①主族元素:主族序数=外围电子数=最外层电子数
的半径.
原子半径的几种形式(见书P17图1-2-9)
(1)共价半径. 按分子中两原子核间距离是两原子的半径
和进行测定的数据.(常用数据) (2)金属半径
由金属晶体中原子之间最短距离计算而得. (3)范得华半径
由分子晶体中原子之间最短距离计算而得. 由图可知: 一般有下列关系:
范得华半径>金属半径>共价半径
洪特规则的特例:
对于能量相同的轨道(同一电子亚层),当电子排布 处于全满(s2、p6、d10、f14)、半满(s1、 p3、d5、f7)、全空(s0、p0、d0、f0)时比较 稳定,整个体系的能量最低。
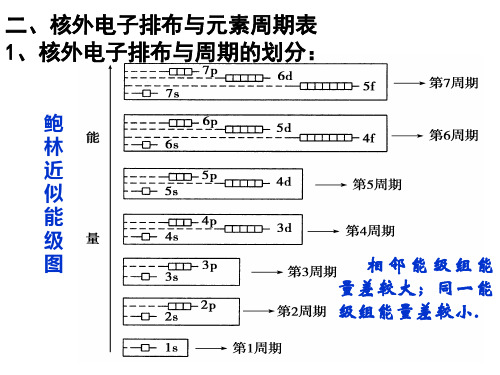
鲍林近似能级图
1.元素周期表共有几个周期?每个周期各有多 少中元素?写出每一周期开头第一个元素和结 尾元素的最外层电子排布通式。为什么第一周 期结尾元素的电子排布跟其他周期不同?
按照电子排布,可把周期表的元素划 分为5个区:s区、d区、ds区、p区、f区 。
【想一想】 划分区的依据是什么? s区、d
区、ds区、p区分别有几个纵列?
依据外围电子的排布特征, 看最后一个电子填充的轨道类型 。
s区元素
最后1个电子填充在 n轨s 道上, 价电子的构型是 或 ns,1 位ns于2 周 期表的 侧,包左括 和 ⅠA ⅡA族,它们都是 活泼,金容属易失去 电子形成 或 价+1离子+。2
核外电子排布式

[1]H氢1s1[2]He氦1s2[3]Li锂1s2 2s1[4]Be铍1s2 2s2[5]B硼1s2 2s2 2p1[6]C碳1s2 2s2 2p2[7]N氮1s2 2s2 2p3[8]O氧1s2 2s2 2p4[9]F氟1s2 2s2 2p5[10]Ne氖1s2 2s2 2p6[11]Na钠1s2 2s2 2p6 3s1[12]Mg镁1s2 2s2 2p6 3s2[13]Al铝1s2 2s2 2p6 3s2 3p1[14]Si硅1s2 2s2 2p6 3s2 3p2[15]P磷1s2 2s2 2p6 3s2 3p3[16]S硫1s2 2s2 2p6 3s2 3p4[17]Cl氯1s2 2s2 2p6 3s2 3p5[18]Ar氩1s2 2s2 2p6 3s2 3p6[19]K钾1s2 2s2 2p6 3s2 3p6 4s1 [20]Ca钙1s2 2s2 2p6 3s2 3p6 4s2 [21]Sc钪1s2 2s2 2p6 3s2 3p6 3d1 4s2 [22]Ti钛1s2 2s2 2p6 3s2 3p6 3d2 4s21s2 2s2 2p6 3s2 3p6 3d3 4s2*[24]Cr铬1s2 2s2 2p6 3s2 3p6 3d5 4s1 [25]Mn锰1s2 2s2 2p6 3s2 3p6 3d5 4s2 [26]Fe铁1s2 2s2 2p6 3s2 3p6 3d6 4s2 [27]Co钴1s2 2s2 2p6 3s2 3p6 3d7 4s2 [28]Ni镍1s2 2s2 2p6 3s2 3p6 3d8 4s2*[29]Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1 [30]Zn锌1s2 2s2 2p6 3s2 3p6 3d10 4s2 [31]Ga镓1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1 [32]Ge锗1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 [33]As砷1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p31s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4[35]Br 溴1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 5[36]Kr 氪1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 例3.不同元素的气态原子失去最外层一个电子所需要的能量(设其为E )如下图所示。
化学元素核外电子排布表(各亚层电子排布)[PDF]
![化学元素核外电子排布表(各亚层电子排布)[PDF]](https://img.taocdn.com/s3/m/04fa9c787fd5360cba1adb61.png)
兰色为估计排布式
d8->d9,注① d9->d10,注①全满
灰色பைடு நூலகம்未发现元素
[Ne]
[Ar]
d4->d5,注①半满
d9->d10,注①全满
[Kr]
39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78
K.L.M.N.O.P.Q 1 2 2.1 2.2 2.3 2.4 2.5 2.6 2.7 2.8 2.8.1 2.8.2 2.8.3 2.8.4 2.8.5 2.8.6 2.8.7 2.8.8 2.8.8.1 2.8.8.2 2.8.9.2 2.8.10.2 2.8.11.2 2.8.13.1 2.8.13.2 2.8.14.2 2.8.15.2 2.8.16.2 2.8.18.1 2.8.18.2 2.8.18.3 2.8.18.4 2.8.18.5 2.8.18.6 2.8.18.7 2.8.18.8 2.8.18.8.1 2.8.18.8.2
元 序数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 名称 氢H 氦 He 锂 Li 铍 Be 硼B 碳C 氮N 氧O 氟F 氖 Ne 钠 Na 镁 Mg 铝 Al 硅 Si 磷P 硫S 氯 Cl 氩 Ar 钾K 钙 Ca 钪 Sc 钛 Ti 钒V 铬 Cr 锰 Mn 铁 Fe 钴 Co 镍 Ni 铜 Cu 锌 Zn 镓 Ga 锗 Ge 砷 As 硒 Se 溴 Br 氪 Kr 铷 Rb 锶 Sr
核外电子排布元素周期表

2020年11月11日
1—18号元素原子结构示意图
周期序数=电子层数
1
族序号=最外层电子数
2
3
2020年11月11日
二、元素周期表
1.编排原则
A 按原子序数的递增顺序从左到右排列
B 将电子层数相同的元素排列成一个横行
C
把最外层电子数相同的元素按电子层数递增 的顺序从上到下排成纵行。
2020年11月11日
2020年11月11日
元素的“位—构”关系
以钠为例:
第3周期
ⅠA 族
1.书写原子 2.周期序数= 3.族序号=最 结构示意图 电子层数 外层电子数
2020年11月11日
练一练
4.指出Br在周期表中的位置 Br:第4周期 ⅦA族
5.某元素位于第二周期,第ⅦA 族,它 是_氟__元素。
2020年11月11日
门捷列夫
梦中的景象 • 从学生时代开始,门捷列夫就一直对“元素”与 “元素”之间可能存在的种种关联感兴趣,并且 利用一切时间对化学元素进行研究。
不过是十五 • 一天清晨,门捷列夫经过一个夜晚的研究后,疲 倦地躺在书房的沙发上,不知不觉就睡着了。睡
年来的努力! 梦中,他突然清晰地看见元素排列成周期表浮现 在他的眼前,他又惊又喜,随即清醒过来,顺手 记下梦中的元素周期表。 • 因为在梦中得到灵感,元素周期表的发现又被称 为四大名梦之一。
2020年11月11日
2种元素 8种元素 8种元素
18种元素 18种元素
32种元素 ……
二、元素周期表的结构
周 期
(横行)
2n2
三长三短一不全
短周期:1~3周期 长周期:4~7周期 不完全周期:第7周期
化学元素核外电子排布表

90
钍Th
[Rn]7s2 5f0 6d2
2.8.18.32.18.10.2
f2->f0,注②全空
91
镤Pa
[Rn]7s2 5f2 6d1
2.8.18.32.20.9.2
f3->f2,注②
92
铀U
[Rn]7s2 5f3 6d1
2.8.18.32.21.9.2
f4->f3,注②
93
2.8.6
17
氯Cl
[Ne]3s2 3p5
2.8.7
18
氩Ar
[Ne]3s2 3p6
2.8.8
[Ar]
19
钾K
[Ar]4s1
2.8.8.1
20
钙Ca
[Ar]4s2
2.8.8.2
21
钪Sc
[Ar]4s2 3d1
2.8.9.2
22
钛Ti
[Ar]4s2 3d2
2.8.10.2
23
钒V
[Ar]4s2 3d3
2.8.11.2
24
铬Cr
[Ar]4s1 3d5
2.8.13.1
d4->d5,注①半满
25
锰Mn
[Ar]4s2 3d5
2.8.13.2
26
铁Fe
[Ar]4s2 3d6
2.8.14.2
27
钴Co
[Ar]4s2 3d7
2.8.15.2
28
镍Ni
[Ar]4s2 3d8
2.8.16.2
29
铜Cu
[Ar]4s1 3d10
2.8.18.32.32.18.7
灰色为未发现元素
化学元素核外电子排布表
铥Tm
[Xe]6s2 4f13
70
镱Yb
[Xe]6s2 4f14
71
镥Lu
[Xe]6s2 4f14 5d1
72
铪Hf
[Xe]6s2 4f14 5d2
73
钽Ta
[Xe]6s2 4f14 5d3
74
钨W
[Xe]6s2 4f14 5d4
75
铼Re
[Xe]6s2 4f14 5d5
76
锇Os
[Xe]6s2 4f14 5d6
d8->d9,注①
111
[Rn]7s1 5f14 6d10
d9->d10,注①全满
112
[Rn]7s2 5f14 6d10
113
[Rn]7s2 5f14 6d10 7p1
114
[Rn]7s2 5f14 6d10 7p2
115
[Rn]7s2 5f14 6d10 7p3
116
[Rn]7s2 5f14 6d10 7p4
23
钒V
[Ar]4s2 3d3
24
铬Cr
[Ar]4s1 3d5
d4->d5,注①半满
25
锰Mn
[Ar]4s2 3d5
26
铁Fe
[Ar]4s2 3d6
27
钴Co
[Ar]4s2 3d7
28
镍Ni
[Ar]4s2 3d8
29
铜Cu
[Ar]4s1 3d10
d9->d10,注①全满
30
锌Zn
[Ar]4s2 3d10
钯Pd
[Kr]5s0 4d10
d8->d10,注①全满
47
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
111
[Rn]7s1 5f14 6d10
,注①全满
112
[Rn]7s2 5f14 6d10
5f14 6d10 7p1
5f14 6d10 7p2
5f14 6d10 7p3
5f14 6d10 7p4
5f14 6d10 7p5
灰色为未发现元素
118
[Rn]7s2 5f14 6d10 7p6
注:①d亚层在s亚层外,常多填d亚层(使之趋于全满/半满),少填s亚层
11
钠Na
[Ne]3s1
镁Mg
[Ne]3s2
铝Al
[Ne]3s2 3p1
硅Si
[Ne]3s2 3p2
磷P
[Ne]3s2 3p3
硫S
[Ne]3s2 3p4
氯Cl
[Ne]3s2 3p5
氩Ar
[Ne]3s2 3p6
钾K
[Ar]4s1
钙Ca
[Ar]4s2
钪Sc
[Ar]4s2 3d1
钛Ti
[Ar]4s2 3d2
钒V
[Ar]4s2 3d3
铬Cr
[Ar]4s1 3d5
,注①半满
25
锰Mn
[Ar]4s2 3d5
铁Fe
[Ar]4s2 3d6
钴Co
[Ar]4s2 3d7
镍Ni
[Ar]4s2 3d8
铜Cu
[Ar]4s1 3d10
,注①全满
30
锌Zn
[Ar]4s2 3d10
镓Ga
[Ar]4s2 3d10 4p1
锗Ge
[Ar]4s2 3d10 4p2
②d亚层在f亚层外,常多填d亚层,少填f亚层(使之趋于全空/半满)
锑Sb
[Kr]5s2 4d10 5p3
碲Te
[Kr]5s2 4d10 5p4
碘I
[Kr]5s2 4d10 5p5
氙Xe
[Kr]5s2 4d10 5p6
铯Cs
[Xe]6s1
钡Ba
[Xe]6s2
镧La
[Xe]6s2 4f0 5d1
,注②全空
58
铈Ce
[Xe]6s2 4f1 5d1
,注②
59
镨Pr
[Xe]6s2 4f3
红色为放射性元素
85
砹At
[Xe]6s2 4f14 5d10 6p5
氡Rn
[Xe]6s2 4f14 5d10 6p6
钫Fr
[Rn]7s1
镭Ra
[Rn]7s2
锕Ac
[Rn]7s2 5f0 6d1
,注②全空
90
钍Th
[Rn]7s2 5f0 6d2
,注②全空
91
镤Pa
[Rn]7s2 5f2 6d1
,注②
92
铀U
[Rn]7s2 5f3 6d1
,注②
93
镎Np
[Rn]7s2 5f4 6d1
,注②
94
钚Pu
[Rn]7s2 5f6
镅Am
[Rn]7s2 5f7
加粗为人造元素
96
锔Cm
[Rn]7s2 5f7 6d1
,注②半满
97
锫Bk
[Rn]7s2 5f9
锎Cf
[Rn]7s2 5f10
锿Es
[Rn]7s2 5f11
元素核外电子排布表
序数
名称
电子排布
备注
1
氢H
1s1
1
2
氦He
1s2
2
[He]
3
锂Li
[He]2s1
4
铍Be
[He]2s2
5
硼B
[He]2s2 2p1
6
碳C
[He]2s2 2p2
7
氮N
[He]2s2 2p3
8
氧O
[He]2s2 2p4
9
氟F
[He]2s2 2p5
10
氖Ne
[He]2s2 2p6
[Ne]
,注①半满
43ห้องสมุดไป่ตู้
锝Tc
[Kr]5s2 4d5
钌Ru
[Kr]5s1 4d7
,注①
45
铑Rh
[Kr]5s1 4d8
,注①
46
钯Pd
[Kr]5s0 4d10
,注①全满
47
银Ag
[Kr]5s1 4d10
,注①全满
48
镉Cd
[Kr]5s2 4d10
铟In
[Kr]5s2 4d10 5p1
锡Sn
[Kr]5s2 4d10 5p2
砷As
[Ar]4s2 3d10 4p3
硒Se
[Ar]4s2 3d10 4p4
溴Br
[Ar]4s2 3d10 4p5
氪Kr
[Ar]4s2 3d10 4p6
铷Rb
[Kr]5s1
锶Sr
[Kr]5s2
钇Y
[Kr]5s2 4d1
锆Zr
[Kr]5s2 4d2
铌Nb
[Kr]5s1 4d4
,注①
42
钼Mo
[Kr]5s1 4d5
镱Yb
[Xe]6s2 4f14
镥Lu
[Xe]6s2 4f14 5d1
铪Hf
[Xe]6s2 4f14 5d2
钽Ta
[Xe]6s2 4f14 5d3
钨W
[Xe]6s2 4f14 5d4
铼Re
[Xe]6s2 4f14 5d5
锇Os
[Xe]6s2 4f14 5d6
铱Ir
[Xe]6s2 4f14 5d7
铂Pt
[Xe]6s1 4f14 5d9
,注①
79
金Au
[Xe]6s1 4f14 5d10
,注①全满
80
汞Hg
[Xe]6s2 4f14 5d10
铊Tl
[Xe]6s2 4f14 5d10 6p1
铅Pb
[Xe]6s2 4f14 5d10 6p2
铋Bi
[Xe]6s2 4f14 5d10 6p3
钋Po
[Xe]6s2 4f14 5d10 6p4
钕Nd
[Xe]6s2 4f4
钷Pm
[Xe]6s2 4f5
钐Sm
[Xe]6s2 4f6
铕Eu
[Xe]6s2 4f7
钆Gd
[Xe]6s2 4f7 5d1
,注②半满
65
铽Tb
[Xe]6s2 4f9
镝Dy
[Xe]6s2 4f10
钬Ho
[Xe]6s2 4f11
铒Er
[Xe]6s2 4f12
铥Tm
[Xe]6s2 4f13
镄Fm
[Rn]7s2 5f12
钔Md
[Rn]7s2 5f13
兰色为估计排布式
102
锘No
[Rn]7s2 5f14
铹Lr
[Rn]7s2 5f14 6d1
Rf
[Rn]7s2 5f14 6d2
Ha
[Rn]7s2 5f14 6d3
5f14 6d4
5f14 6d5
5f14 6d6
5f14 6d7
5f14 6d9
