热统第三章
热力学与统计物理第三章知识总结

§3.1 热动平衡判据当均匀系统与外界达到平衡时,系统的热力学参量必须满足一定的条件,称为系统的平衡条件。
这些条件可以利用一些热力学函数作为平衡判据而求出。
下面先介绍几种常用的平衡判据。
oisd一、平衡判据1、熵判据熵增加原理,表示当孤立系统达到平衡态时,它的熵增加到极大值,也就是说,如果一个孤立系统达到了熵极大的状态,系统就达到了平衡态。
于是,我们就能利用熵函数的这一性质来判定孤立系统是否处于平衡态,这称为熵判据。
孤立系统是完全隔绝的,与其他物体既没有热量的交换,也没有功的交换。
如果只有体积变化功,孤立系条件相当与体积不变和内能不变。
因此熵判据可以表述如下:一个系统在体积和内能不变的情形下,对于各种可能的虚变动,平衡态的熵最大。
在数学上这相当于在保持体积和内能不变的条件下通过对熵函数求微分而求熵的极大值。
如果将熵函数作泰勒展开,准确到二级有d因此孤立系统处在稳定平衡态的充分必要条件为既围绕某一状态发生的各种可能的虚变动引起的熵变,该状态的熵就具有极大值,是稳定的平衡状态。
如果熵函数有几个可能的极大值,则其中最大的极大相应于稳定平衡,其它较小的极大相应于亚稳平衡。
亚稳平衡是这样一种平衡,对于无穷小的变动是稳定是,对于有限大的变动是不稳定的。
如果对于某些变动,熵函数的数值不变,,这相当于中性平衡了。
熵判据是基本的平衡判据,它虽然只适用于孤立系统,但是要把参与变化的全部物体都包括在系统之内,原则上可以对各种热动平衡问题作出回答。
不过在实际应用上,对于某些经常遇到的物理条件,引入其它判据是方便的,以下将讨论其它判据。
2、自由能判据表示在等温等容条件下,系统的自由能永不增加。
这就是说,处在等温等容条件下的系统,如果达到了自由能为极小的状态,系统就达到了平衡态。
我们可以利用函数的这一性质来判定等温等容系统是否处于平衡态,其判据是:系统在等温等容条件下,对于各种可能的变动,平衡态的自由能最小。
这一判据称为自由能判据。
热统(第三章

§3.2 开系热力学基本方程
1. 化学势
单元单相
Gm
G n
d SmdT Vmdp
2. 开系基本方程
dG nd dn dG SdT Vdp dn
G G(T, p, n)
S G T p, n
V
G p
T
,
n
G
n T , p
U G TS pV
dU TdS pdV dn
ΔU 0 常数值 中性平衡
4. 焓判据
(U T0S p0V ) 0
p p0 p 0 H 0 ΔS 0
S,p 不变,平衡态 H 极小。
定熵定压系发生的一切过程朝 着焓减小的方向进行。
平衡态的必要条件 δH 0
δ2H 0 ΔH 0 极小值 稳定平衡 最小极值 稳定平衡 较大极值 亚稳平衡
ΔS0
ΔU 0
p0ΔV0 T0
ΔU ΔU0 0 ΔV ΔV0 0
ΔS~ ΔS ΔS0 0
ΔS~ ΔS ΔU p0ΔV 0 T0
(U T0S p0V ) 0
2. 热动平衡及其稳定性条件
U U(S,V )
ΔS δS ΔV δV
ΔU δU 1 δ2U 2
ΔS~ δS~ 1 δ2S~ 2
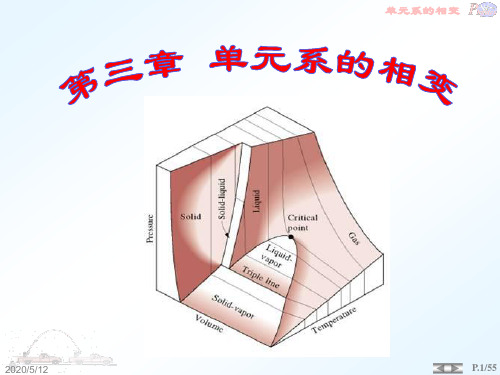
第三章 单元系的相变
1、组元 组成物质系统的化学成分 2、相 被一定边界包围,性质均匀的部分
3、虚变动:所谓虚变动是理论上假想的满足外加约束条件 的各种可能的变动,与分析力学中的虚位移相当。
1. 热动平衡判据 2. 开系热力学基本方程 3. 单元系的复相平衡 4. 气液相变和临界点
§3.1 热动平衡判据
1. 平衡条件
1
2
孤立系统
两部分为两相(或两子系, 或系统与媒质)。
热力学统计物理 第三章 课件

故而,由δS=0可以得到平衡条件,由δ2S<0可以得到 平衡的稳定性条件。
熵判据是基本的平衡判据,适用于孤立系统。 自由能判据和吉布斯函数判据 自由能判据:等温等容系统处在稳定平衡状态的必要 和充分条件为 ΔF > 0
将F作泰勒展开,准确到二级,有 1 F F 2 F 2 由δF=0和δ2F>0可以确定平衡条件和平衡的稳定性条件。
在平衡曲线上两相的化学势相等,两相可以以任意比 例共存。两相平衡是一种中性平衡。
当系统缓慢地从外界吸收或放出热量时,物质将由一
相转变到另一相而始终保持在平衡态,称为平衡相变。
单元系三相共存时,三相的温度、压强和化学势都必须相等,即 Tα = Tβ = Tγ = T , p α = p β = p γ = p
δS = 0
因为δUα、δVα、δnα是可以独立改变的,这要求 1 1 p p 0, 0, 0 T T T T T T 即
Tα = Tβ(热平衡条件)
pα = pβ(力学平衡条件)
μα =μβ(相变平衡条件)
上式指出,整个系统达到平衡时,两相的温度、压强和化 学势必须分别相等。
吉布斯函数是一个广延量,当物质的量发生变化时,吉布斯函 数也将发生变化。
对于开系,上式应推广为
dG = -SdT + Vdp +μdn 式中第三项代表由于物质的量改变dn所引起的吉布斯函数 的改变,而
称为化学势。
G n T , p
由于吉布斯函数是广延量,系统的吉布斯函数等于物
H和F分别是以S、p、n和T、V、n为独立变量的特性函数。
定义一个热力学函数 J = F -μn 称为巨热力势。
热力学统计物理第三章1

§3.1 热动平衡判据
这一节的中心问题是如何判定一个系统是否达到了平衡状态。 这一节的中心问题是如何判定一个系统是否达到了平衡状态。 如何判定一个系统是否达到了平衡状态
一、熵判据
熵增加原理指出, 孤立系统的熵永不减少。 孤立系统中发 熵增加原理指出 , 孤立系统的熵永不减少 。 生的任何实际的宏观过程,包括趋向平衡的过程, 生的任何实际的宏观过程 , 包括趋向平衡的过程 , 都朝着使系 统的熵增加的方向进行。 统的熵增加的方向进行。 不平衡状态 熵
∆S < 0
将S为泰勒展开,准确到二级。有 为泰勒展开,准确到二级。
1 2 ∆ S = δS + δ S 2
根据数学上熟知的结果: 根据数学上熟知的结果:当熵函数的一级变分 δS = 0 ,熵 时 函数有极值;可以由此得到平衡条件。 函数有极值;可以由此得到平衡条件。当熵函数的一级变分 时熵函数有极大值, δS = 0 ,二级变分 δ 2 S < 0时熵函数有极大值,由可以得到 稳定条件。如果熵函数的极大不止一个, 稳定条件。如果熵函数的极大不止一个,则其中最大的极大 相应稳定平衡。 相应稳定平衡。
泰勒展开: 泰勒展开:
f ( x ) = f ( x 0 ) + f ′( x ) x = x0 ( x − x 0 ) +
f ( x , y ) = f ( x0 , y0 ) + ∂f ( x , y ) ∂x
f ′′ ( x ) x = x 0 ( x − x 0 ) 2!
2
+ ⋯⋯
x = x0
∂p 假如子系统的体积由于某种原因发生收缩, 假如子系统的体积由于某种原因发生收缩,根据平衡稳定条件 <0 ∂p ∂V T <0 ∂V T 子系统的压强将略高于媒质的压强,于是子系统膨胀而恢复平衡。 子系统的压强将略高于媒质的压强,于是子系统膨胀而恢复平衡。
热力学统计物理第三章

孤立系统处在稳定平衡状态的必要和充分条件是,虚 变动引起的熵变
S 0
将S作泰勒展开,准确到二级,有 S S 1 2S
2
由数学上的极值条件:
当 S 0, 2S 0 时,熵函数有极大值。
可得
S 0 2S 0
( 相变平衡条件)
即整个系统达到平衡时,两相的温度、压强和化 学势分别相等。
分析:若平衡条件未满足,复相系的变化将朝着熵增加 ( S 0 )的方向进行:
(1)若只有热平衡条件未满足,则向 的方向变化:
U
(
1 T
1 T
)
0
如 T T 则 U 0 即能量从高温的相传到低 温的相。
(2)若只有力学平衡条件未满足,则向 的方向变化:
•因为两相的化学势相等,所以两相可以以任意比例共存; •整个系统的吉布斯函数保持不变,系统处在中性平衡。
(3)单元三相平衡共存,必须满足
T T T p p p
(T , p) (T , p) (T , p)
由上面的方程可以唯一地确定温度和压强的一组解
TA和PA ,即单元系的三相平衡共存的三相点。 水的三相点为:TA = 273.16 K, pA = 610.9 Pa .
dH TdS Vdp
若S, p不变,则 dH 0 ,即过程向焓H减少的方向 进行,因此平衡态的焓H最小。
热力学判据 过程遵循规律
U
dU TdS pdV
H
dH TdS Vdp
F
dF SdT pdV
G
dG SdT Vdp
TdS dU pdV S
TdS dH Vdp
热力学与统计物理第三章PPT课件

24.07.2020
2
• 熵判据
一个系统在内能和体积都保持不变的情况下, 对于各种可能的变动,以平衡态的熵为最大。
孤立系统处在稳定平衡状态的必要且充分条件为: Δ~S0
泰勒级数展开为: Δ~S δS1δ2S 2
根据数学知识可知,熵S有极大值的条件应为:
δS0
熵函数有极值
δS0 δ2S 0
24.07.2020
CV 0,
p VT
0
稳定性条件
平衡满足稳定性条件时,系统对平衡发生偏离时,系
统将自发产生相应的过程,以恢复系统的平衡。适用于均 匀系统的任何部分。
24.07.2020
10
气体的范德瓦耳斯方程: pVa2 VbRT
p
V 气体的等温曲线
24.07.2020
11
§3.2 开系热力学基本方程
一、单元复相系平衡性质的描述及特点
24.07.2020
T U
p
U
U
S V , n
V S, n
n S,V
14
3、开系的焓
HGT SUpV
d H T d S V d p d n HH(S,p,n)
T H S p, n
V
H p
S,n
4、开系的自由能
H
n S, p
FGpV UTS
d F S d T p d V d n
16
§3.3 单元系的复相平衡 1.由熵判据推导平衡条件
考虑一单元两相系统( 相与 相 )组成一孤立系,则有:
24.07.2020
17
由开系的基本热力学方程知: d U T d Sp d V d n
SUpTV n SUpTV n 由熵的广延性质: SSS
热力学统计物理第三章

G0
系统的温度和压强不变的条件下,对于各种可能的变动,
系统的吉布斯永不增加,即平衡态的吉布斯最小。
4、泰勒展开:
G G 1 22 G G 2 G 0 0 确 平 定 衡 平 稳 衡 定 条 性 件 条 件
第十页,共87页
5、判断方法
趋向平衡态的变化过程中: G 0
G是T, p, n 以为独立变量的特性函数。
已知G(T, p, n),其它热力学量可通过下列偏导数求得:
d= G Sd V T+ d dPn
S (GT )p,n
V
(
G p
)T
,n
G ( n )T,p
第二十页,共87页
二、开系中内能
UGTSpV
内能的全微分
dU Td p Sd V d由n 于摩尔数的改变所
体积的变化 内能的变化
V+V0=0 U+U0=0
整个系统是孤立系统,则这些量一个变 大,另一个变小,总量不变。
子系统的熵变 S=S+2S
媒质的熵变 S0=S0+2S0
虚变动引起的系统的熵变 S总 = S +S0
稳定的平衡条件下,
S总 = S+S0=0
整个孤立系统的熵取极大值,
第十三页,共87页
对于一个孤立的均匀系统
热量传递将使子系统温度降低,从而恢复平衡。
3子系子统系的统压的强体将积增发高生,收缩大,于根媒据质的压强,( 于VP是)T子系0统将膨胀。系统恢复
平衡。
第十七页,共87页
3、单(多)元系,单(多)相系
【单元系】:指化学纯的物质系统.只含一种化学组分(组元).
【单相系】:一个均匀的部分称为一个相, 均匀系也称单相系.
热统3、4

即要求
p CV 0, ( )T 0 V
第三章 单元系的相变 19
上式称为热力学稳定平衡条件。
用热学平衡的稳定性条件对简单系统作平衡稳定性分析 假如子系统的温度由于涨落或某种外界影响而略 高于媒质(T↑),由热力学第二定律知,热量将从子 系统传到媒质(Δ Q﹤0 ),根据CV= ΔQ / ΔT ﹥0 , 热量的传出将使子系统的温度降低(T↓ ),从而恢复 平衡。该过程可简单表示为
2
得
S 1 ( )V , U T
S p ( )U V T
17
第三章 单元系的相变
于是
1 1 p p S [ ( )U ( )V ]U [ ( )U ( )V ]V U T V T U T V T 1 p 2[ ( )U ( )V ] 0 T T
T Q 0 T
相反的过程表示为
T Q 0 T
第三章 单元系的相变 20
用力学平衡的稳定性条件对简单系统作平衡稳定性分析 假如子系统的体积由于某种原因发生收缩
( V↓ ),由
(
p p )T 0 ,子系统的压强将增 V V
加( p↑ ),于是子系统发生膨胀而恢复平衡( V↑ )。
第三章 单元系的相变
10
p VdpTdS Vdp TdSpdU TdS p S dH dG dF dU SdT S, H pdV dU pdV dF T T 0dF Vdp G, H dG TdS F, F U,,,V0SdT pdV V V0dG SdT G p dH SdT SS H U V G T F S
f f f f ( y y0 ) dx dy 一级微分 df ( x x0 ) x y x y
热统10-第3章1

48.1C
90
p
高温下 二氧化 碳的等 温线
80
35.5
p / p0
C
70
32.5 31.1 21.5
13.1
0
T5 T4 T3 Tc T2 T1
范氏方 程等温 线
60
50
0
1
2
第三章
3 4 5 单元系的相变 v / cm 3
6
7
第 2 页
Vm
2014年7月21日星期一
在v1<v<v2范围围内, (p / V )T 0 ,由于不满足平 衡稳定性的条件的要求.这些状态是不能实现的.
b b
2 2 a a ( p , T ) ( p, T ) ( p p ) r r
2 (T , p ) b (T , p) r
a
第 25 页
第三章 单元系的相变
2014年7月21日星期一
2 p p r
p a v RT ln p
Ta T b Tg
⑵
第三章 单元系的相变
第 16 页
2014年7月21日星期一
假定热平衡条件已经满足,温度保持不变,我们用 自由能判据推求系统的力学平衡条件和相变平 衡条件. 设想在温度和总体积保持不变的条件下,系统发 生一个虚变动 . 在这虚变动中 , 三相的摩尔数 , 体 积和面积分别有微小 变化
即
2 p p r
a (T , pa ) b (T , p b ) ⑷ 2 a (T , p ) b (T , p)
r
第 23 页 2014年7月21日星期一
第三章 单元系的相变
上式给出曲面上的平衡蒸汽压强
热统第三章功课答案

3.5 求证:
dG SdT Vdp dn
p
T ,n
U n
T ,V
V n
S n
T ,V
T , p
T
解:自由能 F U TS 是以T , V , n 为自变量的特性函数,求 F 对
n 的偏导数(T , V 不变),有
但由自由能的全微分 可得
代入式(1),即有
F n
T ,V
尔焓 Hm 和摩尔体积Vm 的改变满足
Um Hm pVm.
平衡相变是在确定的温度和压强下发生的,相变中摩尔焓的变化等
于物质在相变过程中吸收的热量,即相变潜热 L:
Hm L.
克拉珀龙方程(式(3.4.6))给出
即
将式(2)和式(4)代入(1),即有
U m
dp L , dT T Vm
Vm
L T
L 1
dT dp
p T
.
V
dT dp
.
,n
.
.
(3)
(1)
(3)
(4)
(5)
(6)
(7)
C
C
p
Vm
如果 相是蒸气,可看作理想气体, 相是凝聚相,上式可简化为
并说明为什么饱和蒸气的热容量有可能是负的.
C
C
L Vm
p
解:根据式(1.14.4),在维持 相与 相两相平衡的条件下,
U n
T ,V
dF SdT pdV dn
F n
S n
T ,V
T ,V
,
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,通系电1,力过根保管据护线生高0不产中仅工资2艺料22高试2可中卷以资配解料置决试技吊卷术顶要是层求指配,机置对组不电在规气进范设行高备继中进电资行保料空护试载高卷与中问带资题负料2荷试2,下卷而高总且中体可资配保料置障试时2卷,32调需3各控要类试在管验最路;大习对限题设度到备内位进来。行确在调保管整机路使组敷其高设在中过正资程常料1工试中况卷,下安要与全加过,强度并看工且25作尽52下可22都能护可地1关以缩于正小管常故路工障高作高中;中资对资料于料试继试卷电卷连保破接护坏管进范口行围处整,理核或高对者中定对资值某料,些试审异卷核常弯与高扁校中度对资固图料定纸试盒,卷位编工置写况.复进保杂行护设自层备动防与处腐装理跨置,接高尤地中其线资要弯料避曲试免半卷错径调误标试高方中等案资,,料要编试求5写、卷技重电保术要气护交设设装底备备置。4高调、动管中试电作线资高气,敷料中课并设3试资件且、技卷料中拒管术试试调绝路中验卷试动敷包方技作设含案术,技线以来术槽及避、系免管统不架启必等动要多方高项案中方;资式对料,整试为套卷解启突决动然高过停中程机语中。文高因电中此气资,课料电件试力中卷高管电中壁气资薄设料、备试接进卷口行保不调护严试装等工置问作调题并试,且技合进术理行,利过要用关求管运电线行力敷高保设中护技资装术料置。试做线卷到缆技准敷术确设指灵原导活则。。:对对在于于分调差线试动盒过保处程护,中装当高置不中高同资中电料资压试料回卷试路技卷交术调叉问试时题技,,术应作是采为指用调发金试电属人机隔员一板,变进需压行要器隔在组开事在处前发理掌生;握内同图部一纸故线资障槽料时内、,设需强备要电制进回造行路厂外须家部同出电时具源切高高断中中习资资题料料电试试源卷卷,试切线验除缆报从敷告而设与采完相用毕关高,技中要术资进资料行料试检,卷查并主和且要检了保测解护处现装理场置。设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
热统第三章

由
S F ; p F ; F
T V ,N
V T ,N
N T ,V
可以决定物态方程及系统的其它性质。
2、∵ ∴
dSU-TdS ≤ dW
对于等温过程
∴
d(U-TS)≤dW
对于等温过程,系统自由能的增加总是小于外界对系统作功,反过来
-dF≥dW
能最小。
由熵增加原理可以导出内能最小原理,内能也是一个判定过程进行方向的函
数,与熵具有等价的信息,但是用内能作为判据,自变量不同。
1
例 1:热辐射问题 如何测量太阳表面的温度 一个封闭的空腔,保持腔壁的温度为 T,经过一段时间后,整个腔内会达到一
种辐射平衡,腔壁的原子不断向腔内发射电磁波,同时又不断吸收电磁波,光是 电磁波,又叫光子,腔内可以认为是装满了光子气体,假若这种光子气体的内能 已知,写为
碳酸镁在水溶液中自动沉淀(室温)
这个过程中△U=25.1KJ/mol
T S=71.1KJ/mol
△F≤0
4
这个过程不能被表面所迷惑,沉淀:MgCO3 似乎熵小,但实际上离子在水溶 液中被水分子有规则的水化外壳所包围,把这个水化外壳打破增加熵,要比离子 凝聚成固态减少的熵要多。 ② U= 2 NkT = U(T, V, N)与 F(T,V,N)并不等价,后者可以给出系统的全部信
(把 S 代入)
内能密度 u=aT4
在壁上开一小孔,有辐射溢出,但不破坏平衡,可以测出其辐射通量密度 Ju,
即单位时间通过单位面积的能量,可以证明
Ju
1 Cu 4
1 CaT 4 4
T 4
叫斯特藩一玻耳兹曼定律, 5.669 108 W·m-2·K-4
如果知道小孔处 Ju,则知腔内温度。问题能否由基本参量推出系数呢?
高教热统答案第三章

第三章 单元系的相变习题3.2试由0>v C 及0)(<∂∂T V p 证明0>p C 及0)(<∂∂S Vp 。
证: 由式(2.2.1) T C C V p =-⇒V T p ⎪⎭⎫ ⎝⎛∂∂ pT V ⎪⎭⎫ ⎝⎛∂∂ =P C p T H ⎪⎭⎫ ⎝⎛∂∂=pT S T ⎪⎭⎫ ⎝⎛∂∂;=V C V T U ⎪⎭⎫ ⎝⎛∂∂V T S T ⎪⎭⎫ ⎝⎛∂∂= =dp dV V p T ⎪⎭⎫ ⎝⎛∂∂dT T p V⎪⎭⎫ ⎝⎛∂∂+ =dp +⎪⎭⎫ ⎝⎛∂∂dV V p S dS S p V⎪⎭⎫ ⎝⎛∂∂ =+⎪⎭⎫ ⎝⎛∂∂dV V p S VS p ⎪⎭⎫ ⎝⎛∂∂⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂dT T S dV V S V T ⇒=⎪⎭⎫ ⎝⎛∂∂T V p VS p ⎪⎭⎫ ⎝⎛∂∂T V S ⎪⎭⎫ ⎝⎛∂∂+S V p ⎪⎭⎫ ⎝⎛∂∂ (1) =⎪⎭⎫ ⎝⎛∂∂V T p V S p ⎪⎭⎫ ⎝⎛∂∂TT S ⎪⎭⎫ ⎝⎛∂∂ (2) 由麦氏关系(2.2.3)代入(1)式中 ⇒=⎪⎭⎫ ⎝⎛∂∂S V T -VS p ⎪⎭⎫ ⎝⎛∂∂ ⇒=⎪⎭⎫ ⎝⎛∂∂T V p -⎪⎭⎫ ⎝⎛∂∂S V p S V T ⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂T V S -⎪⎭⎫ ⎝⎛∂∂SV p ()()⋅∂∂S V S T ,,()()T V T S ,,∂∂ =+⎪⎭⎫ ⎝⎛∂∂S V p ()()⋅∂∂T V S T ,,()()⋅∂∂S V T V ,,()()T V S T ,,∂∂ =+⎪⎭⎫ ⎝⎛∂∂S V p ()()⋅∂∂S V T V ,,()()2,,⎥⎦⎤⎢⎣⎡∂∂T V S T =+⎪⎭⎫ ⎝⎛∂∂S V p V S T ⎪⎭⎫ ⎝⎛∂∂()()2,,⎥⎦⎤⎢⎣⎡∂∂T V S T 由式(2.2.5) ⇒V C V T S T ⎪⎭⎫ ⎝⎛∂∂=;即0>=⎪⎭⎫ ⎝⎛∂∂V V C T S T .于是: 0>=⎪⎭⎫ ⎝⎛∂∂T V p +⎪⎭⎫ ⎝⎛∂∂SV p 正数 于是: SV p ⎪⎭⎫ ⎝⎛∂∂<0 =P C P T S T ⎪⎭⎫ ⎝⎛∂∂()()=∂∂=p T p S T ,,()()⋅∂∂V S p S T ,,()()=∂∂p T V S ,,⋅⎪⎭⎫ ⎝⎛∂∂S V p T ()()p T V S ,,∂∂ ⋅⎪⎭⎫ ⎝⎛∂∂=S V p T ()()⋅∂∂V T V S ,,()()=∂∂p T V T ,,⋅⎪⎭⎫ ⎝⎛∂∂S V p T VT S ⎪⎭⎫ ⎝⎛∂∂Tp V ⎪⎪⎭⎫ ⎝⎛∂∂⋅ ⋅⎪⎭⎫ ⎝⎛∂∂=S V p V TC p V ⋅⎪⎪⎭⎫ ⎝⎛∂∂ 0>V C ; 因而0>P C 习题3.4 求证:(1)-=⎪⎭⎫ ⎝⎛∂∂n V T ,μV T n S ,⎪⎭⎫ ⎝⎛∂∂;(2)-=⎪⎪⎭⎫ ⎝⎛∂∂nT p ,μp T n V ,⎪⎭⎫ ⎝⎛∂∂ 证: (1) 开系吉布斯自由能dn Vdp SdT dG μ++-= , ),(T V p p = ⇒dn dT T p dV V p V SdT dG V Tμ+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂+-= dn dV V P V dT T P V S n T n V μ+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂+-= ⇒V S T G n V +-=⎪⎭⎫ ⎝⎛∂∂,VT p ⎪⎭⎫ ⎝⎛∂∂ ① V V G nT =⎪⎭⎫ ⎝⎛∂∂,T V p ⎪⎭⎫ ⎝⎛∂∂ ② μ=⎪⎭⎫ ⎝⎛∂∂VT n G , ③ 由式 ① ⇒n V n V T G T p V S ,⎪⎭⎫ ⎝⎛∂∂-⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂=V T n S ,⎪⎭⎫ ⎝⎛∂∂⇒VT n V n T G ,,⎪⎪⎪⎪⎪⎭⎫ ⎝⎛∂⎥⎥⎦⎤⎢⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂∂-=V n T G ⎪⎪⎭⎫ ⎝⎛∂∂∂-=2V T n G ⎪⎪⎭⎫ ⎝⎛∂∂∂-=2 VT n S ,⎪⎭⎫ ⎝⎛∂∂n V T ,⎪⎭⎫ ⎝⎛∂∂-=μ 第(1)式得证。
热力学与统计物理第三章
P.6/55
单元系的相变
等温等容系统处在稳定平衡状态 的必要和充分条件为
G 0
将G作泰勒展开,准确到二级,有
F 0
将F作泰勒展开,准确到二级,有
1 2 G G G 2
由 G 0 和 2 G 0 可以确定平衡 条件和平衡的稳定性条件。
1 2 F F F 2
泰勒展开,准确到二级有:
1 1 p p s U V 0 T T0 T T0 由于U和V 可独立变化,所以上
式成立,必有平衡条件:
1 S S 2 S 2 1 2 S 0 S 0 S 0 2
2013-7-31
T T0 ,
p p0
意义:达到平衡时,子系统与媒质 具有相同的温度和压强。子系统是 任选的,所以达到平衡时整个系统 的温度和压强是均匀的。
P.9/55
s S S0
平衡时有:
1 2 S 2 S0 2
单元系的相变
2、平衡的稳定性条件 平衡的稳定性条件应满足:
2 S0 2 S
2 ①式近似为: s S 0 2
p 0 V T
讨论:系统处于稳定平衡时,由 于扰动偏离时,系统将自动回落 到平衡态。
根据泰勒展开公式: 2S 2 2 S 2 U U
2S 2 U V
2S 2 U V
2S 2 U V 2 V 0 V P.10/55
单元系的相变
2、平衡的稳定性条件 平衡的稳定性条件应满足:
通过导数变换将上式化为平方和:
s 0 T T0 ; p p0 2 s 2S 2S 0 ①
热统答案第三章 单元系的相变

(2)
代入式(1) ,即有
⎛ ∂U ⎞ ⎛ ∂µ ⎞ ⎜ ∂n ⎟ − µ = −T ⎜ ∂T ⎟ . ⎝ ⎠T ,V ⎝ ⎠V ,n
(3)
3.6
Hale Waihona Puke ⎞ 两 相 共 存 时 , 两 相 系 统 的 定 压 热 容 量 Cp = T ⎛ ⎜ ∂T ⎟ , 体 胀 系 数 ⎝ ⎠p
∂S
58
α=
1 ⎛ ∂V ⎞ 1 ⎛ ∂V ⎞ 和等温压缩系数 κ T = − ⎜ ⎟ 均趋于无穷,试加以说明. ⎜ ⎟ V ⎝ ∂T ⎠ p V ⎝ ∂p ⎠T
(5)
如果一相是气体,可以看作理想气体,另一相是凝聚相,其摩尔体积远小于 气相的摩尔体积,则克拉珀龙方程简化为
(5)
(6)
⎛ p⎞ ⎛ ∂ p⎞ ⎛ ∂ p⎞ δ⎜ ⎟ = ⎜ ⎟ δT + ⎜ ⎟ δV ⎝ T ⎠ ⎝ ∂T T ⎠V ⎝ ∂V T ⎠T = 1 T2 ⎡ ⎛ ∂p ⎞ ⎤ 1 ⎛ ∂p ⎞ ⎢T ⎜ ∂T ⎟ − p ⎥ δT + T ⎜ ∂V ⎟ δV . ⎠V ⎝ ⎠T ⎣ ⎝ ⎦
(7)
δ S = 0, đW = 0.
根据式(1) ,在虚变动中必有
δ U < 0.
(2)
如果系统达到了 U 为极小的状态,它的内能不可能再减少,系统就不可能自 发发生任何宏观的变化而处在稳定的平衡状态,因此,在 S , V 不变的情形下, 稳定平衡态的 U 最小. (b)在 S , p 不变的情形下,有
δ U < T δ S + đW ,
(1)
式中 δ U 和 δ S 是虚变动前后系统内能和熵的改变, đW 是虚变动中外界所做的 功, T 是虚变动中与系统交换热量的热源温度. 由于虚变动只涉及无穷小的变 化, T 也等于系统的温度. 下面根据式(1)就各种外加约束条件导出相应的 平衡判据. (a)在 S , V 不变的情形下,有
热力学统计物理第三章总结

第三章 单元复相系总结组别:第二组 组长:胡娟秀 组员:仓荣琴、宋莹珊、字艳美 汇报人:仓荣琴3.1热动平衡的判据1、热动平衡判据 (1)熵判据等v 等u 条件下,孤立系统处在稳定平衡状态的充要条件:0<∆s 平衡条件: 稳定平衡条件:02<S δ (2)自由能判据等v 等T 条件下,孤立系统处在稳定平衡状态的充要条件:0>∆F平衡条件:0=F δ 稳定平衡条件:02>F δ (3)吉布斯函数等T 等P 条件下,孤立系统处在稳定平衡状态的充要条件:0>∆G平衡条件:0=G δ 稳定条件:02>G δ0=S δ3.2开系的热力学基本方程1、开系的五个热力学方程dU TdS PdV dn dH TdS VdP dn dF SdT PdV dn dG SdT VdP dn dJ SdT PdV nd μμμμμ=-+=++=--+=-++=--- 2、化学势,m T PG G n μ∂⎛⎫==⎪∂⎝⎭ 3、巨热力势 定义式:J F n μ=-全微分是:dJ SdT PdV nd μ=---3.3单元系的复相平衡条件1、单元二相系的平衡条件平衡条件为:,,T T P P αβαβαβμμ=== 2、单元复相系的平衡条件 热学平衡条件:T T T αβγ==力学平衡条件:P P P αβγ==化学平衡条件(相平衡条件):αβγμμμ==3、利用熵增加原理对孤立系统各相之间趋于平衡的过程进行分析 (1)若热平衡条件未达条件到,T T αβ>,0U αδ<,Q 从αβ→ (2)若热平衡条件达到,力学平衡条件未达到,当P P αβ>,0V αδ>,α相体积膨胀,β相体积被压缩。
(3)若热平衡条件达到,化学平衡条件未达到,0U U n TT αβααβδ⎛⎫--> ⎪⎝⎭,U U αβ>,0n αδ<物质由αβ→(α相0n α<,β相0n βδ>)3.4复相系的平衡性质1、单元复相系的平衡汽化曲线:μL =μG熔化曲线:μS =μL 升华曲线:μS =μG ⇒三相平衡:μL =μS =μG2、相图的热力学解释(1)在一定温度和压强下,系统的平衡状态---化学势最小 (2)若在某一温度和压强范围内,α相的化学势低于其他相的化学势,那么系统以α相单独存在(3)单元系两相平衡共存时,两相平衡曲线方程 T α=T β=TP α=P β=P μα=μβ=μ3、克拉珀龙方程dp dT =L T (V mβ−V m α)物理意义:给出两相平衡曲线的斜率dpdT<0冰的熔点随压强的变化dp>0水的沸点随压强的变化3.5 临界点和气液两相的转变1.范德瓦耳斯气体物态方程:(2)()m m ap V b RT V +-= 2.c T ,c p ,mc V 的确定 等温线上极大值点N 点, ()0T m pV ∂=∂,22()0T m P V ∂<∂极小值点J 点,()0T m pV ∂=∂,22()0T mP V ∂>∂当温度升高,N 和J 逐渐靠近;温度继续升高,c T T =时,N 和J 重合,形成拐点,则()0T m p V ∂=∂,22()0T m P V ∂=∂ 利用范氏方程,可得827c a T Rb =,227c ap b =,3mc V b = c T ,c p ,mc V 的关系:83c c mc RT p V =3.7 相变的分类1、一级相变及其特点:(1)相变点两相的化学势连续),(),(P T U P T U βα=(2)相变点两相的化学势的一阶偏导发生突变TT ∂∂≠∂∂)()(βαμμ, pp ∂∂≠∂∂)()(βαμμ 特点:(1)两相存在各自的非奇异化学势函数,在相变点两相的化学势相等;(2)在相变点两相平衡共存;(3)在相变点两相化学势的一级偏导不相等,存在相变潜热和体积突变;(4)在相变点两侧,化学势低的是稳定相,较高的为亚稳相。
热统-(PDF)

§ 3.8 临界现象和临界指数
二、液气流体系统
t T Tc Tc
1、l g (t) , t 0
1、临l界 指g数:(t )
,
t
0.34
0
2、T (t) T (t ) '
t 0, t 0。
' 1.2
28
§ 3.8 临界现象和临界指数
3、p pc c , t 0 K 5.0 4.6
p
( p ' 2 , T ) ( p ', T )
r
( p ' p 2 )v RT ln p '
r
p
14
§3.6 液滴的形成
实际问题中,p ' p 2 / r , 上式可近似为:
( p ' p 2 )v RT ln p '
r
p
ln p ' 2 v
p RTr
以水滴为例:在温度T = 291K时,水的表面张力系数和
r 自由能判据:定温定容时平衡态的自由能最小。
F=0 ;V 和n 可独立变动,有: 力学平衡条件 p p 2
r
相变平衡条件
说明:当两相分界面是平面时(即r →∞),两相的力学 平衡条件为两相的压强相等。
12
§3.6 液滴的形成
2. 曲面上的蒸汽压与平面上的饱和蒸汽压的关
系:
设分界面为平面时,饱和蒸汽压强为p;分界面
整个系统的自由能为三相的自由能之和: F F F F ( p p )V A ( ) n
假定液滴是球形,则有:
V 4 r3, A 4 r2
3
V 4 r2 r A 8 r r
11
§3.6 液滴的形成
热统-03

热力学第二定律指明两者的“不等价性”
21
§ 1.11 热力学第二定律
2. 开氏表述和克氏表述的等价性(反证法)
(A). 克氏表述不成立 T1
Q1
Q2
开氏表述不成立 T1
Q1 Q2
W
Q2
W
T2
§ 1.11 热力学第二定律
(B) 开氏表述不成立 克氏表述不成立
T1
T1
Q1 W
W Q2 Q2
W
Q2
2. 证明: 设有两个热机A和B。它们的工作物质在各自的循环过程 中,分别从高温热源吸取热量Q1和Q1′,在低温热源放出 热量Q 2 和Q 2 ′,对外作功W和W′。效率分别为:
假设A为可逆机,要证明
A B
26
§ 1.11 诺定理
反证法: ' 假设 A B , 令 Q1 Q1
有:W W '
② 正/负循环:在P-V图上,准静态循环过程是一条
闭合曲线。如果循环沿顺时针方向进行,称为正循 环。如果循环沿逆时针方向进行,称为逆循环。 o
逆
V
10
§ 理想气体的卡诺循环 1.9
③ 热机:利用正循环,把热量转变为功的机器。 ④ 致冷机:利用逆循环,将从低温热源传递给高温热源的机
器。
⑤ 卡诺循环:过程由两个等温过程和两个绝热过程组成。
个极限温度,当低温热源的温度趋于这个极限温度时,传给
低温热源的热量趋于零。
3. 理想气体温标和绝对温标一致 对于以理想气体为工作物质的可逆卡诺热机,有
Q T W Q Q2 1 1 2 1 2 Q1 Q1 Q1 T1 Q2 T2 Q1 T1
都规定:水的三相点的温 度为273.16K 。
32
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
相变是自然界中普遍存在的一类形象: 气液固三态的转变;金属超导态---正常态的转变;合金的有序---无 序的转变;超流---正常(He4, He3);铁磁---顺磁;液晶的相变等 等····· ···· 本章研究任务: 1. 什么情况下发生两相或多相会达到平衡,平衡是否稳定? 2. 两相平衡时的性质 3. 如果不平衡,相转变的方向等 相变的种类:第一类相变,第二类相变,临界点
第三章 单元系的相变
4. 内能判据 一体系在熵,体积和总粒子数不变的情形下,对于各种可能的变动, 平衡态的内能是极小。 推导: 从热力学第二定律判断不可逆过程方向的普遍原则出发,考虑一 个微小的真实变化 热力学第一定律 dU=đQ+đW
体积不变的情况下,且不考虑非体积功有đW=0
热力学第二定律 đQ≤TdS ∴ 在熵不变的情况下,dU= đQ≤TdS=0
对任意的小变化(δx1,··· n),都有Δf<0 ·· δx f {xi}= (x1, x2, ··xn), ·· ·· {x0i}
f f
{xi}
微小变动{δ xi} 可以将上式作泰勒级数展开:
0
1 2 1 f 3 f 2! 3! n f f ( ) 0 xi , i 1 xi 2 f 0 f ( ) xi x j , i , j xi x j
n 2
f x i
f x i
|{ x0 } x j ( i j )
3 f (
i , j ,k
n
f ) 0 xi x j xk , xi x j xk
3
极 值: δf=0
极大值: δ2f<0
第三章 单元系的相变
第三章 单元系的相变
孤立系实际发生的不可逆过程,总向着熵增加的方向进行,即Δs>0, 与这里的不同,这是为了求极值,是假想相对平衡态作了以微小的虚变 动,应有Δs<0,为了表述一致Δs<0表述,但是含义不同。 平衡的稳定性 势能φ 2 a b
0, 2 0
一个类比,重力场中光滑轨道上的小球状态 a, c: 为极大值,明显是不稳定的状态 b, d: 为极小值,稳定的状态。
U=S1+S2=常量;V=V1+V2=常量;N=N1+N2=常量
1 2 对于一个虚变动,由约束条件可知:
S1 S2 0; V1 V2 0; N1 N2 0
U U1 U 2 T1S1 p1V1 1N1 S 2 p2V2 2N 2 S1 (T1 T2 ) V1 ( p1 p2 ) N1 ( 1 2 )
0, 0
c d
对b: 小扰动是稳定的,大扰动不稳定;亚稳态 对c: 最小值,稳定的状态,稳态
对于熵判据,求极大值
δS=0 δ2S<0
平衡条件,必要条件 极大值;包含稳态和 亚稳态
进一步区分稳态和亚稳态,就必须要找到最大值!
第三章 单元系的相变
临界态 熵判据
S S
(T1 T2 ) 0; p1 p2 0; 1 2 0 T1 T2 p1 p2
巨热力势
J J J S ,p , T V , V T , T T ,V
第三章 单元系的相变
2. 平衡条件 维持热力学平衡所需要的具体条件,有以下四种:
热平衡条件,物体内部各部分之间不发生热传递;
力学平衡条件,物体内部各部分之间不发生宏观位移; 相平衡条件, 物体各相之间不发生物质转移;
U1 (
1 1 p p ) V1 ( 1 2 ) N1 ( 1 2 ) T1 T2 T1 T2 T1 T2
第三章 单元系的相变
平衡条件: δS=0, 因为δU1 δV1 δN1的变化时可以相互独立的,因此要δS=0对于任意的变化 都成立,必须是其中每项都等于0!即
1 2 1 1 S 3S 4 S 0 2! 3! 4!
如果
S 0, S 0
2
在数学上叫这样的点为拐点
这时候稳定性条件就由后面两项判定,由于三阶项的符号可 正可负,要确保上式成立,必须要求三阶项等于0,因此稳定 性由
S 0
4
第三章 单元系的相变
原则上,熵判据已经足够解决问题。但是在实际应有时,其他的判据更方便 2. 自由能判据
推导: 对于1mol物质,有, du=Tds-pdv
∵ dU=d(Nu)=Ndu+udN=N(Tds-pdv)+udN 有∵ dS=d(Ns)=Nds+sdN, dV=d(Nv)=Ndv+vdN
∴dU=T(dS-sdN)-p(dV-vdN)+udN=TdS-pdV+(u-Ts+pv)dN
=TdS-pdV+ μdN
一体系在温度,体积和总粒子数不变的情形下,对于各种可 能的变动,平衡态的自由能是极小。
1 2 F F F 0 2! T 0, V 0, N 0
或者
F 0 2F 0 T 0, V 0, N 0
类似于熵判据
第三章 单元系的相变
第三章 单元系的相变
3.1 平衡判据 热力学第二定律的推论,普遍的法则 1. 熵判据 熵增加原理:孤立系的熵永不减小。如果一个孤立系发生一个不可逆 的变化,那么熵总是向着增加的方向进行。当体系的熵不断地增加, 最终达到极大值的时候,体系的状态也就不会发生变化了,也就是说 体系处于平衡态。另一方面,如果一个孤立系处于平衡态,那么它的 熵必然处于极大值,否则它就可能发生变化。
平衡条件: δU=0, 因为δS1 δV1 δN1的变化时可以相互独立的,因此要δU=0对于任意的变化 都成立,必须是其中每项都等于0!即
第三章 单元系的相变
(T1 T2 ) 0; p1 p2 0; 1 2 0 T1 T2 p1 p2
热平衡条件
力学平衡条件
相平衡条件
说明体系在熵,体积和总粒子数不变的情况下,内能总是朝着减小的 方向进行,也就是说达到平衡态是内能有极小值!
U=Umi 充分必要条件
n
处于平衡态
U 0 2U 0 S 0, V 0, N 0
第三章 单元系的相变
上面介绍的四种平衡判据 都是热力学第二定律的推论 彼此等价, 方便的原则 还有更多的平衡判据(习题) 不同判据中的附加条件,应理解为用虚变动求热力学函数 极值的附件条件,与体系真实所处的宏观条件并无必然联系。 因为,当体系已达到平衡时,它与外界没有任何宏观的能量和 物质交换,
第三章 单元系的相变
若粒子数不变,dN=0, 上面的式子还原到之前熟悉的形式。相比之 前,多了一项μdN,代表物质量变化引起的内能变化。
粒子数可变系统的基本热力学方程的其他表示形式:
dU=TdS-pdV+ μdN dH=TdS+Vdp+ μdN dF=-SdT-pdV+ μdN dG=-SdT+Vdp+ μdN 化学势可表示为: 变数为:S, V, N 变数为:S, p, N 变数为:T, V, N 变数为:T, p, N
相同的平衡条件!
1 2
补充!对于粒子数不守恒的体系。
U U1 U 2 T1S1 p1V1 1N1 S 2 p2V2 2N 2 S1 (T1 T2 ) V1 ( p1 p2 ) N11 N 2 2
如果要达到平衡,δU=0,要求上面4项全部等于0
U H F G N S ,V N S , p N T ,V N T , p
介绍一下以(T, V, μ)为变数的表达形式 定义:J=F- μN=F-G dJ=dF-d(μN)=-SdT-pdV-Ndμ
1 1 p1 p2 1 2 ( ) 0; 0; 0 T1 T2 T1 T2 T1 T2 T1 T2 p1 p2
热平衡条件 力学平衡条件 相平衡条件
1 2
讨论:1. 如果热平衡条件不满足,那么应向着 S U1 (
1 1 )0 T1 T2
如T1>T2,就有δU1<0,这表明高温相的内能减小,能量从高温相想地温相传递 2. 同样的方法,如果相平衡条件不满足,物质将由化学势高的相转移到 化学势低的相!
第三章 单元系的相变
之前讲过几种判据是等价的,下面简单介绍下内能判据!
U 0, 平衡条件 2U 0,稳定性条件 S 0, V 0, N 0,约束条件
设想体系由两个部分组成,代表两相,两相之间可以发生物质能量交换。 但是整个体系是孤立系,因而,总内能,总体积,和总粒子数是不变的。
S=Smax
充分必要条件
处于平衡态
数学上如何表述?
求极值问题,多元函数极值问题!
第三章 单元系的相变
设有多元函数 f(x1, x2, ··xn), 如果在(x01, x02, ··x0n),为极大,那么有 ·· ·· ·· ··
0 0 0 f f ( x10 x1 , x2 x2 ,, xn xn ) f ( x10 ,, xn ) 0
3. 吉布斯函数判据 一体系在温度,压强和总粒子数不变的情形下,对于各种可 能的变动,平衡态的吉布斯函数是极小。
1 2 G G G 0 2! T 0, p 0, N 0
或者
G 0 2G 0 T 0, p 0, N 0
类似于熵判据
熵判据: 一体系在内能、体积和总粒子数不变的情况下,对于各种可能的变 动,平衡态的熵极大。 数学形式:
S 0 S 0 U 0, V 0, N 0
