论呋喃_吡咯_噻吩的芳香性和亲电取代反应的活性_马军营
1095《有机化学(二)》西南大学网教19秋作业答案
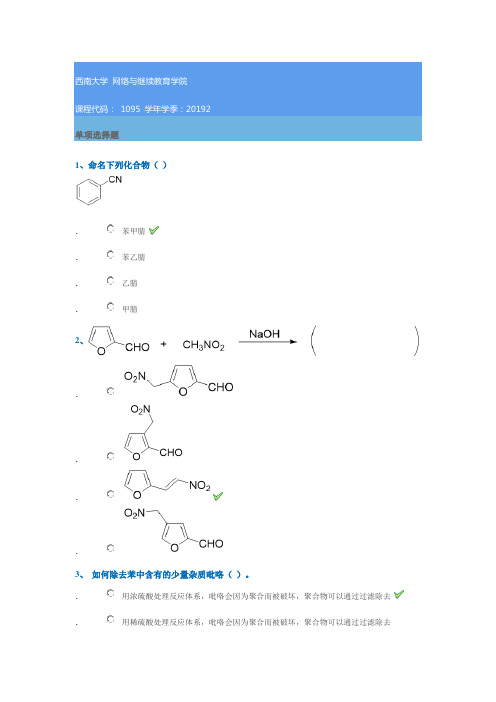
1095 20192单项选择题1、命名下列化合物( ).苯甲腈. 苯乙腈. 乙腈 .甲腈2、....3、 如何除去苯中含有的少量杂质吡咯( )。
. 用浓硫酸处理反应体系,吡咯会因为聚合而被破坏,聚合物可以通过过滤除去.用稀硫酸处理反应体系,吡咯会因为聚合而被破坏,聚合物可以通过过滤除去.用浓硫酸处理反应体系,吡咯很容易与浓硫酸发生磺化反应而溶解在浓硫酸中,从苯中分离出去。
.用稀硫酸处理反应体系,吡咯很容易与稀硫酸发生磺化反应而溶解在稀硫酸中,从苯中分离出去。
4、........5、()是最常用的淀粉鉴定试剂。
.茚三酮.2,4-二硝基氟苯.碘.异硫氰酸苯酯6、命名下列化合物().戊二酸酐.反丁烯二酸酐.丁二酸酐.顺丁烯二酸酐7、下列化合物中,碱性最强的是()。
....8、下列化合物中,()可以用作化学合成染料。
....9、蛋白质的基本组成单位是()。
.氨基酸.脱氧核糖核酸.核糖核酸.葡萄糖10、()是一切糖类甜味剂中甜味最大的单糖。
.D-木糖.D -半乳糖.D-果糖.D-葡萄糖11、....12、....13、....14、下列化合物中,()不能与水形成氢键。
.甲胺.二甲胺.甲烷.三甲胺15、....16、命名下列化合物().2-甲基呋喃.1-甲基四氢呋喃.2-甲基四氢呋喃.1-甲基呋喃17、... .18、写出对氨基苯乙酮的结构( )....19、....20、....21、....22、( )和亚硝酸或亚硝酸盐及过量的酸在低温下反应可生成芳香重氮盐 。
. 芳香铵盐 . 芳香三级胺. 芳香一级胺.芳香二级胺23、为何酰胺熔沸点比分子量相近的酯高( )。
. 范德华力 . A and B. 分子间氢键作用 .分子间静电作用24、下列氨基酸中,( )不属于必需氨基酸。
. 蛋氨酸 . 异亮氨酸. 精氨酸.赖氨酸25、两个或两个以上的异戊二烯分子以头尾相连的方式结合起来的化合物称为______。
.生物碱.甾体化合物.萜类化合物.蛋白质26、....27、....28、下列基团中____不能用来保护羟基. THP (四氢吡喃基). 对甲氧基苄氧基甲基p -MeOC6H4CH2OCH2―简写为PMBM. 硅保护基,例如三乙基硅基(TES ) .苄基29、下列反应中,( )不属于周环反应。
12 杂环化合物《有机化学》

Br
(80%)
O
O Cl2
-40℃ , CH3COOH
Cl
O
(64%)
Br2
CH3COOH
Br
S
(78%)
S Cl2
50℃
Cl
S
(36%)
I2,HgO C6H6, 0℃
I
S
(70%)
吡咯极易卤化生成四卤吡咯。
(2)硝化
呋喃和吡咯很易被氧化,遇无机酸容易发生聚合, 因而不能用硝酸硝化。通常用比较温和的非质子硝化试 剂,如用硝酸乙酰酯
离域能 呋喃、吡咯和噻吩的离域能分别为: 67 kJ·mol-1、 88 kJ·mol-1和117 kJ·mol-1 比苯的离域能(150.5 kJ·mol-1 )低,但比大多数共 轭二烯烃的离域能(约12~28 kJ·mol-1 )要大得多。
芳香性:苯>噻吩>吡咯>呋喃
2、 呋喃、噻吩和吡咯化学性质
有机化学 第12章 杂环化合物
基本要求:
• 1.掌握呋喃、吡咯、噻吩、吡啶、嘧啶、 喹啉、吲哚、嘌呤及其衍生物的命名。
• 2.掌握呋喃、吡咯、噻吩、吡啶的结构 与芳香性的关系,结构与亲电取代反应 活性的关系。
• 3.掌握吡咯和吡啶的酸碱性,呋喃、吡 咯、噻吩、吡啶的亲电取代反应(卤代、 磺化),还原反应,吡啶侧链的氧化反应。
COOH
(烟酸 )
N
HNO3
COOH
COOH
N
△
COOH △
N
N
吡啶可被催化加氢或用乙醇和钠还原而成为六氢吡啶。
Na + C2H5OH
N
或 H2/Pt ,0.3MPa,25℃
N H
常见吡啶衍生物
有机化学答案(何建玲)

第二章 烷烃1. 写出庚烷的所有的构造异构体的结构式,并用系统命名法命名。
2. 写出下列化合物的结构式,并指出化合物分子中碳原子和氢原子的类型。
CH 3CH 2CH 2CH 2CH 2CH 2CH 3CH 3CH 2CH 2CH 2CHCH 33CH 3CH 2CH 2CHCH 2CH 33正庚烷2-甲基己烷3-甲基己烷CH 3CH 2CHCH(CH 3)23CH 3CHCH 2CHCH 333(CH 3)3CCH 2CH 2CH 32,3-二甲基戊烷2,4-二甲基戊烷2,2-二甲基戊烷CH 3CH 2CCH 2CH 3CH 3CH 2CHCH 2CH 3(CH 3)3CCH(CH 3)2CH 33CH 2CH 33,3-二甲基戊烷3-乙基戊烷2,2,3-三甲基丁烷(CH 3)2CHCCH 2CH 2CH 2CH 3CH 3CH 3CH 3CHCHCH 2CH 3CH 32CH 3CH 3CH CH 3C CH CH 3CH 2CH 3CH 33CH 3CH 2CHCHCH 2CH 2CH 2CH 2CH 3CH 3CH 2CH 3(1)(2)(3)(4)CH 3CH 3CH 2CH 3CH CH 3CH 2CH 2CH 3C CH 33H 3C CH 3CH 3CH 2CH 2CHCH 2CH 2CH 2CH 2CH 3CH(CH 3)2CH 3CHCH 2CH 2CHCHCH 2CH 2CH 2CH 3CH 3CH 2CH 3C(CH 3)3CH 3CH CH 3CH 2C CH 32CH 3CH(CH 3)2CH 3CH 3CH 2CHCH 2CHCH 2CH 2CH 2CH 3CH 2CH 32CH 3H 3C (5)(6)(7)(8)(9)(10)3. 用系统命名法命名下列各化合物。
⑴ 4-异丙基辛烷 ⑵ 2,2,4-三甲基庚烷 ⑶ 2-甲基-3-乙基己烷 ⑷ 2,5-二甲基-4-乙基辛烷 ⑸ 3,5-二甲基-4-异丙基壬烷 ⑹ 3-甲基-4,6-二乙基壬烷 ⑺ 2,3-二甲基-5-乙基辛烷 ⑻ 2,5-二甲基-3-乙基庚烷4. 以纽曼投影式,画出下列化合物的最稳定和最不稳定的构象式。
有机化学(第五版)下册课后答案 李景宁知识讲解
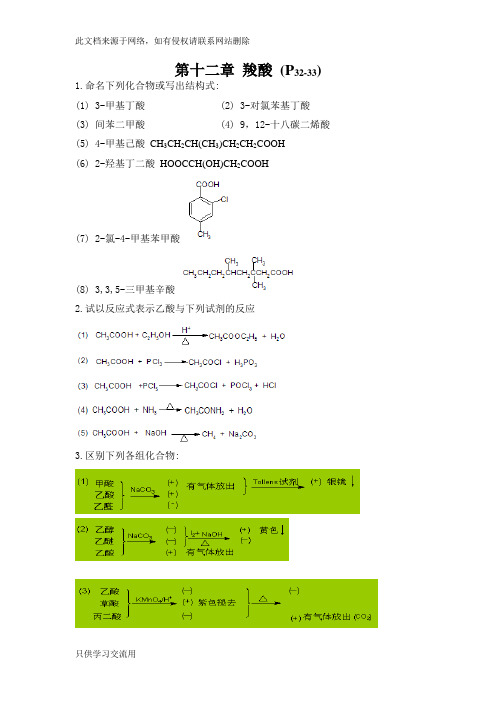
第十二章羧酸(P32-33) 1.命名下列化合物或写出结构式:(1) 3-甲基丁酸 (2) 3-对氯苯基丁酸(3) 间苯二甲酸 (4) 9,12-十八碳二烯酸(5) 4-甲基己酸CH3CH2CH(CH3)CH2CH2COOH(6) 2-羟基丁二酸HOOCCH(OH)CH2COOH(7) 2-氯-4-甲基苯甲酸(8) 3,3,5-三甲基辛酸2.试以反应式表示乙酸与下列试剂的反应3.区别下列各组化合物:4.指出下列反应的主要产物:(第四版保留)(1)C6H5CH2Cl 干醚MgC6H5CH2MgCl(1) CO2(2) H2OC6H5CH2COOH SOCl2C6H5CH2COCl4.完成下列转变:5、怎样由丁酸制备下列化合物?6、解:7、指出下列反应中的酸和碱。
按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
8.(1)按酸性降低的次序排列下列化合物:①酸性: 水>乙炔>氨;②酸性: 乙酸>环戊二烯>乙醇>乙炔(2)按碱性降低的次序排列下列离子:>>①碱性:CH3HC C CH3O②碱性:(CH3)3CO>(CH3)2CHO>CH3O9. 解:化合物A有一个不饱和度,而其氧化产物B含有两个不饱和度。
产物DC5H10有一个不饱和度。
从题意可知:D的结构式可能为环戊烷;C的结构为环戊酮;B的结构为己二酸;A的结构式为环己醇。
10.解:(1)由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为CnH2n-2。
(2)该烃有旋光性,氧化后成二元酸,所以分子量=66*2=132。
故二元酸为CH3CH(CH2COOH)COOH11.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D 的IR谱图:3200-2300cm-1为羟基中O-H键的伸缩振动。
1680为共扼羧酸的>C=O的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm -1和700cm-1是一取代苯的C-H 键的面外弯曲振动。
呋喃、噻吩和吡咯

/yjhx/16/right4_11.htm呋喃、噻吩和吡咯→ 结构与芳香性呋喃、噻吩与吡咯结构相似,都是由一个杂原子和四个碳原子结合构成的化合物。
从结构上它们可以看做是由O、S、NH分别取代了1,3-环戊二烯(也称为茂)分子中的CH后得到的化合物。
但从化学性质上看,它们与环戊二烯并无多少相似之处,倒是与苯非常类似。
例如,呋喃、噻吩、吡咯这三个化合物都非常容易在环上发生亲电取代反应,而不太容易发生加成反应。
这说明用上述三个结构来代表这三个化合物存在着某种片面性。
按照杂化理论的观点,呋喃、噻吩、吡咯分子中四个碳原子和一个杂原子间都以sp杂化轨道形成σ键,并处于同一平面上,每一个原子都剩一个未参与杂化的p轨道(其中碳原子的p轨道上各有一个电子,杂原子的p轨道上有两个电子)。
这五个p轨道彼此平行,并相互侧面重叠形成一个五轨道六电子的环状共轭大π键,π电子云分布于环平面的上方与下方(见图16-1),其π电子数符合休克尔的4n+2规则(n=1)。
这三个化合物所形成的共轭体系与苯非常相似,所以它们都具有类似的芳香性。
但是,这三个化合物所形成的共轭体系与苯并不完全一样,主要表现在以下两处:(1)键长平均化程度不一样。
苯的成环原子种类相同,电负性一样,键长完全平均化(六个碳碳键的键长均为140pm),其电子离域程度大,π电子在环上的分布也是完全均匀的。
这三个化合物都有杂原子参与成环,由于成环原子电负性的差异,使得它们分子键长平均化的程度不如苯,电子离域的程度也比苯小,π电子在各杂环上的分布也不是很均匀,所以呋喃、噻吩、吡咯的芳香性都比苯弱。
三种杂环分子中共价键的长度如下:另外,由于这三个杂环所含杂原子的电负性也各不相同,各环系中电子云密度的分布也不一样,所以它们之间的芳香性有差异。
氧是三个杂原子中电负性最大的,呋喃环π电子的离域程度相对较小,所以其芳香性最差;硫的电负性小于氧和氮,与碳接近,噻吩环上的电子云分布比较均匀,π电子离域程度较大,因此其芳香性最强,与苯差不多;氮的电负性介于氧和硫之间,吡咯环的芳香性也介于呋喃和噻吩之间。
14 杂环化合物习题答案
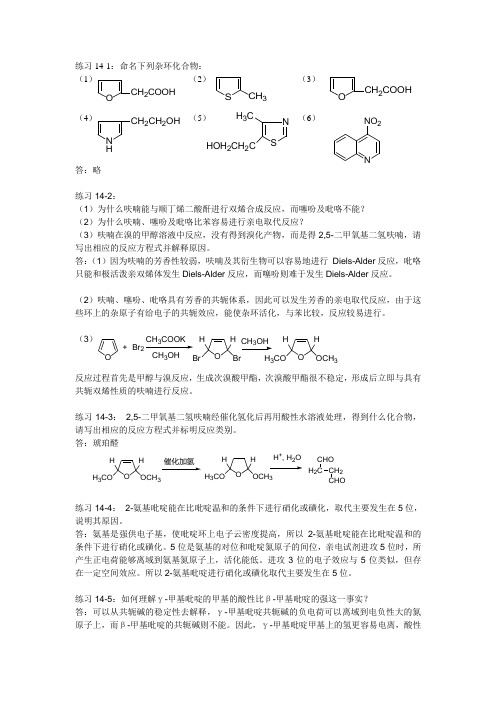
练习14-1:命名下列杂环化合物:(1) (2) (3)(4) (5) (6)答:略练习14-2:(1)为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩及吡咯不能?(2)为什么呋喃、噻吩及吡咯比苯容易进行亲电取代反应?(3)呋喃在溴的甲醇溶液中反应,没有得到溴化产物,而是得2,5-二甲氧基二氢呋喃,请写出相应的反应方程式并解释原因。
答:(1)因为呋喃的芳香性较弱,呋喃及其衍生物可以容易地进行 Diels-Alder 反应,吡咯只能和极活泼亲双烯体发生Diels-Alder 反应,而噻吩则难于发生Diels-Alder 反应。
(2)呋喃、噻吩、吡咯具有芳香的共轭体系,因此可以发生芳香的亲电取代反应,由于这些环上的杂原子有给电子的共轭效应,能使杂环活化,与苯比较,反应较易进行。
(3)反应过程首先是甲醇与溴反应,生成次溴酸甲酯,次溴酸甲酯很不稳定,形成后立即与具有共轭双烯性质的呋喃进行反应。
练习14-3: 2,5-二甲氧基二氢呋喃经催化氢化后再用酸性水溶液处理,得到什么化合物,请写出相应的反应方程式并标明反应类别。
答:琥珀醛练习14-4: 2-氨基吡啶能在比吡啶温和的条件下进行硝化或磺化,取代主要发生在5位,说明其原因。
答:氨基是强供电子基,使吡啶环上电子云密度提高,所以2-氨基吡啶能在比吡啶温和的条件下进行硝化或磺化。
5位是氨基的对位和吡啶氮原子的间位,亲电试剂进攻5位时,所产生正电荷能够离域到氨基氮原子上,活化能低。
进攻3位的电子效应与5位类似,但存在一定空间效应。
所以2-氨基吡啶进行硝化或磺化取代主要发生在5位。
练习14-5:如何理解γ-甲基吡啶的甲基的酸性比β-甲基吡啶的强这一事实?答:可以从共轭碱的稳定性去解释,γ-甲基吡啶共轭碱的负电荷可以离域到电负性大的氮原子上,而β-甲基吡啶的共轭碱则不能。
因此,γ-甲基吡啶甲基上的氢更容易电离,酸性OC H 2C O O H S C H 3OC H 2C O O HN HC H 2C H 2O H SNH 3C H O H 2C H 2CNN O 2O +Br 3C H 3OH O H B r H Br 3O HO C H 3H H 3C O OH C H 3HH 3C O催化加氢OH C H 3H H 3C OH +, H 2OC H 2H 2CC H OC H O更强。
15 杂环化合物问题参考答案
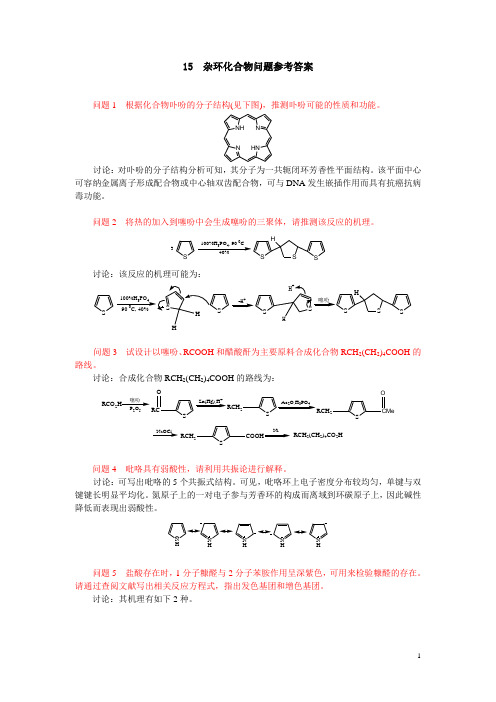
15 杂环化合物问题参考答案问题1 根据化合物卟吩的分子结构(见下图),推测卟吩可能的性质和功能。
NNH N HN讨论:对卟吩的分子结构分析可知,其分子为一共轭闭环芳香性平面结构。
该平面中心可容纳金属离子形成配合物或中心轴双齿配合物,可与DNA 发生嵌插作用而具有抗癌抗病毒功能。
问题2 将热的加入到噻吩中会生成噻吩的三聚体,请推测该反应的机理。
SSSSH 3100%H 3PO 4, 90 0C40%讨论:该反应的机理可能为:SS S SH100%H 3PO 440%SSSSHH噻吩HH +_H+90 0C,问题3 试设计以噻吩、RCOOH 和醋酸酐为主要原料合成化合物RCH 2(CH 2)4COOH 的路线。
讨论:合成化合物RCH 2(CH 2)4COOH 的路线为:S 噻吩NaOClP 2O 5RCO 2HRCOZn(Hg),H+SRCH 2Ac 2O,H 3PO 4SRCH 2CMeOSRCH 2COOHNiRCH 2(CH 2)4CO 2H问题4 吡咯具有弱酸性,请利用共振论进行解释。
讨论:可写出吡咯的5个共振式结构。
可见,吡咯环上电子密度分布较均匀,单键与双键键长明显平均化。
氮原子上的一对电子参与芳香环的构成而离域到环碳原子上,因此碱性降低而表现出弱酸性。
N H N H N H N H N H问题5 盐酸存在时,1分子糠醛与2分子苯胺作用呈深紫色,可用来检验糠醛的存在。
请通过查阅文献写出相关反应方程式,指出发色基团和增色基团。
讨论:其机理有如下2种。
OC HN H 2O H +C C HN CH HC HC OHOH C C HN CH 2H 2C CH OOC6H 5NH 2HClC C HN CHHCCH OH N HHCl机理1深紫色OC HN HClC 6H 5NH 2CC HH N CHHC CH OHN HOC HH N ClOC HH N H N H +CC H NHCHHCCH OHN HCl-+机理2发色基团和增色基团分别为:CC HN CHHC CH OHN HHCl发色基团助色基团问题6 请排列苯、吡啶、呋喃、噻吩、吡咯发生环上亲电取代反应的难易顺序,指出取代基进入的位置,并解释原因。
有机化学2 第十八章习题解答

18.8 解决下列问题。
(1) 区别吡啶和喹啉; (1)吡啶溶于水,喹啉在水中的溶解度很小(这是由于多 了一个疏水性苯基的结果。 (2) 除去混在苯中的少量噻吩; (2)向混合物中加入浓硫酸,振摇,使生成的2-噻吩 磺酸溶于下层的硫酸中得以分离。苯不溶浓硫酸中。 (3) 除去混在甲苯中的少量吡啶; (3)吡啶溶于水,甲苯不溶。
电负性是O(3.5)﹥N (3.0)﹥S (2.5),提供电子 对构成具有芳香性的芳环的能力与此电负性的关系相反。 因此芳香性噻吩>吡咯>呋喃。另一方面,反映出来的 共轭二烯性:呋喃>吡咯>噻吩。因此呋喃易与顺丁烯
二酸酐发生环加成反应,而吡咯、噻吩则需反应性更强
的亲双烯体,如苯炔、丁炔二酸酯等。
上页 下页
上页 下页 退出
(4) 除去混在吡啶中的六氢吡啶。 (4)根据六氢吡啶的碱性比吡啶的碱性强得多,将 混合物先溶于乙醚等有机溶剂,再向溶液中加入适量 的酸,将六氢吡啶和酸生成的盐沉淀出来。
上页 下页 返回 退出
第十八章 杂环化合物 习题解答
18.1 命名下列化合物:
4-甲基-2-乙基噻唑
α -呋喃甲酸
N-甲基吡咯
4-甲基咪唑
α,β-吡啶二甲酸
上页 下页 退出
3-乙基喹啉
5-异喹啉磺酸
β-吲哚乙酸
腺嘌呤或6-氨基嘌呤
6-羟基嘌呤
上页 下页 退出
18.2 为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,
而噻吩及吡咯则不能?使解释之。 在呋喃、吡咯、噻吩中,杂原子分别是O,N和S。
退出
18.3 为什么呋喃、噻吩及吡咯容易进行亲电取 代反应,试解释之。
呋喃、噻吩和吡咯中,具有五原子六个π 电子
呋喃吡咯噻吩的化学性质

呋喃 噻吩
吡咯
. . . . . . H . . . . . . . . . C . . H C
H
H
C
C
C H HC
H
H
C
C
C H HC
H C
CH
O
S
N
4
H
呋喃环结构 噻吩环结构 吡咯环结构
4
二、呋喃、吡咯、噻吩的一般性质
1、电负性:3.50(O)>3.04(N)> 2.58(S) >2.55(C) 。
第一取代 3(β)-取 代
实例
取代基类型
A Z=O,S,N; A=o, p -位基团
Z
A
Z=O,S,N; A= m -位基团
Z
12
Cl
N
12
第二取代
A B B主要在2-位 Z
A
B
B主要在5-位
Z
SO3H
O
练习题16-3
1、完成下列反应,写出反应主要产物。
1.
O2N
O
CHO + ( CH3CO)2O
A Z=S,N; A=o, p -位基团 Z
A
Z=S,N; A= m -位基团
Z
11
B
A B总是在5-位
O
B
A B主要在5-位
Z
B Z
A B主要在4-位
实例
CHO O
S CH3
11
S NO2
三、单取代呋喃、吡咯、噻吩的定位规律
1、第二取代:主要发生在a位,因为α 位的π电 子密度较大,容易受到亲电试剂进攻。
H
K+
CH3MgX
N H
C2H5OC2H5
有机化学-第五版-下册-第十八章答案

第十八章杂环化合物〔答案〕1.命名下列化合物。
NS C2H5H3CO COOHNCH3NNHH3CN COOHCOOHNC2H5NSO3HNHCH2COOHNN NNNH2HNN NNOHH(1)(2)(3)(4) (5)(6)(7) (8)(9)(10)1.解:〔1〕4-甲基-2-乙基噻唑〔2〕2-呋喃-甲酸或糠酸〔3〕N-甲基吡咯〔4〕4-甲基咪唑〔5〕α,β-吡啶二甲酸〔6〕3-乙基喹啉〔7〕5-异喹啉磺酸〔8〕β-吲哚乙酸〔9〕腺嘌呤〔10〕6-羟基嘌呤2.为什么呋喃能与顺丁烯二酸酐进行双烯合成反应,而噻吩与吡咯则不能?试解释之。
2.解:五元杂环的芳香性比较是:苯>噻吩>吡咯>呋喃。
由于杂原子的电负性不同,呋喃分子中氧原子的电负性〔3.5〕较大,π电子共扼减弱,而显现出共扼二烯的性质,易发生双烯合成反应,而噻吩和吡咯中由于硫和氮原子的电负性较小〔分别为2.5和3〕,芳香性较强,是闭合共扼体系,难显现共扼二烯的性质,不能发生双烯合成反应。
O +OOO△OOOO3.为什么呋喃、噻吩与吡咯容易进行亲电取代反应?试解释之。
3.解:呋喃、噻吩和吡咯的环状结构,是闭合共扼体系,同时在杂原子的P轨道上有一对电子参加共扼,属富电子芳环,使整个环的π电子密度比苯大,因此,它们比苯容易进行亲电取代反应。
4.吡咯可发生一系列与苯酚相似的反应,如可与重氮盐偶合。
试写出反应式。
解:吡咯分子中N 原子上的一对 p电子参与了大π键的形成,使碳环部分电子云密度升高,而N 上电子云密度有所降低,由于 N 原子的电负性比 H 原子的电负性大,所以诱导作用的结果使N—H 的氢原子具有弱酸性。
因而,吡咯分子具有与苯酚类似性的性质。
例如:N H(1)N Na+ H 2OOHONa+ H 2O(2)OH+N 2+NaO 3SN N OHNaO 3SN H+N 2+NaO 3SN HNN NaO 3S5.比较吡咯与吡啶两种杂环。
关于芳香性的概念

第15卷 第4期 大学化学2000年8月关于芳香性的概念姚子鹏 高 翔 任平达 黄毕生 (复旦大学化学系 上海200433) (云南大理师专化学系 云南671000) 摘要 简要介绍了芳香性概念的发展历史,并从结构、稳定性、反应性能等方面进行了总结。
在有机化学中,芳香性是一个重要的概念。
为了使学生能较好理解和掌握这一概念,我们在教学中从经典的芳香性概念、共振论对芳香性的看法、Hückel规则到核磁共振对芳香性化合物的测定,介绍了这一概念不断深化发展的过程。
并从结构、稳定性、反应性能等方面进行了总结,取得了较好的教学效果。
现把我们的看法进行简单介绍,以供教学参考。
1 芳香性的经典概念 1825年法拉第从鲸油裂解产生气体的冷凝液中发现了苯,接着测定了苯的组成、蒸气压、熔点等物理性质,并得出了苯的正确分子式C6H6。
此后,人们又发现许多具芳香气息的物质中含有苯的母核。
德国化学家凯库勒推断出苯的结构式为。
苯这种高度不饱和的化合物具有与一般不饱和烯烃不同的特殊性质,主要是:(1)环较稳定,在通常情况下不易被化学试剂破坏。
例如:甲苯易被氧化成苯甲酸,保留了苯环。
(2)易取代,难加成。
例如:苯在三氯化铁催化下和氯反应生成氯苯,而没有得到加成产物。
价键理论问世后,后一条表述为苯易亲电取代,难亲电加成。
上面两条就是经典的芳香性概念。
2 共振论对芳香性概念的发展 共振论认为苯主要是Ⅰ和Ⅱ的共振杂化体。
由于共振,共振杂化体(苯的真正结构)比较稳定。
通过比较苯和环己三烯的氢化热(以3个环己烯计),可以计算出苯的共振能为150.6 kJ/mol。
即苯比环己三烯稳定150.6kJ/mol。
Ⅰ∴Ⅱ 如果说经典的芳香性概念中,芳香环的稳定性是根据环对化学试剂的稳定性而言,那么,共振论则进一步把芳香环的稳定性与它具有较低的内能明确地联系起来。
通过氢化热、燃烧热等数值,计算出了一大批芳香族化合物的共振能,从而可以比较各种芳香环的稳定性高低或芳香性强弱。
噻吩、吡咯、呋喃在H-FAU分子筛中吸附和扩散行为的分子模拟

噻吩、吡咯、呋喃在H-FAU分子筛中吸附和扩散行为的分子模拟党宇;杨晓东;刘熠斌;冯翔;杨朝合【摘要】采用蒙特卡洛方法(GCMC)和分子动力学方法(MD),研究了在823 K、100~1000 kPa条件下噻吩、吡咯和呋喃3种典型的杂原子分子在H-FAU分子筛中吸附和扩散性能,分析了3种分子在H-FAU分子筛中的概率密度分布、分子扩散动力学和径向分布函数(RDF).单组分吸附模拟的结果表明,噻吩的饱和吸附量和吸附热最大,吡咯居中,呋喃最小.三元混合组分的吸附模拟表明:噻吩的吸附强度明显大于吡咯和呋喃;3种分子在分子筛的超笼和SOD笼中均有分布,且噻吩在超笼中更加集中;3种分子在孔道中扩散阻力的大小依次为噻吩、吡咯、呋喃;噻吩、吡咯和呋喃主要通过分子环区的离域电子及杂原子与孔道表面H质子进行作用.【期刊名称】《石油学报(石油加工)》【年(卷),期】2019(035)005【总页数】9页(P911-919)【关键词】杂原子分子;八面沸石(FAU)分子筛;吸附;扩散;分子模拟【作者】党宇;杨晓东;刘熠斌;冯翔;杨朝合【作者单位】中国石油大学重质油国家重点实验室,山东青岛 266580;中国石油大学重质油国家重点实验室,山东青岛 266580;中国石油大学重质油国家重点实验室,山东青岛 266580;中国石油大学重质油国家重点实验室,山东青岛 266580;中国石油大学重质油国家重点实验室,山东青岛 266580【正文语种】中文【中图分类】TE624八面沸石(FAU)分子筛因具有较高的内表面积、适宜的孔结构、固体酸特性及高温稳定性而被用作催化裂化(FCC)反应的催化剂[1-2]。
目前,催化裂化过程正逐步适应加工劣质的重油,而劣质重油中含有大量杂原子化合物。
杂原子化合物通过诱导效应来中和催化剂的酸中心,或以形成焦炭覆盖酸中心的方式使催化剂中毒失活,严重阻碍其它烃类的反应[3-4]。
原料分子中的杂原子主要包括S、N、O原子,不同的杂原子化合物对催化裂化反应的影响程度不同。
(徐寿昌版)有机化学课后习题答案详细讲解
4-乙烯基-4-庚烯-2-炔
(7)
1,3,5-己三烯
3.写出下列化合物的构造式。
(1)
4-甲基-1-戊炔
(2)
3-甲基-3-戊烯-1-炔
(3)
二异丙基乙炔
(4)
1,5-己二炔
(5)
异戊二烯
(6)
丁苯橡胶
(7)
乙基叔丁基乙炔
4.写出1-丁炔与下列试剂作用的反应式。
5.完成下列反应式。
6.以反应式表示以丙炔为原料,并选用必要的无机试剂,合成下列化合物。
(1)CH3-CH3
(2)(CH3)3C-C(CH3)3
(3)CH3CH2-CH3
7.用Newmann投影式写出1,2-二溴乙烷最稳定及最不稳定的构象,并写出该构象的名称。
解:
对位交叉式构象
最稳定
全重叠式构象
最不稳定
8.下面各对化合物那一对是等同的?不等同的异构体属于何种异构?
解:
1.
不等同,构象异构
乙炔
Br2/CCl4
不变
褪色
褪色
硝酸银氨溶液
不变
(2)CH3CH2CH2C三CH和CH3C三CCH3
解:分别加入硝酸银氨溶液,有炔银沉淀的位1-丁炔。
12.试用适当的化学方法将下列混合物中的少量杂志除去。
解:(1)将混合物通入硝酸银的氨溶液,乙炔生成乙炔银而沉淀除去。
(2)将混合物进行Lindlar催化加氢,则乙炔变为乙烯。
8.某烃(A)经臭氧化并在锌纷存在下水解只得一种产物2,5-己二酮,试写出该烃可能的结构式。
解:该烃为1,2-二甲基环丁烯:
9.分子式为C4H6的三个异构体(A),(B),(C)能发生如下的反应:
用芳香性、共振式对芳环并环上取代的选择性进行解释

反应机理如下:
反应的关键是Cl-对芳环的亲核取代。
在上面的共振式中,II要比III稳定,在II中有一个环满足芳香性;在III中两个环都不满足芳香性。
问题三:
噻吩环上溴属于芳环的亲电取代反应。由于3位羧基的吸电子作用,所以处于邻位的2位和4位电荷密度会降低,而5位受的影响不大。所以5位反应活性大于2位和4位。
从共振式可以看出,2位和3位都富有电荷。
苯并吡咯等共振式如下:
从共振式VI可以看出3位富有电荷。而共振式VII由于破坏了苯环的芳香性,所以稳定性要大大下降,所以2位比起3位来讲,电荷密度会大大减小。
问题四:吡咯、噻吩,2位3位都富电子,在亲电反应中活性都很高。为何苯并吡咯和苯并噻吩中,3位活性要r是一种亲电氟化试剂。在上面四种共振式种,共振式II要比I稳定,因为共振式II种两个环都满足芳香性,共振式I中只有一个环满足。考虑到氨基的供电子性,共振式IV比III稳定,IV中有一个环满足芳香性,III中两个环都不满足芳香性。由此可知,5位比7位更富电子,在亲电反应中活性更高。
关环一步反应,也属于芳环亲电取代,只是比较2位和4位的电荷密度,差别并没有那么大,主要是从形成产物的芳香性来比较。
很明显,II比IV要稳定,II可以满足两个环都具有芳香性;而IV如果也要使得两个环都具有芳香性,则要产生更多的分散电荷,电荷分散也会降低稳定性。
问题四:
吡咯或者噻吩以及呋喃的共振式如下:
问题一:6-氨基喹啉上氟,主要产物是5位氟取代;为什么7位活性要远远小于5位?
问题二:1-取代-6-N氧化物-6氮杂吲哚,和三氯氧磷反应,主要得到7-氯产物;为什么5位活性要远远小于7位?
问题三:噻吩-3-羧酸,上溴的产物主要是5-溴,还有少量2,5-二溴以及更少的2,4,5-三溴;在最后一步关环的时候,关环的位点在2-位,而4位关环产物没能观察到。如何解释这种现象?
五元单杂环化合物芳香性和反应活性讨

五元单杂环化合物芳香性和反应活性讨组员分工:总结和演讲:曹朋成收集资料:尹文,晏杭,冯柏塨,周英杰,卓帅整理资料:龙贤哲,冉天飞PPT制作:刘泽宇五元单杂环化合物,呋喃、吡咯、噻吩中各原子在同一平面上,碳原子与杂原子(氧,硫,氮)都是sp2杂化。
每个碳原子剩下一个未杂化P轨道,其中填充有一个P电子。
杂原子的P轨道上填充有一对未共用的电子,组成一个五原子,六电子的环状共轭体系,符合休克尔规则,具有杂芳香呋喃、>吡咯>呋喃。
另外从呋喃、吡咯、噻吩的共轭能也证明了这个芳香性大小次序。
共轭能高,说明环共轭体系稳定性高,芳香性大。
共轭能低,环共轭体系稳定性低,芳香性小。
根据上表数据可见,噻吩的共轭能高、芳香性大,呋喃的共轭能低、芳香性小,吡咯介于噻吩、呋喃之间。
2.加成反应与芳香性加成反应与芳香性的标志之一是不易进行加成反应。
那么,如果容易进行加成反应,则芳香性小,甚至无芳香性。
所以,可以从吡咯、呋喃、噻吩加成反应的难易来分析它们芳香性的大小。
呋喃、吡咯、噻吩有芳香性,也能进行加成反应。
例如,呋喃、吡咯、噻吩都能催化氢化,呋喃较易加氢,并很快生成四氢呋喃。
吡咯、噻吩相对加成较慢,特别是噻吩,加氢时硫可以使催化剂(Pd、Pt、Ni)>吡咯>这可能杂原子是噻的稳定件大于呋喃,这样噻吩的亲电取代反应活性小于呋喃。
4.结果讨论五元杂环化合物呋喃、吡咯、噻吩都有芳香性,芳香性大小是,噻吩>吡咯>呋喃。
都易进行亲电取代反应,反应活性次序是吡咯>呋喃>噻吩。
芳香性和亲电反应活性看似没有规律性联系,这是二者考虑问题的角度不同,芳香性考虑是键长、电子密度平均化程度、环的稳定性等。
亲电取代反应活性考虑环上电子密度大小。
电子密度大的易进行亲电取代,电子密度小不易进行亲电取代。
虽然如此,二者还是有联系的。
例如噻吩,芳香性在三个单杂环化合物中是最大的,在亲电取代反应中是最不活泼的。
这是因为,对富电子的芳香杂环化合物,电子云平均化程度越大,芳香性越大,亲电取代反应活性越小,噻吩就是如此。
论呋喃_吡咯_噻吩的芳香性和亲电取代反应的活性_马军营

乙酐
+ C H3 CON O2 - 5℃
N
N O2 + N
当亲电试剂进攻 β - 位时 ,生成的正离子极限式为 IV和 V 的杂化体 ; 当进攻 α- 位时 ,生成 的正离子极限式为 I、Ⅱ 、Ⅲ 的杂化体 ,这一正离子的正电荷是分布在 3个原子上而不是两个
Franklin值
151. 634 114. 11 123. 73 92. 80
从表 3的共振化能值大小顺序可知 ,其芳香性顺序与实测值顺序相符 ,其中 Klayes值 比较符合实验结果 . 1. 2. 2 环氢原子化学位移的比较 由表 2可知 ,苯分子的 6个碳原子由于电负性相同 , 6 个氢原子的化学位移相等 ,差值为零 .而在呋喃、吡咯、噻吩中 ,由于杂原子的电负性不同引 起的环上的电子云密度不完全相等 ,其环氢原子的化学位移不相等 ,其中差值越大 ,其芳香 性越小 . 即呋喃 <吡咯 <噻吩 < 苯 . 1. 2. 3 从键角大小的比较 由表 1可知 ,噻吩分子中 ,∠ CSC缩小 ,而使∠ SCC和∠ CCC 增大 ,与正常键角 120°偏差较小 ,角张力最小 ,最稳定 ; 而呋喃则相反 ,角张力最大则最不稳 定. 1. 2. 4 分子极性的比较 在这 3种杂环化合物中 ,由于杂原子氧 ( 3. 50)、氮 ( 3. 70)、硫 ( 2. 44)的电负性比碳 ( 2. 05)大 ,具有吸电子的诱导效应 ( - I) ,使电子沿着 σ键方向偏向杂原 子 . 同时 ,杂原子 p轨道上的未共用电子对参与了五员环的共轭体系 ( p- π共轭 ) ,产生给电 子性的共轭效应 (+ C) .两者使杂环分子具有极性 .在呋喃、噻吩分子中 ,杂原子的诱导效应 ( - I)与共轭效应 (+ C)方向相反 ,所以它们的偶极矩与相应的脂杂环化合物 (只有 - I)相比 减小 ,而吡咯由于+ C> - I偶极矩增大 (见表 4)
呋喃、噻吩和吡咯 结构与芳香性

呋喃、噻吩和吡咯→ 结构与芳香性结构与芳香性性质衍生物呋喃、噻吩与吡咯结构相似,都是由一个杂原子和四个碳原子结合构成的化合物。
从结构上它们可以看做是由O、S、NH分别取代了1,3-环戊二烯(也称为茂)分子中的CH后得到的化合物。
但从化学性质上看,它们与环戊二烯并无多少相似之处,倒是与苯非常类似。
例如,呋喃、噻吩、吡咯这三个化合物都非常容易在环上发生亲电取代反应,而不太容易发生加成反应。
这说明用上述三个结构来代表这三个化合物存在着某种片面性。
按照杂化理论的观点,呋喃、噻吩、吡咯分子中四个碳原子和一个杂原子间都以sp杂化轨道形成σ键,并处于同一平面上,每一个原子都剩一个未参与杂化的p轨道(其中碳原子的p轨道上各有一个电子,杂原子的p轨道上有两个电子)。
这五个p轨道彼此平行,并相互侧面重叠形成一个五轨道六电子的环状共轭大π键,π电子云分布于环平面的上方与下方(见图16-1),其π电子数符合休克尔的4n+2规则(n=1)。
这三个化合物所形成的共轭体系与苯非常相似,所以它们都具有类似的芳香性。
但是,这三个化合物所形成的共轭体系与苯并不完全一样,主要表现在以下两处:(1)键长平均化程度不一样。
苯的成环原子种类相同,电负性一样,键长完全平均化(六个碳碳键的键长均为140pm),其电子离域程度大,π电子在环上的分布也是完全均匀的。
这三个化合物都有杂原子参与成环,由于成环原子电负性的差异,使得它们分子键长平均化的程度不如苯,电子离域的程度也比苯小,π电子在各杂环上的分布也不是很均匀,所以呋喃、噻吩、吡咯的芳香性都比苯弱。
三种杂环分子中共价键的长度如下:另外,由于这三个杂环所含杂原子的电负性也各不相同,各环系中电子云密度的分布也不一样,所以它们之间的芳香性有差异。
氧是三个杂原子中电负性最大的,呋喃环π电子的离域程度相对较小,所以其芳香性最差;硫的电负性小于氧和氮,与碳接近,噻吩环上的电子云分布比较均匀,π电子离域程度较大,因此其芳香性最强,与苯差不多;氮的电负性介于氧和硫之间,吡咯环的芳香性也介于呋喃和噻吩之间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
键角 ∠ x CC 110. 7 108. 08 111. 5
∠ CCC 106
107. 45 112. 4
从表 1的数据可知 ,这 3种化合物的键趋于平均化 ,即分子中的 6个 π电子充分离域形 成了一个整体性的大 π键 ,但由于杂原子与碳原子的电负性不同 ,键长仅是部分地平均化 . 1. 1. 4 环氢原子的化学位移测定 芳香环的 π电子若有离域 ,就会产生环电流 ,可由此来 判断环是否有芳香性 .在这 3种化合物中 , 6个 π 电子若组成一个连续封闭的大 π 键 ,就会 在外磁场的作用下产生一个沿分子骨架流动的环电流 ,这种环电流产生的感应磁场 ,对于环 上的氢原子在外加磁场中的行为起去屏蔽作用 ,即使得氢原子的共振吸收峰向低场方向移 动 . 通过对这 3种化合物的 NM R图谱 ,计算环电流对化学位移 (δ) ,一般在 7ppm , (见表 2) , 也充分说明了这 3种化合物的 6个 π电子发生了离域 .
综上所述这 3种杂环化合物的芳香性大小顺序为: 苯 > 噻吩 > 吡咯 > 呋喃 .
64
河南师范大学学报 (自然科学版 ) 1998年
2 呋喃、吡咯、噻吩的亲电取代反应
2. 1 反应活性比较 与苯相似 ,这 3种杂环化合物也能发生硝化、磺化、卤代、酰化等亲电取代反应 ,但由于
小心控制条件 ,噻吩可用酸性较弱的质子酸 (如磷酸 )而吡咯可直接配基化 .
150~ 200℃
+ ( CH3 CO ) 2 O
COC H3 + C H3 CO
CO CH3
N
N
N
|
|
|
H
H
H
O
B F3
+ ( CH3 CO ) 2 O 0℃
CC H3
O
O
( 75% ~ 72% )
O
+
( CH3 CO ) 2
⒇ 文稿收到日期: 1997- 10- 24.
62
河南师范大学学报 (自然科学版 ) 1998年
1. 1. 3 键长趋于平均化 通过现代 X光衍射法测得这 3种杂环化合物的键 ,与正常的双 键和单键的键长不同 . 其中双键比正常碳碳双键的键长 ( 0. 135nm)略长 ,其单键要比正常碳 碳单键的键长 ( 0. 154nm )略短些 .它们的键长和键角如表 1所示 .
乙酸得硝化产物 .
2. 1. 2 磺化反应 一般选用温和的吡啶三氧化硫而不用浓硫酸作磺化剂 .由于噻吩芳香性
和稳定性较大 ,也可直接在室温下直接用浓硫酸磺化 ,而苯则不能反应 ,即用此反应除去煤
焦油中少量的噻吩 .
+ C2 H5 N· SO3
CH2Cl2 100℃
N |
H
+ C5 H5 N· SO3
表 1 呋喃、吡咯、噻吩的部分键长和键角 [2 ]
化合物
呋喃 吡咯 噻吩
x- C2 0. 136 2 0. 138 3 0. 171 4
键长 ( nm ) C2- C3 0. 136 1 0. 137 1 0. 137 0
C3- C4 0. 143 1 0. 142 9 0. 142 3
∠ CxC 106. 6 108. 9 92. 2
表 4 呋喃、吡咯、噻吩及相应脂杂环化合物的偶极矩 [2 ] (μ, D)
化合物
噻吩
呋喃
吡咯
四氢噻吩 四氢呋喃 四氢吡咯
偶极矩
0. 51
0. 70
1. 81
1. 90
1. 73
1. 58
对于吡咯与相应的脂杂环相比 ,偶极矩方向相反 ,除了以上因素外 ,还由于 N- H键偶极矩 的方向与共轭方向一致 .即
第 26卷 第 1期 1998年 2月
河南师范大学学报 (自然科学版 ) Journal of Henan N ormal University (N atural Science )
Vol. 26 N o. 1 Feb. 1998
论呋喃、吡咯、噻吩的芳香性和 亲电取代反应的活性
马军营
(平顶山师专化学系 , 467000,平顶山 ; 32岁 ,男 ,讲师 )
在这 3个杂环化合物中 ,因杂原子不同 ,上述电子效应也不同 . 氮的电负性比氧小 ,则其 吸电子效应比氧弱 ,供电子效应比氧强 ,使吡咯 π电子云平均化程度比呋喃大 ,即吡咯的芳 香性比呋喃大 . 而硫原子尽管其 p- π共轭效应较弱 ( 3p轨道半径大 ) ,但由于 3d轨道可参 与成键 ,使噻吩中碳与硫形成的 π 键除了 p- p成分外 ,还有 p- d成分 ,因此噻吩的 π电子 云密度平均化程度最大 .
Franklin值
151. 634 114. 11 123. 73 92. 80
从表 3的共振化能值大小顺序可知 ,其芳香性顺序与实测值顺序相符 ,其中 Klayes值 比较符合实验结果 . 1. 2. 2 环氢原子化学位移的比较 由表 2可知 ,苯分子的 6个碳原子由于电负性相同 , 6 个氢原子的化学位移相等 ,差值为零 .而在呋喃、吡咯、噻吩中 ,由于杂原子的电负性不同引 起的环上的电子云密度不完全相等 ,其环氢原子的化学位移不相等 ,其中差值越大 ,其芳香 性越小 . 即呋喃 <吡咯 <噻吩 < 苯 . 1. 2. 3 从键角大小的比较 由表 1可知 ,噻吩分子中 ,∠ CSC缩小 ,而使∠ SCC和∠ CCC 增大 ,与正常键角 120°偏差较小 ,角张力最小 ,最稳定 ; 而呋喃则相反 ,角张力最大则最不稳 定. 1. 2. 4 分子极性的比较 在这 3种杂环化合物中 ,由于杂原子氧 ( 3. 50)、氮 ( 3. 70)、硫 ( 2. 44)的电负性比碳 ( 2. 05)大 ,具有吸电子的诱导效应 ( - I) ,使电子沿着 σ键方向偏向杂原 子 . 同时 ,杂原子 p轨道上的未共用电子对参与了五员环的共轭体系 ( p- π共轭 ) ,产生给电 子性的共轭效应 (+ C) .两者使杂环分子具有极性 .在呋喃、噻吩分子中 ,杂原子的诱导效应 ( - I)与共轭效应 (+ C)方向相反 ,所以它们的偶极矩与相应的脂杂环化合物 (只有 - I)相比 减小 ,而吡咯由于+ C> - I偶极矩增大 (见表 4)
C2 H2Cl2 100℃源自O+ H2 SO4 (浓 ) 25℃
SO3 H N | H
SO3 H O
SO3 H
S
S
2. 1. 3 卤代反应 在卤代反应中 ,这 3种杂环化合物的反应活性类似于活化的苯环 (如胺
类和酚类 ) ,室温下不用催化剂即发生剧烈反应 ,尤其是吡咯 ,即使用溶剂稀释及低温下也可
得到四卤吡咯 ,而噻吩反应较温和 .
摘 要 本文 就呋喃、吡咯、噻吩的芳 香性的存在 和大小及 其反应活 性的大 小给以 定性
的解释 .
关键词 呋 喃 ;吡咯 ; 噻吩 ;芳香性 ; 亲电取代反应活动 分类号 O 626. 1
呋喃、吡咯、噻吩都是比较稳定的化合物 ,无论是在通常条件下进行蒸馏 ,还是在比较强 烈的条件下发生的许多反应 (如亲电取代反应 ) ,五员杂环本身都不容易被破坏 ,即具有芳香 性 . 实验证明 ,这 3个化合物实测的生成热都比其理论计算值低 ,这个低出的部分能量即为 稳 定化能 (或共振能 ) ,其数值 ( k J/mol)为: 呋喃 ( 71. 1)、吡咯 ( 90. 4)、噻吩 ( 125. 5)、苯 ( 150. 6) ,这表明其芳香性大小顺序 [1]为: 呋喃 <吡咯 <噻吩 < 苯 .与苯相似 ,这 3种杂环化合物也 能发生亲电取代反应 ,其活性大小顺序为: 吡咯 > 呋喃 > 噻吩 > 苯 .本文就此两个顺序给以 定性解释 .
第 1期 马军 营: 论呋喃、吡咯、噻吩的芳香性和亲电取代反应的活性
63
化合物
苯 噻吩 吡咯 呋喃
表 3 共振化能值 [4 ] ( ER , k J/mol)
Pauling 值
133. 92 87. 75 100. 74 63. 95
Kla y es值
150. 06 122. 89 84. 85 66. 04
1 呋喃、吡咯、噻吩的芳香性
1. 1 呋喃、吡咯、噻吩芳香性的证实 1. 1. 1 呋喃、吡咯、噻吩的结构 现代物理实验方法 证明 ,组成这 3个化合物的 5个原子都是采取 sp2杂 化 ,通过 σ键连接成平面五员环和 C- H、 N- H键 (吡咯 ) ; 每个原子各有一个未参与杂化的 p轨道垂直 于环平面 ,碳原子有一个电子 ,而杂原子有一对电子 , 它们相互侧面重叠形式 π65的闭合共轭体系 (见图 1) . 1. 1. 2 共振论的解释 按照价键理论观点 ,由于呋喃、吡咯、噻吩中的杂原子上未共用电子 对的离域作用 ,使得这 3种分子分别形成一系列结构组成的共振杂化体 (见图 2) . 由于结构 共振化而使其内能降低 ,稳定性增大 . 但在 6种共振结构中 ,对组成杂化体的贡献并不等同 . 根据共振论规则 ,其中贡献最大的为电荷不分散的式 I(如在吡咯分子中 ,式 I为 62% ,Ⅲ 和 Ⅳ 为 29% 、Ⅴ 和Ⅵ 为 8% 、Ⅱ 是极少量的 ) .
其芳香性、稳定性较差 ,反应时必须严格选择试剂和控制反应条件 ,否则导致环的破裂或得 到复杂产物 . 2. 1. 1 硝化反应 对于此反应一般不直接用混酸、硝酸硝化而是用较温和的乙酰硝酸酯作 硝化剂 ,并在低温条件下进得 ,主要得到 α- 取代产物 .
乙酐
+ C H3 CON O2 - 5℃
N
N O2 + N
H3 PO4 90℃
C C H3
S
S
( 95% )
另外 ,这些杂环化合物还能发生 Reimer- Tiemann. Kolbe- Schmit t、亚硝化反应及与重 氮盐发生偶联反应 . 说明呋喃、吡咯、噻吩的反应活性远大于苯 ,而类似于苯胺和苯酚 . 故其 反应活性顺序为: 吡咯 > 呋喃> 噻吩 > 苯 . 2. 2 亲电取代反应活性的解释 2. 2. 1 与苯的反应活性比较 在呋喃、吡咯、噻吩中 ,首先由于杂原子具有给电子的共轭效 应 ,而使杂环上的 π电子云密度大于苯、更易受亲电试剂的进攻 ,尤其是 α- 位 .其次还与反 应过渡态相应中间体正离子结构有关 (见图 4[4 ] )
