工 程 热 力 学 第一章 热力学基本概念PPT课件
高等工程热力学第1章
t
( C) =5 t(F ) 32 9
° °
33
☻ 压力
绝对压力 p;
表压力 pe(pg); 真空度 pv;
p=
F A
p = pb + pe ( p > pb )
p = pb - pv ( p < pb )
动压力、静压力、滞止压力和绝对压力 ?
☻ 热力学能
Uch
G = G( p, T , n1 , n2 , , nr )
热力平衡系统
其中
是驱使第i 种组分变化的势,即化学势:
12
用A表示的化学势
改变约束条件,化学势还可有其它的表达式、但是 无论如何表示,其实质都相同:
据化学势概念,定温、定容和定压、定温系统的 平衡判据:
13
四. 稳定平衡判据
力学中平衡的稳定性
+
+
1
b2
1
C)状态参数分类: 广延量 强度量 (广延量的比性质,具有强度量特性)32
► 系统两个状态相同的充要条件: 所有状参一一对应相等 简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
► 基本状态参数
☻ 温度
测温的基础—热力学零定律 热力学温标和国际摄氏温标
{t } C = {T }K 273.15
δ AT ,V = 0
1
δ AT , V > 0
2
定温定压系统,平衡与稳定的条件
δ GT , p = 0
1
δ GT , p > 0
2
16
过程
不同形式能量之间的转换必须通过工质的状态变化过程才 能完成。 一切过程都是平衡被破坏的结果,工质和外界有了热的、力的 或化学的不平衡才促使工质向新的状态变化,故实际过程都是不 平衡的。
工程热力学-01 基本概念及定义

平衡状态1
p1 v1
p
p2
2
压容图 p-v图
平衡状态2
p1
1
p2 v2
O
v2
v1
v
12
1-4 状态方程式
在平衡状态下,由气态物质组成的系统,只要知道两个独立的 状态参数,系统的状态就完全确定,即所有的状态参数的数值随之 确定。这说明状态参数间存在某种确定的函数关系,状态参数之间 存在着确定的函数关系,这种函数关系就称为热力学函数。
(2)当系统处于热力学平衡状态时,只要没有外界的影响, 系统的状态就不会发生变化。
(3)整个系统可用一组具有确定数值的温度、压力及其他参
? 数来描述其状态。
10
经验表明,确定热力学系统所处平衡状态所需的独立状 态参数的数目,就等于系统和外界间进行能量传递方式的数 目。对于工程上常见的气态物质组成的系统,系统和外界间传递 的能量只限于热量和系统容积变化所作的功两种形式,因此只需 要两个独立的状态参数即可描述一个平衡状态。
3、平衡状态、稳定状态、均匀状态
(1)关于稳定状态与平衡状态
稳定状态时,状态参数虽不随时间改 变,但它是依靠外界影响来维持的。而平 衡状态是不受外界影响时,参数不随时间 变化的状态。
85℃ 20℃
90℃
15℃
铜棒
平衡必稳定,稳定未必平衡。
(2)关于均匀状态与平衡 水
质统称为外界。 通常选取工质作为热力学系统,把高温热源、低温热源
等其他物体取作外界。
3、边界 ——热力学系统和外界之间的分界面称为边界。
边界可以是固定的,也可以是移动的; 边界可以是实际的,也可以是假想的。
3
二、热力学系统的分类 依据——有无物质或能量的交换
工程热力学_基本概念

广延性参数:整个系统的某广延性参数值等于系 统中各单元体该广延性参数值之和,如系统的容 积、内能、焓、熵等。在热力过程中,广延性参数 的变化起着类似力学中位移的作用,称为广义位 移。
所吸收或放出的热量。
4.定压比热: c p
q p dT
dh dT
表明单位物量的气体在定压情况下升高或降低 1K
所吸收或放出的热量。
5.梅耶公式:
3
cp cv R
c' p c'v 0 R
Mc p Mcv MR R0
6.比热比:
c p c' p Mc p cv c'v Mcv
p
gi
Ri R
p
混合气体的比热容:
c g1c1+g2c2 +
n
gncn gici i 1
4
混合气体的容积比热容:
c ' r1c'1+r2c'2 +
n
rnc 'n ric 'i i 1
混合气体的摩尔比热容:
n
n
Mc M gici xiMici
i 1
制冷系数:
1
q2 w0
q2 q1 q2
式中
q1—工质向热源放出热量; q2—工质从冷源吸取热量;
w0—循环所作的净功。
供热系数:
2
q1 w0
q1 q1 q2
式中
工程热力学(基本概念)
国际实用温标的固定点
平衡状态
平衡氢三相点 平衡氢沸点 氖沸点 氧三相点 氧冷凝点
国际实用温标指定
值
T,K
t,℃
13.81 -259.34
20.28 -252.87
20.102 -246.048
54.361 -218.789
90.183 -182.962
平衡状态
水三相点 水沸点
锌凝固点 银凝固点 金凝固点
一、热力过程
定义:热力系从一个状态向另一个状态变化时所经 历的全部状态的总和。
二、准平衡(准静态)过程
准平衡过程的实现
工程热力学 Thermodynamics
二、准平衡(准静态)过程
定义:由一系列平衡态组成的热力过程 实现条件:破坏平衡态存在的不平衡势差(温差、
力差、化学势差)应为无限小。 即Δp→0 ΔT→0 (Δμ→0)
工程热力学 Thermodynamics
三、可逆过程
力学例子:
定义: 当系统完成某一热力过程后,如果有可能使系统再
沿相同的路径逆行而恢复到原来状态,并使相互中所涉 及到的外界亦恢复到原来状态,而不留下任何变化,则 这一过程称为可逆过程。
实现条件:准平衡过程加无耗散效应的热力过程 才是可逆过程。
工程热力学 Thermodynamics
用来实现能量相互转换的媒介物质称为工质。
理想气体
工 质
实际气体
蒸气
工程热力学 Thermodynamics
二、平衡状态
(一)热力状态:热力系在某一瞬间所呈现的宏观
物理状况。(简称状态)
(二)平衡状态 1、定义:一个热力系统,如果在不受外界影响的条件下,
系统的状态能够始终保持不变,则系统的这种状态称为平衡 状态。
工程热力学第1章-基本概念

两者关系:
v
1
河北理工大学
1-4 平衡状态
工程热力学
一、平衡状态(thermodynamic equilibrium state)
1.定义:无外界影响系统保持状态参数不随时间而改变的状态
热平衡(thermal equilibrium) : 在无外界作用的条件下,系统内部、系统与外界 处处温
度相等。
河北理工大学
四、逆向循环(reverse cycle)
▲制冷循环(refrigeration cycle) ▲热泵循环(heat-pump cycle)
工程热力学
一般地讲:输入净功; 在状态参数图逆时针运行; 吸热小于放热。
河北理工大学
五、循环经济性指标:
收益 代价
动力循环: 热效率(thermal efficiency)
河北理工大学
三、热量(heat)
1.定义:仅仅由于温差而 通过边界传递的能量。
2.符号约定:系统吸热“+”; 放热“-”
3.单位: J kJ
4.计算式及状态参数图
(T-s图上)表示
2
Q TdS
(可逆过程)
1
δQ TdS
热量是过程量
河北理工大学
工程热力学
四、热量与功的异同:
1.均为通过边界传递的能量;
热力学温标单位:开尔文,K。水的三相 点的温度,即固相、液相和气相平衡共 存状态的温度作为基准点,并规定为 273.16K。
t T 273.15
C
K
河北理工大学
河北理工大学
工程热力学
工程热力学
华氏温标和摄氏温标
{t} ℃=5/9[{t} ℉-32] {t} ℉ =9/5{t} ℃ +32
《工程热力学》第一章 基本概念

9
1.3.1、基本术语-状态、状态参数
1、状态:工质在热力变化过程中某一瞬间所呈现的宏观 物理状况称状态
2、状态参数:表示状态特征的物理量称为状态参数
状态与状态参数是一一对应的
3、状态参数特点
数学特征为点函数: 微元变化的微增量具全微分性质
4、热力学基本状态参数为三个:比容、压力、 温度
10
1.3.2、基本状态参数--比容及密度
C 1 2 B B A
16
1-4
平衡状态、状态方程式、坐标图
1.4.1 平衡状态与非平衡态 平衡状态:系统在不受外界影响的条件下, 如果宏观热力性质不随时间而变化,系统 内、外同时建立了热平衡、力平衡(及 化学平衡),此时系统所处状态为平衡态 非平衡态: 系统与外界,系统内部各部分间 存在能量传递及相对位移,状态将随时间 变化,称系统处于非平衡态
受逐渐变化的压力作用下的活塞的移动过程 发生系统状态变化 (力作用)(NEXT)
受变化的恒温热源缓慢加热的活塞系统发生 系统状态变化(热的作用) (NEXT)
26
P3 P2
P1
工质 工 质
工质
受逐渐变化压力作用下的活塞移动过程发生系 统状态变化(P、V、T变化) (力作用)
27
工质
工质
工质
热源T
31
1-6
过程功与热量
1.6.1 功的定义: 1、功的力学定义: 将物体间通过力的作用而传递的能量称为功并 定义:功等于力F与物体在力作用方向上的位移X 的乘积(点积) dW = F ·dX 2、功的热力学定义: 热力学系统和外界通过边界而传递的能量, 其效果可表现为举起重物
区别:功与系统动能、重力位能等“储存能”变化传递 的机械能的本质区别
《工程热力学》课件

理想气体混合物
理想气体混合物的性质
理想气体混合物具有加和性、均匀性、 扩散性和完全互溶性等性质。
VS
理想气体混合物的计算
通过混合物的总压力、总温度和各组分的 摩尔数来计算混合物的各种物理量。
真实气体近似与修正
真实气体的近似
真实气体在一定条件下可以近似为理想气体。
真实气体的修正
由于真实气体分子间存在相互作用力,因此需要引入修正系数对理想气体状态方程进行 修正。
特点
工程热力学是一门理论性较强的学科 ,需要掌握热力学的基本概念、定律 和公式,同时还需要了解其在工程实 践中的应用。
工程热力学的应用领域
能源利用
工程热力学在能源利用领域中有 着广泛的应用,如火力发电、核 能发电、地热能利用等。
工业过程
工程热力学在工业过程中也发挥 着重要的作用,如化工、制冷、 空调、热泵等。
稳态导热问题
稳态导热是指物体内部温度分布不随时间变 化的导热过程,其特点是热量传递达到平衡 状态。
对流换热和辐射换热的基本规律
对流换热的基本规律
对流换热主要受牛顿冷却公式支配,即物体 表面通过对流方式传递的热量与物体表面温 度和周围流体温度之间的温差、物体表面积 以及流体性质有关。
辐射换热的基本规律
辐射换热主要遵循斯蒂芬-玻尔兹曼定律, 即物体发射的辐射能与物体温度的四次方成
正比,同时也与周围环境温度有关。
传热过程分析与计算方法简介
要点一
传热过程分析
要点二
计算方法简介
传热过程分析主要涉及热量传递的三种方式(导热、对流 和辐射)及其相互影响,需要综合考虑物性参数、几何形 状、操作条件等因素。
常用的传热计算方法包括分析法、实验法和数值模拟法。 分析法适用于简单几何形状和边界条件的传热问题;实验 法需要建立经验或半经验公式;数值模拟法则通过计算机 模拟传热过程,具有较高的灵活性和通用性。
热力学完整ppt课件

01
02
空调制冷技术原理:利 用制冷剂在蒸发器内蒸 发吸收室内热量,再通 过压缩机将制冷剂压缩 成高温高压气体,经冷 凝器散热后变成低温低 压液体,如此循环实现 制冷。
节能措施探讨
03
04
05
采用高效压缩机和换热 器,提高制冷效率。
优化控制系统,实现精 准控温和智能节能。
采用环保制冷剂,减少 对环境的影响。
THANKS
感谢观看
05
化学热力学基础
化学反应热效应计算
反应热的概念及分类
反应热的计算方法及 实例
热化学方程式的书写 及意义
盖斯定律在化学热力学中应用
盖斯定律的内容及意义 盖斯定律在反应热计算中的应用
盖斯定律在相变热计算中的应用
化学反应方向判断依据
化学反应自发进行的方向判据
焓变与熵变对反应方向的影响
自由能变化与反应方向的关系
热力学完整ppt课件
目 录
• 热力学基本概念与定律 • 热量传递与热平衡 • 气体性质与过程分析 • 相变与相平衡原理 • 化学热力学基础 • 热力学在能源工程领域应用
01
热力学基本概念与定律
热力学系统及其分类
孤立系统
与外界既没有物质交换也没有能量交 换的系统。
开系
与外界既有能量交换又有物质交换的 系统。
04
相变与相平衡原理
相变现象及分类
相变现象
物质从一种相转变为另一种相的过程 ,如固、液、气三相之间的转变。
分类
一级相变和二级相变。一级相变涉及 热量的吸收或释放,体积发生变化; 二级相变无热量交换,体积不变。
相平衡条件与克拉珀龙方程
相平衡条件
在一定温度和压力下,各相之间达到动 态平衡,各相的性质和组成不再发生变 化。
工程热力学---第1章 基本概念

pv RgT
实际气体(real gas; imperfect gas)的状态方程
范德瓦尔方程
R—K方程
a p 2 v b v
RgT
a p 0.5 v b T v(v b)
RgT
(a,b为物性常数)
27
三、状态参数坐标图
一简单可压缩系只有两个独立参数,所以 可用平面坐标上一点确定其状态,反之任一状 态可在平面坐标上找到对应点,如:p-v、T-s。
a)刚性的或可变形的或有弹性的 b)固定的或可移动的 c)实际的或假想的
边界示意图
10
汽缸-活塞装置(闭口系例)
11
汽车发动机(开口系示例)
12
热力系分类
按照组元和相数分 单元系 多元系 按系统与外界能质交换分 单相系 复相系
闭口系—closed system 控制质量CM) —没有质量越过边界 开口系—open system (控制体积CV) —通过边界与外界有质量交换
所有状参一一对应相等
简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
状态法则:系统独立状态参数的数目N等于系统对外所 作广义功的数目n加1,即N=n+1.
20
基本状态参数
温度
热力学第零定律(R.W. Fowler in 1931) 如果两个系统分别与第三个系统处于 热平衡,则两个系统彼此必然处于热平衡。
dx 0
ห้องสมุดไป่ตู้
2、分类 #可逆循环与不可逆循环,状态参数坐标图上表示。 正向循环:输出功,热能 目的 机械能 Q 高温热源
逆向循环:消耗功,低温热源
二、正向循环(动力循环)
wnet t 1 q1
6 6 6
工程热力学PPT课件

还有一种表述是,自然发生的热传递总是向着熵增加的方向进行,即系统总是向着熵增加的方向演化。
热力学第二定律的应用
01
在能源利用领域,热力学第二定律指导我们如何更有效地利用能源,避免能源 浪费。例如,在发电厂中,利用热力学第二定律可以优化蒸汽轮机的设计和运 行,提高发电效率。
热力学第二定律的实质
热力学第二定律的实质是揭示了自然界的不可逆性,即自然界的自发过程总是向着熵增加的方向进行 。这意味着自然界的能量转化和物质转化总是向着无序和混乱的方向发展,而不是向着有序和规则的 方向发展。
热力学第二定律的实质还表明了人类对自然界的干预和改造是有限制的,我们不能违背自然规律来无 限地利用能源和资源。因此,我们需要更加珍惜和合理利用自然界的能源和资源,以实现可持续发展 和环境保护的目标。
热力学第一定律的表述
01
热力学第一定律的表述是:能量既不能凭空产生,也不能凭空 消失,它只能从一种形式转化为另一种形式,或者从一个物体
传递给另一个物体。
02
热力学第一定律也可以表述为:在封闭系统中,能量守恒。
03
热力学第一定律也可以表述为:系统总能量的变化等于系 统与环境之间传递的热量和系统对外界所做的功之和。
制冷与空调技术
制冷与空调技术
制冷和空调技术是利用热力学原理实现热量转移和控制的工程技术。
制冷剂的选择
制冷剂是制冷和空调技术中的重要物质,需要具备适当的热力学性质 和环保性能。
制冷循环的类型
制冷循环有多种类型,如压缩式、吸收式和吸附式等,每种类型都有 其特定的应用场景。
空调系统的优化
为了提高空调系统的效率和降低能耗,需要对空调系统进行优化设计, 如采用变频技术、智能控制等措施。
2024版化工热力学精ppt课件

化工热力学精ppt课件目录•化工热力学基本概念•流体的热物理性质•化工过程能量分析•相平衡与相图分析•化学反应热力学基础•化工热力学在工艺设计中的应用PART01化工热力学基本概念孤立系统与外界既没有物质交换也没有能量交换的系统。
开放系统与外界既有能量交换又有物质交换的系统。
封闭系统与外界有能量交换但没有物质交换的系统。
热力学系统及其分类热力学基本定律热力学第零定律如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统也必定处于热平衡状态。
热力学第一定律热量可以从一个物体传递到另一个物体,也可以与机械能或其他能量互相转换,但是在转换过程中,能量的总值保持不变。
热力学第二定律不可能把热从低温物体传到高温物体而不产生其他影响,或不可能从单一热源取热使之完全转换为有用的功而不产生其他影响,或不可逆热力过程中熵的微增量总是大于零。
状态方程与状态参数状态方程描述系统或它的性质和本质的一系列数学形式。
将系统的物理性质用数学形式表达出来,即建立该系统各状态参数间的函数关系。
状态参数表征体系特性的宏观性质,多数指具有能量量纲的热力学函数(如内能、焓、吉布斯自由能、亥姆霍茨自由能)。
偏微分与全微分概念偏微分在多元函数中,函数对每一个自变量求导数,就是偏导数。
全微分如果函数z = f(x, y) 在(x, y) 处的全增量Δz = f(x + Δx, y + Δy) -f(x, y) 可以表示为Δz = AΔx + BΔy + o(ρ),其中A、B 不依赖于Δx, Δy 而仅与x, y 有关,ρ = √[(Δx)2 + (Δy)2],此时称函数z = f(x, y) 在点(x, y) 处可微,AΔx + BΔy 称为函数z = f(x, y) 在点(x, y) 处的全微分。
PART02流体的热物理性质基于实验数据的经验方法利用已有的实验数据,通过拟合、插值等数学手段,得到纯物质的热物理性质随温度、压力等条件的变化规律。
《工程热力学》PPT课件

n从到0,放热→0 →吸热;等温线右内能增加,左内能减少。 例如压缩机压缩过程:K>n>1
第五节 热力学第二定律
重点掌握:
1、热力学第二定律的表述; 2、热力循环的热效率; 3、卡诺循环的热效率。
一、热力学第二定律的表述
1、热量不可能自发的、不付任何代价的由一个低温物 体传至高温物体。—热量不可能自发地从冷物体转移到
K= cp/cν:绝热指数
3、参数间的关系: 由 Pvk=常数 →P1v1k=P2v2k →P1/P2=(v2/v1)k 又 Pv=RT →P=RT/v →Tvk-1=常数 →T1/T2=(v2/v1)k-1 →T2=T1(v1/v2)k-1 =T1εk-1 4、过程量的计算: 推出: w=-u q=w+ u q=0
一、定容过程
1、定义:过程进行中系统的容积(比容)保持不变
的过程。
2、过程方程式:ν =常数 3、参数间的关系: 由 PV=RT 知,P/T=常数, 所以: P1/P2=T1/T2, P1/T1=P2/T2 4、过程量的计算: 又 q=Δ u+w, 由 W=∫PdV, 且 dV=0
→ w=0
→ q=Δ u
热力系统从一个平衡状 态到另一个平衡状态的变 化历程。
力过程。
二、膨胀功W(J)
气体在热力过程中由于体 积发生变化所做的功(又 称为容积功)
规定:热力系统对外界做功为正,外界对热
力系统做功为负。 由δ W=PdV得: dV>0,膨胀,δ W>0, 系统对外界做功; dV<0,压缩,δ W<0, 外界对系统做功; dV=0,δ W=0, 系统与外界之间无功量 传递。
四、课程的特点、要求、学时分配、考核
特点:本课程理论性较强,无多少实物供参照,课堂上的 讲授以理论分析和推导为主。
第1章 工程热力学基础

喷管出口流速计算:
根据稳定流动开口系统能量方程:
1 2 q h c gz ws 2
简化得到:
c2 2(h1 h2 ) c12
喷管出口流速c2 ,取决于喷管入口压力p1与喷管 出口环境压力pb(背压)之比; 进出口压力之比越大,喷管出口流速越高。
45
喷管是一种能量转换部件,通过截面的变化把 系统的储存能变成动能(提高流速)。
第1章 工程热力学基础
1-1 热能与机械能的转换过程 1-2 基本概念 1-3 热力学基本定律 1-4 热力过程与热力循环 1-5 热力学的工程应用
1
1-1 热能与机械能的转换过程
一、工程热力学
定义:工程热力学是研究热能与机械能的转换规律、 条件、方法,以及工程应用的一门学科。 燃料能源的利用方式: 燃料(化学能) →热能 →机械能 →电能
与热力学能相关的能量传递和转化过程,都 具有方向性,如传热、自由膨胀等。 自发过程:能够自动进行,不需要附加条件; 非自发过程:自发过程的反方向过程,需要在 一定的附加条件才能进行;
热力学第二定律研究内容: 研究能量传递和转换的方向、条件与转换限度。为非自发过程。 在制冷循环中,通过消耗机械能,实现热量从低温 热源传导高温热源。消耗机械能就是附加条件。 能量转换分析:
热力学能组成:
内动能+内位能、化学能、原子能…..(内能)
一般不涉及化学、原子反应时: U= Uk+Up
比热力学能u:单位质量工质的热力学能:
u=U/m,kJ/kg
内动能Uk:主要取决于系统温度T; 内位能Up:主要取决于系统压力p。
25
(五)焓H
概念:流体的热力学能与推动功之和,kJ;
工程热力学-第一章—基本概念

● 为什么叫做热力学第零定律
热力学第零定律 热力学第一定律 热力学第二定律 热力学第三定律
1931年
T
18401850年 E
18541855年 S
1906年
S基准
● 温度的热力学定义
★由热力学第零定律可以推断:处于同一热平衡 状态的各个热力系,必定有某一宏观特征彼此 相同,用于描述此宏观特征的物理量——温度。
T 0.5 m c2 T=0 0.5 m c2=0 分子一切运动停止,零动能。
● 热力学第零定律
◆ 热平衡:不同物体的冷热程度相同,则它们处于热平衡。 ◆ 热力学第零定律(热力学中的一个基本实验结果):
若两个热力系分别与第三个热力系处于热平衡,那么这 两个热力系也处于热平衡。
温度测量的理论基础 B 相当于温度计
压力的表示方法
◆ 绝对压力(p)、表压力(pg)、 真空度(pv)
◆ 绝对压力p、表压力pg、真空度pv、 大气压力pb的关系 pg =p- pb pv= pb-p
只有绝对压力p才是系统的状态参数。
例1:已知甲醇合成塔上压力表的读数为 150kgf/cm2,这时车间内气压计上的 读数为780mmHg。试求合成塔内绝 对压力等于多少kPa?
●状态参数的微分特性:全微分
状态参数的微分特性
设 z =z (x , y) , dz是全微分 则: dzxzy dxyzxdy
充要条件是: 2 z 2 z xy yx
可判断是否是状态参数。
2.强度参数和广度参数
● 强度参数:与物质的量无关的参数。
如 p、T、v 等
0 冰熔点
32
-17.8 盐水熔点 0
559.67 491.67 459.67
工程热力学-1第一章 基本概念

例1-2 P23 可逆过程功的计算关键:找到p和v之间的关系
三、过程热量
系统与外界之间依靠温差传递的能量称为热量。 符号:Q ;单位:J 或kJ。
单位质量工质所传递的热量用q 表示,单位为 J/kg 或 kJ/kg。
热量正负的规定: 系统吸热:q > 0 系统放热:q < 0
热量和功量都是系统与外界在相互作用的过程 中所传递的能量,都是过程量而不是状态量
热量如何表达?
热量是否可以用类似于功的
? 式子表示?
Entropy
引入“熵”
清华大学刘仙洲教授 命名为“熵”
在可逆过程中,系统与外界交换的热量与功量
的计算公式具有相的形式。
功量:
热量:
w pdv
qqTTds?
2
w 1 pdv
2
q 1 Tds
条件 准静态或可逆
可逆
s 称为比熵。比熵同比体积 v 一样是工质的状态 参数。
比熵的定义式:ds q
T
(可逆过程)
比熵的单位为J/ (kg·K) 或 kJ/ (kg·K)
对于质量为m的工质,
Q TdS
2
Q 1 TdS
S为质量为 m 的工质的熵,单位是 J/K。
示热图
2
w 1 pdv
2
q 1 Tds
在可逆过程中单位 质量工质与外界交换 的 热 量 可 以 用 T-s 图 (温熵图)上过程曲 线下的面积来表示。
消除一种 不平衡势差
达到某一 方面平衡
消除一种能量 传递方式
状态公理 对于组成一定的物质系统,该系统平衡态的
独立状态参数有 n +1
n-表示系统与外界进行准静功交换的数目
工程热力学课件第1,2章

Basic Concepts and Definition
1-1 热能和机械能相互转换过程
1-2 热力系统
1-3 工质的热力学状态及其基本状态参数 1-4 平衡状态 1-5 工质的状态变化过程
1-6 功和热量 1-7 热力循环
1
1-1 热能和机械能相互转换的过程
一、热能动力装置(Thermal power plant)
定义:从燃料燃烧中获得热能并利用热能得到动力 的整套设备。 燃气动力装置(combustion gas power plant) 内燃机(internal combustion gas engine) 燃气轮机装置(gas turbine power plant) 喷气发动机(jet power plant) …… 蒸气动力装置 (steam power plant)
定义:工质从中吸取或向之排出热能的物质系统。 • 高温热源—热源 ( heat source ) 低温热源—冷源(heat sink) • 恒温热源(constant heat reservoir) 变温热源
热动力装置工作可以概括为:
工质从高温热源吸取热能,将其中一部分转化为机械能, 把另一部分热能传给低温热源。
分 类
2
热机工作过程示意图
过热蒸汽 发电机
高温热源 吸热Q1 作功W 热机 机械能 放热Q2 低温热源
3
锅 炉
汽轮机
循环水
乏汽
冷凝器
水泵 冷却水
为使热能源源不断地转化为机械能必须:
1. 凭借工质作为媒介物质;
2. 工质源源不断地从高温热源吸收热量;
3. 工质热力学状态发生循环往复的连续变化;
4. 向温度较低的热源排出一部分热量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章
热力学基本概念
学习导引
本章介绍了许多重要的概念,对于后续内 容的学习非常重要。在学习过程中,应注意把 相关的概念串接起来,既对单个概念的物理意 义有较深刻的理解,又能从整体上将这些概念 有机的联系起来。
气缸
活塞
(2)开口热力系
1
进口
与外界有能量、
物质交换的系统。系
1
统的容积始终保持变。
(3)绝热热力系
与外界没有热 量交换的系统。
汽轮机
边界
2 出口
叶轮
2
(4)孤立热力系
与外界既无能量(功、热量)交 换又无物质交换的系统。
特殊热力系
如:热源
本身热容量很大, 且在放出或吸收有限量 热量时自身温度及其它 热力学参数没有明显变 化的物体。
提供热量的热源称 为高温热源;吸收热量 的热源称为低温热源。
高温热源
吸热Q1 作功W
热机 机械能
放热Q2
低温热源
第二节 工质的热力状态和基本状态参数
工质在进行热
量传递和能量转
锅
换的过程中, 其
炉
状态不断发生变
化.
汽机轮
凝 汽 器
一、 热力状态和状态参数
1.热力状态
——工质在某一瞬间所呈现的宏观物理状况称为工质的热力状态, 简称状态。
• 可为真实的物质、设备或假想的热力学模型 如:泵中的水、汽轮机 、卡诺热机
如:对小球进行受力分析
A
α C
O G B β
(a)
TC
O βα B
G NB
(b)
热力系
过热蒸汽
发电机
高温热源
锅 汽轮机 炉
乏汽 循环水
凝汽器
吸热Q1 作功W
热机 机械能
放热Q2
水泵
冷却水
低温热源
热力系
过热器 锅 炉
给水泵
1 at (工程大气压) = 9.80665104 Pa
1 mmH2O(毫米水柱) = 9.80665 Pa 1 mmHg (毫米汞柱) = 133.322 Pa
• 压力的测量: 测压计
压力
压力
• 三种压力
学习要求
• 理解工质、热力系的定义,掌握热力系的分类。 • 理解热力状态和状态参数的定义;掌握状态参数的特征、分
类,基本状态参数的物理意义和单位;掌握绝对压力、表压 力和真空度的关系。
• 掌握平衡状态的物理意义及实现条件。
• 了解状态方程式及参数坐标图的物理意义及作用。
• 理解热力过程、准平衡过程和可逆过程的物理意义与联系, 能正确判定准平衡过程和可逆过程。
3. 常用工质: 热机循环中: 水蒸气、空气 、燃气 、 制冷循环 、热泵循环中: 氨 、氟里昂
蒸汽动力循环示意图
过热器
锅 炉
汽机 轮
凝 汽 器
给水泵
过热蒸汽
发电机
锅 汽轮机 炉
乏汽 循环水
凝汽器
水泵
冷却水
二、 热力系、 边界与外界
1. 热力系
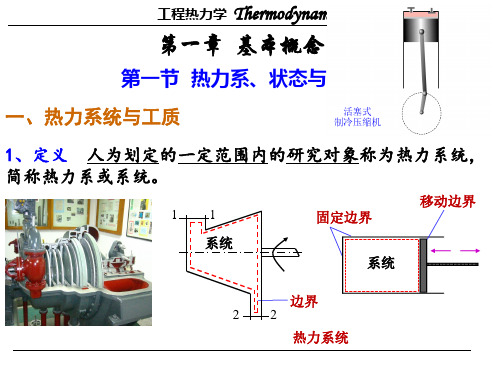
——在工程热力学中,通常选取一定的工质或空间作为 研究的对象,并将之人为划分出来,称为热力系统,简称 热力系或系统。
二、 基本状态参数
1.温度
——用来标志物体冷热程度的物理量。
• 温度是热平衡的判据 。
温度相等
热平衡
• 温度的测量: 温度计 • 温度的数值表示: 温标
温标 摄氏温标
温度及符号 摄氏温度t
热力学温标
热力学温度T
单位 ℃ K
关系 Tt+273.15 或 Tt+273
1K=1℃
摄氏温标
瑞 典 天 文 学 家 摄 尔 修 斯 ( Celsius ) 于 1742 年 建立。
汽机轮
凝 汽 器
高温热源
吸热Q1 作功W
热机 机械能
放热Q2
低温热源
2. 外界
——与热力系相互作用的周围物体。
3. 边界
——热力系与外界之间的分界面。
• 可实际存在,亦可假想;可固定不动,亦可移动或变形。
三、 热力系的分类
边界
(1)封闭热力系
与外界有能量传 递,无物质交换的系统。 系统的质量恒定不变。
第一篇 工 程 热 力 学
整体概况
概况一
点击此处输入 相关文本内容
01
概况二
点击此处输入 相关文本内容
02
概况三
点击此处输入 相关文本内容
03
2
工程热力学是从工程应用的角度研究热能与机械能 之间相互转换的规律。
工程热力学是各种动力装置、制冷装置、热泵空调机 组、锅炉及各种热交换器进行分析和计算的理论基础。
本章难点
• 本章的许多概念比较抽象,较难理解。学习中应将抽 象的概念与具体的物理量或图形联系起来。
• 在工程热力学中普遍采用抽象和简化的方法,为此, 应对研究方法的实用性和科学依据有比较深刻的理解。
第一节 工质和热力系
一、工质
1. 什么是工质 ? ——实现热能与机械能相互传递与转换的媒介物
质。
2. 工质特性:可压缩、易膨胀、易流动
在标准大气压下,纯水的冰点温度为0 ℃ ,纯 水的沸点温度为100 ℃,纯水的三相点(固、液、 汽三相平衡共存的状态点)温度为0.01℃ 。
选择水银的体积作为温度测量的物性,认为其 随温度线性变化,并将0 ~100 ℃温度下的体积差 均分成100份,每份对应1 ℃。
热力学温标
英国物理学家开尔文(Kelvin)在热力学第二 定律基础上建立,也称绝对温标。
2.状态参数
——描述工质热力状态的宏观的物理量。
状态参数特征: • 状态参数的变化量只与初、终态有关,与所经历的路径
无关。 • 经历一个循环,状态参数的变化量必为零。 • 状态参数与状态一一对应。
常用状态参数
可直接或间接测量 基本状态参数
温度(T)、压力(p)、比体积(v)
导出状态参数
热力学能(U)、焓(H)和熵(S)
基本状态参数
用热力学温标确定的温度称为热力学温度。 热力学温标取水的三相点为基准点,并定义其 温度为273.16 K。温差1K相当于水的三相点温度 的1/273.16。
热力学温标与摄氏温标的关系
温差: 1 K = 1 ℃
T = t + 273.15
或 T = t + 273
基本状态参数
2. 压力
——指单位面积上承受的垂直作用(即压强) . • 压力的实质:大量分子向容器壁面撞击的平均结果.
• 压力的符号: p
• 压力的单位: Pa (帕),1 Pa =1 N/ m2 1 MPa = 103 kPa =106 Pa
工程上常用非SI压力单位
压力
1 bar(巴) = 105 Pa 1 atm(标准大气压) = 1.01325105 Pa
