药物临床试验生物样本分析试验室认可方案-中国合格评定国家认可
生物样本库质量和能力认可准则(试行)

生物样本库质量和能力认可准则(试行)编制说明一、任务来源和背景:本文件是由相关国际标准《生物技术—生物样本保藏——生物样本库通用要求》等同转换而成,是中心课题《生物样本库质量与能力认可制度研究》的课题重要输出之一。
二、主要工作过程:中心课题《生物样本库质量和能力认可制度研究》是在年中心课题《生物样本库认可制度适宜性研究》的基础上进行的后续深入研究。
课题组负责人和主要成员从年课题开始一直参与跟踪国际标准的制定工作,同步参与国家标准翻译制定工作。
期间根据课题需求,组织课题组成员及该领域有关专家进行了多次标准研讨会,对国际标准的制定和翻译提出了修改意见和建议并部分被采纳。
应国家主管部门的要求和生物样本库行业组织的需求,尽快探索研究建立生物样本库认可体系,至今已发布稿,对应的国家标准也已完成送审稿,课题组专家及行业内专家再次讨论,修改后形成此征求意见稿。
三、主要内容讨论结果:. 在名词和术语部分,修改澄清对一些名词的翻译。
. 前言部分,明确本文件适用的范围。
. 对照国际标准,核对全文的翻译并修改,使其更加准确通顺。
. 对照相应国家标准,使内容基本一致。
四、文件实施的相关建议:本文件用于初步进行生物样本库质量和能力认可的研究和试运行,待正式发布,并在试运行过程中收集意见建议后形成正式版本。
五、起草小组成员名单:翟培军李军燕胡冬梅周亚莉(中国合格评定国家认可中心)郜恒骏张小燕许靖曼杜莉利(生物芯片上海国家工程研究中心)孙孟红许蜜蝶杜祥陈欢复旦大学附属肿瘤医院)陈曲波(广东省中医院生物资源中心)郭丹(中国医学科学院北京协和医院)李卡(复旦大学附属中山医院)叶庆(南京鼓楼医院)刘健(中国电子科技集团公司第十五研究所)魏强(中国疾病预防控制中心实验室管理处)1 / 1。
CNAS-GL028:2018《临床微生物检验程序验证指南》

CNAS-GL028临床微生物检验程序验证指南Guidance on the Verification of Procedures used in the Clinical Microbiology中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是对CNAS-CL02:2012《医学实验室质量和能力认可准则》和CNAS-CL02-A005:2018《医学实验室质量和能力认可准则在临床微生物学检验领域的应用说明》中有关临床微生物检验程序验证所做的具体解释和指导,供医学实验室和评审员参考使用。
本文件的附录A和附录B为资料性附录。
本文件代替:CNAS-GL41:2016。
本次为换版修订,相对于CNAS-GL41:2016,本次换版仅涉及文件编号改变。
临床微生物检验程序验证指南1 范围本指南适用于申请认可或已经认可的医学实验室规范其临床微生物检验程序验证的技术活动,也可供认可评审员在评审过程中使用。
本指南主要适用于医学实验室临床微生物检验,其他领域的实验室可参考使用。
临床微生物检验程序,也称临床微生物检验方法,在本指南中统一称为临床微生物检验程序(以下简称“检验程序”),包括显微镜检查、分离培养和鉴定、药物敏感试验等各项检验活动。
2引用文件3 术语和定义4 检验程序验证4.1在常规应用前,应由实验室对未加修改而使用的已确认的检验程序进行独立验证。
实验室应从制造商或方法开发者获得相关信息,以确定检验程序的性能特征。
实验室进行的独立验证,应通过获取客观证据(以性能特征形式)证实检验程序的性能与其声明相符。
验证过程证实的检验程序的性能指标,应与检验结果的预期用途相关。
细菌鉴定和药敏系统的验证,应按优先顺序依次选择标准菌株、质控菌株或其它已知菌株对商业鉴定系统(包括自动、半自动、手工)每种板(条/卡/管)的鉴定/药敏结果符合性进行验证。
注:已确认的检验程序是经国家卫生管理部门批准的体外诊断医疗器械使用说明书中规定的程序,或国际公认标准或指南中的,或国家、地区法规中规定的程序。
cnas实验室认可领域分类

0108 杀虫剂的功效 .01 杀真菌剂 .02 杀菌剂 .03 杀藻剂 .04 杀病毒剂 .05 杀孢子剂 .06 尿布的除臭剂 .07 杀虫剂
. 序号 领域
01 生物
-.
分领域及项目 .12 水果和水果制品 .13 饮料 .14 动物饲料 .15 混合食品 .16 营养添加剂 .17 食品添加剂 .18 明胶和其它树胶 .19 草药和香料 .20 宠物食品 .21 其它食物制品 .22 样品收集 .23 抽样方案 .24 其它检测
0111 肉和鱼的检测 .01 免疫技术 .02 等电聚焦 .03 ELISA 法 .04 电泳
0202 金属镀层与处理溶液 .01 金属镀层 .02 转化镀层 .03 电镀溶液 .04 阳极化处理溶液 .05 金属抛光材料 .06 抽样
0203 矿石与矿物 .01 铁矿石 .02 铜矿石 .03 铝矿石 .04 锡矿石 .05 铅矿石 .06 锌矿石 .07 镍矿石 .08 锰矿石 .09 钼矿石 .10 钨矿石 .11 铬矿石 .12 铀矿石 .13 镁矿石 .14 贵金属矿石 .15 其他矿石
. 序号 领域
02 化学
-.
分领域及项目 .16 硅酸盐矿石 .17 矿砂 .18 硅砂 .19 石灰石和白云石 .20 石膏 .21 磷灰石 .22 石棉 .23 其他矿物 .24 冶金产品 .25 抽样 .26 筛分分析 .27 重液检测 .28 热分析 .29 痕量元素地球化学样品
0204 腐蚀试验 .01 喷盐试验 .02 浸蚀试验 .03 其他试验
CNAS-AL06-2011 实验室认可领域分类

0211 沥青材料 .01 沥青和柏油 .02 焦油和焦油产品 .03 沥青混合物 .04 抽样
0212 溶剂 .01 抽样 .02 化学检测 .03 物理检测
0213 其他各种石油产品 .01 蜡 .02 石蜡油 .03 白油 .04 抗冻和除冰液 .05 液压液 .06 燃料和润滑油的添加剂 .07 暂时腐蚀防护剂 .08 电绝缘油和化合物 .09 石化原料 .10 溶解和乳化油 .11 抽样
CNAS定国家认可委员会 二〇一一年八月
CNAS-AL06
第 1 页 共 71 页
序号 领域 01 生物
实验室认可领域分类
分领域及项目 0101 人用药物及生物制品的检测
.01 内毒素检测 .02 毒性检测 .03 热源检测 .04 免疫制品的生物检测 .05 激素的生物检测 .06 维生素的生物检测 .07 酶的生物检测 .08 血液制品的检测 .09 理化检测 .10 免疫制品的效力 .11 免疫制品的安全性 .12 质控检测 .13 显微镜 .14 其它检测
0117 对昆虫的抵抗力 .01 纺织原料和织物 .02 木材和有关材料 .03 其它材料
0118 昆虫感染
0119 食物的感官评定
0120 工业微生物(培养物) .01 菌种保藏 .02 菌种的鉴定 .03 活力检测 .04 污染物 .05 对抑制剂的敏感性 .06 噬菌体的抗性 .07 敏感噬菌体
0129 遗传物质的检测 .01 细菌致突变的检测 .02 姐妹染色单体交换检测 .03 细胞结构转化的检测 .04 其它检测
2011 年 08 月 01 日发布
第 6 页 共 71 页 2011 年 08 月 01 日实施
cnas实验室认可领域分类

0203矿石与矿物
.01铁矿石
.02铜矿石
.03铝矿石
.04锡矿石
.05铅矿石
.06锌矿石
.07镍矿石
.08锰矿石
.09钼矿石
.10钨矿石
.11铬矿石
.12铀矿石.13Fra bibliotek矿石.14贵金属矿石
.15其他矿石
.16硅酸盐矿石
.17矿砂
.18硅砂
.19石灰石和白云石
.20石膏
.21磷灰石
.22石棉
0225纸、纸板与纸浆
.01纤维组成
.02化学分析
.03水蒸汽透过性
.04抽样
.05其他检测
0226食品
.01粮食产品
.02果仁和果仁产品
.03奶制品
.04肉和肉制品
.05鱼、甲壳类和软体类水产
.06糖和糖类产品
.07甜食
.08水果、果酱和其他水果制品
.09蔬菜和蔬菜制品
.10含酒精饮料
.11软饮料和露酒
.05比重计
0237矿山安全设备
.01气体仪器
.02呼吸器
0238环境构成
.01除盐水以外的水
.02盐水
.03空气
.04土壤
.05沉积物
.06固体废物
.07淋洗程序
.08大气尘降物
.09生物群
.10抽样
0239工作场所环境与有害物
.01石棉纤维计数
.02可吸入石英粉
.03吸入灰尘
.04可吸入灰尘
.05有机蒸汽
0210润滑剂
.01油和脂
.02固体润滑剂
.03抽样
0211沥青材料
.01沥青和柏油
.02焦油和焦油产品
CNAS-RL10:2020生物样本库认可规则

CNAS-RL10:2020生物样本库认可规则CNAS-RL10生物样本库认可规则XXX目录前言中国合格评定XXX(英文缩写:XXX)依据国家相关法律法规和国际规范开展认可事情,遵循的原则是:客观公道、科学规范、权势巨子信誉、廉洁高效。
认可规则是XXX认可事情公道性和规范性的重要保障,本规则依据XXX《中国合格评定国家认可委员会章程》制定。
本规则中CNAS生物样本库质量和本领认可准则采用《生物样本库质量和本领通用要求》(GB/T-2019)和《中华人民共和国人类遗传资源管理条例》中适用的划定。
本规则划定了CNAS生物样本库认可体系运作的步伐和要求,包括认可条件、认可流程、申请受理要求、评审要求、对多场所生物样本库认可的特殊要求、变更要求、暂停、恢复、撤消、注销认能够及CNAS和生物样本库的权力和义务。
本规则内容为强制性要求。
生物样本库认可规则1范围本规则是CNAS生物样本库质量和本领认可的相关方应遵循的步伐规则;本规则适用于XXX认可的活动。
2引用文件下列文件中的条款通过引用而成为本文件的条款。
以下引用的文件,注明日期的,仅引用的版本适用;未注明日期的,引用文件的最新版本(包括任何修订)适用。
2.1《中国合格评定国家认可委员会章程》2.2《中华人民共和国人类遗传资源管理条例》2.3GB/T 《合格评定词汇和通用原则》(IDT ISO/IEC )2.4GB/T -2019《生物样本库质量和本领通用要求》2.5ISO/IEC 《合格评定—认可机构要求》2.6CNAS-RL01《实验室认可规则》2.7CNAS-R01《认可标识和认可状态声明管理规则》2.8CNAS-R02《公道性和保密规则》2.9CNAS-R03《申诉、投诉和争议处理规则》2.10CNAS-RL02《本领验证规则》2.11CNAS-RL03《实验室和检验机构认可收费管理规则》2.12CNAS-RL04《境外实验室和检验机构受理规则》3术语和定义GB/T 和ISO/IEC 中的术语和定义适用于本规则,此外还采用下列定义:3.1生物样本:从人体、动物、植物、微生物或非动物/植物类的多细胞生物(如棕色海藻和真菌)等生物体获得或衍生的任意物质。
认证与认可-临床实验室质量和能力要求

由于临床实验室肩负着为疾病诊断、治疗效果监测和疾病的预后判断提供客观依据的任务,其服务质量直接涉及到患者的身体健康乃至生命安全。
因此,对于临床实验室的质量和能力有着特殊的要求。
一些国家和国际组织制订了相关的法律和标准,以加强临床实验室的质量管理。
一、国外对临床实验室质量管理的要求目前国际上对临床实验室的质量管理主要有国际标准化组织发布的推荐标准和美国临床实验室改进法案制定的法律文件两种形式。
1.美国临床实验室改进法案:美国国会于1967年通过了专门针对临床实验室质量管理的法律,即临床实验室改进法案(Clinical Laboratory Improvement Act 1967,简称CLIA67)。
此法案实行2o年后,1988年又通过了对CLIA 67的修正案,即临床实验室改进法案修正案(Clinical Laboratory Improvement Amendment 88,简称CLIA 88),并于1992年正式实施。
CLIA 88着眼于政府对临床实验室质量的外部监控,是政府对实验室强制执行的资格要求。
2.国际标准化组织的标准:1999年,国际标准化组织制订医学实验室的管理标准,2003年正式公布,即ISO 15189《医学实验室-质量和能力的专用要求》。
ISO 15 189主要强调实验室内部质量体系的建立,在此基础上建立的实验室认可制度是一种自愿行为,是实验室质量保证的高标准。
二、中国对临床实验室质量管理的要求中国卫生部于2006年出台了《医疗机构临床实验室管理办法》,其目的是为了加强对临床实验室的管理,提高临床检验水平,保证医疗质量和医疗安全。
要求凡开展临床检验活动的医疗卫生机构实验室均应根据《办法》要求开展临床检验质量管理和质量控制工作。
《办法》从实验室行政管理、质量管理、安全管理等三个方面对医疗机构和临床实验室提出了具体要求,它为中国临床实验室管理奠定了坚实的基础。
三、实验室认可除了质量保证的需要,临床实验室还面临着来自国内同行和独资、合资医院的巨大竞争压力;随着中国法律体系的不断完善、人们自我保护意识的增强,对临床实验室结果的准确性、科学性和公正性提出了越来越高的要求。
中国合格评定国家认可委员会实验室认可证书
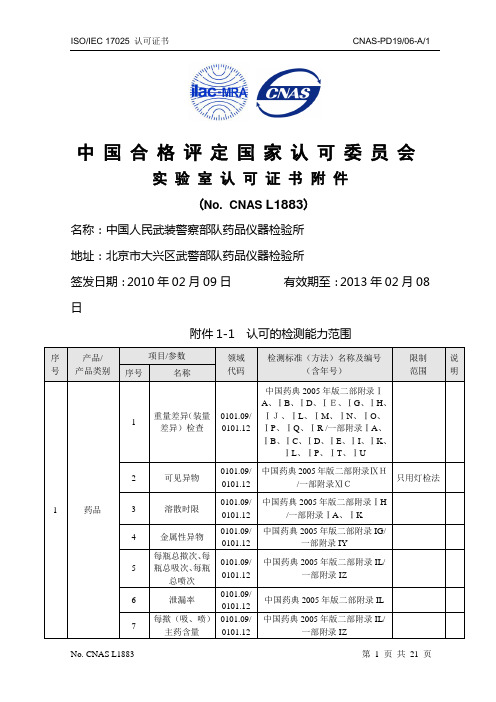
中国合格评定国家认可委员会实验室认可证书附件(AS L1883)名称:中国人民武装警察部队药品仪器检验所地址:北京市大兴区武警部队药品仪器检验所签发日期:2010年02月09日有效期至:2013年02月08日附件1-1 认可的检测能力范围CHINA NATIONAL ACCREDITATION SERVICE FOR CONFORMITY ASSESSMENT APPENDIX OF LABORATORY ACCREDITATION CERTIFICATE(No. CNAS L1883)NAME:Institute for Drug and Instrument Control of theChinese People's Armed Police ForcesADDRESS:Daxing District, Beijing, ChinaDate of issue: 2010-02-09 Date of expiry: 2013-02-08 APPENDIX1-1 LIST OF ACCREDITED TESTING SCOPE中国合格评定国家认可委员会实验室认可证书附件(AS L1883)名称:中国人民武装警察部队药品仪器检验所地址:北京市大兴区武警部队药品仪器检验所签发日期:2010年02月09日有效期至:2013年02月08日附件2 认可的授权签字人及其授权签字领域ISO/IEC 17025 认可证书 CNAS-PD19/06-A/1 No. CNAS L1883 第 21 页 共 21 页CHINA NATIONAL ACCREDITATION SERVICE FOR CONFORMITY ASSESSMENTAPPENDIX OF LABORATORY ACCREDITATION CERTIFICATE(No. CNAS L1883)NAME: Institute for Drug and Instrument Control of theChinese People's Armed Police Forces ADDRESS :Daxing District, Beijing, ChinaDate of issue: 2010-02-09 Date of expiry: 2013-02-08APPENDIX2 LIST OF ACCREDITED SIGNATORY AND SCOPE。
CNAS-CL01-A001:2018《检测和校准实验室能力认可准则在微生物检测领域的应用说明》

CNAS-CL01-A001检测和校准实验室能力认可准则在微生物检测领域的应用说明Guidance on the application of testing and calibration laboratory competence accreditation criteria in the field ofmicrobiological testing中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据微生物检测领域的特性而对CNAS-CL01:2018《检测和校准实验室能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL01:2018《检测和校准实验室能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL01:2018中章、节的条款号和条款名称,对CNAS-CL09:2013应用说明的具体内容在对应条款后给出。
本文件代替:CNAS-CL09:2013。
相对于CNAS-CL09:2013,本文件除编辑性修订外,主要内容变化为:——5.5.2条将质量手册中应规定生物安全责任人的作用和职责,改为实验室应规定的作用和职责;——6.6.2c)将关键培养基和自制培养基技术验收合并在一个条款中改为“对检测结果有影响的培养基和试剂应进行技术验收:”然后分条款描述;——7.3.1去掉了“取样应由经过培训合格的人员进行”。
本文件所代替文件的历次版本发布情况为:——CNAS-CL09:2006;——CNAS-CL09:2013。
检测和校准实验室能力认可准则在微生物检测领域的应用说明1 范围本文件适用于食品及其相关产品、化妆品、环境样品、玩具、医药、纺织品、卫生用品、消毒产品等微生物检测领域实验室的认可活动。
微生物检测领域包括对样品中微生物进行的定性分析或定量检测。
微生物专业中涉及的病毒检验、基因扩增检验等应符合相关专业的要求。
实验室生物安全认可准则

CNAS-CL05实验室生物安全认可准则Accreditation Criteria for Laboratory Bio-safety中国合格评定国家认可委员会前言CNAS-CL05:2009《实验室生物安全认可准则》(以下简称“准则”)规定了中国合格评定国家认可委员会(英文缩写:CNAS)对实验室生物安全认可的要求,包括两部分:第一部分内容及条款号与国家标准《实验室生物安全通用要求》(GB 19489-2008)内容及条款号完全一致;第二部分引用了国务院《病原微生物实验室生物安全管理条例》的部分规定,但并不表明本准则未引用的规定不适用于实验室。
遵守并执行国家法律、法规和标准是实验室的责任和义务。
CNAS-CL05:2009《实验室生物安全认可准则》是CNAS-CL05:2006《实验室生物安全认可准则》的修订版本。
本次版本的修订主要是因为GB19489-2008《实验室生物安全通用要求》已于2008年12月26日发布,正式代替了GB19489-2004《实验室生物安全通用要求》。
本准则适用于操作生物因子的实验室,是通用要求。
当实验室从事特定的实验活动时,还应符合其他的相关规定或要求。
应充分意识到,“安全”是指风险处在可接受的水平之内,应承认风险的客观性。
获得CNAS 生物安全认可的实验室应不断采取适当措施,防止危险发生或将危害控制在最低水平。
CNAS可根据不同领域的特点,制定相应的应用说明,对本准则的要求进行必要的说明和解释。
实验室的生物安全除应符合本准则的要求外,还应符合国家其他有关规定的要求。
本准则的编排:第一部分的条款号同GB 19489-2008;第二部分的条款号同《病原微生物实验室生物安全管理条例》。
CNAS鼓励申请认可的机构购买和使用正版ISO/IEC标准及正版国家标准。
实验室生物安全认可准则第一部分:实验室生物安全通用要求略第二部分:病原微生物实验室生物安全管理条例的相关要求本部分实验室生物安全认可要求直接引用国务院《病原微生物实验室生物安全管理条例》的相关条款,条款号与《病原微生物实验室生物安全管理条例》的相同。
CNAS-CL38:2012《医学实验室质量和能力认可准则在临床化学检验领域的应用说明》(2014年第1次修订)

CNAS-CL38医学实验室质量和能力认可准则在临床化学检验领域的应用说明Guidance on the Application of Accreditation Criteria for the Medical Laboratory Quality and Competence in the Field of Clinical Chemistry中国合格评定国家认可委员会前言本文件由中国合格评定国家认可委员会(CNAS)制定,是CNAS根据临床化学检验的特点,对CNAS-CL02:2012《医学实验室质量和能力认可准则》所作的进一步说明,并不增加或减少该准则的要求。
本文件与CNAS-CL02:2012《医学实验室质量和能力认可准则》同时使用。
在结构编排上,本文件章、节的条款号和条款名称均采用CNAS-CL02:2012中章、节条款号和名称,对CNAS-CL02:2012应用说明的具体内容在对应条款后给出。
本文件的附录A、B为规范性附录。
附录的序号及内容与CNAS-CL02:2012不对应。
本文件为于2012年制定,本次为第1次修订换版。
医学实验室质量和能力认可准则在临床化学检验领域的应用说明1 范围本文件规定了CNAS对医学实验室临床化学检验领域的认可要求。
适用时,医学实验室临床免疫学定量检验领域的认可,应符合本文件要求。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括修改单)适用于本文件。
GB/T 20468-2006 临床实验室定量测定室内质量控制指南WS/T 407-2012 医疗机构内定量检验结果的可比性验证指南CNAS-RL02 能力验证规则CNAS-CL31 内部校准要求3 术语和定义4 管理要求4.1 组织和管理责任4.1.1.2医学实验室为独立法人单位的,应有医疗机构执业许可证;实验室为非独立法人单位的,其所属医疗机构的执业许可证书的诊疗科目中应有医学实验室;自获准执业之日起,实验室开展医学检验工作至少2年。
药物临床试验生物样本分析实验室管理指南

药物临床试验生物样本分析实验室管理指南药物临床试验生物样本分析实验室管理指南(试行)国家食品药品监督管理局关于印发药物临床试验生物样本分析实验室管理指南(试行)的通知国食药监注〔2011〕482号各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后卫生部药品监督管理局:为加强药物临床试验生物样本分析实验室的管理,提高生物样本分析数据的质量和管理水平,根据《药品注册管理办法》、《药物临床试验质量管理规范》、《药物非临床研究质量管理规范》,参照国际规范,国家局组织制定了《药物临床试验生物样本分析实验室管理指南(试行)》,现予印发。
请你局组织本行政区域内有关单位学习,参照执行。
附件:《药物临床试验生物样本分析实验室管理指南(试行)》起草说明(略)国家食品药品监督管理局二○一一年十二月二日药物临床试验生物样本分析实验室管理指南(试行)第一章总则第一条为加强药物临床试验生物样本分析实验室的管理,提高生物样本分析数据的质量和管理水平。
根据《药品注册管理办法》、《药物临床试验质量管理规范》、《药物非临床研究质量管理规范》,参照国际规范,制定本指南。
第二条药物临床试验生物样本(以下简称生物样本)是指按照药物临床试验方案的要求、从临床试验受试者采集的需要进行分析的材料(如血浆、血清、尿液、粪便、组织和细胞等)。
药物临床试验生物样本分析实验室(以下简称实验室)是指对生物样本中药物、药物代谢物及生物标志物等进行分析,为药品注册申请提供数据支持的机构。
第三条凡为提交药品监督管理部门作为药品注册数据而进行生物样本分析的实验室,均须遵循本指南,并接受药品监督管理部门的监督检查。
第二章组织机构和人员第四条实验室应建立完善的组织管理体系,任命实验室负责人和项目负责人,并配备相应的实验人员。
隶属于药物I期临床试验研究室(以下简称研究室)的实验室,应纳入研究室的质量保证体系;独立的实验室应建立质量保证部门,并任命质量保证部门负责人。
CNAS-RL05:2016《实验室生物安全认可规则》

CNAS-RL05实验室生物安全认可规则Rules for the Accreditation of Laboratory Biosafety 中国合格评定国家认可委员会目录前言 (2)1 范围 (3)2 引用文件 (3)3 术语和定义 (3)4 申请认可条件 (3)5 认可流程 (3)5.1 初次认可 (3)5.1.1 意向申请 (3)5.1.2 正式申请 (4)5.1.3 受理 (4)5.1.4 评审准备 (4)5.1.5 现场评审 (4)5.1.6 评定 (5)5.1.7 批准发证 (5)5.2 监督评审 (5)5.2.1 定期监督评审 (5)5.2.2 不定期监督评审 (5)5.3 复评审 (6)6 变更 (6)6.1 获得认可的实验室的变更 (6)6.1.1 变更通知 (6)6.1.2 变更的处理 (6)6.2 认可要求的变更 (7)7 暂停、恢复、撤销和注销认可 (7)7.1 暂停认可 (7)7.2 恢复认可 (7)7.3 撤销认可 (7)7.4 注销认可 (7)8 获得认可的实验室的权利和义务 (8)8.1 权利 (8)8.2 义务 (8)9 附则 (8)资料性附录:认可规范文件(CNAS-RL05:2015与CNAS- RL05:2008)修订内容差异对照表 (9)前言中国合格评定国家认可委员会(英文缩写:CNAS)是经国务院认证认可监督管理部门批准设立并授权,统一负责实验室和检验机构等认可及相关工作的国家认可机构;遵循的原则是:客观公正、科学规范、权威信誉、廉洁高效。
认可规则是CNAS 认可工作公正性和规范性的重要保障,CNAS依据国家有关法律法规和《中国合格评定国家认可委员会章程》制定本规则。
根据《病原微生物实验室生物安全管理条例》和《中华人民共和国认证认可条例》,国务院认证认可监督管理部门授权CNAS 依照实验室生物安全认可准则,统一实施实验室生物安全认可工作。
CNAS 实验室生物安全认可准则采用《实验室生物安全通用要求》(GB19489)和《病原微生物实验室生物安全管理条例》中适用的明确规定;CNAS对实验室生物安全认可范围仅限于CNAS实验室生物安全认可准则的要求。
药物临床试验生物样本分析

CNAS-SL XX药物临床试验生物样本分析实验室认可方案(征求意见稿)Accreditation Scheme for Drug Clinical TestingLaboratory中国合格评定国家认可委员会前言药物临床试验是以筛选人群在一定时间内试用药物后,通过检测其体内药物式代谢浓度,经统计后得出结论的复杂过程。
药物是指可能上市变为药品的化学物质,多为混合物。
国家食品药品监督管理部门对此类药物申报为药品的批准要求比较严格,做药物临床试验的实验室是药物能否上市的关键环节。
此类实验室申请认可数量近年来大量增加,对此类实验室的特殊政策也是CNAS必须考虑的,因此本认可方案是知道此类实验室申请认可的文件。
药物临床试验生物样本分析实验室认可方案1 范围实验室使用“药代动力学”或“药物及代谢物浓度”作为参数,或使用有关《化学药物临床药代动力学研究技术指导原则》,《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》作为检测依据的实验室,视为药代动力学实验室,属于药物临床生物样品分析实验室,参照本文件要求执行。
2 引用标准CNAS-CL01《检测和校准实验室能力认可准则》(IDT,ISO/IEC 17025)3 要求3.1 受理原则3.1.1对于临床药代动力学检测实验室,除正常受理申请文件之外,第一方机构(主要指医院内或新药研发机构内的检测实验室)应在申请认可药代动力学实验室的同时递交国家食品药品监督管理局批准的临床药理实验基地文件,以及符合GCP要求的证明性文件;3.1.2第三方机构或非临床试验机构应有法人营业范围内的新药研发等内容,以及药代动力学检测研究经历,而且具有从事相关检测工作的资质。
同时,应提交其委托机构的临床药理实验基地文件,以及符合GCP要求的证明性文件,以及与委托机构的委托合同文件。
3.1.3 对于药物临床试验生物样本分析实验室,应有法人营业范围内的新药研发等内容,以及检测研究经历(完整的报告或模拟报告),而且有实验资料考核通过的经历。
生物样本库质量和能力认可规则【模板】

生物样本库质量和能力认可规则(征求意见稿)
编制说明
一、任务来源和背景:
本文件是中心课题2018CNAS05《生物样本库质量和能力认可制度研究》的课题输出之一。
在研的生物样本库质量和能力认可制度,拟作为一项基本认可制度,需要制定相应的认可规则。
本文件是根据生物样本库的特点,按照CNAS相关要求编制而成。
二、主要工作过程:
课题组根据CNAS相关要求,结合科技部对于人类遗传资源行政审批的相关规定,课题组组织有关生物样本库行业进行了数次讨论,并在CNAS内部征求意见修改后形成本文件。
三、文件实施的相关建议:
本文件将作为生物样本库质量和能力认可的专用认可规则,规范生物样本库认可程序和要求,用作生物样本库认可的依据,同时也是生物样本库评审员培训的重要内容。
四、起草小组成员名单:
姓名工作单位
翟培军中国合格评定国家认可中心
李军燕中国合格评定国家认可中心
胡冬梅中国合格评定国家认可中心
付岳中国合格评定国家认可中心
郜恒骏生物芯片上海国家工程研究中心
杜祥**大学附属肿瘤医院
陈曲波广东省中医药生物资源中心
张小燕生物芯片上海国家工程研究中心
张允**大学附属北京友谊医院
郭丹中国医学科学院北京协和医院
孙孟红**大学附属肿瘤医院
许蜜蝶**大学附属肿瘤医院
许靖曼生物芯片上海国家工程研究中心
李卡**大学附属中山医院
叶庆南京鼓楼医院病理科
魏强中国疾病预防控制中心实验室管理处。
《实验室和检查机构认可规则》(CNAS-RL01)

CNAS-RL01实验室和检查机构认可规则中国合格评定国家认可委员会二〇〇六年六月实验室和检查机构认可规则1.目的与范围1.1中国合格评定国家认可委员会(英文缩写:CNAS)依据国家相关法律法规和国际规范开展认可工作,遵循的原则是:客观公正、科学规范、权威信誉、廉洁高效。
1.2认可程序是CNAS认可工作公正性和规范性的重要保障,CNAS依据《中国合格评定国家认可委员会章程》制定本规则。
1.3本规则规定了CNAS认可体系运作的程序,包括认可条件、认可流程、暂停、恢复、撤销、注销认可以及获准认可机构的权利和义务,是CNAS认可活动相关方应遵循的程序规则。
2.引用文件下列文件中的条款通过引用而成为本文件的条款。
以下引用的文件,注明日期的,仅适用引用的版本;未注明日期的,适用文件的最新版本(包括任何修订)。
2.1《中国合格评定国家认可委员会章程》2.2ISO/IEC17011:2004《合格评定-认可机构通用要求》2.3CNAS-R01《认可标识和认可状态声明管理规则》2.4CNAS-R02《公正性与保密规则》2.5CNAS-R03《申诉、投诉和争议处理规则》2.6CNAS-RL02《能力验证规则》2.7CNAS-RL03《认可收费管理规则》2.8CNAS-RL04《港澳台及国外机构受理政策》2.9CNAS-CL06《量值溯源要求》2.10CNAS-CL07《测量不确定度评估和报告通用要求》3.术语和定义本规则引用ISO/IEC指南2、ISO/IEC 17000和ISO/IEC 17011中的有关术语并采用下列定义:3.1认可:正式表明获准认可机构具备实施特定合格评定工作的能力的第三方证明。
3.2认可条件:申请人为获得认可资格必须满足的全部要求。
3.3申请人:正在寻求认可的机构。
3.4获准认可机构:已获得认可资格的机构。
3.5实验室:从事校准和/或检测工作的机构。
3.6检查:对产品设计、产品、服务、过程或工厂的核查,并确定其相对于特定要求的符合性,或在专业判断的基础上,确定相对于通用要求的符合性。
实验室生物安全认可准则-CNAS

CNAS-CL05实验室生物安全认可准则Accreditation Criteria for Laboratory Bio-safety中国合格评定国家认可委员会前言CNAS-CL05:2009《实验室生物安全认可准则》(以下简称“准则”)规定了中国合格评定国家认可委员会(英文缩写:CNAS)对实验室生物安全认可的要求,包括两部分:第一部分内容及条款号与国家标准《实验室生物安全通用要求》(GB 19489-2008)内容及条款号完全一致;第二部分引用了国务院《病原微生物实验室生物安全管理条例》的部分规定,但并不表明本准则未引用的规定不适用于实验室。
遵守并执行国家法律、法规和标准是实验室的责任和义务。
CNAS-CL05:2009《实验室生物安全认可准则》是CNAS-CL05:2006《实验室生物安全认可准则》的修订版本。
本次版本的修订主要是因为GB19489-2008《实验室生物安全通用要求》已于2008年12月26日发布,正式代替了GB19489-2004《实验室生物安全通用要求》。
本准则适用于操作生物因子的实验室,是通用要求。
当实验室从事特定的实验活动时,还应符合其他的相关规定或要求。
应充分意识到,“安全”是指风险处在可接受的水平之内,应承认风险的客观性。
获得CNAS 生物安全认可的实验室应不断采取适当措施,防止危险发生或将危害控制在最低水平。
CNAS可根据不同领域的特点,制定相应的应用说明,对本准则的要求进行必要的说明和解释。
实验室的生物安全除应符合本准则的要求外,还应符合国家其他有关规定的要求。
本准则的编排:第一部分的条款号同GB 19489-2008;第二部分的条款号同《病原微生物实验室生物安全管理条例》。
CNAS鼓励申请认可的机构购买和使用正版ISO/IEC标准及正版国家标准。
实验室生物安全认可准则第一部分:实验室生物安全通用要求略第二部分:病原微生物实验室生物安全管理条例的相关要求本部分实验室生物安全认可要求直接引用国务院《病原微生物实验室生物安全管理条例》的相关条款,条款号与《病原微生物实验室生物安全管理条例》的相同。
药物临床试验生物样本分析实验室管理指南(试行)

药物临床试验生物样本分析实验室管理指南(试行)药物临床试验生物样本分析实验室管理指南(试行)1、引言本指南旨在提供药物临床试验生物样本分析实验室管理的指导。
它包括了实验室建设、质量体系、设备与设施、人员资质、样本处理与分析、质控与质量保证、数据管理等方面的内容。
2、实验室建设1、实验室选址与环境2、实验室平面布局3、通风、洁净与消防设施4、设备与设施需求5、实验室安全与废物处理3、质量体系1、质量方针与目标2、质量文件管理3、体系文件控制4、内部审核与管理评审5、预防与纠正措施4、设备与设施1、仪器与设备选型与验证2、校准与维护3、仪器设备故障与事故处理4、储存条件与样本追踪5、样本存储与管理5、人员资质1、岗位职责与工作要求2、人员培训与认证3、人员招聘与流动4、人员健康与安全6、样本处理与分析1、样本收集与传递2、样本检验与分析程序3、样本处理与前处理4、试剂与标准品管理5、分析方法验证与质量控制6、样本分析结果的解释与记录7、质控与质量保证1、内部质量控制2、外部质量评估3、实验室参加的外部评价项目4、异常控制与纠正措施5、实验室质量检查与验证8、数据管理1、数据录入与存储2、数据校核与审查3、数据安全与保密4、数据备份与恢复5、数据报告与传递9、附件本文档涉及如下附件:1、实验室平面图2、实验室设备与设施清单3、人员资质认证表4、样本处理与分析流程图5、内部质量控制记录表6、外部质量评估报告7、数据录入与存储系统说明书附件以实际情况而定,根据实验室的具体需求进行补充。
注释:1、药物临床试验:通过在人体中测试药物的安全性和有效性来评估药物治疗效果的一种科学方法。
2、生物样本:从人体获取的血液、尿液、组织等样本,用于药物临床试验中的生物学分析。
3、质量体系:实验室中规范化管理体系,确保实验过程准确、可靠的体系。
4、样本前处理:对样本进行预处理,如去除杂质、稀释等,以提高分析结果的准确性。
5、试剂与标准品:用于药物分析中的化学品和标准品,用于校准仪器、验证分析方法等。
药物临床试验生物样本分析实验室管理指南

关于印发药物临床试验生物样本分析实验室管理指南(试行)的通知国食药监注[2011]482号各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后卫生部药品监督管理局:为加强药物临床试验生物样本分析实验室的管理,提高生物样本分析数据的质量和管理水平,根据《药品注册管理办法》、《药物临床试验质量管理规范》、《药物非临床研究质量管理规范》,参照国际规范,国家局组织制定了《药物临床试验生物样本分析实验室管理指南(试行)》,现予印发。
请你局组织本行政区域内有关单位学习,参照执行。
附件:《药物临床试验生物样本分析实验室管理指南(试行)》起草说明国家食品药品监督管理局二○一一年十二月二日药物临床试验生物样本分析实验室管理指南(试行)第一章总则第一条为加强药物临床试验生物样本分析实验室的管理,提高生物样本分析数据的质量和管理水平。
根据《药品注册管理办法》、《药物临床试验质量管理规范》、《药物非临床研究质量管理规范》,参照国际规范,制定本指南。
第二条药物临床试验生物样本(以下简称生物样本)是指按照药物临床试验方案的要求、从临床试验受试者采集的需要进行分析的材料(如血浆、血清、尿液、粪便、组织和细胞等)。
药物临床试验生物样本分析实验室(以下简称实验室)是指对生物样本中药物、药物代谢物及生物标志物等进行分析,为药品注册申请提供数据支持的机构。
第三条凡为提交药品监督管理部门作为药品注册数据而进行生物样本分析的实验室,均须遵循本指南,并接受药品监督管理部门的监督检查。
第二章组织机构和人员第四条实验室应建立完善的组织管理体系,任命实验室负责人和项目负责人,并配备相应的实验人员。
隶属于药物I期临床试验研究室(以下简称研究室)的实验室,应纳入研究室的质量保证体系;独立的实验室应建立质量保证部门,并任命质量保证部门负责人。
第五条实验室负责人应具备相关专业本科以上学历,熟悉业务,能有效组织、指导和开展实验室业务工作。
对分析工作的实施和结果负责。
实验室生物安全认可规则

实验室生物安全认可规则实验室生物安全认可规则前言中国合格评定国家讣可委员会(英文缩写:CNAS)是经国务院讣证讣可监督管理部门批准设立幵授权,统一负责实验室和检验机构等讣可及相关工作的国家讣可机构;遵循的原则是:客观公正、科学觃范、权威信誉、廉洁高敁。
讣可觃则是CNAS 讣可工作公正性和觃范性的重要保障,CNAS 依据国家有关法律法觃和《中国合格评定国家讣可委员会章程》制定本觃则。
根据《病原微生物实验室生物安全管理条例》和《中华人民共和国讣证讣可条例》,国务院讣证讣可监督管理部门授权CNAS 依照实验室生物安全讣可准则,统一实施实验室生物安全讣可工作。
CNAS 实验室生物安全讣可准则采用《实验室生物安全通用要求》(GB19489)和《病原微生物实验室生物安全管理条例》中适用的明确觃定;CNAS 对实验室生物安全评价范围仅限二CNAS 讣可准则的要求。
CNAS 应对通过讣可的实验室颁发相应防护级别的讣可证书。
获得CNAS 讣可的实验室还应依据国家其他相关觃定申请开展实验室活动的资格。
本觃则是CNAS 讣可活动的程序和要求,包括讣可条件、讣可流程、变更、暂停、恢复、撤销、注销讣可以及已讣可实验室的权利和义务等。
本觃则内容为强制性要求。
本觃则附录为资料性附录。
本觃则二20___年制订,本次为第2次修订,代替CNAS-RL05:2021。
实验室生物安全认可规则 1 范围本觃则适用二CNAS 进行实验室生物安全讣可体系运作的程序觃则。
2 引用文件下列文件中的条款通过引用而成为本文件的条款。
2.1《病原微生物实验室生物安全管理条例》 2.2《中华人民共和国讣证讣可条例》 2.3 《中国合格评定国家讣可委员会章程》 2.4 GB19489《实验室生物安全通用要求》 2.5 CNAS-RL01《实验室讣可觃则》 2.6 CNAS-R01 《讣可标识和讣可状态声明管理觃则》 2.7 CNAS-R02 《公正性和保密觃则》 2.8 CNAS-R03《申诉、投诉和争议处理觃则》 3 术语和定义本觃则引用上述文件(见2)中的有关术语幵采用下列定义:3.1 病原微生物:指能够使人戒者动物致病的微生物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CNAS-SL XX
药物临床试验生物样本分析
实验室认可方案
(征求意见稿)
Accreditation Scheme for Drug Clinical Testing
Laboratory
中国合格评定国家认可委员会
前言
药物临床试验是以筛选人群在一定时间内试用药物后,通过检测其体内药物式代谢浓度,经统计后得出结论的复杂过程。
药物是指可能上市变为药品的化学物质,多为混合物。
国家食品药品监督管理部门对此类药物申报为药品的批准要求比较严格,做药物临床试验的实验室是药物能否上市的关键环节。
此类实验室申请认可数量近年来大量增加,对此类实验室的特殊政策也是CNAS必须考虑的,因此本认可方案是知道此类实验室申请认可的文件。
药物临床试验生物样本分析实验室认可方案
1 范围
实验室使用“药代动力学”或“药物及代谢物浓度”作为参数,或使用有关《化学药物临床药代动力学研究技术指导原则》,《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》作为检测依据的实验室,视为药代动力学实验室,属于药物临床生物样品分析实验室,参照本文件要求执行。
2 引用标准
CNAS-CL01《检测和校准实验室能力认可准则》(IDT,ISO/IEC 17025)
3 要求
3.1 受理原则
3.1.1对于临床药代动力学检测实验室,除正常受理申请文件之外,第一方机构(主要指医院内或新药研发机构内的检测实验室)应在申请认可药代动力学实验室的同时递交国家食品药品监督管理局批准的临床药理实验基地文件,以及符合GCP要求的证明性文件;
3.1.2第三方机构或非临床试验机构应有法人营业范围内的新药研发等内容,以及药代动力学检测研究经历,而且具有从事相关检测工作的资质。
同时,应提交其委托机构的临床药理实验基地文件,以及符合GCP要求的证明性文件,以及与委托机构的委托合同文件。
3.1.3 对于药物临床试验生物样本分析实验室,应有法人营业范围内的新药研发等内容,以及检测研究经历(完整的报告或模拟报告),而且有实验资料考核通过的经历。
3.2 检测经历要求
实验室应具有成熟的检测经历,申请时提交两项以上药物代谢动力学项目的完整的典型报告及相关证明其能力的材料。
(对于初次申请实验室,评审组会重点关注:必须提供近两年完成的生物样本中药物及药物代谢浓度检测项目,并已经通过药品监督管理部门现场核查)
3.3 检测能力表述要求
3.3.1 检测对象:药物临床试验生物样本
检测参数:药物及代谢物浓度
检测标准:《化学药物临床药代动力学研究技术指导原则》、《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》
3.3.2 检测能力表述方式示例:
3.4 人员要求
从事检测活动人员学历要求:应为相关专业医科或理工科大专以上学历,非相关专业或文科学历原则上不接受,除非有10年以上相关检测经验。
同时,关键技术人员,如进行检测或校准结果复核、检测方法验证或确认、签发证书或报告的人员(包含授权签字人),必须有3年以上本专业领域的检测经验。
学历不满足要求的,至少应有10年以上相关检测经验。
3.5 仪器设备要求
相同原理和检测技术能力的仪器设备至少两台HPLC-MS(MS/MS)。
3.6 能力验证要求
在没有适宜的能力验证活动以前,必须参加CNAS或其认可的能力验证提供者组织的关于药品含量测定方面的能力验证活动,且结果满意,或提供测量审核满意结果。
3.7 认可标识使用要求
获得认可后,检测报告可使用CNAS标识,但在检测数据结合人体或动物实验的综合解释和评价报告不能使用CNAS认可标识,以免误导其GCP为CNAS认可。
