蛋白质中二硫键的定位及其质谱分析解析
如何分析和解读判断蛋白有二硫键的结果?

如何分析和解读判断蛋白有二硫键的结果?蛋白质中的二硫键是一种重要的化学键,能够在蛋白质结构和功能中发挥关键作用。
准确判断蛋白质中是否存在二硫键对于深入理解其结构和功能具有重要意义。
本文将重点介绍如何分析和解读判断蛋白质有二硫键的结果,帮助读者深入了解该领域的相关方法和步骤。
1.二硫键的形成和作用。
二硫键是两个半胱氨酸残基通过氧化反应形成的特殊化学键。
在蛋白质中,二硫键能够稳定蛋白质的立体结构,维持蛋白质的功能和稳定性。
了解二硫键的形成和作用是判断蛋白质中是否存在二硫键的基础。
2.生化实验方法。
判断蛋白质中是否存在二硫键的常用方法包括:2.1二硫键还原:通过还原试剂(如巯基乙醇)将二硫键还原为巯基,从而断开二硫键并使蛋白质在凝胶电泳中出现移动。
2.2还原条件下的质谱分析:利用质谱技术在还原条件下分析蛋白质的质量和离子荷质比,观察差异以判断是否存在二硫键。
2.3差异还原剂标记:使用含有差异还原剂的标记试剂标记蛋白质,通过质谱分析比较标记的蛋白质片段,以鉴定是否存在二硫键。
3.生物信息学方法。
生物信息学方法可以帮助预测蛋白质中是否存在二硫键,并提供判断的参考:3.1二硫键预测算法:通过分析蛋白质的氨基酸序列和结构特征,预测蛋白质中可能存在的二硫键。
3.2蛋白质结构数据库查询:利用已知蛋白质结构数据库,检索与目标蛋白质相似结构的蛋白质,并观察其是否存在已验证的二硫键。
4.结果解读与验证。
对于实验或预测得到的蛋白质二硫键结果,需要进行综合解读和验证:4.1结果的可靠性评估:评估实验方法或生物信息学方法的可靠性,并考虑结果的一致性和重复性。
4.2结果与蛋白质功能的关联:分析蛋白质的结构和功能特征,判断二硫键对蛋白质结构和功能的影响。
4.3进一步验证实验:通过其他实验方法验证蛋白质中是否存在二硫键,如质谱分析、X射线晶体学等。
5.结论。
准确判断蛋白质中是否存在二硫键对于深入理解蛋白质结构和功能具有重要意义。
通过生化实验方法和生物信息学方法的综合应用,可以有效分析和解读判断蛋白质有二硫键的结果。
二硫键定位分析
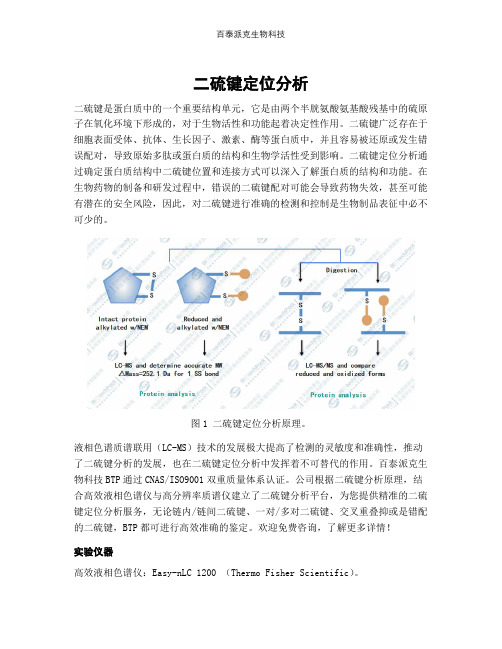
二硫键定位分析二硫键是蛋白质中的一个重要结构单元,它是由两个半胱氨酸氨基酸残基中的硫原子在氧化环境下形成的,对于生物活性和功能起着决定性作用。
二硫键广泛存在于细胞表面受体、抗体、生长因子、激素、酶等蛋白质中,并且容易被还原或发生错误配对,导致原始多肽或蛋白质的结构和生物学活性受到影响。
二硫键定位分析通过确定蛋白质结构中二硫键位置和连接方式可以深入了解蛋白质的结构和功能。
在生物药物的制备和研发过程中,错误的二硫键配对可能会导致药物失效,甚至可能有潜在的安全风险,因此,对二硫键进行准确的检测和控制是生物制品表征中必不可少的。
图1 二硫键定位分析原理。
液相色谱质谱联用(LC-MS)技术的发展极大提高了检测的灵敏度和准确性,推动了二硫键分析的发展,也在二硫键定位分析中发挥着不可替代的作用。
百泰派克生物科技BTP通过CNAS/ISO9001双重质量体系认证。
公司根据二硫键分析原理,结合高效液相色谱仪与高分辨率质谱仪建立了二硫键分析平台,为您提供精准的二硫键定位分析服务,无论链内/链间二硫键、一对/多对二硫键、交叉重叠抑或是错配的二硫键,BTP都可进行高效准确的鉴定。
欢迎免费咨询,了解更多详情!实验仪器高效液相色谱仪:Easy-nLC 1200 (Thermo Fisher Scientific)。
高分辨质谱仪:Q Exactive™ Hybrid Quadrupole-Orbitrap™ Mass Spectrometer (Thermo Fisher Scientific)。
案例示意液相色谱质谱联用法定位二硫键,不进行还原处理,而是直接进行烷基化,这个步骤将游离的巯基封闭。
随后,进行酶切操作,将蛋白质分子切割成小片段。
在这个过程中,存在二硫键的半胱氨酸之间形成了特定的连接,导致分子量发生变化。
接下来,通过质谱仪采集数据,并使用相应的分析软件进行数据库匹配,从而得到二硫键的信息。
表1 二硫键分析。
Site:形成二硫键的半胱氨酸在蛋白中的位置;Enzyme:酶解蛋白所用的酶;Peptide:肽段序列;Peptide_Mass:肽段分子量;Mass_Error(ppm):肽段的质量偏差。
二硫键详细资料大全

二硫键详细资料大全
二硫键(S-S)是连线不同肽链或同一肽链的不同部分的化学键。
它由含硫胺基酸形成,半胱氨酸被氧化成胱氨酸时即形成二硫键,二硫键是比较稳定的共价键,在蛋白质分子中,起著稳定肽链空间结构的作用。
二硫键数目越多,蛋白质分子对抗外界因素影响的稳定性就愈大。
基本介绍
•中文名:二硫键
•外文名:disulfide bond
•性质:蛋白质
•反应:2SH=-S-S-+2H
基本信息,功能,
基本信息
二硫键 disulfide bond 反应:2SH=-S-S-+2H 此键在蛋白质分子的立体结构形成上起著一定的重要作用。
为了确定蛋白质的一级结构,首先必须将二硫键打开,使成为线状多肽链。
为此,需要在2-巯-乙醇、二硫苏糖类、巯基乙酸等的硫化合物与尿素那样的变性剂同时存在下使之发生作用,使还原成-SH基(为了防止再氧化通常用适当的SH试剂将该基团烷基化)或是在过甲酸的氧化作用下衍生成-SO3H基或是采用在氧化剂共存下用亚硫酸的作用诱导成-S-SO3H基的方法。
功能
二硫键与蛋白质高级结构的生物活性有关同时与蛋白质的复性也有关联。
如核糖核酸酶A经巯基乙醇(还原剂)和尿素(蛋白质变性剂)处理后,发生变性作用,4对二硫键断裂,多肽链伸展开来,高级结构发生变化,失去生物活性。
如果用透析法将大量还原剂和变性剂除去,在微量还原剂存在下,4对二硫键在原来的位置重新形成,伸展开的多肽肽链会自发摺叠成天然构象,生物活性得到恢复。
此试验也证明蛋白质高级结构的信息存在于一级结构中。
测定蛋白质中二硫键位置的经典方法

测定蛋白质中二硫键位置的经典方法1. 二硫键还原方法:通过还原蛋白质中的二硫键,使其断裂并形成巯基,然后通过化学反应或质谱分析等方法定位巯基的位置。
常用的还原剂包括二巯基丙醇、巴巴锡、二硫化碳等。
2. 红细胞凝集试验:利用二硫键的存在可以促使红细胞间的凝集反应。
该方法可以快速筛查蛋白质中的二硫键位置,但只能给出大致的结果,不能确定具体的二硫键位置。
3. 巯基标记方法:通过使用巯基化合物(如巯基乙基硫酸酯)标记蛋白质中的巯基,然后通过质谱分析等方法确定巯基的位置。
这种方法可以较准确地确定蛋白质中二硫键的位置,但需要进行复杂的实验操作和分析过程。
4. 立体化学分析:通过测定蛋白质中二硫键的立体结构,可以确定二硫键的位置。
常用的方法包括核磁共振(NMR)和X射线晶体学等。
5. 蛋白质结构预测:利用蛋白质的序列信息和结构模型,通过计算方法预测蛋白质中的二硫键位置。
这种方法可以快速预测二硫键的位置,但需要对蛋白质结构预测方法有一定的了解。
6. 蛋白质质谱分析:通过质谱分析蛋白质中的二硫键,可以确定二硫键的位置。
常用的质谱方法包括质子转移反应质谱(PTR-MS)、质谱成像等。
7. 单分子力谱:通过单分子力谱技术,可以直接测量蛋白质中二硫键的断裂力,从而确定二硫键的位置。
这种方法具有高分辨率和高灵敏度,但需要复杂的实验操作和数据处理。
8. 蛋白质电泳:通过蛋白质电泳分离和检测,可以确定蛋白质中二硫键的位置。
常用的电泳方法包括SDS-PAGE、非变性电泳等。
9. 硫醇还原法:通过使用硫醇还原剂如巴巴锡等,可以将蛋白质中的二硫键还原为巯基,然后通过化学反应或质谱分析等方法确定巯基的位置。
10. 蛋白质交联方法:通过使用交联试剂如二硫化亚砜等,可以将蛋白质中的巯基交联形成二硫键,然后通过质谱分析等方法确定二硫键的位置。
这种方法在研究蛋白质的亚单位组装和结构中起到重要作用。
二硫键的定位修饰

蛋白质药物的二硫键定点修饰摘要:蛋白质中的二硫键在蛋白质分子的立体结构形成上起着重要作用,通过合适的策略可用于定点修饰。
本文简要介绍了利用蛋白质原生二硫键对其进行定点修饰的策略和实施方法,并讨论了该方法的有效性。
前言蛋白质和多肽药物(以下简称蛋白质药物)具有作用位点专一、疗效明确等优点,用于各种疾病治疗的蛋白质药物研制及应用已经成为生物医药产业发展的热点。
蛋白质药物的聚乙二醇修饰,是将活化的聚乙二醇通过化学方法偶联到蛋白、多肽、小分子有机药物和脂质体上,可以有效地解决蛋白质药物所存在的半衰期短、酶稳定性差、具有免疫原性等问题[1, 2]。
自1977年PEG用于修饰牛血清白蛋白以来,已有许多不同种类的活化PEGs 被成功地开发并用于蛋白质修饰。
PEG修饰技术也经历了两个发展阶段,即以传统的随机修饰为特点的第一代PEG修饰技术和以定点修饰为特点的第二代PEG 修饰技术。
相对于随机修饰,定点修饰能够针对特定基团或专一位点进行修饰,有利于保持蛋白质药物的活性,产物易于表征,产品质量更容易控制,已成为PEG修饰蛋白质药物的研究热点[3]。
为了达到这一目标,研究者们设计了不同的合成策略并合成了相应的PEG 修饰剂,不断探索蛋白质药物定点修饰的方法[4,5]。
其中,对于含有自由巯基的半胱氨酸的残基的蛋白质药物,可以利用巯基的高反应活性,选取能够特异性与巯基偶联的PEG修饰剂,能够高效地对蛋白质进行定点修饰。
然而,蛋白质分子中的半胱氨酸残基数量较少且很少以游离形式存在,虽然可以通过基因工程准确将半胱氨酸引入到蛋白质药物预先设计的位置,但这在技术上和成本上均有较高的要求。
另外,在蛋白质的纯化过程,过多的自由巯基将导致二硫键形成,蛋白质空间结构改变,以及蛋白质的不可逆聚集。
虽然利用自由巯基定点修饰蛋白质的方法困难重重,研究者发现大多数蛋白质都具有的二硫键更适于用来定点修饰,可以通过化学还原,使二硫键释放出两个巯基,从而进行定点修饰。
蛋白质中的二硫键

蛋白质中的二硫键
蛋白质是真核生物的主要结构大分子,在蛋白质的结构中,二硫键发挥着非常重要的作用。
二硫键是一种化学键,它使两个原子之间的距离保持在一定的位置,从而形成了蛋白质的可能的二维或三维构型。
二硫键的形成需要一种具有双价的元素,该元素可以与两个不同的原子构成单键,从而形成二硫键。
具有双价性的元素包括硫、氮、氟、氯、氧等。
其中最常用的是硫,因为它们能够在任何形式的环境中稳定地结合。
硫原子在氧原子或氮原子的双键室内形成二硫键时,其电子结构特征成为反应机制的核心。
从电子结构上看,形成二硫键时,硫原子从硫原子轨道中贡献的电子和氮原子从氮原子轨道中贡献的电子被
共享;这种共享的电子产生了一个大的分子穿梭孔,构成了二硫键。
硫原子的双价性可以保持两个原子的距离,并且可以吸收一定的能量,使蛋白质的结构得以稳定。
对二硫键而言,当结合处产生变化时,该能量也会随之变化。
当双硫键受到RF能量的作用时,它们会产生电子转移,从而使蛋白质的结构发生变化。
这些变化有时会影响蛋白质的功能,因此,了解二硫键的特性对于了解蛋白质的功能和机理很重要。
除了维持蛋白质结构的稳定性,二硫键还可以在其他方面发挥作用,如运输和燃烧、精细化学修饰等,这些都是生物体中为构成有机体所需的重要化学反应。
在医学上,二硫键也可以用来治疗某些疾病,
如癌症。
综上所述,蛋白质中的二硫键具有重要的作用,它们保持着蛋白质结构的稳定性,并且可以发挥多重功能。
它们在维护生物体正常功能方面也有重要的意义,因此,有必要进一步探究二硫键的作用机制和其在医学上的应用价值。
二硫键 nhs

二硫键nhs
二硫键在生物学中是一个非常重要的概念,特别是在蛋白质的结构和功能方面。
二硫键是由两个硫原子之间形成的化学键,通常在蛋白质的二级结构中起到关键作用。
它能够稳定蛋白质的结构,并且在一些生物过程中起着至关重要的作用。
在蛋白质中,二硫键是由两个巯基(-SH)之间的反应形成的。
当两个巯基相遇并反应时,它们会形成一个稳定的二硫键。
这个过程需要一个氧化环境,通常由一些特殊的酶来催化。
这些酶被称为二硫键异构酶或二硫键还原酶,它们在生物体内起着调节二硫键形成和断裂的作用。
二硫键的形成对于维持蛋白质的特定构象和稳定性非常重要。
在蛋白质折叠的过程中,二硫键的形成可以稳定蛋白质的三维结构,使其在生理条件下保持稳定。
此外,二硫键还可以影响蛋白质的功能,因为它可以影响蛋白质的构象和与其他蛋白质的相互作用。
在生物体内,二硫键的形成和断裂是动态的过程。
一些氧化剂和还原剂可以调节这个过程,从而影响蛋白质的结构和功能。
此外,一些疾病也会影响二硫键的形成和断裂,例如某些遗传性疾病和氧化应激相关疾病。
因此,研究二硫键的形成和断裂对于理解生物学过程和疾病机制具有重要意义。
总之,二硫键是生物学中的一个重要概念,它对于维持蛋白质的结构和稳定性起着关键作用。
通过研究二硫键的形成和断裂,我们可以更深入地了解生物学过程和疾病机制,为未来的生物医学研究提供更多有价值的信息。
质谱检测二硫键

百泰派克生物科技
质谱检测二硫键
蛋白质二硫键
蛋白质二硫键(S-S)是由不同蛋白肽链或同一蛋白质肽链上的两个半胱氨酸残基-巯基被氧化而形成的共价键。
伴随着二硫键的形成,蛋白质或多肽的空间结构也会发生变化,因此二硫键在维持多肽或蛋白质的空间结构,和由此决定的生物学功能方面有着重要作用。
二硫键广泛存在于细胞表面受体、抗体、生长因子、激素、酶、血浆以及毒液等蛋白质中,且容易被还原而断裂或发生错配,从而影响原多肽或蛋白的正常结构和生物学活性。
因此,分析多肽或蛋白质中的二硫键有助于我们理解和解释其高级结构和生物学功能,在生物医学和生物制药方面具有重要意义。
质谱检测二硫键
目前,质谱技术正蓬勃发展,其检测范围广、分辨率高、准确度好、分析速度快,已广泛运用于蛋白二硫键的分析检测。
利用高效液相串联质谱可以对单个或混合体系中的蛋白质二硫键进行检测、以及定位定量分析。
由于二硫键容易还原而断裂,因此在提取分离蛋白质时要严格控制实验条件,避免原有的二硫键断裂或发生错配。
百泰派克生物科技提供基于质谱的蛋白质质谱鉴定服务,包括蛋白二硫键分析、蛋白质串联质谱鉴定、蛋白质组学定性分析、基于质谱的序列分析、蛋白与蛋白互作分析等。
欢迎免费咨询152-****7680。
蛋白二硫键鉴定和定量分析

蛋白二硫键鉴定和定量分析BTP-蛋白二硫键鉴定和定量分析蛋白质鉴定和结构功能分析是现代生物学研究中的必要环节,而质谱已成为这一环节的支撑技术。
很多定位到细胞表面或分泌到胞外的蛋白质都有二硫键,例如免疫系统(immune system)产生的抗体、各类生长因子(growth factors)、内分泌系统产生的肽激素如胰岛素(insulin),以及这些生长因子或激素的受体。
因为二硫键的正确形成对于这些蛋白质的稳定性和活性至关重要,而且很多蛋白质品以及生物制剂(Biopharmaceutical)的靶蛋白都有这些属性,所以二硫键配对状态的精确解析对于它们的结构功能研究和相关品的研发、质控有重要价值。
百泰派克公司采用Thermo Fisher的Q ExactiveHF质谱平台,Orbitrap Fusion质谱平台,Orbitrap Fusion Lumos质谱平台结合Nano-LC,推出蛋白二硫键分析解决方案,您只需要将您的实验目的告诉我们并将您的样品寄给我们,我们会负责项目后续所有事宜,提供蛋白二硫键位点的相关信息。
百泰派克公司基于发表在Nature Methods上的文章:mapping native disul de bonds at a proteome scale,结合自己的实验经验建立了针对于单个蛋白和组学水平上的蛋白二硫键分析解决方案,包括克服蛋白质二硫键体外交换、保持其天然结构的样品制备方法,二硫键交联肽段的有效质谱分析方法,以及配套的二硫键鉴定软件pLink-SS。
二硫键鉴定研究路线BTP-蛋白二硫键鉴定和定量分析研究案例该项目是某高校老师二硫键鉴定,得到的部分结果如下图所示:二硫键鉴定研究案例BTP-蛋白二硫键鉴定和定量分析样品要求1. 如果您提供的是组织样品,请您干冰将组织样品寄给我们;植物组织样本最少200mg,血液样品至少1ml(血浆注意用EDTA防凝),血清0.2-0.5ml,尿液2ml,动物组织样品至少1g,细胞样品为1X107个细胞,酵母、微生物等干重200mg。
二硫键与蛋白质的结构

二硫键与蛋白质的结构徐国恒(北京大学医学部生理与病理生理系北京100191)摘要二硫键是肽链上2个半胱氨酸残基的巯基基团发生氧化反应形成的共价键,具有链内二硫键和链间二硫键2种形式。
与氨基酸的氨基氮原子之间形成的稳定共价键不同,二硫键容易被还原而断裂,断裂后可再次氧化重新形成二硫键,因而是可以动态变化的化学键。
二硫键是参与一级结构也是形成高级结构的重要化学键,对蛋白质折叠和高级结构的形成与维持十分重要。
讨论了二硫键的形成和特征及其与蛋白质结构和功能之间的关系,并讨论了生物学教学中关于二硫键的一些疑问。
关键词蛋白质二硫键高级结构功能二硫键(disulifide bond)即S—S键,是2个巯基被氧化而形成的—S—S—形式的硫原子间的共价键。
肽链上的2个半胱氨酸(cysteine,简称Cys)残基的巯基基团,可发生氧化反应形成二硫键;伴随二硫键的形成,半胱氨酸残基转变为胱氨酸残基。
二硫键对维持蛋白质的分子结构具有十分重要的作用。
1 链内二硫键和链间二硫键同一条肽链上的2个半胱氨酸残基之间形成的二硫键,称为链内二硫键,例如胰岛素A链内有1个二硫键。
不同的肽链上的2个半胱氨酸之间可形成链间二硫键,例如胰岛素蛋白分子由A、B 2条肽链组成,除了A链内部有1个链内二硫键外。
A链和B 链之间也通过2个二硫键连接在一起(图1)。
另外,免疫球蛋白lgG的轻链和重链也是通过链间二硫键结合的。
图 1 胰岛素蛋白分子的链内二硫键和链间二硫键Cys是半胱氨酸的英文缩写2 二硫键的作用二硫键对蛋白质的正确折叠和高级结构的形成与维持十分重要。
二硫键的形成迫使同一或不同肽链的不同区域的氨基酸残基向一起靠拢集合,由此肽链迅速折叠并形成稳定的空间拓扑结构,该区域的氨基酸残基数量是高度密集的;同时疏水氨基酸残基围绕着二硫键,可形成局部疏水中心,拒绝水分子进入肽的内部破坏氢键。
利于形成稳定的高级结构区域。
由于二硫键可以桥接肽链的不同区域,有时候也被称为二硫桥(disulifide bridge)。
蛋白质中二硫键的形成

蛋白质中二硫键的形成蛋白质是生物体内一种重要的有机化合物,它在细胞的结构和功能中发挥着重要的作用。
而蛋白质中的二硫键的形成则是蛋白质结构的重要组成部分。
二硫键是指两个硫原子通过共价键连接在一起的化学键。
在蛋白质中,二硫键的形成起到了增强蛋白质稳定性和结构的作用。
二硫键主要由半胱氨酸(Cysteine)之间的氧化反应形成。
半胱氨酸是一种含有硫原子的氨基酸,在蛋白质的结构中起到了重要的桥梁作用。
蛋白质的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
其中,二硫键的形成对于蛋白质的二级结构和三级结构的稳定性起到了至关重要的作用。
蛋白质的二级结构是指由多个氨基酸残基之间的氢键和其他非共价键相互作用而形成的稳定的结构单元。
常见的二级结构包括α-螺旋和β-折叠。
在这些二级结构中,二硫键的形成起到了增强氨基酸残基之间相互作用的作用。
二硫键能够将两个半胱氨酸残基连接在一起,从而使蛋白质的结构更加稳定。
蛋白质的三级结构是指整个蛋白质分子的折叠形态。
在蛋白质的折叠过程中,二硫键的形成起到了重要的桥梁作用。
通过二硫键的形成,半胱氨酸残基能够将蛋白质的不同区域连接在一起,形成稳定的空间结构。
这种空间结构决定了蛋白质的功能和性质。
除了在蛋白质结构中起到桥梁作用之外,二硫键还可以通过断裂和重建来调控蛋白质的结构和功能。
在一些生物过程中,蛋白质的结构需要发生变化,这时二硫键的断裂和重建就发挥了重要的作用。
通过断裂和重建二硫键,蛋白质的结构可以发生变化,从而实现特定的功能。
蛋白质中二硫键的形成对于蛋白质的结构和功能起到了重要的作用。
通过二硫键的形成,蛋白质的结构变得更加稳定,同时也能够调控蛋白质的结构和功能。
对于了解蛋白质的结构和功能以及生物过程中的蛋白质调控机制具有重要的意义。
蛋白质二硫键检测:选择适用的方法解决技术难题
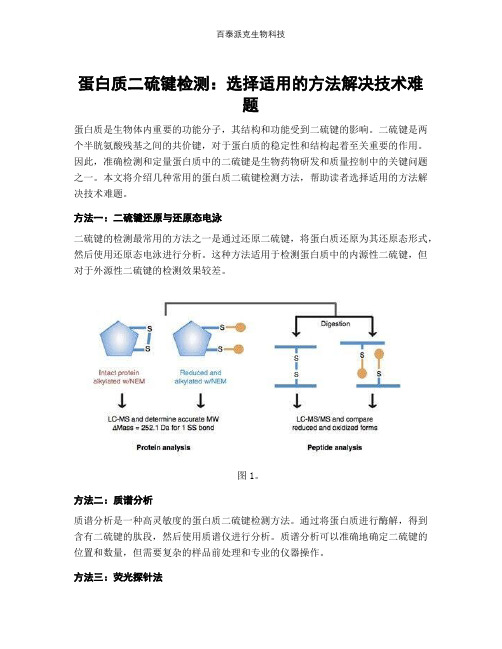
蛋白质二硫键检测:选择适用的方法解决技术难题蛋白质是生物体内重要的功能分子,其结构和功能受到二硫键的影响。
二硫键是两个半胱氨酸残基之间的共价键,对于蛋白质的稳定性和结构起着至关重要的作用。
因此,准确检测和定量蛋白质中的二硫键是生物药物研发和质量控制中的关键问题之一。
本文将介绍几种常用的蛋白质二硫键检测方法,帮助读者选择适用的方法解决技术难题。
方法一:二硫键还原与还原态电泳二硫键的检测最常用的方法之一是通过还原二硫键,将蛋白质还原为其还原态形式,然后使用还原态电泳进行分析。
这种方法适用于检测蛋白质中的内源性二硫键,但对于外源性二硫键的检测效果较差。
图1。
方法二:质谱分析质谱分析是一种高灵敏度的蛋白质二硫键检测方法。
通过将蛋白质进行酶解,得到含有二硫键的肽段,然后使用质谱仪进行分析。
质谱分析可以准确地确定二硫键的位置和数量,但需要复杂的样品前处理和专业的仪器操作。
方法三:荧光探针法荧光探针法是一种简单、快速的蛋白质二硫键检测方法。
该方法利用特定的荧光探针与二硫键发生反应,产生荧光信号。
通过测量荧光信号的强度可以定量分析蛋白质中的二硫键含量。
荧光探针法操作简便,适用于高通量的蛋白质二硫键检测。
方法四:生物传感器技术生物传感器技术是一种新兴的蛋白质二硫键检测方法。
该方法利用生物传感器与蛋白质中的二硫键发生特异性的相互作用,产生信号响应。
生物传感器技术具有高灵敏度、高选择性和实时监测的优势,但需要专业的设备和操作。
蛋白质二硫键检测是生物药物研发和质量控制中的重要环节。
根据实际需求,选择适用的方法解决技术难题至关重要。
二硫键还原与还原态电泳适用于内源性二硫键的检测,质谱分析可以准确确定二硫键的位置和数量,荧光探针法操作简便适用于高通量检测,而生物传感器技术具有高灵敏度和实时监测的优势。
在实际应用中,可以根据需求和实验条件选择合适的方法进行蛋白质二硫键检测。
蛋白质四级结构中的二硫键

蛋白质四级结构中的二硫键
二硫键是最常见的一类非常重要的非疏水性键,这类键是分子中最稳
定的非疏水性键之一,能够在蛋白质四级结构中用于对多肽链进行聚合,
以及控制蛋白质的活性、穿透性和可生物利用性。
这类键在生物体的生理
过程中起着重要的作用,它能够将多肽链聚集在一起形成各种蛋白质结构,并参与蛋白质与药物的相互作用,在调节细胞过程中也起着重要作用。
二硫键是一类有助于蛋白质四级结构的强稳定的、不可分解的、非疏
水性有序聚合物。
在一个蛋白质中,由二硫键构成的复合物,可以把多肽
链聚集在一起,使它们在发挥功能时有着更多的活性。
它们是由两个硫原
子相互结合而产生的,每个硫原子都带有一个有效载体,由一个硫原子所
带负电荷和另一个硫原子所带正电荷相互作用形成分子结构。
两个硫原子
之间的结合在一定条件下是可逆的,这种可逆性使得二硫键能够在不同的
条件下被激活或失活,从而对蛋白质功能有一定的影响。
在蛋白质四级结构形成过程中,二硫键能够结合多肽链上的离子位点,形成氨基酸对,稳定蛋白质结构,防止蛋白质分解,而且这种结合非常强
稳定。
二硫键 多肽 质谱

二硫键、多肽与质谱的深入探讨在生物化学领域中,二硫键、多肽和质谱是三个紧密相关且不可或缺的概念。
它们各自在蛋白质的结构、功能和分析中扮演着重要角色。
本文将详细探讨这三个概念及其在生物化学中的应用。
一、二硫键的奥秘二硫键(-S-S-),作为一种强大的共价键,在稳定蛋白质三级结构中起着至关重要的作用。
它是由两个半胱氨酸残基中的硫原子通过氧化反应形成的。
这种键能抵抗多种化学和物理因素的破坏,从而确保蛋白质在细胞内外环境中的稳定性。
值得一提的是,二硫键的形成并不是随机的。
在蛋白质折叠过程中,特定的半胱氨酸残基会精确地对齐,以便在适当的条件下形成二硫键。
这一过程受到细胞内多种分子伴侣和酶的严格调控,确保蛋白质能够获得正确的三维结构并行使其生物学功能。
二、多肽的多样性多肽是由多个氨基酸通过肽键连接而成的生物分子。
它们是蛋白质的基本组成单位,同时也是生物体内许多重要信号分子的前体。
多肽的多样性源于氨基酸的种类、数量和排列顺序的不同,这使得多肽在生物体内具有广泛的功能。
多肽在生物体内的作用多种多样,包括作为激素、神经递质、生长因子和抗体等。
它们通过与特定的受体结合来传递信息,从而调控细胞的生长、分化和代谢等过程。
此外,多肽还参与构成细胞膜和细胞骨架等结构,为细胞提供必要的支持和保护。
三、质谱的解析力质谱是一种强大的分析工具,能够对多肽和蛋白质进行精确的质量测量和结构分析。
它通过测量样品中离子的质荷比(m/z)来推断出分子的质量和结构信息。
在生物化学领域中,质谱技术被广泛应用于蛋白质组学、代谢组学和药物研发等领域。
对于多肽和蛋白质的分析,质谱技术能够提供氨基酸序列、修饰状态(如磷酸化、糖基化等)以及二硫键位置等关键信息。
这些信息对于理解蛋白质的结构和功能至关重要,同时也为疾病诊断和治疗提供了有力的支持。
四、二硫键、多肽与质谱的交汇点二硫键、多肽和质谱在生物化学领域中的交汇点主要体现在蛋白质组学研究中。
蛋白质组学旨在全面解析生物体内所有蛋白质的种类、数量和功能状态。
adalimumab4组二硫键

一、概述二、二硫键1. 什么是二硫键2. 二硫键在蛋白质中的重要性三、adalimumab1. adalimumab的简介2. adalimumab中的二硫键四、adalimumab中的二硫键对药物作用的影响1. 二硫键在生物活性中的作用2. 二硫键在adalimumab药效中的作用五、研究成果1. 过去关于adalimumab二硫键的研究2. 新近关于adalimumab二硫键的研究六、结论七、致谢概述二硫键是蛋白质分子中的重要化学键之一,对蛋白质的结构和功能起着至关重要的作用。
在生物医药领域中,一些药物的分子中也包含有二硫键,其中就包括一种重要的生物制剂——adalimumab。
本文将重点探讨adalimumab中的二硫键,并分析其在药效和临床应用中所起的作用。
二硫键1. 什么是二硫键二硫键是由两个硫原子以共价键形式连接起来的功能基团,其化学结构为-S-S-。
在蛋白质或多肽链的折叠和稳定过程中,二硫键具有非常重要的作用。
2. 二硫键在蛋白质中的重要性二硫键可以在蛋白质的折叠和构象稳定中起着关键作用,保持蛋白质的结构完整性。
它们可以连接蛋白质中的不同链或不同部位,从而确保蛋白质的正确折叠和功能发挥。
adalimumab1. adalimumab的简介adalimumab是一种重要的生物制剂,属于抗肿瘤坏死因子(TNF)单克隆抗体药物。
它被广泛应用于风湿性关节炎、类风湿性关节炎、银屑病关节炎、强直性脊柱炎等自身免疫性疾病的治疗中。
adalimumab的分子结构中含有二硫键。
2. adalimumab中的二硫键adalimumab的分子结构由蛋白质组成,其中含有多个半胱氨酸残基。
这些半胱氨酸残基可以通过形成二硫键来连接多个蛋白质链或部位,从而保持adalimumab分子的结构完整性和稳定性。
adalimumab中的二硫键对药物作用的影响1. 二硫键在生物活性中的作用二硫键的存在可以影响蛋白质的生物活性。
二硫键对稳定蛋白质的影响

二硫键对稳定蛋白质的影响说到蛋白质,大家第一反应肯定是它跟我们身体健康有关。
对吧?这可是生命的基本组成部分,咱们的细胞、肌肉、血液里都有它的身影。
蛋白质不光是修复组织、维持免疫功能那么简单,还是我们生命活动的幕后工作者,像个默默奉献的无名英雄。
咱们平时吃的肉、豆腐、鸡蛋里都有它,都是为了给我们补充这位超级帮手。
说了这么多,肯定有小伙伴会问了:“蛋白质到底是什么呢?它又是怎么运作的?”嗯,简单来说,蛋白质就是由氨基酸组成的长链,这些氨基酸一块儿搭配起来,就能折叠成各种各样的形状,而这个形状才决定了它的功能。
可是你知道吗,蛋白质的形状可不是随便折的,它有个“神秘力量”帮助它稳定下来,那就是“二硫键”!你可能会想,二硫键是啥?怎么听着这么高大上?别急,咱慢慢说。
二硫键就像一对“结婚的纽扣”,它们把蛋白质链条上的两个硫原子牢牢地捆绑在一起。
你想象一下,两根长长的链条如果没有什么东西把它们固定住,可能就会随风飘荡,随时都可能变形、散开。
可是二硫键就像是给这条链子扎了一个结,这样蛋白质就能保持它应有的形状,不容易被破坏。
就像你买的那件衣服,挂上衣架的挂钩能让它保持整齐,而不是皱巴巴的。
可见,二硫键在蛋白质稳定性方面可是“大有作为”。
那么二硫键对蛋白质的影响到底有多大呢?我们可以举个例子。
你知道鸡蛋煮熟了为什么变硬吗?这就是因为鸡蛋里的蛋白质发生了变化。
煮蛋的高温会打破蛋白质的结构,导致其中的二硫键断裂,然后蛋白质链条就像被解开的拉链,开始散开、重组。
这时候蛋白质的原始结构已经被破坏,它的功能也就不再如原来那样了。
所以,二硫键就像是蛋白质的“安全带”,保护它们不轻易出错。
但是,二硫键的作用可不止是让蛋白质保持原状。
二硫键还会在蛋白质折叠的过程中提供支持,帮助它们形成一个稳定的三维结构。
想象一下,如果你要做个复杂的拼图,拼图的每一块都得摆放得恰到好处,这时候你肯定需要一些辅助工具来确保每块拼图不跑偏。
二硫键就像是这些辅助工具,把蛋白质的一些小部分固定住,避免它们跑得太远,保证它们最终拼成完整的形状。
二硫键位置的确定

31
(1)氨基酸的两性性质
❖ 氨基酸在结晶形态或在水溶液中,并不是以 游离的羧基或氨基形式存在,而是离解成两 性离子。
❖ 在两性离子中,氨基是以质子化(-NH3+)形 式存在,羧基是以离解状态(-COO-)存在。
2021/4/17
32
❖ 在不同的pH条件下,两性离子的状态也 随之发生变化。
羧基
-H+ pK1'
❖ 肌球蛋白和组蛋白中含有6-N一甲基赖氨酸; r-羧基谷氨酸,存在于凝血酶原中。
❖ 哺乳类动物的肌肉中存在N一甲基甘氨酸(肉 氨酸);
❖ 酪蛋白中存在磷酸丝氨酸等。
2021/4/17
18
2021/4/17
19
❖ 四、非蛋白质氨基酸(天然氨基酸)
❖ 除了上述的氨基酸外,自然界中还存在许多 的氨基酸。
43
❖ 60年代以后,随着对蛋白质分子结构知 识的积累,又增加了不少新的内容。
❖ 如在三级结构以上又增加了四级结构, 在二级和三级结构之间又增加了超二级 结构和结构域这两个结构层次。
2021/4/17
44
木瓜蛋白酶
2021/4/17
45
2021/4/17
46
2021/4/17
47
半胱氨酸蛋白酶抑制剂
❖ 自然界存在的蛋白质大约有1010-1012种,不 同的蛋白质具有不同的结构,那么,由20种 氨基酸如何组成了数目繁多、结构各异的蛋 白质大分子?
❖ 20世纪50年代初,Linder-strop-Long及其
同事最先认识到蛋白质具有不同的结构层次,
并引人一级、二级、三级结构来描述这一现
象。 2021/4/17
此外,如视网膜上感觉光信号的视色素、味 蕾上的味觉蛋白、某些植物、昆虫、微生物产
二硫键和巯基在蛋白质结构功能中的作用及分析方法

1499
综述
二硫键和巯基在蛋白质结构功能中的作用及分析方法
田 悦, 杜军保
(北京大学第一医院 儿科, 北京 100034)
E ffect of D isu lfide B ond and M ercap to - G roup on S truc ture and Funct ion of P rotein and Ana lyticalM e thod TIAN Yue, D U Jun - bao
( D epartm en t of Ped iatrics, Pek ing U n ivers ity First H osp ita,l B eijing 100034, Ch ina)
摘要: 本文总结了二硫键和巯基在稳定蛋白质结构、实现蛋白质功能中的主要作用及二硫键和巯基在体内外各种条件下相互转
二、巯基对于蛋白质结构功能影响 半胱氨酸残基中的巯基是所有蛋白质氨基酸残基中最 活泼的基团, 在体内参抗氧化、亚硝基化和巯基 二硫键交换 等多种重要生理反应。 1. 巯基的抗氧化作用 谷胱甘肽 ( GSH )是由谷氨酸、甘 氨酸和半胱氨酸组成的三肽, 其中半胱氨酸的巯基是其最重 要的功能基团。 GSH 的疏基维持细胞的正常代谢与保护细 胞膜的完整性, 并能结合亲电子基, 重金属离子与氧自由基 等有害物质, 具有抗脂质过氧化作用, 可直接使氧自由基还 原或促进超氧化物歧化酶合成 [ 5 9] 。另外, 由于巯基的抗氧 化作用, 现已证明 GSH 水平下降是诱导细胞发生凋亡的重要 因素。细胞发生凋亡前有 GSH 水平下降, 耗竭细胞内 GSH 可诱导多种细胞发生调亡 [ 10 12] 。 2. 巯基的亚硝基化 巯基的亚硝基化主要是指与气体 信号分子一氧化氮 ( NO) 反应。这也是 NO 在体内发挥生理 作用的机制之一。 S tam ler等 [ 13] 研究发现, 蛋白质巯基被 NO 或其衍生物修饰可发挥 NO的生物活性, 且使 NO 更稳定; 并 于 1994 年首先提出蛋白质巯基亚硝基化修饰概念。后续研 究不断证实蛋白质的巯基亚硝基化修饰影响其在细胞内的 活性和功能, 如核转录因子 ( NF B) 的一个亚基巯基亚硝基 化影响其与 DNA 结合, 蛋白质巯基亚硝基化修饰能活化钙 离子通道, 天门冬氨酸受体 ( NM DAR )蛋白质巯基亚硝基化 影响相关信号通路, 蛋白质巯基亚硝基化调控 C aspase 酶活 性, 用 Fas处理细胞, C aspase 3 发生去亚硝基化后活化, 诱导 细胞凋亡 [ 14] 。 3. 巯基 二硫键交换反应对细胞信号分子影响 人热休 克转录因子 1( heat shock transcription factor 1, H SF1) 的结构
抗体药物二硫键定位

抗体药物二硫键定位抗体药物是一类由基因工程技术生产的蛋白质药物,主要包括单克隆抗体和抗体药物偶联物等。
它们具有高度的特异性,可以精确地靶向和中和疾病相关的分子。
在这些抗体药物中,二硫键对于保持抗体的三维结构和功能稳定性至关重要。
在生物药物的研发和生产过程中,对抗体中的二硫键进行准确的检测和控制是必不可少的。
不正确的二硫键配对可能会导致药物失效,甚至可能产生潜在的安全风险。
因此,开发和采用有效的二硫键定位方法对于保证抗体药物的质量和安全性至关重要。
目前二硫键定位的方法主要包括质谱法、核磁共振法、X射线以及辅助化学法等。
生物制品表征二硫键定位示意图。
质谱法是一种常用的二硫键定位方法,具有很高的灵敏度和分辨率,其通过将抗体蛋白用特定的酶或化学试剂切割成多肽片段,然后利用质谱技术分析这些片段,可以直接测量蛋白质片段的质量,从而确定二硫键的位置。
此外,质谱法可以处理相对大的样品量,对样品的纯度要求相对较低。
百泰派克生物科技(BTP),采用ISO9001认证质量控制体系管理实验室,获国家CNAS实验室认可,为客户提供符合全球药政法规的药物质量研究服务。
我们结合多年的实验经验,为您提供高水平的针对抗体药物的二硫键分析解决方案,包括阻断蛋白质二硫键体外交换、保持其天然结构的样品制备方法,二硫键交联肽段的质谱分析方法,以及配套的二硫键鉴定pLink-SS软件分析,能够实现二硫键连接及自由硫基分析。
二硫键连接可通过质谱法对抗体药物中二硫键数目和位点进行确认。
经过多年的经验积累,无论是常规二硫键,还是交叉重叠的二硫键抑或错配的二硫键,百泰派克生物科技均能为您实现高效检测。
百泰派克生物科技抗体药物表征内容。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学进展
第20卷
链内二硫键,而且包含一对邻位的半胱氨酸(Cys
A6,Cys
A7)。1960年,Moore等¨引完成牛胰核糖核
酸酶(RNase)全序及二硫键分析。该酶含有124个氨基酸,4个链内二硫键。这些早期的研究确立了如今仍在使用的二硫键定位研究的基本思路,包括:(1)将样品蛋白在避免二硫键重排或交换的条件下,尽可能地在其所有半胱氨酸残基之间断裂而形成二硫键相连的肽段;(2)分离这些肽段混合物;(3)鉴定分离所得的各个肽段;(4)断开肽段中的二硫键;(5)分析断开二硫键后的肽段,与整个氨基酸序列比较,推断二硫键的位置。同时这些早期的研究也提供了很多相关实验条件的经验¨7_21|。比如强酸的环境会促进二硫键的重排,在弱碱性条件下进行酶切时也会产生二硫键的交换,因此要小心地控制裂解实验条件。后来又有许多关于二硫键在碱性pH条件下交换反应增强的报道m一划。但是在酸性条件下蛋白构象趋于展开从而更容易在半胱氨酸残基之间断裂,所以提议采用酸水解或胃蛋白酶(pepsin)酶解h9’死训。酸水解法特异性不强,对较大蛋白和肽不合适。胃蛋白酶可以在酸性条件下使用,其专一性较低,断裂位点多,所以也更容易在半胱氨酸残基之间断裂,生成的含二硫键肽段比较小,有利于后面的分离和鉴定。
(1.ChangchunCenterofMassSpectrometry,ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,
Changchun130022,China;2.GraduateSchooloftheChineseAcademyof
收稿:2007年7月,收修改稿:2007年9月
*国家自然科学基金项目(No.30672600,20675079)资助
**通讯联系人e.衄il:syliul9@yahoo.tom.ca
硫键还将有助于我们进一步揭示蛋白的高级结构及其生物功能¨“,指导定向化学合成和审评基因工程重组蛋白的折叠¨2叫引,便于X射线晶体衍射法(x.
第20卷第6期2008年6月
化
学进展
PROGRESSINCHEMISTRY
V01.20No.6June,2008
蛋白质中二硫键的定位及其质谱分析*
仇晓燕1’2
崔
勐1
(1.中国科学院长春应用化学研究所长春质谱中心
刘志强1
刘淑莹H‘
长春130022;2.中国科学院研究生院
北京100039)
摘
要
二硫键是一种常见的蛋白质翻译后修饰,对稳定蛋白质的空间结构,保持及调节其生物活性有
ray
crystallography)的三维结构研究¨纠以及为通过核
磁共振波谱法(NMR)正确解析溶液中的构象奠定基础㈨。
当蛋白质分子中存在二硫键时,在完成其氨基酸测序分析后,需要对二硫键的位置加以确定。1955年Ryle等【17’坞3对胰岛素二硫键结构的分析是蛋白质化学研究史中的里程碑。胰岛素分子的A、B两链通过两个链间二硫键连在一起,A链还有一个
中图分类号:0657.63;Q51
文献标识码:A文章编号:1005.281X(2008)06.0975—09
ProteinDisulfideBondDeterminationandItsAnalysisbyMassSpectrometry
Qiu
Xiaoyanl'2
CuiMen91Liu劢iqian91LiuShu乒n91‘‘
advantagesofbeingsimple,rapidandsensitive.Someusefulmethodsforassignmentofdisulfide
bondsinproteins
are
introduced.thedevelopmentsandapplicationsofrnass
spectrometryinthis
着非常重要的作用。因此,确定二硫键在蛋白质中的位置是全面了解含二硫键蛋白化学结构的重要方面。在众多实验方法中,现代质谱技术因其操作简单、快速、灵敏等优点而成为分析二硫键的重要手段。本文介绍了目前主要的定位二硫键的方法以及质谱在二硫键定位分析中的应用与进展。
关键词
二硫键定位质谱串联质谱三羧乙基膦稳定同位素标记
ofthechemicalstructureof
a
protein.Numerousexperimentalmethodshavebeendevelopedforthe
determinationof
disulfidebondsinproteins.Modernmassspectrometryhasdevelopedas锄importanttoolfortheanalysisofdisulfidebondpatternsduetoits
the
three-dimensionalstructures
ofproteins
and
theirbiological
activities.
Therefore.thedeterminationofdisulfidebondsbecomesanimportantaspectforobtaininga
comprehensiveunderstanding
areaare
reviewed.
Keywords
assignmentofdisulfideboБайду номын сангаасd;lll越Sspectrometry;MS/MS;TCEP;stable
isotopelabeling
1
引言
二硫键广泛存在于原核和真核生物的激素、酶、
免疫球蛋白、血浆、抑制剂和毒液等蛋白质中,是一种常见的蛋白质翻译后修饰。二硫键作为共价键交联多肽链内或链间的两个半胱氨酸,对稳定蛋白质的空间结构¨-5】、维持正确的折叠构象№’7]、保持及调节其生物活性¨-1训等都有着举足轻重的作用。因此,确定二硫键在蛋白质中的位置对于鉴定蛋白质一级结构有着重要的意义,是研究含有二硫键结构的活性多肽/蛋白质化学结构的重要方面。定位二
Sciences,Beijing100039,China)
AbstractDisulfidebonds
areone
ofthemostcommoncovalentposttranslationalmodificationsofproteins.Theyplay
an
importantrole
in
maintaining
