病毒滴度测定知识讲解
病毒TCID50测定

病毒TCID50测定病毒TCID50测定是一种常见的病毒滴度测定方法。
下面将介绍具体的操作步骤。
首先,需要准备好细胞。
取出一块细胞培养板,每个孔铺成单层大约60%丰度即可接种病毒。
对照选取16个孔即可。
注意不要窜孔,保证实验条件一致。
其次,稀释待测病毒液。
可以采用A法或B法。
在A法中,向每支试管中加入1.8ml病毒稀释液,依次10倍系列稀释至适宜浓度。
在B法中,可以根据病毒大致的滴度确定稀释的倍数,并根据接种的孔数稀释病毒。
接下来,进行接种。
用多道加样器吸去96孔板中的培养液,吸取孵育液加在每孔中再轻轻吹打一次,然后吸出孵育液。
将稀释好的病毒液加到96孔板上,每孔100µl,根据观察的惯,一般从右到左,从上到下,从高稀释度到低稀释度到原液加样。
切记要设置正常的细胞对照,每次实验要重复4次,计算标准差。
最后,进行培养。
37℃CO2培养箱中孵育1h,取出培养板吸去病毒液,加入维持液200µl继续在37℃CO2培养箱中培养。
实验方法将待检病毒接种于细胞培养物中,培养时间为5天,培养温度为37℃,CO2浓度为5%。
测定结果取出培养板,使用显微镜观察细胞病变情况。
根据病变程度,计算出病毒的浓度。
计算方法1) ___-Karber法利用病变程度计算出病毒的50%细胞传染量(CCID50),计算公式为:LgCCID50/0.2ml= -(X-d/2 + d×∑R1/N1),其中X代表全部病变最低稀释度对数,d代表稀释因数对数,N1代表每个稀释度所种的孔数,R1代表病变孔数,∑代表积和。
2) Reed-Muench法观察细胞病变情况,找出能引起半数细胞感染的病毒稀释倍数,按照Reed和Muench公式计算出该病毒液的50%细胞传染量(TCID50)。
根据实验结果,能使50%细胞感染的病毒稀释度在10^-4~10^-5之间,根据Reed和Muench公式计算出TCID50.。
病毒感染力的滴定(TCID50的测定)

实验四病毒感染力的滴定(TCID50的测定)一、实验目的了解病毒感染力测定的几种常用方法,掌握半数细胞培养物感染量TCID50的操作步骤、计算方法及含义。
二、测定病毒感染力的方法( 50% lethal dose):用动物或鸡胚来检测半数致死量LD50半数鸡胚感染量EID(egg 50% infective dose):用鸡胚来检测50(50% tissue culture infective dose):用细胞半数细胞培养物感染量TCID50来检测蚀斑形成单位(plaque forming unit,PFU):用细胞来检测三、材料1、长满单层的细胞1瓶2、胰酶、吸球、吸管、生长液3、96孔细胞培养板4、加样器、枪头5、病毒液(PRV)四、TCID50的操作步骤1、在青霉素瓶或离心管中将病毒液作连续10倍的稀释,从10-1-10-10。
2、将稀释好的病毒接种到96孔微量培养板中,每一稀释度接种一纵排共8 孔,每孔接种100µl。
3、在每孔加入细胞悬液100µl,使细胞量达到2~3×105个/ml。
4、设正常细胞对照,正常细胞对照作两纵排。
(100µl生长液+100µl细胞悬液)5、逐日观察并记录结果,一般需要观察5-7天。
6、结果的计算,按Reed-Muench两氏法或Karber法五、TCID50的计算方法1、Reed-Muench两氏法CPE:Cytopathic effect距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数)=(91.6-50)/(91.6-40)= 0.8=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数lgTCID50=0.8×(-1)+(-3)=-3.8TCID=10-3.8/0.1ml50含义:将该病毒稀释103.8接种100µl可使50%的细胞发生病变。
病毒滴度测定

病毒滴度测定有很多名词都用来描述病毒溶液的滴度。
1. VP(病毒颗粒)或OPV(光学颗粒单位)2. GTU(基因转移单位)或转导颗粒(BFU即蓝点形成单位,与GTU类似)3. PFU(空斑形成单位)4. TCID50(50%组织培养感染剂量)不同的概念缘于不同的滴度测定方法,这些方法包括2类:物理方法(VP)和生物学方法(GTU、PFU、TCID50)。
1.测定VP的方法是测定病毒颗粒在260nm处的吸光度(病毒DNA和蛋白的总吸光度中主要为DNA),1个OD值相当于1.1×1012个病毒颗粒。
用这种方法进行测定在各个实验室中都较为稳定,但它不能区分感染性和缺陷性病毒颗粒。
因此这种方法只能提供病毒的量,至于质,比如是否含有缺陷性颗粒则没有考虑在内。
2. GTU则测定感染后能表达报告基因的细胞数量。
这个过程中,病毒将DNA转入细胞,在一个感染周期结束前立即测定表达报告基因的细胞。
如果重组腺病毒含有报告基因如GFP 或LacZ等则可以用这种方法进行测定,病毒保存液通常不用这种方法来进行描述。
3. PFU是测定腺病毒滴度最早的标准方法,主要测定单层细胞培养中病毒裂解空斑的形成。
空斑形成需要许多个感染周期,得到最终结果通常需要三个星期。
一般来说,这种方法得到的结果很少能在其它实验室重复,即使在同一实验室内,不同技术员操作也很少能得到相同的结果。
4. TCID50已被用于测定许多种病毒的滴度,但以前并不用于腺病毒。
病毒稀释液与细胞在96孔板进行培养,然后监测每孔是否CPE。
TCID50方法相对PFU方法而言有几个优点,如速度是PFU的2倍,结果更具预料性,在不同操作个体间也更稳定。
所有生物学方法所得到的结果在不同实验室之间往往有所差异,它主要与病毒感染方法有关。
许多因素如加入的病毒储存液的量、管子的类型、培养的时间、细胞和培养液的量等都会影响结果。
最近,出现了两种测定病毒滴度的改良方法。
一种是用更小体积的病毒液进行感染并在感染过程中不断晃动培养板(Mittereoler等,1996);另一种方法则在感染时将培养板进行离心(1000 RCF90分钟)(Nyberg-Hoffman等,1997)。
病毒滴度测定

10 -6
0
8
0
21
0(0/21)
CPE(阳性)孔累计数由下向上累积 无CPE(阴性)孔累计数由上向下累积
CCID50
(难点、重点)
Calculation of TCID50
• Use of Reed & Muench method (if 50 ul of virus dilution is added to each well)
计算,S:感染比率总和; 计算,S:死亡比率总和;
(掌握)
血凝试验测定病毒滴度
血凝试验的基本原理(掌握)
红细胞凝集现象(血凝现象)
红细胞凝集抑制
(红细胞与抗体结合,失去血凝)
血凝滴度/血凝单位
干扰滴定测定病毒滴度
小结
主要介绍空斑形成单位法、50%终点法、血凝试 验和干扰滴定法测定病毒滴度的原理及其方法; 重点要掌握空斑形成单位法、50%终点法测定病 毒滴度的原理及其滴度的计算; 熟悉:空斑形成单位法、50%终点法、血凝试验 和干扰滴定法测定病毒滴度的具体方法;
病毒滴度的测定
空斑形成单位法测定病毒滴度
原理(重点):适当稀释的病毒悬液与长成单 层的宿主细胞混合,在细胞上覆以营养琼脂培 养基等固体或半固体介质,由于琼脂的限制,
病毒只能感染并破坏临近的细胞,造成细胞溶
解而形成空斑,每个空斑由一个病毒颗粒造成,
计算空斑数量再乘以稀释倍数即可得知原来的
病毒感染单位的浓度。 空斑形成单位(Plaque Forming Units, PFUs)
病毒液 稀释度 CPE孔数 无CPE 孔数 累
(难点、重点)
计 出现CPE孔 所占的%
CPE孔数 无CPE孔数
10-1
病毒滴度测定方法

病毒滴度测定方法
病毒滴度测定是一种用于确定病毒在溶液中的浓度的方法。
它通常用于病毒学研究、疫苗生产和药物研发等领域。
正确的病毒滴度测定方法可以帮助科研人员准确地评估病毒的活性和浓度,从而为相关研究工作提供可靠的数据支持。
下面将介绍几种常用的病毒滴度测定方法。
一、细胞培养法。
细胞培养法是一种常用的病毒滴度测定方法。
首先,将待测病毒样品与细胞培养基混合,然后在培养皿中接种一定数量的细胞,并将混合液加入培养皿中。
接下来,将培养皿放入恒温培养箱中,培养一定时间后观察细胞的感染情况,根据感染细胞的数量可以计算出病毒的滴度。
二、血凝法。
血凝法是另一种常用的病毒滴度测定方法。
这种方法利用病毒对红细胞的凝集作用来确定病毒的滴度。
首先,将一定浓度的病毒样品与红细胞混合,然后在琼脂培养皿中进行凝集反应。
根据凝集的程度和范围可以计算出病毒的滴度。
三、动物接种法。
动物接种法是一种直接将病毒样品接种到动物体内,通过观察动物的感染情况来确定病毒滴度的方法。
这种方法通常用于病毒毒力的测定。
通过确定50%动物传染单位(TCID50)或50%致死剂量(LD50)来表示病毒的滴度。
总结。
以上介绍了几种常用的病毒滴度测定方法,每种方法都有其特点和适用范围。
在进行病毒滴度测定时,需要根据实际情况选择合适的方法,并严格按照操作规程进行操作,以确保测定结果的准确性和可靠性。
希望本文对您有所帮助。
病毒滴度

二、空斑测定法空斑法测定滴度的主要原理是病毒感染细胞后,通过一个感染周期便可再感染邻近细胞,直至形成一个成熟的空斑。
这一方法得到的结果往往最不稳定。
1.5×105细胞/60mm培养皿用5ml DMEM5%培养,3-4小时后等细胞贴壁即可进行病毒感染。
或者在病毒感染前一天加入3×105细胞/60mm培养皿。
2.在12孔板中稀释病毒,储存于-20℃或-80℃备用。
第1个稀释孔将病毒保存液稀释至1ml,其它孔稀释至3ml,大体积可提高可重复性。
稀释浓度原则视病毒浓度而定(纯化还是未纯化的),调节稀释度至10-100个病毒/孔,一般为10-12,这样稀释比大约为10-7~10-12。
稀释:将100ul病毒保存液加入900ul DMEM5%。
用移液器上下吸打5次,此时稀释度为10-1。
换用新枪头将300ul 10-1稀释液加入2.7ml DMEM5%吸打5次,稀释度为10-2。
然后分别取300ul前一稀释液加入2.7ml DMEM5%,形成一系列稀释度,最后4个稀释度用于感染细胞。
注意:每次稀释时都必须换用新枪头。
3.吸去细胞培养液,每个培养皿中加入1ml病毒稀释液和1ml DMEM5%,十字形轻轻晃动混匀,37℃培养90分钟。
4.吸去培养液,按5.2.2中所述加入1.25%琼脂糖培养基。
5.37℃培养,经常注意是否有空斑形成和是否需要加入新鲜培养基。
21天后应该可以看到空斑形成的白色小斑点。
结果:计数有多少个独立的空斑形成,将此数目乘以稀释度即可得到每毫升产生的空斑形成单位(PFU/ml)。
三、50%组织培养感染剂量法此方法基于最高稀释度下在细胞中CPE的形成,它是昆腾公司用于测定滴度的标准方法(一)细胞准备:1.收集一瓶细胞,计数。
2.用DMEM 2%准备20ml 105/ml细胞。
3.用12道排枪在2块96孔板中每孔加入100ul细胞悬液。
(二)准备稀释病毒液1.第1管中加入0.9ml DMEM 2%,其余加入1.8ml。
测定病毒滴度的方法

测定病毒滴度的方法Protocol:1) 转导前一天(第 1 天),胰酶消化细胞并计数细胞密度,按照合适的细胞密度接种到 6 孔板中,能使转染当天的融合度达到 30%-50%。
放置 37℃、 5%CO2 饱和湿度培养箱过夜培养。
例如:如果用HT1080细胞测定滴度,通常一个六孔版的孔接种 2×105 个细胞;2) 转导当天(第 2 天),融解病毒,准备 10 倍稀释系列样品,稀释倍数从 10-2到10-6。
对于每一个稀释样品,用完全培养液稀释病毒至总体积 1mL 。
避免漩涡震荡;3) 去除细胞中的培养液,加入已含有不同病毒量的完全培养液。
另外,保留一孔不添加病毒的细胞,作为空白对照组。
注:每孔加入的培养液的体积应为 1mL ;4) (可选)在含有病毒的培养液中加入聚凝胺,促进病毒感染细胞。
轻轻地摇晃培养板以混匀聚凝胺。
放置 37℃、5%CO2 饱和湿度培养箱过夜培养;注:一般 polybrene 的储液浓度是 6mg/ml (用超纯水配制,-20 度储存,注意分装,反复冻融三次以上将大大降低效果)。
工作浓度是 6ug/ml 。
5) 转染后一天(第 3 天),去除含有病毒的培养液,加入 2mL 新鲜的完全培养液。
放置 37℃、5%CO2饱和湿度培养箱过夜培养;6) 转染后两天(第 4 天),去除培养液,加入含有适当浓度的嘌呤霉素的完全培养液以筛选稳定转导的细胞;7) 每 3 天更换含有嘌呤霉素的新鲜培养液;8) 筛选数天后,可以看到对照组没有活细胞,而添加过病毒的 1 个或者更多个的孔会出现药物抗性的克隆。
去除培养液,用 PBS 洗涤细胞 2 次。
注:筛选所需天数应以对照组的所有细胞死亡为准;9) 先加入95%甲醇固定10min,再 加入结晶紫染色液(6 孔板每孔 1mL )并放置室温孵育10 分钟;10) 去除染色液,用 PBS 洗涤细胞 2 次;11) 计数被染成蓝色的克隆数目,并计算病毒滴度。
病毒滴度的测定

空斑形成单位法测定病毒滴度
空斑显现原理(掌握):空斑形成后,经中性红 活细胞染色,活细胞显示红色,而空斑区细胞 不着色,形成不染色区域。
Procedures
空斑形成单位法测定病毒滴度
适用条件 (熟悉):凡是能在细胞中产生细胞病 变效应 (CPE) 的病毒都可以采用空斑形成法测 定病毒滴度。
(掌握)
Karber法计算CCID50
病毒液稀释度
10-1
(难点、重点)
出现CPE孔的比率
8/8=1
10-2
10-3
8/8=1
7/8=0.875
10-4
10-5
3/8=0.375
1/8=0.125
10-6
0/8=0
lgCCID50=L+d(s-0.5) L: 病毒的最低稀释倍数的对数 L=lg10-1 = -1
病毒滴度的测定ቤተ መጻሕፍቲ ባይዱ
空斑形成单位法测定病毒滴度
原理(重点):适当稀释的病毒悬液与长成单 层的宿主细胞混合,在细胞上覆以营养琼脂培 养基等固体或半固体介质,由于琼脂的限制,
病毒只能感染并破坏临近的细胞,造成细胞溶
解而形成空斑,每个空斑由一个病毒颗粒造成,
计算空斑数量再乘以稀释倍数即可得知原来的
病毒感染单位的浓度。 空斑形成单位(Plaque Forming Units, PFUs)
中性红
(熟悉)
(了解)
(了解)
空斑形成单位试验技术举例 p51-52 防止琼脂凝固; Hanks液? 双抗? 5% CO2
空斑形成单位的计算 (重点)
(掌握)
(熟悉)
(重点)
LD50
ID50
CCID50
(熟悉)
病毒滴度测定方法

病毒滴度测定方法病毒滴度测定方法是一种用于测定病毒在溶液中的浓度的实验方法。
病毒滴度是指单位体积中含有的病毒颗粒数,通常以每毫升(mL)为单位。
病毒滴度的测定对于病毒学研究和疫苗生产具有重要意义。
本文将介绍常见的病毒滴度测定方法及其操作步骤。
一、细胞培养法。
1. 准备培养皿和细胞悬液,将含有适量细胞的培养皿放入培养箱中孵育,直至细胞生长至适当密度。
用无菌PBS或生理盐水洗涤细胞,用含有适量生长培养基的管中悬浮细胞。
2. 制备病毒稀释液,将病毒溶液以一定比例加入生长培养基中,得到一系列不同浓度的病毒稀释液。
3. 感染细胞,将不同稀释度的病毒溶液加入培养皿中的细胞悬液,孵育一定时间后观察细胞形态变化。
4. 计算滴度,根据感染的细胞数量和病毒稀释液的稀释倍数,利用统计学方法计算出病毒的滴度。
二、血凝法。
1. 准备血凝管,将一定量的新鲜血液加入血凝管中,加入适量的病毒溶液,轻轻摇匀。
2. 孵育,将血凝管放置在37摄氏度的恒温箱中孵育一段时间,观察血凝情况。
3. 计算滴度,根据血凝管中凝结的情况,结合之前加入的病毒溶液的稀释倍数,计算出病毒的滴度。
三、组织培养法。
1. 准备组织培养皿和组织细胞,将含有适量细胞的组织培养皿放入培养箱中孵育,直至细胞生长至适当密度。
2. 感染组织细胞,将病毒溶液加入培养皿中的组织细胞,孵育一定时间后观察细胞形态变化。
3. 计算滴度,根据感染的细胞数量和病毒溶液的稀释倍数,利用统计学方法计算出病毒的滴度。
以上是常见的病毒滴度测定方法及其操作步骤,选择合适的方法取决于实验目的、病毒类型和实验条件。
在进行病毒滴度测定实验时,应严格按照操作规程进行,确保实验结果的准确性和可靠性。
希望本文能对病毒滴度测定方法有所了解和帮助。
tcid50法

tcid50法TCID50法是一种常用的病毒滴度测定方法,用于评估病毒溶液中的活性病毒数量。
TCID50是指病毒的50%组织细胞传染性滴度。
病毒滴度是指病毒溶液中含有多少活性病毒颗粒的浓度。
确定病毒滴度的目的是为了量化病毒溶液中的活性病毒数量,从而为研究人员提供准确的病毒浓度信息,用于病毒研究、疫苗制备和药物筛选等领域。
TCID50法是通过对细胞培养物进行稀释接种,然后观察细胞的病毒感染情况来测定病毒滴度的一种方法。
具体操作过程如下:将细胞培养物均匀地分配到培养皿中。
然后,将病毒溶液进行一系列的稀释,每次稀释一倍,得到一系列的稀释液。
接下来,将每个稀释液滴加到培养皿中的不同孔上。
然后,将培养皿放入恒温培养箱中,让病毒与细胞进行接种。
接种一段时间后,观察培养皿中细胞的感染情况。
可以通过显微镜观察细胞形态的变化,或者通过染色等方法来观察病毒感染的细胞。
根据感染细胞的数量和稀释液的稀释倍数,计算出病毒的TCID50值。
通常,TCID50值是通过统计病毒感染和未感染细胞的比例来计算的。
TCID50值越高,表示病毒的传染性越低;而TCID50值越低,表示病毒的传染性越高。
因此,通过TCID50值可以评估病毒的感染能力和传播能力。
TCID50法具有操作简单、结果可靠的优点,因此被广泛应用于病毒研究和疫苗制备过程中。
通过测定病毒的TCID50值,可以帮助研究人员评估病毒的传播能力和感染能力,从而指导病毒研究和疫苗制备的实验设计。
TCID50法是一种常用的病毒滴度测定方法,通过对细胞培养物进行稀释接种,然后观察细胞的病毒感染情况来测定病毒滴度。
通过测定病毒的TCID50值,可以评估病毒的传播能力和感染能力,为病毒研究和疫苗制备提供准确的病毒浓度信息。
病毒滴度测定

病毒滴度测定有很多名词都用来描述病毒溶液的滴度。
1. VP(病毒颗粒)或OPV(光学颗粒单位)2. GTU(基因转移单位)或转导颗粒(BFU即蓝点形成单位,与GTU类似)3. PFU(空斑形成单位)4. TCID50(50%组织培养感染剂量)不同的概念缘于不同的滴度测定方法,这些方法包括2类:物理方法(VP)和生物学方法(GTU、PFU、TCID50)。
1.测定VP的方法是测定病毒颗粒在260nm处的吸光度(病毒DNA和蛋白的总吸光度中主要为DNA),1个OD值相当于1.1×1012个病毒颗粒。
用这种方法进行测定在各个实验室中都较为稳定,但它不能区分感染性和缺陷性病毒颗粒。
因此这种方法只能提供病毒的量,至于质,比如是否含有缺陷性颗粒则没有考虑在内。
2. GTU则测定感染后能表达报告基因的细胞数量。
这个过程中,病毒将DNA转入细胞,在一个感染周期结束前立即测定表达报告基因的细胞。
如果重组腺病毒含有报告基因如GFP 或LacZ等则可以用这种方法进行测定,病毒保存液通常不用这种方法来进行描述。
3. PFU是测定腺病毒滴度最早的标准方法,主要测定单层细胞培养中病毒裂解空斑的形成。
空斑形成需要许多个感染周期,得到最终结果通常需要三个星期。
一般来说,这种方法得到的结果很少能在其它实验室重复,即使在同一实验室内,不同技术员操作也很少能得到相同的结果。
4. TCID50已被用于测定许多种病毒的滴度,但以前并不用于腺病毒。
病毒稀释液与细胞在96孔板进行培养,然后监测每孔是否CPE。
TCID50方法相对PFU方法而言有几个优点,如速度是PFU的2倍,结果更具预料性,在不同操作个体间也更稳定。
所有生物学方法所得到的结果在不同实验室之间往往有所差异,它主要与病毒感染方法有关。
许多因素如加入的病毒储存液的量、管子的类型、培养的时间、细胞和培养液的量等都会影响结果。
最近,出现了两种测定病毒滴度的改良方法。
一种是用更小体积的病毒液进行感染并在感染过程中不断晃动培养板(Mittereoler等,1996);另一种方法则在感染时将培养板进行离心(1000 RCF90分钟)(Nyberg-Hoffman等,1997)。
病毒滴度测定知识讲解

可以采用倍比稀释来测定病毒的滴度。
第一个Ep管中加入10uL病毒原液,记为1E+1 uL ;第二个Ep管中进行了第一次十倍稀释,所得病毒原液为第一个Ep中的1/10,记为1E+0 uL;第三个Ep管中进行了第二次十倍稀释,所得病毒原液为第二个Ep中的1/10,记为1E-1 uL ;依次类推…第七个Ep管中进行了第六次十倍稀释,所得病毒原液为第六个Ep中的1/10,记为1E-5 uL ;第八个Ep管中进行了第七次十倍稀释,所得病毒原液为第七个Ep中的1/10,记为1E-6 uL ;换句话说:如果在加入1E-5 uL 病毒原液的孔中观察到3个带有荧光的细胞,说明该孔中至少有3个病毒颗粒感染了细胞,则该病毒的滴度等于带有荧光的细胞数除以病毒原液量,本例子中就是3/(1E-5)=3E+5,单位为TU/ uL ,也就等于3E+8 TU/mL。
稀释计数法滴度单位:TU/mL,指每毫升中含有的具有生物活性的病毒颗粒数。
「TU」为「transducing units」的缩写,中文为「转导单位」,表示可以感染并进入到靶细胞中的病毒基因组数。
第一天细胞准备将生长状态良好的293 T 细胞消化计数后稀释至1×100 000/mL,加入96 孔板,100 μL/孔,为每个病毒准备10 个孔。
放入37℃,5% 二氧化碳培养箱中培养。
第二天加病毒在EP 管中做10 倍梯度稀释,连续10 个稀释度。
稀释方法如下:每种病毒准备10 个1.5mL EP 管,每管加入90 μL 培养液,往第一个管中加入10 μL 病毒原液,混匀后,吸取10 μL 加入第二个管混匀。
依此类推,做十个稀释度(10—0.00000001)。
吸取96 孔板中原有的培养基,加入含稀释好的病毒液。
并做好标记。
第三天追加培养液在每个孔再加入100 μL 完全培养液,利于细胞的生长。
第四天观察结果并计算滴度在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。
病毒滴度测定方法

病毒滴度测定方法病毒滴度测定是一种用于测定病毒浓度的方法,通常用于病毒学研究和疫苗生产中。
病毒滴度测定的结果可以帮助科研人员和生产工作者准确地了解病毒的数量,为后续的实验和生产提供重要参考。
本文将介绍病毒滴度测定的常用方法及操作步骤。
首先,进行病毒滴度测定需要准备一定数量的培养皿或培养瓶。
在实验操作前,需要将培养皿或培养瓶进行消毒处理,以避免外源细菌的污染对实验结果的影响。
另外,还需要准备好相应的培养基和试剂,以及需要测定的病毒样品。
接下来,将培养皿或培养瓶按照实验要求进行编号,并分别加入适量的培养基。
然后,将待测病毒样品按照一定的稀释倍数进行稀释,并将不同稀释倍数的样品分别滴入已加入培养基的培养皿或培养瓶中。
在滴定完成后,将培养皿或培养瓶进行培养,培养时间根据不同病毒的特性而定,通常在37摄氏度下培养24-72小时。
培养结束后,观察培养皿或培养瓶中的细胞形态和数量,根据病毒感染的细胞数量和形态变化来确定病毒滴度。
通常情况下,病毒感染的细胞数量越多,病毒滴度越高。
在观察完毕后,可以根据所用的稀释倍数和感染细胞的数量来计算病毒的滴度。
除了上述介绍的常规方法外,还有一些改良的病毒滴度测定方法,如TCID50法、PFU法等。
这些方法在实际应用中有其特定的优势和适用范围,可以根据实际需求选择合适的方法进行病毒滴度测定。
总之,病毒滴度测定是病毒学研究和疫苗生产中不可或缺的重要实验方法之一。
通过本文的介绍,相信读者对病毒滴度测定方法有了更清晰的认识,希望能对相关领域的科研人员和生产工作者有所帮助。
病毒滴度测定

稀释计数法滴度单位:TU/mL,指每毫升中含有的具有生物活性的病毒颗粒数。
「TU」为「transducing units」的缩写,中文为「转导单位」,表示可以感染并进入到靶细胞中的病毒基因组数。
第一天细胞准备将生长状态良好的293 T 细胞消化计数后稀释至1×100 000/mL,加入96 孔板,100 μL/孔,为每个病毒准备10 个孔。
放入37℃,5% 二氧化碳培养箱中培养。
第二天加病毒在EP 管中做10 倍梯度稀释,连续10 个稀释度。
稀释方法如下:每种病毒准备10 个1.5mL EP 管,每管加入90 μL 培养液,往第一个管中加入10 μL 病毒原液,混匀后,吸取10 μL 加入第二个管混匀。
依此类推,做十个稀释度(10—0.00000001)。
吸取96 孔板中原有的培养基,加入含稀释好的病毒液。
并做好标记。
第三天追加培养液在每个孔再加入100 μL 完全培养液,利于细胞的生长。
第四天观察结果并计算滴度在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。
假设为X 和Y,则滴度(TU/mL)=(X+Y×10)×1000/2/X 孔的病毒液的含量(μL)。
定量PCR 法病毒感染1 天前,取6 孔板接种HOS 细胞。
每孔细胞为5×100 000 个。
接种细胞24 小时后,取两个孔的细胞用血球计数板计数,确定感染时细胞的实际数目,记为N。
弃去其他培养板中的培养基,更换为含有5 μg/mL polybrene 的新鲜培养基。
将浓缩病毒用培养基稀释200 倍,也就是取1 μL 病毒加入到199 μL 的培养基中。
在3 个培养孔中分别加入0.5 μL,5 μL 和50 μL 的稀释病毒。
感染开始后20 小时,除去培养上清,换为500 μL 含DNaseI 的新鲜培养基。
在37℃消化15 分钟,这一步是要除去残余的质粒DNA。
然后换为2 mL 正常的培养基,继续培养48 小时。
滴度测定方法

滴度测定方法简介:
1、细胞准备将生长状态良好的 293T 细胞消化计数后稀释至1x105/ml,
加入96孔板,100ul/孔,为每个病毒准备6 个孔。
放入37℃,5%CO2 培养箱中培养。
2、加病毒第二天,在 EP 管中做3 倍梯度稀释,连续6 个稀释度。
稀释方法如下:每种病毒准备6 个1。
5mlEP 管,每管加入90ul 培养液,往第一个管中加入10ul 病毒原液,混匀后,吸取10ul 加入第二个管混匀。
以此类推,做十个稀释度(10~3*10-3)。
3 、追加培养液第三天,吸去带有病毒的培养液,在每个孔中再加入100ul 完全培养液,以利于细胞的生长。
4、观察结果并计算滴度第五天,在荧光显微镜下观察结果。
滴度(PFU/ml)=细胞数*荧光百分比*MOI*病毒稀释倍数*103
汉恒生物科技(上海)有限公司400-092-0065
地址:上海市张江高科技园区蔡伦路150号1号楼021-********
邮箱:service@ 。
慢病毒滴度测定方法简介

慢病毒滴度测定方法简介(表达荧光的慢病毒)Day 0:将生长状态良好的293T 细胞消化计数后稀释至1⨯105/ml, 加入96孔板,100 μl/孔(1⨯104个细胞),每种病毒需要6个孔。
放入37℃,5% CO2培养箱中培养过夜。
Day 1: 在EP 管中做10倍梯度稀释,连续6个稀释度。
稀释方法如下:每种病毒准备6个1.5 ml EP 管,每管加入90 μl完全培养基,往第一个管中加入10 μl病毒原液,混匀后,吸取10 μl 加入第二个管混匀。
以此类推。
然后把稀释好的病毒和细胞孵育过夜。
Day 2:吸去带有病毒的培养液,在每个孔中再加入100 μl 完全培养液,以利于细胞的生长。
Day 3:显微镜观察荧光。
此时荧光会有初步表达。
Day 4:在荧光显微镜下观察结果,对荧光比例合适(10-30%之间)的孔进行细胞计数,并计算滴度。
其计算公式如下:滴度(TU/ml)=细胞数⨯荧光百分比⨯103/病毒原液体积(μl)。
举例:③号管对应孔的荧光比例为30%,细胞总数为8⨯104,滴度(TU/ml)=8⨯104⨯30%⨯103/0.1=2.4⨯108如果要感染2×105个细胞,MOI=30(1个细胞对应30个病毒粒子)(见下注),则需要病毒体积为=2×105⨯30/2.4⨯108(ml)=0.025 ml=25 μl.注:MOI值: MOI 是multiplicity of infection的缩写,中文译为感染复数,实际的含义即为每个细胞被多少个有活力病毒所感染。
各种细胞的最适MOI值有差别,请客户正式实验前先进行预实验摸索最适MOI。
病毒滴度测定

病毒滴度测定有很多名词都用来描述病毒溶液的滴度。
1.VP(病毒颗粒)或OPV(光学颗粒单位)2.GTU(基因转移单位)或转导颗粒(BFU即蓝点形成单位,与GTU类似)3.PFU(空斑形成单位)4.TCID50(50%组织培养感染剂量)不同的概念缘于不同的滴度测定方法,这些方法包括2类:物理方法(VP)和生物学方法(GTU、PFU、TCID50)。
1.测定VP的方法是测定病毒颗粒在260nm处的吸光度(病毒DNA和蛋白的总吸光度中主要为DNA),1个OD值相当于1.1×1012个病毒颗粒。
用这种方法进行测定在各个实验室中都较为稳定,但它不能区分感染性和缺陷性病毒颗粒。
因此这种方法只能提供病毒的量,至于质,比如是否含有缺陷性颗粒则没有考虑在内。
2.GTU则测定感染后能表达报告基因的细胞数量。
这个过程中,病毒将DNA转入细胞,在一个感染周期结束前立即测定表达报告基因的细胞。
如果重组腺病毒含有报告基因如GFP或LacZ等则可以用这种方法进行测定,病毒保存液通常不用这种方法来进行描述。
3.PFU是测定腺病毒滴度最早的标准方法,主要测定单层细胞培养中病毒裂解空斑的形成。
空斑形成需要许多个感染周期,得到最终结果通常需要三个星期。
一般来说,这种方法得到的结果很少能在其它实验室重复,即使在同一实验室内,不同技术员操作也很少能得到相同的结果。
4.TCID50已被用于测定许多种病毒的滴度,但以前并不用于腺病毒。
病毒稀释液与细胞在96孔板进行培养,然后监测每孔是否CPE。
TCID50方法相对PFU方法而言有几个优点,如速度是PFU的2倍,结果更具预料性,在不同操作个体间也更稳定。
所有生物学方法所得到的结果在不同实验室之间往往有所差异,它主要与病毒感染方法有关。
许多因素如加入的病毒储存液的量、管子的类型、培养的时间、细胞和培养液的量等都会影响结果。
最近,出现了两种测定病毒滴度的改良方法。
一种是用更小体积的病毒液进行感染并在感染过程中不断晃动培养板(Mittereoler等,1996);另一种方法则在感染时将培养板进行离心(1000 RCF90分钟)(Nyberg-Hoffman等,1997)。
病毒滴度的测定

病毒滴度的测定◆病毒感染的测量方法–直接计数法将病毒与乳胶颗粒混合,电子显微镜观测缺点是无法判断病毒的感染性–间接计数法空斑形成单位(plaque forming units,PFUs)50%终点法血凝试验干扰滴定第一节空斑形成单位法一、基本原理◆原理–空斑形成单位(plaque forming units,PFUs)试验:将不同稀释倍数的病毒与平铺于平板表面的宿主细胞混合,当病毒感染时会造成宿主细胞溶解而形成空斑,每个空斑系由一个病毒颗粒引起,计数空斑数目再乘稀释倍数,得病毒感染的浓度–病毒空斑—蚀斑将病毒稀释后移入单细胞培养瓶中,吸附1h后,覆盖营养琼脂病毒在琼脂中只感染临近的细胞,形成空斑的退化细胞区中性红染色:活细胞染红色;死细胞无色产生CPU的病毒均可用此方法二、方法与步骤◆测定病毒空斑的试验方法–病毒杀死感染细胞的检测:产生细胞病变效应中型红:活细胞染红色台盼兰:死细胞染蓝色M TT:溴化二苯基四氮唑,将活细胞染成深蓝色,易于计数,易分离病毒转化或有抵抗力的细胞–未能杀死细胞可产生血凝素因能吸附红细胞,空斑用血吸附显出用显微镜计数吸附红细胞的空斑–细胞融合:病毒感染细胞与临近的未感染细胞融合形成多核细胞,用显微镜观查合胞体空斑–空斑中含有病毒的抗原免疫荧光分析–免疫组化技术生物素-抗生物素-过氧化物酶染色技术间接免疫过氧化物酶染色三、空斑形成单位法测定病毒滴度的计算◆空斑形成单位试验技术–传代细胞平皿法单层细胞浓度为2×106,培养液为RPMI1640,Eagle,MEM病毒液稀释在冰浴盘作10倍稀释,每个稀释度培养2瓶,每加一次样时要新吸管,来回吸三次,加至培养瓶无细胞层的瓶壁底角再倾斜来回摇动,使病毒均匀C O2孵箱吸附90min后,再用营养琼脂覆盖培养5~8d后,加入0.01%的中性红染色,计数空斑◆病毒滴度的计数–按以下公式计算空斑形成单位(PFUs/ml) = d vn n ∙∙X +X +X 21 X1、X2、Xn :表示同一稀释度在不同培养孔板(实验单位)中数得到的空斑数;n 表示计数空斑的培养板孔数;v 表示病毒量(ml );d 表示稀释倍数例:以稀释成10-4的病毒悬液感染细胞,四个培养板孔中的空斑数分别为1,1,3及5个,接种量为0.2 ml空斑形成单位(PFUs/ml) = 4100.245311⨯⨯+++ = 1.25×105PFUs/ml ◆ 空斑形成单位(PFUs )与重复感染数(M.O.I )– 重复感染数(Mutiplicity of Infection ,M.O.I )是指感染一个细胞的病毒颗粒的平均数– 一般来说, M.O.I 值越大,则实验细胞被感染的比例越大– 若某病毒的PFUs 已经测得,要按一定量的M.0.I 进行感染细胞时则所需的病毒量可按公式1和2计算公式1:实验细胞数×所需的M.O.I 值=所需的PFUs公式2:所需的PFUs/实际病毒的PFUs=需要加的病毒量例:已知某病毒的滴度为1.3×1011 PFUs/ml ,试验细胞数为每孔1.8×106,计划M.O.I 值为200。
计算病毒滴度方法(ReedandMench法)
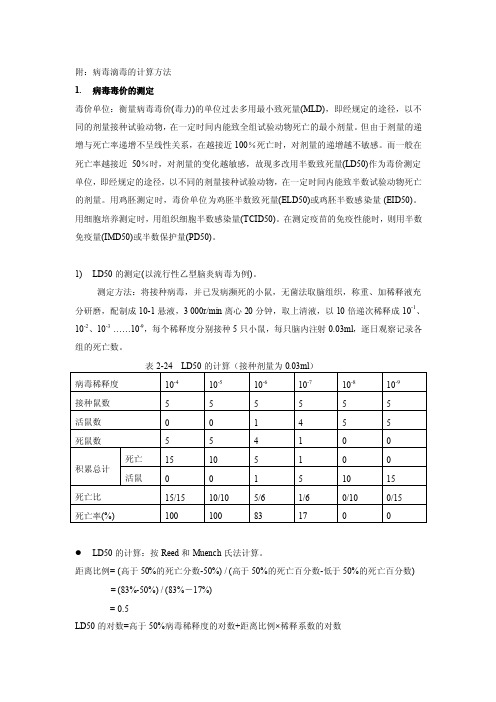
附:病毒滴毒的计算方法1.病毒毒价的测定毒价单位:衡量病毒毒价(毒力)的单位过去多用最小致死量(MLD),即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致全组试验动物死亡的最小剂量。
但由于剂量的递增与死亡率递增不呈线性关系,在越接近100%死亡时,对剂量的递增越不敏感。
而一般在死亡率越接近50%时,对剂量的变化越敏感,故现多改用半数致死量(LD50)作为毒价测定单位,即经规定的途径,以不同的剂量接种试验动物,在一定时间内能致半数试验动物死亡的剂量。
用鸡胚测定时,毒价单位为鸡胚半数致死量(ELD50)或鸡胚半数感染量 (EID50)。
用细胞培养测定时,用组织细胞半数感染量(TCID50)。
在测定疫苗的免疫性能时,则用半数免疫量(IMD50)或半数保护量(PD50)。
1)LD50的测定(以流行性乙型脑炎病毒为例)。
测定方法:将接种病毒,并已发病濒死的小鼠,无菌法取脑组织,称重、加稀释液充分研磨,配制成10-1悬液,3 000r/min离心20分钟,取上清液,以10倍递次稀释成10-1、10-2、10-3……10-9,每个稀释度分别接种5只小鼠,每只脑内注射0.03ml,逐日观察记录各组的死亡数。
LD50的计算:按Reed和Muench氏法计算。
距离比例= (高于50%的死亡分数-50%) / (高于50%的死亡百分数-低于50%的死亡百分数) = (83%-50%) / (83%-17%)= 0.5LD50的对数=高于50%病毒稀释度的对数+距离比例×稀释系数的对数本例高于50%病毒稀释度的对数-6,距离比例为0.5,稀释系数的对数为-1。
代入上式:LgLD=-6+0.5×(-1)=-6.5则LD50=10-6.5,0.03ml,(10-6.5也写作10E-6.5),即该病毒作10-6.5稀释,接种0.03ml 能使半数小鼠发生死亡。
注意:稀释血清法中和试验,计算TCID50或LD50,MID50时,计算公式应改为:TCID50的对数=高于50%血清稀释度的对数-距离比例×稀释系数的对数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可以采用倍比稀释来测定病毒的滴度。
第一个Ep管中加入10uL病毒原液,记为1E+1 uL ;第二个Ep管中进行了第一次十倍稀释,所得病毒原液为第一个Ep中的1/10,记为1E+0 uL;第三个Ep管中进行了第二次十倍稀释,所得病毒原液为第二个Ep中的1/10,记为1E-1 uL ;依次类推…第七个Ep管中进行了第六次十倍稀释,所得病毒原液为第六个Ep中的1/10,记为1E-5 uL ;第八个Ep管中进行了第七次十倍稀释,所得病毒原液为第七个Ep中的1/10,记为1E-6 uL ;换句话说:如果在加入1E-5 uL 病毒原液的孔中观察到3个带有荧光的细胞,说明该孔中至少有3个病毒颗粒感染了细胞,则该病毒的滴度等于带有荧光的细胞数除以病毒原液量,本例子中就是3/(1E-5)=3E+5,单位为TU/ uL ,也就等于3E+8 TU/mL。
稀释计数法滴度单位:TU/mL,指每毫升中含有的具有生物活性的病毒颗粒数。
「TU」为「transducing units」的缩写,中文为「转导单位」,表示可以感染并进入到靶细胞中的病毒基因组数。
第一天细胞准备将生长状态良好的293 T 细胞消化计数后稀释至1×100 000/mL,加入96 孔板,100 μL/孔,为每个病毒准备10 个孔。
放入37℃,5% 二氧化碳培养箱中培养。
第二天加病毒在EP 管中做10 倍梯度稀释,连续10 个稀释度。
稀释方法如下:每种病毒准备10 个1.5mL EP 管,每管加入90 μL 培养液,往第一个管中加入10 μL 病毒原液,混匀后,吸取10 μL 加入第二个管混匀。
依此类推,做十个稀释度(10—0.00000001)。
吸取96 孔板中原有的培养基,加入含稀释好的病毒液。
并做好标记。
第三天追加培养液在每个孔再加入100 μL 完全培养液,利于细胞的生长。
第四天观察结果并计算滴度在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。
假设为X 和Y,则滴度(TU/mL)=(X+Y×10)×1000/2/X 孔的病毒液的含量(μL)。
定量PCR 法病毒感染1 天前,取6 孔板接种HOS 细胞。
每孔细胞为5×100 000 个。
接种细胞24 小时后,取两个孔的细胞用血球计数板计数,确定感染时细胞的实际数目,记为N。
弃去其他培养板中的培养基,更换为含有5 μg/mL polybrene 的新鲜培养基。
将浓缩病毒用培养基稀释200 倍,也就是取1 μL 病毒加入到199 μL 的培养基中。
在3 个培养孔中分别加入0.5 μL,5 μL 和50 μL 的稀释病毒。
感染开始后20 小时,除去培养上清,换为500 μL 含DNaseI 的新鲜培养基。
在37℃消化15 分钟,这一步是要除去残余的质粒DNA。
然后换为2 mL 正常的培养基,继续培养48 小时。
用0.5 mL 0.25% 胰酶-EDTA 溶液消化细胞,在37℃放置1 分钟。
用培养基吹洗下,离心收集细胞。
按照DNeasy 试剂盒的说明抽提基因组DNA 。
每个样品管中加入200 μL 洗脱液洗下DNA 。
用DNA 定量试剂盒定量(Bio-Rad)。
基因组DNA 可以稳定保存在-20℃至少两个月。
准备PCR 所需的试剂和样品。
为病毒序列检测引物配总管Ⅰ:Forward primer (100 pmol/mL):0.1μL ×nReverse primer (100 pmol/mL):0.1μL ×nProbe (100 pmol/mL):0.1μL ×n水:19.7 μL ×nn = number of reactions。
例如:总反应数为40,将1 mL 2×TaqMan Universal PCR Master Mix,4 μL forward primer,4 μL reverse primer,4 μL probe 和788 μL 水混和。
震荡后放在冰上。
2×T aqMan Master Mix:25 μL ×n10×RNaseP primer/probe mix:2.5 μL ×n水:17.5 μL ×nn = number of reactions。
例如:总反应数为40,将1 mL 2×TaqMan Universal PCR Master Mix,100 μL 10×RNaseP primer/probe mix 和700 μL 水混和。
震荡后放在冰上。
在预冷的96 孔PCR 板上完成PCR 体系建立。
从总管Ⅰ中各取45 μL 加入到A-D 各行的孔中,从总管Ⅱ中各取45 μL 加入到E-G 各行的孔中。
分别取5 μL 质粒标准品和待测样品基因组DNA 加入到A-D 行中,每个样品重复1 次。
另留1 个孔加入5 μL 的水做为无模板对照(no-template control)。
分别取5 μL 基因组标准品和待测样品基因组DNA 加入到E-G 行中,每个样品重复1 次。
另留1 个孔加入5 μL 的水做为无模板对照(no-template control)。
所使用定量PCR 仪为ABI PRISM 7000 定量系统。
循环条件设定为:50℃2 分钟,95℃10 分钟,然后是95℃15 秒,60℃1 分钟的40 个循环。
数据分析:测得的DNA 样品中整合的慢病毒载体拷贝数用基因组数加以标定,得到每基因组整合的病毒拷贝数。
滴度(integration units per mL,IU/mL)的计算公式如下:IU/mL= (C ×N×D×1000)/V其中:C = 平均每基因组整合的病毒拷贝数;N = 感染时细胞的数目(约为1×100000)D = 病毒载体的稀释倍数;V = 加入的稀释病毒的体积数。
96孔板病毒滴定实验方法总结一看了前面一个关于病毒滴定方法的帖子,自己也做过不少次,所以想写出一点儿,算是个总结,希望能对各位有所帮助.这里我写2种方法,一种是在稀释好的病毒液里加细胞悬液.另一种是在长成单层的细胞上,加入已经稀释好的病毒液.这两种方法我都做过,效果各有长处.1.一个确定的地方是,所用细胞是贴壁生长,所以在维持液或者生长液中都不能加入胰酶,这一点和流感病毒病毒滴定测定有很大不同;2.稀释液配方:MEM(或DMEM)+1%双抗+NaHCO3(加入量由所需要pH值确定,一般以加到pH7.0为主,可用pH试纸测定,NaHCO3的浓度为6%).另,MEM,或DMEM的选择由所培养的宿主细胞决定;3.细胞悬液为细胞+生长液(MEM+10%小牛血清+3%谷氨酰胺+1%双抗+NaHCO3).在加细胞悬液的病毒滴定测定方法中,如果不加入细胞生长液,则细胞无法贴壁;方法一.在稀释好的病毒液中加入细胞悬液:1.一个确定的地方是,所用细胞是贴壁生长,所以在维持液或者生长液中都不能加入姨酶,这一天和流感病毒病毒滴定测定有很大不同;2.稀释液配方:MEM(或DMEM)+1%双抗+NaHCO3(加入量由所需要pH值确定,一般以加到pH7.0为主,可用pH试纸测定,NaHCO3的浓度为6%).另,MEM,或DMEM的选择由所培养的宿主细胞决定;3.细胞悬液为细胞+生长液:MEM+10%小牛血清+3%谷氨酰胺+1%双抗+NaHCO3加细胞悬液的病毒滴定测定方法中,如果不加入细胞生长液,则细胞无法贴壁;4.96孔板上做10倍稀释病毒,从10-1开始,一般做5-6个稀释度,即到10-5或10-6即可,每孔25微升,每个稀释度做4孔,或者8孔,一般做4孔即可;5.消化细胞,并用生长液反复吹打细胞,使细胞充分混允,放入双碟,用排枪将细胞悬液加入相应孔中,每孔100微升;6.细胞对照孔:125微升细胞悬液,不加病毒;7.关于96孔板,每孔接种的细胞量:一般在此种测定病毒滴度的方法下,要将细胞密度适当调低,至少要比正常传代时低一些,否则细胞生长速度过快,未到7天则细胞出现死亡,对观察CPE不利.一般情况下,小塑料瓶(8-9ml液体为正常用量),培养长慢单层后,消化细胞,加入6ml培养液,吹匀,吸出其中的2ml,到另外的瓶子,在该瓶中加入14-16ml即可,如果不放心,可以用显微镜看一下,细胞数过多则补加培养液,少则补加剩余4ml 的细胞悬液;8.37oC, 5%CO2培养7天左右,每天观察结果,从出现CPE的第一天开始记录,一般第7天可以计算病毒滴度;9.计算公式,比较复杂,明天再附上,这里介绍一个简单的计算TCID50的方法:由以上公式求得0.6 加到僅高於50﹪感染率稀釋指數( 此例中為10-3 )得10-3.6<即為病毒作10-3.6稀釋後每0.1ml 含1 TCIP50,亦即該病毒之力價為10-3.6/0.1ml。
这里是以每个稀释度8孔为例,如果做的是4孔一个稀释度,则对应的换一下数字即可.(这里是转自别人的帖子,但是我用了之后觉得比那个很长的公式容易得多,所以推荐给大家)10.本方法的优点:不容易污染;缺点:①.细胞生长周期长,出结果所需时间也长,一般要到第7天才能计算病毒滴度;②. 病毒本身有毒性,所以对细胞的贴壁造成一定影响,这也是此法中细胞生长慢的原因之一;③. 不容易控制细胞数量,需要经验,一旦细胞数量过多,则不到第7天细胞大量死亡,无法判断CPE;若细胞数量过少,则细胞无法正常生长,不能正常增殖,也是造成无法判断CPE的原因之一;还有另外一种方法,明天再写.如果有什么不恰当的地方,希望有经验的高手多多指教,希望大家能多多交流,谢谢!4.维持液,即病毒培养液,配方为:①.MEM+2%小牛血清+3%谷氨酰胺+1%双抗+NaHCO3;②. MEM+3%谷氨酰胺+1%双抗+NaHCO3;两种维持液的不同在于是否有FBS(小牛血清).我个人曾经做过实验,在状态很好的细胞上接种病毒,分别使用两种不同的维持液,最终结果是一样的,没有什么不同,所以可以根据个人需要进行选择.另外,曾经请教过专门做中和实验的老师,他认为适当的FBS对细胞有保护作用,而且他说这是国外文献上的报道.。
