初中化学_物质间的转化关系PPT课件
《物质的转化》PPT(第3课时)

合 练
的是 ( C )
A.①
B.②
C.③
D.④
图B2-5-9
解析规律方
[解析] 氢氧化锌和稀盐酸反应,生成氯化锌和水;锌与稀盐酸反 应,生成氯化锌和氢气;碱和盐反应时,碱必须是可溶性碱,而氢氧
法 综
化锌不溶于水,所以不能用于制取氯化锌;锌和氯化铜反应,生成
合 氯化锌和铜。
练
解析规律方
8.[2018·绍兴] 如图B2-5-10所示,围棋棋盘上有五枚棋子,代 表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻
合
练
C 硝酸银 铁 碳酸钙 氢氧化钡 稀盐酸
D
铁 氢氧化钡 碳酸钙 硝酸银 稀盐酸
[答案]A
图B2-5-10
解析规律方
9.如图B2-5-11所示为A、B、C、D、E五种不同类别物质卡 片组成的“化学拼图”,相邻两张卡片所标的物质(或其溶液)
法 综
之间能发生反应。
合 练
(1)参照上述拼图,写出制备氯化铁的
谢 谢 观 看!
法 综
液的溶质是AgNO3或Hg(NO3)2。
合
练
自|我|提|升
13.某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几 种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加 入Ba(OH)2溶液质量的关系如图B2-5-15所示。下列说法正
确的是( )
A.HCl和H2SO4一定存在
练 与酸发生了置换反应;②A+C,是酸与金属氧化物反应生成盐和
水,属于复分解反应;③C+D,是某些非金属氧化物与碱溶液反应
生成盐和水,不属于复分解反应;④A+E,是酸与某些盐反应生成
新盐和新酸,属于复分解反应;⑤A+D,是酸与碱发生了反应生成
人教版物质的分类及转化PPT完美课件1

1.作者对“为什么我们会如此平庸”的思考 很有现 实针对 性,既 暴露了 问题, 也进行 了如何 解决问 题的思 考。
2.丰富的情感是人生发展最重要的推动力, 只要心 中有爱 就能免 于孤立 的生存 ,就能 创造杰 出人生 。
3.爱因斯坦认为提出问题比解决问题更重要 的意思 是,提 出一个 新的问 题意味 着我们 的生命 空间开 拓出新 的疆域 。
17. A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3 中的一种.已知:
①A与B反应有气体生成; ②B与C反应有沉淀生成; ③C与D反应有沉淀生成;
HC
④D与E反应有沉淀生成; ⑤A与E反应有气体生成; ⑥②和③的反应中生成的沉淀是同一种物质。
请填空:
(4)④中反应的化学方程式是
。பைடு நூலகம்
在工业生产中要制取某种物质,除了要考虑反应的可能性还需要考虑: 1、原料来源 2、成本高低 3、设备要求
化学帮助工业在不断探索创 新,这类工作不仅与经济发 展、社会进步密切相关,而 且是材料、生命、环境、能 源和信息等现代科学技术发 展的重要基础
完成书本P.12①③④⑦
碳酸钙 CaCO3
我可以通过石灰石(CaCO3)得到哪些物质呢?
CaCl2 盐 CO2(实酸性验室制CO2)
氧化物
碳酸盐钙 CaCO3
加热
CaO生石灰
碱性 氧化物
H2O
Ca(OH)熟石碱 灰
非金属
O2
非金属 氧化物
盐 盐
气
盐体
酸性氧化物或 碱性氧化物
H2O
酸
盐水
碱、碱性氧化物
金属 盐 碱
酸盐
盐
《物质的分类及转化》PPT课件

学习了分类的方法以后,大家应学会对以前和将要学的化学知识进行及时的归 纳和整理,学会对物质及其变化进行分类,并通过对各类物质的代表物质的研 究来了解这类物质的性质,从而提高我们化学学习的效率。
以下每组中都有一种物质与其他物质在分类上不同,试找出这种物质并说明理由。
电荷,使胶体粒子聚集成较大的颗粒,形成沉淀从分散剂里析出,这个过程
叫做聚沉。
②参加带相反电荷胶粒的胶体——破坏胶粒的带电结构。
③加热升温或搅拌—— 增加碰撞时机。
(4)净化胶体的方法——渗析法。 渗析:利用半透膜把胶体中混有的离子或分子从胶体溶液中别离出来的操作。 原理:溶液中的离子或小分子能透过半透膜,胶体微粒不能透过半透膜,从而使 胶体中混杂的分子或离子进入水中而除去。 操作:将某水溶胶盛于半透膜〔如鸡蛋膜或小肠膜〕制作的渗析袋中,置于流动 的蒸馏水里一段时间即可除去胶体中的小分子或离子。
胶体发生电泳现象说明 [Fe(OH)3]胶体颗粒带电荷
电泳的应用:1、判断胶粒的电性 2、提纯和精制胶体 3、使胶体聚集而沉淀 4、工业除尘
3.聚沉:胶体形成沉淀析出的现象。
胶体介稳性的破坏
中和或降低胶体粒子所带的电荷
其方法主要有:
①参加电解质溶液,由于参加的阳离子〔或阴离子〕中和了胶体粒子所带的
无现象产生
原因分析
胶体的直径在1~100nm之间,能使 光波发生散射
溶液中粒子的直径小于1nm,散 射极其微弱
丁达尔现象〔丁达尔效应〕
光束通过胶体时形成一 条光亮的通路。
溶液
胶体
当一束强光透过胶体时,可以看到一条光亮的通路,这种现象叫做丁达尔现象 〔或丁达尔效应〕。
九级化学物质转化关系图

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡1 / 32 /3 ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2O NaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 2 8、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻CaCO3Na2CO3CO2CO2NaOHNa2CO3CO2O2H2ONaOH NH4ClNH3⑼⑽⑾⑿3 / 3。
第2课时 物质的转化

1.根据物质的性质分类,CH3COOH属于
A.碱
B.四元酸
( C)
C.一元酸
D.盐
解析:CH3COOH在水溶液中电离出一个H+,属于一元酸。
2.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和
所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已
知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,则下列
D.与碱性氧化物反应生成盐和水
解析:酸使紫色石蕊溶液变红色,故A错误;酸能和碱反应生成盐 和水,属于酸的通性,故B正确;酸与活泼金属反应生成盐和氢气,属 于酸的通性,故C正确;酸可以和碱性氧化物反应生成盐和水,属于酸 的通性,故D正确。
4.碱溶液中都含有OH-,因此不同的碱表现出一些共同的性质。
基本反应类型
__复__分__解__反__应__ 复分解反应 复分解反应
现象或化学方程式
基本反应类型
盐的 主要 化学 性质
与酸反应 与碱反应
Na2CO3 + 2HCl=== 2_N_a_C__l+___H_2_O_ __+__C__O_2_↑___
Ca(OH)2 + Na2CO3===CaCO3↓ + 2NaOH
写出下列有关序号的化学方程式并注明反应类型:
化学方程式
①_____2_C__a_+__O__2=__=_=_2_C__a_O_____ ②______C_a_O__+__H__2O__=_=__=_C_a_(_O__H__)2_____ ③_C__a_(_O_H__)_2+___N_a_2_C_O__3_=_=_=_C__a_C__O_3_↓_+__2_N__a_O__H_
2.根据酸的通性,说出将盐酸加入含有酚酞的NaOH溶液(红色)的 现象。
浙教版初中科学九上2.5《物质的转化》(共21张PPT)

一、金属单质
Ca
O2
CaO
H2O
Ca(OH)2
HCl
CaCl2
盐的转变关系:
金属 碱性 氧化物
碱 盐
二、非金属单质
C O2
CO2 H2O
H2CO3
Ca(OH)2
CaCO3
盐的转变关系:
非金属
酸性 氧化物
酸
盐
加热
Fe + S == FeS
• 金属 + 非金属
盐 (无氧酸盐)
一、单质、氧化物、酸、碱、盐各类物质的相互关系
1.自然界没有风风雨雨,大地就不会春华秋实。2.瀑布跨过险峻陡壁时,才显得格外雄伟壮观。3.诽谤,同时造了无数的罪业,这是嫉妒;自己欢喜4.在茫茫沙漠,唯有前时进的脚步才是希望的象征。5.只会幻想而不行动的 人,永远也体会不到收获果实时的喜悦。6.我们只要每天睁开眼睛,看到自己还活着,就该庆幸自己多么的幸运7.赞叹,同时积累了同样的功德利益,这是随喜。怎么做,完全在于自己。8.盲目的上进,就像在死胡同里打转。 你浪费的人生,原本可以有更多的精彩。9.其他烦心的事,想开点,看开点,再苦再难的日子,熬着熬着也就挨过来了。10.这个世界到处充满着不公平,我们能做的不仅仅是接受,还要试着做一些反抗。11.懦弱的人只会裹 足不前,莽撞的人只能引为烧身,只有真正敢的人才能所向披靡。12.精神健康的人,总是努力地工作及爱人,只要能做到这两件事,其它的事就没有什么困难。13.命,是失败者的借口;运,是成功者的谦词。带着青春的印 记,我们这代人,慢慢的随着时间的流淌,渐渐老去。晚安!14.努力不是为了做给谁看,无论什么结果都能问心无愧;努力是因为你可以不接受命运的框定,靠自己来场漂亮的反击。15.美国人口普查局的“世界人口时钟” 显示,全世界每秒钟有1.8人死亡,一小时就是6,360人,一天就有152,640人死亡。16.当你觉得老天对你不公的时候,别急着红眼,别急着抱怨,因为这样只会削弱你的意志,消磨你的斗志,最后让你变得平庸,一事无成。 17.昨天,再值得留恋,也不会为你的留恋停留;明天,再艰辛,也不会因为你的脆弱而怜悯;优雅之人心如止水,波谰不惊,不以物喜,不以己悲。做一个优雅从容的人,只有先稳下来,静下心,学会宽容,仁爱,温和。 18.无论你正经历着什么,过得是否开心,世界不会因为你的疲惫,而停下它的脚步。那些你不能释怀的人与事,总有一天会在你念念不忘之中遗忘。无论黑夜多么漫长不堪,黎明始终会如期而至。睡一觉,愿美梦治愈你的 难过。晚安!19.凡事顺其自然,凡事不可强求。人生,错过太多,我们都在重复,所以,我们不必为自己错过的悲哀,而应该为自己拥有的而喜悦。错过了漂亮,你还拥有健康;错过了健康,你还拥有智慧;错过了智慧,你还 拥有善良;错过了财富,你还拥有安逸;错过了安逸,你还拥有自由20.人生,总有乌云密布的低沉的时刻,但也会有蓦然抬头,拨云见日的一天。而最重要的是在低潮时要忍耐得住,不要放弃对光明的追求,永远不要以为走
物质的分类及转化-ppt课件

A. 稀硫酸 生成H2
C. 氢氧化钠溶液
B. 浓硫酸 发生钝化
D. 硫酸铜溶液
不反应
生成Cu
02
物质的转化
二、物质的转化 提示:在化学变化中, 元素种类 不变。
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。请同 学们完成P11思考与讨论
人教版 必修第一册
从物质的分类角度构建物质转化规律的模型认知
金属
O2 碱性氧化物
酸或酸性 氧化物
酸或酸性
H2O 碱 氧化物 盐
非金属单 质
O2 酸性氧化物
碱或碱性
H2O 酸 氧化物 盐
碱或碱性 氧化物
例: 1、写出下列物质之间转化的化学方程式,并说明反应类型
Mg MgO
MgSO4
Mg(OH)2
MgSO4
小试牛刀
1.在括号中填上恰当的化学式,使下列转化关系成立,并写出化学方程式
B 下列物质间的转化通过一步反应不能实现的是( ) A.CaO→Ca(OH)2 B.CuO→Cu(OH)2 C.Ca(OH)2→CaCO3 D.CuSO4→FeSO4
【练习】
下表所列各组物质中,物质之间按箭头方向不能通过
C 一步反应实现如图所示转化的是( )
课堂总结
与指示剂反应
与指示剂反应
与金属反应
CaCl2
2、碱的化学性质 碱=金属离子/铵根离子 + OH-
01 指示剂 使酚酞变 _红_____,使紫色石蕊试液变_蓝_____
02 + 酸性氧化物 碱 + 酸性氧化物 → 盐 + 水
03 + 酸
2NaOH + CO2 = Na2CO3 + H2O 碱+酸→ 盐+水
常见无机物间的转化关系(19张PPT)

本章热点专题
常见无机物间的转化关系
2.三角型转化关系
(1)铁三角: (2)碳三角: (3)铝三角: (4)氯三角:
(5)硅三角:
人教版化学
本章热点专题
常见无机物间的转化关系
3.交叉型转化关系 (1)硫及其重要化合物间的转化:
(2)氮及其重要化合物间的转化:
(3)钠及其重要化合物间的转化:
人教版化学
般有两种考查方式:一是给出一定的转化关系,分析满足给定
转化关系的物质,一般以选择题形式考查;二是结合无机框图 推断题考查,一般作为框图的一部分,通常是解答该题的突破
口。
人教版化学
本章热点专题
常见无机物间的转化关系
D D 1.直线型连续转化关系 A――→B――→C
(1)氧化还原反应型 O2 O2 O2 ①NH3( 或 N2) ――→ NO ――→ NO2 或 NH3 ――→ O2 N2――→NO
[答案] C
人教版化学
本章热点专题
常见无机物间的转化关系
[例2] 选项 化合物 Y W
(2011· 福建高考)下表各选项中,不能利用 ( )
置换反应通过Y得到W的一组化合物是
A
CO2 MgO
B Fe2O3 Al2O3
C
C2H5OH C2H5ONa
D
FeCl3 CuCl2
人教版化学
本章热点专题
常见无机物间的转化关系
O2 O2 O2 O2 ②H2S(或 S)――→SO2――→SO3 或 H2S――→S――→ SO2 O2 O2 C C ③C――→CO――→CO2 或 O2――→CO2――→CO
人教版化学
本章热点专题
常见无机物间的转化关系
物质间的转化关系PPT课件

CuSO4
小结反思
1、解题突破口的寻找:明确试题要求 2、解题技巧:从单质入手,考虑物质的转 化 3、解题感悟:
克服思维定势 对典型物质的性质要熟悉 平时要注意化学学习方法的培养
例题4:
构建知识网络,理清物质间的相互关系,是化
学学习中的一种重要方法。如右图中,连线两端的
物质可以相互反应。下列四组选项中,符合该图要
例题2: 以下框图中的物质均为常见的物质,其中甲、乙、
丙、丁、戊均为单质,常温下,丁为黑色固体,戊为
紫红色金属。农业上常用F改良酸性土壤。常温下,G
是一种具有刺激性气味的气体,其水溶液显碱性,工
业上用甲和丙化合制备G。
通电
A
( 体 积 分 数 )
空 气 成 分 示 意 图
丙78%
乙21%
高温
B
甲丙 G
小结反思
1、解题突破口的寻找:物质的颜色、状态 空气成分示意图
2、推断方法:注意题示信息 如物质的颜色状态、物质的分类、物质的用途 反应条件(如高温、通电、研磨) 用足题给条件
3、解题感悟: 对物质的性质(物理性质和化学性质)、重
要的用途要准确、熟悉 化学用语的使用要规范如条件、气体、沉淀
的表示方法等 4、试题特点及延伸拓展
丙、丁、戊均为单质,常温下,丁为黑色固体,戊为
紫红色金属。农业上常用F改良酸性土壤。常温下,G
是一种具有刺激性气味的气体,其水溶液显碱性,工
业上用甲和丙化合制备G。
通电
A
( 体 积 分 数 )
空 气 成 分 示 意 图
丙78%
乙21%
高温
B
丙
甲
G
戊
乙
H
初中化学物质转化关系图
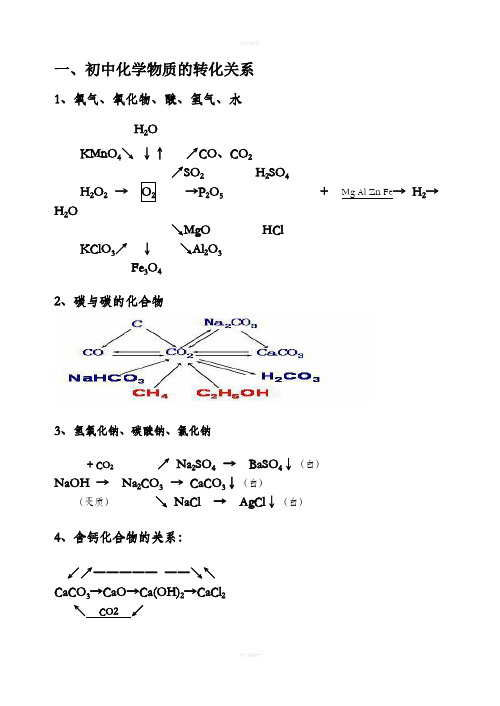
↗ Na2SO4 → BaSO4↓(白)
NaOH → Na2CO3 → CaCO3↓(白)
(变质)
↘ NaCl → AgCl↓(白)
4、含钙化合物的关系:
↙↗――――― ――↘↖ CaCO3→CaO→Ca(OH)2→CaCl2
↖ CO2 ↙
-可编辑-
精品教育
5、氧化钡、氢氧化钡与硫酸钡
↗BaCl2 → BaSO4↓(白)
精品教育
一、初中化学物质的转化关系
1、氧气、氧化物、酸、氢气、水
H2O
KMnO4↘ ↓↑ ↗CO、CO2
↗SO2
H2Sቤተ መጻሕፍቲ ባይዱ4
H2O2 → O2
→P2O5
H2O
↘MgO
HCl
KClO3↗ ↓ Fe3O4
↘Al2O3
2、碳与碳的化合物
+ Mg Al Zn Fe→ H2→
3、氢氧化钠、碳酸钠、氯化钠
+ CO2
BaO → Ba(OH)2
↗
↘ + CuSO4
↘Cu(OH)2↓(蓝)
6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵
CuO ↙↘ CuSO4.5H2O→CuSO4→ Cu
↗ CO2 Ca(HCO3)2 → CaCO3→CaO
↘ H2O
↗Na2CO3 NaHCO3 →CO2
↘H2O →
H2CO3
↗ NH3 → NH3.H2O NH4HCO3 → H2O
-可编辑-
精品教育
Fe Al
↙ FeCl3 ↖
Fe(OH)3
Fe2O3
↖Fe2(SO4)3↙
C CO H2 Mg Al
←――――→
O2 H2O
初中化学27.初高中化学衔接——物质间的相互转化

初高中化学衔接——物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为: 两条纵线通到底(七条规律)(1)~(7) 四条横线相联系(四条规律)(8)~(11) 六条交叉成网络(六条规律)(12)~(17) 17条规律须牢记 反应规律 示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ CuO O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水O H PO Na PO H NaOH 2434333+=+O H CuSO SO H OH Cu 244222)(+=+(5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+(6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232SiO O H SiO H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H (15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用: (1)可知某物质的性质。
物质的转化ppt课件

《物质及其变化》
第一节 物质的分类及其转化
知识 基础 物质的转化规律
2.物质的转化规律 单质到盐的转化关系:
金属单质 ―_―O_→2 _碱__性_氧__化__物__ ―H―2O→碱__ ―酸―性―酸氧―或―化―物→ 盐 非金属单质 ―O_―_2→ _酸__性_氧__化__物__ ―H_―_2O_→ 酸__ ―碱―性―碱氧―或―化―物→ 盐
《物质及其变化》
第一节 物质的分类及其转化
知识 准备 基础知识填充
4.氧化物的通性
(1)与水反应生成酸或碱 SO2 溶于水: SO2+H2O==H2SO3 生灰遇水: CaO+H2O==Ca(OH)2
(2)与酸(或碱)反应生成盐和水 用烧碱溶液吸收 CO2: CO2+2NaOH==Na2CO3+H2O 氧化铜溶于盐酸: CuO+2HCl==CaCl2+H2O (3)酸性氧化物与碱性氧化物反应生成含氧酸盐氧化钠与二氧化碳:
《物质及其变化》
第一节 物质的分类及其转化
知识 基础 物质转化的应用 3.物质转化的应用 (1)物质制备
实例[以制备 Ca(OH)2 为例]
碱性氧化物与水 盐与另一种碱
CaO+H2O=== CaOH2 CaOH2+Na2CO3 ===CaCO3↓+2NaOH
《物质及其变化》
第一节 物质的分类及其转化
《物质及其变化》
第一节 物质的分类及其转化
某同学利用 Fe、CuO、H2SO4 制备 CuSO4,制 备路线及相关物质之间的转化关系如下,回答下列
问题:
(1)写出 A、B、C 的化学式:
A__C__u_S_O_4___、B__C_u_(_O_H__)_2 _、C__C__u_O___。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
请①石灰写石出①上高温C述a方C二O案生氧3石中化灰高碳有温 ②关加反C水a应O石的+灰C化水O学2↑③方程碳式酸;钙:
②你设计的C方aO案+优H点2O是= C二a氧(O化H碳)2 得到充分;利用 ,
节③约原Ca料(OH。)2+Na2CO3=2NaOH+CaCO3↓
。
⑷请你仍用石灰石为原料 (其他试剂自选),设
2008中考复习指导
物质间的转化关系
在千姿百态的物质世界中,各种物质 之间存在着多种相互作用,也不断发 生着变化。研究物质间的相互转化关 系是我们进一步认识初中所学的物质 性质及其转化规律、增进对科学探究 的理解、提高应用化学知识和方法来 分析问题解决问题的能力。
以物质性质为主体的框图推断题
以物质性质与分类相结合的框图推 断题
CuSO4
小结反思
1、解题突破口的寻找:明确试题要求 2、解题技巧:从单质入手,考虑物质的转 化 3、解题感悟:
克服思维定势 对典型物质的性质要熟悉 平时要注意化学学习方法的培养
例题4:
构建知识网络,理清物质间的相互关系,是化
学学习中的一种重要方法。如右图中,连线两端的
物质可以相互反应。下列四组选项中,符合该图要
求的是
( AC )
A.①Na2CO3 ②SO2 ③BaCl2 B.①NaHCO3 ②SO2 ③KNO3 C.①Fe2O3 ②CO2 ③Ba(NO3)2 D.①CuO ②CO ③HCl
2008年中考复习指导
物质间的转化关系
三、从学习小结与模仿 设计来完成的框图推断题
例题5: 仿照下图中C→CO转化的表示方法,将下图中
C、CO、CO2、H2CO3、CaCO3等五种物质之间的转化关 系用“→”连接起来, 并在箭头旁标明必须的其他 反应物及反应条件。
C
O2
点 燃
CO2
HCl
H2CO3
Ca(OH)2
CO
CaCO3
例题6: ⑶牙膏中的摩擦剂碳酸钙可以用石灰石制备。某
学生设计了一种制备碳酸钙的实验方案,流程图为:
石灰石 ①高温 生石灰 ②加水 石灰水 ③加碳酸钠溶液 碳酸钙
进行了如下实验探究(B是常用的建筑材料,H是单质,图中部 分产物被略去):
红褐色 NaOH溶液 黄 色
盐酸 红棕色
沉淀D
②
溶液C ①过滤 固体A
高温 黑 色
白 色 盐酸 无色无味 +X 无色无味 ⑤ 固体G
固体B ③
气体E ④高温 气体F
澄清石灰水 浑浊
(1)写出有关物质的化学式:
A的主要成分 Fe2O3,B的主要成分 CaC,OX3 (2)写出图中下列步骤的化学方程式:
从学习小结与模仿设计来完成的框 图推断题
பைடு நூலகம்
2008中考复习指导
物质间的转化关系
一、以物质性质为主体
的框图推断题。
例题1:
C
F
自然界中存在着氧循环、碳循环、
水循环等。如右图所示, 其中A、B、A
D
G
C就是这些循环中的一种化合物的三
E
种自然状态,A为密度最大时的状态。B 图 物质变化的关系
D具有助燃性和氧化性,能与许多物质发生剧烈地、或
丙、丁、戊均为单质,常温下,丁为黑色固体,戊为
紫红色金属。农业上常用F改良酸性土壤。常温下,G
是一种具有刺激性气味的气体,其水溶液显碱性,工
业上用甲和丙化合制备G。
通电
A
( 体 积 分 数 )
空 气 成 分 示 意 图
丙78%
乙21%
高温
B
丙
甲
G
戊
乙
H
丁
丁
C 高温 E
A
D
F
硫酸铵 F
研磨
C 戊
(((132)))写写写出出出AH高、和温FE和加条G热件的条下化件B学分下式解生:为成CC和和戊D 的的化化学学方方程程式式:: A H2COCaOC,+OF3CuC高O温a(OCH△a)O2 ,+CCGuO+2NC↑HO32 。 。。
戊
乙
H
丁
丁
C 高温 E
A
D
F
硫酸铵 F
研磨
C 戊
(((132)))写写写出出出AH高、和温FE和加条G热件的条下化件B学分下式解生:为成CC和和戊D 的的化化学学方方程程式式:: A H2COCaOC,+OF3CuC高O温a(OCH△a)O2 ,+CCGuO+2NC↑HO32 。 。。
2008中考复习指导
小结反思
1、解题突破口的寻找:物质的颜色、状态 空气成分示意图
2、推断方法:注意题示信息 如物质的颜色状态、物质的分类、物质的用途 反应条件(如高温、通电、研磨) 用足题给条件
3、解题感悟: 对物质的性质(物理性质和化学性质)、重
要的用途要准确、熟悉 化学用语的使用要规范如条件、气体、沉淀
的表示方法等 4、试题特点及延伸拓展
物质间的转化关系
二、以物质性质与分类
相结合的框图推断题。
例题3: 构建知识网络,理清物质间的相互关系,是化学
学习中的一种重要方法。请你在下图方框中填写适当 物质的化学式,使得连线两端的物质能相互反应,且 分别反映出单质A、化合物B的三条不同的化学性质。
O2
H2SO4
单质A Fe
HCl
CO2
化合物BNaOH
计另一种制备碳酸钙的实验方案,仿照⑶所示,将
你的实验方案用流程图表示出来:
小结反思
1、解题技巧:提取题示信息 进行模仿 2、解题感悟:
借助于仔细审题 提取信息 全面认识物质的转化规律 复习中要回归课本,注重基础 在化学学习和复习中注意思想方法
练习 某校兴趣小组在我市某地收集到两种岩石样品 A和B。他们
小结反思
1、解题突破口的寻找:特征物质 2、推断方法:前推后推 3、解题感悟:
克服思维定势 借助于仔细审题 提取信息 对物质的性质要准确、熟悉 化学用语的使用要规范 4、发挥试题的功能,在解题中小结规律和方法, 如对实验室制取氧气的原理方法的小结
例题2:
以下框图中的物质均为常见的物质,其中甲、乙、
缓慢地氧化反应。G 是暗紫色固体,加热时生成D和另
二种固体, 其中一种可作 F分解反应的催化剂。试回
答下列问题:
①若 C 为分子间间隔最大时的状态,写出 B 物质的 名具称②③有写写冰可出出燃F反已性和应知,化的的火学化焰式E 学为物方淡质H程蓝的2O式色化学2H性。。2O质2 M和nO反2 2应H2现O 象+ O:2↑ 。
例题2: 以下框图中的物质均为常见的物质,其中甲、乙、
丙、丁、戊均为单质,常温下,丁为黑色固体,戊为
紫红色金属。农业上常用F改良酸性土壤。常温下,G
是一种具有刺激性气味的气体,其水溶液显碱性,工
业上用甲和丙化合制备G。
通电
A
( 体 积 分 数 )
空 气 成 分 示 意 图
丙78%
乙21%
高温
B
甲丙 G
