备战高考化学知识点过关培优训练∶乙醇与乙酸附答案
备战高考化学知识点过关培优易错试卷训练∶乙醇与乙酸附详细答案

备战高考化学知识点过关培优易错试卷训练∶乙醇与乙酸附详细答案一、乙醇与乙酸练习题(含详细答案解析)1.乙醇(CH3CH2OH)是一种重要的有机物(1)根据乙醇分子式和可能结构推测,1mol乙醇与足量钠反应,产生氢气的物质的量可能是________________mol。
(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,该反应的化学方程式是________________________________,乙醇的官能团是_______________。
(3)用如图装置实验,干冷烧杯罩在火焰上,有无色液体产生。
能否据此说明一定有氢气产生,判断及简述理由是_________________________。
(4)乙醇与钠反应比水与钠反应平缓的多,原因是_______________________________ 。
【答案】0.5、2.5、3 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑羟基不能,因为氢气中会含有乙醇蒸汽乙醇分子中羟基上的氢原子没有水中氢原子活泼【解析】【分析】由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;乙醇的结构中含有官能团-羟基,能够与金属钠反应置换出氢气,且羟基中氢原子的活泼性小于水中氢原子活泼性,乙醇和钠反应与钠与水比较要缓慢的多,据以上分析解答。
【详解】(1)由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,说明钠与乙醇反应置换的是羟基上的氢原子,化学方程式为2C2H5OH+2Na→2C2H5ONa+H2↑;乙醇的官能团为羟基;(3) 图示实验装置不能说明一定有氢气产生,因为乙醇易挥发,乙醇、氢气燃烧都能生成水;(4) 乙醇分子中羟基上的氢原子没有水中氢原子活泼,乙醇与钠反应比水与钠反应平缓的多。
高考化学培优(含解析)之乙醇与乙酸含答案

高考化学培优(含解析)之乙醇与乙酸含答案一、乙醇与乙酸练习题(含详细答案解析)1.食品安全关系国计民生,影响食品安全的因素很多.(1)聚偏二氯乙烯()具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________(写结构简式)发生加聚反应生成的,该物质的分子构型是__________________________ 。
(2)劣质植物油中的亚油酸(]324227[CH (CH )CH CHCH CH CH CH )COOH ==含量很低,下列关于亚油酸的说法中,正确的是_________。
A .分子式为18342C H OB .一定条件下能与甘油(丙三醇)发生酯化反应C .能和NaOH 溶液反应D.不能使酸性KMnO 4溶液褪色 (3)假酒中甲醇()3CH OH 含量超标,请写出Na 和甲醇反应的化学方程式:________。
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是________。
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:____________________________。
【答案】22CCl CH = 平面型 BC 3322CH OH 2Na 2CH ONa H +→+↑ 氨基酸 取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解【解析】【分析】(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可;乙烯为平面型分子;(2)根据结构式可分析结果;(3)Na 和甲醇反应生成甲醇钠和氢气;(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸;(5)淀粉若完全水解,加入碘水溶液不变蓝色。
【详解】(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可,其单体为22CCl CH =,乙烯为平面型分子,22CCl CH =也为平面型分子,故答案为:22CCl CH =;平面型;(2)A. 由结构式可知分子式为18322C H O ,A 项错误;B.含有羧基能与甘油发生酯化反应,B 项正确;C.含有羧基能与氢氧化钠发生中和反应,C 项正确;D.含有碳碳双键能使酸性4KMnO 溶液褪色,D 项错误,故选:BC ;(3)Na 和甲醇反应生成甲醇钠和氢气,反应方程式为:3322CH OH 2Na 2CH ONa H +→+↑,故答案为:3322CH OH 2Na 2CH ONa H +→+↑;(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸,故答案为:氨基酸;(5)淀粉若完全水解,加入碘水溶液不变蓝色,可设计方案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解,故答案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解。
高考化学培优(含解析)之乙醇与乙酸含答案解析

高考化学培优(含解析)之乙醇与乙酸含答案解析一、乙醇与乙酸练习题(含详细答案解析)1.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室制取乙酸乙酯。
回答下列问题:(1)浓硫酸的作用是:________________________。
(2)饱和碳酸钠溶液的主要作用是__________________________________________。
(3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是_____。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。
下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度不再变化【答案】催化作用和吸水作用吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到防止倒吸分液防止暴沸②④⑤【解析】【分析】(1)浓硫酸具有脱水性、吸水性及强氧化性;(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;(3)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,导管伸入液面下可能发生倒吸;(4)乙酸乙酯不溶于水;(5)根据可逆反应平衡状态标志的判断依据进行分析。
【详解】(1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,故答案为:催化作用和吸水作用;(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,故答案为:吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到;(3)导管若插入溶液中,反应过程中可能发生倒吸现象,所以导管要插在饱和碳酸钠溶液的液面上,目的是防止倒吸,故答案为:防止倒吸;(4)乙酸乙酯不溶于水,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,故答案为:分液;(5)①单位时间内生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;②单位时间内生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;③单位时间内消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;④正反应的速率与逆反应的速率相等,各组分的密度不再变化,达到了平衡状态,故④正确;⑤混合物中各物质的浓度浓度不再变化,各组分的密度不再变化,达到了平衡状态,故⑤正确;故答案为:②④⑤。
备战高考化学知识点过关培优 易错 难题训练∶乙醇与乙酸附答案

备战高考化学知识点过关培优易错难题训练∶乙醇与乙酸附答案一、乙醇与乙酸练习题(含详细答案解析)1.乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如下图所示:回答下列问题:(1)A的结构简式为___________________。
(2)B的化学名称是____________________。
(3)由乙醇生产C的化学反应类型为____________________。
(4)E是一种常见的塑料,其化学名称是_________________________。
(5)由乙醇生成F的化学方程式为_______________________________。
【答案】CH3COOH 乙酸乙酯取代反应聚氯乙烯 CH3CH2OH CH2=CH2↑+ H2O 【解析】【分析】乙醇在浓硫酸作用下加热发生消去反应生成乙烯,F是乙烯;乙醇能被氧化为乙酸,A是乙酸;乙酸、乙醇在浓硫酸催化作用下生成乙酸乙酯,B是乙酸乙酯;乙醇与C的分子式比较可知,乙醇分子中的1个H原子被取代,所以反应类型为取代反应;C在浓硫酸的作用下发生消去反应得D为CH2=CHCl,D发生加聚反应得E为,据此分析解答;【详解】(1)A是乙酸,A的结构简式为CH3COOH;(2)B为CH3COOCH2CH3,名称是乙酸乙酯;(3)乙醇与C的分子式比较可知,乙醇分子中的1个H原子被取代,所以反应类型为取代反应;(4)E结构简式为,其化学名称是聚氯乙烯;(5)乙醇在浓硫酸作用下加热发生消去反应生成乙烯的方程式为CH3CH2OHCH2=CH2↑+ H2O2.A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
(1)A的官能团名称是____________,B的结构简式____________。
(2)反应②的反应类型为________________________________。
(3)发生反应①时钠在__________________________(填“液面上方”或“液体底部”)。
高考化学知识点过关培优训练∶乙醇与乙酸及答案解析

高考化学知识点过关培优训练∶乙醇与乙酸及答案解析一、乙醇与乙酸练习题(含详细答案解析)1.CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。
以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如图:(1)步骤①发生的反应离子方程式为___________________。
(2)步骤②所得滤渣1的主要成分为____________(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是____________。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为____________(选填:1∶2;3∶7;2∶3)外,另一目的是___________________。
(4)步骤⑥包含的操作有____________、过滤、洗涤及干燥。
(5)碳酸镁和碳酸钙与醋酸也可以恰好完全反应得到的混合物制融雪剂,下列有关说法错误的是_____A.该融雪剂中的醋酸钙、醋酸镁均是离子化合物B.该融雪剂还可用于除去煤燃烧产生的二氧化硫C.该融雪剂的水溶液显碱性D.生产该融雪剂所需碳酸盐与醋酸的物质的量之比为1:1【答案】MgCO3·CaCO3+4CH3COOH = Ca2++Mg2++4CH3COO-+2CO2↑+2H2O SiO2实验过程中苯酚被空气中氧气氧化最终产生褐色物质 3∶7 除去过量的乙酸蒸发结晶 D【解析】【分析】根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性炭脱色,除去被氧化的苯酚、焦油等杂质,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA。
高考化学知识点过关培优训练∶乙醇与乙酸含详细答案

高考化学知识点过关培优训练∶乙醇与乙酸含详细答案一、乙醇与乙酸练习题(含详细答案解析)1.食品安全关系国计民生,影响食品安全的因素很多.(1)聚偏二氯乙烯()具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________(写结构简式)发生加聚反应生成的,该物质的分子构型是__________________________ 。
(2)劣质植物油中的亚油酸(]324227[CH (CH )CH CHCH CH CH CH )COOH ==含量很低,下列关于亚油酸的说法中,正确的是_________。
A .分子式为18342C H OB .一定条件下能与甘油(丙三醇)发生酯化反应C .能和NaOH 溶液反应D.不能使酸性KMnO 4溶液褪色 (3)假酒中甲醇()3CH OH 含量超标,请写出Na 和甲醇反应的化学方程式:________。
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是________。
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:____________________________。
【答案】22CCl CH = 平面型 BC 3322CH OH 2Na 2CH ONa H +→+↑ 氨基酸 取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解【解析】【分析】(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可;乙烯为平面型分子;(2)根据结构式可分析结果;(3)Na 和甲醇反应生成甲醇钠和氢气;(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸;(5)淀粉若完全水解,加入碘水溶液不变蓝色。
【详解】(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可,其单体为22CCl CH =,乙烯为平面型分子,22CCl CH =也为平面型分子,故答案为:22CCl CH =;平面型;(2)A. 由结构式可知分子式为18322C H O ,A 项错误;B.含有羧基能与甘油发生酯化反应,B 项正确;C.含有羧基能与氢氧化钠发生中和反应,C 项正确;D.含有碳碳双键能使酸性4KMnO 溶液褪色,D 项错误,故选:BC ;(3)Na 和甲醇反应生成甲醇钠和氢气,反应方程式为:3322CH OH 2Na 2CH ONa H +→+↑,故答案为:3322CH OH 2Na 2CH ONa H +→+↑;(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸,故答案为:氨基酸;(5)淀粉若完全水解,加入碘水溶液不变蓝色,可设计方案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解,故答案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解。
高考化学培优(含解析)之乙醇与乙酸

高考化学培优(含解析)之乙醇与乙酸一、乙醇与乙酸练习题(含详细答案解析)1.CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。
以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如图:(1)步骤①发生的反应离子方程式为___________________。
(2)步骤②所得滤渣1的主要成分为____________(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是____________。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为____________(选填:1∶2;3∶7;2∶3)外,另一目的是___________________。
(4)步骤⑥包含的操作有____________、过滤、洗涤及干燥。
(5)碳酸镁和碳酸钙与醋酸也可以恰好完全反应得到的混合物制融雪剂,下列有关说法错误的是_____A.该融雪剂中的醋酸钙、醋酸镁均是离子化合物B.该融雪剂还可用于除去煤燃烧产生的二氧化硫C.该融雪剂的水溶液显碱性D.生产该融雪剂所需碳酸盐与醋酸的物质的量之比为1:1【答案】MgCO3·CaCO3+4CH3COOH = Ca2++Mg2++4CH3COO-+2CO2↑+2H2O SiO2实验过程中苯酚被空气中氧气氧化最终产生褐色物质 3∶7 除去过量的乙酸蒸发结晶 D【解析】【分析】根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性炭脱色,除去被氧化的苯酚、焦油等杂质,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA。
备战高考化学培优 易错 难题(含解析)之乙醇与乙酸附详细答案

备战高考化学培优易错难题(含解析)之乙醇与乙酸附详细答案一、乙醇与乙酸练习题(含详细答案解析)1.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室制取乙酸乙酯。
回答下列问题:(1)浓硫酸的作用是:________________________。
(2)饱和碳酸钠溶液的主要作用是__________________________________________。
(3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是_____。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。
下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度不再变化【答案】催化作用和吸水作用吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到防止倒吸分液防止暴沸②④⑤【解析】【分析】(1)浓硫酸具有脱水性、吸水性及强氧化性;(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;(3)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,导管伸入液面下可能发生倒吸;(4)乙酸乙酯不溶于水;(5)根据可逆反应平衡状态标志的判断依据进行分析。
【详解】(1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,故答案为:催化作用和吸水作用;(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,故答案为:吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到;(3)导管若插入溶液中,反应过程中可能发生倒吸现象,所以导管要插在饱和碳酸钠溶液的液面上,目的是防止倒吸,故答案为:防止倒吸;(4)乙酸乙酯不溶于水,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,故答案为:分液;(5)①单位时间内生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;②单位时间内生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;③单位时间内消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;④正反应的速率与逆反应的速率相等,各组分的密度不再变化,达到了平衡状态,故④正确;⑤混合物中各物质的浓度浓度不再变化,各组分的密度不再变化,达到了平衡状态,故⑤正确;故答案为:②④⑤。
备战高考化学培优(含解析)之乙醇与乙酸及答案
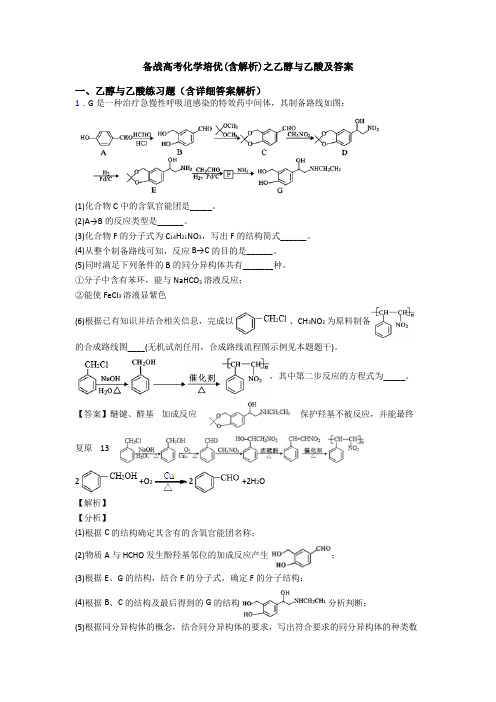
备战高考化学培优(含解析)之乙醇与乙酸及答案一、乙醇与乙酸练习题(含详细答案解析)1.G是一种治疗急慢性呼吸道感染的特效药中间体,其制备路线如图:(1)化合物C中的含氧官能团是_____。
(2)A→B的反应类型是______。
(3)化合物F的分子式为C14H21NO3,写出F的结构简式______。
(4)从整个制备路线可知,反应B→C的目的是______。
(5)同时满足下列条件的B的同分异构体共有_______种。
①分子中含有苯环,能与NaHCO3溶液反应;②能使FeCl3溶液显紫色(6)根据已有知识并结合相关信息,完成以、CH3NO2为原料制备的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
,其中第二步反应的方程式为_____。
【答案】醚键、醛基加成反应保护羟基不被反应,并能最终复原 132+O22+2H2O【解析】【分析】(1)根据C的结构确定其含有的含氧官能团名称;(2)物质A与HCHO发生酚羟基邻位的加成反应产生;(3)根据E、G的结构,结合F的分子式,确定F的分子结构;(4)根据B、C的结构及最后得到的G的结构分析判断;(5)根据同分异构体的概念,结合同分异构体的要求,写出符合要求的同分异构体的种类数目;(6)与NaOH的水溶液共热发生取代反应产生,该物质被催化氧化产生苯甲醛,苯甲醛与CH3NO2发生加成反应产生,发生消去反应产生,发生加聚反应产生;根据题意,第二步反应为苯甲醇被催化氧化产生苯甲醛。
【详解】(1)根据C的结构简式可知C中含有的含氧官能团为醛基、醚键;(2)物质A酚羟基邻位上断裂C-H键,HCHO分子中断裂C、O双键中的较活泼的键,二者发生加成反应产生,所以A→B的反应类型是加成反应;(3)物质E结构简式为,E与CH3CHO、H2在Pd/C作用下反应产生分子式C14H21NO3的F,则F的结构简式为;(4)B结构简式为,B与反应产生C:。
经一系列反应最后生成,两个官能团又复原,所以从整个制备路线可知,反应B→C的目的是保护羟基不被反应,并能最终复原;(5)B结构简式为,其同分异构体符合条件:①分子中含有苯环,能与NaHCO3溶液反应,说明分子中含有羧基-COOH;②能使FeCl3溶液显紫色,说明分子中含有酚羟基,若含有2个侧链,则为-OH、-CH2COOH,二者在苯环上的位置有邻、间、对三种;若有三个官能团,分别是-OH、-COOH、-CH3,三个官能团位置都相邻,有3种不同结构;都相间,有1种位置;若2个相邻,一个相间,有3×2=6种,因此有三个官能团的同分异构体种类数目为3+1+6=10种,则符合题意的所有同分异构体的种类数目是3+10=13种;(6)一氯甲苯与NaOH的水溶液共热发生取代反应产生,该物质与O2在Cu作催化剂条件下加热,发生氧化反应产生苯甲醛,苯甲醛与CH3NO2发生加成反应产生,发生消去反应产生,发生加聚反应产生,故反应流程为:;根据题意,第二步反应为苯甲醇被催化氧化产生苯甲醛,反应方程式为:2+O22+2H2O。
高考化学 乙醇与乙酸 培优练习(含答案)附答案

高考化学乙醇与乙酸培优练习(含答案)附答案一、乙醇与乙酸练习题(含详细答案解析)1.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水。
为研究A的组成与结构,进行了如下实验:(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。
则A的相对分子质量为:___。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。
则A的分子式为:___。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。
用结构简式表示A中含有的官能团为:___、__。
(4)A的核磁共振氢谱如图:则A中含有___种氢原子。
(5)综上所述,A的结构简式为___,跟NaHCO3溶液反应的离子方程式为___。
【答案】90 C3H6O3—COOH —OH 4 CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑【解析】【分析】【详解】(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为:45×2=90;(2)9.0g物质A的物质的量为0.1mol;浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量为:5.4g18g/mol=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是:13.2g44g/mol=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是90-312-616=3,即分子式为:C3H6O3;(3)只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,0.1molA可生成2.24LCO2(标准状况)即0.1mol二氧化碳,则含有一个-COOH;醇羟基和羧基可以和金属钠发生反应生成氢气,0.1molA与足量金属钠反应生成2.24LH2(标准状况)即0.1mol氢气,且已知含有一个羧基,则还含有一个-OH;(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种环境的氢原子;(5)综上所述A的结构简式为;与碳酸氢钠反应生成二氧化碳和水以及相应的钠盐,离子方程式为:CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑。
备战高考化学乙醇与乙酸(大题培优 易错 难题)及详细答案

备战高考化学乙醇与乙酸(大题培优易错难题)及详细答案一、乙醇与乙酸练习题(含详细答案解析)1.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室制取乙酸乙酯。
回答下列问题:(1)浓硫酸的作用是:________________________。
(2)饱和碳酸钠溶液的主要作用是__________________________________________。
(3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是_____。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。
下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度不再变化【答案】催化作用和吸水作用吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到防止倒吸分液防止暴沸②④⑤【解析】【分析】(1)浓硫酸具有脱水性、吸水性及强氧化性;(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;(3)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,导管伸入液面下可能发生倒吸;(4)乙酸乙酯不溶于水;(5)根据可逆反应平衡状态标志的判断依据进行分析。
【详解】(1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,故答案为:催化作用和吸水作用;(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,故答案为:吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到;(3)导管若插入溶液中,反应过程中可能发生倒吸现象,所以导管要插在饱和碳酸钠溶液的液面上,目的是防止倒吸,故答案为:防止倒吸;(4)乙酸乙酯不溶于水,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,故答案为:分液;(5)①单位时间内生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;②单位时间内生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;③单位时间内消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;④正反应的速率与逆反应的速率相等,各组分的密度不再变化,达到了平衡状态,故④正确;⑤混合物中各物质的浓度浓度不再变化,各组分的密度不再变化,达到了平衡状态,故⑤正确;故答案为:②④⑤。
备战高考化学乙醇与乙酸(大题培优)含详细答案

备战高考化学乙醇与乙酸(大题培优)含详细答案一、乙醇与乙酸练习题(含详细答案解析)1.乙醇(CH3CH2OH)是一种重要的有机物(1)根据乙醇分子式和可能结构推测,1mol乙醇与足量钠反应,产生氢气的物质的量可能是________________mol。
(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,该反应的化学方程式是________________________________,乙醇的官能团是_______________。
(3)用如图装置实验,干冷烧杯罩在火焰上,有无色液体产生。
能否据此说明一定有氢气产生,判断及简述理由是_________________________。
(4)乙醇与钠反应比水与钠反应平缓的多,原因是_______________________________ 。
【答案】0.5、2.5、3 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑羟基不能,因为氢气中会含有乙醇蒸汽乙醇分子中羟基上的氢原子没有水中氢原子活泼【解析】【分析】由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;乙醇的结构中含有官能团-羟基,能够与金属钠反应置换出氢气,且羟基中氢原子的活泼性小于水中氢原子活泼性,乙醇和钠反应与钠与水比较要缓慢的多,据以上分析解答。
【详解】(1)由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,说明钠与乙醇反应置换的是羟基上的氢原子,化学方程式为2C2H5OH+2Na→2C2H5ONa+H2↑;乙醇的官能团为羟基;(3) 图示实验装置不能说明一定有氢气产生,因为乙醇易挥发,乙醇、氢气燃烧都能生成水;(4) 乙醇分子中羟基上的氢原子没有水中氢原子活泼,乙醇与钠反应比水与钠反应平缓的多。
高考化学知识点过关培优训练∶乙醇与乙酸含答案

高考化学知识点过关培优训练∶乙醇与乙酸含答案一、乙醇与乙酸练习题(含详细答案解析)1.CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。
以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如图:(1)步骤①发生的反应离子方程式为___________________。
(2)步骤②所得滤渣1的主要成分为____________(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是____________。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为____________(选填:1∶2;3∶7;2∶3)外,另一目的是___________________。
(4)步骤⑥包含的操作有____________、过滤、洗涤及干燥。
(5)碳酸镁和碳酸钙与醋酸也可以恰好完全反应得到的混合物制融雪剂,下列有关说法错误的是_____A.该融雪剂中的醋酸钙、醋酸镁均是离子化合物B.该融雪剂还可用于除去煤燃烧产生的二氧化硫C.该融雪剂的水溶液显碱性D.生产该融雪剂所需碳酸盐与醋酸的物质的量之比为1:1【答案】MgCO3·CaCO3+4CH3COOH = Ca2++Mg2++4CH3COO-+2CO2↑+2H2O SiO2实验过程中苯酚被空气中氧气氧化最终产生褐色物质 3∶7 除去过量的乙酸蒸发结晶 D【解析】【分析】根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性炭脱色,除去被氧化的苯酚、焦油等杂质,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA。
备战高考化学乙醇与乙酸(大题培优)附答案解析

备战高考化学乙醇与乙酸(大题培优)附答案解析一、乙醇与乙酸练习题(含详细答案解析)1.乙醇(CH3CH2OH)是一种重要的有机物(1)根据乙醇分子式和可能结构推测,1mol乙醇与足量钠反应,产生氢气的物质的量可能是________________mol。
(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,该反应的化学方程式是________________________________,乙醇的官能团是_______________。
(3)用如图装置实验,干冷烧杯罩在火焰上,有无色液体产生。
能否据此说明一定有氢气产生,判断及简述理由是_________________________。
(4)乙醇与钠反应比水与钠反应平缓的多,原因是_______________________________ 。
【答案】0.5、2.5、3 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑羟基不能,因为氢气中会含有乙醇蒸汽乙醇分子中羟基上的氢原子没有水中氢原子活泼【解析】【分析】由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;乙醇的结构中含有官能团-羟基,能够与金属钠反应置换出氢气,且羟基中氢原子的活泼性小于水中氢原子活泼性,乙醇和钠反应与钠与水比较要缓慢的多,据以上分析解答。
【详解】(1)由乙醇的结构简式CH3CH2OH,可知乙醇分子内有三种不同环境下的氢原子,如果钠置换的是羟基氢原子,则1mol乙醇与足量钠反应生成0.5mol氢气,如果钠置换的是乙基上的氢原子,则1mol乙醇与足量钠反应生成2.5mol氢气,如果乙醇中的氢原子都能够被钠置换,则1mol乙醇与足量钠反应生成3mol氢气;(2)实验证明反应的乙醇与产生的氢气物质的量比值是2,说明钠与乙醇反应置换的是羟基上的氢原子,化学方程式为2C2H5OH+2Na→2C2H5ONa+H2↑;乙醇的官能团为羟基;(3) 图示实验装置不能说明一定有氢气产生,因为乙醇易挥发,乙醇、氢气燃烧都能生成水;(4) 乙醇分子中羟基上的氢原子没有水中氢原子活泼,乙醇与钠反应比水与钠反应平缓的多。
高考化学培优(含解析)之乙醇与乙酸含答案

高考化学培优(含解析)之乙醇与乙酸含答案一、乙醇与乙酸练习题(含详细答案解析)1.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水。
为研究A的组成与结构,进行了如下实验:(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。
则A的相对分子质量为:___。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。
则A的分子式为:___。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。
用结构简式表示A中含有的官能团为:___、__。
(4)A的核磁共振氢谱如图:则A中含有___种氢原子。
(5)综上所述,A的结构简式为___,跟NaHCO3溶液反应的离子方程式为___。
【答案】90 C3H6O3—COOH —OH 4 CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑【解析】【分析】【详解】(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为:45×2=90;(2)9.0g物质A的物质的量为0.1mol;浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量为:5.4g18g/mol=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是:13.2g44g/mol=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是90-312-616=3,即分子式为:C3H6O3;(3)只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,0.1molA可生成2.24LCO2(标准状况)即0.1mol二氧化碳,则含有一个-COOH;醇羟基和羧基可以和金属钠发生反应生成氢气,0.1molA与足量金属钠反应生成2.24LH2(标准状况)即0.1mol氢气,且已知含有一个羧基,则还含有一个-OH;(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种环境的氢原子;(5)综上所述A的结构简式为;与碳酸氢钠反应生成二氧化碳和水以及相应的钠盐,离子方程式为:CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑。
备战高考化学知识点过关培优训练∶乙醇与乙酸含答案

备战高考化学知识点过关培优训练∶乙醇与乙酸含答案一、乙醇与乙酸练习题(含详细答案解析)1.某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C、D、E;C又可以转化为B、D。
它们的转化关系如下:已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、D、的结构简式和所含官能团名称A_______、________,D__________、___________(2)写出反应⑤的化学方程式___________________________________;(3)从组成上分析反应⑨是___________(填反应类型)。
(4)F的同分异构体中能与NaOH溶液发生反应的共_______种(包含F),写出其中一种与NaOH溶液反应的化学方程式______________【答案】C2H5OH 羟基 CH3CHO 醛基 2C2H5OH+O2 2CH3CHO+H2O 氧化反应 6 −−→CH3CH2OH+CH3COONaCH3COOC2H5+NaOH∆【解析】【分析】D的蒸气密度是氢气的22倍,则相对分子质量为44,并可以发生银镜反应,说明含有-CHO,则D为CH3CHO;D被氧化生成E为CH3COOH,D被还原生成A为CH3CH2OH;A可以与浓氢溴酸发生取代生成B,B可以与碱的水溶液反应生成A,则B为CH3CH2Br,B可以在碱的醇溶液中反应生成C,则C为CH2=CH2;A与E可发生酯化反应生成F,F为CH3COOC2H5。
【详解】(1)根据分析可知A为CH3CH2OH,其官能团为羟基;D为CH3CHO,其官能团为醛基;(2)反应⑤为乙醇的催化氧化,方程式为2C2H5OH+O2 2CH3CHO+H2O;(3)C为CH2=CH2,D为CH3CHO,由C到D的过程多了氧原子,所以为氧化反应;(4)F的同分异构体中能与NaOH溶液发生反应,说明含有羧基或酯基,若为酯则有:HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3CH2COOCH3,若为羧酸则有:CH3CH(COOH)CH3、CH3CH2CH2COOH,所以包括F在内共有6种结构;酯类与NaOH反应方程式以乙酸乙酯为例:CH 3COOC 2H 5+NaOH ∆−−→ CH 3CH 2OH+CH 3COONa ,羧酸类:CH 3CH 2CH 2COOH+NaOH=CH 3CH 2CH 2COONa+H 2O 。
备战高考化学乙醇与乙酸(大题培优)附答案解析

备战高考化学乙醇与乙酸(大题培优)附答案解析一、乙醇与乙酸练习题(含详细答案解析)1.食品安全关系国计民生,影响食品安全的因素很多.(1)聚偏二氯乙烯()具有超强阻隔性能,可作为保鲜食品的包装材料.它是由________(写结构简式)发生加聚反应生成的,该物质的分子构型是__________________________ 。
(2)劣质植物油中的亚油酸(]324227[CH (CH )CH CHCH CH CH CH )COOH ==含量很低,下列关于亚油酸的说法中,正确的是_________。
A .分子式为18342C H OB .一定条件下能与甘油(丙三醇)发生酯化反应C .能和NaOH 溶液反应D.不能使酸性KMnO 4溶液褪色 (3)假酒中甲醇()3CH OH 含量超标,请写出Na 和甲醇反应的化学方程式:________。
(4)劣质奶粉中蛋白质含量很低.蛋白质水解的最终产物是________。
(5)在淀粉中加入吊白块制得的粉丝有毒.淀粉最终的水解产物是葡萄糖.请设计实验证明淀粉已经完全水解,写出操作、现象和结论:____________________________。
【答案】22CCl CH = 平面型 BC 3322CH OH 2Na 2CH ONa H +→+↑ 氨基酸 取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解【解析】【分析】(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可;乙烯为平面型分子;(2)根据结构式可分析结果;(3)Na 和甲醇反应生成甲醇钠和氢气;(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸;(5)淀粉若完全水解,加入碘水溶液不变蓝色。
【详解】(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可,其单体为22CCl CH =,乙烯为平面型分子,22CCl CH =也为平面型分子,故答案为:22CCl CH =;平面型;(2)A. 由结构式可知分子式为18322C H O ,A 项错误;B.含有羧基能与甘油发生酯化反应,B 项正确;C.含有羧基能与氢氧化钠发生中和反应,C 项正确;D.含有碳碳双键能使酸性4KMnO 溶液褪色,D 项错误,故选:BC ;(3)Na 和甲醇反应生成甲醇钠和氢气,反应方程式为:3322CH OH 2Na 2CH ONa H +→+↑,故答案为:3322CH OH 2Na 2CH ONa H +→+↑;(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸,故答案为:氨基酸;(5)淀粉若完全水解,加入碘水溶液不变蓝色,可设计方案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解,故答案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解。
备战高考化学培优专题复习乙醇与乙酸练习题附答案解析

备战高考化学培优专题复习乙醇与乙酸练习题附答案解析一、乙醇与乙酸练习题(含详细答案解析)1.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室制取乙酸乙酯。
回答下列问题:(1)浓硫酸的作用是:________________________。
(2)饱和碳酸钠溶液的主要作用是__________________________________________。
(3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是_____。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。
下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度不再变化【答案】催化作用和吸水作用吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到防止倒吸分液防止暴沸②④⑤【解析】【分析】(1)浓硫酸具有脱水性、吸水性及强氧化性;(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;(3)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,导管伸入液面下可能发生倒吸;(4)乙酸乙酯不溶于水;(5)根据可逆反应平衡状态标志的判断依据进行分析。
【详解】(1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,故答案为:催化作用和吸水作用;(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,故答案为:吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到;(3)导管若插入溶液中,反应过程中可能发生倒吸现象,所以导管要插在饱和碳酸钠溶液的液面上,目的是防止倒吸,故答案为:防止倒吸;(4)乙酸乙酯不溶于水,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,故答案为:分液;(5)①单位时间内生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;②单位时间内生成1mol 乙酸乙酯,同时生成1mol 乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;③单位时间内消耗1mol 乙醇,同时消耗1mol 乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;④正反应的速率与逆反应的速率相等,各组分的密度不再变化,达到了平衡状态,故④正确;⑤混合物中各物质的浓度浓度不再变化,各组分的密度不再变化,达到了平衡状态,故⑤正确;故答案为:②④⑤。
高考化学 乙醇与乙酸 培优练习(含答案)及答案

高考化学乙醇与乙酸培优练习(含答案)及答案一、乙醇与乙酸练习题(含详细答案解析)1.CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。
以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如图:(1)步骤①发生的反应离子方程式为___________________。
(2)步骤②所得滤渣1的主要成分为____________(写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是____________。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为____________(选填:1∶2;3∶7;2∶3)外,另一目的是___________________。
(4)步骤⑥包含的操作有____________、过滤、洗涤及干燥。
(5)碳酸镁和碳酸钙与醋酸也可以恰好完全反应得到的混合物制融雪剂,下列有关说法错误的是_____A.该融雪剂中的醋酸钙、醋酸镁均是离子化合物B.该融雪剂还可用于除去煤燃烧产生的二氧化硫C.该融雪剂的水溶液显碱性D.生产该融雪剂所需碳酸盐与醋酸的物质的量之比为1:1【答案】MgCO3·CaCO3+4CH3COOH = Ca2++Mg2++4CH3COO-+2CO2↑+2H2O SiO2实验过程中苯酚被空气中氧气氧化最终产生褐色物质 3∶7 除去过量的乙酸蒸发结晶 D【解析】【分析】根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性炭脱色,除去被氧化的苯酚、焦油等杂质,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
备战高考化学知识点过关培优训练∶乙醇与乙酸附答案一、乙醇与乙酸练习题(含详细答案解析)1.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室制取乙酸乙酯。
回答下列问题:(1)浓硫酸的作用是:________________________。
(2)饱和碳酸钠溶液的主要作用是__________________________________________。
(3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是_____。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________________。
(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。
下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度不再变化【答案】催化作用和吸水作用吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到防止倒吸分液防止暴沸②④⑤【解析】【分析】(1)浓硫酸具有脱水性、吸水性及强氧化性;(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;(3)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,导管伸入液面下可能发生倒吸;(4)乙酸乙酯不溶于水;(5)根据可逆反应平衡状态标志的判断依据进行分析。
【详解】(1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动,故答案为:催化作用和吸水作用;(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,故答案为:吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到;(3)导管若插入溶液中,反应过程中可能发生倒吸现象,所以导管要插在饱和碳酸钠溶液的液面上,目的是防止倒吸,故答案为:防止倒吸;(4)乙酸乙酯不溶于水,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,故答案为:分液;(5)①单位时间内生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;②单位时间内生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到平衡状态,故②正确;③单位时间内消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;④正反应的速率与逆反应的速率相等,各组分的密度不再变化,达到了平衡状态,故④正确;⑤混合物中各物质的浓度浓度不再变化,各组分的密度不再变化,达到了平衡状态,故⑤正确;故答案为:②④⑤。
2.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水。
为研究A的组成与结构,进行了如下实验:(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。
则A的相对分子质量为:___。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。
则A的分子式为:___。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。
用结构简式表示A中含有的官能团为:___、__。
(4)A的核磁共振氢谱如图:则A中含有___种氢原子。
(5)综上所述,A的结构简式为___,跟NaHCO3溶液反应的离子方程式为___。
【答案】90 C3H6O3—COOH —OH 4 CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑【解析】【分析】【详解】(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为:45×2=90;(2)9.0g物质A的物质的量为0.1mol;浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量为:5.4g18g/mol=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是:13.2g44g/mol=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是90-312-616=3,即分子式为:C3H6O3;(3)只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,0.1molA可生成2.24LCO2(标准状况)即0.1mol二氧化碳,则含有一个-COOH;醇羟基和羧基可以和金属钠发生反应生成氢气,0.1molA与足量金属钠反应生成2.24LH2(标准状况)即0.1mol氢气,且已知含有一个羧基,则还含有一个-OH;(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种环境的氢原子;(5)综上所述A的结构简式为;与碳酸氢钠反应生成二氧化碳和水以及相应的钠盐,离子方程式为:CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑。
3.高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。
E的合成路线如下(部分反应条件和试剂略):请回答下列问题:(1)试剂Ⅰ的名称是______,试剂Ⅱ中官能团的名称是______,第②步的反应类型是_______。
(2)第①步反应的化学方程式是_____________。
(3)第⑥步反应的化学方程式是_____________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。
若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________。
【答案】甲醇溴原子取代反应CH3I【解析】【分析】【详解】(1)试剂Ⅰ的结构简式为CH3OH,名称为甲醇;试剂Ⅱ的结构简式为BrCH2CH2CH2Br,所含官能团的名称为溴原子;根据和的结构及试剂Ⅱ判断第②步的反应类型为取代反应。
(2)根据题给转化关系知第①步反应为CH3CH(COOH)2和CH3OH在浓硫酸、加热的条件下发生酯化反应生成CH3CH(COOCH3)2和水,化学方程式为。
(3)根据题给转化关系推断C为,结合题给信息反应知在加热条件下反应生成,化学方程式为。
(4)试剂Ⅲ为单碘代烷烃,根据和的结构推断,试剂Ⅲ的结构简式是CH3I。
(5)C的分子式为C15H20O5,其同分异构体在酸性条件下水解,含有酯基,生成X、Y和CH3(CH2)4OH,生成物X含有羧基和苯环,且X和Y的核磁共振氢谱均只有两种类型的吸收峰,则X为对二苯甲酸,Y为CH2OHCH2OH,则X与Y发生缩聚反应所得缩聚物的结构简式是。
【点睛】本题考查选修5《有机化学基础》相关知识,以简答或填空形式考查。
常涉及如下高频考点:有机物的命名;官能团的识别、检验方法和官能团转化的反应条件;反应类型判断;有机物分子中原子共线、共面分析;有机物结构简式推断及书写;有机化学反应方程式书写;同分异构数目判断及书写;有机物合成路线设计等。
解答此类题目首先要熟练掌握常见有机物官能团的性质和相互转化关系,然后阅读题给信息(转化关系和题给信息反应),与教材信息整合形成新的知识网络。
有机推断的关键点是寻找突破口,抓住突破口进行合理假设和推断。
常见突破口有:特殊颜色,特殊状态,特殊气味等物理性质;特殊反应类型和反应条件,特殊反应现象和官能团所特有的性质,特殊制法和特殊用途等。
有机合成首先判断目标有机物属于哪类有机物,其次分析目标有机物中碳原子的个数、碳链组成与原料、中间物质的组成关系。
根据给定原料,结合信息,利用反应规律合理地把目标有机物分解成若干个片段,找出官能团引入、转换的途径及保护方法。
找出关键点、突破点后,要正向思维和逆向思维、纵向思维和横向思维相结合,选择最佳合成途径。
(5)小题是本题的难点,首先根据C的分子式和题给信息确定其同分异构体属于酯类,结合水解产物的结构和性质确定X为对二苯甲酸,Y为CH2OHCH2OH,进一步写出缩聚产物的结构简式。
审清题目的要求,规范书写化学用语是得分的关键。
题目难度适中。
4.已知:CH3-CH=CH2+HBr→CH3-CHBr-CH3(主要产物)。
1mol某芳香烃A充分燃烧后可以得到8mol CO2和4mol H2O。
该烃A在不同条件下能发生如下所示的一系列变化。
回答下列问题:(1)A的分子式为_____________,E中官能团名称为___________。
(2)F的结构简式为_______________,③的反应类型为______________。
(3)写出下列反应的化学方程式:② ________________________________;④ ________________________________;(4)下列关于F的说法正确的是_____(填序号)。
a.能发生消去反应b.能与金属钠反应c.1mol F最多能和3mol氢气反应d.分子式是C8H9【答案】C8H8碳碳三键加成abc【解析】【分析】1mol某烃A充分燃烧后可以得到8molCO2和4molH2O,故烃A的分子式为C8H8,不饱和度为28282⨯+-=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为,C为,A与溴发生加成反应生成B,B为,B 在氢氧化钠醇溶液、加热条件下发生消去反应生成E,E为,E与溴发生加成反应生成,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,与HBr放出加成反应生成D,D为,在氢氧化钠水溶液、加热条件下发生水解反应生成F,F为,与乙酸发生酯化反应生成H,H为,据此解答。
【详解】(1)由分析知,A的分子式为C8H8;E的结构简式为,官能团名称为碳碳三键;(2) 由分析知,F的结构简式为;反应③为碳碳双键的加成,反应类型为加成反应;(3)反应②为在氢氧化钠醇溶液、加热条件下发生消去反应生成,反应方程式为;反应④为苯乙烯发生加成反应,方程式为;(4) F为;a.F中羟基邻位碳上有氢原子,能发生消去反应,故a正确;b.F中羟基与金属钠反应产生氢气,故b正确;c.F中有一个苯环,所以1molF最多能和3mol氢气发生加成反应,故c正确;d.F的分子式是C8H10O,故d错误;故答案为abc。
