医疗器械法规受控文件清单
医疗器械受控文件清单

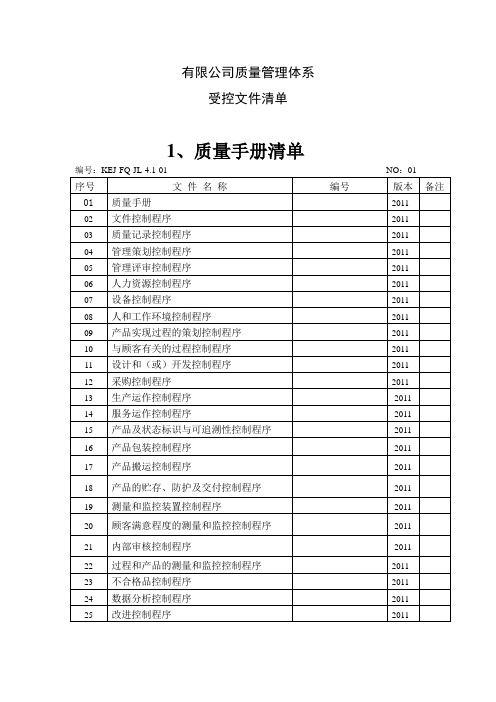
有限公司质量管理体系受控文件清单1、质量手册清单编号:KEJ-FQ-JL-4.1-01 NO :01序号文件名称编号版本备注01 质量手册202202 文件控制程序202203 质量记录控制程序202204 管理策划控制程序202205 管理评审控制程序202206 人力资源控制程序202207 设备控制程序202208 人和工作环境控制程序202209 产品实现过程的策划控制程序202210 与顾客有关的过程控制程序202211 设计和(或者)开辟控制程序202212 采购控制程序202213 生产运作控制程序202214 服务运作控制程序202215 产品及状态标识与可追溯性控制程序202216 产品包装控制程序202217 产品搬运控制程序202218 产品的贮存、防护及交付控制程序202219 测量和监控装置控制程序202220 顾客满意程度的测量和监控控制程序202221 内部审核控制程序202222 过程和产品的测量和监控控制程序202223 不合格品控制程序202224 数据分析控制程序202225 改进控制程序20222、部门质量职责文件清单编号:KEJ-FQ-JL-4.1-01 NO :01序号文件名称编号版本备注01 行政人事部质量职责202202 质量管理部质量职责202203 生产部质量职责202204 物料部质量职责202205 技术部质量职责202206 营销部质量职责202207 财务部质量职责202208 仓库质量职责202209 总经理质量职责202210 执行总经理质量职责202211 行政人事部经理质量职责202212 质量管理者质量职责202213 质量管理部质量职责202214 质量管理员质量职责202215 检验员质量职责202216 生产部经理质量职责202217 车间主任质量职责202218 外包车间主任质量职责202219 生产操作人员质量职责202220 技术部经理质量职责202221 技术员质量职责202222 采购部经理质量职责202223 采购员质量职责202224 营销部经理质量职责202225 营销员质量职责202226 开票员质量职责202227 物料部经理质量职责202228 保管员质量职责202229 运输人员质量职责202230 财务部经理质量职责20223、质量管理文件清单(1)编号:KEJ-FQ-JL-4.1-01 NO :01序号文件名称编号版本备注01 质量否决权制度202202 关键工序质量控制点检查制度202203 产品质量档案制度202204 留样观察制度202205 用户访问制度202206 质量事故报告制度202207 质量统计报告制度202208 顾客投诉处理制度202209 洁净车间环境监测管理制度202210 检测室管理制度202211 检测室安全守则202212 检测设备管理制度202213 产品出厂检测管理制度202214 生产前物料验收管理制度202215 抽样方法202216 生产检测设备校验管理制度202217 化学试剂管理制度202218 检验报告(记录)管理制度202219 产品销后退回处理制度2022内部质量审核控制程序202220 出厂检验操作规程202221 过程检验操作规程202222 无菌检测操作规程202223 pH 计操作规程202224 干湿温度计使用方法202225 高压蒸汽灭菌器操作规程202226 超净工作台操作规程202227 生化培养箱操作规程202228 电子天平操作规程202229 霉菌培养箱操作规程202230 恒温干燥箱操作规程20223、质量管理文件清单(2)编号:KEJ-FQ-JL-4.1-01 NO :01序号文件名称编号版本备注31 壳聚糖质量标准202232 明胶质量标准202233 甘油质量标准202234 硬脂酸质量标准202235 纯化水质量标准202236 羧甲基纤维素钠质量标准202237 薄荷脑质量标准202238 卡波姆质量标准202239 PVC 质量标准202240 铝箔质量标准202241 塑瓶(给药器、喷瓶) 202242 小(中)盒质量标准202243 说明书质量标准202244 纸箱质量标准202245 复合膜袋质量标准20224、生产管理文件清单(1)编号:KEJ-FQ-JL-4.1-01 NO:01序号文件名称编号版本备注1 洁净车间管理规定 20222 外包车间管理规定 20223 物料净化室管理规定 20224 洗衣消毒间管理规定 20225 换鞋管理规定 20226 更衣间更衣管理规定 20227 生产设备管理规定 20228 工作服管理规定 20229 岗位操作管理规定 202210 工艺流程管理规定 202211 工序管理点管理规定 202212 工艺纪律检查管理规定 202213 原辅材料、外购外协件使用管理规定 202214 生产原始记录管理规定 202215 原辅材料、外购零配件消耗定额管理规定 202216 不合格产品管理规定 202217 不合格原辅料、外协件包装材料管理规定 202218 生产试验管理规定 202219 技术分析会管理规定 202220 生产日期、批号、灭菌失效期管理规定 202221 制水设备清洗、消毒管理规定 202222 工艺用水管理规定 202223 产品标识管理规定 202224 产品灭菌管理规定 202225 人员进出洁净区净化程序 202226 物品进出洁净区净化程序 202227 车间交接班管理制度 202228 片剂生产作业指导书 202229 栓剂生产作业指导书 202230 喷膜剂生产作业指导书 202231 水凝胶生产作业指导书 202232 敷尔康创伤愈合海绵生产作业指导书 202233 远红外热收缩机操作与维护规程 202234 打码机操作与维护规程 202235 压片机操作与维护规程 202236 铝塑包装机操作与维护规程 20225、生产管理文件清单(2)编号:KEJ-FQ-JL-4.1-01 NO:01序号文件名称编号版本备注37 纯化水系统操作与维护规程 202238 空调净化系统操作与维护规程 202239 真空乳化机操作与维护规程 202240 膏体灌装机操作与维护规程 202241 多功能薄膜封口机操作与维护规程 202242 卧式转换型冷冻箱操作与维护规程 202243 口腔溃疡贴质量控制点 202244 壳聚糖妇科抗菌栓质量控制点 202245 壳聚糖生物护伤喷膜剂质量控制点 202246 壳聚糖妇科抗菌水凝胶质量控制点 202247 敷尔康创伤愈合海绵质量控制点 20225、物料管理文件清单编号: KEJ-FQ-JL-4.1-01 NO :01文 件 名 称 备注6、营销管理文件清单编号: KEJ-FQ-JL-4.1-01 NO :01版本 2022 2022 2022 2022 2022 2022 2022备注7、卫生管理文件清单编号: KEJ-FQ-JL-4.1-01 NO :01序号 文 件 名 称 1 环境卫生管理规程2 非洁净区环境卫生管理规程3 非洁净区工艺卫生管理规程4 防止交叉污染管理规程5 洁净区环境卫生管理规程6 洁净区工艺卫生管理规程7 人员进出洁净区的净化规程8 物料、容器及工具进出洁净区的净化规程 9 洁净区地漏清洁标准操作规程 10 洁净区清洁规程 11 洁净室消毒规程12 消毒剂和清洁剂的配制与使用规程 13 洁净服清洁规程 编号KEJ-FQ-WS-2022-01 KEJ-FQ-WS-2022-02 KEJ-FQ-WS-2022-03 KEJ-FQ-WS-2022-04 KEJ-FQ-WS-2022-05 KEJ-FQ-WS-2022-06 KEJ-FQ-WS-2022-07 KEJ-FQ-WS-2022-08 KEJ-FQ-WS-2022-09 KEJ-FQ-WS-2022-10 KEJ-FQ-WS-2022-11 KEJ-FQ-WS-2022-12 KEJ-FQ-WS-2022-13版本 备注 2022 2022 2022 2022 2022 20222022 2022 2022 2022 2022 2022 2022序号版本 编号 编号KEJ-FQ-YX-2022-01 KEJ-FQ-YX-2022-02 KEJ-FQ-YX-2022-03 KEJ-FQ-YX-2022-04 KEJ-FQ-YX-2022-05 KEJ-FQ-YX-2022-06 KEJ-FQ-YX-2022-07 序号 文 件 名 称 1 营销管理规程 2 销售记录管理规程 3 批销售记录管理规程 4 市场调查管理制度 5 售后服务制度6 产品质量信息反馈制度7 不良事件监测及上报管理制度8、设备管理文件清单编号:KEJ-FQ-JL-4.1-01 NO:01序号文件名称1 设备管理规程2 设备购置管理规程3 设备开箱验收制度4 设备的安装与调试管理规程5 设备的使用与维修保养管理规程6 设备润滑管理规程7 设备巡回检查规程8 设备计划检修管理规程9 设备备件管理规程10 压力容器管理规程11 输送管道和设备状态标记管理规程12 设备编号管理规程13 计量管理规程14 设备事故管理规程15 设备的更新改造与报废管理规程16 设备档案管理规程17 洁净厂房的验收管理规程编号KEJ-FQ-SB-2022-01KEJ-FQ-SB-2022-02KEJ-FQ-SB-2022-03KEJ-FQ-SB-2022-04KEJ-FQ-SB-2022-05KEJ-FQ-SB-2022-06KEJ-FQ-SB-2022-07KEJ-FQ-SB-2022-08KEJ-FQ-SB-2022-09KEJ-FQ-SB-2022-10KEJ-FQ-SB-2022-11KEJ-FQ-SB-2022-12KEJ-FQ-SB-2022-13KEJ-FQ-SB-2022-14KEJ-FQ-SB-2022-15KEJ-FQ-SB-2022-16KEJ-FQ-SB-2022-17版本备注2022202220222022202220222022202220222022202220222022202220222022202214 洁净鞋清洁规程KEJ-FQ-WS-2022-14 202215 卫生状态标识管理规程KEJ-FQ-WS-2022-15 202216 清洁工具清洁管理规程KEJ-FQ-WS-2022-16 202217 周转容器清洁规程KEJ-FQ-WS-2022-17 202218 外来人员进出洁净区管理规程KEJ-FQ-WS-2022-18 202219 设备清洁规程通则KEJ-FQ-WS-2022-18 202220 废弃物的管理规程KEJ-FQ-WS-2022-19 202221 圾站管理规程KEJ-FQ-WS-2022-20 202222 昆虫和鼠害控制规程KEJ-FQ-WS-2022-21 202223 非洁净服管理规程KEJ-FQ-WS-2022-22 202224 灭蚊灯清洁管理规程KEJ-FQ-WS-2022-23 202218 洁净厂房管理规程KEJ-FQ-SB-2022-18 202219 厂房及设施保养、维修管理规程KEJ-FQ-SB-2022-19 202220 压力容器防爆措施KEJ-FQ-SB-2022-20 2022现行法律法规文件清单编号:KEJ-FQ-JL-4.1-01 NO:01序号文件名称编号版本备注1 医疗器械监督管理条例(国务院令第276 号) 20002 医疗器械临床实验规定(国药监局令第05 号) 20043 医疗器械说明书:标签和包装标识管理规定 (国药监 2004局令第10 号)4 医疗器械生产监督管理办法(国药监局令第12 号) 20045 医疗器械分类规则(国药监局令第15 号) 20006 医疗器械注册管理办法(国药监局令第16 号) 20047 医疗器械新产品审批规定(试行) (国药监局令第17 2000号)8 医疗器械生产企业质量体系考核办法(国药监局令第 200022 号)9 医疗器械说明书管理规定(国药监局令第30 号) 200210 医疗器械标准管理办法(试行)(国药监局令第31 号) 200111 国家食品、药品监督管理局行政立法程序规定 (国药 2002监局令第33 号)12 国家食品药品监督管理局行政复议暂行办法(国药监 2002局令第34 号)13 湖南省医疗生产企业资格认可实施细则14 商品条码管理办法 200515 医疗器械生产质量管理规范 202216 医疗器械召回管理办法 2022。
医疗器械法规文件汇总

医疗器械法规文件汇总这次我们打破按时间分类整理,根据类型不同,我们对医疗器械法规做了汇总。
大家可以根据需求和兴趣了解相关的法规,再也不用在密密麻麻的法规中分辨哪一个是所需的了。
通用篇类型文件号名称发布日期实施日期通用国食药监械[2011]425号《医疗器械不良事件监测工作指南》(试行)的通知2011/9/16通用国务院令第650号《医疗器械监督管理条例》2014/3/72014/6/1通用局令第3号《食品药品行政处罚程序规定》2014/4/282014/6/1通用局令6号《医疗器械说明书和标签管理规定》2014/7/302014/10/1通用食药监械监〔2014〕235号印发国家重点监管医疗器械目录的通知2014/9/30通用主席令第22号《中华人民共和国广告法》2015/4/242015/9/1通用局令第14号《药品医疗器械飞行检查办法》2015/6/292015/9/1通用局令第15号《医疗器械分类规则》2015/7/142016/1/1通用食药监办械监函〔2015〕723号征求医疗器械不良事件监测和再评价管理办法(征求意见稿)意见的函2015/11/12通用总局令第19号《医疗器械通用名称命名规则》2015/12/212016/4/1通用征求医疗器械分类目录(修订稿)意见的函2016/9/30通用局令29号《医疗器械召回管理办法》2017/2/82017/5/1通用局令32号《国家食品药品监督管理总局关于调整部分医疗器械行政审批事项审批程序的决定》2017/4/62017/7/1通用局令33号《医疗器械标准管理办法》2017/4/262017/7/1临床篇类型文件号名称发布日期实施日期临床食药监械管〔2014〕 13号《创新医疗器械特别审批程序(试行)》2014/2/102014/3/1临床2014年第12号关于发布免于进行临床试验的第二类医疗器械目录的通告2014/8/21临床2014年第13号关于发布免于进行临床试验的第三类医疗器械目录的通告2014/8/21临床2014年第14号关于发布需进行临床试验审批的第三类医疗器械目录的通告2014/8/25临床体外诊断试剂临床试验技术指导原则2014/9/11临床医疗器械临床评价技术指导原则2015/5/19临床医疗器械临床评价技术指导原则2015/6/12临床征求《医疗器械临床试验机构资质认定管理办法》﹙征求意见稿﹚意见的通知2015/7/20临床2015年第117号关于开展药物临床试验数据自查核查工作的公告2015/7/22临床总局令第25号《医疗器械临床试验质量管理规范》2016/3/232016/6/1临床2016年第98号关于开展医疗器械临床试验监督抽查工作的通告2016/6/8关于发布第二批免于进行临临床2016年第133号关于发布第二批免于进行临床试验医疗器械目录的通告(二类、三类)2016/9/30临床食药监械管便函〔 2014〕44号关于《体外诊断试剂临床试验技术指导原则》和《体外诊断试剂说明书编写指导原则》征求意见的通知2014/8/14注册篇类型文件号名称发布日期实施日期注册医疗器械产品技术要求编写指导原则2014/5/30注册局令4号《医疗器械注册管理办法》2014/7/302014/10/1注册医疗器械软件注册技术审查指导原则2015/8/5注册局令30号《体外诊断试剂注册办法修正案》2017/2/82017/2/8生产篇类型文件号名称发布日期实施日期生产食药监办械监〔 2014〕 7号关于印发医疗器械生产日常监督现场检查工作指南的通知2014/1/13生产2014年第8号关于发布第一类医疗器械产品目录的通告2014/5/30生产局令第7号《医疗器械生产监督管理办法》2014/7/302014/10/1生产2014年第18号关于发布禁止委托生产医疗器械目录的通告2014/9/26生产关于印发医疗器械生产企业分类分级监督管理规定的通知2014/9/30生产《医疗器械生产质量管理规范》2015/1/162015/3/1生产2015年第1号医疗器械生产企业供应商审核指南2015/1/19生产2015年第102号关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告2015/7/10生产2015年第101号关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告2015/7/10生产2015年第103号关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告2015/7/10生产食药监械监〔2015〕 218号关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知2015/9/25生产食药监科〔2015〕 249号关于印发医疗器械检验机构资质认定条件的通知2015/11/4生产食药监办科函〔 2015〕 775号关于医疗器械检验机构资质认定条件有关事项的通知2015/12/7生产2016年第19号关于第三类医疗器械生产企业实施医疗器械生产质量管理规范有关事宜的通告2016/2/5生产〔 2016〕 17号关于征求医疗器械生产企业质量管理体系年度自查报告编写指南意见的函2016/3/4经营篇类型文件号名称发布日期实施日期经营局令第8号《医疗器械经营监督管理办法》2014/7/302014/10/1经营2014年第58号《医疗器械经营质量管理规范》2014/12/122014/12/12经营食药监械监〔2015〕 158号关于印发医疗器械经营企业分类分级监督管理规定的通知2015/8/17经营食药监械监〔关于印发医疗器械经营环节2015/8/17经营食药监械监〔2015〕 159号关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知2015/8/17经营食药监械监〔2015〕 239号关于印发医疗器械经营质量管理规范现场检查指导原则的通知2015/10/15经营局令第18号《医疗器械使用质量监督管理办法》2015/10/212016/2/1经营食药监办械监函〔 2015〕646号关于经营体外诊断试剂相关问题的复函2015/10/22经营2016年第112号)关于整治医疗器械流通领域经营行为的公告2016/6/7经营2016年第154号医疗器械冷链(运输、贮存)管理指南2016/9/22。
医疗器械相关法规与标准清单
命名
有
无
医疗器械注册管理法规解读之六(命 名)
2016.1.7
命名
有
无
国家食品药品监督 管理总局令第29号
医疗器械召回管理办法
2017.2.8
召回
有
无
《医疗器械召回管理办法》解读
2017.2.8
召回
有
无
《医疗器械召回管理办法》解读之二
2017.5.24
召回
有
无
总局办公厅关于实施《医疗器械召回 管理办法》有关事项的通知
则(2017年修订版)
主清单
2017.4.27
注册
有
无
国食药监械
[2008]409号
关于印发进一步加强和规范医疗器 械注册管理暂行规定的通知
2008.7.23
(已废止)
有
无
总局关于印发一次性使用塑料血袋 等21种医疗器械生产环节风险清单 和检查要点的通知
2017.2.10
注册
有
无
食药监械监〔2016〕
分类
有
无
5 / 11
国家食品药品监督 管理总局令第15号
医疗器械相关法规与标准
医疗器械分类规则
主清单
2015.7.14
分类
有
无
医疗器械分类目录
分类
有
无
国家食品药品监督 管理总局公告2014年第26号
国家食品药品监督管理总局关于第 一类医疗器械备案有关事项的公告
2014.10.1
备案
有
无
食药监办械管
[2014]174号
2015.2.5
说明书与标 签
有
无
医疗器械法规文件大全

医疗器械法规文件大全在本文中,将为您提供医疗器械法规文件的大全。
这些法规文件对于医疗器械的研发、生产、销售和使用具有重要的指导和规范作用。
以下为医疗器械法规文件的详细列表:一、《医疗器械监督管理办法》该法规文件规定了医疗器械的分类、注册、备案、生产、经营、使用等方面的监督管理要求。
二、《医疗器械注册管理办法》该法规文件详细规定了医疗器械注册申请的程序、材料要求、审评审批等内容,对于保证医疗器械的质量和安全具有重要意义。
三、《医疗器械广告审查管理办法》该法规文件对医疗器械广告的内容、形式、批准程序等进行了规范,旨在保护消费者的知情权和权益。
四、《医疗器械不良事件报告与处理办法》该法规文件要求医疗器械生产企业、经营企业和使用单位在发现医疗器械不良事件后的报告、调查和处理程序,以确保人民群众的生命健康安全。
五、《医疗器械召回管理办法》该法规文件规定了医疗器械的召回程序、责任主体、召回范围等要求,保障患者和消费者的权益。
六、《医疗器械注册人员管理办法》该法规文件对从事医疗器械注册工作的人员的资质要求、考核、管理等进行了详细规定,提高了从业人员的专业素质和管理水平。
七、《医疗器械生产许可证管理办法》该法规文件规定了医疗器械生产企业的准入条件、审批程序、生产许可证的有效期等内容,保证医疗器械生产的规范和质量安全。
八、《医疗器械经营许可证管理办法》该法规文件对医疗器械经营企业的申请、审批、管理等方面进行了详细规定,促进了医疗器械市场的有序运行。
九、《医疗器械标准化管理办法》该法规文件对医疗器械标准的制定、修订、执行等方面进行了规范,提高了医疗器械产品的质量和安全性。
十、《医疗器械监督抽查管理办法》该法规文件明确了医疗器械监督抽查的程序、标准和结果公布等要求,保障了医疗器械市场的公平竞争和消费者的权益。
十一、《医疗器械注册和备案监管规定》该法规文件对医疗器械注册和备案的管理要求进行了详细规定,推动了医疗器械的科学研发和技术创新。
04医疗器械法律法规清单
局令第15号
医疗器械说明书、标签和包装标识管理规定
局令第10号
医疗器械广告审查办法
局令第24号
医疗器械广告审查标准
局令第23号
医疗器械分类规则
局令第15号
医疗器械标准管理办法(试行)
局令第31号
医疗器械临床试验规定
局令第5号
关于印发《境内第一类医疗器械注册审批操作规范(试行)》和《境内第二类医疗器械注册审批操作规范(试行)》的通知
国食药监械[2005]73号
《医疗器械生产企业许可证》现场审查评分表:
医疗器械生产企业质量管理体系规范无菌医疗器械实施则(试点用)
医疗器械生产企业质量管理体系规范
无菌医疗器械检查指南(试点用)
医疗器械生产企业质量管理体系规范无菌医疗器械实施细则(试点用)
浙江省第二类医疗器械产品注册受理标准
中华人民共和国标准化法
中华人民共和国产品质量法
中华人民共和国劳动合同法
医疗器械法律法规文件汇总电子版
医疗器械分类
08版
国家药品临床研究基地目录
余姚市吉康医疗器械厂
医疗器械法律、法规清单
QR-4.2.3-04№:
日期
法律、法规名称
法律、法规编号
版本
数量
备注
《医疗器械生产企业许可证》审批操作规范
医疗器械监督管理条例国务院第276号医疗器械注册管理办法
局令第16号
医疗器械生产监督管理办法
局令第12号
医疗器械生产企业质量体系考核办法
局令第22号
最新医疗器械法规文件大全

最新医疗器械法规文件大全医疗器械法规文件是指国家和地方政府出台的相关规定,以管理和监督医疗器械的研发、生产、销售和使用等各个环节。
这些法规文件的出台旨在保障公众的健康和安全,维护医疗器械市场的秩序。
以下是一些最新的医疗器械法规文件的简要介绍:1.中华人民共和国医疗器械监督管理法2.医疗器械产品注册管理办法医疗器械产品注册管理办法是指定医疗器械产品注册的管理要求,包括注册申请材料的提交、技术要求的审查、临床试验的进行等方面的规定。
该办法加强了医疗器械产品注册的管理,提高了注册审查的效率和严格性。
3.医疗器械不良事件报告与处理办法医疗器械不良事件报告与处理办法规定了医疗器械不良事件的申报、调查、评估、处理等程序和要求。
该办法要求各生产经营单位在发现医疗器械不良事件后及时报告,并按规定进行调查和处理,以保障公众的健康和安全。
4.医疗器械生产许可管理办法医疗器械生产许可管理办法规定了医疗器械生产许可的申请、审查、发放等过程和要求。
该办法要求生产企业取得医疗器械生产许可证后方可开展生产经营活动,加强了对医疗器械生产环节的监管。
5.医疗器械经营许可管理办法医疗器械经营许可管理办法规定了医疗器械经营许可的申请、审查、发放等程序和要求。
该办法要求经营企业取得医疗器械经营许可证后方可进行医疗器械的销售和供应,加强了对医疗器械销售环节的监管。
6.医疗器械广告管理办法医疗器械广告管理办法规定了医疗器械广告的发布、审查、监督等内容和要求。
该办法要求医疗器械广告必须真实、准确,不夸大宣传,保护消费者权益,防止虚假宣传误导消费者。
以上是一些最新的医疗器械法规文件的简要介绍,通过这些法规文件的出台和执行,可以更好地规范和管理医疗器械的生产、销售和使用等各个环节,保障公众的健康和安全。
医疗器械法规及标准清单2023.11.29
14
部门规章
国家市场监督管理总 局令第54号
医疗器械经营监督管理办法
15
部门规章
国家食品药品监督管 理总局令第15号
医疗器械分类规则
发布时间 施行时间 2021.02.09 2021.06.01
发文部门 国务院
2000.05.22 2000.07.01 国家市场监督管理总局
2009.04.07
2009.05.20
2022.03.10 2022.05.01 国家市场监督管理总局
2015.07.14
2016.01.01
国家食品药品监督管理总 局
备注
医疗器械标准管理办法
10
部门规章
国家食品药品监督管 理总局令第38号
医疗器械网络销售监督管理办法
11
部门规章
国家市场监督管理总 局令第1号
医疗器械不良事件监测和再评价管理办法
12
部门规章
国家市场监督管理总 局令第47号
医疗器械注册与备案管理办法
13
部门规章
国家市场监督管理总 局令第53号
医疗器械生产监督管理办法
序 号
类别
文件编号
文件名称
1
行政法规
中华人民共和国国务 院令第739号
医疗器械监督管理条例
2
部门规章
国家药品监督管理局 令第22号
医疗器械生产企业质量体系考核办法
3
部门规章
国家食品药品监督管 理局令第65号
医疗器械广告审查办法
4
部门规章
国家食品药品监督管 理总局令第6号
医疗器械说明书和标签管理规定
5
国家食品药品监督管理总 局
2014.07.30 2014.10.01 国家市场监督管理总局
医疗器械受控文件清单

医疗器械受控文件清单在医疗器械行业中,为确保产品质量和安全,减少潜在风险,各个国家和地区都制定了一系列受控文件。
这些受控文件包括标准、指南、规范、法规等,为医疗器械制造商、分销商、使用者等提供了必要的操作指导和法律依据。
以下是医疗器械受控文件的一些常见清单。
2. 行业标准:行业标准是由相关行业组织或协会制定的,针对一些特定领域或行业。
在医疗器械行业中,这些标准通常与特定类型的器械或技术有关。
比如美国FDA的21 CFR Part 820医疗器械质量体系标准、欧洲联盟的医疗器械指令(MDD)等。
3.法规要求:各国和地区的法规要求也是医疗器械制造商和分销商必须遵守的受控文件。
这些法规规定了医疗器械的注册、批准、生产、销售等方面的要求。
比如美国的食品药品监督管理局(FDA)的医疗器械法规、欧洲联盟的医疗器械法规(MDR)等。
4.产品技术文件要求:医疗器械制造商需要提供详细的产品技术文件,以证明其产品符合相应的要求和标准。
这些文件包括产品设计和开发的记录、生产和质量控制的记录、产品测试和验证的结果、风险评估和管理的文件等。
5.质量管理体系文件:医疗器械制造商需要建立和维护有效的质量管理体系。
相关的文件包括质量手册、程序文件、工作指导书、记录和报告等。
这些文件包括了各种质量控制和质量保证措施,确保产品能够符合相关要求,保证产品的质量和安全性。
6.风险管理文件:医疗器械制造商需要进行风险评估和风险管理,以确保产品在正常使用中的安全性和有效性。
相关的文件包括风险评估报告、风险管理计划、风险控制措施的文件等。
8.技术报告和测试文件:医疗器械制造商需要对产品进行各种技术和性能测试,并提供相应的报告和文件。
这些文件包括测试结果、测试方法、测试设备的证书和校准记录等。
总之,医疗器械受控文件是确保医疗器械质量和安全的重要保证。
医疗器械制造商和分销商需要严格遵守这些受控文件的要求,以确保产品的合法性和可靠性。
同时,相关的受控文件也为监管部门、使用者和患者等提供了依据和保障。
医疗器械法规文件大全(最新版)
4
体外诊断试剂注册管理办法
CFDA5号令
2015.10.01
5
医疗器械说明书和标签管理规定
CFDA6号令
2015.10.01
6
医疗器械生产监督管理办法
CFDA7号令
2015.10.01
7
医疗器械经营监督管理办法
CFDA8号令
2015.10.01
三、重要公告(共7项)
序号
名称
文件编号
2014年第16号
2014.09.11
22
关于发布体外诊断试剂说明书编写指导原则的通告
2014年第17号
2014.09.11
23
关于发布禁止委托生产医疗器械目录的通告
2014年第18号
2014.09.26
五、重要通知(共9项)
序号
名称
文件编号
发布日期
24
关于印发创新医疗器械特别审批程序的通知
食药监械管〔2014〕13号
食药监办械管〔2014〕174号
2014.09.15
28
关于印发医疗器械生产企业分类分级监督管理规定的通知
食药监械监〔2014〕234号
2014.09.30
29
关于印发国家重点监管医疗器械目录的通知
食药监械监〔2014〕235号
2014.09.30
30
关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知
生效日期
8
关于贯彻实施《医疗器械监督管理条例》有关事项的公告
2014年第23号
2014.05.29
9
关于医疗器械生产经营备案有关事宜的公告
2014年第25号
中国医疗器械法规清单(更新至202001)

中国医疗器械法规清单(更新至2020/01)《医疗器械监督管理条例》于2014年6月1日起正式实施,并于2017年5月4日修订,各类配套规章及规范性文件亦于近年来陆续制修订并发布。
各医疗器械企业作为受法规变化影响最大的相关方,应积极应对新法规政策下的挑战,密切关注最新法规动态,提前做好攻略规划,确保产品尽快获批上市!完善自身法规体系,确保企业合法合规生产经营!为方便各企业检索最新法规,本协会特收集、整理、编制国家药品监督管理局(NMPA)已发布的医疗器械法规文件(包括但不限于)清单,供大家参考。
各企业应根据自身实际情况及产品领域,对各类法规进行识别、收集、评估、导入、宣贯培训。
一、行政法规1. 《医疗器械监督管理条例》(国务院令第680号)二、部门规章1. 医疗器械注册管理办法(CFDA局令第4号)2. 体外诊断试剂注册管理办法(CFDA局令第5号)3. 医疗器械说明书和标签管理规定(CFDA局令第6号)4. 医疗器械生产监督管理办法(CFDA局令第7号)5. 医疗器械经营监督管理办法(CFDA局令第8号)6. 药品医疗器械飞行检查办法(CFDA局令第14号)7. 医疗器械分类规则(CFDA局令第15号)8. 医疗器械使用质量监督管理办法(CFDA局令第18号)9. 医疗器械通用名称命名规则(CFDA局令第19号)10. 医疗器械临床试验质量管理规范(CFDA国家卫计委令第25号)11. 医疗器械召回管理办法(CFDA局令第29号)12. 体外诊断试剂注册管理办法修正案(CFDA局令第30号)13. 关于调整部分医疗器械行政审批事项审批程序的决定(CFDA局令第32号)14. 医疗器械标准管理办法(CFDA局令第33号)15. 医疗器械网络销售监督管理办法(CFDA局令第38号)16. 医疗器械不良事件监测和再评价管理办法(国家市场监督管理总局令第1号)三、通告1. 关于发布第一类医疗器械产品目录的通告(CFDA通告2014年第8号)2. 关于发布医疗器械产品技术要求编写指导原则的通告(CFDA通告2014年第9号)3. 关于发布需进行临床试验审批的第三类医疗器械目录的通告(CFDA通告2014年第14号)4. 关于发布体外诊断试剂临床试验技术指导原则的通告(CFDA通告2014年第16号)5. 关于发布体外诊断试剂说明书编写指导原则的通告(CFDA通告2014年第17号)6. 关于发布禁止委托生产医疗器械目录的通告(CFDA 通告2014年第18号)7. 关于发布医疗器械生产企业供应商审核指南的通告(CFDA通告2015年第1号)8. 关于发布医疗器械临床评价技术指导原则的通告(CFDA通告2015年第14号)9. 关于发布医疗器械产品出口销售证明管理规定的通告(CFDA通告2015年第18号)10. 关于贯彻落实小微企业行政事业性收费优惠政策的通告(CFDA通告2015年第31号)11. 关于生产一次性使用无菌注、输器具产品有关事项的通告(CFDA通告2015年第71号)12. 关于发布医疗器械注册证补办程序等5个相关工作程序的通告(CFDA通告2015年第91号)13. 关于发布医疗器械注册指定检验工作管理规定的通告(CFDA通告2015年第94号)14. 关于发布医疗器械工艺用水质量管理指南的通告(CFDA通告2016年第14号)15. 关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(CFDA通告2016年第58号)16. 关于发布医疗器械生产企业质量管理体系年度自查报告编写指南的通告(CFDA通告2016年第76号)17. 关于发布医疗器械生产企业质量控制与成品放行指南的通告(CFDA通告2016年第173号)18. 关于发布医疗器械网络安全注册技术审查指导原则的通告(CFDA通告2017年第13号)19. 关于发布医疗器械审评沟通交流管理办法(试行)的通告(CFDA通告2017年第19号)20. 关于发布医疗器械优先审批申报资料编写指南(试行)的通告(CFDA通告2017年第28号)21. 关于实施《医疗器械分类目录》有关事项的通告(CFDA通告2017年第143号)22. 关于发布免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)的通告(CFDA通告2017年第179号)23. 关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(CFDA通告2017年第184号)24. 关于发布医疗器械注册单元划分指导原则的通告(CFDA通告2017年第187号)25. 关于发布移动医疗器械注册技术审查指导原则的通告(CFDA通告2017年第222号)26. 关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(CFDA通告2017年第226号)27. 关于发布接受医疗器械境外临床试验数据技术指导原则的通告(CFDA通告2018年第13号)28. 关于公布新修订免于进行临床试验医疗器械目录的通告(NMPA通告2018年第94号)29. 关于发布医疗器械生产企业管理者代表管理指南的通告(NMPA通告2018年第96号)30. 关于医疗器械经营企业跨行政区域设置库房办理事项的通告(NMPA通告2018年第108号)31. 关于发布创新医疗器械特别审查申报资料编写指南的通告(NMPA通告2018年第127号)32. 关于调整药械组合产品属性界定有关事项的通告(NMPA通告2019年第28号)33. 关于发布医疗器械注册申请电子提交技术指南的通告(NMPA通告2019年第29号)34. 关于医疗器械电子申报有关资料要求的通告(NMPA 通告2019年第41号)35. 关于发布《医疗器械产品注册项目立卷审查要求(试行)》等文件的通告(NMPA通告2019年第42号)36. 关于发布医疗器械生产质量管理规范附录独立软件的通告(NMPA通告2019年第43号)37. 关于做好第一批实施医疗器械唯一标识工作有关事项的通告(NMPA通告2019年第72号)38. 关于公布新增和修订的免于进行临床试验医疗器械目录的通告(NMPA通告2019年第91号)39. 关于发布医疗器械附条件批准上市指导原则的通告(NMPA通告2019年第93号)40. 关于发布医疗器械通用名称命名指导原则的通告(NMPA通告2019年第99号)四、公告1. 关于医疗器械生产经营备案有关事宜的公告(CFDA 公告2014年第25号)2. 关于第一类医疗器械备案有关事项的公告(CFDA公告2014年第26号)3. 关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(CFDA公告2014年第43号)4. 关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(CFDA公告2014年第44号)5. 关于施行医疗器械经营质量管理规范的公告(CFDA 公告2014年第58号)6. 关于发布医疗器械生产质量管理规范的公告(CFDA 公告2014年第64号)7. 关于发布药品、医疗器械产品注册收费标准的公告(CFDA公告2015年第53号)8. 关于医疗器械临床试验备案有关事宜的公告(CFDA 公告2015年第87号)9. 关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(CFDA公告2015年第101号)10. 关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(CFDA公告2015年第102号)11. 关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(CFDA公告2015年第103号)12. 关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(CFDA公告2015年第203号)13. 关于规范含银盐医疗器械注册管理有关事宜的公告(CFDA公告2015年第225号)14. 关于发布医疗器械冷链(运输、贮存)管理指南的公告(CFDA公告2016年第154号)15. 关于发布医疗器械优先审批程序的公告(CFDA公告2016年第168号)16. 关于发布医疗器械生产质量管理规范附录定制式义齿的公告(CFDA公告2016年第195号)17. 关于发布医疗器械技术审评专家咨询委员会管理办法的公告(CFDA公告2017年第36号)18. 关于第二批规范性文件清理结果的公告(CFDA公告2017年第88号)19. 关于发布医疗器械分类目录的公告(CFDA公告2017年第104号)20. 关于医疗器械经营备案有关事宜的公告(CFDA公告2017年第129号)21. 关于进口医疗器械注册申请人和备案人名称使用中文的公告(CFDA公告2017年第131号)22. 关于发布医疗器械临床试验机构条件和备案管理办法的公告(CFDA公告2017年第145号)23. 关于发布医疗器械标准制修订工作管理规范的公告(CFDA公告2017年第156号)24. 关于修改医疗器械延续注册等部分申报资料要求的公告(NMPA公告2018年第53号)25. 关于医疗器械规范性文件(1998—2013年)清理结果的公告(NMPA公告2018年第37号)26. 关于发布创新医疗器械特别审查程序的公告(NMPA 公告2018年第83号)27. 关于发布药品医疗器械境外检查管理规定的公告(NMPA公告2018年第101号)28. 关于调整医疗器械临床试验审批程序的公告(NMPA 公告2019年第26号)29. 关于实施医疗器械注册电子申报的公告(NMPA公告2019年第46号)30. 关于发布定制式医疗器械监督管理规定(试行)的公告(NMPA公告2019年第53号)31. 关于发布医疗器械唯一标识系统规则的公告(NMPA 公告2019年第66号)32. 关于修改一次性使用无菌导尿管(包)说明书等有关内容的公告(NMPA公告2019年第94号)五、通知性文件1. 关于印发医疗器械质量监督抽查检验管理规定的通知(食药监械监〔2013〕212号)2. 关于印发医疗器械生产日常监督现场检查工作指南的通知(食药监办械监〔2014〕7号)3. 关于实施《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》有关事项的通知(食药监械监〔2014〕143号)4. 关于实施《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》有关事项的通知(食药监械管〔2014〕144号)5. 关于实施第一类医疗器械备案有关事项的通知(食药监办械管〔2014〕174号)6. 关于印发医疗器械检验机构开展医疗器械产品技术要求预评价工作规定的通知(食药监械管〔2014〕192号)7. 关于印发境内第三类和进口医疗器械注册审批操作规范的通知(食药监械管〔2014〕208号)8. 关于印发境内第二类医疗器械注册审批操作规范的通知(食药监械管〔2014〕209号)9. 关于印发医疗器械生产企业分类分级监督管理规定的通知(食药监械监〔2014〕234号)10. 关于印发国家重点监管医疗器械目录的通知(食药监械监〔2014〕235号)11. 关于启用医疗器械生产经营许可备案信息系统的通知(食药监办械监函〔2014〕476号)12. 关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知(食药监械管〔2015〕63号)13. 关于印发医疗器械经营企业分类分级监督管理规定的通知(食药监械监〔2015〕158号)14. 关于印发医疗器械经营环节重点监管目录及现场检查重点内容的通知(食药监械监〔2015〕159号)15. 关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知(食药监械监〔2015〕218号)16. 关于印发医疗器械经营质量管理规范现场检查指导原则的通知(食药监械监〔2015〕239号)17. 关于执行医疗器械和体外诊断试剂注册管理办法有关问题的通知(食药监械管〔2015〕247号)18. 关于印发医疗器械检验机构资质认定条件的通知(食药监科〔2015〕249号)19. 关于成立医疗器械分类技术委员会的通知(食药监械管〔2015〕259号)20. 关于启用医疗器械注册管理信息系统备案子系统的通知(食药监办械管函〔2015〕534号)21. 关于启用医疗器械注册管理信息系统受理和制证、技术审评、行政审批子系统的通知(食药监办械管函〔2015〕804号)22. 关于医疗器械产品技术要求有关问题的通知(食药监办械管〔2016〕22号)23. 关于实施《医疗器械通用名称命名规则》有关事项的通知(食药监械管〔2016〕35号)24. 关于印发一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2016〕37号)25. 关于及时公开第二类医疗器械注册信息和第一类医疗器械产品备案信息的通知(食药监办械管〔2016〕65号)26. 关于体外诊断试剂说明书文字性变更有关问题的通知(食药监办械管〔2016〕117号)27. 关于印发医疗器械生产质量管理规范定制式义齿现场检查指导原则的通知(食药监械监〔2016〕165号)28. 关于印发一次性使用塑料血袋等21种医疗器械生产环节风险清单和检查要点的通知(食药监械监〔2017〕14号)29. 关于第一类、第二类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知(食药监办械监〔2017〕120号)30. 关于规范医疗器械产品分类有关工作的通知(食药监办械管〔2017〕127号)31. 关于做好医疗器械临床试验机构备案工作的通知(食药监办械管〔2017〕161号)32. 关于做好医疗器械检验有关工作的通知(食药监办械管〔2017〕187号)33. 关于实施《医疗器械网络销售监督管理办法》有关事项的通知(食药监办械监〔2018〕31号)34. 关于印发医疗器械注册技术审查指导原则制修订工作管理规范的通知(药监办〔2018〕13号)35. 关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知(2018年08月02日发布)36. 关于贯彻落实国务院“证照分离”改革要求做好医疗器械上市后监管审批相关工作的通知(药监综械管〔2018〕39号)37. 关于贯彻落实“证照分离”改革措施进一步推进医疗器械审评审批制度改革的通知(药监综械注〔2018〕43号)38. 关于印发医疗器械临床试验检查要点及判定原则的通知(药监综械注〔2018〕45号)39. 关于扩大医疗器械注册人制度试点工作的通知(国药监械注〔2019〕33号)40. 关于印发医疗器械检验工作规范的通知(国药监科外〔2019〕41号)41. 关于印发医疗器械唯一标识系统试点工作方案的通知(药监综械注〔2019〕56号)42. 2018年医疗器械产品分类界定结果汇总(2019年02月18日发布)43. 2019年第一批医疗器械产品分类界定结果汇总(2019年07月18日发布)44. 2019年第二批医疗器械产品分类界定结果汇总(2019年11月25日发布)六、政策解读1. 《医疗器械经营监督管理办法》部分(一)(2015年01月22日发布)2. 《医疗器械生产监督管理办法》部分(一)(2015年01月22日发布)3. 医疗器械注册管理法规解读之一(《医疗器械注册管理办法》和《体外诊断试剂注册管理办法》部分)(2015年02月05日发布)4. 医疗器械注册管理法规解读之二(《医疗器械说明书和标签管理规定》部分)(2015年02月05日发布)5. 关于《药品医疗器械飞行检查办法》的说明(2015年07月08日发布)6. 医疗器械注册管理法规解读之三(关于《医疗器械分类规则》的修订说明)(2015年07月16日发布)7. 医疗器械注册管理法规解读之四(2015年11月02日发布)8. 医疗器械注册管理法规解读之五(2015年11月19日发布)9. 关于《医疗器械使用质量监督管理办法》的说明(2015年11月30日发布)10. 医疗器械注册管理法规解读之六(2016年01月07日发布)11. 关于《医疗器械通用名称命名规则》的说明(2016年01月27日发布)12. 《医疗器械临床试验质量管理规范》解读(2016年03月23日发布)13. 关于《医疗器械优先审批程序》的说明(2016年10月26日发布)14. YY/T0287-2017idt ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(一)(2017年02月04日发布)15. YY/T0287-2017idt ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(二)(2017年02月04日发布)16. 《医疗器械召回管理办法》解读(2017年02月08日发布)17. 《体外诊断试剂注册管理办法修正案》解读(2017年02月08日发布)18. 《医疗器械网络安全注册技术审查指导原则》解读(2017年03月02日发布)19. 《医疗器械标准管理办法》解读(2017年04月26日发布)20. 《医疗器械召回管理办法》解读之二(2017年05月24日发布)21. 图解政策:《医疗器械召回管理办法》解读(2017年06月22日发布)22. 图解政策:医疗器械不良事件那些事(2017年06月24日发布)23. 图解政策:体外诊断试剂注册管理办法修正案(2017年07月28日发布)24. 创新医疗器械特别审批程序相关问题解读(2017年07月31日发布)25. 医疗器械临床试验质量管理相关问题解读(2017年07月31日发布)26. 《医疗器械标准管理办法》解读之一(2017年08月09日发布)27. 《医疗器械标准管理办法》解读之二(2017年08月09日发布)28. 《医疗器械网络安全注册技术审查指导原则》解读(2017年08月09日发布)29. 图解政策:医疗器械临床试验质量管理相关问题解读(2017年09月04日发布)30. 图解政策:创新医疗器械特别审批程序相关问题解读(2017年09月04日发布)31. 图解政策:ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(一)(2017年09月12日发布)32. 图解政策:ISO13485:2016《医疗器械质量管理体系用于法规的要求》标准解读(二)(2017年09月12日发布)33. 《免于进行临床试验的体外诊断试剂临床评价资料基本要求(试行)》解读(2017年11月08日发布)34. 《医疗器械临床试验机构条件和备案管理办法》解读(2017年11月24日发布)35. 《医疗器械网络销售监督管理办法》解读(2017年12月22日发布)36. 《移动医疗器械注册技术审查指导原则》解读(2017年12月29日发布)37. 图解政策:医疗器械网络销售监督管理办法解读一(2018年01月12日发布)38. 图解政策:医疗器械网络销售监督管理办法解读二(2018年01月15日发布)39. 医疗器械临床试验质量管理相关问题解读之二(2018年04月18日发布)40. 《医疗器械分类目录》实施有关问题解读(2018年08月01日发布)41. 图解政策:国家药品监督管理局办公室关于强脉冲光脱毛类产品分类界定的通知(2018年09月26日发布)42. 图解政策:医疗器械注册技术审查指导原则制修订工作管理规范(2018年09月28日发布)43. 图解政策:关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知(2018年09月28日发布)44. 免于进行临床试验医疗器械目录解读(2018年09月30日发布)45. 图解政策:《医疗器械分类目录》实施有关问题解读(2018年10月09日发布)46. 图解政策:新修订的《免于进行临床试验医疗器械目录》解读(2018年10月19日发布)47. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之一(2018年10月24日发布)48. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之二(2018年10月25日发布)49. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之三(2018年10月26日发布)50. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之四(2018年10月29日发布)51. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之五(2018年10月30日发布)52. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之六(2018年10月31日发布)53. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之七(2018年11月01日发布)54. 图解政策:《医疗器械不良事件监测和再评价监督管理办法》之八(2018年11月02日发布)55. 《创新医疗器械特别审查程序》解读(2018年11月05日发布)56. 图解政策:医疗器械生产企业管理者代表管理指南之一(2018年11月06日发布)57. 图解政策:医疗器械生产企业管理者代表管理指南之二(2018年11月06日发布)58. 图解政策:医疗器械生产企业管理者代表管理指南之三(2018年11月07日发布)59. 图解政策:关于优化优先审评申请审核工作程序的通知(2018年11月14日发布)60. 图解政策:用于罕见病防治医疗器械注册审查指导原则(之一)(2018年11月29日发布)61. 图解政策:用于罕见病防治医疗器械注册审查指导原则(之二)(2018年11月30日发布)62. 图解政策:关于贯彻落实“证照分离”改革措施进一步推进医疗器械审评审批制度改革的通知(2018年12月03日发布)63. 图解政策:创新医疗器械特别审查程序之一(2018年12月14日发布)64. 图解政策:创新医疗器械特别审查程序之二(2018年12月19日发布)65. 图解政策:创新医疗器械特别审查程序之三(2018年12月19日发布)66. 图解政策:药品医疗器械境外检查管理规定(一)(2019年02月01日发布)67. 图解政策:药品医疗器械境外检查管理规定(二)(2019年02月12日发布)68. 《定制式医疗器械监督管理规定(试行)》解读(2019年07月04日发布)69. 《医疗器械唯一标识系统规则》解读(2019年08月27日发布)70. 免于进行临床试验医疗器械目录汇总(2019年12月23日发布)71. 图解政策:国家药监局关于发布医疗器械附条件批准上市指导原则的通告(2019年第93号)(一)(2020年01月02日发布)72. 图解政策:国家药监局关于发布医疗器械附条件批准上市指导原则的通告(2019年第93号)(二)(2020年01月02日发布)73. 图解政策:国家药监局关于发布医疗器械附条件批准上市指导原则的通告(2019年第93号)(三)(2020年01月02日发布)七、相关法律法规1. 中华人民共和国广告法(2018年11月05日发布)2. 药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法(国家市场监督管理总局令第21号)。
医疗器械受控文件清单
36
羧甲基纤维素钠质量标准
2011
37
薄荷脑质量标准
2011
38
卡波姆质量标准
2011
39
PVC质量标准
2011
40
铝箔质量标准
2011
41
塑瓶(给药器、喷瓶)
2011
42
小(中)盒质量标准
2011
43
说明书质量标准
2011
44
纸箱质量标准
2011
45
复合膜袋质量标准
2011
4、生产管理文件清单(1)
2011
14
设备事故管理规程
KEJ-FQ-SB-2011-14
2011
15
设备的更新改造与报废管理规程
KEJ-FQ-SB-2011-15
2011
16
设备档案管理规程
KEJ-FQ-SB-2011-16
2011
17
洁净厂房的验收管理规程
KEJ-FQ-SB-2011-17
2011
18
洁净厂房管理规程
KEJ-FQ-SB-2011-18
28
片剂生产作业指导书
2011
29
栓剂生产作业指导书
2011
30
喷膜剂生产作业指导书
2011
31
水凝胶生产作业指导书
2011
32
敷尔康创伤愈合海绵生产作业指导书
2011
33
远红外热收缩机操作与维护规程
2011
34
打码机操作与维护规程
2011
35
压片机操作与维护规程
2011
36
铝塑包装机操作与维护规程
2011
医疗器械注册常用参考法规文件汇总清单

医疗器械注册常用参考法规文件汇总清单医疗器械注册常用参考法规文件汇总清单一、医疗器械注册相关法规1.《医疗器械监督管理条例》2.《医疗器械分类目录》3.《医疗器械注册管理规定》4.《医疗器械注册申请技术要求》5.《医疗器械注册审评标准》6.《医疗器械技术审评管理办法》7.《医疗器械监督管理工作规范》8.《医疗器械不良事件报告管理规定》9.《医疗器械召回管理规定》二、其他相关法规1.《中华人民共和国药品管理法》2.《中华人民共和国医疗器械广告审查管理办法》3.《医用材料管理办法》4.《植入性医用材料管理规定》5.《药品安全性评价技术指导原则》6.《药品临床试验质量管理规范》7.《药品注册管理办法》8.《药品注册申请技术要求》9.《药品注册管理规定》10.《药品注册申请受理和审评办法》11.《药品审批管理办法》12.《药品GMP规范》13.《药品检查管理办法》14.《药品不良反应监测与报告管理办法》15.《药品委托加工管理规定》三、简要注释1. 《医疗器械监督管理条例》:对医疗器械的监督管理进行了规范,为医疗器械的注册、备案、生产、销售、使用等提供了法律依据。
2. 《医疗器械分类目录》:对医疗器械进行了分类,便于企业的注册申请,避免重复注册。
3. 《医疗器械注册管理规定》:对医疗器械注册的管理、审批流程等进行了规定,明确了注册申请人的义务和承诺。
4. 《医疗器械注册申请技术要求》:对医疗器械注册申请所需的文件材料、技术要求等进行了规定。
5. 《医疗器械注册审评标准》:对医疗器械注册申请的技术评价标准进行了规定,明确了医疗器械的技术要求和指标。
6. 《医疗器械技术审评管理办法》:规定了有关医疗器械技术审评的管理和操作流程。
7. 《医疗器械监督管理工作规范》:对医疗器械监管工作进行了规范,明确了监管职责和工作流程。
8. 《医疗器械不良事件报告管理规定》:对医疗器械不良事件的报告、处理等进行了规定,保障了患者的安全。
中国医疗器械法规清单

中国医疗器械法规清单
中国医疗器械法规清单
1. 医疗器械管理法
该法规是中国医疗器械行业的基本法律,用于规范医疗器械的生产、流通和使用,并保护公共健康安全。
2. 医疗器械注册管理办法
该法规规定了医疗器械注册的程序和要求,以确保医疗器械的安全性和有效性。
3. 医疗器械分类目录
该目录是根据医疗器械的功能和风险程度进行分类的,用于管理医疗器械的注册、备案和监督。
4. 医疗器械生产许可证管理办法
该法规规定了医疗器械生产许可证的申请和管理,制定了医疗器械生产企业的资质要求和生产标准。
5. 医疗器械监督管理办法
该法规规定了医疗器械的监督抽检、逐批检验和不合格产品的处理,以确保医疗器械的质量和安全。
6. 医疗器械生产质量管理规范
该规范是医疗器械生产企业质量管理的指导文件,包括质量管理体系要求、生产记录和产品监测等方面的内容。
7. 医疗器械不良事件报告管理办法
该法规规定了医疗器械不良事件的报告和处理程序,要求企业和医疗机构及时报告不良事件,并进行调查和处理。
8. 医疗器械广告管理办法
该法规规定了医疗器械广告的发布和管理,要求广告内容真实、准确,不得误导消费者。
9. 医疗器械产品标准
该标准规定了医疗器械的技术要求和测试方法,用于评价医疗器械的性能和质量。
10. 医疗器械进口管理办法
该法规规定了医疗器械进口的程序和要求,包括进口许可证的申请和进口检验等方面的内容。
以上是中国医疗器械领域的主要法规清单,这些法规的制定和实施对于保障公众的健康安全起着重要作用。
在医疗器械行业发展过程中,需遵守这些法规,推动医疗器械行业的健康发展。
中国现行医疗器械政策法规文件目录清单(截止2021.12.31)

中国现行医疗器械政策法规文件目录清单(截止2021.12.31)行政法规1.《医疗器械监督管理条例》(国务院令第739号)部门规章1.医疗器械注册与备案管理办法(市场监督管理总局令第47号)2.体外诊断试剂注册与备案管理办法(市场监督管理总局令第48号)3.药品、医疗器械、保健食品、特殊医学用途配方食品广告审查管理暂行办法(市场监督管理总局令第21号)4.医疗器械不良事件监测和再评价管理办法(市场监督管理总局、卫健委令第1号)5.医疗器械说明书和标签管理规定(总局令第6号)6.医疗器械生产监督管理办法(总局令第7号)7.医疗器械经营监督管理办法(总局令第8号)8.药品医疗器械飞行检查办法(总局令第14号)9.医疗器械分类规则(总局令第15号)10.医疗器械使用质量监督管理办法(总局令第18号)11.医疗器械通用名称命名规则(总局令第19号)12.医疗器械临床试验质量管理规范(总局国家卫计委令第25号)13.医疗器械召回管理办法(总局令第29号)14.关于调整部分医疗器械行政审批事项审批程序的决定(总局令第32号)15.医疗器械标准管理办法(总局令第33号)16.医疗器械网络销售监督管理办法(总局令第38号)通告文件1.国家药监局关于实施《第一类医疗器械产品目录》有关事项的通告(2021年第107号)(国家局通告2021年第107号)2.国家药监局关于发布医疗器械临床试验数据递交要求等2项注册审查指导原则的通告(国家局通告2021年第91号)3.国家药品监督管理局关于实施《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》有关事项的通告(国家局通告2021年第76号)4.国家药监局关于发布免于临床试验的体外诊断试剂临床评价技术指导原则的通告(国家局通告2021年第74号)5.国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告(国家局通告2021年第73号)6.国家药监局关于发布体外诊断试剂临床试验技术指导原则的通告(国家局通告2021年第72号)7.国家药监局关于发布免于临床评价医疗器械目录的通告(国家局通告2021年第71号)8.国家药监局关于发布免于临床试验体外诊断试剂目录的通告(国家局通告2021年第70号)9.国家药监局关于发布血管内导管同品种对比临床评价技术审查指导原则的通告(国家局通告2021年第68号)10.国家药监局关于发布神经和心血管手术器械通用名称命名指导原则等2项指导原则的通告(国家局通告2021年第62号)11.国家药监局关于发布医用康复器械通用名称命名指导原则等6项指导原则的通告(国家局通告2021年第48号)12.国家药监局关于发布人工智能医用软件产品分类界定指导原则的通告(国家局通告2021年第47号)13.国家药监局关于发布重组胶原蛋白类医疗产品分类界定原则的通告(国家局通告2021年第27号)14.国家药监局关于发布医疗器械注册人开展产品不良事件风险评价指导原则的通告(国家局通告2020年第78号)15.国家药监局关于发布需进行临床试验审批的第三类医疗器械目录(2020年修订版)的通告(国家局通告2020年第61号)16.国家药监局关于发布医疗器械定期风险评价报告撰写规范的通告(国家局通告2020年第46号)17.国家药监局关于发布无源医疗器械产品原材料变化评价指南的通告(国家局通告2020年第33号)18.国家药监局关于发布医疗器械注册人开展不良事件监测工作指南的通告(国家局通告2020年第25号)19.国家药监局关于发布医疗器械注册质量管理体系核查指南的通告(国家局通告2020年第19号)20.国家药监局关于发布医疗器械安全和性能基本原则的通告(国家局通告2020年第18号)21.国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告(国家局通告2019年第72号)22.国家药监局关于发布医疗器械生产质量管理规范附录独立软件的通告(国家局通告2019年第43号)23.国家药监局关于发布《医疗器械产品注册项目立卷审查要求(试行)》等文件的通告(国家局通告2019年第42号)24.国家药监局关于医疗器械电子申报有关资料要求的通告(国家局通告2019年第41号)25.关于发布医疗器械注册申请电子提交技术指南的通告(国家局通告2019年第29号)26.关于发布创新医疗器械特别审查申报资料编写指南的通告(国家局通告2018年第127号)27.国家药品监督管理局关于医疗器械经营企业跨行政区域设置库房办理事项的通告(国家局通告2018年第108号)28.国家药品监督管理局关于发布医疗器械生产企业管理者代表管理指南的通告(国家局通告2018年第96号)29.总局关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告(国家局通告2017年第226号)30.总局关于需审批的医疗器械临床试验申请沟通交流有关事项的通告(国家局通告2017年第184号)31.总局关于实施《医疗器械分类目录》有关事项的通告(国家局通告2017年第143号)32.总局关于发布医疗器械优先审批申报资料编写指南(试行)的通告(国家局通告2017年第28号)33.总局关于发布医疗器械审评沟通交流管理办法(试行)的通告(国家局通告2017年第19号)34.总局关于发布医疗器械生产企业质量控制与成品放行指南的通告(国家局通告2016年第173号)35.总局关于发布医疗器械生产企业质量管理体系年度自查报告编写指南的通告(国家局通告2016年第76号)36.总局关于发布《医疗器械临床试验伦理审查申请与审批表范本》等六个文件的通告(国家局通告2016年第58号)37.国家食品药品监督管理总局关于发布医疗器械工艺用水质量管理指南的通告(国家局通告2016年第14号)38.国家食品药品监督管理总局关于发布医疗器械注册证补办程序等5个相关工作程序的通告(国家局通告2015年第91号)39.国家食品药品监督管理总局关于生产一次性使用无菌注、输器具产品有关事项的通告(国家局通告2015年第71号)40.国家食品药品监督管理总局关于贯彻落实小微企业行政事业性收费优惠政策的通告(国家局通告2015年第31号)41.国家食品药品监督管理总局关于发布医疗器械产品出口销售证明管理规定的通告(国家局通告2015年第18号)42.国家食品药品监督管理总局关于发布医疗器械生产企业供应商审核指南的通告(国家局通告2015年第1号)43.国家食品药品监督管理总局关于发布禁止委托生产医疗器械目录的通告(国家局通告2014年第18号)44.国家食品药品监督管理总局关于医疗器械生产质量管理规范执行有关事宜的通告(国家局通告2014年第15号)公告文件1.国家药监局关于发布第一类医疗器械产品目录的公告(国家局2021年第158号)2.医疗器械应急审批程序(国家局2021年第157号)3.国家药监局关于发布《体外诊断试剂分类规则》的公告(国家局公告2021年第129号)4.国家药监局关于发布《医疗器械注册自检管理规定》的公告(国家局公告2021年第126号)5.关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告(国家局公告2021年第122号)6.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(国家局公告2021年第121号)7.国家药监局国家卫生健康委国家医保局关于做好第二批实施医疗器械唯一标识工作的公告(国家局公告2021年第114号)8.国家药监局关于公布《免于经营备案的第二类医疗器械产品目录》的公告(国家局公告2021年第86号)9.国家药监局关于贯彻实施《医疗器械监督管理条例》有关事项的公告(国家局公告2021年第76号)10.国家药监局关于发布医疗器械分类目录动态调整工作程序的公告(国家局公告2021年第60号)11.国家药监局关于医疗器械主文档登记事项的公告(国家局公告2021年第36号)12.家药监局关于调整《医疗器械分类目录》部分内容的公告(国家局公告2020年第147号)13.国家药监局关于进一步规范医用超声耦合剂说明书等有关内容的公告(国家局公告2020年第143号)14.国家药监局关于发布《可重复使用医用防护服技术要求》的公告(国家局公告2020年第140号)15.国家药监局关于试点启用医疗器械电子注册证的公告(国家局公告2020年第117号)16.国家药监局关于调整《6840体外诊断试剂分类子目录(2013版)》部分内容的公告(国家局公告2020年第112号)17.国家药监局国家卫生健康委国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告(国家局公告2020年第106号)18.国家药监局关于进口医疗器械产品在中国境内企业生产有关事项的公告(国家局公告2020年第104号)19.国家药监局国家卫生健康委关于发布2020年版《中华人民共和国药典》的公告(国家局公告2020年第78号)20.国家药监局国家卫生健康委关于发布医疗器械拓展性临床试验管理规定(试行)的公告(国家局公告2020年第41号)21.国家药监局关于修改一次性使用无菌导尿管(包)说明书等有关内容的公告(国家局公告2019年第94号)22.国家药监局关于发布医疗器械唯一标识系统规则的公告(国家局公告2019年第66号)23.国家药监局国家卫生健康委关于发布定制式医疗器械监督管理规定(试行)的公告(国家局公告2019年第53号)24.国家药监局关于实施医疗器械注册电子申报的公告(国家局公告2019年第46号)25.关于发布药品医疗器械境外检查管理规定的公告(国家局公告2018年第101号)26.国家药监局关于发布创新医疗器械特别审查程序的公告(国家局公告2018年第83号)27.总局关于发布医疗器械标准制修订工作管理规范的公告(国家局公告2017年第156号)28.国家食品药品监督管理总局国家卫生和计划生育委员会关于发布医疗器械临床试验机构条件和备案管理办法的公告(国家局公告2017年第145号)29.总局关于进口医疗器械注册申请人和备案人名称使用中文的公告(国家局公告2017年第131号)30.总局关于医疗器械经营备案有关事宜的公告(国家局公告2017年第129号)31.总局关于发布医疗器械分类目录的公告(国家局公告2017年第104号)32.总局关于发布医疗器械技术审评专家咨询委员会管理办法的公告(国家局公告2017年第36号)33.总局关于发布医疗器械生产质量管理规范附录定制式义齿的公告(国家局公告2016年第195号)34.总局关于发布医疗器械优先审批程序的公告(国家局公告2016年第168号)35.总局关于发布医疗器械冷链(运输、贮存)管理指南的公告(国家局公告2016年第154号)36.国家食品药品监督管理总局关于规范含银盐医疗器械注册管理有关事宜的公告(国家局公告2015年第225号)37.国家食品药品监督管理总局关于境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可有关事宜的公告(国家局公告2015年第203号)38.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告(国家局公告2015年第103号)39.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录植入性医疗器械的公告(国家局公告2015年第102号)40.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范附录无菌医疗器械的公告(国家局公告2015年第101号)41.国家食品药品监督管理总局关于医疗器械临床试验备案有关事宜的公告(国家局公告2015年第87号)42.国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告(国家局公告2014年第64号)43.国家食品药品监督管理总局关于发布药品、医疗器械产品注册收费标准的公告(国家局公告2015年第53号)44.国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告(国家局公告2014年第26号)45.国家食品药品监督管理总局关于医疗器械生产经营备案有关事宜的公告(国家局公告2014年第25号)国家局器审中心通告1.关于医疗器械注册申请缴纳费用有关事宜的通告(2021年第16号)2.关于发布医疗器械注册电子申报目录文件夹结构的通告(2021年第15号)3.关于办理医疗器械主文档登记有关事宜的通告(2021年第2号)4.关于在eRPS系统提交医疗器械唯一标识有关事项的通告(2020年第26号)5.关于临床急需医疗器械注册申报有关事宜的通告(2020年第22号)6.关于进口医疗器械注册申报资料试行电子签名有关事宜的通告(2020年第20号)7.关于进口医疗器械按第二类申请产品注册经技术审评确认为第三类的退出注册程序及后续处理方式的通告(2020年第17号)8.关于进一步规范受理环节立卷审查工作有关事宜的通告(2020年第16号)9.关于补正资料期间充分利用沟通交流途径提高补充资料质量的通告(2020年第15号)10.关于调整部分医疗器械注册申请事项公证文件提交时间和形式的通告(2020年第13号)11.关于调整医疗器械注册电子申报信息化系统数字认证(CA)证书业务办理方式的通告(2020年第12号)12.关于发布《肺炎CT影像辅助分诊与评估软件审评要点(试行)》的通告(2020年第8号)13.关于发布《2019新型冠状病毒抗原/抗体检测试剂注册技术审评要点(试行)》的通告(2020年第6号)14.关于发布《2019新型冠状病毒核酸检测试剂注册技术审评要点》的通告(2020年第4号)15.关于发布医疗器械注册审评补正资料要求管理规范的通告(2020年第1号)16.关于医疗器械注册电子申报关联提交及禁止重复提交的通告(2019年第15号)17.关于调整部分医疗器械申请事项行政许可文书送达方式的通告(2019年第12号)18.关于发布深度学习辅助决策医疗器械软件审评要点的通告(2019年第7号)19.关于发布医疗器械注册电子申报信息化系统电子申报目录(RPS ToC)文件夹结构的通告(2019年第5号)20.关于医疗器械注册电子申报信息化系统业务办理有关事宜的通告(2019年第4号)21.关于发布医疗器械技术审评中心创新医疗器械特别审查申请审查操作规范的通告(2018年第11号)22.关于提供医疗器械技术审评补正资料预审查服务的通告(2018年第8号)23.关于启用技术审评咨询平台新增功能的通告2018年第7号)江苏省药监局文件1.江苏省药品监督管理局关于调整医疗器械及体外诊断试剂注册申报资料要求的通告2.关于《江苏省第二类医疗器械创新产品注册程序(试行)》的解读3.关于《江苏省第二类医疗器械应急注册程序(试行)》的解读4.关于《江苏省第二类医疗器械优先注册程序(试行)》的解读5.江苏省药品监督管理局关于发布《江苏省第二类医疗器械创新产品注册程序(试行)》等3个程序的公告6.《江苏省药品监督管理局关于重新发布药品、医疗器械产品注册收费标准的公告》政策解读7.江苏省药品监督管理局关于重新发布药品、医疗器械产品注册费收费标准的公告8.《江苏省药品监督管理局关于重新发布药品、医疗器械产品注册收费标准的公告》政策解读9.关于印发江苏省药品监督管理行政处罚裁量权适用规则(试行)的通知10.《江苏省药品监督管理局行政复议工作程序规定》解读11.关于印发江苏省药品监督管理局行政复议工作程序规定的通知12.关于印发《江苏省药品监督管理局听证暂行规则》的通知13.《江苏省药品监督管理局行政复议工作程序规定》解读14.关于印发江苏省药品监督管理局行政处罚程序规范(试行)的通知15.关于印发《江苏省药品医疗器械经营企业(GSP)软件功能标准(试行)》和《江苏省药品医疗器械经营企业远程监管系统数据接口标准(试行)》的通知。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五册 第五册 第五册 第五册 第五册 第六册 第六册 第六册 第六册 第七册 第七册 第七册
41
食药监械监[2014]143号
2014
第七册
42
食药监械监[2014]144号
2014
第七册
43 44 45 67 68 46 47 48 49 50 51 52
食药监办械管[2014]174号 食药监械管[2014]208号 食药监械管[2014]209号 / / 2014年第16号 食药监械监〔2014〕235号 2014年 第58号 2015年 第1号
国食药监械[2009]320号 2014年第64号 国食药监械[2009]834号 (2015年第101号) 国食药监械[2011]425号 国食药监械[2013]242号 2014年第8号 2014年第9号 2014年第17号 2014年第25号 2014年第26号 食药监械管[2014]13号
2009 2014 2009 2015 2011 2013 2014 2014 2014 2014 2014 2014
受控文件清单 部门:品质部 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 医疗废物管理条例 病原微生物实验室生物安全管理条例 易制毒化学品管理条例 国务院关于加强食品等产品安全监督管理的特 别规定 危险化学品安全管理条例 医疗器械监督管理条例 医疗器械临床试验规定 《医疗器械分类规则》 药品医疗器械飞行检查办法 关于印发境内第三类医疗器械注册质量管理体 系核查工作程序(暂行)的通知 关于发布禁止委托生产医疗器械目录的通告 医疗器械标准管理办法(试行) 医疗器械召回管理办法(试行) 工作场所安全使用化学品规定 医疗器械注册管理办法 体外诊断试剂注册管理办法 医疗器械说明书和标签管理规定 医疗器械生产监督管理办法 医疗器械经营监督管理办法 关于发布药品、医疗器械产品注册收费标准的 公告 关于脱敏凝胶等产品分类界定的通知 关于发布医疗器械产品出口销售证明管理规定 的通告 关于牙钻等产品分类界定的通知 食品药品监管总局关于印发医疗器械生产企业 分类分级监督管理规定的通知 关于合成树脂义眼片等产品分类界定的通知 关于发布医疗器械生产质量管理规范附录体外 诊断试剂的公告 关于印发《关于贯彻落实〈国务院关于加强食 品等产品安全监督管理的特别规定〉的实施意 见》的通知 关于印发医疗器械不良事件监测和再评价管理 办法(试行)的通知 文件名称 文件编号 国务院令第380号 国务院令第424号 国务院令第445号 国务院令第503号 国务院令第591号 国务院令第650号 国家局令第5号 (国家食品药品监督管理总局令第15 号) 总局令第14号 食药监械管〔2015〕63号 (2014年第18号) 国家局令第31号 卫生部令第82号 劳部发(1996)423号 国家食品药品监督管理总局局令第4号 国家食品药品监督管理总局局令第5号 国家食品药品监督管理总局局令第6号 国家食品药品监督管理总局局令第7号 国家食品药品监督管理总局局令第8号 (2015年第53号) 国食药监械[2003]333号 (2015年第18号) 国食药监械[2005]236号 食药监械监[2014]234号 国食药监械[2006]454号 (2015年第103号) 版本 2003 2004 2005 2007 2011 2014 2004 2015 2015 2015 2014 2002 2011 1996 2014 2014 2014 2014 2014 2015 2003 2015 2005 2014 2006 2015 备注 第一册 第一册 第一册 第一册 第一册 第一册 第二册 第二册 第二册 第二册 第二册 第二册 第二册 第二册 第三册 第三册 第三册 第三册 第三册 第四册 第四册 第四册 第四册 第四册 第四册 第四册
27
国食药监办[2007]541号
2007
第四册
28
国食药监械[2008]766号
2008
第四册
29 30 31 32 33 34 35 36 37 38 39 40
关于印发体外诊断试剂质量管理体系考核范围 有效覆盖判定原则及认定程序的通知 关于发布医疗器械生产质量管理规范的公告 关于印发《医疗器械生产质量管理规范检查管 理办法(试行)》的通知 关于发布医疗器械生产质量管理规范附录无菌 医疗器械的公告 关于印发医疗器械不良事件监测工作指南(试 行)的通知 关于印发体外诊断试剂分类子目录的通知 国家食品药品监督管理总局关于发布第一类医 疗器械产品目录的通告(第8号) 关于发布医疗器械产品技术要求编写指导原则 的通告 关于发布体外诊断试剂说明书编写指导原则的 通告 国家食品药品监督管理总局关于医疗器械生产 经营备案有关事宜的公告(第25号) 国家食品药品监督管理总局关于第一类医疗器 械备案有关事项的公告(第26号) 关于印发创新医疗器械特别审批程序(试行) 的通知 食品药品监管总局关于实施《医疗器械生产监 督管理办法》和《医疗器械经营监督管理办法 》有关事项的通知 食品药品监管总局关于实施《医疗器械注册管 理办法》和《体外诊断试剂注册管理办法》有 关事项的通知 食品药品监管总局办公厅关于实施第一类医疗 器械备案有关事项的通知 食品药品监管总局关于印发境内第三类和进口 医疗器械注册审批操作规范的通知 食品药品监管总局关于印发境内第二类医疗器 械注册审批操作规范的通知 MDD 93/42/EEC号指令 IVDD 98/79/EC号指令 关于发布体外诊断试剂临床试验技术指导原则 的通告 食品药品监管总局关于印发国家重点监管医疗 器械目录的通知 关于施行医疗器械经营质量管理规范的公告 关于发布医疗器械生产企业供应商审核指南的 通告 关于发布医疗器械临床评价技术指导原则的通 告 关于发布医疗器械生产质量管理规范附录植入 性医疗器械的公告
53 54 55 56 57 58 59 60 61 62 63 64 65 66
关于人工血管接环等172个产品分类界定的通知 食药监办械管〔2015〕69号 食品药品监管总局办公厅关于恒温核酸扩增检 测仪等22个产品分类界定的通知 关于可降解泪道栓子等53个产品分类界定的通 知 食药监办械管〔2015〕75号 食药监办〔2013〕11号
2014 2014 2014 1993 1998 2014 2014 2014 2015 2015 2015 2015
第七册 第七册 第七册 第八册 第八册 第九册 第九册 第九册 第九册 第九册 第十册 第十册
(2015年第14号) (2015年第102号)
关于乳腺摄影立体定位装置等153个产品分类界 食药监办械管〔2015〕49号 定的通知
Байду номын сангаас
2015 2015 2013 2015 2015 / / / / / / 2014 2013 2015
第十册 第十册 第十册 第十一册 第十一册 / / / / / / / / /
关于多功能超声骨刀等127个产品分类界定的通 食药监办械管〔2015〕104号 知 关于印发医疗器械生产质量管理规范现场检查 指导原则等4个指导原则的通知(2015)218号 中华人民共和国标准化法 中华人民共和国标准化法实施条例 中华人民共和国产品质量法 中华人民共和国计量法 中华人民共和国计量法实施细则 中华人民共和国认证认可条例 中华人民共和国安全生产法(2014年修订) 中华人民共和国特种设备安全法 中华人民共和国广告法 食药监械监〔2015〕218号 / / / / / / / 中华人民共和国主席令第四号 主席令第22号
