疫苗生产工艺流程图讲课讲稿
《疫苗生产流程》课件

疫苗生产的挑战和未来发展方 向
疫苗生产面临着各种挑战,但随着科技的发展和研究的推进,我们可以期待 更先进和有效的疫苗生产技术的出现。
质量控制
严格检验
通过多种测试手段确保疫 苗的纯度和有效性。
生物安全
采取必要的生物安全措施, 以防止污染和交叉感染。
遵循规范
符合相关的法规和标准, 确保疫苗质量符合要求。
疫苗的存储和运输
合理的存储和运输是保证疫苗质量和有效性的关键。适当的温度和条件将确 保疫苗在运输和储存过程中不被损坏。
疫苗接种与疫苗管理
疫苗的研发过程
1
病原体研究
分析目标病原体的特性和结构,为疫苗的设计提供依据。
2
抗原选择
选择合适的抗原以Βιβλιοθήκη 发免疫反应。3疫苗候选物开发
通过试验评估多个疫苗候选物的效力与安全性。
疫苗的制备与生产
原料准备
收集适当的原料,包括抗原和 辅助材料。
疫苗制剂
将原料按照特定比例制备成疫 苗制剂。
疫苗灌装
使用自动化设备将疫苗灌装到 瓶子或注射器中。
《疫苗生产流程》PPT课 件
本课程将详细介绍疫苗生产的流程,包括背景与重要性、研发过程、制备与 生产、质量控制、存储和运输、接种和管理等内容。让我们一起探索疫苗生 产的精彩世界!
疫苗生产的背景与重要性
通过了解疫苗的历史和重要性,我们可以深入了解为何疫苗生产对保护人类 健康至关重要。疫苗的发明和运用已经帮助全球范围内控制过许多严重的传 染病。
疫苗生产工艺详细流程

疫苗生产工艺详细流程
1疫苗生产过程
疫苗是为了预防传染病而制造的,是非常重要的预防措施。
为了保证疫苗的安全性,需要按照一系列精确的工艺流程进行生产。
1.1疫苗原料准备
疫苗的原料有多种,包括病原体或其衍生物,生物培养基,抗原制剂,抗凝血剂,抗生素,稀释剂等。
这些原料必须非常干净、有效和纯净,以确保疫苗的有效性和安全性。
1.2疫苗灭活
疫苗原料需要经过灭活处理,以安全地使原料中的病原体具有免疫力而不引起病症。
灭活技术有多种,其中最常用的是热、化学和光照等方法,以确保安全性。
1.3疫苗混合
混合是使用冷激活灭菌的疫苗原料,按照一定的稀释比例,通过高速混合来使成分完全混合。
混合时,需要考虑保存期和抗原强度,以确保安全性和有效性。
1.4疫苗灌注
灌注是将混合疫苗原料注入制药容器,采用自动装置进行灌注装置,以确保每个容器的注射量精确无误。
容器一般是钢皮瓶或塑料瓶等,同时需要适当控制温度,以确保灌注过程的顺畅性。
1.5疫苗封装
封装时,需要将注射液容器封入硬性瓶盖,然后将它们安全地封装在一起,以确保病原体不会轻易外泄,影响安全性。
同时,还要给容器着色、打孔,等操作,以方便后续使用。
1.6疫苗测试
疫苗生产过程完成后,需要进行测试,以评估疫苗的有效性和安全性。
一般的测试方法包括生物活性检测、灭活程度检测和安全性检测等,以确保疫苗满足有效性和安全性要求。
以上就是疫苗生产工艺,它是比较复杂的,关心安全性和有效性,需要精密的生产操作,严格控制程序,以确保疫苗能够准确地预防各种传染病。
hpv疫苗制造工艺流程

HPV疫苗制造工艺流程
一、病毒培养与扩增
1.病毒接种
(1)将HPV病毒接种到合适的宿主细胞中(2)筛选合适的细胞系
2.病毒培养
(1)在细胞培养基中培养病毒
(2)控制培养条件和时间
二、病毒纯化与提取
1.细胞破碎
(1)采用机械或化学方法破碎细胞
(2)分离病毒颗粒
2.病毒纯化
(1)使用离心或过滤等技术纯化病毒
(2)去除杂质和细胞碎片
三、疫苗制备与配方
1.病毒灭活
(1)使用物理或化学方法灭活病毒
(2)确保灭活效果和安全性
2.疫苗配方
(1)加入适量的辅料如佐剂、防腐剂等(2)调配疫苗液体制剂
四、疫苗制剂灌装
1.灌装准备
(1)准备灌装设备和疫苗容器
(2)检查设备清洁和消毒
2.疫苗灌装
(1)将疫苗液体制剂灌装入疫苗容器(2)控制灌装量和速度
五、疫苗包装与贮存
1.包装
(1)使用合格的包装材料和标签
(2)包装成品疫苗
2.贮存
(1)将包装好的疫苗进行冷藏或冷冻贮存(2)控制贮存温度和湿度。
疫苗生产流程(PPT53页)

疫苗生产项目简介
• 生产过程举例1:
发酵
纯化Ⅰ
纯化Ⅱ
灭活吸附
疫苗生产项目简介 二、生产过程举例2:
发酵 收集/灭活
加工
配制和灌装
安全/抑制有效病原体
安全/尤其产生不稳定病毒
去除杂质及所需产物特性相近 的外来物质
在辅助剂帮助下完成对大疫苗颗粒 的灭菌过滤滤
疫苗生产项目简介
• 无论一种疫苗在试验阶段是多么有效
疫苗生产项目简介
当我们拿到一个工程项目时,首先要做 的就是明确设计的依据,这个依据应该 包括:工艺技术、设备及公用辅助设施 等有关基础资料、生产规模、生产方式 、生产班制, 国家及行业主要有关规范和 规定等,只有有了这些依据,我们下一 步的工作才能做到有的放矢。然后就是 确定工程范围,明确我们要做的工作。
疫苗生产项目简介
• 经过机组处理过的洁净空气通过风管送到
各个洁净区域,再经过高效过滤器送到室 内,这与普通的空调送风没有太大的区别 ,不同之处在于疫苗生产车间有消毒杀菌 的需求,是生产过程中的重要一环,所以 选择一个好的杀菌方式是相当重要的,目 前常用的就是用外置臭氧发生器消毒,可 以满足一般的消毒杀菌的要求,但对于部 分有防爆要求的全新风房间,怎要根据具 体的情况选择合适的杀菌方式。
疫苗生产项目简介
生物医药厂房建筑必须针对生物医药工程存在的气溶胶泄露的 可能发生环节进行全面考虑,在产生安全隐患的地方进行彻底的 密封处理。生物医药厂房的维护结构的密封性能和平整度性能主 要体现在以下几个方面:
1、双圆弧天轨;
疫苗生产项目简介
2、圆弧转角;
疫苗生产项目简介
3、单圆弧收边;
疫苗生产项目简介
疫苗生产项目简介
细胞毒生产工艺课件
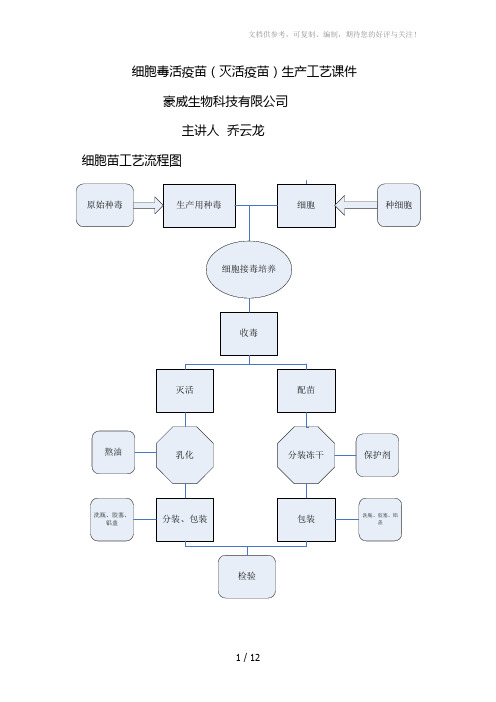
细胞毒活疫苗(灭活疫苗)生产工艺课件豪威生物科技有限公司主讲人乔云龙细胞苗工艺流程图一、种毒二、细胞1、原代细胞:牛睾丸细胞、鸡成纤维细胞、羊睾丸细胞2、传代细胞:wero非洲绿猴肾细胞、MDCK狗肾、DF-1鸡胚成纤维细胞、BHK-21幼仓鼠肾细胞、ST猪睾丸细胞、PK-15猪肾上皮细胞、Marc145猴肾细胞。
三、细胞培养液主要成分氨基酸氨基酸是组成蛋白质的基本单位.不同种类的细胞对氨基酸的要求各异,但有几种氨基酸细胞自身不能合成,必须依靠培养液提供,这几种氨基酸称为必需氨基酸.其中谷氨酰胺是细胞合成核酸和蛋白质必需的氨基酸,在缺少谷氨酰胺时,细胞生长不良而死亡.因此,各种培养液中都有较大量的谷氨酰胺.但是,由于谷氨酰胺在溶液中很不稳定,应置于-20℃冰箱中保存,在使用前加入培养液内.已含谷氨酰胺的培养液在4℃冰箱中储存2周以上时,还应重新加入原来量的谷氨酰胺.碳水化合物碳水化合物是细胞生长主要能量来源,其中有的是合成蛋白质和核酸的成分.主要有葡萄糖,核糖,脱氧核糖,丙酮酸钠和醋酸等.无机盐培养液中无机盐的主要功能是帮助细胞维持渗透压平衡.此外,通过提供钠,钾和钙离子,帮助细胞调节细胞膜功能.培养液的渗透压是一个非常重要的因素,细胞通常可耐受260mOsm/kg 320 mOsm/kg.标准培养液的渗透压在此范围内波动.特别注意:向培养液中加入其它物质有可能会明显改变培养液的渗透压,特别是溶于强酸或强碱中的物质.缓冲系统大多数细胞所需pH 在 7.2 - 7.4.但是,细胞培养最适pH值随培养的细胞种类不同而不同.成纤维细胞喜欢较高pH (7.4 - 7.7),而传代转化细胞系则需要偏酸pH (7.0 - 7.4).由于多数培养液靠碳酸氢钠(NaHCO3)与CO2体系进行缓冲,因此,气相中的CO2浓度应与培养液中碳酸氢钠浓度相平衡.如果气相或培养箱空气中CO2浓度设定在5%,培养3液中NaHCO3的加入量为1.97g/L;如果CO2浓度维持在10%,培养液中NaHCO3的加入量为3.95g/L.细胞培养瓶盖不应拧得太紧,以保证气体交换. HEPES 是一种非离子缓冲液,在pH 7.2 - 7.4 范围内具有较好的缓冲能力,但是非常昂贵,在高浓度时对一些细胞可能有毒.HEPES缓冲液可与低水平的碳酸钠(0.34g/L)共用,以抵消因额外加入HEPES引起的渗透压增加.在这种培养条件下,细胞培养瓶的盖子应拧紧,以防止培养液中所需的少量碳酸盐散入空气中.大多数培养液中含有酚红作为pH指示剂,酸性培养液呈橙黄色,碱性培养液呈深红色.磷酸缓冲液磷酸盐缓冲液是磷酸二氢钠和磷酸氢二钠组成,其中磷酸二氢钠酸性较强。
疫苗制造基本程序课件

经检验合格的菌液,按规定比例加入保护剂配苗,充分摇匀后随即 进行分装,分装量必须准确。
分装好的菌苗迅速送入冻干柜进行预冻、真空干燥,冻于完毕后立 即加塞、抽空、封口,移入冷库保存,并由质检部门抽样检验。
流程图1——细菌疫苗制造工艺流程 文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
如人用炭疽活疫苗、卡介苗经固体表面培养完成后须按规定要求将菌苔洗 下制成菌液
菌液于0~4C暗处保存,待抽样经纯粹、活菌数等检查合格 后使用。
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
二、细菌性活疫苗制造
菌种的选择 菌液培养 浓缩 配苗
(三)浓缩
为提高某些弱毒菌苗的免疫效果,可进行浓缩,以提高单位活菌数,常 用的依缩方法有吸附剂吸附沉降法、离心沉降法等,如于猪丹毒菌液内加入 0.2% ~0.25%羧甲基纤维素(CMC)进行浓缩,也可用离心沉淀浓缩。浓缩 菌液应抽样作纯粹、活菌数等检查。
菌种的选择 菌液培养 灭活 浓缩 配苗
(五)配苗与分装
由于灭活菌苗所用的佐剂不同,所以配苗方法也不相同。
氢氧化铝菌苗:可在加入甲醛灭活的同时,按比例加入氢氧化铝胶 配制;也可在菌液经甲醛灭活后再按比例加入氢氧化铝胶配苗。
有的厂油佐剂菌苗的配制程序为:于灭菌的油乳剂135m110号白油、 11.4m1Span-85、3.6ml Tween80混合液中,在边搅拌下加入等量甲 醛灭活菌液配制。
基本流程
菌液
灭 活
灭活菌液 + 佐剂
配置 原料
乳化
分装和保存
文档仅供参考,不能作为科学依据,请勿模仿;如有不当之处,请联系本人改正。
一、细菌性灭活疫苗制造
疫苗的制造流程与管理ppt课件
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
3、保证措施——兽药GMP背景
GMP是从药品生产实践中取得经验教训的总结。 人类社会经历了12次药物灾难,特别是20世纪出现
的药物灾难“反应停”事件后,公众要求制定严格 监督法律; 最早的GMP是由美国坦普尔大学6名教授编写制定; 1963年美国颁布第一部GMP,美国FDA经过实施; 1975年WHO正式公布GMP,开始向成员国推荐,并确 定为WHO的法规之一,迄今为止有100多个国家实施 了GMP; 我国医用药品从1982年开始颁布GMP,农业部于己于 1989年颁布并决定实施GMP,规定至2005年12月31日 未取得《GMP合格证》的企业,不得进行药品生产。
事物件件有验证:能证明任何程序、生产过程、设 备、物料、活动或系统能导致预期结果,有文件证 明的行动。凡是须问个为什么?怎么样?好不好? 行不行?----通过验证----放心使用
工作一律守制度:有一项工作或活动就必须有一项 制度;有制度就必须执行;有执行就必须有综合 (分析、检查);有综合就有提高(改进、修订)
疫苗生产质量控制
质量控制意义 质量控制要求 质量控制保证措施(兽药GMP管理) 疫苗质量评价
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
1、质量控制意义
国家强制要求
➢ 禽流感事件,人血白蛋白事件
认识到了贫困户贫困的根本原因,才 能开始 对症下 药,然 后药到 病除。 近年来 国家对 扶贫工 作高度 重视, 已经展 开了“ 精准扶 贫”项 目
灭活、减毒疫苗工艺流程
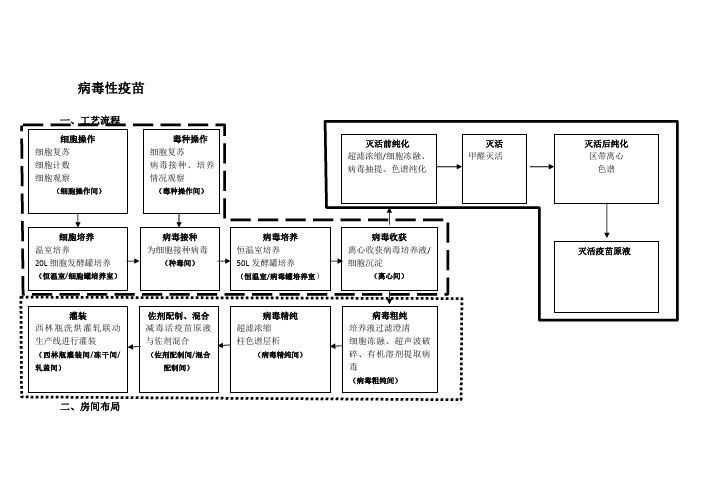
病毒性疫苗(一)疫苗原液生产区:1、细胞操作间(C级洁净度,无毒区)。
进行细胞复苏,细胞CO2培养箱培养,为细胞大量培养做准备;检测细胞恒温室、发酵罐中细胞生长状态。
2、细胞培养恒温室(C级洁净度,无毒区)。
使用转瓶机进行细胞培养,为病毒接种准备细胞。
3、细胞罐培养间(C级洁净度,无毒区)。
利用20L发酵罐进行细胞大量培养,为病毒接种准备细胞。
4、毒种操作间(C级洁净度,有毒区)。
复苏含有毒种的细胞,为毒种的扩增做准备;检测病毒感染后细胞的生长状态。
5、种毒间(C级洁净度,有毒区)。
将病毒按照适宜比例接种于细胞恒温室、细胞发酵罐培养得到的细胞中。
6、病毒培养恒温室(C级洁净度,有毒区)。
将种毒后的细胞置于温室中转瓶培养。
7、病毒罐培养室(C级洁净度,有毒区)。
种毒后的细胞在50L发酵罐中大量培养,培养至适宜程度,将发酵物泵入离心间。
8、离心间(C级洁净度,有毒区)。
使用大容量冷冻离心机,将病毒发酵罐内发酵物进行离心,分离上清液与细胞沉淀。
9、病毒粗纯间(C级洁净度,有毒区)。
对于分泌于细胞培养液中的病毒,使用超滤膜包过滤澄清细胞上清液,得到粗纯后的病毒液;对于胞内病毒,利用细胞冻融、超声破碎技术破碎细胞,释放病毒,并使用有机溶剂抽提法抽提得到病毒。
10、病毒精纯间(B级洁净度,有毒区)。
对粗纯后的病毒液进行超滤浓缩等操作,得到减毒活疫苗原液。
9、灭活前纯化间(C级洁净度,有毒区)。
对灭活疫苗进行纯化(粗纯、精纯)10、灭活间(C级洁净度,有毒区)。
灭活病毒11、灭活后纯化间(B级洁净度,无毒区)。
灭活后疫苗纯化间。
(二)减毒疫苗西林瓶分装单元1、西林瓶灌装间(三)减毒活疫苗中试生产辅助区1、称量间(C级洁净度,无毒区)。
存放减毒活疫苗原液中试生产所需的试剂;利用不同精度的电子天平称量所需的试剂,用于后续生产或溶液配制。
2、配液间(C级洁净度,无毒区)。
将称量的试剂配制成溶液,或对原液进行稀释等,用于后续减毒活疫苗的中试生产。
