全国化学奥林匹克竞赛(初赛)模拟试题(5)
2007年全国化学竞赛初赛模拟试卷(05)附答案

2007年全国化学竞赛初赛模拟试卷(05)(时间:3小时 满分:100分)第题(2分)92235U 原子吸收一个慢中子后,分裂成54136Xe 和3890Sr,写出核反应方程式。
第题(4分)H 2N --NHNH -COCF 3可作为增强基团用于释放显影促进剂的成色剂的合成。
2.合成该有机物可用对硝基苯肼和另一重要有机原料,写出结构简式,并指出该步合成反应的反应类型;第题(7分)3.Li3V2(PO4)3是一种新型的锂离子正极材料。
其阴离子是由2种多面体组合而成的三维第题(10分)钾盐A与氧化物B(等物质的量)在熔融状态下反应,生成C和气体D;C极易与水反应,生成沉淀E和溶液F;E干燥易失水生成B;F溶液中通入气体D生成A的溶液;C易被氧化剂氧化为G,G是一种常用的水消毒剂。
第题(13分)目前工业上通用的铬盐生产工艺是铬铁矿与纯碱及碳酸钙辅料混合、高温焙烧氧化、冷却、水浸、硫酸酸化、结晶除去硫酸钠转化为重铬酸钠产品;然后再进一步加工为其它铬盐产品。
该工艺三废污染严重,污染的同时造成铬资源的浪费。
中科院过程工程研究所研究开发出液相氧化-循环碳氨转化铬盐清洁生产新工艺,反应过程中极易析出产品NaNH4CrO4·2H2O。
NaNH4CrO4·2H2O的TG-DTG曲线见右图图。
由图中曲线可以看出NaNH4CrO4·2H2O的热分解分为三步进行:第一步分解温度范围为50~95℃,失重率19.91%(理论18.66%);第二步分解温度范围为100~180℃,总失重率为27.9%(理论25.40%);第三步分解温度范围为215~385℃,总失重率为32.20%(理论32.16%)3.某学生在实验后发现残留固体质量明显小于67.8%。
第题(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A和B的微观结构重复单元图。
第题(10分)根据信息写出各题要求物质的结构简式;1.以三氯化磷和乙二醇为原料可合成非常重要的有机合成中间体,该中间体中所有氢原2.V2O5、H2O2、在KOH中反应,生成钾盐,其阴离子是一种呈镜面对称的配3.等量的邻苯二胺和邻苯二甲醛,在一定条件下反应,通过模板合成得到一种平面型的多齿配体。
高中化学竞赛2021-2022第35届化学奥林匹克(初赛)模拟试题参考答案及评分标准
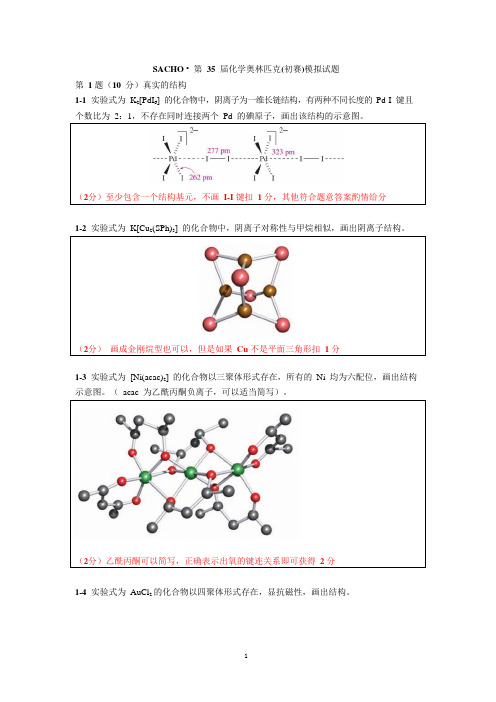
(2分)至少包含一个结构基元,不画I-I 键扣 1 分,其他符合题意答案酌情给分(2分)乙酰丙酮可以简写,正确表示出氧的键连关系即可获得2 分(2分)画成金刚烷型也可以,但是如果Cu 不是平面三角形扣1 分SACHO • 第35 届化学奥林匹克(初赛)模拟试题第1 题(10 分)真实的结构1-1实验式为K2[PdI6] 的化合物中,阴离子为一维长链结构,有两种不同长度的Pd-I 键且个数比为2:1,不存在同时连接两个Pd 的碘原子,画出该结构的示意图。
1-2实验式为K[Cu2(SPh)3] 的化合物中,阴离子对称性与甲烷相似,画出阴离子结构。
1-3实验式为[Ni(acac)2] 的化合物以三聚体形式存在,所有的Ni 均为六配位,画出结构示意图。
(acac 为乙酰丙酮负离子,可以适当简写)。
1-4实验式为AuCl2 的化合物以四聚体形式存在,显抗磁性,画出结构。
(2分)画出八元环1 分,一价金直线型0.5 分,三价金平面四方0.5 分1-5实验式为CoCl2(THF)2 的化合物具有对称中心,且存在两种配位数的Co ,不同环境的Cl 个数比为1:2:1,所有的THF(四氢呋喃)均只与一个Co 配位,画出其结构。
(2分)正确画出骨架0.5 分,钴有六配位有四配位0.5 分,完全符合题意1 分第2 题(12 分)书写反应方程式(提示:要求系数为最简整数比)2-1升汞是一种特殊的盐,其水溶液中几乎不电离出Hg2+,而是电离出一种负一价的阴离子和一种正一价的阳离子,请写出升汞电离的离子反应方程式。
2HgCl2=HgCl++HgCl3-(2分)2-2升汞和氨气反应会生成两种物质,氢的质量分数分别为为0.79974514%和7.534514%,请据此写出此反应的化学方程式。
2NH3+HgCl2=HgNH2Cl+NH4Cl (2分)2-3-1已知KCN 可以还原PbO ,该过程没有气体放出,请写出化学反应方程式。
高中化学奥林匹克竞赛辅导全真模拟试题(5)
高中化学奥林匹克竞赛全真模拟试题(五)题号 1 2 3 4 5 6 7 8 9 10 总分满分 6 13 11 9 11 4 11 12 17 6100 得分评卷人● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb M o TcRu Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na M gAl Si P Cl S K Ca Sc Ti V Cr M n Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.45 4.00320.1839.9583.80131.3[222]HeNe Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(6分)完成下列化学方程式 1-1 某校曾发生误将高锰酸钾与红磷相混,造成一死一残的严重事故。
COBP·中国化学奥林匹克竞赛(初赛)模拟试题

COBP ·中国化学奥林匹克竞赛(初赛)模拟试题出题人:鲁·人来疯 陕·Roentgenium指导人:Resazurin 风吹雨第1题(10分)1-1 二氟化银在碱性条件下的氧化性比酸性条件下的大,原因是其可以生成难溶物Ag 2O 从而升高了电极电势,据此给出二氟化银与水反应和硫酸存在下与水反应的两个反应方程式。
1-2 质谱、红外光谱和电子自旋共振证明了O 2F 2可以解离为两种自由基,而后其中的一种自由基可以发生二聚生成一种含有F 和O 的物质,给出这两个反应方程式。
1-3 在酸性缓冲溶液中,三氧化二砷和碘单质进行反应,产物以氧化物的形式表示,给出反应方程式。
1-4 在氧气中加热氧化钠,三氧化二铋的混合物,得到一种不溶于水的物质,该物质常常用于钢铁中锰含量的比色法定量分析,给出反应方程式。
1-5 在用亚砷酸盐的碱性溶液以BH 4-还原并酸化来制备胂的时候,发现含有少量的副产物,该副产物中含有两个砷原子但是不含硼原子,而且该副产物是对热不稳定的液体,给出该反应方程式。
第2题(13分)辉钼矿(MoS 2)的一种结构如右图所示,其中Mo 的杂化类型为d 4sp 杂化。
根据其结构图,回答下列问题。
2-1 Mo 占据S 组成的什么空隙,占有率为多少?2-2 指出Mo 配位多面体之间的连接方式。
2-3 由图可看出,辉钼矿是由一层一层的MoS 2构成的,据此推测层间与层内分别有何种类型的作用力?2-4 画出其单层沿c 轴的投影图,要明确表示出钼原子2-5 已知辉钼矿可以和氯气反应生成五氯化钼和一种金黄色的有毒液体,试写出反应方程式。
2-6 该晶体的点阵类型为简单六方,a = 315.0 pm ,c = 1230 pm ,而其比重在4.7~5 g/cm 3之间。
据此计算:最小重复单位是什么?2-7 该物质的晶体结构与哪种单质相似?据此类推,辉钼矿可以在工业上起什么作用?第3题(14分)3-1 一个抽真空容器中放入大量NH 4Cl ,当加热到340 °C 时,固体NH 4Cl 仍存在,此时物系的平衡压力为104.7 kPa 。
第33届中国化学奥林匹克竞赛(初赛)模拟试题暨2019年Chemilive夏季考参考答案

第 33 届中国化学奥林匹克竞赛(初赛)模拟试题暨 2019 年 Chemilive 夏季考参考答案及评分标准第 1 题(9 分)1-1反应方程式: B 12H 122- + 50 MnO 4- + 60 OH -→ 12 B(OH) 4- + 50 MnO 42- + 12 H 2O (2 分)1-2 反应方程式: 3 Fe 3Al 2Pb 3(SiO 4)5 + 64 H + + NO 3-→ 9 Fe 3+ + 6 Al 3+ + 9 Pb 2+ + 15 H 2SiO 3 + NO + 17 H 2O (2 分) 将 H 2SiO3 写作 H 4SiO 4、SiO 2、SiO 2·xH 2O 等形式,只要配平正确,均得全分。
2-2 Δf G m (T2O (g ), 298 K ) = - 234.60 kJ mol -1;·只写答案不得分,参考计算过程如下:所求反应可以表示为: (1) - (2) + 2 (3)×:K1 K 3211.9 (1分)K 4 ==K 2Δr G m = - RT ·lnK 4 = - 6.03 kJ mol -·1,Δr G m = Δf G m (T 2O(g), 298 K) - Δf G m (H 2O(g), 298 K) = - 6.03 kJ mol -1,·则: Δf G m (T 2O(g), 298 K) = -234.60 kJ mo ·l -1。
(1 分)2-3-1 干燥后气体体积为 0.5 dm 3。
反应前后总水量不变,故除去的水蒸气体积仍为起始体积 0.5 dm 3。
(1 分)2- 3-2 丰度为 883 ppm ;只写答案不得分,参考计算过程如下: 总氢元素数:1.840 103 101325 0.5 10-3 = 37.6 mol (1 分) n= 2+ 298.09 8.31447 298 对于反应 H 2O (g ) + T 2(g ) → 2TO (g ) + H 2(g ),设 H2O (g )转化率为 x ,则:x 2 =11.9K 4 =2(1- x ) 解得: x = 0.775。
2007年全国化学竞赛初赛模拟试卷1-5(附答案)

2007年全国化学竞赛初赛模拟试卷(01)2007年全国化学竞赛初赛模拟试卷(01)(时间:3小时 满分:100分)第题(2分)右图是同学们经常使用的某品牌修正液包装标签。
请仔细阅读,结合自己的生活经验和所学知识,得出2条重要化学性质。
第题(5分) 羟胺(NH 2OH )熔点33.05℃,沸点56.5℃,是有机合成上最常用的还原剂,工业上可电解硝酸制得,羟胺盐酸盐在工业上用途非常广泛。
1.写出电解硝酸电极上生成羟胺的电极反应方程式;2.写出能体现羟胺弱碱性的离子方程式;3.羟胺能还原溴化银,写出该反应的化学方程式;4.酸性条件下羟胺能将硫酸亚铁氧化,写出反应的离子方程式;5.系统命名右图所示物质的名称。
第题(8分)磺酸型离子交换树脂是最常见的阳离子交换树脂。
1.某磺酸型离子交换树脂X (网型)由常见单体烃A 和交联剂烃B 通过加聚、磺化反应而得树脂。
已知X 中C 、H 原子个数比是1︰1。
写出满足条件的A 、B 的结构简式;2.具有不同交联程度的磺酸型离子交换树脂可作为不同用途要求,如何控制交联的程度?3.除阳离子交换树脂外还有阴离子交换树脂,阴离子交换树脂的结构上有什么特点?4.如何用阴、阳离子交换树脂制备去离子水,简要说明。
5.在电解中使用的离子交换膜,实际上是阳离子交换树脂还是阴离子交换树脂?为什么?第题(7分)某离子化合物钾盐X 具有超导性,超导临界温度为18K 。
它的晶体结构经测定阴离子作立方面心密堆积,K +填充在全部八面体和四面体空隙中,晶胞参数a =1424pm ,晶体密度1.928g/cm 3。
1.计算该晶体X 的摩尔质量;2.确定该晶体X 的化学式;3.画出晶体X 正当晶胞沿着体对角线方向的K +投影(○表示K +的投影,◎表示2个K +的重叠投影)。
第题(10分)杂多化合物是一类含有氧桥的多核配合物,由于具有独特的分子结构及分子易于设计和组装的特点,现已广泛用作新型高效催化剂、药物、磁性材料、高质子导体……1.右图所示为1︰6系列的平面型杂多阴离子的典型代表,配离子Mo (Ⅵ)与氧形成八面体配位,杂原子I (Ⅶ)。
2023年全国化学竞赛初赛模拟试卷含答案

2023年全国化学竞赛预赛模拟试卷5(时间:3小时满分:100分)第一题(4分)一核反映为4个相同的原子A聚合成为一个原子B、两个正电子和两个反中微子,其中B 为元素C最常见的同位素,C不是在地球上发现的天然元素。
写出核反映方程式。
第二题(8分)在低温下,对某化合物A进行准确的元素分析,发现其元素质量分数分别为:C 42.1%,Si 24.6%,N 24.6%。
进一步研究发现,A中所有元素的原子最外层电子数都达成稳定结构,分子中有两种化学环境的碳原子。
已知A的摩尔质量为114g/mol。
1.试拟定A的分子式,写出其结构简式。
2.A在光照下,能发生分解反映生成B和气体C。
B中Si 55.8%(质量分数,下同),Si 32.6%。
已知B中不具有氮元素,分子中存在三种化学环境的碳原子,且分子中所有元素的原子最外层电子数都达成稳定结构。
C是一种稳定的单质。
试拟定B的结构简式。
3.2B→D。
试拟定D最为稳定的结构简式。
第三题(10分)SO2是现今空气污染的重要物质,如何消除SO2对空气的污染是化学家有待解决的问题。
182023,化学家GayLussac作了一个有趣的实验:将SO2与MnO2作用,生成了A和B两种盐。
进一步研究发现:A和B两种盐只有三种离子,其中A的阴离子为正四周体结构,B的阴离子是通过顶角相连的二个三角锥,A和B的阴离子的中心原子相同。
若将A和B物质分别溶解在稀酸中,久置后都变成同一种酸。
1.试拟定A和B的分子式。
2.上述反映可以看作发生了两个反映。
第一个反映是MnO2与SO2生成了A;第二个反映是MnO2被SO2还原成C,同时生成D。
C再与SO2反映,生成盐E。
盐E不稳定,分解成盐F和B。
盐E被D氧化成A。
已知C、E结构分别与Fe2O3和Fe2(SO3)3[注:该盐要在非水溶剂中制备]类质同晶。
写出C、E、F的分子式。
3.写出生成C、E和F的化学反映方程式。
第四题(10分)将硫磺在氟气中燃烧,可得到非极性分子A 。
(精品)全国高中化学竞赛(初赛)模拟试题20套

(精品)全国高中化学竞赛(初赛)模拟试题20套全国高中化学竞赛(初赛)模拟试题20套高中化学竞赛初赛模拟试卷(01)(时间:3小时满分:100分)题号满分 1 6 2 12 3 9 4 6 5 7 6 8 7 8 9 6 10 11 12 9 5 12 10 10 H He相对原子质量 1.008 4.003 Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.0116.00 19.00 20.18 Na Mg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 Cs Ba La-Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9 137.3 Lu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr Ra Ac-Rf Db Sg Bh Hs Mt Ds [223] [226] La La系 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Tb Lu 138.9 140.1 140.9 144.2144.9 150.4 152.0 157.3 158.9 162.5 164.9 167.3 168.9 173.0 175.0 第一题(6分)锦上添花:(根据已有内容的规律进行增补) 1.填分子式:(1)①C2H6 ②C8H18 ③________ ④C80H162 (2)①________ ②MgO ③SO3 ④CuSO4(3)①Fe2O3 ② ③Na2O2 ④FeSO4・7H2O ⑤CuSO4・5H2O ⑥ 2.填化学方程式:①2Na+2H2O=2NaOH+H2↑ ②2C+SiO2=Si+CO↑③2H2S+O2=2S+2H2O ④____________________________。
全国化学竞赛初赛模拟试卷

全国化学竞赛初赛模拟试卷第一题(10分)根据信息写出化学反应方程式:1.cu2s以辉铜矿的形式存在于自然界。
赤热的cu2s与水蒸气反应可以得到金属铜和气体。
经分析,产生的气体和铁与浓硫*反应的气体相同。
2.fe2(so4)3溶液能氧化cu2s使之溶解,且在空气中可以重复使用fe2(so4)3溶液。
第四题(11分)2000年美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它由4个氧原子构成的o4分子,专家认为它液化后的能量密度比普通氧分子高得多。
1.o4分子可看作2个o2聚合得到。
试解释o2为什么能聚合成为o4?2.试判断o4的结构。
3.从结构的角度解释o4和o2分子的稳定*、氧化*强弱。
第五题(10分)脱水反应是化学反应的基本类型。
试根据下列问题回答:1.某物质a其摩尔质量是so3的三倍。
它可以看作硫*分子间脱水得到的。
试写出化学反应方程式,并确定a的结构。
ooo2.p4o10的结构为:oo,若将p4o10是**分子间脱水得到的,问**分子间如何脱水才能得到p4o10呢?3.硅*分子间如何脱水才能得到sio2呢?第八题(16分)a是一种不稳定的物质。
在低温下可以用clf与无水hno3发生取代反应制得。
1.试写出制备a的化学反应方程式。
2.在0℃时,a也可以用cl2o与n2o5反应制得。
试写出化学反应方程式。
3.指出a的结构特点。
4.在-300c时,a与icl3反应生成一种不稳定的物质b。
试写出化学反应方程式。
5.a能够与ch2=c(ch3)2发生反应。
试写出化学反应方程式。
第九题(9分)最近化学家对氙化学的研究表明:xef2蒸气能与cf3·自由基反应,生成一种具有挥发*的蜡状白*固体a,同时释放出f·自由基。
已知在等离子体中,c2f6能解离成cf3·自由基。
1.写出在等离子体中,xef2+c2f6→a的化学反应方程式。
2.在20℃时,a能够发生分解,重新生成xef2和碳原子数不固定的全*代烃(以fm表示)。
2022年全国高中生化学竞赛初赛模拟模拟试题(05)

2022年全国化学竞赛初赛冲刺试卷(五)(时间:3小时满分:100分)第一题(4分)某锕系元素X于1944年由α粒子轰击Pu靶(Pu是锕系第6个元素)而得,并以某法国科学家的名字命名,已知上述反应只涉及3种粒子,且反应物总质量数为243。
第二题(3分)实验室中观察丁达尔现象一般是用Fe(OH)3胶体,但Fe(OH)3胶体须现场制取,不能保存,现有一种解决方法:取一支试管,加入一些蔗糖,用酒精灯缓慢加热使熔化……第三题(6分)化合物X是铋的共价型分子,含Bi %;X有较强的化学活性,能与盐酸作用,生成一种酸(酸根为正八面体构型),同时得到一种常见气体。
在沸腾的酒精溶液中,X也能与硫磺反应生成铋的硫化物和另一种气体。
2.写出上述X发生的2个化学方程式;第四题(8分)化合物X为一无色透明液体,是由短周期元素组成的非极性分子,沸点77℃,对氢气的相对密度为85。
1.确定X的分子式。
2.若在X中通入H2S气体,可以得到Y沉淀,试确定Y的化学式。
3.已知X和Y都能发生醇解,生成化合物Z,试写出X和Y分别与过量乙醇发生化学反应的方程式。
4.Z能与格氏试剂CH3MgBr反应,生成化合物M,该反应可看作酯基部分被烷基所取代。
假设反应中Z与CH3MgBr的物质的量之比为1︰2。
试写出该化学反应方程式。
5.Z也能被氢气还原,已知该反应过程中Z与H2的物质的量之比为2︰1,且生成物中有N生成外,还有C2H5OH生成。
试写出该化学反应方程式。
第五题(6分)1.某团簇分子由C、Cl、Zn三种元素组成,具有正八面体的对称性;其中心为C,且处于由6个Zn组成的八面体的中心;Zn都等价,处于由1个C和5个Cl组成的八面体的中心。
该分子中Cl有个,其化学式为。
2.钒酸根(VO43-)有缩合性,某多聚钒酸根(外观模型如右图)可看作由若干个钒氧八面体(VO6,中心为V,顶点为O)共棱(共用O原子)连接而成;而其中钒原子(忽略氧原子)的空间相对位置可看作由2个钒八面体(顶点为V,实际V与间无作用力)共用一条棱而成。
全国化学竞赛模拟考试-33届答案解析

第31届中国化学奥林匹克(初赛)模拟试题参考答案及评分标准第1题(10分)1-1锰最简单的羰基配合物在液氨中与金属钾作用可得到唯一产物,该产物为一种羰合金属阴离子化合物。
1-1-1写出反应方程式。
Mn2(CO)10 + 2K = 2 K[Mn(CO)5] 1分1-1-2说明两羰合物均符合EAN规则。
十羰基合二锰:Mn(0)提供7个电子,CO提供2个电子,形成一个Mn - Mn键,总电子数7×2+2×10+2=36=18×2,符合。
1分K[Mn(CO)5]:Mn(-1)提供8个电子,8+10=18,符合。
1分1-2金属铍易溶于氟氢化铵水溶液中,所得溶液的溶质受热分解可用于制备无水氟化铍。
写出这两个反应的方程式。
Be + 2 NH4HF2 = (NH4)2BeF4 + H2(NH4)2BeF4 = 2 NH4F + BeF2 2分1-3用化学式可表示为NaPb2.25的合金在乙二胺中与穴状配体(可记作crypt)作用可产生一种含全金属裸簇阴离子的暗红色晶体,且若反应完全进行,则没有Na元素或Pb元素的剩余。
1-3-1写出反应方程式。
4 NaPb2.25 + 4 crypt = [Na(crypt)]4[Pb9] 2分1-3-2若阴离子中只有一个四重旋转轴,不存在镜面与对称中心,试指出阴离子的结构。
加冠四方反棱柱,其中冠加在四边形面上。
1分。
第2题(19分)2-1 十硫化四磷与氟化钾作用可得到盐A与另一种与A互为等电子体的盐,盐A用溴氧化可以得到共价化合物B。
2-1-1写出两个反应的方程式。
P4S10 + 6 KF = 2 K2PS3F + 2 KPS2F22KPS2F2 + Br2 = 2KBr + P2S4F4 各1分2-1-2画出A与B的结构。
A:B: A 1分 B 2分2-2 二(二异丙胺基)氯化磷与三氯化铝在液态二氧化硫中作用可得到离子化合物C,试画出C的稳定的共振结构式。
中国化学奥林匹克竞赛模拟试题

“化学礁”杯 Hydrogenium中国化学奥林匹克竞赛模拟试题题号 1 2 3 4 5 6 7 8 9 10 11 总分 满分 12 10 9 14 6 8 10 8 4 9 10 100 得分● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn 相对原子质量Rf Db Sg Bh Hs Mt如果你在做这张卷子时有什么问题或者发现题目有什么漏洞,欢迎来到化学礁吧讨论,我们热切期待你的加入!第1题(12分)写出并配平下列化学反应的方程式。
中国化学奥林匹克竞赛(初赛)模拟试题

中国化学奥林匹克竞赛(初赛)模拟试题无机部分(170分)·竞赛时间3小时。
迟到超过半小时者不能进考场。
把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
阿伏伽德罗常数6.02214076×1023mol-1法拉第常数96485C·mol-1理想气体常数 8.314J·mol-1·K-1第1题(14分)请按要求书写下列化学反应方程式1-1 在过量S2-的存在下,在控制条件下将一氧化氮通入硫化亚铁沉淀,制得Roussin红盐(K2[Fe2(NO)4S2)或者Roussin黑盐(K[Fe4(NO)7S3)。
1-2 二氧化铅与亚硫酰氯在150℃下反应,生成三种化合物,硫元素存在于两种气体产物中。
1-3 氯酸钾加强热,产生两种物质,不含气体产物。
1-4 四氯化钛和银的反应的平衡会受温度的影响,请给出该可逆反应的方程式,并说明平衡会这样改变的原因。
1-5 请解释碘化钙在空气中久置会变黄的原因。
第2题(15分)2-1 B 4H 10的结构如右图所示,已知1mol 的B 4H 10可以与2mol 的NH 3作用,形成1:1的离子化合物。
已知正负离子中所含的对称元素完全相同,且负离子与B 4H 10中部分骨架结构相近。
请根据上述提示给出正负离子的结构式。
2-2二氨基磷酸负离子可通过如下有趣的流程制备。
2-2-1 请画出反应底物的结构。
2-2-2 请给出A 、B 的化学式。
2-2-3 请写出由B 生成产物的化学方程式。
第3题(17分)3-1 已知两种第二周期元素和三种第三周期元素可以形成一种六元环状化合物,与环磷氮烯是等电子体,其中含氯量为45.60%,请通过计算推导出该化合物的分子式并画出其结构。
全国化学竞赛初赛模拟题及答案

备战全国化学竞赛考前模拟训练题第一题(12分)写出下列各化学反应的方程式定量检测硝基乙烷的含量。
为正四面体构型。
将A的最高价含氧酸冷冻后与B的最高价氧化物混合,升温融化,维持温度40℃,剧烈反应生成气体C,氟化硼可于C以摩尔比1:1反应,生成D,将D溶于硝基甲烷中,通入干燥的氟化氢气体可得到沉淀E,E的阳离子与CO2为等电子体,阴离子为四面体构型。
将E与氟化钠在240℃反应得到产物F,F与固态C中的阴离子为等电子体。
2-1写出A和B生成C的方程式________________________________________2-2推测D,E,F的结构2-3 F可苯剧烈反应,写出反应的方程式第三题(10分)第四周期过渡金属M的氧化物X是重要的无机功能化工材料,研究小组将M 的氯化物加入剧烈搅拌的无水乙二醇中,并通入氨气制得了A,A是金属M的乙二醇盐。
A通过控制水量水解可得到纳米级X,A中M含量为28.5%,所有原子化学环境均相同,且不含氯元素。
X与碳酸钡熔融可以得到一重要压电材料Y,同时有气体生成。
3-1、写出M的元素符号和价电子构型3-2、写出制备A的化学方程式3-3、A的晶体分析结果表明,M的配位数为6,试说明M的配位数是如何满足的3-4、给出Y的化学式第四题(12分)经X射线分析鉴定,某一离子晶体属于立方晶系,其晶胞参数a=403.lpm。
晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
请据此回答或计算:4-1用分数坐标表达各离子在晶胞中的位置。
4-2写出此晶体的化学式。
4-3指出Ti4+的氧配位数和Ba2+的氧配位数。
4-4计算两种正离子的半径值(O2-半径为140 pm)。
4-5钼金属的晶格类型为体心立方晶格,原子半径为136pm,相对原子质量为95.94。
试计算该晶体钼的密度(原子体积占晶体空间的百分率)。
ρ= ;4-6钼能形成六核簇合物,如一种含卤离子[Mo6Cl8]4+,6个Mo原子形成八面体骨架结构,氯原子以三桥基与与Mo原子相连。
全国化学竞赛初赛模拟试卷

全国化学竞赛初赛模拟试卷第一题(4分)1.丁达尔效应的实质及产生条件各是什么?2.胶体系统能在一定程度上稳定存在的2个最主要原因是什么?第二题(5分)1.同一温度和压力条件下液态氖与液态氟化氢样品哪个熵更高些?为什么?2.氯化钠溶于水的反应NaCl(s)+n H2O(l)=Na+(aq)+Cl-(aq)。
25℃的标准焓变为3.81kJ/mol,这暗示该过程可能不自发。
我们知道NaCl事实上易溶于水,否则海水中就不会有那么高的盐分了。
那么反应的驱动力是什么?具体说明。
第三题(7分)人造血液是一种乳白色的完全人工合成的血液代用品。
它可以代替人血中的血红蛋白从肺脏向人体其他部分输送氧气。
目前对人造血液成分的研究主要集中在全氟代有机物上,A是其中有代表性的一种,输氧能力是血红蛋白的20倍,二氧化碳的溶解度也比血液高。
A由3种原子组成,质量分数为2.69%、20.75%、76.57%,其结构中F有3种不同的空间环境。
1.为什么人体血液是红色的,是否所以生物的血液都是红色的,为什么?2.写出A的结构简式;3.与健康人献血相比,人造血液具有3大优点,除输氧(CO2)量大外,还有2个优点是什么?4.人造血的发明,是人类输血史上的一项重大成果,但目前的人造血只是被用来急救,还不能完全替代人血。
其最主要原因是什么?第四题(5分)已知MgS、MnS、CaS、CaO、MgO中阴、阳离子都作立方密堆积,晶胞参数分别为520pm、520pm、567pm、480pm、420pm。
尽可能多的出求这些体系中的离子半径。
第五题(6分)木犀草素属于黄酮类化合物,结构简式如右图,具有止Array咳、怯痰和消炎等多种生理作用,金属配合物可增强原配体的生物活性。
等物质的量的醋酸盐MAc2与木犀草素在非水溶剂中完全反应得到一种配合物X,已知M(Ⅱ)的配位数为4。
1.X中木犀草素是几齿配体,说明理由;2.X是配合物分子还是存在配合物阳离子、阴离子?说明理由;3.画出配合物X的可能结构简式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
全国化学竞赛初赛模拟试卷(05)(时间:3小时 满分:100分) H 1.008 相对原子质量 He 4.003 Li 6.941 Be 9.012 B 10.81 C 12.01 N 14.01 O 16.00 F 19.00 Ne20.18 Na 22.99 Mg 24.31 Al 26.98 Si 28.09 P 30.97 S 32.07 Cl 35.45 Ar 39.95 K 39.10 Ca 40.08 Sc 44.96 Ti 47.88 V 50.94 Cr 52.00 Mn 54.94 Fe 55.85 Co 58.93 Ni 58.69 Cu 63.55 Zn 65.39 Ga 69.72 Ge 72.61 As 74.92 Se 78.96 Br 79.90 Kr 83.80 Rb 85.47 Sr 87.62 Y 88.91 Zr 91.22 Nb 92.91 Mo 95.94 Tc [98] Ru 101.1 Rh 102.9 Pd 106.4 Ag 107.9 Cd 112.4 In 114.8 Sn 118.7 Sb 121.8 Te 127.6 I 126.9 Xe 131.3 Cs 132.9 Ba 137.3 La -Lu Hf 178.5 Ta 180.9 W 183.8 Re 186.2 Os 190.2 Ir 192.2 Pt 195.1 Au 197.0 Hg 200.6 Tl 204.4 Pb 207.2 Bi 209.0 Po [210] At [210] Rn [222] Fr [223] Ra [226] Ac -LaRf Db Sg Bh Hs Mt Ds 第一题(8分)1.纯HClO 4是一种不导电的液体,而当固体HClO 4·H 2O 熔化时其具有导电性。
(1)写出HClO 4和HClO 4·H 2O 分子的可能点电子结构图 (2)说明在此例中氢键的重要性。
2.今有化学式为Co(NH 3)5CO 3Cl 配合物。
(1)写出其可能的结构式并命名。
(2)用化学方法鉴别它们。
第二题(8分)汞蒸气有毒,为了检查室内汞含量是否超标,可用含某一化合物A 的试纸悬挂于室内,室温下若三小时内试纸变色,则表明室内汞超标。
化合物A 为较常见化合物,白色,难溶于水,其金属阳离子在水中不稳定,可发生歧化反应,歧化产物之一可与A 的非金属阴离子作用并生成化合物A 。
1.判断A 为 ,键型 。
2.A 的阳离子在水溶液中的歧化反应方程式。
3.歧化产物之一与A 的阴离子反应方程式。
4.检测汞蒸气时,试纸颜色由 色变成 色。
写出反应方程式(已知反应产物之一是配合物)。
第三题(9分)1.大茴香腈(CH 3O --CN )是一种重要的新型的香料。
其制备可以醛A 和盐酸羟胺为原料反应,反应得到中间产物醛肟B ;B 在全氟磺酸树脂催化下失水得到大茴香腈。
(1)系统命名法命名大茴香腈;(2)写出A 、B 的结构简式。
2.有机合成材料C ()有许多实际应用,可作为杀虫剂、表面活性剂的消泡剂及塑料的抗氧化剂等。
(1)系统命名法命名C(2)C 中2个苯环是否可能共平面,为什么?(3)写出由两种常见有机物在膨胀石墨催化下合成C 的化学反应方程式。
3.2-(二氯甲基)苯并咪唑是合成阳离子型染料和药物的重要中间体。
合成路线如下:邻苯二胺+二氯乙酸−−−−−→−回流 ][%30PTC HCl D −→−EF (2-(二氯甲基)苯并咪唑)已知D 能溶于水,E 是常见的无机盐。
(1)写出上述两步反应的化学方程式;(2)写出F 水解产物的名称。
第四题(9分)甲磺酸铅通常为50%~58%的水溶液,在电镀及电子工业中有广泛地应用。
电化学合成法制备甲磺酸铅的要点:以甲磺酸为电解液,金属铅做为阳电极,石墨做阴极,聚乙烯磺酸型阳离子交换膜为阴阳极室隔膜。
1.写出电极反应方程式、总反应方程式和电池符号。
2.使用隔膜的目的是什么?不使用会有什么后果。
3.是否需要加入支持电解质?为什么?4.电化学合成法比一般的化学合成法有什么优点?第五题(7分)Li 4SiO 4具有有利于离子传导的结构,为锂离子导体理想的基质材料。
实验发现用三价离子M 3+如B ,Al ,Ga ,Cr ,Fe ,In 能取代Li 或Si (Li 4+x M x Si 1-x O 4,Li 4-3y M y SiO 4)可大大提高它的离子电导性。
Li 4.1Fe 0.1Si 0.9O 4是其中重要的一种,可用溶胶-凝胶法合成:称取一定量的CH 3COOLi ,Fe(NO 3)3合成,用稀硝酸溶解,按化学计量摩尔比加入Si(OC 2H 5)4,并加入适量的无水乙醇,使Si(OC 2H 5)4∶C 2H 5OH =1∶4做共溶剂,再加入金属离子摩尔总和1.5倍的柠檬酸,用NH 3·H 2O 调整pH =2~3。
样品在80℃回流使其水解缩聚,然后在70℃缓慢蒸发,实现溶液-溶胶-凝胶的转化。
在120℃干燥得到干凝胶。
干凝胶在高温下进行一定时间热处理,于750℃得到超细粉。
1.写出制备Li 4.1Fe 0.1Si 0.9O 4的化学方程式。
2.溶胶-凝胶法是近几年发展起来的湿化学合成方法,比以前较多使用的固相法有何优点?3.右图为Li 4.1Fe 0.1Si 0.9O 4干凝胶的TG -DTA 曲线。
从图中可以发现在248℃处都有一吸热峰,那是干凝胶表面 的吸热峰;在417℃左右的峰为 放热峰;而 ℃的放热峰则为Li 4.1Fe 0.1Si 0.9O 4形成峰。
第六题(8分)离子化合物A 及B 均只含有C ,H ,O ,N 四种元素,并且阴阳离子互为等电子体。
电导实验证实化合物A 属于K 2SO 4型,化合物B 属于MgSO 4型,已知A 及B 阴离子的含氧量分别为79.99%,76.91%。
1.画出化合物A 及B 的结构式(阴阳离子分开写)2.再写出一种阴阳离子互为等电子体的离子化合物。
3.写出制备A 的方程式。
第七题(13分)1.苄基-2-萘基醚是芳香族的混醚,其传统合成方法采用威廉森法。
主要用于合成苄氧萘青霉素等医药工业,且广泛地作为合成香料,用于皂用香精、化妆品香精、草霉香精及调合香精等香料工业。
写出合成苄基-2-萘基醚的化学方程式。
2.三羟甲基丙烷(简称TMP )是重要的化学中间体和精细化工产品,广泛应用于生产高级醇酸树脂和聚氨脂、聚脂、合成干性油、高级润滑油、印刷油墨、增塑剂、玻璃钢、纺织助剂等,在许多方面其性能优于甘油、新戊二醇和季戊四醇。
工业上可以用正丁醛和甲醛(实际消耗量为1︰3)为原料,用碳酸氢钠和碳酸钠混合碱溶液作为缩合催化剂,再加入少量的助催化剂三乙胺,在25~85℃常压条件下合成。
(1)写出分步反应方程式。
(2)如果该合成是绿色工艺,如何处理副产物。
3.N ,N -双(对甲苯磺酰基)-2-哌嗪羧酸甲酯是合成抗结核病及抗类风湿病药物2-哌嗪羧酸的中间体。
其合成路线如下:A +Br 2→BC +CH 3--SO 2Cl→D B +D→(1)写出A 、B 、C 、D 的结构简式;(2)命名B 和CH 3--SO 2Cl 。
第八题(7分)某晶体的结构可看作由金原子和铜原子在一起进行(面心)立方最密堆积,它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由4个金原子和2个铜原子构成,另一种由2个金原子和4个铜原子一起构成,两种八面体的数量比是1:1。
该晶体具有储氢功能,氢原子全部填充在由金、铜原子构成的四面体空隙中。
1.写出该晶体储氢后的化学式。
2.该晶体属于哪种晶系?其四面体空隙由什么原子组成,是否全部等价?3.画出该晶体的一个晶胞(金原子用大○球,铜原子用大球)。
4.如果该晶体中金、铜原子的排列无序,出现相互代换的现象(按统计原子计),则其晶胞与哪种常见物质的晶胞是相同的?第九题(6分)某金属X 与短周期非金属元素组成的簇合物A (含X :40.0%),具有很好的空间对称性。
14.73g A 在氧气中燃烧,固体失重43.7%,所得气体干燥后为7.467L (标准状况下)CO 2气体。
1.通过计算确定X 的化学式;2.画出出X 的结构式;3.指出化合物A 中X 的氧化数和杂化类型。
第十题(11分)止咳酮(C 6H 5CH 2CH 2COCH 3)在临床上具有止咳、祛痰的作用。
作为治疗剂时,通常被制成亚硫酸氢钠的加成物,便于服用和存放。
1.系统命名法命名“止咳酮”;2.利用乙酰乙酸乙酯与A 反应,得到中间产物B ,再经水解脱羧得到止咳酮,合成路线如下:乙酰乙酸乙酯+A −−−−−→−OH H C ONa H C 5252/B −−−−→−O H NaOH 2/−−−→−-2/CO HCl 止咳酮(1)写出A 、B 的结构简式(2)写出两步配平的反应的总方程式。
(3)分离止咳酮的实验操作是什么?3.写出止咳酮和饱和亚硫酸氢钠的加成产物的结构简式;溶液的pH 值对这一步制备反应有什么影响?为什么?4.某学生做止咳酮和饱和亚硫酸氢钠加成的实验时,在反应开始不久就出现有油状物漂在水溶液表面的现象,继续加热回流,结果油状物不但没有消失反而越来越多,最后得不到晶体。
试分析该学生实验失败的原因。
第十一题(14分)Pb3O4为红色粉末状固体。
该物质为混合价态氧化物,化学式可写成2PbO·PbO2实验,其中Pb(Ⅱ)占约2/3,Pb(Ⅳ)约占1/3。
下面是测定Pb3O4中PbO和PbO2组分的实验:准确称取0.0400g~0.0500g干燥好的Pb3O4固体,置于250mL锥形瓶中。
加入HAc-NaAc (1︰1)10mL,再加入0.2mol/L KI溶液1~2mL充分溶解,使溶液呈透明橙红色。
加0.5mL 2%淀粉溶液,用0.0100mol/L Na2S2O3标准溶液滴定使溶液由蓝色刚好褪去为止,记下所用去的Na2S2O3标准溶液的体积为V(S2O32-)。
再加入二甲酚橙3~4滴,用0.0100mol/L EDTA标准液滴定溶液由紫红色变为亮黄色时,即为终点。
记下所消耗的EDTA溶液的体积为V(EDTA)。
1.写出上述实验原理中的化学方程式;2.溶解Pb3O4固体为什么用HAc,而不用常见的硫酸、盐酸、硝酸?使用缓冲溶液HAc -NaAc对后面的实验有什么意义?3.写出Pb3O4中PbO和PbO2组分的物质的量4.评价该滴定实验有什么特点(优点)?全国化学竞赛初赛模拟试卷(05)参考答案第一题:1.(1) (各1分)(2)在HClO 4分子中氢键是广泛存在的,而在HClO 4·H 2O 中,由于存在晶格能,离子的位置是固定的,所以氢键不是广泛存在的。
