第十章界面化学
10 第十章 界面现象习题解

第十章界面化学 课后作业题解10.3 计算373.15K 时,下列情况下弯曲液面承受的附加压力。
已知373.15K 时水的表面张力为58.91×10-3N.m -1。
(1)水中存在的半径为0.1μm 的小气泡;(2)空气中存在的半径为0.1μm 的小液滴;(3)空气中存在的半径为0.1μm 的小气泡。
解:10.4 在298.15K 时,将直径为0.1mm 的玻璃毛细管插入乙醇中。
问需要在管内加多大的压力才能防止液面上升?若不加任何压力,平衡后毛细管内液面的高度为多少?已知该温度下乙醇的表面张力为22.3×10-3N.m -1,密度为789.4 kg.m -3 ,重力加速度为9.8m.s -2。
设乙醇能很好地润湿玻璃。
解:乙醇能很好地润湿玻璃,可看作cos θ=0,所以r=r 1(曲率半径与毛细管半径相等)需要在管内加892 Pa 的压力才能防止液面上升。
若不加任何压力,平衡后毛细管内液面的高度为0.115m 。
kPa 2356Pa 2356400101091584r 4p 3kPa 1178Pa 1178200101091582r 2p 217373==⨯⨯=γ=∆==⨯⨯=γ=∆----..)())((Pa 892100.051022.32r 2p 33=⨯⨯⨯=γ=∆--m 1150100.0589789.41022.32gr 2h 33..=⨯⨯⨯⨯⨯=ργ=--10.9 已知在273.15K 时,用活性炭吸附CHCl 3,其饱和吸附量为93.8dm 3.kg -1,若CHCl 3的分压力为13.375 kPa ,其平衡吸附量为82.5 dm 3.kg -1。
试求:(1)朗缪尔吸附等温式中的b 值;(2)CHCl 3的分压为6.6672 kPa 时,平衡吸附量为若干?解:(1)朗缪尔吸附等温式(2)根据朗缪尔吸附等温式10.14 293.15K 时,水的表面张力为72.75mN.m -1,汞的表面张力为486.5mN.m -1,而汞和水之间的界面张力为375mN.m -1,试判断:(1)水能否在汞的表面上铺展开?(2)汞能否在水的表面上铺展开?解:(1)水能在汞的表面上铺展(2)汞不能在水的表面上铺展bp 1bp V V m +=b 375131b 37513893582....+=0m 38.75mN 72.75-375-486.5--S -1->⋅==γγγ=水水汞汞0m -788.75mN 486.5-375-72.75--S -1-<⋅==γγγ=汞水汞水1-3m kg 73.58dm 6.66720.54591 6.66720.545993.8bp 1bp V V ⋅=⨯+⨯⨯=+=1kPa 545901-82.593.8375131b -=⎪⎭⎫ ⎝⎛⨯=..10.17 292.15K 时,丁酸水溶液的表面张力可以表示为)bc 1(a -0+γ=γln ,式中0γ为纯水的表面张力,a 和b 皆为常数。
第十章界面化学思考题答案(1)

第十章界面化学思考题答案1.已知水在两块玻璃间形成凹液面,而在两块石蜡板间形成凸液面。
试解释为什么两块玻璃间放一点水后很难拉开,而两块石蜡板间放一点水后很容易拉开?答:水在两玻璃和两石蜡板间的状态如下图。
水能润湿玻璃,在两块玻璃之间的水层两端液面呈凹形,故其附加压力方向指向空气,使水层内的压强小于外部大气压强,两者相差2γ/r,即相当于两块玻璃板外受到2γ/r的压力作用,所以要把它们分开很费力。
且两板越靠近,此压力差越大,使两板难以拉开。
石蜡板的情况相反,液体压力p大于外压力,易于拉开。
2.如下图所示,在一玻璃管两端各有一大小不等的肥皂泡。
当开启活塞使两泡相通时,试问两泡体积将如何变化?为什么?2图3图答:开启活塞后,大泡将变大,小泡将变小。
活塞关闭时,由于肥皂泡膜产生附加压力,Δp=p内-p外=4γ/r.泡的半径r越小,附加压力越大,而大、小泡的p外是相同的,故小泡内空气压力大于大泡内空气压力。
因此打开活塞后,小泡内空气就流向大泡,导致小泡变成更小。
当小泡收缩至其半径等于玻璃管口半径时的r最小,若再收缩,其曲率半径反而增大。
所以当小泡收缩至其曲率半径与大泡半径相等时,停止收缩。
3.如上图所示,玻璃毛细管A插入水中后,水面上升高度应能超过h,因此推断水会从弯口B处不断流出,于是便可构成第一类永动机,如此推想是否合理?为什么?答:不合理,由于毛细管上方弯曲,当液面上升到顶端后,又沿弯曲管下降到弯口B处,液面下降时,由于弯曲部分液体受到重力作用,使凹液面的曲率半径由r增大到r',故附加压力也相应减小到Δp'=2γ/r ' 。
到B处,Δp'与B处高度的静压力达到平衡,曲率不再变化(仍是凹液面)。
故水滴不会落下。
4.一定量的小麦,用火柴点燃并不易着火。
若将它磨成极细的面粉,并使之分散在一定容积的空气中,却很容易着火,甚至会引起爆炸。
这是为什么?答:这有两方面原因。
磨成极细的面粉后,比表面积大大增加,磨得越细,其表面能越高,所处的状态就越不稳定,其化学活性也越大,因而容易着火。
第十章__界面现象2005.11.20

有等于系统增加单位面积时所增加的吉布斯函数,
所以也称为表面吉布斯函数
9
例:
20 ℃时汞的表面张力 =4.85×10
-1
N· m
-1
,若在此温度
及101.325 kPa 时,将半径r1 = 1 mm的汞滴分散成半径为 r2 =10-5 mm 的微小液滴时,请计算环境所做的最小功。 解:因为T,p 恒定,所以为常数,环境所做的最小功为可逆过程 表面功W’,
6
此实验证明,液体表面层存在着一个平行于液面,垂直 于分界线的力,此力使表面收缩 —— 表面张力。
对于弯曲液面,表面张力则与液面 相切。
表面张力
7
2. 表面功与表面张力表面吉布斯函数:
dx
当T、p、n不变的条件下,若把 MN移动dx,
F外
l
则增加面积dA=2l· dx,
此时外界必反抗表面张力做功。 WR' F外 dl 在可逆条件下:F外=F表+dF≌F表
15
5. 影响表面张力的因素
(1)表面张力和物质性质有关和它接触的另一相的性质有关。 (i)和空气接触时,液体和固体中的分子间作用力越大表面 张力越大。一般:
(金属键)> (离子键)> (极性共价键)> (非极性共价键)
(ii)同一种物质和不同性质的其它物质接触时,界面层中分 子所处的力场不同,界面张力出现明显差异。(看下表数据)
16
某些液体、固体的表面张力和液/液界面张力
物质 水(溶液) 乙醇(液)
/(10-3
N· -1) m 72.75 22.75
T/K 293 293
物质 W(固) Fe(固)
10-物理化学第十章 界面现象

ln
Pr Ps
2 M r RT
凸(液滴)~ “+” 凹(气泡)~ “–”
凸(液滴,固体粉末 or r > 0)— Pr>Ps 凹(气泡 or r < 0 )— Pr<Ps
水平液面(r→∞)— Pr=Ps
❖ 亚稳状态和新相的生成 ——分散度对系统性质的影响
亚稳状态
——热力学不稳定态,一定条件下能相对 稳定的存在。
杨氏方程
cos
s l
sl
润湿条件 s sl 铺展条件 s sl l
❖ 应用
毛细管内液面
凹: 润湿
凸: 不润湿
§10–3 弯曲液面下的附加压
由此产生毛细现象,并影响饱和蒸气压
10·3·1 弯曲液面产生附加压
附加压 △P= P心-P外
➢ 杨-拉普拉斯方程
曲面— P 2 膜— P 4
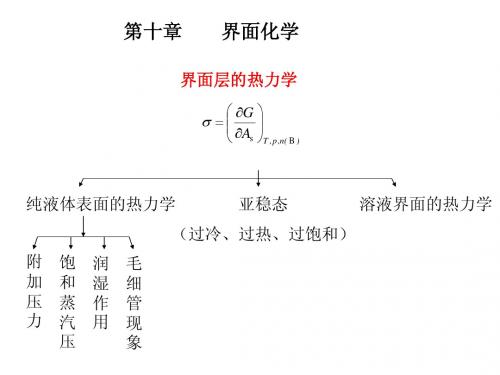
第十章 界面现象
讨论界面性质对系统的影响
新的系统—多相,小颗粒系统
非体积功—表面功
❖ 需考虑界面影响的系统 界面所占比例大的系统
比表面——
aS
AS m
❖ 本章内容 表面张力
① 表面现象的成因 表面现象的总成因
与AS↓有关 ② 各类现象分析
与γ↓有关
§10–1 表面现象的成因 10·1·1 表面张力 ❖ 表面张力 γ 定义—作用于单位边界上的表面紧缩力 方向—总指向使表面积减小的方向
为降低表面张力而产生 吸附剂 —— 起吸附作用的 吸附质 —— 被吸附的
§10–4 固体表面的吸附 固体对气体的吸附
10·4·1 吸附的产生
固体特点—有大的比表面,不稳定。 通过吸附其它分子间力较小的物质,形成 新的表面能较低的界面。
两个相对的过程——吸附和解吸 吸附量——一定T、P下,吸附和解吸达平 衡时,吸附气体的量。
界面化学第10.11章

3)量子尺寸效应 )
对于纳米微笑,能带变化不是连续的,当热能、 电能、磁能、光电子能量或超导态的凝聚能比 平均的能级间距还小时,纳米微粒会呈现一系 列与宏观物体截然不同的反常特征,称之为量 量 子尺寸效应。 子尺寸效应。
4)量子隧道效应 )
电子既有粒子性又具有波动性,它的运动范围 可以超过经典力学所限制的范围,这种超过是 穿过势垒,而不是翻越势垒,这就是量子力学 量子力学 中所说的隧道效应。 中所说的隧道效应。
5)小尺寸效应 )
当超细微粒尺寸不断减小,与光波波长、德布 罗意波长以及超导态的相干长度或透射深度 等特征尺寸相当或更小时,晶体周期性的边 界条件将被破坏,引起材料的电、磁、光和 热等特性呈现新的小尺寸效应。例如: a. 陶瓷器件在通常情况下呈脆性,纳米陶瓷材 料有良好的韧性 b. 特殊的光学性质,当金被制成纳米微粒时, 会失去原有的光泽而呈现黑色。
光催化氧化就是光照射到纳米材料后, 光催化氧化 电子被激发到材料的表面态被捕获,满 带电子跃迁到空带,满带的空穴把周围 环境中羟基的电子夺去,使之变成自由 基。即
h++OH-→·OH
仿生纳米化学 生物体系中的许多结构单元及结构 的尺寸都在纳米范围。生物膜厚度约610nm,血红蛋白直径为6.8nm,DNA 直径约为2nm,这些都是天然的纳米材 料。 仿照生物分子通过分子之间非共价 弱相互作用,形成具有特定功能的多分 子聚集体。
2.纳米材料的分类 纳米材料的分类
零维 纳米材料
三维 纳米材料
按形态
一维 纳米材料
二维 纳米材料
2.纳米材料的分类 纳米材料的分类
纳米结构材料 按作用 纳米功能材料
按纳米材料 的种类
有机纳米材料 无机纳米材料 药物纳米材料 生物纳米材料
物理化学第十章 界面现象

27
饱和蒸气压与液滴曲率半径关系的推导:
dn的微量液体转移到小液滴表面 小液滴面积A:4r2 4(r+dr)2 面积的增量:dA = 8rdr dG =dA= 8r dr 又:dn液体由p pr: dG = (dn)RTln(pr/p)
p = 8 p g r dr
2 d n = 4 p r (dr )r / M 由于
24
毛细现象:
当接触角θ<90o时, 液体在毛细管中上升; 当接触角θ>90o时,液 体在毛细管中下降。 当接触角θ=0时,r曲面= r毛细管= r 2
r 由流体静力学有: p g p l gh p p g p l
h
r pg pl pg
液体在毛细管中的上升高度为: 2 h r g
球形,正是因为相同体积下球形面积最小。
22
弯曲液面附加压力Δp 与液面曲率半径之间关系的推导: 水平分力相互平衡, 垂直分力指向液体内部, 其单位周长的垂直分力为 cos 球缺底面圆周长为2 r1 ,得垂直分力在圆周上的合力为: F=2r1 cos 因cos = r1/ r ,球缺底面面积为 r12, 故弯曲液面对于单位水平面上的附加压力 p 整理后得:
B
B( )
d n B( ) dA s
A G U H A A A A s s s s T , p,n B( ) S,V ,n B( ) S, p,n B( ) T ,V ,n B( )
11
(1)表面张力(surface tension)
液体表面的最基本的特性是趋向于收缩。 由于表面层分子的受力不均衡,液滴趋向于呈球
形,水银珠和荷叶上的水珠也收缩为球形。
物理化学知识点chap 10

Pa
2.356
103
kPa
【10.5】水蒸气迅速冷却至298.15K时可达到过饱和状态。已
知该温度下水的表面张力为71.97×10-3 N·m -1 ,密度为997
kg·m-3。 当过饱和水蒸气压力为平液面水的饱和蒸气压的4
倍时,计算: (1)开始形成水滴的半径;(2)每个水滴中
所含水分子的个数。
m
= 7.569 ? 10- 10m
(2)每个水滴的体积
( ) V 水滴=
4 3
pr
3
=
4 创3.14 3
7.569 ? 10- 10 3 m 3
1.815 ? 10- 27m 3
每个水分子的体积
V 水分子=
M rL
=
骣 琪 琪 琪 桫997
创
0.018 6.022
m 3 = 3.00 ? 10- 29m 3 1023
分析: 利用拉普拉斯方程
p 2
r
解: (1)和(2)两种情况下均只存在一个气-液界面, 其附加压力相同。根据拉普拉斯方程
p
2
r
2 58.91103 0.1106
Pa
1.178
103
kPa
(3)空气中存在的气泡,有两个气-液界面,其附加压力 为
p
4
r
4
58.91103 0.1106
•
pg
••
•
气
•
p
• •
pl
(a)
pg
• 气 p • •
液•
pl (b)
附加压力方向示意图
•
•
气•
•
•
• •
p=• 0
界面化学

Ⅰ
水中加无机酸、碱、盐等。
{σ} Ⅱ
水中加有机酸、醇、酯、醚、酮等。
Ⅲ
水中加入肥皂、合成洗涤剂等。
{c}
图10-7 溶液的表面张力与浓度的关系 通常,把能显著降低液体表面张力的物质称为该液体的表面 表面 活性剂。一般水的表面活性剂都是由亲水性的极性基团(亲水 活性剂 基)和憎水性的非极性基团(亲油基)两部分构成。
* r
* pr (毛细管中凹液面)
对液体中的气泡其饱和蒸气压与平面液体的饱和蒸气压相 对大小关系比较复杂,这里不多加论述。
(3)液体对固体的润湿作用 润湿是指:固体表面上的气体(或液体)被液体(或另一种液体) 润湿 取代的现象。 润湿类型可分为:沾附润湿 浸渍润湿 铺展润湿 沾附润湿、浸渍润湿 铺展润湿(见图9 沾附润湿 浸渍润湿、铺展润湿 -3)
(3)高度分散系统的热力学基本方程 高度分散系统具有巨大的表面积,所以具有巨大的表面能 高度分散系统 表面能。 表面能 因此从热力学角度不能不考虑它所产生的表面效应。于是,对 高度分散系统,其热力学基本方程变为: dU=TdS-pdV+σdAs+∑µBdnB dH=TdS+Vdp+σdAs+∑µBdnB dA=-SdT-pdV+σdAs+∑µBdnB dG=-SdT+Vdp+σdAs+∑µBdnB 于是有
Γ= V m ,V,m为被吸附气体的体积(吸附温度
T、p下),m为吸附剂质量。
如以θ=Γ/Γ∞表示(Γ∞为吸附剂吸满一层气体分子的吸附量), 则上式可改写为
p
Γ bΓ ∞
=
1
+
p
Γ ∞
(3)BET多分子层吸附定温式
第十章 界面化学

5、理解吉布斯等温方程式中各项的物理意义,会 用其作简单计算,会用其解释正吸附、负吸附 等界面现象。
6、什么叫表面活性物质,了解表面活性剂的大致 分类及它的几种重要作用。
7、了解液-液、液-固界面润湿性能的热力学
基础。
pg
0
pg
Vm (l)[ pl pl ] RT ln
pg
0 pg
2γ p pl pl ' R
0
Vm (l)
M
2M RT ln 0 ' pg R ——Kelvin公式 pg
pg p
pg
0
讨论:
① 凸液面
0 g
凸液面(如液滴)上方的饱和蒸气压比平液面大; 凹液面
B
dG SdT Vdp γdA BdnB
B
利用全微分性质可知
S γ A V ,T ,nB T V , A,nB
S γ A T , p,nB T A, p,nB
1 1 p γ ( ' ' ) ——杨—拉普拉斯方程 R1 R2
对于球面,
R R R
' 1 ' 2
'
水平液面:
R , p 0
'
2γ p ' R
p 0
对凸液面,曲率中心在液体内部,
曲面下液体多承受△P 力作用 对凹液面,曲率中心在液体外部, 曲面下液体少承受△P 力作用
δ WR,f Fdx
F dx
表面张力:与界面相切,垂直于边界并指向液体 收缩方向的力。
表面化学习题答案

第十章 界面现象习题答案一、名词解释1. 表面活性剂:溶于水中能显著地降低水的表面张力的物质,称为表面活性剂。
2. 接触角:是指在一光滑水平的固体表面上的液滴,在一定的T 、p 下达平衡时,固液界面与气液界面的切线在三相接触点处的夹角(夹有液体)。
3. 表面张力:液体的表面张力定义为沿着液体表面垂直作用于单位长度线段上的紧缩力。
用符号γ表示。
4. 临界胶束浓度:形成一定形状的胶束所需表面活性物质的最低浓度。
5. 吸附:物质在两相界面上自动富集或贫乏的现象称为吸附。
6. 溶液的表面吸附:溶质在溶液表面层(或表面相)中的浓度与在溶液本体(或本相)中的浓度不同的现象,称为溶液表面的吸附。
二、简答题1. 兰格缪尔吸附理论的基本假设是什么在推导BET 公式时,所作的基本假设是什么二者的使用范围如何 兰格缪尔吸附理论的基本假设有四条:(1)固体表面是均匀的;(2)吸附是单分子层的;(3)被吸附分子间无相互作用力;(4)吸附平衡是动态平衡。
兰格缪尔吸附等温式适用于五种常见吸附等温线中的第一种类型。
BET 吸附理论接受了兰格缪尔理论的许多观点,其主要区别在于他们认为吸附可形成多分子层的,而且第二层以后的各层吸附,是相同分子间的相互作用。
吸附热均相等,并相当于该气体的凝聚热。
BET 公式适用于相对压力p/p 0=~范围的吸附。
2. 进行蒸馏实验时,通常在蒸馏瓶中加入少量碎瓷片或沸石类的物质以防止暴沸,试分析其原因。
暴沸现象是由于新相种子(小气泡)难以生成而产生的。
由开尔文公式可知,对小气泡,r<0,|r|越小,气泡内的饱和蒸气压也越小,而附加压力却越大。
在液面下的小气泡须承受的外压力等于大气压力、液体静压力及附加压力三者之和。
在正常沸腾温度下,气泡内的饱和蒸气压远远小于p 外,因此小气泡无法产生。
只有再升高温度,使p r 增大,当达到p mgh p p r ∆++≥0时,液体便开始沸腾。
而一旦气泡生成,它便迅速长大,随之p r 相应增加,p 相应降低,气泡反抗的外压迅速减小,因而液体沸腾激烈,形成暴沸现象。
物理化学第10章界面现象ppt课件

在1913—1942年期间,美国科学家Langmuir在界面 科学领域做出了杰出的贡献,特别是对吸附、单分 子膜的研究尤为突出。他于1932年获诺贝尔奖,被 誉为界面化学的开拓者。 界面化学的统计力学研 究是从范德华开始的。1893年,范德华认识到在界 面层中密度实际上是连续变化的。他应用了局部
与一般体系相比,小颗粒的分散体系有很大的表 面积,它对系统性质的影响绝对不可忽略。
首 页 刚看的页 上一页 下一页 结 束
物质的分散度用比表面积 as 表示,它的定义为 物质的表面
积 As 与质量 m 的比:
as
As m
10.0.1 单位:m2·kg-1
对于以上水滴的例子,若近似认为其在室温下密度为 1g ·cm-3,则以上两种情况,比表面积 as 分别约为:6 cm2 ·g1 及600 m2 ·g-1 。
αB
4.2.7
首 页 刚看的页 上一页 下一页 结 束
dU TdS pdV μB (α)dnB (α) 4.2.8
αB
dH TdS Vdp μB (α)dnB (α) 4.2.9
αB
dA SdT pdV μB (α)dnB (α) 4.2.10
αB
当体系作表面功时,G 还是面积A的函数
界面现象是自然界普遍存在的现象。胶体指的是 具有很大比表面的分散体系。对胶体和界面现象 的研究是物理化学基本原理的拓展和应用。从历 史角度看,界面化学是胶体化学的一个最重要的 分支,两者间关系密切。而随着科学的发展,现 今界面化学已独立成一门科学,有关“界面现象” 或“胶体与界面现象”的专著在国内外已有多种 版本。本课程主要介绍与界面现象有关的物理化 学原理及应用。它包括各种相界面和表面活性剂 的相关特性,界面上的各种物理化学作用,实验 的和理论的研究方法及其重要应用。对于准备考 研的同学,还应将其作为物理化学课程的一部分。
第10章 界面性质

液面为球面时公式的推导
O1 r1
α
r
O
cos r1
• 定义:ΔP= P内-P外 > 0
P外 P内
凸液面ΔP= Pl-Pg 凹液面ΔP= Pg- Pl
凸液面
凹液面
液面为球面时: P P内 P外 2
r
平面、凸面、凹面的液内受力情况分析
P外
P外
γ
γγ
γ γ
△P
P内=P外
P内=P外+ △P
附加压γ
P内=P外- △P
• 表面张力一般随温度增加而降低。
• 纯物体: γ = γ0(1-T/ Tc)n • (3)压力的影响:
• 表面张力一般随压增加而降低。
§10.2 弯曲液面的附加压力及其后果
• (1) 弯曲液面的附加压力:拉普拉斯方程
• 液面 有凸液面和凹液面两种。
• 弯曲液面的附加压力: 由于表面张力的作用,弯 曲液面的两侧存在一个压力差ΔP 。
§10.1 界面张力
• 1、表面张力
外
• 表面功及表面张力
力
• 表面功:将体相中的分子称到液体的表面以扩大液 体的表面,则必须由环境对系统作功。
•
δ Wr‘ = dGT,p = γdA
故:
•γ •
单位面积的表面功 单位面积的表面吉布斯函数
( G AS
)T , p
• 表面张力 : 作用在表面单位长度上的力。
10-3
109
6× 10-1 6× 105 0.44×10-1
10-4
1012
6
6× 106
0.44
10-5
1015
6× 101 6× 107 0.44×101
界面现象

§10-2 弯曲液面的附加压力及其后果
1. 液面附加压力的产生 (1)平液面 对一小面积 AB , 沿 AB 的四周
p0
f
A
每点的两边都存在表面张力,大 小相等,方向相反。因此,水平 液面下液体所受压力即为外界压 力。 所以平液面没有附加压力。
B
f
p0
(2)凸液面 例如:一个液滴悬浮在它的饱和蒸汽中,呈球状,液面为凸面。 由于液面是弯曲的,则沿AB的周 界上的表面张力不在一个平面上, 无法对消,于是产生了一个指向 球心的合力,称为附加压力,用 Δp表示。
——Kelvin公式
(2)kelven公式
凸液面(液滴):
2g M pr R T ln = p rr
——Kelvin公式
pr:弯曲液面的饱和蒸汽压 p:水平液面的饱和蒸汽压
凹液面(气泡、毛细管凹面):
2g M pr R T ln = p rr
——Kelvin公式
由Kelvin公式可知: 1)p凸> p平> p凹 2)在一定温度下,液滴越小,其饱和蒸汽压越大; 气泡越小,泡内(毛细管内)液体的饱和蒸汽压越小。 简答: 请利用Kelvin公式解释毛细管凝结现象。
。
2)空气中的小气泡,其内外气体的压力差在数值上 等于 。
3)在室温、大气压力下,于肥皂水内吹入一个半径为r的空气 泡,该空气泡的压力为p1。若用该肥皂水在空气中吹一同样为r 的气泡,其泡内压力为p2,则两气泡内压力的关系为p2 p1。 设肥皂水的静压力可忽略不计。 (A)>; (B) <; (C) =; (D)二者大小无一定的关系。
三种情况:
①润湿:液滴在固体表面上呈单面凸透镜形。
②不润湿:液滴呈扁球形。
十界面现象物理化学

弯曲表面下的附加压力
1.在平面上 研究以AB为直径的一个环作
为边界,由于环上每点的两边都 存在表面张力,大小相等,方向 相反,所以没有附加压力。
设向下的大气压力为Po, 向上的反作用力也为Po ,附加 压力Ps等于零。
Ps = Po - Po =0
剖面图 液面正面图
弯曲表面下的附加压力
气压曲线
Tf < Tf T
一定外压下,温度低于正常凝固点还不凝固 的液体称为过冷液体。
过饱和溶液
• 一定温度下,溶液浓度已超过饱和浓度而仍未析 出晶体的溶液称为过饱和溶液。
产生原因: 同样温度下,小颗粒的溶解度大于普通晶
体的溶解度。 消除:结晶操作中,溶液过饱和程度大会生成
细小的晶粒,不利于后续操作。常采用 投入晶体种子的方法,获得较大颗粒的 晶体。
比表面Av/(m2/m3) 6 ×102
6 ×103 6 ×105 6 ×107
6 ×109
分散度与比表面
从表上可以看出,当将边长为10-2m的立方体分 割成10-9m的小立方体时,比表面增长了一千万倍。
可见达到nm级的超细微粒具有巨大的比表面积, 因而具有许多独特的表面效应,成为新材料和多相 催化方面的研究热点。
影响表面张力的因素
(1)分子间相互作用力的影响 对纯液体或纯固体,表面张力决定于分子间形成
的化学键能的大小,一般化学键越强,表面张力越大。
g (金属键)>g (离子键)> g g (极性共价键)> (非极性共价键)
两种液体间的界面张力,界于两种液体表面张力之间。
(2)温度的影响 温度升高,表面张力下降。
2g R'
RTln(p p0)g2gR Vm '(l)2r gR M '
第十章 界面化学

上一内容
下一内容
回主目录
返回
(2)、表面功、表面吉布斯函数
• 由于恒温恒压下,可逆非体积功等于系统的吉 布斯函数变,即: • δW|r = dGT,p = σdAs • ∴σ = (G/As)T,p • 可见: σ又等于系统增加单位面积时所增加的 吉布斯函数,所以σ也称为表面吉布斯函数, 单位为J· m-2 • 表面张力、单位面积的表面功、单位面积的表 面吉布斯函数三者虽为不同的物理量但他们的 数值和量纲是等同的。
上一内容
回主目录
返回
毛细管现象
• 由上式可见:在一定温度下,毛细管越细,液 体的密度越小,液体对管壁润湿得越好,液体 在毛细管中上升的越高。 • 当液体不能润湿管壁,θ>90度,cos θ<0时, h为负值,表示管内凸液面下降的深度。(如 玻璃管插入汞内) • 可见:表面张力的存在是弯曲液面产生附加压 力的根本原因,而毛细管现象则是弯曲液面附 加压力的必然结果。 • 应用:(如农民锄地)
上一内容
下一内容
回主目录
返回
毛细管现象
r1 θ r θ h
毛细管现象
上一内容 下一内容 回主目录
返回
毛细管现象
• 由图中的几何关系可以看出: • Cosθ= r/r1 • 将此式代入(10.2.3),可得到液体在毛细管 中上升的高度: • h=
2 cos rg
下一内容
(10.2.4)
界面张力的作用方向效果
dl
L
表面张力
(a) 平液面表面张力示意图
上一内容 下一内容 回主目录
球形液面表面张力示意图
返回
(2)、表面功、表面吉布斯函数
第十章界面现象

物化第十章界面现象习题一、名词解释1. 表面活性剂2. 接触角3. 表面张力4. 临界胶束浓度5. 吸附6. 溶液的表面吸附二、简答题1 兰格缪尔吸附理论的基本假设是什么?在推导BET公式时,所作的基本假设是什么?二者的使用范围如何?2. 进行蒸馏实验时,通常在蒸馏瓶中加入少量碎瓷片或沸石类的物质以防止暴沸,试分析其原因。
3. 为什么表面活性剂能大大地降低水的表面张力?4. 表面活性物质的增溶作用是什么?增溶作用与一般溶解有什么区别?5. 气-固、液-固、液-液界面分别以什么方式降低表面自由能?6. 简述人工降雨的科学道理。
7. 加热液体时为什么会出现过热现象?怎样避免暴沸?请解释原因。
8 为什么空气中会出现水蒸气过饱和的现象?人工降雨的道理何在?9. 在亲水固体表面,经过表面活性剂(如防水剂)处理后,为什么可以改变其表面性质,使其具有憎水性?三、判断题1. 比表面吉布斯自由能与表面张力符号相同,数值相等,所以两者的物理意义相同。
2. 在液体中形成的小气泡,气泡的半径越小,泡内饱和蒸汽压越小。
3. 若增加浓度能使表面张力增大时,则溶质在表面层发生正吸附。
4.只有表面活性剂的浓度低于临界胶束浓度时,才具有增溶作用。
5. 在恒温下,液体的分散度越大,其饱和蒸气压也越大7.只有在比表面很大时才能明显地看到表面现象,所以系统表面增大是表面张力产生的原因。
8.对大多数系统来讲,当温度升高时,表面张力下降。
9.比表面吉布斯函数是指恒温、桓压下,当组成不变时可逆地增大单位表面积时,系统所增加的吉布斯函数,表面张力则是指表面单位长度上存在的使表面张紧的力。
所以比表面吉布斯函数与表面张力是两个根本不同的概念。
10.恒温、恒压下,凡能使系统表面吉布斯函数降低的过程都是自发过程。
11.过饱和蒸气之所以可能存在,是因新生成的微小液滴具有很大的比表面吉布斯函数。
12.液体在毛细管内上升或下降决定于该液体的表面张力的大小。
第10章 界面化学
r
θ
R
θ
h
2σ cosθ h= ρ B gR
σ——液体表面张力; ρB——液体体积质量;
g——重力加速度。
亚稳状态 液体的过热现象——定压下,当液体的温度高于该压力下的沸 液体的过热现象 点,而液体仍不沸腾的现象。 液体的过冷现象——定压下,当液体的温度已低于该压力下 液体的过冷现象 液体的凝固点,而液体仍不凝固的现象。 蒸气的过饱和现象——定温下,当蒸气分压超过该温度下的饱 蒸气的过饱和现象 和蒸气压,而蒸气仍不凝结的现象。 溶液的过饱和现象——定温、定压下,当溶液中溶质的浓度 溶液的过饱和现象 已超过该温度、压力下的溶质的溶解 度,而溶质仍不析出的现象。
p* 2σ M B ln r = ± p r ρ B RT
(“+”——球形液滴或毛细管中的凸液面;“-”——毛 细管中的凹液面)
(3)液体对固体的润湿作用 )
固体
沾附润湿
液体
∆Ga,w=σ(s/l)-[σ(s/g)+σ(l/g)]
固体
浸渍润湿
液体
∆Gd,w=σ(s/l)-σ(s/g) 铺展润湿
液体 固体
溶液界面的热力学 (1)溶液的表面张力 )
Ⅰ
水中加无机酸、碱、盐等。
{σ} Ⅱ
水中加有机酸、醇、酯、醚、酮等。
Ⅲ
水中加入肥皂、合成洗涤剂等。
{c}
溶液的表面张力与浓度的关系
(2)表面活性剂及其结构特征 ) 表面活性剂定义: 表面活性剂定义: 把能显著降低液体表面张力的物质称为该液体的表面活性剂。 表面活性剂。 表面活性剂 表面活性剂结构: 表面活性剂结构: 一般水的表面活性剂都是由亲水性的极性基团(亲水 基)和憎水性的非极性基团(亲油基)两部分构成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产生表面(界面)现象的原因是什么?
§10.1界面张力
§10.1界面张力
1、表面张力、表面功及表面吉布斯函数 表面分子及内部分子的受力分析
表面分子受到一个向内的力。使液体 分子总是向液体内部移动,力图缩小 表面积。内部分子所受到的力在各个 方向的力相等,其合力为零。
用金属丝制成的框架上涂有肥皂泡其受力情况 如图:
r1
2 r
2
eg: ①小液滴 ②液体中的气泡
p pl pg
2 r
p pg pl
2 r
③肥皂泡
p p i p o ( p g ,i p l ) ( p l p g ,o )
2 r2 rFra bibliotek4 r
⑤ ④毛细管连通的大小不等的气 泡
T↑
气相中分子密度降 低 液相中分子距离↑ 极限情况:T→Tc时,γ→0
γ↓ (有例外)
④压力的影响。 a.表面分子受力不对称的程度 ↓
P↑
b.气体分子可被表面吸附,改变γ, ↓
c.气体分子溶于液相 一般:p↑10atm, γ ↓1mN/m。eg:
γ↓
1atm
10atm
γH2O = 72.8 mN/m
T
露点:T小< T正常
( 2)实验中加热为何加沸石,加晶种?铝壶底为
何做成波纹状?
p大气压 Δp
静液压p静
pi
∵pi = p静+p大气压+Δp ∴液体内部产生气泡所需的温度Ti>T正常,产生暴沸。
(3)对固体也适用。
4.过饱和溶液
在一定温度下,溶液浓度超过了饱和浓度,而未析出晶 体的现象,该溶液称为过饱和溶液
G
l g
a
s g
sl
l g
Gs
G
s
s g
sl
s g
sl
可见 : ①沾湿 →浸湿→铺展,过程进行程度依次加难。 ②沾湿→浸湿→铺展,是不同层次的润湿,铺展为最高层次。 ③对三种润湿影响不同的γl-g可测,γs-g、γs-l不可测量。
h
2 cos r g
0
进一步:
①.
当 90 时 , h
0
2 cos r g
h
0 , ( 毛细管液面上升
0
)
②.
90
0
时,
2 cos r g
毛细管中液面下降
例① 当玻璃管插入汞中或水中:
汞 ② 农民为何要锄地? ③感冒时为何要发汗? ④
(1) ΔG1
(3)ΔG3
ΔG2=? 1mol饱和蒸汽 (p) (2) 1mol饱和蒸汽 (pr)
⑴ 过程恒温、恒压, 为液体的可逆蒸发过程 ΔG1 = 0 ⑵ 可认为理想气体的恒温变压过程 pr G 2 RT ln( ) p ⑶ 过程仍然恒温恒压,但是为理想气体的可逆 冷凝微小液滴的相变过程: ΔG3 = 0
Δp 加热
Δp
加热
2.毛细现象:
rl
pg
θ
r
θ
h
pl
毛细管的半径为
r
p p g pl
2 r1
(1)
由流体静力学有:p g p l gh
………………………(2)
(1)、(2)联立可得,液体在毛细管中的上升高度为:
h 2 r1 g
r r1
cos
r1 r / cos
对上述途径a:
G G G G RT ( pr p ) ...... (1 )
1
2
3
G b
Pr
P
V m ( l ) dp
P P
P
V m ( l ) dp
对上述途径b: 当压力变化不大时
Vm(l)近似认为常数 Vm(l) = M/ρ
Vm(l)·Δp
2 M
水
§10.4稳态和新相的生成
1、 微小液滴的饱和蒸汽压-kelven公式
足够长的时间
半径不同的小水滴 结论:根据液体蒸汽的大小决定于液体分子向空间逃逸的倾向,可知:
p 小水滴 〉 p 大水滴
p*反比于曲率半径
1mol液体 (p,平面)
ΔGb=? 途径b 恒T 途径a
1mol小液滴 (p+Δp,r)
;系统增加单位面积的表面吉布斯函数变,所以称为表面
吉布斯函数单位Jm-2
定义:沿着液面垂直作用于单位长度上的紧缩力——表面张力,符 号——γ,单位——mN/m。
•=F/2L
方向:对于平面,沿着平面与液面行;
对于弯曲液面,应与液面相 切。 γ可理解为:使液体增加单位表面时所需作的可逆功, 称比表面功。 单位:J· -2= mN/m。 m
杨氏方程
或润湿方程
或 :
s g
s l
l g
cos
G
s
g l (cos 1 ) 0 ,
180
0
0
G a g l (cos 1 ) 0 G g l cos 0 ,
90 0
γH2O = 71.8 mN/m
⑤分散度、运动情况对γ也有影响。
§10.2 液-固界面
1.接触角与杨氏方程
1)润湿角(或接触角):固液界面的水平线与气液界面在O点 的切线之间 的夹角θ。 rl-g rs-g
rl-g
rs-g rs-l
rs-l
平衡时 , s g s l l g cos
A A s S , p , n B ( ) , A sj
T , V , n B ( ) , A sj
n B(a)表示各相中各物质的量均不变, 表示除了界 面面积 A sj 外,其余界面面积均不改变。
As
j
在恒温恒压下,各相的物质的量不变时,
G a [ sl ( sg lg ) A w a
G a wa 0 , 沾湿功
①飞机飞行中水珠是否附着于机翼上 ②喷施农药时是否有效地附着于叶片上,自动铺展
(2)浸湿或浸渍润湿(immersional wetting)
固 气
液
固液
G i w i 0
0
i
问题:θ=180º 的情况有没有?不存在绝对不润湿的物质。
由于θ可测,习惯上用接触角来衡量润湿程度。
0º
润湿
90º
不润湿
结论:①θ的大小用来判断润湿与否,θ角越小润湿效果越好。 ②要使cosθ>0,(或θ<90º ),须满足γs-l<γs-g,降低γs-l。
2.润湿现象
固体表面上原来的气体被液体取代。接触过程的Gibbs函数降低, △G<0。Gibbs函数降低越多,越易润湿。 1.分类: (1)沾湿(ahhensional wetting) 气 液 固 液 固
④Δp永远指向球心。
拉普拉斯方程也可按以下方法导出: 设一凸面AB,其球心为O,球的半径r, 球底面所受到的力为:
A
r1
B
r
O
F 2 r1 cos
r1
2
球底截面积为
cos r1 / r
所以弯曲液面对于单位上的 附加压力为
p p 2 r1 r1 / r
4 3
r dV 4 r dr
3 2 2
A 4 r dA 8 rdr
p
2 r
Laplace
公式
可见: ①该形式的Laplace公式适用于球形液面。
②曲面内(凹)的压力大于曲面外(凸) 的压力,Δp>0。
③r越小,Δp越大;r越大,Δp越小。对平 液面:r →∞,Δp→0,(并不是γ= 0)
2、热力学公式 对一般多组分体系:
G f (T 、 p 、 n B 、 n C 、 n D )
当体系作表面功时,G还是面积A的函数
G f ( T 、 p 、 n B、 n C、 n D A )
dG S dT Vdp dA
s
B
B
dn
B
dU TdS pdV dH TdS Vdp
例:体积为1cm3的正方型小水滴
分散 106倍
(边长10nm的正方型小
液滴)
相差106倍
面积: 6 ×10-4m2
600m2
与一般体系相比,小颗粒的分散体系有很大的表面积,它对体系性质的 影响绝对不可忽略!
日常自然界中表面现象的例子: 1.汞在光滑的玻璃上呈球形,在玻璃管中呈凸形。 2.水在光滑的玻璃上完全铺展,在玻璃管中呈凹形。 3. 露珠在荷叶、草叶上呈球形。 4. 液体的过热、过冷,溶液的过饱和。
Δp由表面张力γ产 生
Vm (l)
2 r
r
2M
………………(2)
RT ln
pr p
r
可见:①由于附加压力的作用,使由平面液体分 散成小液滴为恒温变压 过程; ②对纯液体,当温度一定的情况下,pr = f(r), 且r↓, pr ↑ 。 ③凸液面:
r 0, ln pr p 0 pr p
dn dn
B B
B
dA s dA
s
B
dA SdT pdV
B
dn B dA s
G A s
U A s T , p , n B ( ) , A sj
