坎地沙坦酯杂质列表
基因毒性杂质

什么是基因毒性杂质对于基因毒性杂质的定义主要是指:在以DNA 反应物质为主要研究对象的体内/ 体外试验中,如果发现它们对DNA 有潜在的破坏性,那可称之为基因毒性。
对没有进行体内实验的情况下,也可以根据关联系做一些相关的体外实验去评估该物质在体内的毒性。
如果没有关联评估的,体外基因毒性物质经常被考虑为假定的体内诱变剂和致癌剂。
GUIDELINE ON THE LIMITS OF GENOTOXIC IMPURITIES ( EMEA/CHMP/QWP/251344/2006 )基因毒性杂质的风险按照目前的法规来说,(体内)基因毒性物质在任何摄入量水平上对DNA 都有潜在的破坏性,这种破坏可能导致肿瘤的产生。
因此,对于基因毒性致癌物,不能说“不存在明显的阀值,或是任何的摄入水平都具有致癌的风险”。
可接受风险的摄入量对于那些可以与DNA 进行反应的化合物,由于在较低的剂量时机体保护机制可以有效的运行,按照摄入量由高到低所造成的影响进行线性推断是很困难的。
目前,对于一个给定诱变剂,我们很难从实验方面证明它的基因毒性存在一个阀值。
特别是对某些化合物,它们可以与非DNA 靶点进行反应,或一些潜在的突变剂,在与关键靶位结合之前就迅速失去了毒性。
由于缺乏支持基因毒性阀值存在的有力证据,而使得我们很难界定一个安全的服用量。
所以有必要采取一个新观点:确定一个可接受其风险的摄入量。
可接受其风险的摄入量即毒理学阈值一般通用的被定义为Threshold of Toxicological Concern (TTC)。
具体含义为:一个“ 1.5ug/day ”的TTC 值,即相当于每天摄入1.5ug 的基因毒性杂质,被认为对于大多数药品来说是可以接受的风险(一生中致癌的风险小于100000 分之1 )。
按照这个阀值,可以根据预期的每日摄入量计算出活性药物中可接受的杂质水平。
在特定的条件下一些基因毒性杂质也可以有较高的阈值。
坎地沙坦酯质量标准

坎地沙坦酯质量标准
坎地沙坦酯是一种有机化合物,化学式为CHN₆O₆,主要用作抗高血压药。
以下是坎地沙坦酯的质量标准:
外观:应为白色或类白色结晶性粉末。
有关物质:取本品适量,精密称定,加甲醇适量使溶解,用流动相稀释制成每1ml中约含2mg的溶液,作为供试品溶液;精密量取供试品溶液适量,用流动相稀释制成每1ml中约含5μg的溶液,作为对照溶液。
照高效液相色谱法试验,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵溶液(取醋酸铵5.0g加水50ml溶解后,用稀醋酸调节pH 值至6.5)-甲醇-乙腈(40:40:20)为流动相;检测波长为254nm。
取对照溶液10μl,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%;精密量取供试品溶液与对照溶液各10μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
供试品溶液的色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的1/5(0.2%),各杂质峰面积的和不得大于对照溶液主峰面积(1.0%)。
水分:取本品,照水分测定法(通则0832第一法)测定,含水分不得过0.5%。
炽灼残渣:取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
重金属:取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
此外,坎地沙坦酯应符合规定的其他各项标准。
坎地沙坦酯片(迪之雅)的说明书

坎地沙坦酯片(迪之雅)的说明书很多子女都在为自己家里的老年人患有心脑血管疾病而烦恼怎么治疗,心脑血管疾病在老年病中是非常常见的一种,而且给老年人的身体健康造成了很大的威胁。
最近推出了一种叫做坎地沙坦酯片(迪之雅)的药物,在治疗心脑血管疾病上有着突出的功效。
【药品名称】通用名称:坎地沙坦酯片商品名称:坎地沙坦酯片(迪之雅)【规格型号】8mg*6s【用法用量】口服,一般成人1日1次,1次4~8mg,必要时可增加剂量至12mg。
【禁忌】1、对本制剂的成分有过敏史的患者。
2、妊娠或可能妊娠的妇女(参照【孕妇及哺乳期妇女用药】项)。
3、严重的肝、肾功能不全或胆汁淤滞患者。
【注意事项】1、慎重用药(对下列患者应慎重用药)(1)有双侧或单侧肾动脉狭窄的患者(见2重要的基本注意事项)。
(2)有高血钾的患者(见2重要的基本注意事项)。
(3)有肝功能障碍的患者(有可能使肝功能恶化。
并且,据推测活性代谢物坎地沙坦的清除率低,因此应从小剂量开始服用,慎重用药,参照【药代动力学】项)。
(4)有严重肾功能障碍的患者(由于过度降压,有可能使肾功能恶化,因此1日1次,从2mg开始服用,慎重用药)。
(5)有药物过敏史的患者。
(6)老年患者(参照【老年患者用药】项)。
(7)肾移植:对于近期做过肾脏移植手术的病人,尚未有本品用药经验。
(8)大动脉和左房室瓣狭窄(阻塞性心肌肥大症):使用其他血管扩张剂的患者,患者血液动力学相关的大动脉或左房室瓣狭窄或者阻塞性心肌肥大症的病人特别慎用。
(9)轻、中度肾上腺皮质激素过多症:轻、中度肾上腺皮质激素过多症患者,对于抑制肾素-血管紧张素-醛固酮系统起作用的降压药物通常没有反应,因此不主张服用本品。
2.重要的基本注意事项(1)有双侧或单侧肾动脉狭窄的患者,服用肾素-血管紧张素-醛固酮系统药物时,由于肾血流和滤过压的降低可能会使肾功能危险性增加,除非被认为治疗必需,应尽量避免服用本药。
(2)由于可能加重高血钾,除非被认为治疗必需,有高血钾的患者,尽量避免服用本药。
坎地沙坦酯氨氯地平片的溶出度测定

坎地沙坦酯氨氯地平片的溶出度测定徐斌;毛柯;吴晓刚;陈宁【摘要】目的建立坎地沙坦酯氨氯地平片中坎地沙坦酯及苯磺酸氨氯地平溶出度测定方法.方法按照《中国药典》2010年版(二部)附录ⅩC第二法(桨法),转速为50 rpm,以1%吐温20水溶液为溶出介质,45 min时,对坎地沙坦酯取样;以0.01 mol·L-1盐酸溶液为溶出介质,转速为50 rpm,30 min时对氨氯地平取样.采用C18色谱柱,流动相为甲醇-乙腈-20 mmol·L-1癸烷磺酸钠溶液[含0.04 mol·L-1磷酸二氢钾(磷酸调 pH 3.5)] (600 :100 :300),检测波长238 nm,流速1.0 mL·min-1.结果坎地沙坦酯在0.562~8.992 μg·mL-1(r=0.9998)浓度范围内呈良好的线性关系,氨氯地平在0.292~4.672 μg·mL-1(r=0.9995)浓度范围内呈良好的线性关系;坎地沙坦酯、苯磺酸氨氯地平的平均回收率为101.0%±0.8%和100.5%±0.9%.溶出度测定结果限度为坎地沙坦酯45 min大于标示量的75%,苯磺酸氨氯地平30 min 大于标示量的80%.结论所建立的方法专属性好,操作简便,可用于坎地沙坦酯氨氯地平片溶出度的检查.【期刊名称】《药学研究》【年(卷),期】2017(036)010【总页数】4页(P585-588)【关键词】坎地沙坦酯;氨氯地平;高效液相色谱法;溶出度【作者】徐斌;毛柯;吴晓刚;陈宁【作者单位】南京工业大学江苏省药物研究所有限公司,江苏南京210009;南京工业大学江苏省药物研究所有限公司,江苏南京210009;南京工业大学江苏省药物研究所有限公司,江苏南京210009;南京工业大学药学院,江苏南京210009;南京工业大学江苏省药物研究所有限公司,江苏南京210009【正文语种】中文【中图分类】R927.2坎地沙坦酯氨氯地平片是由日本武田公司开发的治疗高血压的复方制剂,其主要组分为坎地沙坦酯和苯磺酸氨氯地平,为血管紧张素Ⅱ受体阻滞剂和钙离子拮抗剂的组合,两个主要成分作用机制不同,但临床疗效确切,两药物降压平稳,效果显著,临床耐受性和安全性良好[1-3],该制剂于2010年4月在日本批准上市,商品名为“UNISIA”[4-5]。
坎地沙坦酯主要原辅料及工艺说明

坎地沙坦酯主要原辅料及工艺说明一、主要原辅料二、工艺说明2.1.AM1工艺向反应釜内加入甲醇xxkg,搅拌下加入AM0xxkg,DMFxxg,搅拌溶清后,室温下,缓慢滴加氯化亚砜xxkg。
滴加完毕后将反应液升温至回流,并在回流下保温搅拌xx小时。
反应完全后,浓缩甲醇至大量固体析出,后将反应液降温至5-10℃,并在此温度下保温搅拌1小时,抽滤。
2.2.AM6工艺向洁净干燥的釜内加入甲苯xxkg,AM1(甲酯)xxKg(干重),氯化亚砜xxKg,DMF xxkg。
将反应液用蒸汽升温至xx℃,保温搅拌xx小时,反应结束后,将反应液降温至xx℃。
加入四丁基溴化铵xxkg。
确保温度不高于xx℃,滴加叠氮化钠溶液(xxKg叠氮化钠与xxkg纯化水配制)。
滴加过程中温度保持在xx℃之间。
滴加完毕后,控制温度在xx℃滴加碱液(xxKg氢氧化钠与xxkg纯化水配制)调反应液PH=xx 。
检测控制反应终点(要求无原料点存在)。
萃取分层,合并有机层于干燥反应釜中,加入xxkg无水硫酸钠,将反应液抽滤至反应釜,将反应液缓慢升温至xx℃,在此温度下保温反应至反应液无气体放出为止。
加入叔丁醇xxkg。
将反应液在xx℃下,保温搅拌xx小时。
反应完全后,将反应液降温至室温,加入纯化水xxkg静置分层,收集上层甲苯层于反应釜中,加入xxkg无水硫酸钠,抽滤。
浓缩甲苯至无馏分。
浓缩结束后将反应液降温至xx℃,加入氯仿xxkg,氰基溴联苯xxKg,四丁基溴化铵xxKg,碱液。
xx℃搅拌xx小时。
反应结束后,加入xxkg纯化水,静置分层,收集氯仿层于反应釜中,加入xxkg无水硫酸钠,抽滤备用。
浓缩氯仿至无馏分。
浓缩结束后,将反应液降温至室温,加入甲醇xxkg,盐酸xxkg。
用蒸汽升温至xx℃,保温搅拌xx小时。
反应结束后,将反应液缓慢降温至xx℃。
保温搅拌xx小时。
搅拌结束后,将物料分批抽滤,称重。
将离心出的AM6均匀置于干燥箱内,温度不高于xx℃,烘料。
顶空气相色谱法测定坎地沙坦酯中残留溶剂

顶空气相色谱法测定坎地沙坦酯中残留溶剂摘要:目的建立顶空气相色谱法测定坎地沙坦酯中有机溶剂甲醇、乙醇、二氯甲烷、乙酸乙酯和甲苯含量的方法。
方法以DB-624毛细管柱为分离柱,采用程序升温,检测器为FID。
结果 5个成分的线性关系良好,方法精密度、重复性均符合要求。
结论该方法可用于坎地沙坦酯原料中残留溶剂甲醇、乙醇、二氯甲烷、乙酸乙酯和甲苯的含量测定。
关键词:顶空气相色谱法;坎地沙坦酯;残留溶剂;测定坎地沙坦酯由日本武田公司和瑞典阿斯特拉公司共同研制的产品,于1997年11月首先在瑞典上市,商品名为Atacand[1]。
坎地沙坦酯属于前体药物,可在胃肠道中完全水解而转化成具有抗高压活性的坎地沙坦。
坎地沙坦酯是一种新型的非肽类的血管紧张素Ⅱ受体拮抗剂,可以高选择性与血管紧张素Ⅱ受体结合,用于治疗原发性高血压,具有降压效果强、每天服用一次、耐受性好、生物利用度高、不良反应少等优点,是一种具有良好前景的抗高压药[2-3]。
由于在生产过程中用到甲醇、乙醇、二氯甲烷、乙酸乙酯和甲苯,其中甲醇、二氯甲烷、甲苯均为二类溶剂,需严格控制;为控制药品质量,对残留溶剂进行了测定和控制。
按照《中国药典》[4]中对残留溶剂的要求,甲醇含量不得过0.3%、二氯甲烷含量不得过0.06%、甲苯含量不得过0.089%,乙醇与乙酸乙酯的含量均不得过0.5%。
笔者建立了顶空毛细管气相色谱法同时测定上述5种溶剂在坎地沙坦酯中的残留量,方法灵敏、准确。
1仪器与试药Agilent6890型气相色谱仪,配FID检测器,Agilent7694E顶空进样仪,DB-624毛细管色谱柱。
坎地沙坦酯原料(威海迪素制药有限公司,批号:CA180702W,CA181008W,CA181109W)。
乙醇、二氯甲烷、乙酸乙酯与二甲基亚砜均为分析纯,甲醇、四氢呋喃均为色谱纯。
2方法2.1 色谱条件 DB-624毛细管柱(30m×0.53mm,3μm),进样口温度:200℃,检测器温度:250℃;柱温:40℃,保持8min,以20℃·min-1升温至200℃,保持5min。
坎地沙坦酯杂质
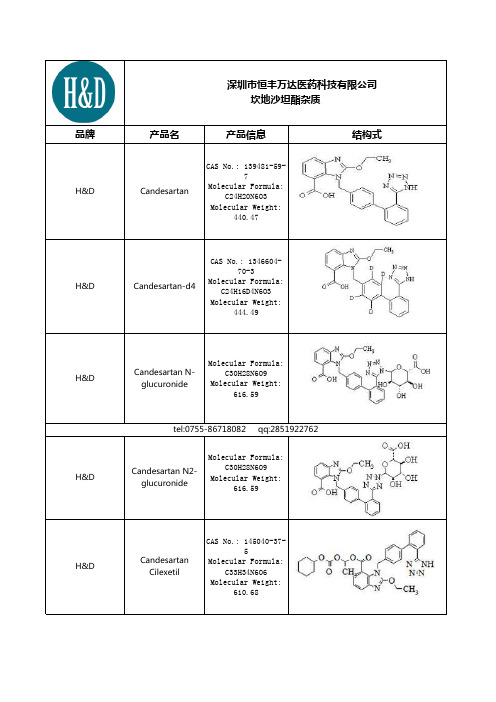
H&D
O-Desethyl Candesartan Cilexetil
达格列净杂质,依帕列净杂质,来那替尼杂质,赛洛多辛杂质,依非韦伦杂质,依匹
,依非韦伦杂质,依匹斯汀杂质
H&D
N-Trityl Candesartan
CAS No.: 139481-724 Molecular Formula: C43H34N6O3 Molecular Weight: 682.79 CAS Number: 869631-11-8 Possible CAS Number: NA Mol. Formula: C31H30N6O6 Appearance: White Solid
H&D
Candesartan Cilexetil
CAS No.: 145040-375 Molecular Formula: C33H34N6O6 Molecular Weight: 610.68
H&D
Desethyl Candesartan Cilexetil
CAS No.: 86963-11-8 Molecular Formula: C31H30N6O6 Molecular Weight: 582.62
H&D
CAS No.: 118525599-5 Candesartan Molecular Formula: C33H34N6O6 Cilexetil Impurity C Molecular Weight: 610.68
H&D
CAS No.: N/A Molecular Formula: Candesartan C33H34N6O6 Cilexetil Impurity D Molecular Weight: 610.68
坎地沙坦酯

坎地沙坦酯 KandishatanzhiCandesartan CilexetilC 33H 34N 6O 6 分子量:610.67本品为(±)-1-[[(环己氧代)羰基]氧代]乙基-2-乙氧基-1-[[2’-(1H-四氮唑基-5-基)联苯基-4-基]甲基]-1H-苯并咪唑-7-羧酸酯。
按干燥品计算,含C 33H 34N 6O 6不得少于98.5%。
【性状】 本品为白色或类白色结晶性粉末。
本品在三氯甲烷中易溶,在无水乙醇中微溶,在水中几乎不溶。
【鉴别】 (1)取有关物质项下的对照溶液作为供试品溶液;另取坎地沙坦酯对照品适量,用乙腈-水(3:2)溶解并稀释制成每1ml 中约含4μg 的溶液作为对照品溶液。
照有关物质项下的色谱条件测定,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱(光谱集1147图)一致。
【检查】 氯化物 取本品0.40g ,加水100ml ,强力振摇10分钟,滤过,取续滤液25ml ,依法检查(中国药典2010年版二部附录ⅧA ),与标准氯化钠溶液5.0ml 制成的对照液比较,不得更深(0.05%)。
有关物质 取本品约20mg ,置50ml 量瓶中,加乙腈-水(3:2)溶解并稀释至刻度,摇匀,作为供试品溶液;精密量取1ml ,置100ml 量瓶中,用乙腈-水(3:2)稀释至刻度,摇匀,作为对照溶液。
照高效液相色谱法(中国药典2010年版二部附录Ⅴ D )测定,用十八烷基硅烷键合硅胶为填充剂;以乙腈-冰醋酸-水(57:1:43)为流动相A ,乙腈-冰醋酸-水(90:1:10)为流动相B ,检测波长为254nm 。
按下表进行线性梯度洗脱。
取供试品溶液20ml ,加0.1mol/L 盐酸溶液1.0ml ,90℃水浴加热10分钟后,加0.1mol/L 氢氧化钠溶液1.0ml 中和,作为系统适用性溶液,取系统适用性溶液10μl 注入液相色谱仪,记录色谱图,杂质Ⅰ{(±)-1-[[(环己氧代)羰基)氧代)乙基-2-氧代-3-[(2′-(1H-四氮唑基-5-基)联苯基-4-基]甲基]-2,3-二氢-1H-苯并咪唑-4-羧酸酯}的相对保留时间约为0.5;理论板数按坎地沙坦酯峰计不低于12000,拖尾因子不得过1.5。
必洛斯坎地沙坦酯片说明书

核准日期:2007年1月29日修改日期:2009年9月21日2015年5月29日2011年2月1日2016年6月7日2012年10月16日2017年4月28日2013年6月27日2020年2月10日2014年6月27日2020年12月14日坎地沙坦酯片说明书请仔细阅读说明书并在医师指导下使用。
1、一旦发现妊娠应当立即停止使用本品。
直接作用于肾素-血管紧张素系统的药物,可能造成发育期胚胎损伤甚至死亡。
2、糖尿病患者在使用本品时,禁止同时服用阿利吉仑,因其可能增加非致命性卒中,肾功能不全、高血钾或低血压的风险。
【药品名称】通用名称:坎地沙坦酯片商品名称:必洛斯英文名称:Candesartan Cilexetil Tablets汉语拼音:Kandishatanzhi Pian【成份】化学名称:(±)-1-(环己氧代羰基氧代)乙基-[2-乙氧基-1-[[2’-(1H-四氮唑基-5)联苯基-4]甲基]-1H-苯并咪唑–7]羧酸酯化学结构式:分子式:C33H34N6O6分子量:610.67辅料为:玉米淀粉,羧甲醚纤维素钙,羟丙基纤维素,聚乙二醇6000,硬脂酸镁,日落黄,乳糖。
【性状】本品为淡粉色片。
【适应症】原发性高血压。
【规格】8mg【用法用量】口服,一般成人1日1次,4~8mg坎地沙坦酯,必要时可增加剂量至16mg。
【不良反应】1. 临床上重要的不良反应(发生率不明):1)血管性水肿:有时出现面部、口唇、舌、咽、喉头等水肿为症状的血管性水肿,应进行仔细的观察,见到异常时,停止用药,并进行适当处理。
2)休克、昏厥和失去意识:降压可能引起休克、昏厥和失去意识。
在这种情况下,应密切观察患者情况。
如观察到畏寒、呕吐、失去意识等,应立即进行适当处理。
使用本药治疗应从较低的剂量开始服用。
如有必要增加剂量,应密切观察患者情况,缓慢进行,特别是正进行血液透析的患者、严格进行限盐疗法的患者、服用利尿药的患者、伴有心衰的患者。
常见农药及制剂中相关杂质列表
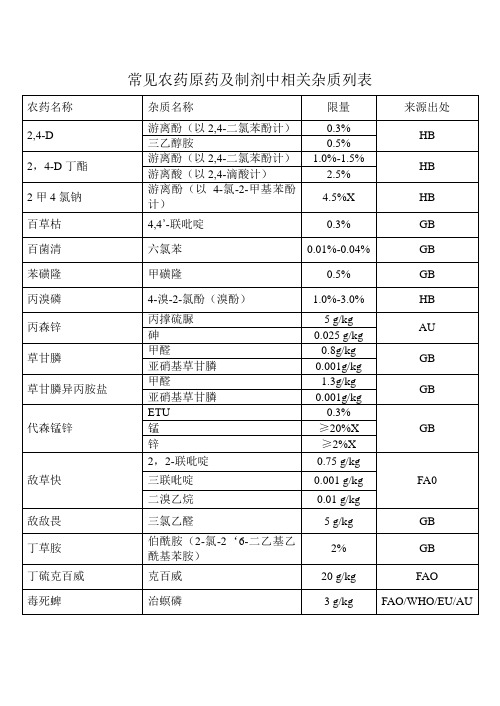
AU
三乙膦酸铝
亚磷酸盐(以亚磷酸铝计)
1%
HB
三唑酮
4-氯酚
5g/kg
HB
速灭威
游离酚(以间甲酚计)
0.1%-1.0%
HB
五氯硝基苯
六氯苯
1.0%-3.03%
HB
辛硫磷
氯化物(以(C2H5O)2PSCl)计
0.5%-1.0%
GB
乙草胺
伯酰胺(2-氯-2’-甲基-6‘-乙基替苯胺)
2%
GB
乙酰甲胺磷
农药名称
杂质名称
限量
GB / HB
多菌灵
HAP(2-氨基-3-羟基吩嗪)
1%
AU
DAP(2,3-二氨基吩嗪)
3%
二甲戊灵
N-亚硝基二甲戊灵
60mg/kg
AU
氟乐灵
N-亚硝基二正丙胺
0.001g/kg
HB
甲草胺
N-(2,6二乙基)-N-氯乙酰胺(伯酰胺)
3%
HB
甲基硫菌灵
HAP(2-氨基-3-羟基吩嗪)
代森锰锌
ETU
0.3%
ห้องสมุดไป่ตู้GB
锰
≥20%X
锌
≥2%X
敌草快
2,2-联吡啶
0.75 g/kg
FA0
三联吡啶
0.001 g/kg
二溴乙烷
0.01 g/kg
敌敌畏
三氯乙醛
5 g/kg
GB
丁草胺
伯酰胺(2-氯-2‘6-二乙基乙酰基苯胺)
2%
GB
丁硫克百威
克百威
20 g/kg
FAO
毒死蜱
治螟磷
3 g/kg
非诺贝特酸杂质种类整理列表
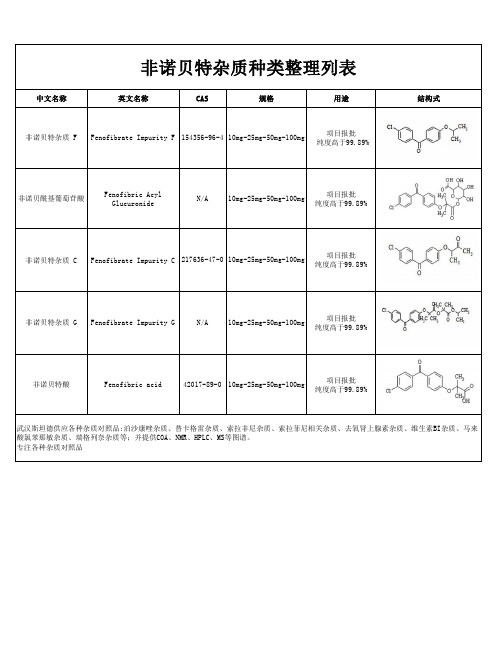
项目报批 纯度高于99.89%
非诺贝特酸
Fenofibric acid
42017-89-0 10mg-25mg-50mg-100mg
项目报批 纯度高于99.89%
武汉斯坦德供应各种杂质对照品:泊沙康唑杂质、替卡格雷杂质、索拉非尼杂质、索拉菲尼相关杂质、去氧肾上腺素杂质、维生素BI杂质、马来 酸氯苯那敏杂质、瑞格列奈杂质等;并提供COA、NMR、HPLC、MS等图谱。 专注各种杂质对照品
项目报批 纯度高于99.89%
结构式
非诺贝特杂质 C
Fenofibrate Impurity C 217636-47-0 10mg-25mg-50mg-100mg
项目报批 纯度高于99.89%
非诺贝特杂质 G Fenofibrate Impurity G
N/A
10mg-25mg-50mg-100mg
中文名称
非诺贝特杂质种类整理列表
英文名称
CAS
规格
用途
非诺贝特rity F 154356-96-4 10mg-25mg-50mg-100mg
项目报批 纯度高于99.89%
非诺贝酰基葡萄苷酸
Fenofibric Acyl Glucuronide
N/A
10mg-25mg-50mg-100mg
坎地沙坦酯结构

坎地沙坦酯结构坎地沙坦酯,化学式C24H29N5O3,是一种抗高血压药物,属于安格Ⅱ受体拮抗剂。
其分子结构中包含了苯环、异噻吩环和咪唑环等多个结构单元,这些结构单元的有机化学特点对于坎地沙坦酯的药理活性具有重要影响。
本文将对坎地沙坦酯的结构进行探讨,从分子构象、官能团位置等方面剖析其药理效应的机制。
一、坎地沙坦酯分子结构分析坎地沙坦酯(Candesartan Cilexetil)的化学式为C24H29N5O3,其分子量为440.52g/mol。
从化学结构上看,坎地沙坦酯包含一个苯环、一个异噻吩环和一个咪唑环,它们通过杂原子(氮和硫)与共有一个架桥氧原子进行连接形成分子结构。
二、分子构象研究坎地沙坦酯由于存在多个手性中心,因此可以存在多个立体异构体。
根据文献报道,坎地沙坦酯主要存在两个立体异构体:S-坎地沙坦酯和R-坎地沙坦酯。
它们的立体构型如下图所示:这两个异构体在体内的代谢过程中可以互相转化,但S-坎地沙坦酯的活性更强。
研究表明,S-坎地沙坦酯的体内清除速率比R-坎地沙坦酯更慢,因此其药效更持久。
三、官能团位置分析坎地沙坦酯分子中存在多个官能团,其中最重要的是酯基(Cilexetil)和咪唑基团。
酯基的存在使得坎地沙坦酯可以通过经口给药的方式进行服用,通过体内酯酶的作用,酯基被水解为酸性物质,即S-坎地沙坦。
而咪唑基团则是坎地沙坦酯与受体结合的关键部分,它能与受体的特定区域发生相互作用,从而抑制安格Ⅱ的活性。
四、药理活性机制坎地沙坦酯是一种安格Ⅱ受体拮抗剂,在体内主要通过抑制安格Ⅱ的活性来达到降低血压的效果。
其作用机制可以分为以下几个方面:1. 选择性与亲和性:坎地沙坦酯对于AT1受体具有高选择性和亲和力。
AT1受体属于安格Ⅱ受体家族的一种,对调节血管紧张素转化酶的活性和肾素-血管紧张素系统具有重要作用。
坎地沙坦酯在体内能够与AT1受体结合,从而阻断安格Ⅱ对该受体的结合,实现对安格Ⅱ效应的抑制。
HPLC测定坎地沙坦酯分散片的含量

HPLC测定坎地沙坦酯分散片的含量曹春英;张悫【摘要】目的:建立测定坎地沙坦酯分散片含量的高效液相色谱法.方法:色谱柱为Symmetry C18(416mm×150 mm,5μm);流动相:乙腈-水-磷酸-三乙胺(700∶300∶0.3∶0.3),检测波长:254 nm,流速:1.0 ml/min.结果:坎地沙坦酯在1.0625~10.500 0μg/ml范围内呈良好的线性关系(r=0.999 9),平均回收率为100.1%(n=5),RSD为0.24%.结论:本法简便、快速、准确,适应于坎地沙坦酯分散片的含量测定.%Objective: To establish a method to determine the content of Candesartan cilexetil dispersible Tablets by HPLC. Methods: The chromatographic column was symmetry C18 (4.6 mm×150 mm, 5 μm), the mobile phase was acetonitrile, water, phosphonc acid and triethylamine (700∶300∶0.3∶0.3) with the flow rate of 1.0 ml/min. The UV detection wavelength was 254 nm. Results: The linear range of concentration of Candesartan cilexetil was 1.062 5-10.500 0 μg/m l. The average recovery was 100.1% with a RSD of 0.24%. Conclusion: The method is simple, fast and accurate. It is suitable for content determination of Candesartan cilexetil dispersible Tablets.【期刊名称】《中国医药导报》【年(卷),期】2011(008)001【总页数】2页(P55-56)【关键词】HPLC;坎地沙坦酯分散片;坎地沙坦酯;含量测定【作者】曹春英;张悫【作者单位】沈阳广播电视大学,辽宁,沈阳,110003;沈阳广播电视大学,辽宁,沈阳,110003【正文语种】中文【中图分类】R917坎地沙坦酯(candesartan cilexetil)是一种新型血管紧张素Ⅱ受体亚型AT1 拮抗剂。
坎地沙坦酯氨氯地平片中降解产物的研究

坎地沙坦酯氨氯地平片中降解产物的研究靳茂礼;姚振江;申磊;董珊红【摘要】目的确定坎地沙坦酯氨氯地平片中降解产物的来源.方法采用2种不同色谱条件的高效液相色谱法(HPLC)和液相色谱-质谱/质谱(LC-MS/MS)分析方法确定坎地沙坦酯氨氯地平片中降解产物与坎地沙坦酯片中有关物质的关系.结果 3种方法的结果显示,坎地沙坦酯氨氯地平片中的降解产物和坎地沙坦酯片中的有关物质一致.结论坎地沙坦酯氨氯地平片中的5个降解产物分别与坎地沙坦酯有关物质Ⅱ,Ⅲ,Ⅳ,Ⅴ,Ⅵ相对应.【期刊名称】《中国药业》【年(卷),期】2014(023)003【总页数】2页(P29-30)【关键词】坎地沙坦酯氨氯地平片;降解产物;保留时间;质谱分析【作者】靳茂礼;姚振江;申磊;董珊红【作者单位】河北省石家庄市食品药品检验所,河北石家庄 050031;石药集团中诺药业<石家庄>有限公司,河北石家庄050091;石药集团中诺药业<石家庄>有限公司,河北石家庄050091;石药集团中诺药业<石家庄>有限公司,河北石家庄050091【正文语种】中文【中图分类】R972+.4;R927.11坎地沙坦酯氨氯地平片是由坎地沙坦酯和苯磺酸氨氯地平组成的复方制剂,为血管紧张素Ⅱ受体阻滞剂和钙离子拮抗剂的组合,虽然2个主要成分作用机制不同,但临床疗效确切、降压平稳,临床耐受性和安全性良好。
本试验中采用坎地沙坦酯片国家药品标准中有关物质的检测方法[1]测定了坎地沙坦酯氨氯地平片的降解产物,采用液相色谱-质谱/质谱(LC-MS/MS)分析3种分析方法,测定降解产物峰面积与坎地沙坦酯峰面积的比值、降解产物的保留时间,确定了坎地沙坦酯氨氯地平片降解产物的来源。
现报道如下。
1 仪器与试药戴安U3000型高效液相色谱仪;LC-MS联用系统;梅特勒AE-240型分析天平。
坎地沙坦酯氨氯地平片(日本武田药品工业株式会社,批号为0007,规格为每片8mg∶5mg);乙腈为色谱纯,磷酸、醋酸等为分析纯。
