有机化学必背方程式
常考有机化学方程式

常考有机化学方程式work Information Technology Company.2020YEAR有机化学方程式大全1. 甲烷与氯气 CH 4+Cl 2CH 3Cl+HCl CH 3Cl+Cl 2CH 2Cl 2+HCl CH 2Cl 2+Cl 2CHCl 3+HCl CHCl 3+Cl 2CCl 4+HCl2. 乙烯实验室制法(浓硫酸作催化剂,脱水剂) CH 3CH 2OH H 2O + CH 2=CH 2 ↑3. 乙烯通入溴水中 CH 2=CH 2 + Br 2 CH 2BrCH 2Br4.乙烯和HBr 的反应 CH 2=CH 2 + HBr 催化剂 CH 3CH 2Br 5. 乙烯水化制乙醇 CH 2=CH 2 + H 2O CH 3CH 2OH6. 制取聚乙烯、聚丙烯 n CH 2=CH 2 催化剂n CH 3–CH=CH 2 催化剂CH 37. 乙炔的制取 CaC 2 + 2H 2O Ca(OH)2 + ↑ 8. 由乙炔制聚氯乙烯 + HCl H 2C=CHCl n H 2C=CHCl催化剂9. 苯与液溴反应(需铁作催化剂)+ Br 2 +HBr10. 苯的硝化反应+ HNO 3 + H 2O11. 苯与氢气加成生成环己烷+ 3H 2 催化剂△12. 甲苯发生硝化反应CH 2-CH 2 nBrFe浓H 2SO 4 55-60℃ —NO 2CH 3 ––NO 2O 2N –– CH 3|催化剂 △ HC ≡CHHC ≡CH CH -CH 2 n ClCH -CH 2n+3HONO 2 浓硫酸 △ + 3H 2O 13. 溴乙烷水解 CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr14. 溴乙烷消去反应CH 3CH 2Br +NaOH CH 2=CH 2 + NaBr + H 2O 15. 乙醇与钠反应 2CH 3CH 2OH + 2Na2CH 3CH 2ONa + H 2↑ 16. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O17.乙醇脱水(分子间、分子内)CH 3CH 2OH H 2O + CH 2=CH 2 ↑2CH 3CH 2OH H 2O + CH 3CH 2O CH 2 CH 318. 苯酚与氢氧化钠溶液反应+ NaOH + H 2O19. 苯酚钠溶液中通入二氧化碳+ CO 2 + H 2O + NaHCO 320. 苯酚的定性检验定量测定方法:+ 3Br 2 ↓ + 3HBr 21. 丙醛制1-丙醇 CH 3CH 2CHO + H 2催化剂△ CH 3CH 2CH 2OH 22. 乙醛制乙酸2CH 3CHO + O 2 催化剂△ 2CH 3COOH23. 乙醛的银镜反应CH 3CHO + 2Ag(NH 3)2OH H 2O + 2Ag↓+ 3NH 3 + CH 3COONH 4甲醛的银镜反应 HCHO + 4Ag(NH 3)2OH2H 2O + 4Ag↓+6NH 3 +(NH 4)2CO 3 24. 乙醛与新制氢氧化铜悬浊液CH 3CHO + 2Cu(OH)2 Cu 2O ↓+ 2H 2O + CH 3COOHH 2O Cu △ —OH —ONa —ONa—OH ––Br |BrBr –– OH |OH |醇 △浓H 2SO 4 140℃25. 乙酸与氢氧化铜悬浊液2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O26. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH 3COOH + CH 3CH 2OH CH 3COOC 2H 5 + H 2O27. 葡萄糖与银氨溶液 CH 2OH (CHOH )4 CHO +2Ag(NH 3)2OH H 2O + 2Ag↓+ 3NH 3 + CH 2OH (CHOH )4 COO NH 428. 蔗糖水解方程式C 12H 22O 11 + H 2O 催化剂C 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖29. 麦芽糖水解方程式C 12H 22O 11 + H 2O 催化剂2C 6H 12O 6麦芽糖 葡萄糖30. 淀粉水解(C 6H 10O 5)n + nH 2O 催化剂nC 6H 12O 6淀粉 葡萄糖31. 硬脂酸甘油酯皂化反应+3NaOH3 C 17H 35COONa +浓硫酸△ CH 2–OH | CH –OH | CH 2–OH C 17H 35COO─CH 2C 17H 35COO─CH C 17H 35COO─C。
有机化学重要方程式汇总

有机化学重要方程式汇总1.CH4与Cl2光照2.实验室制CH2=CH23.CH2=CH2与H2O催化加成4.CH2=CH2与HCl催化加成5.CH2=CH2催化氧化制CH3CHO6.氯乙烯制聚氯乙烯7.苯乙烯加聚8.1,3—丁二烯与Br2水加成(三种情况)9.合成天然橡胶(聚2—甲基—1,3—丁二烯)10.实验室制CH≡CH11.CH≡CH与H2O催化加成(1︰1)12.CH≡CH与HBr催化加成(1︰1、1︰2)13.CH3C≡CH与HCl催化加成(1︰2 两种情况)14.苯制溴苯15.苯制硝基苯16.甲苯与液Br2取代(Fe催化、光照两种情况)17.甲苯与浓HNO3加热18.对二甲苯与足量Cl2催化加成19.丁烷催化裂化20.CH3CH2Br水解21.CH3CH2Br消去22.2,3—二溴丁烷消去23.CH3CH2OH与Na反应24.CH3CH2ONa溶于水25.CH3CH2OH分子间脱水26.CH3CH2OH催化氧化27.CH3CH2OH与HBr共热28.CH3CH(OH)CH2OH与Na反应29.CH3CH(OH)CH2OH分子间脱水成环30.CH3CH(OH)CH2OH催化氧化31.C6H5OH与Na反应32.C6H5OH与NaOH溶液33.C6H5OH与Na2CO3溶液反应34.C6H5ONa溶于水35.CO2通入C6H5ONa溶液36.C6H5OH与浓Br2水37.CH3CHO催化氧化38.CH3CHO的银镜反应39.CH3CHO与新制Cu(OH)2悬浊液40.HCHO的银镜反应41.HCHO与新制Cu(OH)2悬浊液42.OHCCHO的银镜反应43.OHCCHO与新制Cu(OH)2悬浊液44.CH3COOH与NaHCO3溶液45.HCOOH溶解鸡蛋壳46.CH3COOH与CH3CH2OH酯化47.HNO3与CH3CH2OH酯化48.CH3COOCH2CH3与NaOH溶液49.HCOOH与HOCH2CH2OH酯化(2︰1)50.乙二酸与乙二醇酯化:(1)1︰1成链(2)2︰1成链(3)1︰2成链(4)1︰1成环(5)成聚酯51.乳酸(1)两分子酯化成链(2)两分子酯化成环(3)缩聚成聚酯52.硬脂酸甘油酯的皂化反应53.蔗糖水解54.麦芽糖水解55.葡萄糖无氧呼吸56.葡萄糖的银镜反应57.葡萄糖与足量乙酸酯化58.纤维素与浓硝酸酯化59.丙氨酸与HCl60.谷氨酸与足量NaOH61.甘氨酸(1)两分子缩合成链(2)两分子缩合成环(3)缩聚成多肽62.H2NCH2CH2CH2COOH分子内缩合。
高中有机化学方程式汇总(全)(已免费)

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂催化剂 催化剂△ 催化剂催化剂浓硫酸△ △CH 3 NO 2O 2N CH 3催化剂△高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2O24. + 3H 2催化剂NaOH H 2O 醇△ 催化剂 △ 浓硫酸 170℃ 浓硫酸140℃OH Br Br OH 催化剂 △ 催化剂△△ △ 浓硫酸△ Br25. +3HO -NO 2 +3H 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2O O OC — CO OCH2-CH249. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O6 (s)+ 6O2 (g)6CO2 (g)+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式大全

Ca催化催催化催化催催催高中有机化学方程式大全1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n 13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n催化催催化14. 2CH2 = CH2 + O2 2CH3CHO15. CH≡CH + Br2 CHBr = CHBr16. CHBr = CHBr+ Br2 CHBr2-CHBr217. CH≡CH + HCl H2C = CHCl18. nCH2 = CH [ CH2-CH ] nCl Cl19. CH≡CH + H2O CH3CHO20. CaC2 + 2H2O CH≡CH↑+ Ca(OH)2-2 +H2O-SO33H+H2O225. +3HO-NO22ONaOH醇催化浓硫浓硫BrOH催化催化26. 3CH≡27. CH3CH2Br + H2O CH3CH2OH + HBr28. CH3CH2Br + NaOH CH3CH2OH + NaBr29. CH3CH2Br+ NaOH CH2 = CH2 + NaBr +H2O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O+C2H5OH C2H5OC2H5+H2O34. OH+NaOH ONa+H2O2O O-+H3O+233738. CH3CHO + H2 CH3CH2OH△△催催催39. 2CH 3CHO + O 2 2CH 3COOH40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ +Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 33COO)2Cu + 2H 2O+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖催催化催化+浓硫+ 2H OOC —O OCH-53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH2 57. C17H35COO-CH2 CH2-OH C17H35COO-CH +3NaOH 3C17H35COONa+ CH-OHC17H35COO-CH2 CH2-OH 58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光HClClCHClClCH+−→−+2223光2.4.5.6.7.8.222Br CH CH CH CH +=-=9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+ O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式总结(默写版)

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。
有机化学方程式大全

光照 光照 光照 光照高温 CaO △ 催化剂加热、加压 催化剂催化剂△ 催化剂 △ 催化剂 催化剂 催化剂催化剂 △ 催化剂催化剂 浓硫酸 △ △高中有机化学方程式大全1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2 + H 2 CH 3—CH 312. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n14. 2CH 2 = CH 2 + O 2 2CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)221. + Br 2 Br + HBr22. + HO -NO 2 NO 2 +H 2O23. + HO -SO 3H SO 3H+H 2OCH 3 NO 2NO 2 O 2N CH 3催化剂 NaOH H 2O醇 △ 催化剂△ 浓硫酸170℃ 浓硫酸140℃OH Br Br OH催化剂 △ 催化剂△ △△ Br 催化剂 △ 24.+ 3H 2 25. +3HO -NO 2 +3H 2O26. 3CH ≡C H → 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O34. OH+NaOH ONa+H 2O35. OH+H 2O O -+H 3O +36. ONa+H 2O+CO 2 OH+ NaHCO 337. +3Br 2 ↓ +3HBr38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O浓硫酸 △催化剂 催化剂 催化剂 催化剂 催化剂 △ 催化剂 加热、加压 + 浓硫酸 △ + 2H 2OO O C — CO O CH 2-CH 246. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH49. nOHCH 2CH 2COO H → [ OCH 2CH 2C ] n +H 2O50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l)51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖53. C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6淀粉 葡萄糖55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6纤维素 葡萄糖56.C 17H 33COO-CH 2 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 257. C 17H 35COO-CH 2 CH 2-OHC 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OHC 17H 35COO-CH 2 CH 2-OH58. CH 2OH COOH CH 2OH COOH1.HCl ClCH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8. 222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
有机化学方程式(70个)

有机化学基础反应方程式汇总 1.甲烷(烷烃通式:C n H 2n +2) 甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 点燃2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+ClCH 3CH 2Cl 2CHCl 3(32.乙烯((1(2(3CH 3CH CH 3CH n CH 2=3.乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br =CHBr CHBr =CHBr+Br 2—CHBr 2与氢气加成:HC ≡CH+H 2催化剂H 2C =CH2图3乙炔的制取与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH2=CHCl催化剂[CH2—]n乙炔加聚,得到聚乙炔:n HC≡CH催化剂[CH=CH]n4.1,3-丁二烯与溴完全加成:CH2=CH-CH=CH2+2Br2Br-CHBr-CHBr-CH2Br与溴1,2-加成:CH2=CH-CH=CH2+Br2Br-CHBr-CH=CH2与溴5.苯(1(2(制溴苯)+HO—苯硝化反应生成硝基苯,它是一种带有苦杏仁味、无色油状液体,有毒。
+HO—(3)加成反应(环己烷)6.甲苯(1(2)取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、开矿等。
注意:甲苯在光照条件下发生侧链的取代,而在催化剂条件下发生苯环上的取代。
CH3CH3BrCH3Br+Br2Fe(或 )+HBr(本反应用纯溴,催化剂时苯环上取代)CH3|+3HNO 浓硫酸O2N—CH3|—NO2|NO2+3H2O3。
高中有机化学方程式汇总

高中有机化学方程式汇总一、取代反应1、CH 4 + Cl 2 HCl + CH 3Cl ( 气态) 一氯甲烷CH 3Cl + Cl 2HCl + CH 2Cl2 ( 液态 ) 二氯甲烷CH 2Cl + Cl 2HCl + CHCl 3 ( 液态 ) 三氯甲烷或氯仿 CHCl 3+ Cl 2HCl +CCl 4 ( 液态 )四氯甲烷或四氯化碳 2、C 2H 6 + Cl 2 HCl + CH 3CH 2Cl3 + Br 2Br + HBr (真正催化剂是FeBr3)3 + Cl 22Cl + HCl3 + 3Cl 2 + 3HCl4 + HONO 2 2 + H 2O+ HOSO 3H 3H + H 2O5 + 3Br 2 + 3HBr+ 3HONO 2 + H 2O6、C 2H 5OH + HBr C 2H 5Br + H 2O C 2H 5Br C 2H 5OH + HBrC 2H 5Br CH 2 CH 2 + HBr7、CH 3COOC 2H 5 + H 2O CH 3COOH + C 2H 5 OH光照光照光照 光照光照Fe 光照无水AlCl 3Cl LNaOHH 2O NaOHC 2H 5OHBr L3H 2SO 4浓50-60℃2NO NO 2 LH 2SO 4浓50-60℃ H 2SO 4浓70-80℃ 无机酸或碱8、 + 3 NaOH + 3C 17H 35 COONa二、加成反应1、CH 2 CH 2 + H 2CH 3 CH 32、CH 2 CH 2 + HCl CH 3 CH 2Cl3、CH 3CH CH 2+ HClCH 3 CHClCH3(马氏加成)CH 3 CHCH 2 + HCl CH 3 CH 2 CH 2Cl (反马氏加成)4、CH CH + H 2 CH 2 CH 2 CH CH + 2 H 2 CH 3 CH 35、CH CH + 2HCl CH 3 CHCl 26、CH 3 CHO + 2 H 2 CH 3 CH 2OH 7+ 3 H 2 + H 2 CH 3 CH 2 CH 3+ H 2 CH 3 CH 2 CH 2 CH 3 ㊣ Pt 比Ni 催化效率高 8+ 3Cl 2 C 6H 6 Cl 69、 CH 2 CH 2 + H 2O CH 3 CH 2OHCH CH + H 2O 2CH 2 CH 2 + O 22 1、CH3 CH 2OH CH 2 2 + H 2O2、2CH 3 CH 2OH+ H 2O (分子间脱水) 3、C 2H 5 Cl CH 2 CH 2 + H ClOOOCH 2 O C C 17H 35 CH O C C 17H 35 CH 2 O C 17H 35CH 2CH OH CH 2 无水AlCl 3/HgCl 2/ZnCl 2150-160℃ 无过氧酸有过氧酸如CH 3COOOH 催化剂加热 HHC CH Cl +--+ H Cl无水AlCl 3 H 2SO 4 或 H 3PO 4 加热 加压HgSO 4(H +)OCH 3 C H高温、高压PdCl 2 或CuCl 2OCH 3 C H三、消去反应H 2SO 4浓170℃ H 2SO 4浓 140℃CH 3 CH 2 O CH 2 CH 3 NaOH C 2H 5OH四、酯化反应 (酯化反应也是取代反应)1、CH 3 COOH + CH 3 CH 2OH CH 3 COOCH 2 CH 3 + H 2O2、 + 3HONO 2+ H 2O3、[C 6H 7 O 2(OH) 3 ]n + 3n HONO 2 [C 6H 7 O 2(NO 2) 3 ]n + 3nH 2O 五、水解反应(卤代烃、酯、油脂的水解见上,也是取代反应)1、CH 3 COONa + H 2O 3 COOH + NaOH2、C 17H 35 COONa + H 2 C 17H 35 COOH + NaOH3、(C 6H 10O 5)n + nH 2O n C 6H 12O 64、C 12H 22O11 + H 2OC 6H 12O 6 + C 6H 12O 6C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖5、CH 3 COOCH 2 CH 3 + H 2O CH 3 COOH + CH 3 CH 2OH六、氧化反应①被强氧化剂氧化 1、2 CH 3 CH 2OH + O 2 2 + H 2O 2、2 + O 2 2 CH 3 COOH 3、2 CH 2 CH 2 + O 2 2 ②被弱氧化剂缓慢氧化1、CH 3 CHO + 2[Ag(NH 3)2] OH CH 3 COOH + 4 NH 3 + 2Ag + H 2O2、CH 3 CHO + 2 Cu(OH)2 CH 3 COOH + 2 Cu 2O + H 2O3、CH 2 OH(CHOH)4 CHO + 2[Ag(NH 3)2] OH CH 2 OH(CHOH)4 COOH + 4 NH 3 + 2Ag + H 2O4、CH 2 OH(CHOH)4 CHO +2 Cu(OH)2 OH(CHOH)4 COOH + 2 Cu 2O + H 2O5、HCOOH + 2[Ag(NH 3)2] OH CO 2 + 4 NH 3 + 2Ag + H 2OH 2SO 4浓 加热CH 2 OH CH OHCH 2 OHCH 2 O NO 2 CH O NO 2 CH 2 O NO 2 H 2SO 4浓 H 2SO 4浓H 2SO 4稀加热淀粉/纤维素 葡萄糖H 2SO 4稀加热蔗糖 葡萄糖 果糖H 2SO 4稀加热无机酸 或碱Cu 或Ag OCH3 C H OCH 3 C H Mn(AC)2 Mn(AC)2 OCH 3 C H 水浴加热 水浴加热 水浴加热6、HCOOH + 2 Cu(OH)2CO 2 + 2 Cu 2O + 2H 2O③有化合机物的燃烧 C x H y + (x+y /4) O 2xCO 2 + y /4 H 2O七、还原反应1、+ H 22、 + H 2 CH 3 CH 2OH3、 八、加聚反应1、n CH 2 CH 22、n CH CH3、 九、缩聚反应1、n+ nH 2O2、+ nH 2O 1、CH 4 C + 2H 2 C 16H 34 C 8H 16 + C 8H 18C 8H 18 C 4H 8 + C 4H 10 C 8H 16 CH 4 + C 7H 12十一、其它有机反应12 + H 2O 3 2、2CH 3 CH 2OH + 2Na 2CH 3 CH 2O Na + H 2 3、OH + 2Na 24、C 12H 22O 11 12C + 11 H 2O C + 2H 2SO 4(浓) CO 2 +2 SO 2 + 2H 2O5、氨基酸的两性点燃 O CH 3 C CH 3 CH 3 C CH 3 OCH 3 C H 2 CH 2 + H 2 2 CH 3nCH 2 CH CH 2 CH 2催化剂[ CH 2 CH CH 2 CH 2]nH N CH 2 C OH H O [N CH 2 C ]n H O催化剂COOH + nHO CH 2 CH 2 OH 催化剂O O CH 2 CH 2 O C C]n [ O 十、裂化反应高温 高温 高温 高温 H 2SO 4浓 + HClCH 2 COOH NH 2 CH 2 COOHNH 3Cl+ NaOHCH 2 COOH NH 2CH 2 COONa + NH 2H 2O。
有机化学基础方程式归纳

有机化学基础方程式归纳一、烷烃(1)氧化反应:CH 4 + 2O 2CO 2 + 2H 2O 燃烧的通式:C n H2n+2 + O 2 nCO 2+ (n+1)H 2O (2)取代反应:CH 4 + Cl 2 CH 3Cl + HCl CH 3Cl + Cl 2CH 2Cl 2+ HClCH 2Cl 2+ Cl 2 CHCl 3+ HClCHCl 3 + Cl 2 CCl 4+ HCl(3)受热分解: CH 4 ==== C + 2H 2(4)实验室制法:CH 3Na 2CO 3 + CH 4二、烯烃(1)氧化反应:CH 2=CH 2 + 2O 2 2CO 2 + 2H 2O 2CH 2=CH 2 + O 2 2 燃烧的通式:C n H 2n + O 2 n CO 2 + n H 2O (2)加成:CH 2=CH 2 + X 2 CH 2X-CH 2XCH 2=CH 2CH 3-CH 2XCH 2=CH 2 + H 2CH 3-CH 3CH 2=CH 2 + H 2CH 3-CH 2OH (3)加聚:n CH 2=CH(4)实验室制法:CH 3CH 2OH CH 2=CH 2 + H 2O 三、乙炔(1)氧化反应:2 + 5O 2 4CO 2 +2 H 2O 燃烧的通式:C n H 2n-2 + O 2 n CO 2 + (n-1)H 20 (2)加成: + H CH 2=CH 2 + 2H 23-CH 3CH 2=CHCl3n+1 2光 光 光 受热 3n-1 23n 2光 [CH 2-CH 2] n CH CH 点燃 ====点燃 ==== 点燃 ==== 点燃 ==== 点燃 ==== 点燃 ==== CH CHCH CH CH CH 浓H 2SO 4 170℃催化剂 CH 3-C-HO+ X2CHX=CHX+ 2H2O(3)实验室制法:CaC2 + 2H2O Ca(OH)2 +四、1、3-丁二烯(1)加成:CH2=CH-CH=CH2 + Br2CH2Br-CHBr-CH=CH2CH2=CH-CH=CH2 + Br2CH2Br-CH=CH-CH2BrCH2=CH-CH=CH2 + 2Br2CH2Br-CHBr-CHBr-CH2Br(2)加聚:n CH2=CH-CH=CH五、苯和苯的同系物(1)氧化反应:+ 15O212CO2 + 6H2O燃烧的通式:C n H2n-6 + O2n CO2 + (n-3)H2O(2)取代反应:+ Br2 + HBr+ HO-NO2+ H2O+ 3HO-NO2+ 3H2O+ HO-SO3+ H2O(3+ 3H2+ 3H2+ 3Cl2六、卤代烃(1)水解反应:CH3CH2CH3CH2OH + NaBrR-OH + NaX(2)消去反应:CH3CH2Br + NaOH CH2=CH2 + NaBr + H2O+ NaX + H2OCH CHCH CHFeBr32-CH=CH-CH2]n点燃====点燃====3n-32浓H2SO450~60℃2370~80℃浓H2SO4100℃CH32ON-CH3-NO2NO2CH3CH3ClClClClCl紫外线R2R3R1 C C R4R2R3R1 C C R4CH CH催化剂CH3-C-HO七、醇(1)与活泼金属:2Na + 2CH 3CH 2OH 2CH 3CH 2ONa + H 22C n H 2n+1OH + 2Na 2C n H 2n+1ONa + H 2 (2)①氧化反应:CH 3CH 2OH + 3O 2 2CO 2 + 3H 2O燃烧的通式:2C n H 2n+1OH + 3nO 22nCO 2 + (2n+2)H 2O②催化氧化:2CH 3CH 2OH + O 2 + 2H 2O2R-CH 2-OH + O 22+ 2H 20 + O 2 2 + + 2H 20 (3)消去反应:CH 3CH 2OHCH 2=CH 2 + H 2O + H 2O (4)酯化反应:CH 3CH 2OH + + H 2O R′-OH + + H 2O+ 3HO-NO 2 + 3H 2O (5)与HX 反应:CH 3CH 2CH 3CH 2X + H 2OR-X + H 2O(6)分子间脱水:CH 3CH 2OH + CH 3CH 2OH CH 3CH 2OCH 2CH 3 + H 2O R 1-OH + R 2R 1-O-R 2 + H 2O(7)制备:CH 2=CH 2 + H 2CH 3-CH 2OH 八、酚(1)弱酸性: H + + ①与NaOH 溶液的反应:+ NaOH + H 2O 点燃 ==== 点燃 ==== CH 3-C-H O 浓H 2SO 4 170℃R 2 R 3R 1 C C R H OH R 2 R 3 R 1 C C R 4 CH 3-C-OH O CH 3-C-O-CH 2-CH 3 OR-C-O-H O R-C-O-R ′ O 浓H 2SO 4 140℃R-C-H O2 2R 1-CH-OH R 1-C-R 2 O 2-OH CH 2-OH CH-OH CH 2-ONO 2CH 2-ONO 2CH-ONO 2催化剂 -OH-O --OH -ONa②与Na 反应:2 + 2Na 2 + H 2 ③苯酚的制备(强酸制弱酸):+ H 2O + CO 2 + NaHCO 3 + HCl+ NaCl (2)取代反应:①苯酚的溴化反应:+ 3Br 2+ 3HBr ②硝化反应: + 3HO-NO 2(浓+ 3H 2O (3)加成反应:+ 3H 2(4)缩聚反应:n + n+ nH 2O (5)显色反应:苯酚遇FeCl 3溶液显紫色九、醛:(1)加成反应: + H CH 3-CH 2-OH + H 2CH 3OH + H 2 R-CH 2-OH(2)氧化反应:①与O 2反应:Ⅰ、燃烧: + 5O 2 4CO 2 + 4H 2O + O 2 CO 2 + H 2O Ⅱ、催化氧化:-OH -ONa -ONa -OH-ONa -OH -OH O 2N -OH -NO 2 NO 2-OH Br- OH-Br -OH OH -OH O nCH 2 OH [ ] OCH 3-C -H OCH 3-C -H 点燃 ==== O H -C -H O R -C -H OH -C -H 点燃 ====2 + O 222+ O2 2+ O CO 2 + H 2O 2 + O 2②与弱氧化剂反应:Ⅰ、银镜反应: + 2Ag(NH 3)2OH+2Ag +3NH 3+H 2O + 4Ag(NH 3)2OH (NH 4)2CO 3 + 4Ag + 6NH 3 + 2H 2O + 2Ag(NH 3)2OH +2Ag +3NH 3+H 2OⅡ、与新制Cu(OH)2反应: + 2Cu(OH) + Cu 2O + H 2O + 4Cu(OH)2O + CO 2 + 5H 2O + 2Cu(OH)2 + Cu 2O + H 2O (3)缩聚反应: n + n + nH 2O 十、羧酸(1)酸性:CH 3COOH CH 3COO - + H +(2)酯化反应:CH 3CH 2OH ++ H 2O (3)缩聚反应:n 十一、酯(1)水解反应:2O 3C 17H 35COOH + OCH 3-C -OH O CH 3-C -H O R -C -H O CH 3-C -H OCH 3-C -ONH 4 O CH 3-C -H O3-C -OH O H -C -H OH -C -OH OR -C -OH OH -C -H OH -C -H O R -C -H OR -C -ONH 4OH -C -H OR -C -HO -C -OH -OH O H -C -nCH 2 OH[ ] CH 3-C-OH O CH 3-C-O-CH 2-CH 3 O--OH O HO -C - O + nHO -CH 2CH 2-OH --O --O O-CH 2CH 2-O - 〔 〕n + 2nH 2O 1735CH C H -COO -CH脂肪酶 CH 2-OH CH -OHCH 2-OH3C 17H 35COONa + (2)加成反应:+ 3H 十二、糖类(1)氧化反应:①燃烧:C 6H 12O 6 (s)+ 6O 2(g) 6CO 2(g) + 6H 2O(l)②被银氨溶液或新制Cu(OH)2氧化:CH 2OH(CHOH)4CHO + 2Ag(NH 3)22OH(CHOH)4COONH 4 + 2Ag + 3NH 3 + H 2OCH 2OH(CHOH)4CHO + 2Cu(OH)2CH 2OH(CHOH)4COOH + Cu 2O + 2H 2O (2)加成反应:CH 2OH(CHOH)4CHO + H CH 2OH(CHOH)4CH 2OH(己六醇)(3)酯化反应:CH 2OH(CHOH)4CHO+5CH 3COOH H 2OCOCH 3(CHOCOCH 3)4CHO+5H 2O+ 3nHO-NO 3 + 3nH 2O (4)水解反应:C 12H 22O 11 + H 2C 6H 12O 6 + C 6H 12O 6C 12H 22O 11 + H 2O 2C 6H 12O 6(C 6H 10O 5)n + nH 26H 12O 6(C 6H 10O 5)n + nH 2nC 6H 12O 6十三、氨基酸(1)两性:H 2N-CH 2-COOH + HCl HOOC –CH 2–NH 3ClC 17H 33-COO -CH 2C 17H 33-COO -CH C 17H 33-COO -CH 21735CH C 17H 35-COO -CH 21735CH C 17H 35-COO -CH 2CH 2-OHCH -OHCH 2-OH 点燃 一定条件 催化剂 OH OH [(C 6H 7O 2) OH]n ONO 2 ONO 2[(C 6H 7O 2) ONO 2]nH 2N-CH 2-COOH + NaOH H 2N –CH 2–COONa + H 2O (2)缩合反应: H 2N-CH 2-COOH + H 2N-CH2-COOH + H 2O(3):酯化反应:H 2N-CH 2-COOH + HOCH 2CH 3 H 2N-CH 2-COOCH 2CH 3+H 2O十四、蛋白质(1)两性:(2)盐析:给蛋白质溶液中加入某些无机盐的浓溶液,如(NH 4)2SO 4、Na 2SO 4等,可使蛋白质的溶解度降低而析出的作用,是可逆过程,故可用于分离、提纯蛋白质。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:CnH2n+2)甲烷的制取:CaO △(1)氧化反应甲烷的燃烧:点燃甲烷不成使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 光照一氯甲烷)+HCl 光照二氯甲烷)+HCl 光照三氯甲烷)+HCl (CHCl3又叫氯仿) 光照四氯化碳)+HCl(3)分解反应甲烷分解:高温2. 乙烯(烯烃通式:CnH2n)乙烯的制取:浓硫酸170℃=CH2↑+H2O(消去反应) (1)氧化反应乙烯的燃烧:CH2=点燃乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH2=—CH2Br与氢气加成:CH2=CH2+H2催化剂CH3CH3 与氯化氢加成:CH2=CH2+HCl 催化剂CH3CH2Cl 与水加成:CH2=CH2+H2O催化剂CH3CH2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH2=CH2催化剂 [CH2—CH2 ] n 适当拓展:CH3CH =׀ Cl CH -׀ ClCH2 CH3CH =CH2+H2催化剂CH3CH2CH3 CH3CH =CH2+HCl 催化剂CH3CH2CH2Cl 或CH3׀ ClCHCH3 CH3CH =CH2+H2O 催化剂CH3CH2CH2OH 或CH3׀ OHCHCH3 nCH2=CH -CH3催化剂 [CH2—׀ CH3CH ] n(聚丙烯) 3. 乙炔(炔烃通式:CnH2n-2)乙炔的制取: CH↑+Ca(OH)2(1)氧化反应乙炔的燃烧:点燃乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CHBr =CHBr CHBr =—CHBr2 与氢气加成:HC≡CH+H2催化剂H2C =CH2与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl (3)聚合反应图2 乙烯的制取图1 甲烷的制取图3 乙炔的制取氯乙烯加聚,得到聚氯乙烯:nCH2=CHCl催化剂[CH2—׀ Cl CH ] n 乙炔加聚,得到聚乙炔:n HC≡CH催化剂 [CH =CH ] n 4. 1,3-丁二烯 与溴完全加成:CH2=CH -CH =CH2Br -CHBr -CHBr -CH2Br 与溴1,2-加成:CH2=CH -CH =CH2Br -CHBr -CH =CH2 与溴1,4-加成:CH2=CH -CH =CH2Br -CH =CH -CH2Br 5. 苯苯的同系物通式:CnH2n-6(1)氧化反应苯的燃烧:2+15O2点燃苯不克不及使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式汇总(全)(已免费)

Ca催化催催化催化催催催高中有機化學方程式匯總1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2 + H 2O CH 3CH 2OH 10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 12. nCH 2 = CH 2 [ CH 2—CH 2 ] n 13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n 14. 2CH 2 = CH 2 + O 2 2CH 3CHO催化催NaO催化15. CH≡CH + Br2 CHBr = CHBr16. CHBr = CHBr+ Br2 CHBr2-CHBr217. CH≡CH + HCl H2C = CHCl18. nCH2 = CH [ CH2-CH ] nCl Cl19. CH≡CH + H2O CH3CHO20. CaC2 + 2H2O CH≡CH↑+ Ca(OH)2-2 +H2O-SO33H+H2O225. +3HO-NO22O26. 3CH≡H醇催化浓硫浓硫BrOH催化催化△27. CH3CH2Br + H2O CH3CH2OH + HBr28. CH3CH2Br + NaOH CH3CH2OH + NaBr29. CH3CH2Br+ NaOH CH2 = CH2 + NaBr +H2O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O+C2H5OH C2H5OC2H5+H2O34. OH+NaOH ONa+H2O2O O-+H3O+233738. CH3CHO + H2 CH3CH2OH39. 2CH3CHO + O2 2CH3COOH△催催催40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ +Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 33COO)2Cu + 2H 2O+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l) 51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖 53. C 12H 22O 11 + H 2O 2C 6H 12O 6催催化催化+浓硫+ 2H O O C —O OCH -麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖 55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 2 57. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OH C 17H 35COO-CH 2 CH 2-OH58. CH 2OH COOH CH 2OH COOH1.HCl Cl CH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+ O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
有机化学方程式
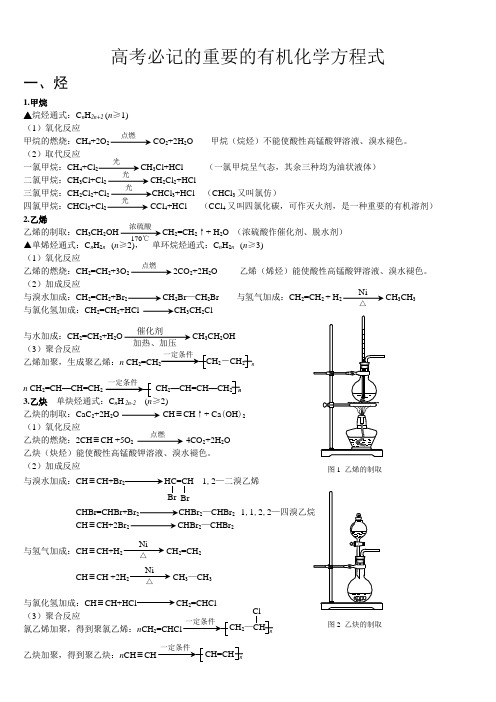
高考必记的重要的有机化学方程式一、烃1.甲烷▲烷烃通式:C n H 2n+2 (n ≥1) (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷(烷烃)不能使酸性高锰酸钾溶液、溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl (一氯甲烷呈气态,其余三种均为油状液体)二氯甲烷:CH3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯甲烷:CHCl 3+Cl 2CCl 4+HCl (CCl 4又叫四氯化碳,可作灭火剂,是一种重要的有机溶剂)2.乙烯乙烯的制取:CH3CH 2OH CH 2=CH 2↑+ H 2O (浓硫酸作催化剂、脱水剂)▲单烯烃通式:C n H 2n (n ≥2), 单环烷烃通式:C n H 2n (n ≥3) (1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 2 2CO 2+2H 2O 乙烯(烯烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:CH 2=CH 2 + H 2 CH 3CH 3与氯化氢加成:CH 2=CH 2+HCl CH 3CH 2Cl与水加成:CH 2=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n CH 2=CH nn CH 2=CH —CH=CH CH 2—CH=CH —CH 2 n3.乙炔 n 2n-2 2)乙炔的制取:CaC 2+2H 2O CH ≡CH ↑+ Ca (OH )2(1)氧化反应乙炔的燃烧:2CH ≡CH +5O 2 4CO 2+2H 2O乙炔(炔烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应 与溴水加成:CH ≡CH+Br 2 HC=CH 1,2—二溴乙烯BrCHBr=CHBr+Br 2 CHBr 2—CHBr 2 1,1,2,2CH ≡CH+2Br 2 CHBr 2—CHBr 2与氢气加成:CH ≡CH+H 2 CH 2=CH 2CH ≡CH +2H 2 CH 3—CH 3与氯化氢加成:CH ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n CH ≡ n点燃光光光光浓硫酸170℃点燃Ni△催化剂加热、加压2-CH 2点燃Br 2—CHClCH=CHNi△Ni△ 图1 乙烯的制取图2 乙炔的制取4.苯▲苯及其苯的同系物通式:C n H2n-6 (n≥6)(1)氧化反应苯的燃烧:2C6H6+15O212CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
有机化学常用反应方程式汇总

光照光照 光照光照高温CaO△ 催化剂加热、加压催化剂△ 催化剂 浓硫酸△有机化学方程式汇总1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 22OH10. CH 2 = CH 3—CH 2Br 11. CH 2 = CH CH 3 12. nCH 2 CH 2 ] n 13. nCH 2-CH=CH-CH 2] n14. 2CH 23CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2NaOHH 2O醇 △催化剂△ 浓硫酸 170℃浓硫酸140℃催化剂△-NO 22 +H 2O -SO 33H+H 2O24. + 3H 2 -NO 22O26. 3CH ≡27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O2O 2O O -+H 3O + 2O+CO 33738. CH 339. 2CH 3△催化剂催化剂催化剂催化剂催化剂△ 催化剂加热、加压 40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O 41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑ 44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑ 45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)3COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 23COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH 49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O 50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l)51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖53. C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖 54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6 淀粉 葡萄糖55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6纤维素 葡萄糖 56.C 17H 33COO-CH 2 C 17H 35COO-CH 2 C 17H 33COO-CH +3H 2 C 17H 35COO-CH C 17H 33COO-CH 2 C 17H 35COO-CH 257. C 17H 35COO-CH 2 CH 2-OH C 17H 35COO-CH +3NaOH 3C 17H 35COONa+ CH-OHC 17H 35COO-CH 22-OH+浓硫酸△+ 2H2O58. CH2OH COOH CH 2OH COOH1.HClCl CH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结 1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
《有机化学基础》必背化学方程式

高中选修有机化学方程式精华版1. CH4+Cl2 CH3Cl + HCl取代反应2. CH2=CH2 + Br2 CH2BrCH2Br加成反应3.nCH2 CH—CH3加聚反应4.CH3CH2OH消去反应(实验室制取乙烯) CaC2+2H2O Ca(OH)2+C2H2↑水解反应(实验室制取乙炔)6.加成反应7.+Br2 CHBr2—CHBr2加成反应8.9.+Br2 +HBr取代反应10.+HO—NO2+H2O 取代反应11.取代反应12. C x H y+(x+y4)O2 xCO2+y2H2O氧化反应13. C2H5—Br+NaOH C2H5—OH+NaBr水解反应(取代反应)14. CH3CH2Br+NaOH CH2 CH2↑+NaBr+H2O消去反应15. 2CH3CH2OH+2Na 2CH3CH2ONa+H2↑置换反应16.CH3CH2OH+HBr CH3CH2Br+H2O取代反应17.2CH3CH2OH+O2 2CH3CHO+2H2O氧化反应18.C6H5ONa+CO2+H2O C6H5OH+NaHCO3复分解反应19.+3Br 2↓+3HBr取代反应20.CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O氧化反应21.CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O氧化反应22. 2CH3CHO+O2 2CH3COOH氧化反应23.CH3CHO+H2 CH3CH2OH还原反应(加成反应)24. CH3COOH+C2H5OH CH3COOC2H5+H2O 酯化反应(取代反应)25. RCOOR’+H2O RCOOH+R’OH水解反应(取代反应)26. RCOOR’+NaOH RCOONa + R’OH水解反应(取代反应)27. C6H12O6+6O2 6CO2+6H2O氧化反应28. C12H22O11蔗糖+H2O C6H12O6葡萄糖+C6H12O6果糖水解反应30. C12H22O11麦芽糖+H2O2C6H12O6葡萄糖水解反应31. (C6H10O5)n淀粉+nH2O nC6H12O6葡萄糖水解反应32. C6H12O6葡萄糖2C2H5OH+2CO2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1部分甲烷烷烃
1、甲烷燃烧
2、甲烷和氯气光照反应,第1步
3、甲烷和氯气光照反应,第2步
4、甲烷和氯气光照反应,第3步
5、甲烷和氯气光照反应,第4步
6、甲烷和氯气光照反应,4步合并的总反应(生成的有机物物质的量均为1)
7、乙烷和氯气光照反应,第1步
8、丙烷和氯气光照反应,第1步(写两个方程式)
第2部分乙烯
1、乙烯的实验室制取反应
2、乙烯使溴水褪色反应
3、乙烯和氢气加成
4、乙烯和氯化氢加成
5、乙烯和水加成
6、乙烯加聚反应
7、乙烯燃烧
第3部分烯烃
1、丙烯使溴水褪色反应
2、丙烯和氢气加成反应
3、丙烯和氯化氢加成反应(写两个方程式)
4、丙烯和水加成反应(写两个方程式)
5、丙烯加聚反应
6、1,3丁二烯使溴水褪色(写两个方程式)
7、1,3丁二烯制取顺式聚1,3丁二烯(顺丁橡胶)
第4部分乙炔
1、乙炔的实验室制法
2、乙炔燃烧
3、乙炔使溴水褪色(1:1加成)反应
4、乙炔使溴水褪色(1:2加成)反应
5、乙炔和氯化氢加成(1:1)反应
6、乙炔和水加成
第5部分苯苯的同系物
1、苯的溴代反应
2、苯的硝化反应
3、苯和氢气加成反应
4、甲苯的硝化反应
5、甲苯和氢气加成反应
6、苯和氯气的取代反应
第6部分卤代烃
1、溴乙烷水解反应
2、溴乙烷消去反应
3、制取聚氯乙烯的反应
4、1-氯丙烷水解反应
5、2-氯丙烷消去反应
6、氯苯的水解反应第7部分乙醇
1、乙醇和金属钠反应
2、乙醇和氢溴酸的反应
3、乙醇的消去反应
4、乙醇的分子间脱水反应
5、乙醇的催化氧化
6、乙醇的酯化反应
7、乙醇的燃烧
第8部分苯酚
1、苯酚和浓溴水的反应
2、苯酚的电离方程式
3、苯酚和氢氧化钠反应
4、苯酚和金属钠反应
5、苯酚和碳酸钠反应
6、苯酚钠和盐酸反应
7、苯酚钠溶液里通二氧化碳反应
第9部分醛
1、乙醛和氢气加成反应
2、乙醛和银氨溶液反应
3、乙醛和新制氢氧化铜反应
4、乙醛的催化氧化
5、银氨溶液的配制反应(2个方程式)
6、甲醛和苯酚反应(酸性条件)
第10部分乙酸酯
1、乙酸和乙醇的酯化反应
2、乙酸和碳酸氢钠反应
3、乙酸和氢氧化铜反应
4、乙酸和碳酸钙反应
5、乙酸和碳酸钠反应
6、乙酸乙酯的酸性水解
7、乙酸乙酯的碱性水解
第11部分油脂
1、硬脂酸甘油酯的碱性水解
2、油酸甘油酯的氢化反应
第12部分合成高分子
1、制取聚乙烯的反应
2、制取聚氯乙烯的反应
3、制取聚苯乙烯的反应
4、制取聚己二酸乙二醇酯的反应
5、制取聚-6-羟基己酸酯的反应
6、制取酚醛树脂的反应
7、制取涤纶(聚对苯二甲酸乙二醇酯)的反应
8、制取顺丁橡胶的反应。
