各地自来水硬度 钙镁离子含量 测试结果
不同水源检测结果报告

不同水源检测结果报告一:水样来源:吃水、老井水、开水、盐井水二:检测项目与标准1.按饮用水标准检测:PH、总硬度、大肠杆菌2.按医药用纯化水标准检测:氯化物、硝酸盐、亚硝酸盐、氨、重金属三:检测原理及过程:1.PH检测:执行标准药典饮用水标准,规定水样PH范围6.5~8.5检测结果:项目PH值吃水7.53老井水7.51开水7.65盐井水7.232.总硬度检测:执行标准药典饮用水标准,规定水样的总硬度(以碳酸钙计),不得过450mg/L。
方法:精密量取水样50ml,加PH=10.0的氨-氯化氨缓冲溶液2ml,铬黑T指示剂少许,摇匀,以EDTA滴定液(0.01mol/L)滴定,滴定至溶液有酒红色变为蓝色,到达终点,记录所消耗体积数。
同时做空白实验(用纯化水/超纯水做空白)。
实验结果:水样来源水样体积ml 消耗EDTA体积ml 总硬度mg/L 纯化水(空白)50 0.42 ——吃水50 17.64 351.6老井水50 8.04 155.6开水50 21.72 434.9盐井水50 14.32 238.83.大肠杆菌检测:执行标准药典饮用水标准,规定水样不得检出大肠杆菌群。
实验结果:未检出大肠杆菌群。
4. 氯化物检测:执行标准药典纯化水标准,取水样50ml,加浓硝酸5滴与硝酸银试液1ml,不得发生浑浊。
实验结果:水样来源水样体积ml 实验现象吃水50 发生浑浊老井水50 发生浑浊开水50 发生浑浊盐井水50 发生浑浊(浊度<前三个)5. 硝酸盐检测:执行标准药典纯化水标准,规定水样产生的蓝色不得比标准硝酸盐溶液[取硝酸钾0.163g,加水(纯化水)溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释至100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1ugNO3)]0.3ml,加无硝酸盐水(超纯水/蒸馏水)4.7ml,用同一方法处理后的颜色更深。
方法:取水样5ml,置于试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加浓硫酸5ml,摇匀,将试管于50度水浴中放置15min.。
《自来水的总硬度及钙镁含量的测定》实验综述报告

自来水的总硬度及钙镁含量的测定一、实验目的本实验旨在通过测定自来水的总硬度及钙镁含量,掌握水质分析的基本方法和技能,了解自来水中钙镁含量对人体健康的影响。
二、实验原理1.总硬度的测定原理总硬度是指水中钙、镁离子的总浓度,通常用钙的浓度表示。
测定总硬度的方法有多种,其中以EDTA络合滴定法最为常用。
EDTA是一种强螯合剂,它与钙、镁等金属离子形成配合物,使之转化为稳定的螯合物。
在pH=10左右的条件下,EDTA与钙、镁离子形成的络合物是稳定的,通过滴定EDTA溶液,即可测定水中钙、镁离子的含量。
2.钙镁含量的测定原理钙、镁是人体必需的微量元素,但如果摄入过量,会对人体健康产生不良影响。
测定自来水中钙镁含量的方法有多种,其中以原子吸收光谱法最为常用。
该方法是利用钙、镁原子在炉管中被蒸发、电离、激发后产生的特定波长的光谱线进行测定,从而得到钙、镁元素的含量。
三、实验步骤1.总硬度的测定步骤(1)取100ml水样,加入2ml NH3-NH4Cl缓冲液和10ml 0.01mol/LEDTA溶液,用Erlenmeyer瓶摇匀。
(2)加入1~2滴酚酞指示剂,溶液呈现粉红色。
(3)滴定0.01mol/L CaCl2溶液,直至溶液变成稳定的蓝色。
(4)记录滴定所用的CaCl2溶液体积V1。
2.钙镁含量的测定步骤(1)取100ml水样,加入2ml HNO3和2ml HCl,用蒸馏水定容至1000ml。
(2)在原子吸收光谱仪中设置好钙、镁的波长,调节火焰高度和炉管温度。
(3)将水样注入炉管,测定钙、镁的含量。
四、实验结果本次实验测得自来水的总硬度为200mg/L,钙、镁含量分别为50mg/L和30mg/L。
五、实验结论自来水中的总硬度和钙、镁含量都是影响水质的重要指标。
总硬度高的水会使水垢增多,影响水的使用寿命;而钙、镁含量过高则会对人体健康产生不良影响。
因此,我们应该注重自来水的水质检测,选择适合自己的饮用水源。
六、实验体会通过本次实验,我了解了水质分析的基本原理和方法,掌握了总硬度和钙镁含量的测定技能。
自来水硬度的测定实验报告

自来水硬度的测定实验报告实验目的:通过实验,掌握测定自来水硬度的方法,了解自来水的硬度对水质的影响。
实验原理:自来水中的硬度是由水中的钙离子和镁离子所引起的。
硬度可以分为总硬度和临界硬度两种。
总硬度是指水中所有的碳酸钙和碳酸镁的总和,临界硬度是指水中的碳酸钙和碳酸镁的总和与水中碳酸氢根离子的总和之比。
实验仪器和试剂:1. 自来水样品。
2. 硬度计。
3. 硝酸铵。
4. EDTA指示剂。
5. 硫酸铵。
实验步骤:1. 取一定量的自来水样品,放入硬度计中。
2. 在硬度计中加入适量的硝酸铵和硫酸铵,使水中的碳酸钙和碳酸镁转化为氢氧化钙和氢氧化镁。
3. 滴加EDTA指示剂,当水样中的钙和镁离子与EDTA生成螯合物后,指示剂由蓝色变为红色,此时停止滴加。
4. 记录滴加EDTA的体积V1。
5. 重复以上步骤3-4,直至两次滴加EDTA的体积相差不超过0.1mL,取平均值作为V1。
6. 计算自来水样品的硬度。
实验结果:经过实验测定,自来水样品的硬度为Xmg/L。
实验分析:根据实验结果,可以得出自来水样品的硬度符合国家标准,属于优质饮用水。
但是,硬度过高的自来水会影响水的口感,对人体健康也会有一定的影响,因此在日常生活中应该选择适当硬度的饮用水。
实验结论:通过本次实验,我们成功掌握了测定自来水硬度的方法,了解了自来水硬度对水质的影响,为日常生活中选择优质饮用水提供了参考依据。
实验注意事项:1. 实验中要注意使用实验仪器和试剂,避免发生意外。
2. 在实验过程中要严格按照操作步骤进行,确保实验结果的准确性。
3. 实验结束后要做好实验仪器的清洁和存放工作。
总结:自来水硬度的测定是非常重要的,通过本次实验,我们深入了解了自来水硬度的测定方法和意义,为日常生活中的饮水健康提供了科学依据。
希望大家在日常生活中注重饮用水的选择,保障自己和家人的健康。
《自来水的总硬度及钙镁含量的测定》实验综述报告(一)

《自来水的总硬度及钙镁含量的测定》实验综述报告(一)实验综述:《自来水的总硬度及钙镁含量的测定》一、实验目的•了解水的硬度概念及计算方法•掌握EDTA滴定法测定水中钙镁离子含量的方法•掌握复合指示剂法测定水的硬度的方法二、实验原理1. 水的硬度水的硬度是指水中的钙镁离子含量。
硬度分为临时硬度和总硬度两种,其中临时硬度反映水中碳酸盐类离子的含量,易通过沸腾使其析出消除;而总硬度既包括临时硬度,也包括水中的非碳酸盐类离子。
### 2. EDTA滴定法这种测定方法是利用EDTA(乙二胺四乙酸)分别与水中的钙、镁离子配位形成螯合络合物,用酚酞作指示剂,在逐渐加入EDTA及调节pH值的过程中,在EDTA配位反应达到终点时,出现颜色的转变。
从此可以计算出水样中钙、镁离子的含量。
### 3. 复合指示剂法这种测定方法是将一种称为“EDTA- 红色三原酸盐”的复合指示剂溶于水中,与以EDTA为溶解剂的固体EDTA作测量,根据指示剂的颜色变化来反映水的硬度。
三、实验步骤1. EDTA滴定法1.取约50mL样品,通入气泡。
2.用pH计调节样品pH值为10±0.2。
3.加入2-3滴酚酞指示剂,然后用标准0.01mol/L的EDTA溶液从滴定管中滴加。
4.每次滴加后充分搅拌,并观察溶液的颜色变化,当溶液从红色变为洋红色时,停止滴定。
5.记录滴定体积,并计算水样中钙离子和镁离子的含量以及总硬度。
### 2. 复合指示剂法6.取约100mL样品,滴加20%碳酸钠溶液,搅拌均匀并过滤。
7.将滤液从容器中的体积标尺读数调整至100mL,并加入2mL复合指示剂。
8.分步加入标准的EDTA水溶液,并搅拌均匀。
9.待颜色从蓝色变为洋红色,再加入2-3滴1%的硫酸铵指示剂,并继续滴定至颜色变为蓝色为止。
10.记录需要的EDTA滴定体积,并计算水样中的总硬度。
四、实验注意事项1.实验过程中应保证仪器干净和精准度。
2.EDTA溶液中可加入少量的2-5g/L的NaOH,调节pH值,有助于反应快速达到终点。
济南市不同地区饮用水硬度的测定分析
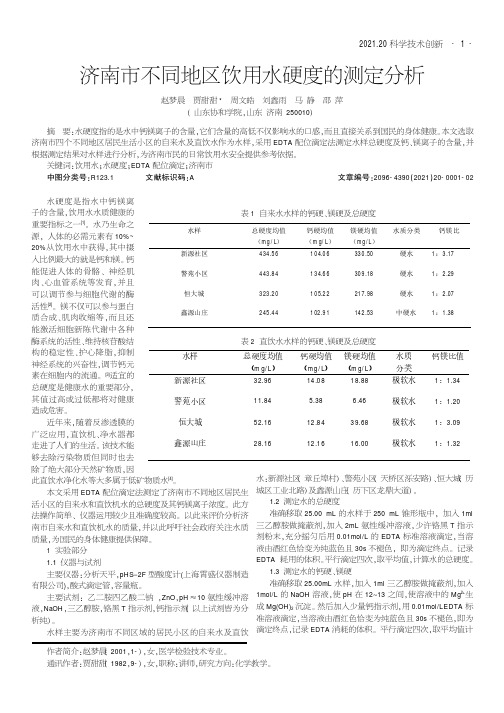
济南市不同地区饮用水硬度的测定分析
赵梦晨 贾甜甜 * 周文皓 刘鑫雨 马 静 邵 萍 渊 山东协和学院袁山东 济南 250010冤
摘 要院水硬度指的是水中钙镁离子的含量袁它们含量的高低不仅影响水的口感袁而且直接关系到国民的身体健康遥 本文选取
济南市四个不同地区居民生活小区的自来水及直饮水作为水样袁采用 EDTA 配位滴定法测定水样总硬度及钙尧镁离子的含量袁并
为群[7]等提出了适合我国居民的钙尧镁尧总硬度最低可接受水 平尧适宜水平和上限水平的建议值袁当水必须进行膜处理时袁建 议设定饮用水中钙尧 镁尧 总硬度的最低可接受水平为 25mg/L尧 10mg/L尧100mg/L遥 由此看来以上四个居民小区直饮机水的钙硬 和总硬度都低于最小限值袁 恒大城直饮水镁硬大于最低限值袁 而其它三个小区的镁硬都低于最低限制袁长期饮用会增加疾病 发生风险遥
参考文献 [1]中华人民共和国卫生部.生活应用水卫生标准:GB5749-2006 [S].北京:中国标准出版社,2006. [2]李向东,陈烨.喀斯特地区高硬度水质和重金属污染对人体健 康的影响[J].微量元素与健康研究,2014,31(2):71-73. [3]张忠诚,徐祗云,张素洁.镁与人体健康[J].微量元素与健康研 究,2006,4(4):67-69. [4]查锡良.生物化学[M].北京:人民卫生出版社,2000,226. [5]张照英,舒为群.长期饮用纯净水对血脂尧钙镁离子尧丙二醛尧 一氧化氮和血浆内皮素含量的影响 [J]. 中国动脉硬化杂志,
除了绝大部分天然矿物质袁因 此直饮水净化水等大多属于低矿物质水[4]遥
本文采用 EDTA 配位滴定法测定了济南市不同地区居民生 活小区的自来水和直饮机水的总硬度及其钙镁离子浓度遥 此方 法操作简单尧 仪器运用较少且准确度较高遥 以此来评价分析济 南市自来水和直饮机水的质量袁并以此呼吁社会政府关注水质 质量袁为国民的身体健康提供保障遥
自来水的硬度测定实验报告

自来水的硬度测定实验报告实验目的,通过实验,了解自来水的硬度及其测定方法,掌握分析测定结果的技巧。
实验原理,自来水中的硬度是由水中的钙、镁离子所致。
硬度可以分为总硬度、临界硬度和碳酸钙硬度。
总硬度是指水中所有碱土金属离子的含量;临界硬度是指水中的镁、钙离子的含量;碳酸钙硬度是指水中的碳酸钙含量。
硬度的测定一般采用EDTA法。
实验仪器,分光光度计、烧杯、容量瓶、滴定管、电磁搅拌器等。
实验步骤:1. 取一定量的自来水,加入适量的NH3-NH4Cl缓冲液,使水的pH值保持在10左右。
2. 用EDTA标准溶液滴定,直至水中的钙、镁离子完全与EDTA结合。
3. 在滴定过程中,加入几滴甲基橙指示剂,当水变成橙色时,表示EDTA已经与水中的钙、镁离子完全结合。
4. 记录滴定时EDTA的用量V1,再分别加入几滴甲基紫和二甲基黄指示剂,继续滴定,直至水中的钙、镁离子完全与EDTA结合。
5. 记录滴定时EDTA的用量V2和V3。
6. 计算出自来水的总硬度、临界硬度和碳酸钙硬度。
实验数据:V1=25.0ml,V2=32.5ml,V3=28.0ml。
实验结果:总硬度=V1×C×1000/容量(ml)=25.0×0.01×1000/100=250mg/L。
临界硬度=(V2-V1)×C×1000/容量(ml)=(32.5-25.0)×0.01×1000/100=75mg/L。
碳酸钙硬度=(V3-V2)×C×1000/容量(ml)=(28.0-32.5)×0.01×1000/100=-45mg/L。
实验结论:通过本次实验,我们测定出自来水的总硬度为250mg/L,临界硬度为75mg/L,碳酸钙硬度为-45mg/L。
其中,碳酸钙硬度为负值,可能是由于实验操作不当或者其他因素导致的。
总体来说,自来水的硬度较高,需要进行进一步的处理才能达到饮用水的标准。
软硬水检验报告

软硬水检验报告1. 引言本报告旨在对水源中的软硬水进行检验,并分析其对环境、生活和工业等方面的影响。
通过对硬度和碱度等关键参数的测定,了解水质的情况,为进一步的处理和利用提供参考依据。
2. 软硬水的概念软硬水是指水中钙、镁等金属离子含量的多少。
水中含有较高比例的钙、镁离子时,称为硬水;反之,含有较低比例的钙、镁离子时,称为软水。
3. 检验方法为了准确地检验水中的硬度和碱度,我们采用了以下常用的检验方法:3.1 硬度测定硬度代表水中的钙、镁离子含量,通常以毫摩尔/升(mmol/L)或以mg/L计。
3.1.1 酸碱滴定法首先,我们使用酸碱滴定法测定水样中的总硬度,这需要以下步骤:1.取一定体积的水样(例如100mL);2.将一定量的碳酸氢钠溶液滴入水样中,同时加入酚酞指示剂;3.滴定过程中,溶液的颜色会发生转变,从开始的红色到终点的蓝色;4.记录滴定液的用量,根据滴定液的浓度和用量,计算出总硬度的值。
3.1.2 EDTA滴定法EDTA滴定法可以用于测定水样中的临界硬度和非临界硬度。
1.取一定量的水样,加入相应量的EDTA溶液,并加入维纳反应指示剂;2.在滴定的过程中,溶液会从红色转变为蓝色;3.记录EDTA滴定液的使用量,并根据浓度计算出相应的硬度值。
3.2 碱度测定碱度是指水中氢氧化物离子的含量,通常以mg/L计。
3.2.1 酸碱滴定法使用酸碱滴定法测定水样的碱度,需要进行以下步骤:1.取一定体积的水样;2.加入酚酞指示剂;3.逐滴加入硫酸至溶液转变为深红色;4.记录滴定液的用量,根据滴定液的浓度和用量,计算出碱度的值。
3.3 其他参数的测定除了硬度和碱度外,还可以进行PH值、总溶解固体(TDS)等参数的测定,以更全面了解水质情况,并对水的使用做出合理的判断。
4. 检验结果经过上述检验方法的操作和计算,我们得到了以下的检验结果:参数检测结果总硬度xx mmol/L硬度A xx mmol/L硬度B xx mmol/L碱度xx mg/LPH值x.xTDS xx mg/L5. 结论根据我们的检测结果,得出以下结论:1.水样的硬度为xx mmol/L,其中硬度A为xx mmol/L,硬度B为xxmmol/L;2.水样的碱度为xx mg/L;3.PH值为x.x,属于酸性/中性/碱性范围;4.TDS为xx mg/L,符合/不符合水质标准。
山东省部分地区生活饮用水水硬度测定分析

分析检测山东省部分地区生活饮用水水硬度测定分析刘 丽,贾甜甜*,贾晓晓,杨雨萍(山东协和学院,山东济南 250109)摘 要:目的:对山东省部分地区生活饮用水水硬度进行测定分析,为居民日常生活饮水安全提供参考,预防由水硬度问题引起的疾病。
方法:随机抽取山东省部分地区自来水与直饮水样品,采用EDTA配位滴定法测定水硬度。
结果:济南、济宁自来水水硬度均超过450 mg/L,不符合国家规定,日照自来水属于软水;济南、济宁、枣庄的直饮水水硬度均属于软水,低于水硬度建议的最低水平。
结论:济南、济宁自来水硬度较大,需进行处理后饮用;济南、济宁、枣庄的直饮水水硬度均较小,长期饮用会增加患病风险。
关键词:山东省部分地区;生活饮用水;水硬度;居民健康Determination and Analysis of Water Hardness of DomesticDrinking Water in Some Areas of Shandong ProvinceLIU Li, JIA Tiantian*, JIA Xiaoxiao, YANG Yuping(Shandong Xiehe University, Jinan 250109, China)Abstract: Objective: The hardness of drinking water in some areas of Shandong province was measured and analyzed to provide reference for residents’ daily drinking water safety and prevent diseases caused by water hardness. Method: Tap water and direct drinking water samples were randomly selected from some areas in Shandong Province, and the water hardness was determined by EDTA coordination titration. Result: The hardness of tap water in Jinan and Jining exceeded 450 mg/L, which did not meet the national regulations. Rizhao tap water was soft water. The hardness of direct drinking water in Jinan, Jining and Zaozhuang all belong to soft water, which is lower than the minimum level suggested by water hardness. Conclusion: The hardness of tap water in Jinan and Jining is high, so it needs to be treated before drinking. The hardness of direct drinking water in Jinan, Jining and Zaozhuang is low, and long-term drinking will increase the risk of illness.Keywords: parts of Shandong province; drinking water; water hardness; residents’ health水是生命之源,是人体重要的营养素之一,水质的好坏与身体健康息息相关,而水硬度则是衡量水质量的重要标准之一[1]。
自来水硬度测定实验报告

自来水硬度测定实验报告自来水硬度测定实验报告一、引言自来水是我们日常生活中必不可少的资源之一,它的质量直接关系到我们的健康和生活质量。
而自来水中的硬度是一个重要的指标,它主要由镁、钙等金属离子引起。
本实验旨在通过测定自来水的硬度,了解水质的优劣,并探讨可能的影响因素。
二、实验目的1. 学习使用复合指示剂法测定水的硬度。
2. 探究水中硬度的来源和影响因素。
三、实验原理自来水中的硬度主要由钙和镁离子引起,可以通过复合指示剂法进行测定。
在本实验中,我们将使用EDTA(乙二胺四乙酸)作为配位剂,它能与钙和镁离子形成稳定的配合物。
当EDTA与钙离子结合时,溶液中的指示剂呈红色;当EDTA与镁离子结合时,溶液中的指示剂呈蓝色。
通过滴定的方法,可以测定出水样中的钙和镁离子的含量,从而计算出水的硬度。
四、实验步骤1. 取一定量的自来水样品,加入适量的复合指示剂溶液。
2. 使用标准化的EDTA溶液进行滴定,直至溶液颜色发生明显变化。
3. 记录滴定所需的EDTA溶液体积,并进行计算。
五、实验结果与分析通过实验测定,我们得到了自来水样品的硬度值。
根据硬度值的不同,可以将水质分为软水、中硬水和硬水。
硬度值越高,水质越硬。
硬水在使用过程中容易产生水垢,对家电、水龙头等设备有一定的损害。
因此,合理评估水的硬度对我们的生活和健康非常重要。
六、影响因素的讨论1. 地理因素:地下水和地表水的硬度值有所不同,地理位置也会对水的硬度产生影响。
2. 水源因素:水源中的钙和镁离子含量不同,会直接影响水的硬度。
3. 水处理因素:水处理厂在净化水质过程中可能会添加化学药剂,这些药剂也会影响水的硬度。
4. 管道因素:自来水经过管道输送到家中时,可能会与管道中的金属产生反应,导致水的硬度发生变化。
七、结论通过本实验,我们成功地使用复合指示剂法测定了自来水的硬度,并对水质的优劣进行了评估。
水的硬度是一个重要的指标,它与地理、水源、水处理和管道等因素密切相关。
自来水硬度的测定实验数据 -回复

自来水硬度的测定实验数据-回复自来水硬度的测定实验数据[实验目的、实验原理、实验步骤、实验结果、实验讨论和结论]实验目的:本实验的目的是测定自来水中的硬度。
硬度是指水中含有的可溶解的钙和镁的离子含量。
水的硬度对水质、水管、洗涤效果等方面都有一定影响,因此了解自来水的硬度对我们的生活有一定的重要性。
实验原理:水硬度一般分为总硬度和临时硬度两种。
总硬度是指水中所有的碳酸盐硬度和非碳酸盐硬度的总和;而临时硬度主要是水中碳酸盐硬度的含量。
实验步骤:1. 实验前准备:准备好自来水样品、分液漏斗、烧杯、滴定管、酚酞指示剂和乙炔三醇试剂等。
2. 滴定总硬度:将50ml自来水样品转移至烧杯中,加入1-2滴酚酞指示剂,溶解10g乙炔三醇试剂于50ml蒸馏水中,再用滴定管逐滴加入,直至溶液由无色变为浅红色,记录滴定的乙炔三醇试剂的用量。
3. 滴定临时硬度:将50ml自来水样品转移至烧杯中,加入少量硫酸盐试剂,用水稀释至约200ml,再用盐酸滴定至酸度pH=3,此时加入1-2滴酚酞指示剂,用硝酸钠标准溶液逐滴加入,直至溶液由红色变为黄色,记录滴定的硝酸钠标准溶液的用量。
4. 计算结果:根据用量计算总硬度和临时硬度的含量。
实验结果:根据实验步骤进行实验后,得到了自来水样品的总硬度和临时硬度的含量。
实验讨论:通过实验得到的数据,可以对自来水的硬度进行判断和评价。
根据国家标准,自来水的硬度一般应控制在一定范围内,以保证给水的质量。
如果自来水的硬度过高,可能会导致水垢的产生并且影响水的使用效果;而硬度过低,则会对人体健康有一定影响。
结论:通过本次实验,我们可以测定出自来水的硬度。
根据实验数据,我们可以对自来水的质量进行评估,以采取适当的措施来调节水质。
同时,我们也可以了解到自来水的硬度对生活的影响以及可能产生的问题。
实验二自来水总硬度的测定

实验二自来水总硬度的测定实验二:自来水总硬度的测定引言:自来水中的硬度是指水中钙离子和镁离子的总含量,是水质的一个重要指标。
高硬度的水会导致水垢的形成,不仅影响水质,还会对水管等设备造成损坏。
因此,了解自来水的硬度是十分重要的。
本实验旨在通过计量法测定自来水的总硬度,并通过实验结果对自来水的水质进行评估。
实验原理:自来水中的总硬度主要包括钙离子和镁离子的含量。
常用的测定方法有EDTA滴定法、石碱滴定法等。
本实验采用EDTA滴定法进行测定。
EDTA(乙二胺四乙酸)是一种螯合剂,可以与钙离子和镁离子形成稳定的络合物。
当EDTA与钙离子形成络合物时,其指示剂溴甲蓝呈红色;当EDTA与镁离子形成络合物时,溴甲蓝呈蓝色。
通过滴定过程中指示剂颜色的变化,可以确定自来水中钙离子和镁离子的含量,从而计算得到总硬度。
实验步骤:1.实验前准备: a. 取得自来水样品; b. 准备0.01mol/L EDTA标准溶液;c. 准备溴甲蓝指示剂。
2.样品的制备: a. 取约50mL自来水样品加入250mL锥形瓶中; b. 加入适量的NH4Cl和NH4OH溶液,使溶液呈碱性,以促使钙离子和镁离子与EDTA络合。
3.滴定操作: a. 取约50mL样品溶液加入滴定瓶中,加入2-3滴溴甲蓝指示剂; b. 使用0.01mol/L EDTA标准溶液进行滴定,直至溶液由红色转变为蓝色。
记录滴定消耗的EDTA溶液体积V1(mL)。
4.空白试验: a. 重复步骤3,不加入自来水样品,仅进行滴定操作,记录滴定消耗的EDTA溶液体积V2(mL)。
5.数据处理: a. 计算自来水样品的总硬度(以CaCO3计):总硬度(mg/L)= (V1 - V2) × 0.01 × 1000 / V实验注意事项:1.实验操作过程中要注意安全,避免溶液飞溅或皮肤接触。
2.滴定时要控制滴液速度,避免溶液过量。
3.每组实验进行3次滴定,计算平均值。
自来水中钙镁含量的测定实验报告

自来水中钙镁含量的测定实验报告
实验名称:自来水中钙镁含量的测定实验报告
实验目的:测定自来水中钙镁含量,了解其水质情况,为饮用水的安全性提供依据。
实验原理:钙和镁是水中的重要阳离子,它们的含量对水的硬度有很大影响。
硬度是指水中钙和镁离子与碳酸盐结合的程度,通常用钙离子(Ca²⁺)和镁离子(Mg²⁺)的浓度来衡量。
测定水中钙镁含量的方法有多种,常用的方法是使用EDTA滴定法,通过EDTA与钙镁离子结合形成稳定的络合物,然后通过测定消耗的EDTA的体积来计算钙镁含量。
实验仪器:滴定管、移液管、烧杯、pH计、电导率仪、EDTA滴定仪等。
实验步骤:
(1)取一定量的自来水样品,用烧杯或容量瓶将其转移至烧杯中。
(2)用pH计测定样品的pH值。
(3)用EDTA滴定仪加入EDTA溶液,直到样品中的钙镁离子完全被EDTA络合。
(4)记录滴定所用的EDTA体积,计算样品中钙和镁的含量。
实验结果:根据实验结果,可以了解自来水中钙和镁的含量是否超标,是否符合饮用水标准。
如果超标,可能对人体健康造成影响,需要采取措施进行处理。
实验注意事项:
(1)实验过程中应注意操作规范,避免误差。
(2)在滴定过程中,应缓慢滴加EDTA溶液,避免过量加入造成误差。
(3)在测定结果时,应注意准确记录实验数据,避免误差。
水中总硬度钙镁离子的测定

清远连州大江村部分自然村水硬度检测一.检测原理1) 钙是硬度的主要组成之一,镁也是硬度的主要组成之一。
总硬度是钙镁的总浓度。
水总硬度的测定,可采用络合滴定法,用EDTA标准溶液直接滴定水中Ca、Mg总量,然后以Ca换算为相应的硬度单位。
2) 用EDTA滴定Ca、Mg总量时,一般实在PH=10的氨缓冲溶液中进行,用铬T做指示剂。
滴定前,络黑T与少量的Ca2+、Mg2+络合物,绝大部分的Ca2+、Mg2+处于游离状态。
随着EDTA的滴入,Ca2+和Mg2+络合物的条件稳定常数大于铬T与Ca2+、Mg2+络合物的条件常数,因此EDTA夺取铬黑T络合物中的金属离子,将铬黑T游离出来,溶液呈现游离铬黑T的蓝色,指示终点。
同样的,利用钙指示剂,在PH=12时,侧的水中Ca2+钙的含量,据此可以求出Mg2+二、饮用水相关数据1) 水硬度的表示方法是以每升水中含10mgCaO为硬度1,写为1°。
水质分类是:0~4为很软的水,4~8为软水,8~16为中等硬水,16~30为硬水,30以上为很硬的水。
2) 我国生活饮用水国家标准规定总硬度不超过450 mg/L,也就是45°。
而我国饮用水中,高品质的饮用水不超过25°,高品质的软水总硬度在10°以下。
最适宜的饮用水的硬度为8—18度,属于轻度或中度硬水。
3) 联合国WHO推荐的生活饮用水硬度标准:(1)饮用水:≤100 (2)优质饮用水:50三.实验数据及结果表1总硬度表2Ca2+含量表3Mg2+含量四、数据分析(根据国家饮用水标准,并未对钙镁离子做定量限制,此部分只分析总硬度)1)上新桥水样上新桥所取两个水样中,均为同一源头的自来水。
检测结果水中总硬度分别为18 mg/L、17mg/L,即为1.8°和1.7°,其水中所含钙镁离子量很低,属于很软的水。
长期饮用过低硬度水,对人体生理功能也有负面作用。
水中适量的硬度是我们日常摄取钙镁离子的主要方式之一。
《自来水的总硬度及钙镁含量的测定》实验综述报告

Science &Technology Vision 科技视界《自来水的总硬度及钙镁含量的测定》实验综述报告朱田生徐伟(安徽水利部淮委水利科学研究院,安徽蚌埠233000)【摘要】阐述了《自来水的总硬度及钙镁含量的测定》实验的意义和地位、实验目的、实验原理、仪器和试剂、实验步骤以及数据处理和实验注意事项。
自来水的总硬度及钙镁含量的测定方法,对于分析化学工作者特别是水质分析工作者来说具有非常重要的意义。
【关键词】综述报告;自来水;总硬度测定水的硬度对生活及工业用水影响极大。
硬水用于蒸汽锅炉,易生沉淀结成锅垢,不仅浪费燃料,又易引起爆炸;长期饮用高硬度的水,会引起心血管、神经、泌尿造血等系统的病变;烧开的水口感差,且常常造成壶底结垢,不但严重影响饭菜的味道和质量,而且矿物质(主要是钙镁的盐类)极易在体内累积,容易造成胆结石、肾结石以及尿道结石等;热水器随着使用时间的增加而热效率降低,这也是因为积存的水垢增加了,不仅浪费能源还形成了不安全隐患。
水是人类以及所有动植物赖以生存的最重要的自然资源,水的硬度是水质监测的重要指标之一。
因此了解并掌握水的硬度的测定在分析化学中具有非常重要的地位。
1实验目的1.1了解水的硬度的表示方法1.2掌握EDTA 法测定水中钙、镁含量的基本原理和方法1.3正确判断铬黑T 指示剂的滴定终点1.4掌握缓冲溶液的应用2实验原理2.1水硬度的表示方法自然水(自来水、河水、井水等)含有较多的钙盐、镁盐,它们的酸式碳酸盐遇热分解,析出沉淀,而使硬度除去,例如:Ca (HCO 3)2=CaCO 3↓+H 2O+CO 2↑这种硬度称为暂时硬度。
钙、镁的其他盐类所形成的硬度遇热不会分解,称为永久硬度。
暂时硬度和永久硬度的总和称为水的总硬度。
水的总硬度是就水中钙、镁的含量而言的。
水的硬度的表示方法很多,各国采用的方法和单位也不甚一致。
我国目前最常用的表示水的硬度的方法主要有两种。
(1)以度(°)表示。
水硬度标准对照表
水硬度标准对照表
水的硬度是指水中钙、镁离子沉淀肥皂水化液的能力,通常用来描述水中钙和镁的含量。
硬度分为碳酸盐硬度(暂时硬度)和非碳酸盐硬度(永久硬度)。
碳酸盐硬度主要由钙、镁的碳酸氢盐形成,这种硬度在加热后会分解成沉淀物从水中除去。
非碳酸盐硬度则由钙镁的硫酸盐、氯化物和硝酸盐等形成,这类硬度不能用加热分解的方法除去。
1、水硬度的表示方法有多种,中国采用的表示方法与德国相同。
例如,德国度表示1L 水中含有相当于10mg的钙,而美国度则表示1L水中含有相当于1mg的钙。
不同国家水硬度标准对照表
2、根据不同的标准,水硬度的分类也有所不同。
例如,根据钙离子浓度,水可以分为软水、中等硬度水、硬水和非常硬的水。
不同硬度分类标准对照表
3、水质硬度的单位也有多种,如毫克和度。
1升水中相当10mg Ca为1度,0-4度为很软水,4-8度为软水,8-16度为中度硬水,16-30度为硬水。
我国《生活饮用水卫生标准》规定,水的硬度标准为450mg/L。
总之,以上为水硬度标准对照表,这些信息为您提供了关于水硬度标准的一个全面概览,希望为您带来帮助。
都江堰水中钙镁离子含量及总硬度的测定

都江堰自来水中钙镁离子含量及总硬度的测定目的:1、掌握EDTA法测定水中Ca2+、Mg2+含量的原理和方法。
2、了解水的硬度的测定意义和水硬度常用表示方法。
3、掌握用EDTA法测定水中钙含量的测定方法和操作;实验原理:自来水中将含有较多钙、镁盐类的水称为硬水,水的硬度是将水中Ca2+、Mg2+来计算,水中的主要成分是钙离子,其次是镁离子,钠的总量折合成CaO或CaCO3离子,以及少量的Fe和Al离子。
在pH>12的介质中,镁离子会形成沉淀,从而掩蔽镁离子可以直接滴定测出,以钙指示剂为指示剂,用EDTA标准溶液滴定测定,水中钙的含量。
由于钙离子与EDTA形成的络合物比与钙指示剂形成的要稳定,可以通过置换反应来进行滴定和观察滴定终点,即溶液由酒红色变为微蓝色。
一般把小于4°的水称为很软水,4°~8°的水称为软水,8°~16°的水称为中硬水,16°~32°的水称为硬水,大于32°的水称为很硬水。
(Ca2+含量的测定:用氢氧化钠溶液调节待测水样的PH=12,将Mg2+转化为Mg(OH)2沉淀,使其不干扰Ca2+的测定。
)。
实验仪器:250ml锥形瓶,50ml酸式滴定管,铁架台,分析电子天平,10ml量筒,100ml移液管,滴管,250ml容量瓶。
实验试剂:0.01mol/LEDTA标准溶液,6mol/L的HCl溶液,10%NaOH溶液,pH=10的NH4CI-NH3·H2O氨性缓冲溶液,铬黑T指示剂(液体),钙指示剂(液体),蔗糖溶液。
内容及步骤:1.自来水中钙、镁总含量的测定用100ml移液管取100.00ml自来水溶液于250ml锥形瓶中,加入10mlpH=10的氨性缓冲溶液,滴入1~2滴的铬黑T指示剂.,用EDTA标准溶液滴定,滴定至溶液由酒红色变为微蓝色。
平行滴定3次。
记下EDTA用量。
2.自来水中钙含量的测定用100ml移液管取100.00ml自来水溶液于250ml锥形瓶中,加入10ml 的10%NaOH溶液,滴入2~3滴的钙指示剂,并加入几滴蔗糖溶液,用EDTA 标准溶液滴定,(切忌滴定时要放缓速度)滴定至溶液由酒红色变为微蓝色。
硬软水检验的实验现象和结论

硬软水检验的实验现象和结论硬软水是指水中溶解的矿物质和金属离子的含量不同所导致的水质差异。
硬水中主要含有钙离子和镁离子,而软水则相对含有较少的这些金属离子。
因为硬水和软水的性质不同,对人体和家电设备都有着不同的影响。
在日常生活中,我们常常需要对水进行检验,以了解水的硬度,从而选择适合的水处理方法。
因此,本文将通过对硬软水检验的实验现象和结论进行探讨,以深入研究硬软水的性质及影响。
在进行硬软水检验实验时,最直观的方法是通过肉眼观察水的颜色和透明度。
通常来说,硬水中含有较多的金属离子,因此呈现出较浑浊的现象,而软水则相对清澈。
但仅凭肉眼观察来确定水的硬度是不够准确的,因此我们需要借助化学试剂进行更为精确的检测。
一种常用的硬水检验方法是使用皂液试剂。
皂液试剂通过观察水与皂液的起泡情况来判断水的硬度。
通常情况下,硬水中的金属离子会与皂液中的活性物质发生反应,降低皂液的起泡能力,导致起泡量较少。
而软水中的金属离子较少,不会影响皂液的起泡,因此软水的起泡量较大。
通过比较不同水样的起泡情况,可以初步判断水的硬度。
除了皂液试剂外,还可以使用专门的硬度试剂来测试水样的硬度。
硬度试剂中通常含有一种与金属离子发生化学反应的指示剂,当水中金属离子的浓度达到一定程度时,指示剂会发生明显的变色反应。
通过观察试剂的颜色变化,可以准确地判断水样中金属离子的含量,从而确定水的硬度程度。
在实验中,我们还可以通过pH试纸来测试水样的酸碱性。
硬水通常含有较多的碱性物质,因此其pH值较高。
而软水则相对中性或稍微偏酸性。
通过测试水样的pH值,可以进一步确认水的硬度,为后续的水处理提供参考。
通过以上实验方法的比较和分析,我们可以得出硬软水检验的一些结论。
首先,硬水对皂液起泡能力的影响是由其中的金属离子所导致的。
硬水中的钙离子和镁离子会与皂液中的活性物质发生反应,降低皂液的起泡能力,使得起泡量减少。
而软水中的金属离子较少,不会影响皂液的起泡,因此起泡量较大。
各地自来水硬度 钙镁离子含量 测试结果

项目地区内蒙古呼而浩特山西运城广西南宁重庆住家用水重庆商场用水福建泉州福建厦门11342008206512051105368477258256249250757754343338325339119119144144257250756341332119144110105338326424286846764171728281183324285661728资料查阅参考值各地自来水硬度钙镁离子含量测试结果总硬度换算成碳酸钙cacomgl钙camgl镁mgmgl内蒙古
75.7 75.4 75.6
34.3 33.8 34.1
32.5 33.9 33.2
11.9 11.9 11.9
14.4 14.4 14.4
11.0 10.5 镁Mg2+(mg/L)
1Hale Waihona Puke .833.8 32.6 33.2
4.2 4.2 4.2
8.6 8.4 8.5
6.7 6.4 6.6
1.7 1.7 1.7
各地自来水硬度(钙镁离子含量)测试结果
项目
内蒙古呼而浩 特
山西运城
总硬度
(换算成碳酸钙 CaCO3含量)
(mg/L)
113.4
200.8
地区 广西南宁 重庆住家用水 重庆商场用水 福建泉州
206.5
120.5
110.5
36.8
福建厦门 47.7
25.8 25.6 钙Ca2+(mg/L)
25.7
24.9 25.0 25.0
2.8 2.8 2.8
资料查阅参考 内蒙古:平均 山西:平均硬 广西:平均硬
值
硬度硬度200 度硬度120 度硬度80
重庆:平均硬度硬度60
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.8 2.8 2.8
资料查阅参考 内蒙古:平均 山西:平均硬 广西:平均硬
值
硬度硬度200 度硬度120 度硬度80
重庆:平均硬度硬度60
福建:平均硬度硬度10
备注: 1、水的硬度是指水中钙、镁离子的浓度,硬度单位是ppm,1ppm代表水中碳酸钙含量1mg/L; 2、水的硬度是将水中的全部盐类换算为碳酸钙来计量,总硬度换算公式=(钙离子含量*100/40)+(镁离子含量 *100/24); 3、当水中的硬度以碳酸钙计小于150mg/L时,称为软水;150—450mg/L时,称为硬水;450—714mg/L时为高硬水;大于 714mg/L时为特硬水。 4、内蒙古呼而浩特、山西运城和广西南宁水质为当地客诉水件结垢问题用水水质。其测试硬度值相对偏高。 5、以上各地区自来水取样均为个例取样,并不能完全代表当地自来水硬度水平,测试值与各对应省的水质硬度平均值存 在一定的差异,测试数据仅供参考。
75.7 75.4 75.6
34.3 33.8 34.1
32.5 33.9 33.2
11.9 11.9 11.9
14.4 14.4 14.4
11.0 10.5 镁Mg2+(mg/L)
11.8
33.8 32.6 33.2
4.2 4.2 4.2
8.6 8.4 8.5
6.7 6.4 6.6
1.7 1.7 1.7
各地自来水硬度(钙镁离子含量)测试结果
项目
内蒙古呼而浩 特
山西运城
总硬度
(换算成碳酸钙 CaCO3含量)
(mg/L)
113.4
重庆商场用水 福建泉州
206.5
120.5
110.5
36.8
福建厦门 47.7
25.8 25.6 钙Ca2+(mg/L)
25.7
24.9 25.0 25.0
