活细胞成像设备的选择
活细胞成像技术的使用教程

活细胞成像技术的使用教程活细胞成像技术是一种能够观察和记录活细胞在活体条件下的实时动态的图像技术。
这种技术在生物医学研究、药物发现、细胞生物学和生物工程领域得到了广泛应用。
本文将介绍活细胞成像技术的基本原理、常用的成像方法和实验步骤,以及一些常见的应用案例。
一、基本原理活细胞成像技术基于显微镜成像原理,通过将活细胞标记或转染成荧光染料、标签蛋白或荧光蛋白,利用显微镜观察和记录这些标记物的荧光信号。
荧光信号可以直接显微镜观察或使用专门的成像设备进行采集和记录。
活细胞成像技术依赖于荧光标记物的特异性和稳定性。
常用的荧光染料或标签包括荧光染料,如荧光素、达菲红和荧光素酮;标签蛋白,如绿色荧光蛋白(GFP)、红色荧光蛋白(RFP)和黄色荧光蛋白(YFP)等。
这些荧光标记物会与特定的生物分子结合,如细胞器、蛋白质、DNA或RNA等。
荧光标记物与目标结合后,通过激发荧光染料吸收光,产生特定波长的荧光信号。
这些信号可以通过荧光显微镜进行实时观察和记录。
二、常用成像方法1. 荧光显微镜荧光显微镜是观察荧光信号的主要工具。
它包括激发光源、滤光片、物镜、荧光探测器和成像系统。
激发光源选择合适波长的激光或白炽灯,滤光片选择对目标荧光信号具有高透射率的滤光片,以减少背景干扰。
荧光探测器可以选择光电倍增管或CCD相机等,用于接收和记录荧光信号。
成像系统可以是显微镜附件或独立的荧光成像仪。
2. 皮肤窗准备法皮肤窗准备法是一种常用的动物模型实验方法,可以观察和记录活细胞在活体动物皮肤上的实时图像。
在这种方法中,通过手术将活体动物的皮肤上形成一个窗口,并标记活细胞,然后使用荧光显微镜观察和记录细胞的活动和变化。
这种方法可用于研究细胞迁移、细胞分裂、血管生成等生物过程。
三、实验步骤1. 准备样品根据实验需要选择合适的细胞系,培养到合适的生长状态。
根据实验目的选择适当的荧光标记物或标签蛋白,将其转染到细胞中。
确保标记物与目标分子结合后的效果和细胞生理状态正常。
TCB9-2活细胞工作站

活细胞高速共聚焦成像分析系统背景为适应目前对活细胞成像速度的要求,高速活细胞共聚焦显微镜应运而生,它们大大提高了成像速度,在取得高质量图像的同时,尽量保护样品,减少荧光淬灭,捕捉活细胞长时间动态变化,在生物学中得到广泛应用。
分类(根据扫描单元不同)(一)碟片式共聚焦1、高灵敏度、高分辨率的EMCCD2、YOKOGAWA CSU22/10共聚焦扫描单元3、电动载物台、快速聚焦单元4、细胞培养小室共聚焦扫描单元EMCCD电动载物台细胞培养小室分类(根据扫描单元不同)特点:1、高灵敏度2、高速成像3、低光毒性、光漂白4、多种实验技术应用分类(根据扫描单元不同)(二)点扫描式共聚焦1、PMT2、点扫描共聚焦单元3、电动载物台、快速聚焦单元4、细胞培养小室特点:高分辨率1)细胞迁移与细胞骨架2)细胞分裂与细胞周期3)细胞信号转导4)组织分化与发育5)囊泡和蛋白运输6)生理学和神经科学7)钙离子信号研究8)蛋白质与DNA相互作用9)宿主与病原体相互作用10)癌症研究11)药理研究12)生物物理研究T 细胞,绿色颗粒为HIV 病毒可以精确的跟踪需要观察的细胞记微管蛋白,红色标记染色体Determining the position of the cell division planeVol 424, 1074 -1078 (28 August 2003)T-cell engagement of dendritic cells rapidly rearranges MHC class II transportVol.418、No.6901(29 Aug.’02)细胞核囊泡和微管囊泡运输模式动物4D成像、追踪分析--3D+T光诱导动力学(Photokinesis)020060010001400C e l l C o u n t M itochondrial M ass-3-2-1123456400800120016002000T a crineF C C PA ce ta m in o p h e n L o g co m p o un d [礛]M i t o c h o n d r i a l M a s s 020040060080010001200140016001800200000.030.10.3131030Staurosporine [µM]C e l l n u m b e r a n d n u c l e i a r e a [-]什么是高内涵(HCA)细胞成像分析技术?高内涵细胞成像分析系统由三个部分组成:全自动高速显微成像,全自动图像分析和数据管理。
活细胞高速共聚焦成像系统使用说明
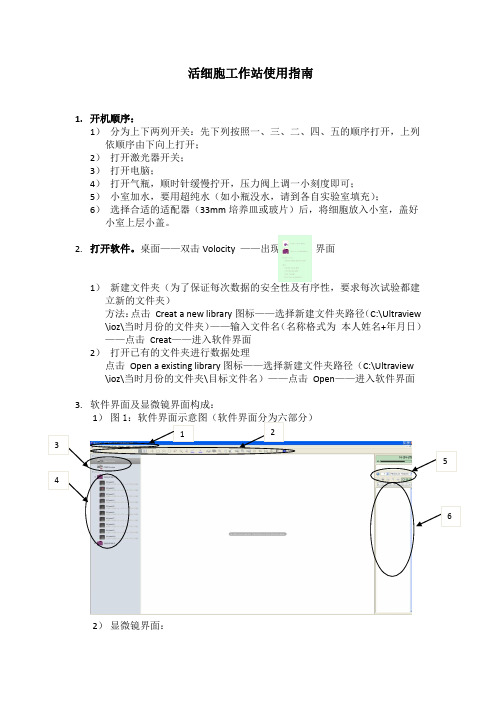
活细胞工作站使用指南1. 开机顺序:1) 分为上下两列开关:先下列按照一、三、二、四、五的顺序打开,上列依顺序由下向上打开;2) 打开激光器开关;3) 打开电脑;4) 打开气瓶,顺时针缓慢拧开,压力阀上调一小刻度即可;5) 小室加水,要用超纯水(如小瓶没水,请到各自实验室填充);6) 选择合适的适配器(33mm 培养皿或玻片)后,将细胞放入小室,盖好小室上层小盖。
2. 打开软件。
桌面——双击Volocity ——出现 界面1) 新建文件夹(为了保证每次数据的安全性及有序性,要求每次试验都建立新的文件夹)方法:点击 Creat a new library 图标——选择新建文件夹路径(C:\Ultraview \ioz\当时月份的文件夹)——输入文件名(名称格式为 本人姓名+年月日)——点击 Creat ——进入软件界面2) 打开已有的文件夹进行数据处理点击 Open a existing library 图标——选择新建文件夹路径(C:\Ultraview \ioz\当时月份的文件夹\目标文件名)——点击 Open ——进入软件界面3. 软件界面及显微镜界面构成:2) 显微镜界面:图2:显微镜正面示意图(学生可操作的部分有两部分):图44. UltraVIEW VoX 图像采集简要操作流程1) 将样品放入小室,盖好小室上层小盖;2) 打开软件,单击图1 第三部分中的“video preview ”图标,点击图1 第六部分中的⑦打开明场光路;3) 选择合适的物镜后在显微镜下调整样品对焦;4) 点击图2.第一部分中的“L100”将显微镜光路切换至共聚焦成像模式;5) 选择合适的激光通路6) 依次调节各路激光的激光功率,敏感度(sensitivity )及曝光时间(exposure time );激光功率最大一般控制在40%左右,如果荧光较弱,敏感度可以拉的很大,但曝光时间一般最大控制在500ms 左右。
3D数字共聚焦活细胞成像分析系统

双相机检测器。
7
LCD触摸彩色显示器,分辨率1920x1080像素。
8
显微图像控制与分析软件。
9
图像工作站
9.1
外部PC,配备Microsoft Windows 10操作系统,英特尔i7-8700处理器,32G DDR4内存,512G硬盘,NVDIA Quadro P1000独立显卡。
9.2
输出端口:多个USB 0和USB 2.0端口以及DVI(或HDMI)端口,支持直接输出至USB和连接至大屏幕。
2.12
原装活细胞模块的上盖不少于3层,包含一层透明玻璃用于明场成像,一层茶色玻璃,用于明场和荧光同时成像,一层全黑塑料,用于纯荧光成像。
2.13
触摸屏或鼠标控制的X-Y精密扫描载物台,可移动范围≥120mm × 80 mm,亚微米级别分辨率,具有长时间稳定性。
2.14
载物台速度可调,移动速度需满足:具有3档移动速度:慢速(小于等于30 μm/s)、中速(小于等于60 μm/s)和快速(小于等于100 μm/s),重复精度小于1 μm。
2.20
获取的图像需满足:可输出单色和彩色图片JPEG,TIFF或RAW图像格式,普通图像分析软件即可打开,也可输出延时AVI和实时录像AVI格式视频文件。
2.21
成像速度需满足:96孔板单通道扫描≤1.5 min/板,3通道扫描≤4.5 min/板。
2.22
操作和自带分析软件需支持至少中文和英文语言,且不限安装次数。
2.2
具有至少5位电动物镜转盘,包含4-100x,仪器可支持1.25-100×,并可配置1.25-100×各种高NA值物镜以及油镜。
2.3
相差环需满足:至少适用于4×、10×、20×、40×物镜。
FRET暨活细胞显微成像系统

荧光共振能量转移(FRET)影像系统Olympus(北京)销售服务有限公司上海分公司PDF created with pdfFactory Pro trial version 荧光共振能量转移(FRET)影像系统一、研究目的随着生命科学研究的不断深入, 光学显微镜使我们理解了细胞结构和有关功能。
但是分子 生物学研究已经显示了分子事件,例如信号传导和基因翻译,需要蛋白质的装配成特殊的大 分子复合体等。
对各种生命现象发生的机制,特别是对细胞内蛋白质间相互作用的研究变得尤 为重要。
传统的生物物理或生物化学方法例如亲和色谱法或免疫沉淀反应法和近来的酵母双杂 交、磷酸化抗体、免疫荧光、放射性标记等方法等,都需要破碎细胞或对细胞造成损伤,无 法做到在活细胞生理条件下实时地对细胞内蛋白质-蛋白质间相互作用进行动态研究。
而基于强度的影像技术FRET方法,使得研究活细胞内的这些相互作用变得容易了,荧光 共振能量转移( FRET)是用于对生物大分子之间相互作用定性、定量检测的一种有效方法。
根 据所基于的荧光显微镜配置不同而有不同的应用侧重,可在多细胞,单细胞,细胞膜,细胞 器等不同层次对生物大分子间的相互作用距离,动力学特性等进行研究。
二、FRET的原理和实现方法FRET的原理和发生的基本条件:1. 2. 3. 4. 发色团之间的距离在10A到100A 。
供体D的荧光光谱和受体A的吸收光谱足够多的重叠。
供体D的量子产率和受体A的吸收系数足够大。
D和A的跃迁偶极矩有最佳的相对取向,或者两者之一有一定的快速旋转的自由度。
FRET的实现方法:1) 稳态方法(基于供体、受体的三通道计算校准) 供体荧光的减弱-主要的方法 受体荧光的增强 激发光谱和吸收光谱的比较 2) 3) 光漂白方法 (Pb-FRET) 时间分辨方法(TR-FRET) 供体荧光的衰减 受体荧光的增长PDF created with pdfFactory Pro trial version FRET 特点:1) 动态实验,采集速度快 / 高速Shutter、高速CCD 2) 3) 4) 维持活细胞活性-CO2培养箱、恒温培养箱、恒温板 尽量减少光毒性,减少光照时间 保证长时间观察奥林巴斯 FRET 系统组成:1、显微镜 2、光源、高速荧光激发光切换控制和电动光闸 3、电动 XY 载物台 4、环境控制 5、高灵敏度冷 CCD 6、多种部件同时工作的控制软件 7、图像分屏器——DualView三、Olympus FRET系统详细技术参数一)显微镜:Optics 光学性能Ø 光学系统(Optical System): 奥林巴斯 2005 年最新推出的 UIS2 无限 远光学系统(UIS2 Infinity optical system) (UIS2 光学系统具有的高光 透过率和全光谱范围的色差校正,及高信噪比的特点,非常适合荧光 方面的研究,可以说是目前最先进的光学系统之一) 光路设计: V型光路把反射时的光线损失减少到最小程度,保证最大光 通过量System Flexibility系统适应性Ø Ø Ø 光口: 双层多光口设计(奥林巴斯首创)保证了输入/输出灵活性,提 供 6 条射入/射出光路,最多可同时接 4 路采集原像的图像获取系统。
活细胞成像工作站-丁香通-你的实验室采购专家

活细胞成像⼯作站-丁⾹通-你的实验室采购专家MetaMorph 活细胞成像分析系统 MM-LCI在维持细胞长时间存活过程中,必须保证在观察过程中给细胞最⼩的刺激(光毒性、光漂⽩等)和获得尽可能清晰的细胞图像。
MetaMorph活细胞系统结合多种先进技术,呵护细胞,清晰呈现。
在进⾏长时间的活细胞成像和观察中,需要保证活细胞⽣存所需最基本的温度、湿度、CO2等条件,以确保细胞正常⽣长代谢MetaMorph活细胞成像系统,在保证细胞⽣长存活的同时,能够最⼤限度的降低细胞损害,并能获得清晰的细胞多维图像,满⾜活细胞各个⽅⾯观察和研究的需要。
优化⾼效的⼯作流程能够清晰呈现细胞图像,并获得⽆偏移的分析结果。
■精准、清晰新的反卷积提供了实时的反卷积功能■充分保护活细胞降低细胞光照射,为细胞提供保护,获得细胞最真实的影像■从宏观到细节同时获得相同细胞的微观和宏观图像■从平⾯到⽴体4D浏览,获知细胞的所有结构随时间发⽣的位移变化和转移过程,获得前所未有的深层细胞信息获取准确清晰的细胞图像■精准、清晰新的反卷积提供了实时的反卷积功能■充分保护活细胞降低细胞光照射,为细胞提供保护,获得细胞最真实的影像准确、清晰充分保护细胞■灵活的光学系统MetaMorph 活细胞系统能够配合Leica 、Nikon 、Olympus 、Zeiss 显微镜,结合各品牌显微镜的成像优势,获得⽆以伦⽐的成像效果。
■3D 反卷积和实时反卷积捕获的荧光图像通过强⼤的3D 反卷积和实时反卷积提⾼⽔平和Z 轴的分辨率,获得更⾼的信噪⽐和图像质量,并能恢复由于光学系统导致的信号损失。
■⾼精度的载物台系统采⽤⾼精度回馈电路XY 载物台系统,速度快,精度⾼,最⼩步进可达20nm ,适合活细胞连续观察过程中的精确定位,⽀持多孔板、玻⽚、培养⽫等各种样品。
实时反卷积使⽤前后的图像对⽐■远红外⾃动对焦及防漂移系统能够快速聚焦找到细胞,同时对细胞⽆光毒性和光漂⽩作⽤。
活体成像技术-活细胞成像

整体水平和组织水平研究方法活体成像技术活体成像技术,即可见光成像技术,是在小动物活体内细胞和分子水平上进行生物学行为研究的一项技术,是近年来发展最快的生命科学和药物学的研究方法,是最直接观察细胞和分子在体内行为的一项新兴技术。
多模式活体成像是当今可见光成像的最新技术潮流,不仅由荧光、生物发光和同位素三种成像方法构成完整的功能成像体系,还有X光成像提供结构成像,二者相叠加,实现特异性信号的精确定位,真正体现活体成像技术的两大技术优势—空间上的分布和时间上的变化。
对于生命科学和药物学等研究而言,了解横向空间上的分布和纵向时间上的变化尤其重要。
要了解所研究对象的特性,就必须掌握其进入体内后在各脏器和组织的分布情况,就必须进行精确的定位,现阶段这一点必须借助X光成像系统来实现。
同时,还必须掌握所研究的对象在时间上的变化,即代谢情况。
这一点,包括两种含义,即要了解同一器官不同时间量上的变化,也要了解不同时间点不同脏器内分布的变化,同样离不开精确的定位。
1.肿瘤方面的应用(应用的成像技术:X光、荧光、发光)例一:使用荷有4T1luc肿瘤细胞的小鼠模型;肿瘤细胞稳定表达生物素酶,通过生物发光技术显示肿瘤位置;用CY5.5近红外荧光染料标记VEGF(血管内皮生长因子)的单链抗体,静脉注射后,采用荧光成像技术显示抗体体内分布和代谢信息。
活体成像表明,这种抗体可以特异性结合到肿瘤细胞上,成为一种新的肿瘤标示物。
Marina V Backer1, Zoya Levashova, NATURE MEDICINE 2007, 13(4):504-509例二:前列腺癌的生物发光成像:深层的前列腺癌成像,辅以肾造影剂显示的膀胱显影,进行精确的肿瘤定位。
例三:肺癌的生物发光成像:深层脏器的生物发光成像。
B, time course for the in vivo imaging of primarytumor and tumor metastasis (arrows) in xenografts of PC-3 and DU145transfected with DsRed2、药学研究的应用(使用X光、同位素和荧光三种模块)例一:CCPM是一种新型的荧光染料,可以用作肿瘤细胞的特异性标示;DTPA 则为常见原料药。
一设备名称技术参数及功能要求

一设备名称技术参数及功能要求一、设备名称、技术参数及功能要求:(一)、活细胞显微成像系统1、研究级倒置荧光显微镜:*1.1光学系统:1.1.1、采用ICCS色差、反差双重矫正无限远光学系统,高分辨率、高反差、高色还原。
1.1.2、国际标准的45mm物镜齐焦距离;1.1.3、可建立明场、相差、荧光以及DIC等多种观察方式;1.1.4、不用化学药品的绿色环保防霉技术。
*1.2主机:根据人机工程学原理设计的主机,1.2.1、高效率V型光路设计,性能优越;光程短,有利于镜下观察以及成像1.2.2、全金属结构,稳定性强,避免由于震动对观察的影响1.2.3、主要工作部件一体化设计,从而避免或减少由于机体受热,各部件受热不均造成的影像漂移*1.3调焦机构:显微镜内置电动调焦驱动马达,最小步进:10nm,调焦行程:10mm,同轴、独立的粗微调焦手柄,防漂移设计,调焦限位,电动的从聚焦位置移出/复位功能。
1.4透射光照明系统:1.4.1、显微镜透射光源:超长寿命高亮度卤素灯。
1.4.2、根据所用物镜,光源自动匹配适当亮度。
1.4.3、聚光镜:工作距离≥26mm;数值孔径≥0.551.5荧光系统:1.5.1、复消色差荧光光路,显微镜内置高速电动光闸,实现快速荧光开/关控制。
1.5.2、长寿命金属卤化物灯荧光光源,使用寿命≥2000h。
1.5.3、六位电动滤色镜转盘,含蓝/绿/红/红外5个带通激发滤色镜组件,带光陷阱技术以消除杂散光。
1.6目镜筒360度自由旋转;上下自由翻转1.7目镜一对:10X,视场数≥23mm。
1.8六位电动物镜转换器,具有自动齐焦功能。
*1.9全套微分干涉(DIC)附件,针对每颗物镜的优化设计,每颗物镜对应一个DIC棱镜。
1.10物镜:针对共聚焦显微镜应用优化的高分辨率、高透过率平场复消色差物镜:1.10.1、5X,增强反差型平场荧光物镜5X,数值孔径≥0.16;1.10.2、10X,增强反差型平场荧光物镜,数值孔径≥0.30;1.10.3、20X,超长工作距离相差荧光物镜,数值孔径≥0.4,1.10.4、40X,超长工作距离相差荧光物镜,数值孔径≥0.60;*1.10.5、20X,平常复消色差物镜,数值孔径≥0.8;*1.10.6、40X,平常复消色差物镜,数值孔径≥0.95;1.11可通过触控屏、机身按钮和共聚焦软件控制显微镜并显示工作状态。
活细胞工作站的使用及常见问题分析

活细胞工作站的使用及常见问题分析作者:槐玉英宋瑞龙来源:《科技视界》2020年第16期摘要活细胞工作站可为体外细胞提供生存环境并维持细胞在较长时间内的正常生长繁殖,该设备便于细胞内或细胞间物质代谢的追踪观察,现已成为生物学领域中的一种热门研究手段。
本文概述了该设备的操作方法及常见问题,供大家参考。
关键词活细胞工作站;样品制备;应用;常见问题中图分类号: Q2-33 ; ; ; ; ; ; ; ; ; ; ;文献标识码: ADOI:10.19694/ki.issn2095-2457.2020.16.085AbstractThe live cell imaging system can provide a living environment for cells in vitro and maintain the normal growth and reproduction of cells for a long time.It is convenient for tracking and observing the metabolic of intracellular or intercellular substance.It has become a popular research method in the biological field.This paper outlines the operation and common problems of the live cell imaging system.Key WordsLive cell imaging system;Sample preparation;Application;Common problems活细胞工作站是在倒置荧光显微镜基础上实现长时间、连续观察活细胞培养并能连续采集图像的成像系统,可对细胞内或细胞间的物质代谢或信息传递进行动态观察。
细胞成像系统等设备参考技术参数

细胞成像系统等设备参考技术参数设备名称数量招标参数细胞成像系统 2 1、仪器需要可长时间放置于超净工作台内使用;2.2物镜:标配4×、10×、20×、100×物镜,长工作距离相差物镜,可用于明场、相差观察2、物镜转盘:4位(手动控制)3、对照方法:透射光(明场和相差)4、光源:透射光LED(≥5万小时寿命),可调强度5、聚光镜工作距离:60mm6、照相机:高灵敏CMOS彩色照相机,310万像素7、载物台:机械载物台,机械载物台配有X-Y轴控制和容器支架适配框8、LCD显示器:12.1英寸彩色;显示分辨率1024 × 768像素;倾斜度可调9、图像采集:内置成像软件通过机身机械按钮和鼠标屏幕操作共同完成采集和存储功能10、获取的图像:24位彩色TIFF, BMP和JPG;2048 × 1536像素11、电源:交流电源适配器,100-240 V,47-63 Hz;最大电流0.58 A;输出功率最大24 W12、输出端口:成像系统主机上不少于2个USB接口蛋白纯化系统 1 1 工作条件1.1工作温度: 4 - 40 ℃1.2相对湿度:10-95%1.3溶剂兼容:所有层析常用缓冲溶液2 技术规格2.1触摸式按键面板,整套系统(包括系统泵、紫外检测器、电导检测器、组分收集器等)采用一体化集成设计2.2 系统泵2.2.1 具有耐腐蚀性和生物兼容性,内置活塞清洗功能2.2.2 泵类型:活塞泵2.2.3 流速:0.1 - 50 ml/min (梯度模式),增量:0.1ml/min2.2.4压力范围:0-1 MPa (10bar, 145 psi)2.2.5 泵控制器:可进行设定和编程,控制泵进行梯度洗脱,梯度范围:0%-100%2.2.6 适用粘度范围:0-10cP2.2.7混合器混合模式:电动搅拌混合2.3 紫外/ 电导检测器2.3.1在线紫外检测:具备检测波长:254nm、280nm2.3.2吸光范围:0.01-5AU2.3.3线性:<3%(254nm、2AU),<5%(280nm、2AU)2.3.4噪声:≤40x10-6AU(254nm),漂移:≤100x10-4AU2.3.5最大压力:4MPa(40bar, 580psi),流速:0-100ml/min2.3.6流通池光径长度:2mm2.3.7在线电导检测,电导检测范围:≥1μS/cm – 999.9 mS/cm 2.4组分收集器2.4.1收集模式:体积收集、峰收集2.4.2试管载量:≥15mm试管架:≥90根2.6其他2.6.1进样阀模式:上样、进样、冲洗2.6.2上样环类型:100μL、2000μL 、5000μL2.6.3自动压力传感器:系统一旦超压(如层析柱堵塞),压力传感器能防止柱损坏2.7自动收集软件:可通过电脑在线监测峰型、电导值、紫外吸收等参数,并可通过电脑直接控制、存储图形和数据3 产品基本配置要求3.1 快速蛋白纯化工艺优化工作站:1台(包括包括系统泵、紫外/电导检测器、组分收集器、混合器、压力传感器、缓冲液阀、梯度形成阀、上样阀、三通阀等);计算机:1台3.2 保证仪器设备的正常运行和常规保养所需的附件、专用工具和消耗品3.3 整机零部件2年保修超低温冰箱 1 1、内部容积:不小于490L,2英寸冻存盒容量不少于320 个2、压缩机:2台1.5 HP国际知名品牌工业级高效压缩机,杜邦制冷剂,无CFC,无HCFC,阻燃3、工作温度:-50℃至-86℃4、工作电压:208-240V宽工作电压范围,带时间延迟断路器5、Boost/Buck电压及电流补偿器,当电压异常和电流异常时,保证冰箱的正常运行6、标配两台冷凝风扇智能开停,高效节能7、箱体结构:重型冷轧钢箱体结构,粉末涂层外壁,盐喷测试超过1000小时;镀锌钢内壁,可选配不锈钢内壁,便于清洗耐腐蚀;3块可调节高度的不锈钢搁板;工业级门铰链不易变形,确保良好的密封性,8、标配四扇内门,减少冷气丢失9、具有良好的保温性能,断电时,空载的情况下从-80℃升温到-50℃的时间不低于234 分钟10、压缩机高效强劲,空载情况下,内外门全开一分钟后关闭,冰箱回温到-75℃的时间不超过33 分钟11、三点四层式门密封条,提供极佳的保温性能12、单手操作门把手,可锁定并可同时增加一挂锁,提高安全性13、预留外接端口,可连接外部探头或仪器14、标配4-20mA, RS-485 以及dry contacts数据输出端口15、标配冷凝器过滤网,易拆卸,可水洗, 保护冷凝器免沾灰尘,提高制冷性能16、外门配有带加热功能的自动减压阀,可在关门后迅速平衡冰箱门内外压差,方便高度密封的外门30-60秒内再次单手轻松开启17、全电脑控制和信息显示中心可进行多种状态和参数显示,提供九种报警提示: 过温,温度不足,门过久开启,断电,温度探头损坏,电源错误,后备电池需充电,压缩机故障,制冷电路损坏18、重型脚轮,方便移动和固定冰箱19、冰箱底部装有消声器和吸音泡沫,能大大减少噪音,运行安静20、后备电池在断电情况下为监控报警系统供电长达72小时21、可以选配液态CO2和液氮后备制冷系统,可在断电和冰箱故障时启动,使样品保持-60℃以下低温22、可选配6英寸(15.2cm)图表温度记录仪,连续记录七天温度,符合验证和法规要求23、整机零部件2年保修,压缩机2年延保;二氧化碳培养箱 1 1、工作体积:不小于150升2、具有玻璃内门和不锈钢内壁3、搁板数目:4块4、温度控制范围:高于室温5℃~55℃5、温度控制精度:±0.1℃6、温度均一性: ±0.2℃(在37℃下)7、温度跟踪报警:有8、温度显示:LED9、保温方式:水套10、二氧化碳控制范围:0~20%11、二氧化碳控制精度:±0.1%12、二氧化碳跟踪报警:有13、二氧化碳浓度恢复:3分钟内达到5±0.2%14、二氧化碳浓度控制:TC 热导传感器15、氧气浓度范围:1-20%16、氧气传感器:燃烧池17、用户编程上下限可跟踪报警18、HEPA高效过滤系统在关门5分钟内使腔体达到100级洁净指标,每隔1分钟腔体内空气自动过滤循环一次19、具有程序自检功能20、显示控制:LED数字显示温度和二氧化碳浓度和氧气浓度21、断电自动启动:有22、加热玻璃内门,防止腔体内玻璃上形成冷凝水,造成污染23、银离子水盘污染防护24、AquaTec银离子消毒技术,消除水源污染25、整机零部件2年保修超微量核酸蛋白检测仪 1 1、最小样品体积:1ul;2、检测下限:基座2ng/ul(dsDNA);基座0.06mg/ml(BSA);基座0.03mg/ml(IgG);3、检测上限:基座27,500ng/ul(dsDNA);基座820mg/ml(BSA);基座400mg/ml(IgG);4、检测重复性:0.002A(1.0mm光程) 或1%CV;5、波长范围:190-850nm连续波长全光谱分析;6、波长精度:±1nm;7、光吸收范围:基座0-550A(10mm光路径);8、光吸收准确度:3%(at 0.97A at 302nm);9、光谱分辨率:≤1.8nm(FWHM at Hg254nm);10、光路径:内含0.03,0.05,0.1,0.2,1mm 5个光程,根据样品浓度进行自动匹配最佳光程,无需手工设置,光程调节器不会曝露在空气中,避免灰尘,纸屑或液体进入生锈导致光程不准确;11、显示器:高分辨率彩色显示屏;12、触摸屏:多点电容式触摸;13、手套兼容性:兼容实验室手套;14、连接方式:3个USB插口,以太网,蓝牙,Wi-Fi;15、免费下载电脑软件,用于分析仪器导出的结果;16、可加配:标签打印机,蓝牙键盘,蓝牙鼠标;17、具备Acclaro智能样本检测技术可进行污染物鉴定和结果校正,保证样本精确的浓度和样本的质量,鉴定出的污染物可帮助我们优化样本提取的实验;18、具有摄像头,对结果可疑样品进行上样液柱中气泡,形态完整等的拍照监测,保证样本检测时无杂散光干扰,排除样本液柱塌陷等带来的检测不准确;19、支持的应用:核酸A260,A260/A280,A260/A230和标记的核酸;蛋白A280和A205,蛋白Pierce660,蛋白Bradford,蛋白BCA,蛋白Lowry,标记蛋白;OD600,动力学,UV-Vis,和用户自定义;具备Acclaro智能样本检测技术。
活细胞工作站 及应用案例简介

活细胞工作站及应用案例介绍关键词:活细胞工作站,CV1000,6D 活细胞成像,3D 成像,激光共聚焦显微镜,四转盘扫描,双转盘扫描,YOKOGAWA,最长扫描时间活细胞工作站可实现在细胞水平上的定性和定量分析、活细胞图像处理、活细胞动态示踪。
在分子水平上,可做到基因定位定量表达的动态分析、蛋白质合成讲解运输和相互作用的动态研究、细胞骨架的代谢动力学测定和细胞周期各时相的动态观察等。
现在市场上有众多的活细胞工作站、激光共聚焦观察系统等,下面以Yokogawa 的CV1000 为例介绍此类型的活细胞工作站。
CV1000 活细胞动态成像系统是定位于长时间、多时相、6D 活细胞成像的一体化共聚焦系统,它整合了显微镜,共聚焦光路系统,以及活细胞工作站等诸多模块于一体,不需暗室操作并且集成了温度、湿度控制等繁琐过程。
整套安装简易,操作简单,使用方便,并且厂家携代理商提供完善的售后服务。
CV1000 使用的四转盘共聚焦扫描头,最大限度地降低了光毒性和光漂白。
CV1000 是目前唯一的能长时间对胚胎做3D 成像,然后被观察的胚胎细胞能顺利发育为健康成体小鼠的系统。
该系统的精确的温度控制系统(精确度可达0.1℃),使得干细胞,胚胎,以及其他细胞可在稳定的温度环境中生长,精确地完成您的实验操作。
四转盘共聚焦扫描系统,以及独一无二的为转盘共聚焦优化的双针孔设计,为活细胞的观察在技术水平上提供了双保险,使得CV1000 更适合于非常适合于精确度要求极高的生命过程的观察,如癌症,发育生物学,干细胞研究等领域的长时高速6D 成像,尤其适合于肿瘤细胞的增殖和迁移,干细胞增殖和分化,iPS 细胞成像,胚胎发育,转基因细胞,细胞周期观察等领域。
此外,在活细胞观察中至关重要的温度控制,不仅可以影响活细胞在观察过程中的生长状态,还会引起Z 轴漂移。
YOKOGAWA 在CV1000 严格控制了机箱内的温度,结合其一体化的设计使得温度控制可精确到0.1℃,并在检测的14 天范围内保持恒定。
活体成像技术及其应用

活体成像技术及其应用随着科学技术的不断发展,越来越多的技术被开发和应用到生命领域中。
其中,活体成像技术是近年来发展迅速的一种生命科学技术。
它可以以非侵入性的方式观察生物体内部的生物学过程,帮助我们更加深入地了解生命现象,同时也有许多应用。
一、活体成像技术活体成像技术是一种通过非侵入性手段,以非破坏性的方式观察动态生物过程的技术。
它主要利用光学、荧光、磁共振成像等方法,通过对生物体内的活体成像标记的识别和追踪,对生物体进行观察和分析。
其中,生物体内活体成像标记的种类很多,例如荧光蛋白,纳米粒子等等,这些标记都能够在我们观察和分析生物体的过程中提供有效的帮助。
此外,活体成像技术还涉及到成像仪器的类型、成像条件的选择等等。
二、活体成像技术的应用活体成像技术在生命领域中有许多应用。
以下是其中的几个方面:1、药物开发活体成像技术可以帮助研究员在生物体内快速地筛选出药物,加速药物研究开发过程,提高研发效率。
同时,活体成像技术还可以帮助研究员推测药物的药效,研究其机理。
2、疾病诊断活体成像技术可以帮助研究人员深入了解某些疾病的病理和分子机制,提高疾病的诊断速度和准确性。
例如,该技术可以在体内观察炎症、肿瘤等生物系统的形态学和生物学变化,从而为疾病的诊断和治疗提供指导。
3、生物学基础研究活体成像技术可以帮助研究人员更加深入地了解动态生物过程的本质。
例如,该技术可以快速地观察细胞分裂、细胞活动、神经元的运动等等的生物学过程,有助于研究人员更好地理解生命现象的原理和规律。
三、活体成像技术的局限性和发展活体成像技术的应用和发展得到了越来越多的关注,但在其应用过程中也存在一些局限性,导致技术的进一步完善和优化。
1、分子探针的选择活体成像技术需要用到分子探针来标记生物体,而不同的分子探针在不同的物理条件下会发生不同的变化,可能会导致活体成像的误差。
因此,分子探针的选择对于活体成像技术的准确性至关重要,研究员需要在对不同的分子探针进行测试研究的过程中选出最适用的标记物质。
专业成像系统 活细胞内 (钙 )离子比例成像分析系统

专业成像系统活细胞内(钙)离子比例成像分析系统系统组成及系统优势--高灵敏度与高速度结合* Nikon/Olympus/Zeiss/Leica倒置荧光显微镜* 系统采用制冷式、高灵敏度的CCD或EMCCD相机来进行活细胞内(钙)离子比例成像的实验,具有系统灵敏度高, 速度快,实时响应的特点。
推荐采用:1,Coolsnap ES2:无风扇设计的制冷型、高灵敏度CCD相机,价格经济,是常规钙离子成像的最佳选择。
2,QUANTEM:512SC:Roper公司最新推出的EMCCD,具有单分子超高探测灵敏度的同时,更有100fps以上的成像速度。
3,Cascade:128+:500fps以上超高速成像的EMCCD相机,是超高速与超高灵敏度的完美结合。
* 采用单色仪或滤光片转轮的高速波长切换器件,切换速度可小于2ms。
是世界上同类产品中波长切换速度最快的。
推荐采用:1,英国Cairn Research公司单色仪系统(含150W/300W氙灯光源)。
波长在200nm-700nm范围内连续可调,300nm-500nm范围内任意波长切换速度可高达1ms。
2,美国Sutter公司DG-4超高速滤光片转换器(世界上高速离子成像最常用的波长转换器件)。
包含175W氙灯光源,光纤导出;最快切换速度小于1.2ms。
可同时放置4片25mm滤光片,更换滤光片操作简便。
3,美国Sutter公司滤光片转轮系统: 可同时放置10片滤光片,切换速度小于55ms。
并包含电子快门系统。
* 最专业的离子比例成像分析软件,易于操作掌握。
推荐采用:1,MetaFluor:全世界钙离子成像分析领域最专业、最知名的软件系统。
2,MetaFluor/MetaMorph:离子成像分析与通用生物成像分析的完美结合。
* 可选滤光片组:。
活细胞离子成像分析系统技术参数-20160321

活细胞部分:1.多维立体温控活细胞培养装置*1.1.支持培养皿和多孔板(6-1536孔)1.2.具有地面、侧壁、上盖以及物镜加热功能,温度控制范围:室温+3℃-45℃1.3.>90%饱和湿度控制1.4.CO2浓度控制范围为1-20%2.高速通道切换器,*2.1.≥10位的滤色片转轮。
2.2.通道切换时间<40ms。
2.3.非皮带,直接驱动模式3.固态光源3.1.白光固态光源,≥10000小时寿命,3.2.能够实现多通道荧光的瞬间切换。
满足多种荧光通道的快速成像。
*3.3.波长范围:380-680nm3.4.开关时间:10us4.检测器*4.1.高灵敏度高速度sCMOS检测器,550万像素*4.2.分辨率:2560x2160*4.3.像素大小:6.5x6.5um4.4.动态范围:25000:15.载物台*5.1.高精度Z轴,最小步进50nm5.2.具有自动聚焦功能,提高成像速度6.多维图像获取专用控制窗口,可以同时获取时间序列(timelapse),多通道(multiple wavelengths),Z轴序列(Z series)图像,并可以在多维图像获取过程中插入用户自定义的宏,弹性调整图像获流程,并支持一次实验中不同位点不同倍数、不同波长的各种不同方式的观察和成像。
7.支持FRET分析功能,FRET专用分析界面能够实现受体漂白法,受体敏感法等FRET测量,必须提供五篇以上已发表的文献支持。
8.Ratio测量功能,能够进行多通道亮度比例变化的显示和测量9.具有自动距离测量功能,能够自动计算和分析细胞或细胞内结构相互距离的变化10.玻片拼接专用控制窗口,可以进行多通道的玻片多个不同视野的成像,并且拼接为一幅高分辨率的完整图像。
11.Stream功能,在不需要信号触发线组的情况下,可控制相机和其他硬件(例如:光源)进行无间断高速的图像撷取。
12.实时回看功能,开启实时回看功能之后,用户获取图像时,软件会按照设定把此时间点前后的图像也同时保存。
全自动荧光成像活细胞成像系统

1.5.观察方式:荧光与透射光(明场和相差)
1.6.荧光通道:标配DAPI、GFP、RFP三种荧光光立方,荧光滤片采用高光效硬质带通滤片
1.7.荧光光立方装载后软件自动读取荧光滤片信息,无需额外设置
1.8.光源:LED(5万小时寿命),可调强度,无需预热,实验后无需降温,即开即用
1.15.电源:交流电源适配器,100-240 V,50-60 Hz;输入电流5 A,24 W
1.16.输出端口:多个USB接口,1个DVI端口(支持直接输出至USB和网络存储)
2.软件
2.1.具有集成的软件系统,内置软件可通过鼠标操控,也可以通过触摸屏显示器操作;具备多种标准功能,如快速的多通道荧光或明场下的图片捕获及叠加,添加标尺和图像预览。所有的图像均可保存为JPEG、BMP摸屏;显示分辨率不低于1024 × 768像素;倾斜度可调
1.13.图像采集:可通过触屏操作完成采集和存储功能,内置成像软件可自动调焦,可对成像图片进行自动细胞分类计数,图像拼接,也可以进行Z-stack扫描成像和延时成像
1.14.提供原装暗室装置,在自然光实验环境下即可进行荧光样本的观察和图片采集
设备名称
数量
参考技术参数
全自动荧光成像-活细胞分析系统
1台
1.技术指标
1.1.仪器类型:无目镜台式全自动成像分析系统,一键开关设备和软件,通过鼠标屏幕操作完成所有功能,主机可放入超净台使用
1.2.提供彩色相机进行可见光彩色成像,用于彩色组织切片的观察成像
1.3.4个物镜:长工作距离消色差物镜4x/0.13(工作距离16.9mm);长工作距离半复消色差物镜10x/0.3(工作距离8.3mm);长工作距离半复消色差物镜20x/0.45(工作距离7.1mm)、长工作距离半复消色差物镜40×/0.65(工作距离2.8mm)
活细胞成像技术中的光学显微镜设计及应用

活细胞成像技术中的光学显微镜设计及应用活细胞成像技术是生命科学研究中的重要分支,很多研究工作需要对活细胞进行实时、高清、三维成像,从而了解生命活动的分子机制、信号传递等过程。
这就需要相应的光学显微镜设计和技术支撑。
本文将谈到活细胞成像技术中的光学显微镜设计及应用方面。
一、光学显微镜设计在细胞成像中,光学显微镜是最重要的成像工具。
目前,常见的光学显微成像技术包括荧光显微成像、共聚焦显微成像、单分子荧光成像、光片荧光显微成像等。
这些技术基本都是建立在弱荧光成像和高信噪比的基础上,需要有高质量的显微镜设计和成像技术支撑。
1.1 光路设计在荧光显微观察中,特别是全息显微成像中,对所使用光路的光线传输非常关键。
基于正透视式的荧光显微镜构成中,光扫描进行直观分析,比常规的显微镜更有优势。
例如,在光片荧光显微成像系统中,为了满足光路传输,需要设计自动对焦功能。
整个成像精度直接掌握在对脆弱荧光标签的识别上,所以必须严谨对待每一个光路组件的安装,以保证精度不受影响。
1.2 光学材料在光学显微成像中,除了光路的优化设计,我们还需要选用高质量的光学材料,以确保成像清晰并消除残留的像差。
今天,一些先进的显微镜设计中使用的光学材料是非常复杂的,具有顶级的抗衰减性,同时具有较高的荧光倍增器,还具备增强自然光和荧光信号的能力。
1.3 成像系统的计算如果我们要使用光学显微镜进行高品质的荧光成像,就需要对成像系统的设计进行计算。
这些计算包括确定最佳光路长度、光学材料品质、调整照明条件等方面。
同时,还需要考虑采用不同的数字放大技术,例如electron-multiplying CCD (EMCCD) 相机和高速画幅相机等来增强像素,从而实现更高的光线传输质量。
二、光学显微镜的应用除了精良的设计,光学显微镜在活细胞成像技术的应用中也非常重要。
例如,荧光显微镜系统可用于选择性地标记了含有荧光染料的特定细胞组,从而对细胞内分子的移动进行记录。
活细胞成像设备的选择
为活细胞研究设计光学显微系统时,首要考虑的是检测器的敏感度(对信号乃至噪音的检测),图像获取的速度,以及在此基础上标本的可行性。
对于固定细胞的成像,曝光时间及光强度相对来说都很高,这时可能会造成光漂白;然而对于活细胞成像,上述光的影响必须去除。
几乎在所有情况下,活细胞显微镜都会在尽可能高的图像质量与尽可能好的细胞活性之间取得一个平衡。
对于此类实验,时间及空间上的分辨率需要设定在能满足实验要求的水平上,而不是给予过度的光照或设定过多采样时间点。
基本上,一个理想的活细胞成像系统必需有足够的敏感度,来满足在弱荧光条件下仍能得到高图片质量;同时,系统也必需足够快,以记录整个动态过程。
另外,这个系统还需要有足够高的分辨率以捕捉样品细节,并且能够准确的实时测量每个微小的光强变化。
然而不幸的是,要改善上述的任意一条都需建立在牺牲其它性能的基础上。
因此现在还不能够设计出一个可以满足所有要求的活细胞成像体系。
研究人员现在只能在尽量减低不重要的信息的遗失的同时,尽可能的获得最优的重要参数。
这样,显微镜的配置最终取决于成像的要求,对于样品在实验期间活性的要求,进行标记的难度水平,以及仪器的可用性等实际因素。
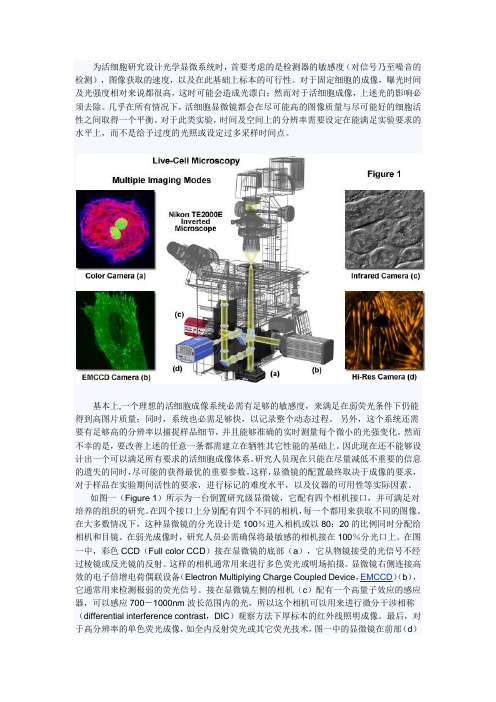
如图一(Figure 1)所示为一台倒置研究级显微镜,它配有四个相机接口,并可满足对培养的组织的研究。
在四个接口上分别配有四个不同的相机,每一个都用来获取不同的图像。
在大多数情况下,这种显微镜的分光设计是100%进入相机或以80:20的比例同时分配给相机和目镜。
在弱光成像时,研究人员必需确保将最敏感的相机接在100%分光口上。
在图一中,彩色CCD(Full color CCD)接在显微镜的底部(a),它从物镜接受的光信号不经过棱镜或反光镜的反射。
这样的相机通常用来进行多色荧光或明场拍摄。
显微镜右侧连接高效的电子倍增电荷偶联设备(Electron Multiplying Charge Coupled Device,EMCCD)(b),它通常用来检测极弱的荧光信号。
活体成像技术-活细胞成像

整体水平和组织水平研究方法活体成像技术活体成像技术,即可见光成像技术,是在小动物活体内细胞和分子水平上进行生物学行为研究的一项技术,是近年来发展最快的生命科学和药物学的研究方法,是最直接观察细胞和分子在体内行为的一项新兴技术。
多模式活体成像是当今可见光成像的最新技术潮流,不仅由荧光、生物发光和同位素三种成像方法构成完整的功能成像体系,还有X光成像提供结构成像,二者相叠加,实现特异性信号的精确定位,真正体现活体成像技术的两大技术优势—空间上的分布和时间上的变化。
对于生命科学和药物学等研究而言,了解横向空间上的分布和纵向时间上的变化尤其重要。
要了解所研究对象的特性,就必须掌握其进入体内后在各脏器和组织的分布情况,就必须进行精确的定位,现阶段这一点必须借助X光成像系统来实现。
同时,还必须掌握所研究的对象在时间上的变化,即代谢情况。
这一点,包括两种含义,即要了解同一器官不同时间量上的变化,也要了解不同时间点不同脏器内分布的变化,同样离不开精确的定位。
1.肿瘤方面的应用(应用的成像技术:X光、荧光、发光)例一:使用荷有4T1luc肿瘤细胞的小鼠模型;肿瘤细胞稳定表达生物素酶,通过生物发光技术显示肿瘤位置;用CY5.5近红外荧光染料标记VEGF(血管内皮生长因子)的单链抗体,静脉注射后,采用荧光成像技术显示抗体体内分布和代谢信息。
活体成像表明,这种抗体可以特异性结合到肿瘤细胞上,成为一种新的肿瘤标示物。
Marina V Backer1, Zoya Levashova, NATURE MEDICINE 2007, 13(4):504-509例二:前列腺癌的生物发光成像:深层的前列腺癌成像,辅以肾造影剂显示的膀胱显影,进行精确的肿瘤定位。
例三:肺癌的生物发光成像:深层脏器的生物发光成像。
B, time course for the in vivo imaging of primarytumor and tumor metastasis (arrows) in xenografts of PC-3 and DU145transfected with DsRed2、药学研究的应用(使用X光、同位素和荧光三种模块)例一:CCPM是一种新型的荧光染料,可以用作肿瘤细胞的特异性标示;DTPA 则为常见原料药。
超高分辨活细胞成像系统技术

GE超高分辨活细胞成像系统利用活细胞成像工作站进行细胞和基因的功能研究,是生物医学研究的最新趋势。
固定细胞观察仅能提供固定瞬间细胞的静态信息,无法反映细胞在正常生理生化条件下的状态。
活细胞观察,对处于正常生理状况下的细胞进行全程扫描和记录,获得其连续、全面、动态过程由于其显示的正常细胞动态的活动过程,很容易发现和确定细胞间相互作用和信号传导的过程,以及在活细胞水平上的生物分子间的相互作用,不仅可以解决长期以来悬而未解的问题,更为未来的研究提出新的问题,指出新的方向。
一、活细胞成像系统原理目前主流的活细胞成像系统从原理上可以分为两大类:➢基于宽场反卷积技术➢基于共聚焦技术两种技术作为目前最流行的活细胞成像技术,均可以实现在维持细胞存活的情况下,快速获取单一焦平面的信号,在具体性能上则各有擅长。
宽场反卷积技术对光线进行反卷积运算是光学成像领域的成熟技术,最早由美国国家航空航天局开发并成为观察微弱天体信号的标准技术。
去卷积和共聚焦技术是光学显微镜领域获得单一焦平面光线的两大主流技术(J.M.Murray, live cell imaging, 2010)。
通过将非焦平面的光线还原至焦平面上,大大提高了样品信号的强度以及图像的信噪比。
由于去卷积技术设计到大量的后期运算,因此在高性能计算机发明以前,一直受制于运算能力,没有得到大规模的推广。
随着近年来计算机性能的大幅提升和价格的下降,去卷积技术逐渐成为光学显微镜的主流技术。
一个点光源经过显微镜的光路,由于镜片对光线的衍射和散射,最终呈现在观察者面前的是一个模糊的点,所以点光源变成模糊的点的过程即为卷积。
反卷积就是把模糊的点还原成点光源的过程。
以API 公司的DeltaVision系统为例,其反卷积过程经历以下几步:1)首先通过无数的计算和实验,得到点光源经过显微镜物镜后变模糊的规律,建立模型。
2)选择完美的物镜,保证样品信号经过物镜后变模糊的规律符合步骤一中得到的模型。
JuLI 高级细胞成像仪活细胞荧光成像仪活细胞观测仪 nanoentek

JuLI高级细胞成像仪活细胞荧光成像仪活细胞观测仪Nanoentek JuLI FL fluorescence live cell movie analyzer Nanoentek JuLI Smart fluorescent cell analyzer digitalbio Nanoentek仪器特点:·将细胞计数和细胞分析两种功能集于一身;·通过荧光和亮光两种方式进行细胞成像;·50,000小时寿命的蓝光LED ;·一键获取图像功能; ·LCD 触摸屏·连续储存的细胞图像可转化成影像资料;·通过新式分析软件可对荧光细胞进行全面分析,使得出芽增殖分析,活细胞计数等数据更加可靠;·通过无线保真技术可轻易将图像、影像等资料传输至PC 。
仪器用途:·活细胞成像;·细胞迁移测定; ·优化细胞分析; ·细胞培养质量控制; ·出芽增殖检测;·GFP 转染细胞定量; ·通过台盼蓝检测存活细胞;活细胞成像活细胞实时动态影像技术操作使用非常简单:第一步:打开蓝LED按钮第二步:将培养板放置在JuLI上第三步:观察结果/保存图像GFP 转染细胞图像白光:Hela细胞12小时内形状变化的时间动态影像荧光:Hela细胞48小时内EGFP表达的时间动态影像仪器参数:电源:AC 100-240V, 50-60HzCPU : AMD AU1250放大率:10x和20x滤光器:激发光、散射光、二向色滤光片光源:白光/蓝光LED(488nm)可选:白光/绿光(532nm)白光/红光(630nm)相机:CMOS 1.3M像素(1280X1024)显示器:7 ’ TFT-LCD (WVGA, 800×480)重量:<5Kg尺寸:220×375×220 mm∙J uLI高级细胞成像仪活细胞荧光成像仪活细胞观测仪∙∙可放在培养箱或生物安全柜中使用,进行活细胞实时观察和时间序列(Time lapse)实验∙Wi-Fi传输:可在iPhone、iPad、PC等终端上进行实时监控,而无需从培养箱中取出∙一体化设计,触屏操控,外观时尚,操作简便∙超长寿命:配置40,000小时的蓝色LED光源(可选红色)∙使用环境无限制:可在任意室内光线(光照或暗室)条件下观察∙三种观察模式,满足不同要求:白光、荧光及叠加模式,图像清晰∙自带图像分析软件:扩展JuLI的应用功能,可进行细胞增殖、迁移、计数、及细胞表面标记物分析等∙仪器用途:∙•活细胞成像;(定时拍摄功能)∙•细胞迁移测定;∙•优化细胞分析;∙•细胞培养质量控制;∙•细胞增殖分析∙∙仪器参数:电源:AC 100-240V, 50-60HzCPU : AMD AU1250放大率:10x和20x滤光器:激发光、散射光、二向色滤光片光源:白光/蓝光LED(488nm)可选:白光/红光(630nm)相机: CMOS 1.3M像素(1280X1024)显示器:7 ’ TFT-LCD (WVGA, 800×480)重量:<5Kg尺寸:220×375×220 mm∙。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
为活细胞研究设计光学显微系统时,首要考虑的是检测器的敏感度(对信号乃至噪音的检测),图像获取的速度,以及在此基础上标本的可行性。
对于固定细胞的成像,曝光时间及光强度相对来说都很高,这时可能会造成光漂白;然而对于活细胞成像,上述光的影响必须去除。
几乎在所有情况下,活细胞显微镜都会在尽可能高的图像质量与尽可能好的细胞活性之间取得一个平衡。
对于此类实验,时间及空间上的分辨率需要设定在能满足实验要求的水平上,而不是给予过度的光照或设定过多采样时间点。
基本上,一个理想的活细胞成像系统必需有足够的敏感度,来满足在弱荧光条件下仍能得到高图片质量;同时,系统也必需足够快,以记录整个动态过程。
另外,这个系统还需要有足够高的分辨率以捕捉样品细节,并且能够准确的实时测量每个微小的光强变化。
然而不幸的是,要改善上述的任意一条都需建立在牺牲其它性能的基础上。
因此现在还不能够设计出一个可以满足所有要求的活细胞成像体系。
研究人员现在只能在尽量减低不重要的信息的遗失的同时,尽可能的获得最优的重要参数。
这样,显微镜的配置最终取决于成像的要求,对于样品在实验期间活性的要求,进行标记的难度水平,以及仪器的可用性等实际因素。
如图一(Figure 1)所示为一台倒置研究级显微镜,它配有四个相机接口,并可满足对培养的组织的研究。
在四个接口上分别配有四个不同的相机,每一个都用来获取不同的图像。
在大多数情况下,这种显微镜的分光设计是100%进入相机或以80:20的比例同时分配给相机和目镜。
在弱光成像时,研究人员必需确保将最敏感的相机接在100%分光口上。
在图一中,彩色CCD(Full color CCD)接在显微镜的底部(a),它从物镜接受的光信号不经过棱镜或反光镜的反射。
这样的相机通常用来进行多色荧光或明场拍摄。
显微镜右侧连接高效的电子倍增电荷偶联设备(Electron Multiplying Charge Coupled Device,EMCCD)(b),它通常用来检测极弱的荧光信号。
接在显微镜左侧的相机(c)配有一个高量子效应的感应器,可以感应700-1000nm 波长范围内的光,所以这个相机可以用来进行微分干涉相称(differential interference contrast,DIC)观察方法下厚标本的红外线照明成像。
最后,对于高分辨率的单色荧光成像,如全内反射荧光或其它荧光技术,图一中的显微镜在前部(d)配备了Peltier-cool 相机。
这个相机最小像素点为6μm,适合于此类成像的需求。
如图一中的配置非常昂贵,但是它能满足用户所有的成像要求。
进行活细胞成像的光学显微镜需要宽光谱增称模块。
大多数的研究者使用荧光显微镜,通常还会配合一种或多种透射光技术。
其中荧光技术包括了传统的宽视场落射荧光,激光扫描共聚焦,真空碟片共聚焦,场扫描共聚焦,多光子,全内反射(TIRF),荧光关联光谱,荧光寿命成像(FILM),光活化,镭射陷阱等技术。
相应的成像技术有光谱成像,多色成像,共定位,时间序列,荧光光漂白恢复,(FRAP,FLIP,FLAP),荧光共振能量转移(FRET),荧光散斑显微镜,膜片钳技术等,以上这些技术通常要配合一种或多种基础成像技术。
当荧光与明场,DIC,霍夫曼调制相称(HMC),相差等技术相结合时,荧光技术作为探针,可用于定位.对于绝大多数的活细胞成像来说,显微镜的配置都需要满足一些特定的需要以保证试验能够成功进行。
除了显微镜与数字成像系统,活细胞成像还需要考虑到两个限制因素——一个是保持细胞的活性,另一个是在北京噪音及自发荧光的基础上尽可能的提高信号强度。
提高活细胞成像的信噪比活细胞成像与固定细胞成像之间的基本区别是,后者的成像没有过多的限制,如合适视野的选定,曝光时间的设定,电子益增的设定,读出率及,偏移值等。
这样,染色的固定样品的成像就可以充分利用相机的全部动态设定。
因此,固定成像可以得到理想的信噪比。
但不幸的是,由于细胞活性对照明的严格要求,活细胞成像的情况又与固定细胞的成像有所不同。
在活细胞成像时,样品的灰度往往比背景高不了多少。
在这种情况下,成像首要考虑的是检测系统的暗电流及噪音值。
经济型的相机通常噪音都会比较高,导致背景混乱并掩盖样品信号,在读出速率增加时这种影响更为严重。
所以,几乎所有的活细胞成像设备质量的衡量标准都是检测器的好坏。
数字图像的噪音主要由四方面造成,检测器,照明系统,Poisson 噪音或shot 噪音(由于光子通量的随机性造成),以及弥散光。
在大多数情况下,通过选择好的检测器或优化照明条件可以降低系统噪音。
事实上,任何一种光子检测器在记录的时候都会产生某种形式上的噪音。
扫描光聚焦及多光子显微镜中的光电倍增管(PMT)会产生杂电子。
同样的,用于明场,全内反射,针孔碟片共聚焦,场扫描显微镜的CCD也会生成背景暗电流。
对此,CCD 及光电倍增设备也做了一系列的改进,比如制冷设备,它会使仪器工作时保持在低温状态,从而降低暗电流的水平。
然而,在读取光信号并将模拟信号转换为数字信号的时候,特别是CCD这种仪器,也会产生噪音,即read noise,制冷数码相机产生的主要噪音。
Figure 2所示为影响活细胞成像质量的数字相机的读出速度与敏感度的相互依存关系。
The specimen is a culture of human 图中样品为人的宫颈癌细胞(HeLa 细胞系),展示mKO (monomeric Kusabira Orange)荧光蛋白与人的α珠蛋白融合,图片在宽视场荧光下单色相机拍摄,照明中添加TRITC滤片,读出速度为10或1.25 MHz。
Figures 2(a) & 2(b)所示,在关闭CCD 光闸的条件下,低读出速度下的噪音要明显高于高读出速度下的噪音。
但是,如果将CCD 调节到全动态范围的话,这方面的影响就不明显了,如Figures 2(c) & 2(d) 所示;然而,在低光照条件下,低读出速度(Figure 2(f))的图片质量要明显的优于高读出速度(Figure 2(e)。
Figures 2(e) & 2(f) 的照明强度大约是 Figures 2(c) & 2(d) 的十分之一。
如将照明强度再降低5倍效果会更加明显,如Figures 2(g) & 2(h),低读出速度下的图片至少还能够表达出需要的效果(Figure 2(h)),然而高读出速度下的成像质量则很不理想(Figure 2(g))。
一个成功的数字成像实验,要求样品的空间照明模式是连续的,即整个视野内的照明是连续一致的,每次成像间的图片也是连续一致的。
这取决于照明光源,使用钨卤素灯照明,样品的光学性质在显微镜下通常都是连续的(被称为光学一致性)。
然而使用激光扫描显微镜的照明装置对某一特定的点进行扫描,则每一次的扫描结果都不一样。
另外,使用汞灯(the mercury plasma arc-discharge lamp)作为宽视野荧光显微镜的照明光源,图片结果会在光谱上体现为特定的分离的波长峰值。
相比之下氙灯(Xenon lamps)在可见光谱下的结果就相当连续,÷但是在它在紫外区的结果不佳(这一光谱范围通常不用于活细胞成像)。
对于金属卤素灯这样的照明光源,它的特性介于汞灯与氙灯之间,也许是性能最佳的光源。
金属卤素灯能够提供从紫外到红外间连续的光谱,此外,保有汞灯的光强。
除了调整照明光源,为了达到照明一致的效果,还可以在灯箱及显微镜的照明输入端口之间添加一个光导纤维(或液体光导)。
在视场中的照明梯度可以通过计算来矫正(flat-field algorithms)。
灯泡有时在输出的亮度会与平均值有10%的偏离,这时需要注意的是它不能够通过光学纤维来矫正,而要使用稳定的电源。
对光子通量的测量是统计学的处理,在检测信号时会产生偏差。
所谓的Poisson 或 shot noise(如前所述),它体现在测量N个光子时,出现的偏差与N的平方根成正比,即信噪比。
所以,增加信号光子的数量N可直接提高信噪比及图像对比度。
提高信号最简单的方法是手机更多的光子,通常做法是增加曝光时间或提高激发照明的强度,但是这些做法会增加光毒性并降低细胞活性。
其次,另一个更有用的方法是加强检测器的敏感度。
为了解决活细胞成像低光照的问题,现在的数字CCD相机检测器更加敏感,这是通过面元划分(binning)来实现的(如Figures 3 & 8所示)。
一般CCD读取像素点会将横向上的像素值转移到只读寄存器上,然后进行顺序分析。
在binning 处理时,相互临近的一群光信号会被合在一起检测(2 x 2 或 4 x 4)为一个信号值进行输出。
这通过将多行像素转移到一系列只读寄存器(比如两行进行 2 x 2 binning ,四行进行4 x 4 binning)中然后多行同时读取来实现的。
在2 x 2 binning 情况下,空间分辨率会降低一半,信号强度增加4倍,信噪比增加2倍。
很明显,虽然降低了空间分辨率,但对于弱信号强度的提高是很显著的。
Figure 3显示的是将临近的像素结合在一起并不断的增加binning 水平,对数字图像的空间分辨率及最终尺寸的影响。
样品为印度麂鹿皮肤组织的纤维原细胞,它表达mCherry 荧光蛋白(红色伪彩)及人的β肌动蛋白,位于应力纤维组成的丝状细胞骨架网络中。
通常在进行荧光蛋白标记时,表现出很好的共定位的细胞常常表达很低水平的融合蛋白,其发出的信号极微弱。
如果不用binning处理(Figure 3(a)),在不产生光毒性及光漂白的曝光时间下得到的信号弱到无法辨别。
Binning 2 x 2 渐进到 4 x 4增加了信号水平,但降低了空间分辨率(Figures 3(b) and 3(c))。
在binning 8 x 8 像素下的图像(Figure 3(d))最亮。
但分辨率降低极多。
另外很重的一点是,在binning 处理时,增加合并像素点,图像尺寸按比例缩小例如,不进行binning 处理(1 x 1)的图像(Figure 3)的原始大小为1360 x 1024(pixels),在(2 x 2), (4 x 4), 及 (8 x 8) 处理条件下的图像分辨率分别为680 x 512, 340 x 256, 及 170x 128(pixels)。
如上所述,这些图像的尺寸被缩小了。
同样的,一个512 x 512 的数码相机在进行上述比例处理时,图像的大小将分别缩小为256 x 256, 128 x 128, and 64 x 64(pixels)。
Binning 处理的重点是读出噪音产生在binning 处理后,所以虽然读取了几个像素的集合,但是每个binning处理后的像素只读取一次。
