讲义3(物质构成的奥秘)解析
人教版九年级化学第三单元物质构成的奥秘复习详解演示文稿

点拨
解答有关原子结构知识题目,关键是熟练掌握以下两个关系式解答:①在原子中, 质子数=核电荷数=核外电子数;②相对原子质量≈质子数+中子数。
化学·新课标(RJ)
第6页,共22页。
下面是五种粒子的结构示意图
A +17 2 8 7 B
C +18 2 8 8
D +11 2 8 1 E +17 2 8 8
被压缩,这说明气体分子间间隔比液体和固体分子间间隔
;蔗糖放到水中,一会儿
就不大见了,水却有了甜味,这说明
。
2.分原子子是是不断运动的,且分子的间最存小在粒间子隔。分子和原子的区别在于:在化学变化中,
能分成
,而
不能再分。
3.原子中,质化子学数变=化原中子序数= 核电荷数 =
;原子的质量主
要集中在
分子
原子
上,因此,相对原子质量≈
核
质子数+中子数
化学·新课标(RJ)
第3页,共22页。
第三单元┃ 物质构成的奥秘
4.离子是 带电微粒,它也是构成物质一种微粒,如氯化钠是由
钠离子和氯离子构成的。阳离子特点是
质子数大于核外电,子阴数离子特点
是
质子数小于。核外电子数
5.元素的种类是由
质子数 决定的,决定元素化学性质的
(1)图中粒子共能表示 四 种元素。A所表示的元
素位于元素周期表的第
周三期。
(2)图中表示的阳离子是 M(g用2离+ 子符号表示),
表示的阴离子是
C二l- 者 形 成 的 化 合 物 的 化 学
式
MgC。l2
第7页,共22页。
元素X核电荷数为a,它的阳离子Xm+与Y的阴
人教版化学初三上册第三单元《物质构成的奥秘》教材解读

人教版化学初三上册第三单元《物质构成的奥秘》教材解读课标内容在2019新课程标准中有五个一级主题,,每个一级主题由多少个二级主题组成,该单位正是第三个一级主题,该主题包含四个二级主题,分别是化学物质的多样性、微粒组成物质、明白化学元素、物质组成的表示。
该单位表现的课程目标分为“知识与技术”“历程与要领”“情绪态度与代价观”三个层面。
知识与技术1.要修业生明白一些常见物质的组成和组成,能用简略的化学语言予以描述述;2.初步明白物质是有原子、分子、离子等微观组成,并能理解物质的三态变化以及物质的化学变化本质。
3.认识核外电子在化学反响中的作用,联合元素的原子于离子可以相互转化,知道原子可以组成分子。
历程与要领1.将帮助学生用微粒的看法去学习化学,议决查看、想象、类比、模型化、实验等方法使学生初步理解化学现象的本质;2.体验获取知识的历程,学会探究,学会表达,发觉标题、剖析标题和办理标题的要领。
情绪态度与代价观1.利用有关探索原子布局的科学史实,使学生保持好奇心,激发学生学习化学的兴趣。
2.培育他们主动到场意识、珍惜资源意识,养成勤于思考、善于合作、乐于实践、勇于创新的品格。
本单位在课本中的身分、作用本单位基本概念比较集结,这些概念是初中化学最核心的概念,本单位从微观角度明白物质的组成,理解物质及其变化的本质是化学的重要学习内容。
只有对物质的微观布局有所明白,才华理解物质的多样性和联合性,才华理解物质变化的客观性和纷乱性,才华形成化学的基本概念,成长学生探究物质及其变化的兴趣。
因此,本单位的学习内容虽然涉及面广,要求不高,但在初中化学课程中是必不可少的。
编写特点《物质组成的秘密》部署在《我们周围的空气》后,《自然界的水》之进步行传授,是在学生已经学习氧气的基础上,初步明白分子、原子的性质和基本概念,对元素、原子等知识举行更深条理的学习。
使学生对原子的布局建立一个初步的概况,进而明白离子的形成,以及原子和离子的关联。
化学初三教材梳理:物质构成的奥秘

化学初三教材梳理:物质构成的奥秘化学初三教材梳理:物质构成的奥秘分子⒈概念:分子是保持物质化学性质的最小粒子。
注意:分子只能保持物质的化学性质,但不能保持物质的物理性质,因为一些物理性质(如颜色、状态等)是由大量的分子聚集在一起才表现出来,单个分子不能表现。
⒉分子的根本性质⑴分子体积和质量都很小。
⑵分子间有间隔,且分子间的间隔受热增大,遇冷缩小,气态物质分子间隔最大。
⑶分子在不停运动。
⑷同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
⒊分子的内部结构⑴在化学变化中分子可分成原子,分子是由原子构成的;⑵同种元素的原子构成单质分子,不同种元素的原子构成化合物的分子。
原子⒈概念:原子是化学变化中的最小粒子。
⒉化学反响的实质:在化学反响中,分子可分成原子,原子重新组合成新的分子。
⒊分子与原子的本质区别:在化学变化中分子可分,而原子不可再分。
⒋分子与原子的联系:分子是由原子构成的,分子分成原子,原子经过组合可构成分子。
运用分子、原子观点解释有关问题和现象⒈物理变化和化学变化⑴物理变化:分子本身没有变化;⑵化学变化:分子本身发生改变,原子重新组合。
⒉纯洁物和混合物(由分子构成的物质)⑴纯洁物:由同种分子构成的物质,如:水中只含有水分子;⑵混合物:由不同种分子构成的物质。
⒊有些生活中的现象和自然现象也可用分子、原子的观点解释。
如:衣服晾晒、花香、热胀冷缩、溶解、蒸发、物质三态变化、气体压缩等。
相对原子质量⒈相对原子质量的标准:碳-12原子质量的1/12。
⒉相对原子质量是一个比值,不是原子的实际质量。
⒊原子的质量主要集中在原子核上元素⒈元素的定义:具有相同核电荷数(即核内质子数)的一类原子的总称。
⒉元素的种类决定于核电荷数(即核内质子数)。
⒊地壳中含量列前四位的元素(质量分数):氧、硅、铝、铁,其中含量最多的元素(非金属元素)是氧,含量最多的金属元素是铝。
⒋生物细胞中含量列前四位的元素:氧、碳、氢、氮。
3.3物质构成的奥秘

第3章物质构成的奥秘第三节物质的组成知识梳理一、化学式反映物质的组成1定义:用元素符号和数字的组合表示纯净物组成的式子,称为该物质的化学式。
如二氧化碳的化学式为 CO2,铜的化学式为 Cu 。
3金属铁是由许许多多的铁原子构成,所以单质铁的化学式为_ Fe __。
它既可以表示铁单质,也可以表示___铁元素______,还可以表示__一个铁原子__。
氯化钠中钠离子和氯离子的个数比为__1∶1_,氯化钠的化学式为__ NaCl _。
二、如何书写化合物的化学式1化学式的读法(1)单质化学式的读法一般除稀有气体和双原子分子构成的气体单质在元素名称后加“气”字外,其余直接读元素的名称。
如:“O2”读作“氧气”,“ Fe”读作“铁”等。
(2)化合物化学式的读法由两种元素组成的化合物,其化学式名称一般读作“某化某”,如:“NaCl”读作“氯化钠”。
读法恰好与书写顺序相反。
在读化合物的化学式时,有时要读出各元素的原子个数,但“1”一般不读出。
如“CuO”读作“氧化铜”。
若该元素能组成多种不同的物质,在这些物质的化学式中,该元素的原子个数不同,此时这个“1”字就要读出。
如“CO2”读作“二氧化碳”,“CO”读作“一氧化碳”。
2单质化学式的写法1. 单原子构成的单质(1)稀有气体原子的最外层已达到相对稳定结构,其单质由单原子构成,化学式用元素符号表示。
氦气He 氖气Ne等。
(2)金属、某些固态非金属(如碳、硫、硅、磷等)的化学式,也用元素符号表示。
如:金Au 铁Fe 汞Hg 碳C 等。
(3)多原子构成的单质写多原子构成的单质的化学式时,它的分子是由几个同种原子构成的,就在元素符号的右下角写上数字几。
如:氧分子由两个氧原子构成,其化学式是O2。
气体单质多是双原子分子(稀有气体、臭氧O3等例外),液态溴(Br2)、固态碘(I2)等单质也是双原子分子。
3化合物化学式的写法(1)氧化物:氧元素写在右边,其他元素写在左边。
在每种元素符号的右下角用阿拉伯数字表明组成这种化合物的各元素的原子个数。
第三单元 物质构成的奥秘带解析_0.doc

第三单元物质构成的奥秘带解析姓名:_____________ 年级:____________ 学号:______________题型选择题填空题简答题xx题xx题xx题总分得分一、选择题(共10题)1.如图所示实验不能用“分子在不停地运动”解释的是( )【答案】【解析】选C。
黄铜可在铜上划出痕迹,说明黄铜的硬度大于铜的硬度,不能用“分子在不停地运动”解释。
难度:容易知识点:分子和原子2.科学家发现一种新元素。
该元素原子核外电子数为117,中子数为174,相对原子质量为291,元素名称为Ununseptium,符号为Uus。
请模仿图甲,将该元素对应信息编写到图乙中相应位置,“①”处应填( )A.291B.174C.117D.57【答案】【解析】选C。
根据甲中所提供的信息可知,在乙的①处应该填写原子序数,而原子序数等于核外电子数,故选C。
难度:容易知识点:离子3.一种微粒的原子核内含有n个质子,核外共有n+1个电子,则该粒子一定属于( )A.原子B.分子C.阴离子D.阳离子【答案】【解析】选C。
该粒子中的原子核内有n个质子,原子核外有n+1个电子,说明该粒子的原子得到一个电子,电子数=质子数+得到的电子数,该粒子带负电荷,为阴离子。
难度:容易知识点:离子4.如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。
下列说法正确的是( )评卷人得分A.该模型表示一种碳原子B.该原子的核电荷数为4C.该原子的质量主要集中在2个电子上D.该原子核由2个质子和2个中子构成【答案】【解析】选D。
由图示可知,该原子核内有两个质子和两个中子,是一种氦原子,A、B错误,D正确;原子的质量主要集中在原子核上,C错误。
难度:容易知识点:离子5.下列关于微观粒子的说法正确的是( )A.只有离子能构成物质B.分子之间有间隔,原子之间没有间隔C.分子和原子都在不停运动D.分子和原子在化学变化中都能够再分【答案】【解析】选C。
物质构成的奥秘讲义(完整资料).doc

此文档下载后即可编辑物质构成的奥秘【复习目标】1.了解原子是由质子、中子和电子构成的,初步掌握相对原子质量的概念,2.了解元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
3.初步认识元素周期表,知道它是学习和研究化学的工具,能根据原子序数在元素周期表4.初步了解核外电子是分层运动——分层排布的,了解离子形成的过程,认识离子也是构成物质的一种粒子5.了解化学式的涵义,能用化学式表示物质的组成,并能利用化合价推求化学式。
6.了解相对分子质量的涵义,并能利用相对原子质量和相对分子质量进行有关简单计算。
【重点】:原子的构成、元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
【难点】:元素符号的正确写法,逐步记住一些常见的元素符号。
原子的核外电子是分层排布的;元素的化学性质与原子最外层电子数的关系。
常见元素及原子团的化合价,利用化合价推求化学式。
一、原子的构成(1)原子结构示意图的认识(2)在原子中核电荷数=质子数=核外电子数 决定元素种类 质子数(核电荷数)(3)原子的质量主要集中在原子核上 (4)三决定 决定元素化学性质 最外层电子数(4)相对原子质量≈质子数+中子数 决定原子的质量 原子核说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2)最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构)二、元素与元素符号(1)定义:具有相同核电荷数(质子数)的一类原子的总称*一种元素与另一种元素的本质区别:质子数不同注意:*由同种元素组成的物质不一定是单质,(如由O 2、O 3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
(2)表示方法——元素符号——拉丁文名称的第一个字母大写a 、书写方法:b 、意义注意:有些元素符号(所有的金属元素,稀有气体元素)还可表示一种单质 如Fe,He,C,Si在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O :只表示3个氧原子c 、分类三、离子及离子的形成(学科内综合考点)(1)离子的概念:带电的原子(或原子团)叫做离子。
人教版九年级化学上册《物质构成的奥秘》讲义(含答案)

物质构成的奥秘——原子与元素【“原子”知识梳理】1、物质的构成:2、原子与分子的基本特点:3、化学变化中的原子和分子:4、化学变化的本质:5、原子的构成:6、相对原子质量:以一种碳原子的质量的1/12作为标准,其他原子的质量跟它相比较所得的比,就是这种原子的相对原子质量。
相对原子质量近似等于(质子数 + 中子数)【课堂例题】◆例1:甲原子与乙原子的质量比为a:b,而乙原子与碳原子的质量比为c:d,则甲原子的相对原子质量为( A )A、12ac/bdB、bc/12acC、12bd/acD、ab/12bc◆例2:物质的构成与原子和分子的关系正确的是( D )◆例3:雄伟壮观的国家大剧院主体建筑表面安装了近2万块钛(Ti)金属板。
已知Ti原子核内有22个质子,则下列叙述正确的是( A )A、Ti可以表示一个钛原子B、Ti4+核外有26个电子C、TiO2中含有氧分子D、CaTiO3属于金属氧化物【巩固习题】1.据报道,上海某医院正在研究用放射性碘治疗肿瘤。
这种碘原子的核电荷数为53,相对原子质量为125。
下列关于这种原子的说法中,错误的是( B ) A.中子数为72 B.质子数为72C.电子数为53 D.质子数和中子数之和为125 2.用其质量的1/12作为相对原子质量的标准的碳原子相对原子的质量是( B ) A.12g B.12 C.1/12g D.1/123.原子的质量采用相对质量来衡量的原因是( C )A.不同原子所含的质子、中子、电子数目不同B.由于核内的质子数与核外的电子数相等C.由于原子质量数值太小,书写和使用都不方便D.氢的相对原子质量约为14.有两种不同的原子,一种原子核内有6个中子和6个质子另一种原子有7个中子和6个质子,则它们不相等的是( D )A.核电荷数B.核外电子数C.原子的质量D.相对原子质量5.我国“嫦娥工程”探月计划的一个重要目标是开发月球新能源——“氦—3”,10吨氦—3就能满足我国一年所有的能源需求。
物质构成的奥秘全章PPT课件(3)

氢氧根离子
板书设计
一、元素的概念和意义 二、元素符号、原子团 三、元素周期表
谢谢!
宁可笑着流泪,绝不哭着后悔。 业余生活要有意义,不要越轨。——华盛顿 把自己当傻瓜,不懂就问,你会学的更多。 意志命运往往背道而驰,决心到最后会全部推倒。——莎士比亚 人生最大的挑战没过于战胜自己! 我总觉得,生命本身应该有一种意义,我们绝不是白白来一场的。 教师进行劳动和创造的时间好比一条大河,要靠许多小的溪流来滋养它。教师时常要读书,平时积累的知识越多,上课就越轻松。——苏霍姆林斯 基 学习这件事,不是缺乏时间,而是缺乏努力。 如果你不给自己烦恼,别人也永远不可能给你烦恼。因为你自己的内心,你放不下。
钡、铂、金、锡、铅)
2.含义:①表示
②表示这种元素的
③表示
(当这种原子可直接构成C、H、O、Fe三种元素符号的含义。 ①C: ②H: ③O: ④Fe:
元素符号表示一种元素,还表示这种元素的一个原子。
练习:用元素符号如何表示离子。
钠离子
氯离子
碳酸根离子
氢离子
钙离子
数,没有数量多少的含义。 接构成物质。 ③元素可以组成物质。
①元素的概念建立在原子的基础上,即具有相同核电荷数(即质 联 子数)的一类原子的总称。 系 ②原子的核电荷数决定元素的种类。
如果用文字来表示一百多种元素以及由他们组成的几千万 种物质将十分麻烦。
(三)元素符号:拉丁字母
1.书写:“一大二小”(表3-4,补充:氦、氖、氩、氟、
②在化学变化前后,、不变。 3.分类:①元素、元素(元素)
②自然元素、人造元素 4.地壳中含量最多的前五种元素易次是氧、硅、铝、铁、钙。
地壳中的元素含量(质量分分数)
(二) 元素与原子的关系 (学生讨论后填写下表)
第三单元物质构成的奥秘讲义.doc

第三单元物质构成的奥秘课题1 分子和原子考试要求认识物质的微粒性,知道分子、原子是构成物质的微粒能用微粒的观点解释常见的物理现象和化学现象知道原子可以结合成分子能用分子和原子的观点认识化学变化考点一、构成物质的微粒:分了、原了等微粒1、由分了构成的物质:例如水、二氧化碳、氢气、氧气等物质2、由原子构成的物质:金属、稀有气体、金刚石、石果等物质3、物质构成的描述:物质由XX分子(或原子)构成。
例如:铁由铁原子构成;氧气由氧分子构成。
考点二、分子1、基本性质:⑴质量、体积都很小;⑵在不停地运动旦与温度有关。
温度越高,运动速率越快例:水的挥发、品红的扩散;⑶分子间存在间隔。
同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分了间的间隔受热时增大,遇冷时变小的缘故。
⑷同种物质间分了的性质相同,不同物质间分了的性质不同。
2、分子的构成:分子由原子构成。
分子构成的描述:①X X分子由X X原子和X X原子构成。
例如:水分子由氢原子和氧原子构成②一个X X分子由儿个X X原子和儿个X X原子构成。
例如:一个水分了由一个氧原了和二个氢原了构成3、含义:分了是保持物质化学性质的最小微粒。
例:纨分了是保持翅气化学性质的最小粒了4、从分了和原了角度来区别下列几组概念⑴物理变化与化学变化由分子构成的物质,发生物理变化时,分子种类不变。
发生化学变化时,分子种类发生了改变。
⑵纯净物与混合物由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
⑶单质与化合物(1)相对原子质最二 某原了的质量碳原子质量的1/12单质的分子由同种原子构成;化合物的分子由不同种原子构成。
考点三、原了1、 含义:原子是化学变化中最小的微粒。
例:氢原了、氧原子是电解水中的最小粒子2、 分了与原子的比较分子原子 定义分子是保持物质化学性质最小的微粒 原子是化学变化中的最小微粒。
性质体积小、质量小;不断运动;有间隙 联系 分子是由原子构成的。
物质构成的奥秘说课稿解读

独立思考知识关系
组内交流,教师指导
知识整合
教学策略 五、整合知识,理清关系。
物质的宏观组成
元素符号
物质的微观构成
离子
质子 原子核 中子
相对原子质量
元素
物质
原子
电子
分子
元素周期表
核电荷数=质子数=核外电子数
教学策略 五、链接中考,把握动向。
(2015年河南)14.右图是元 8 O氧 9 F氟 10 Ne 16.00 19.00 20.18 素周期表的一部分。原子序数 为10的元素名称为 ;氟原子 的核外电子数为 ;等质量的 本节知识在中考多以选择题、填空题的形式 氧气和氟气中,所含原子数较 少的是出现,一般试题难易程度不大,主要考查学 。 生的记忆、理解、应用,其中原子结构示意 (2015年河南)20.(2分)请用分子的相关知识解释生产或生活中的现象。 图,元素周期表的认识以及用原子分子解释 (1)酒香不怕巷子深。 生活中的现象考察最多。
教学策略
二、充分利用教学资源、使课堂灵动、有趣、高效。
原子 的构成
科 学 家 汤 姆 生 物 理 学 家 卢 瑟 夫
氯化钠的形成过程
教学策略 三、敢于对教材进行适时的删减或补充。
案例分析:核外电子的排布
教学策略 四、重视实验,合理设计实验。
教学策略 五、整合知识,理清关系。
学生罗列知识点
(2)加压时,6000L氧气装入容积为40L的钢瓶中。
教学策略
(2014河南)13.元素周期表是学习化学的重要工 具,右图是表中的一格,其中A表示____;B表示 _____。
(2013河南)5.下列结构示意图表示的粒子中,属 于离子的是( )
在教育的舞台上,每位教师 都应该是学生灵魂的舞者,用点 点滴滴的细节,舞动出生命的灵 动与睿智。所以,走进教材走进 课堂,这是我们教师“收获幸福” 永远的必修课。
《物质组成的奥秘》教材及考点解析

二、知识点、考点分析
近三年泰安市的中考试题既注重考查学生基础知 识和基本技能的掌握程度,又注重评价学生的科 学探究能力,同时关注学生在情感、态度、价值 观方面的发展,本部分内容约占 24%,其中物质 的分类、物质的组成和构成、原子的结构、化合 价、根据化学式计算为高频考点。
2014年泰安市中考试题中本部分内容如下:
《物质组成的奥秘》教材及考点解析
一、教材及课标要求剖析
初中化学课程标准共有五个一级主题,“物质构 成的奥秘”是其中的一个。该主题的确立旨在帮 助学生从微观角度了解物质的构成,理解物质及 其变化的本质。学生只有对物质的微观结构有所 了解,才能理解物质的多样性和统一性,才能理 解物质变化的客观性和复杂性,才能形成化学学 科的基本观念,形成对物质及其变化规律探究的 兴趣,形成对化学学习价值及其意义的认识。因 此,“物质构成的奥秘”主题在初中化学教学中 具有至关重要的作用。
三、2015年中考预测
1、物质的多样性:更加灵活的考查物质的分类。 如:下列选项符合图示从属关系的是 A X 金属 Y 单质 B 溶液 乳浊液 C 纯净物 化合物 D 化石燃料 石油
三、2015年中考预测
2、微粒构成物质:以信息题考查物质的组成和结构、 原子的结构、分子和原子的性质。 如:某市售天然矿泉水标签的部分 内容如右图所示,请仔细阅读并完 成下列问题。 (1)用化学符号填空: 钙离子____________;硫酸根离子 ____________;由 标签中的离子构成的一种盐_________________。 (2)偏硅酸中硅元素的化合价_____________;氯离
化学用语表示的意义
分子的基本性质 元素符号的意义
29(2-5) 计算题
根据化学式计算
物质构成的奥秘 解说

正确的 人生观 正确的 价值观
能力与 价值体系
可持续发展 意识
科学的 态度 合作与交流 意识
STS意识
创新意识
13
四、教材处理
14
本主题在教材中的地位、作用
本主题是全书 (甚至是整个 中学阶段)的 一个重心,是 基础 物质 构成 的奥 秘 1.知识上承上 启下的作用 2.揭示化学学科 发展趋势
化学基 本概念
物质 结构 重点
化学 用语 运用
物质 构成 的奥 秘
想象中微 观世界的 建立 化学用语 记忆运用 难点
<物质构成的奥秘> [主要考点]
常 见 现 象 释的 微 观 解
原 离 元 元 关 子 子 素 素 于 周 标 的 期 签 构 表 问 成 题
化 化 学 合 式 算 价 的 与 有 化 关 学 计 式
33
教学策略
6、设计游戏,突破记忆难点
元素符号
对 比 记 忆
铁(Fe)——氟(F ) 铂(Pt )——磷(P ) 硅(Si )——硫(S )
铝(Al )——氯(Cl) 钙(Ca)——铜(Cu) 银(Ag)——汞(Hg)
教学策略
6、设计游戏,突破记忆难点
上网查找“化学游戏之化学式连连 看”,让学生在娱乐中学习,其乐无穷。
五、教学策略
20
学情分析
学生在 物理课的学习中,已
经初步了解了一些关于分子和原子 的知识,引入本专题知识并不困难。 但学生缺乏粒子的观点和微观想象 力,涉及的一些化学微观概念比较 抽象,学生不容易理解和掌握。
21
教学策略
1、联系生活实际,激发学习兴趣
送 人 玫 瑰
手 有 余 香?
火车铁轨接缝处留有空隙 ? 衣物中放置的樟脑丸会逐渐变小?
讲义3(物质构成的奥秘)

- 总结资料-物质构成的奥秘1、原子的构成(1)原子结构示意图的认识(2)在原子中核电荷数=质子数=核外电子数决定元素种类质子数(核电荷数)(3)原子的质量主要集中在原子核上三决定决定元素化学性质最外层电子数(4)相对原子质量≈质子数+中子数决定原子的质量原子核说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)2、元素(1)定义:具有相同核电荷数(质子数)的一类原子的总称*一种元素与另一种元素的本质区别:质子数不同注意:*由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
(2)表示方法——元素符号——拉丁文名称的第一个字母大写a、书写方法:b、意义注意:*有些元素符号还可表示一种单质如Fe、He 、C 、Si*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3个氧原子c、有关元素周期表*发*排列依据*d、分类e地壳:O、Si、Al、Fe 细胞:O、C、H3、离子:带电的原子或原子团(1)表示方法及意义:如Fe3+:一个铁离子带3个单位正电荷(2)离子结构示意图的认识注意:与原子示意图的区别:质子数=电子数则为原子结构示意图*原子数≠电子数为离子结构示意图-粒子电性不显电性显正电性显负电性符号用元素符号表示用阳离子符号表示用阴离子符号表示二、物质的组成的表示:1、化合价化合物均有固定的组成,即形成化合物的元素有固定的原子个数比,化学上用“化合价”表示原子间相互化合的数目。
(1)化合价的一般规律:①化合价有正价和负价。
a.氧元素通常显—2价;b.氢元素通常显+1 价;c.金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价;d.一些元素在不同的化合物中可显不同的化合价。
②在化合物里正、负化合价的代数和为0 。
③元素的化合价是元素的原子在相互形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为0 。
第三单元:《物质构成的奥秘》知识汇总精讲解析版
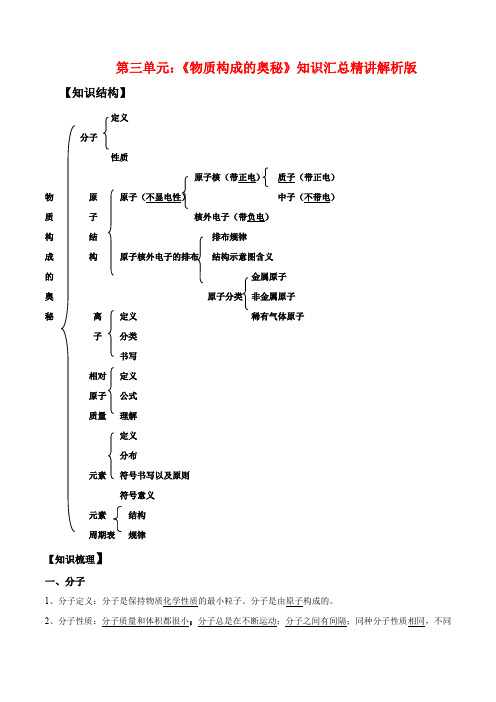
第三单元:《物质构成的奥秘》知识汇总精讲解析版【知识结构】定义分子性质原子核(带正电)质子(带正电)物原中子(不带电)质子核外电子(带负电)构结排布规律成构结构示意图含义的金属原子奥非金属原子秘离定义稀有气体原子子分类书写相对定义原子公式质量理解定义分布元素符号书写以及原则符号意义元素结构规律【知识梳理】一、分子1、分子定义:分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
2、分子性质:分子质量和体积都很小;分子总是在不断运动;分子之间有间隔;同种分子性质相同,不同种分子性质不同。
3、物理变化:分子本身没有发生变化,分子的化学性质不变。
化学变化:分子本身发生变化,生成了新的分子,不再保持原分子的化学性质。
典例1 【2019湖南益阳】建立宏观和微观之间的联系对学习化学十分重要。
下列宏观事实的微观解释错误的是()A.品红在水中扩散﹣﹣分子在不断运动B.水蒸发由液态变成气态﹣﹣水分子发生改变C.NO与NO2化学性质不同﹣﹣构成物质的分子不同D.10mL H2O与10mL C2H5OH混合后体积小于20mL﹣﹣分子间有间隔典例2【2019甘肃兰州一模】下列关于分子和原子的说法,错误的是()A.分子和原子都可以构成物质B.由分子构成的物质,分子是保持其化学性质的最小粒子C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小二、原子结构(一)原子结构原子核(带正电)质子(带正电)1、原子(不显电性)中子(不带电)核外电子(带负电)2、核电荷数:原子核所带电荷数。
3、原子质量几乎全部集中在原子核上,但原子核体积很小,原子的体积由核外电子决定。
4、在原子中,质子数=核外电子数=核电荷数。
(二)相对原子质量1、定义:一个原子质量与一个碳12原子的质量的1/12的比值就是相对原子质量。
2、公式:相对原子质量=质子数+中子数3、理解(1)相对原子质量不是个质量是个比值;(2)有单位,是“1”常省略不写;(3)相对原子质量之比等于原子实际质量之比;(4)引入相对原子质量是为了书写、记忆和运算方便。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质构成的奥秘1、原子的构成(1)原子结构示意图的认识(2)在原子中核电荷数=质子数=核外电子数决定元素种类 质子数(核电荷数)(3)原子的质量主要集中在 原子核上 三决定 决定元素化学性质 最外层电子数(4)相对原子质量≈质子数+中子数 决定原子的质量 原子核说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2)最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构) 2、元素(1)定义:具有相同核电荷数(质子数)的一类原子的总称 *一种元素与另一种元素的本质区别:质子数不同 注意:*由同种元素组成的物质不一定是单质,(如由O 2、O 3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
(2)表示方法——元素符号——拉丁文名称的第一个字母大写 a 、书写方法: b 、意义注意:*有些元素符号还可表示一种单质 如Fe 、He 、C 、Si*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O :只表示3个氧原子 c 、有关元素周期表 *发 *排列依据* d 、分类e 地壳:O 、Si 、Al 、Fe 细胞:O 、C 、H3、离子:带电的原子或原子团(1)表示方法及意义:如Fe 3+ :一个铁离子带3个单位正电荷 (2)离子结构示意图的认识注意:与原子示意图的区别:质子数=电子数则为原子结构示意图 *原子数≠电子数为离子结构示意图符号用元素符号表示用阳离子符号表示用阴离子符号表示1、化合价化合物均有固定的组成,即形成化合物的元素有固定的原子个数比,化学上用“化合价”表示原子间相互化合的数目。
(1)化合价的一般规律:①化合价有正价和负价。
a.氧元素通常显—2价;b.氢元素通常显 +1 价;c.金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价;d.一些元素在不同的化合物中可显不同的化合价。
②在化合物里正、负化合价的代数和为 0 。
③元素的化合价是元素的原子在相互形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为 0 。
(2)写法:a单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气、氯气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2、Cl2 。
b化合物:正价在前,负价在后(NH3,CH4除外)(3)意义分类意义实例宏观①表示一种物质水①表不该物质组成元素水是由H、O两种元素组成的微观①表示物质的一个分子一个水分子②表示物质的分子构成每个水分于是由2个氢原子和1个氧原子构成(4)几种数字的含义Fe2+每个亚铁离子带两个单位正电荷 3 Fe2+:3个亚铁离子2H2O 两个水分子,每个水分子含有2个氢原子(5)化合价口诀常用元素化合价歌:一价钾钠氯氢银,二价氧钙钡镁锌,三铝四硅五价磷,铜一、二价记在心,二三铁,二四碳,硫二四六都齐全,2、化学式(2)意义:如化学式H2O的意义:4点化学式 Fe的意义:3点(3)化学式的意义(以H2O为例):化合价离子表示方法用+1、+2、-1、-2……表示标在元素符号的正上方(“1”不省)用+、2+、-、2-……表示标在元素符号右上角(“1”省去)实例+1 -1-1 +2Na、Cl、OH、CaNa+、Mg2+、Al3+、Cl-、SO42-联系与区别同种元素(或原子团)的化合价和离子电荷通常在数值上相等,位置不同,正、负号的写法不同。
(1)相对分子质量:(2)相对分子质量的计算:例:CaCO3的相对分子质量=CO(NH2)2的相对分子质量=(3)计算物质组成元素的质量比:例:H2O中各元素的质量比=NH4NO3中N、H、O各元素的质量比=(4)计算物质中某元素的质量分数:例:NH4HCO3中氮的质量分数=KClO3中氧的质量分数=CuSO4﹒5H2O中氧的质量分数=专题复习—物质构成的奥秘(一)物质的多样性从组成上区分纯净物和混合物、单质和化合物、有机物和无机物。
用粒子的观点解释某些常见的现象。
(二)微粒构成物质宏观物质都是由微观粒子构成的。
1.分子、原子、离子都是构成物质的粒子它们之间的关系如下:2.原子的构成(1)质子数=核电荷数=原子序数=核外电子数,原子不显电性。
(2)质子数+中子数=相对原子质量(数值),原子的质量主要集中在原子核上。
(3)不是所有原子的原子核都有中子。
(4)核外电子是分层排布的(认识原子结构示意图)。
3.分子和原子的本质区别(1)分子的定义:分子是保持物质化学性质的最小粒子。
提示:分子在物理变化中不可分,分子间的距离可变化;分子在化学变化中可分,构成分子的原子可重新组合,构成新的分子。
原子的定义:原子是化学变化中的最小粒子。
提示:原子在化学变化中不可分,但原子可重新组合。
(2)认识分子的主要性质,并能用分子的性质解释一些基本问题。
a.分子的体积和质量都很小b.分子总是在不停地运动c.分子间有一定的间隔d.分子在化学变化中可分(三)化学元素1.定义:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
已经发现的元素有一百余种。
地壳里和生命细胞中含量最多的元素是氧。
地壳里含量较多的元素还有:硅、铝、铁、钙、钠、钾、镁等;生命细胞中含量较多的元素还有:碳、氢、氮、钙、磷等。
2.两个决定:在原子结构中,核内质子数决定元素的种类;最外层电子数主要决定元素的化学性质。
3.元素的简单分类:金属元素、非金属元素和稀有气体元素。
元素的简单分类最外层电子数化学性质金属元素一般为1~3个较易失电子形成阳离子非金属元素一般为5~7个较易得电子形成阴离子稀有气体元素8个(氦为2个) 化学性质稳定4.一些常见元素的名称和符号5.提示:元素只论种类,不论个数。
(四)物质组成的表示1.物质的构成2.物质组成的表示3.化学式:表示物质的组成。
纯净物的组成是固定不变的,一种物质只有一个化学式。
4.化学式与化合价的关系根据化学式可以推算化合价,根据化合价可以书写化学式。
(1)在单质里,元素的化合价为零。
(2)在化合物里,正负化合价的代数和为零。
5.化学式的涵义(以H2O为例)可以从宏观和微观来理解它的涵义。
宏观:(1)表示水这种物质。
(2)表示水是由氢元素和氧元素组成的。
(3)表示水中氢元素和氧元素的质量比为1∶8。
微观:(1)表示一个水分子。
(2)表示水是由大量的水分子构成的。
(3)表示一个水分子是由两个氢原子和一个氧原子构成的。
(五)溶液1.溶液知识体系2.几个概念溶液:一种或几种物质分散到另一种物质里,形成的均一的、稳定的混合物叫做溶液。
溶剂:能溶解其他物质的物质叫溶剂。
溶质:被溶解的物质叫做溶质。
最常用的溶剂是水,汽油、乙醇等也可以做溶剂。
如碘酒,碘是溶质,酒精是溶剂。
溶质可以是固体,也可以是液体或气体。
如果两种液体互相溶解时,一般把量多的一种叫做溶剂,量少的一种叫做溶质。
如果其中有一种是水,一般把水叫做溶剂。
3.溶液的基本特征:均一性和稳定性。
4.溶液中,溶液质量=溶质质量+溶剂质量5.溶解过程中的吸热、放热现象在溶解过程中发生了两种变化,一种是溶质的分子(或离子)向水中扩散,这一过程吸收热量;另一种是溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),这一过程放出热量。
即:扩散──吸热;水合──放热。
当Q吸>Q放:水溶液的温度降低,如NH4NO3溶于水时吸收热量;当Q吸<Q放:水溶液的温度升高,如NaOH、浓硫酸等溶于水时放出热量;当Q吸=Q放:水溶液的温度不变,如NaCl溶于水溶液的温度变化不大。
6.饱和溶液和不饱和溶液在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做饱和溶液,还能继续溶解的溶液叫做不饱和溶液。
不饱和溶液与饱和溶液间的相互转化:7.溶解度的概念在一定温度下,某固态物质在100 g 溶剂(通常溶剂为水)里达到饱和状态时所溶解的质量。
(1)“易溶”、“可溶”、“微溶”、“难溶”等表示的意思:溶解度/g >10 1~10 0.01~1 <0.01溶解性易溶可溶微溶难溶(2)溶解度曲线用纵坐标表示溶解度,横坐标表示温度,绘制出的溶解度随温度而变化的曲线叫做溶解度曲线。
溶解度曲线表示的有关信息:①某物质在某温度时的溶解度;②同一物质在不同温度时的溶解度是不同的;③不同物质在同一温度时的溶解度可能不同;④曲线的交点所表示某一温度下不同物质的溶解度相同。
⑤物质的溶解度受温度影响的变化;……(3)气体的溶解度气体的溶解度是指在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
一般情况下,气体的溶解度随外界压强的增大而增大;随温度的升高而降低。
气体溶解度在实际测定时比较复杂,非标准状况下的数据还应该换算成标准状况下的值。
8.溶质的质量分数溶质质量=溶液质量×溶质的质量分数溶剂质量=溶液质量-溶质质量【典型例题】1.以下物质属于纯净物的是()分析:本题考查物质的分类。
A选项是自来水,属于混合物;B选项C70,一种碳的单质,故属于纯净物;C选项石灰石,是混合物,主要成分是碳酸钙。
D选项石油是混合物。
2.甲醛(化学式为CH2O)是一种对人体有毒害的物质,是室内装饰材料释放的主要污染物之一,也是一些不法分子为了增强食品耐煮、防腐等能力,不顾人们的身体健康而经常使用的一种添加剂和浸泡剂。
国家为此对甲醛的使用进行了严格控制并严厉打击不法行为。
下列关于甲醛的说法正确的是()A.甲醛是由碳、氢、氧三种元素组成的化合物B.甲醛是由碳和水分子构成的物质C.甲醛分子是由碳原子、氢分子、氧原子构成的物质D.甲醛由1个碳元素、2个氢元素、1个氧元素组成物质分析:本题考查物质组成的表示。
甲醛的化学式为CH2O,故是由碳元素、氢元素和氧元素组成的化合物。
甲醛是由大量的甲醛分子构成的,不存在氢分子或水分子;一个甲醛分子是由一个碳原子、两个氢原子和一个氧原子构成的。
另外元素论种不论个,故B、C、D都是不正确的。
3.a、b两物质的溶解度曲线如图1所示,请根据图回答:(1)30℃时,a的溶解度是 g。
(2)a的溶解度小于b的溶解度的温度范围是。
(3)如图2所示,现有20℃时等质量的a、b两物质的饱和溶液,试管底部有等质量的a、b剩余,向烧杯的水中加入氢氧化钠固体,则对相关变化判断正确的是(不考虑溶剂的蒸发,析出的固体不含水)A.a溶液中溶质质量增多,b溶液中溶质质量减少B.a溶液中溶质质量分数小于b溶液中溶质质量分数C.a溶液中溶剂质量小于b溶液中溶剂质量D.试管底部a固体的质量小于b固体的质量分析:本题考查溶解度及溶解度曲线的相关知识。
从图1观察可得,a 的溶解度在30℃时是40g,a的溶解度小于b的溶解度的温度范围是0℃≤t<20℃。
由于氢氧化钠固体溶于水是放热的,烧杯内的溶液温度升高,由于a 的溶解度随着温度升高而升高,故a试管中的固体减少;由于b的溶解度随着温度的升高而减小,故b试管中有晶体析出。
