离子晶体教学设计.doc
3《离子晶体》教案

3《离子晶体》教案第一章:离子晶体的定义与特征1.1 离子晶体的定义解释离子晶体的概念强调离子晶体是由阳离子和阴离子组成的晶体结构1.2 离子晶体的特征描述离子晶体的基本特征,如电荷、大小、间距等解释离子晶体的电荷平衡和稳定性第二章:离子晶体的构成元素2.1 阳离子介绍常见的阳离子及其化合价强调阳离子在离子晶体中的作用和重要性2.2 阴离子介绍常见的阴离子及其化合价强调阴离子在离子晶体中的作用和重要性第三章:离子晶体的空间结构3.1 简单立方堆积解释简单立方堆积的概念和特点给出简单立方堆积的实例3.2 体心立方堆积解释体心立方堆积的概念和特点给出体心立方堆积的实例3.3 面心立方堆积解释面心立方堆积的概念和特点给出面心立方堆积的实例第四章:离子晶体的性质4.1 离子晶体的熔点解释离子晶体熔点的形成原因给出影响离子晶体熔点的因素4.2 离子晶体的溶解性解释离子晶体溶解性的形成原因给出影响离子晶体溶解性的因素4.3 离子晶体的电导性解释离子晶体电导性的形成原因给出影响离子晶体电导性的因素第五章:离子晶体的应用5.1 离子晶体在材料科学中的应用介绍离子晶体在材料科学中的应用领域强调离子晶体在制备陶瓷、玻璃等方面的作用5.2 离子晶体在化学反应中的应用介绍离子晶体在化学反应中的应用领域强调离子晶体在催化、缓控释放等方面的作用第六章:离子晶体的制备方法6.1 离子晶体的实验室制备介绍常见的离子晶体实验室制备方法,如溶液蒸发、离子交换等强调制备过程中的条件和参数控制6.2 离子晶体的工业制备介绍常见的离子晶体工业制备方法,如熔融电解、加热分解等强调工业制备过程中的条件和参数控制第七章:离子晶体的应用领域7.1 离子晶体在电子学中的应用介绍离子晶体在电子学中的应用领域,如离子晶体管、离子晶体传感器等强调离子晶体在电子学中的特性和优势7.2 离子晶体在光学中的应用介绍离子晶体在光学中的应用领域,如激光晶体、光调制器等强调离子晶体在光学中的特性和优势第八章:离子晶体的研究方法8.1 离子晶体的结构分析介绍离子晶体结构分析的方法,如X射线晶体学、核磁共振等强调结构分析在离子晶体研究中的重要性8.2 离子晶体的性质测试介绍离子晶体性质测试的方法,如熔点测定、溶解性测试等强调性质测试在离子晶体研究中的重要性第九章:离子晶体的未来发展9.1 离子晶体的新材料研发介绍离子晶体在新材料研发中的应用领域,如新型电池、超级电容器等强调离子晶体在新材料研发中的潜力和前景9.2 离子晶体的环境保护应用介绍离子晶体在环境保护领域的应用,如离子晶体吸附剂、离子晶体催化剂等强调离子晶体在环境保护中的作用和意义第十章:案例分析与实验操作10.1 离子晶体的案例分析提供几个离子晶体的案例,让学生进行分析讨论强调案例分析在理解离子晶体性质和应用中的重要性10.2 离子晶体的实验操作设计几个离子晶体的实验操作,让学生进行实际操作和观察强调实验操作在理解和掌握离子晶体性质和制备方法中的重要性重点和难点解析重点环节1:离子晶体的定义与特征解析:理解离子晶体的基本概念和特征是学习后续章节的基础。
2021年新人教版高二化学选修3:3.4离子晶体(第1课时)教案 Word版

第四节离子晶体第一课时教育内容剖析:学生具有了离子键、离子半径、离子化合物等基础常识,本节直接给出氯化钠、氯化铯晶胞,然后在科学探求的基础上介绍影响离子晶体结构的要素,经过制造典型的离子晶体模型来进一步了解离子晶体结构特色,为学习晶格能作好常识的衬托。
教育方针设定:1.把握离子晶体的概念,能辨认氯化钠、氯化铯、氟化钙的晶胞结构。
2.学会离子晶体的性质与晶胞结构的联系。
3.经过探求知道离子晶体的配位数与离子半径比的联系。
4、经过碳酸盐的热分化温度与阳离子半径的自学,拓宽学生视界。
教育重点难点:1、离子晶体的物理性质的特色2、离子晶体配位数及其影响要素教育方法主张:剖析、概括、评论、探求教育进程规划:[引进]1、什么是离子键?什么是离子化合物?2、下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物?Na2O NH4Cl O2 Na2SO4 NaCl CsCl CaF23、咱们现已学习过几种晶体?它们的结构微粒和微粒间的相互作用别离是什么?[板书]一、离子晶体[展现] NaCl 、CsCl晶体模型[板书]阴、阳离子经过离子键构成离子晶体1、离子晶体界说:由阳离子和阴离子经过离子键结合而成的晶体注:(1)结构微粒:阴、阳离子(2)相互作用:离子键(3)品种繁复:含离子键的化合物晶体:强碱、生动金属氧化物、绝大多数盐(4)理论上,结构粒子可向空间无限扩展[考虑]下列物质的晶体,哪些属离子晶体?离子晶体与离子化合物之间的联系是什么?干冰、NaOH、H2SO4、K2SO4、NH4Cl、CsCl[投影]2、离子晶体的物理性质及解说性质解说硬度()熔沸点()溶于水()熔融()离子晶体溶解性差异较大:NaCl、 KNO3、(NH4)2SO4_______BaSO4、CaCO3_______[板书]3、离子晶体中离子键的配位数(C.N.)(1)界说:是指一个离子周围附近的异电性离子的数目[探求] NaCl和CsCl晶体中阴、阳离子的配位数离子晶体阴离子的配位数阳离子的配位数NaClCsCl(2)决议离子晶体结构的主要要素:正、负离子的半径比[投影]离子Na+Cs+Cl-离子半径/pm 95 169 181[学生活动] NaCl、CsCl中正、负离子的半径比和配位数NaCl CsClr+/r- = r+/r- =C.N.=6 C.N.=8[自主探求]CaF2晶体中阴、阳离子的配位数[板书](3)影响阴、阳离子的配位数的要素|①正、负离子半径比的巨细②正、负离子所带电荷的多少[学生活动]四品种型晶体的比较晶体类型离子晶体分子晶体原子晶体金属晶体构成粒子粒子间相互作用或许的相互作用硬度熔沸点导电性溶解性典型实例[操练]1、下列含有极性键的离子晶体是1.醋酸钠②氢氧化钾③金刚石④乙醇⑤氯化钙A、①②⑤B、①②C、①④⑤D、①⑤2下列说法正确的是1.一种金属元素和一种非金属元素一定能构成离子化合物2.离子键只存在于离子化合物中3.共价键只存在于共价化合物中4.离子化合物中必定含有金属元素3、CsCl晶体中Cs+的 C.N.是 ____ Cl-的C.N.是_____.CaF2晶体中Ca2+的 C.N.是 ____ F-的C.N.是_____.已知KCl的晶体结构与NaCl的类似,则KCl晶体中K+的C.N.是 ____ Cl-的C.N.是_____.。
2024高中化学离子晶体设计教案

2024高中化学离子晶体设计教案第一章:离子晶体的概念与特征1.1 离子晶体的定义1.2 离子晶体的构成元素1.3 离子晶体的空间结构1.4 离子晶体的性质第二章:离子晶体的化学键2.1 离子键的概念与特点2.2 离子键的形成与断裂2.3 离子键的类型2.4 离子键与其他类型的化学键的区别第三章:离子晶体的性质与应用3.1 离子晶体的熔点与沸点3.2 离子晶体的溶解性3.3 离子晶体的电导性3.4 离子晶体在实际应用中的例子第四章:离子晶体的制备方法4.1 离子晶体的实验室制备方法4.2 离子晶体的工业制备方法4.3 离子晶体制备过程中的问题与解决方法4.4 离子晶体制备实验的注意事项第五章:离子晶体设计的基本原则5.1 离子晶体设计的目标与意义5.2 离子晶体设计的基本原则5.3 离子晶体设计的步骤与方法5.4 离子晶体设计中的创新与挑战第六章:离子晶体的设计原理6.1 离子晶体设计的理论基础6.2 离子晶体设计的计算方法6.3 离子晶体设计的模拟技术6.4 离子晶体设计案例分析第七章:离子晶体在材料科学中的应用7.1 离子晶体在陶瓷材料中的应用7.2 离子晶体在药物载体中的应用7.3 离子晶体在电池材料中的应用7.4 离子晶体在其他功能性材料中的应用第八章:离子晶体的实验设计与操作8.1 离子晶体实验的准备工作8.2 离子晶体实验的基本操作步骤8.3 离子晶体实验中可能遇到的问题及解决方法8.4 离子晶体实验的数据处理与分析第九章:离子晶体的结构分析技术9.1 X射线晶体学的基本原理9.2 核磁共振技术在离子晶体结构分析中的应用9.3 电子显微镜技术在离子晶体结构分析中的应用9.4 离子晶体结构分析案例分析第十章:离子晶体设计的未来趋势与挑战10.1 离子晶体设计的新材料探索10.2 离子晶体在新能源领域的应用前景10.3 离子晶体设计中的环境友好性考虑10.4 离子晶体设计的未来发展挑战与机遇第十一章:离子晶体设计的案例研究11.1 离子晶体设计案例一:硫酸铵晶体设计11.2 离子晶体设计案例二:锂离子电池负极材料设计11.3 离子晶体设计案例三:药物晶体的设计11.4 离子晶体设计案例分析与讨论第十二章:离子晶体的计算化学方法12.1 计算化学方法在离子晶体设计中的应用12.2 分子动力学模拟在离子晶体研究中的应用12.3 量子化学计算在离子晶体设计中的应用12.4 离子晶体计算化学案例分析第十三章:离子晶体的实验技术进展13.1 现代实验技术在离子晶体研究中的应用13.2 离子晶体生长的实验技术进展13.3 离子晶体结构分析的高分辨率技术13.4 实验技术在离子晶体设计中的应用案例第十四章:离子晶体设计的伦理与责任14.1 离子晶体设计中的伦理问题14.2 离子晶体设计的可持续性考虑14.3 离子晶体设计中的社会责任14.4 离子晶体设计的伦理与责任案例讨论第十五章:综合项目与实践15.1 离子晶体设计的项目规划与实施15.2 离子晶体设计的团队协作与沟通15.3 离子晶体设计的成果展示与评价15.4 实践中的离子晶体设计案例分享与总结重点和难点解析重点:1. 离子晶体的定义、构成元素、空间结构及性质。
34离子晶体教案10(人教版选修3).doc

第四节离子晶体第1课时【知识与技能】1、通过复习钠与氯形成氯化钠的过程,使学生理解离子键的概念、形成过程和特点。
2、理解离子晶体的概念、构成及物理性质特征,掌握常见的离子晶体的类型及有关晶胞的计算。
【过程与方法】1、复习离子的特征,氯化钠的形成过程,并在此基础上分析离子键的成键微粒和成键性质,培养学生知识迁移的能力和归纳总结的能力。
2、在学习本节的过程中,可与物理学屮静电力的计算相结合,晶体的计算与数学的立体儿何、物理学的密度计算相结合。
【情感态度与价值观】通过木节的学习,进一步认识晶体,并深入了解晶体的内部特征。
[板书计划]第四节离子晶体一、离子晶体:Ftl阳离子和阴离子通过离子键结合而成的晶体。
1、儿何因素:晶体屮正负离子的半径比(r+/r-)02、电荷因素:正负离子的电荷比。
3、键性因素:离子键的纯粹程度。
4、离子晶体特点:硬度较大、难于压缩、较高的熔点和沸点。
二、晶格能1、定义:气态离子形成1摩离子晶体释放的能量,通常取正值。
2、规律:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
【教案设计】1、钠原子与氯原子是如何结合成氯化钠的?你能用电子式表示氯化钠的形成过程吗?2、根据元素的金属性和非金属性差异,你知道哪些原子Z间能形成离子键?【板书】第二单元离子键离子晶体§3-2-1离子键的形成一、离子键的形成【学生活动】写出钠在氯气屮燃烧的化学方程式;思考:钠原子与氯原子是如何结合成氯化钠的?请你用电子式表示氯化钠的形成过程。
【过渡】以阴、阳离子结合成离子化合物的化学键,就是离子键。
【板书】1、离子键的定义:使阴、阳离子结合成离子化合物的静电作用2.离子键的形成过程【讲解】以NaCl为例,讲解离子键的形成过程:1)电子转移形成离子:一般达到稀有气体原子的结构【学生活动】分别达到Ne和Ar的稀有气体原子的结构,形成稳定离子。
2)判断依据:元素的电负性差要比较大【讲解】元素的电负性差要比较大,成键的两元素的电负性差用AX表示,当△X>1.7,发生电子转移,形成离子键;当厶XV 1.7,不发生电子转移,形成共价键.【说明】:但离子键和共价键之间,并非严格截然可以区分的.可将离子键视为极性共价键的一个极端,而另一极端为非极性共价键.如图所示:—一化合物中不存在百分之百的离子键,即使是NaF的化学键之中,也有共价键的成分,即除离子间靠静电相互吸引外,尚有共用电子对的作用.AX>1.7,实际上是指离子键的成分(百分数)大于50%.【小结】:1、活泼的金属元素(1A、1IA)和活泼的非金属元素(VIA、VIIA)形成的化合物。
离子晶体教学设计.doc

离子晶体教学设计.doc教学设计《离子晶体》教学设计五常市高级中学解晓丽《离子晶体》教学设计教材分析:关于离子晶体,教材以离子键的知识为基础,以学生比较熟悉的NaCl晶体为例子,介绍了离子晶体的结构模型,并对一些性质作了解释。
教材还通过举例归纳一些离子晶体的溶解性,使教材与初中内容衔接,帮助学生复习初中学过的知识。
该部分内容理论性较强,比较抽象,教材除了选择学生易接受的知识和使用通俗的语言外,还选配了较多的插图,以帮助学生理解知识,并提高兴趣。
学生分析:学生在高一曾学习了物质结构和元素周期律、离子键、共价键等知识,在此基础上,再学习离子晶体,不但可使学生对有关知识有更全面的了解,也可使学生进一步深化对所学知识的认识。
但由于该内容抽象,离子晶体的化学式所表示的含义,学生不易理解,均摊法求晶体的化学式也是对学生来说也是一大难点。
设计思路:1、为了加强直观教学,尽可能把复杂问题简单化,抽象问题具体化,降低学生理解知识的难度,激发学生的兴趣,我利用3D动画把离子晶体的空间结构充分展示给学生,关于均摊法求化学式也就由难变易,有效地突破了难点;2、这节课我大胆改革,是一节学生自主学习课,全部的课程内容都在课件中体现,无须教师讲解,学生只要操作电脑就可以把本节内容学习,并配有课堂练习、趣味化学等,使学生的学习不局限在书本上,教师只起到引导、适时点拔的作用。
(该课件在哈市课件大赛上获一等奖)教学目标知识与技能1、了解离子晶体的晶体结构模型及其性质的一般特点;2、理解离子晶体的晶体类型与性质的关系;3、学会确定离子晶体化学式的方法。
过程与方法培养学生提出问题,通过观察模型分析问题、解决问题的能力情感态度与价值观培养学生敢于质疑、勤于思索、勇于创新、积极实践的科学态度,体验发现的乐趣。
教学重点离子晶体的结构模型教学难点均摊法求离子晶体的化学式教学策略诱导、分析、推理、归纳相结合,充分利用多媒体辅助教学。
教学准备3D多媒体课件,安装在每个同学的电脑上,以便于学生自主操作。
最新整理高二化学教学《离子晶体、分子晶体和原子晶体》(第1课时)教学设计.docx

最新整理高二化学教学《离子晶体、分子晶体和原子晶体》(第1课时)教学设计《离子晶体、分子晶体和原子晶体》(第1课时)教学设计一、离子晶体1.定义:离子间通过离子键结合而成的晶体。
阳离子:活泼金属的阳离子(例如IA和IIA的金属)和铵根离子。
阴离子:活泼非金属的阴离子(例如VIA和VIIA的非金属)和酸根离子。
注意:①含金属元素的离子不一定是阳离子,例如:偏铝酸根离子等。
②由非金属元素组成的离子不一定是阴离子,例如:铵根离子等。
③由金属和非金属元素组成的化合物不一定是离子晶体,例如:氯化铝为分子晶体。
④全部由非金属元素组成的化合物也可能是离子晶体,例如:铵盐等。
⑤离子晶体中一定存在离子键,还可能存在共价键,例如:氢氧化钠、过氧化钠等。
⑥含有离子键的晶体一定是离子晶体。
2.物理性质(1)硬度较大、难于压缩。
(2)有较高的熔点和沸点,且离子键越强,熔沸点越高。
离子半径越小、离子所带的电荷越高,则离子键越强,熔沸点越高。
例如:氯化钠熔点801℃沸点1413℃氯化铯645℃1290℃(3)在水溶液和熔融状态下能够导电。
注意:①在熔融状态下能够导电的化合物一定是离子晶体(注意金属的导电性)。
②在水溶液中能够导电的化合物不一定是离子晶体,例如:硫酸等。
3.空间构型(1)晶胞:晶体中最小的重复单元。
(2)氯化钠①Na+和Cl—;是相间着沿立方体进行排列的。
②每个Na+周围等距离且最近的Cl—;是6个,这6个Cl—;连线形成的空间几何体为正八面体(Na+位于中心位置)。
同时,每个Cl—;周围等距离且最近的Na+也是6个。
③每个Na+周围等距离且最近的Na+是12个。
④1个氯化钠晶胞所占有的Na+4个、Cl—;4个。
Na+:体心1个,棱上12个,所以共1x1+12x1/4=4个Cl—;:面心6个,角顶8个,所以共6x1/2+8x1/8=4个计算方法:晶胞完全占有的粒子数:体心为1、面心为1/2、棱上为1/4、角顶为1/8。
离子晶体教学设计

[教学设计]第四节离子晶体【知识与技能】1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2.学会离子晶体的性质与晶胞结构的关系。
3.通过探究知道离子晶体的配位数与离子半径比的关系。
4、了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。
【教学重点】离子晶体的物理性质的特点;离子晶体的配位数及其影响因素;晶格能的定义和应有用。
【教学难点】离子晶体配位数的影响因素;晶格能的定义和应有用。
【教案设计】【回忆复习】分子晶体、原子晶体分别有哪些物理特性?【投影】晶体比较【问题引入】1.钠原子与氯原子是如何结合成氯化钠的?你能用电子式表示氯化钠的形成过程吗?2.常见的离子化合物包括哪些?常温下以什么形态存在?晶体是如何形成的?构成微粒是什么?这些微粒是怎样堆集的?【展图观察】NaCl、CsCl晶体模型。
【板书】一、离子晶体1、定义:离子间通过离子键结合而成的晶体(1)结构微粒:阴、阳离子(2)相互作用:离子键【讲解】通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,只要空间条件允许,一个离子可以同时吸引多个带相反电荷的离子。
因此离子键没有方向性和饱和性。
【板书】离子键无方向性和无饱和性【展示图片】(3)种类繁多:含离子键的化合物晶体:强碱、活泼金属氧化物、绝大多数盐(4)理论上,结构粒子可向空间无限扩展【思考】NaCl、CsCl晶体中有无单个个分子,“NaCl”、“CsCl”是否代表分子组成呢?【讲述】在NaCl晶体或CsCl晶体中,都不存在单个的NaCl分子或单个的CsCl分子,但是,在这两种晶体里阴、阳离子的个数比都是1∶1。
所以,NaCl和CsCl是表示离子晶体中离子个数比的化学式,而不是表示分子组成的分子式。
【思考】在NaCl晶体中,每个Na+周围有几个Cl-?每个Cl-周围有几个Na+?在CsCl晶体中,每个Cs+周围有几个Cl-?每个Cl-周围有几个Cs+?【板书】二、离子晶体中离子键的配位数(1)定义:是指一个离子周围邻近的异电性离子的数目【探究】NaCl和CsCl晶体中阴、阳离子的配位数【思考】为什么同是AB型离子晶体,CsCl与NaCl的晶体结构和配位数不一样?请从两者的组成中试寻找形成差异的原因。
2024高中化学离子晶体教案

2024高中化学离子晶体教案第一章:离子晶体的定义与特征1.1 离子晶体的定义1.2 离子晶体的特征1.3 离子晶体的组成元素第二章:离子的结构与性质2.1 离子的结构2.2 离子的性质2.3 离子的大小与电荷第三章:离子晶体的空间结构3.1 简单立方堆积3.2 面心立方堆积3.3 体心立方堆积3.4 六方最密堆积第四章:离子晶体的化学键4.1 离子键的定义与性质4.2 离子键的形成与断裂4.3 离子键的类型与特点第五章:离子晶体的物理性质5.1 熔点与沸点5.2 硬度与韧性5.3 导电性与热膨胀第六章:离子晶体的制备方法6.1 离子晶体的实验室制备6.2 离子晶体的工业制备6.3 制备过程中的影响因素第七章:离子晶体的重要类型7.1 碱金属离子晶体7.2 碱土金属离子晶体7.3 卤素离子晶体7.4 过渡金属离子晶体第八章:离子晶体在水中的溶解性8.1 离子晶体溶解平衡8.2 离子晶体溶解速率8.3 影响溶解性的因素第九章:离子晶体的应用领域9.1 陶瓷材料中的应用9.2 玻璃工业中的应用9.3 制药工业中的应用9.4 材料科学研究中的应用第十章:离子晶体的发展趋势与挑战10.1 新型离子晶体的设计与合成10.2 离子晶体在纳米尺度上的应用10.3 离子晶体环境的可持续性10.4 未来发展趋势与挑战第十一章:离子晶体的结构分析技术11.1 X射线晶体学11.2 核磁共振(NMR)11.3 电子显微镜技术11.4 光学显微镜与颜色观察第十二章:离子晶体的光谱技术12.1 红外光谱(IR)12.2 拉曼光谱(Raman)12.3 紫外-可见光谱(UV-Vis)12.4 质谱(MS)第十三章:离子晶体的电化学性质13.1 离子晶体的电导性13.2 离子晶体的电化学反应13.3 离子晶体电化学电池13.4 离子晶体电化学传感器第十四章:离子晶体在现代科技中的应用14.1 离子晶体在电子学中的应用14.2 离子晶体在光电子学中的应用14.3 离子晶体在能源存储中的应用14.4 离子晶体在生物医学中的应用第十五章:离子晶体的教学与研究方法15.1 离子晶体的教学策略15.2 离子晶体的研究方法论15.3 离子晶体实验设计与操作15.4 离子晶体研究领域的前沿问题重点和难点解析本文教案涵盖了离子晶体的基本概念、结构、性质、制备方法、应用领域以及研究前沿。
新人教版高二化学选修3:离子晶体(第1课时)教案 Word版

第四節離子晶體第一課時教學內容分析:學生具備了離子鍵、離子半徑、離子化合物等基礎知識,本節直接給出氯化鈉、氯化銫晶胞,然後在科學探究的基礎上介紹影響離子晶體結構的因素,通過製作典型的離子晶體模型來進一步理解離子晶體結構特點,為學習晶格能作好知識的鋪墊。
教學目標設定:1.掌握離子晶體的概念,能識別氯化鈉、氯化銫、氟化鈣的晶胞結構。
2.學會離子晶體的性質與晶胞結構的關係。
3.通過探究知道離子晶體的配位數與離子半徑比的關係。
4、通過碳酸鹽的熱分解溫度與陽離子半徑的自學,拓展學生視野。
教學重點難點:1、離子晶體的物理性質的特點2、離子晶體配位數及其影響因素教學方法建議:分析、歸納、討論、探究教學過程設計:[引入]1、什麼是離子鍵?什麼是離子化合物?2、下列物質中哪些是離子化合物?哪些是只含離子鍵的離子化合物?Na2O NH4Cl O2Na2SO4NaCl CsCl CaF23、我們已經學習過幾種晶體?它們的結構微粒和微粒間的相互作用分別是什麼?[板書]一、離子晶體[展示] NaCl 、CsCl晶體模型[板書]陰、陽離子通過離子鍵形成離子晶體1、離子晶體定義:由陽離子和陰離子通過離子鍵結合而成的晶體注:(1)結構微粒:陰、陽離子(2)相互作用:離子鍵(3)種類繁多:含離子鍵的化合物晶體:強鹼、活潑金屬氧化物、絕大多數鹽(4)理論上,結構粒子可向空間無限擴展[思考]下列物質的晶體,哪些屬離子晶體?離子晶體與離子化合物之間的關係是什麼?乾冰、NaOH、H2SO4、K2SO4、NH4Cl、CsCl[投影]2、離子晶體的物理性質及解釋離子晶體溶解性差異較大:NaCl、KNO3、(NH4)2SO4_______BaSO4、CaCO3_______[板書]3、離子晶體中離子鍵的配位數(C.N.)(1)定義:是指一個離子周圍鄰近的異電性離子的數目[探究] NaCl和CsCl晶體中陰、陽離子的配位數(2[投影][學生活動] NaCl、CsCl中正、負離子的半徑比和配位數[自主探究]CaF2晶體中陰、陽離子的配位數[板書](3)影響陰、陽離子的配位數的因素|①正、負離子半徑比的大小②正、負離子所帶電荷的多少[學生活動]四種類型晶體的比較[練習]1、下列含有極性鍵的離子晶體是①醋酸鈉②氫氧化鉀③金剛石④乙醇⑤氯化鈣A、①②⑤B、①②C、①④⑤D、①⑤2下列說法正確的是A、一種金屬元素和一種非金屬元素一定能形成離子化合物B、離子鍵只存在於離子化合物中C、共價鍵只存在於共價化合物中D、離子化合物中必定含有金屬元素3、CsCl晶體中Cs+的 C.N.是____ Cl-的C.N.是_____.CaF2晶體中Ca2+的 C.N.是____ F-的C.N.是_____.已知KCl的晶體結構與NaCl的相似,則KCl晶體中K+的 C.N.是____ Cl-的C.N.是_____.。
3.3.2离子晶体教学设计2023-2024学年高二下学期化学人教版(2019)选择性必修2

今天,我在课堂上教授了离子晶体这一章节。通过观察学生的课堂表现、小组讨论成果展示和随堂测试,我发现学生们对离子晶体的构成、性质和应用有一定的理解。然而,在教学过程中,我也发现了一些问题,需要我在今后的教学中进行改进。
首先,在讲授离子晶体的构成和性质时,我发现学生们对离子键的概念和性质的理解不够深入。为了更好地帮助学生理解离子键,我计划在下一次教学中使用更多的实例和实验来展示离子键的形成和作用。同时,我也会鼓励学生们积极参与课堂讨论,提出自己的疑问和看法,以促进他们对离子键的理解和掌握。
4. 课后作业:通过评价学生在课后作业的完成情况和质量,可以评价他们对离子晶体知识的巩固和应用能力。例如,如果学生在课后作业中能够正确应用所学知识解决问题,并且作业完成质量高,则表明他们对离子晶体的知识有较好的掌握和应用能力。
5. 教师评价与反馈:根据以上各方面的评价,教师可以对学生的学习情况进行总结和反馈。例如,如果学生在课堂表现、小组讨论、随堂测试和课后作业方面都表现出色,教师可以给予积极的评价,鼓励他们继续保持良好的学习态度和能力。同时,教师也可以针对学生在某些方面的不足提出改进建议,帮助他们进一步提高。
4. 创新与迁移:培养学生运用所学知识,解决实际问题和创新的能力,能够将离子晶体的知识迁移到其他相关领域。
5. 科学态度与价值观:培养学生对科学的热爱和好奇心,培养学生的科学态度和价值观,使学生认识到科学对于社会和人类的重要性。
三、重点难点及解决办法
重点:
1. 离子晶体的定义、构成和性质。
2. 离子晶体在实际应用中的例子。
3.3.2 离子晶体 教学设计 2023-2024学年高二下学期化学人教版(2019)选择性必修2
课题:
科目:
班级:
2024-2025学年高中化学下学期第三周离子晶体教学设计

(2)在讲授新课时,采取了提问、讨论等多种教学方法,有助于学生理解和掌握知识。
(3)课堂练习和小组讨论相结合,提高了学生的实践能力和合作精神。
然而,我也发现了一些不足之处:
(1)在讲授离子晶体构成时,部分学生对于离子间的电荷吸引和空间排列理解不够深入,需要进一步加强。
(2)在离子方程式书写环节,通过更多实例分析和练习题,让学生在实际操作中熟练掌握离子的释放和反应过程。同时,设计一些有趣的化学实验,让学生在实验过程中更好地理解离子方程式的意义。
(3)加强与学生的互动,鼓励学生提出问题,及时解答学生的疑问。在课堂提问环节,针对不同学生的回答,进行有针对性的引导和点评,提高学生的思维能力和逻辑推理能力。
- 离子晶体的研究前沿,例如:新型离子晶体材料的合成和应用。
- 相关的学术期刊和论文,例如:《晶体学杂志》、《化学学报》等术期刊和论文,了解离子晶体研究的最新进展。
- 学生可以参观材料科学实验室或相关企业,了解离子晶体在实际应用中的具体情况。
- 学生可以进行一些离子晶体的合成实验,深入探究离子晶体的性质和应用。
5. 离子晶体性质解释的题目:
题目:为什么离子晶体具有较高的熔点和硬度?
答案:离子晶体中的离子通过电荷吸引形成稳定的晶体结构,因此具有较高的熔点。在熔融状态下,离子可以自由移动,但离子间的相互作用依然很强,因此熔融状态下的离子晶体具有较高的硬度。
作业布置与反馈
1. 作业布置:
根据本节课的教学内容和目标,布置以下作业,以帮助学生巩固所学知识并提高能力:
2024-2025学年高中化学下学期第三周 离子晶体教学设计
主备人
备课成员
教材分析
鲁科版化学选修3《离子晶体》优秀教案(重点资料).doc

第2节金属晶体与离子晶体第二课时离子晶体【教学目标】1. 使学生认识几种常见的AB型离子晶体(NaCl、CsCl、ZnS)的结构,了解其配位数情况。
2. 能用“切割法”计算一个给定的简单离子晶体晶胞中实际拥有的阴、阳离子个数。
3. 了解晶格能的概念,知道离子晶体的熔、沸点等性质决定于晶格能的大小;知道晶格能的大小与离子晶体的结构型式和阴、阳离子所带电荷以及阴、阳离子的间距有关。
【教学重点、难点】离子晶体的空间堆积方式,离子晶体的结构特点【教学方法】借助模型课件教学【教师具备】制作课件【教学过程】【复习引入】1. 晶体有哪些类型?2. 什么叫离子晶体?【回答】1. 金属晶体,离子晶体,分子晶体和原子晶体。
2.离子晶体是阴、阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。
那么,离子晶体的结构是怎样的,有什么特点呢?我们这节课就来学习离子晶体的结构。
【板书】二、离子晶体我们先来探讨NaCl晶体的内部结构【提出问题】请同学们观察NaCl晶体的堆积模型,思考以下问题:1. NaCl晶体采取哪种堆积方式?2. 像NaCl这样的离子晶体采取密堆积的原因是什么?【回答】1. NaCl晶体中的Cl-采取A1型密堆积,Na+填在Cl- 所形成的空隙中,整体是采取不等径圆球的密堆积。
2. 离子晶体微粒间的作用力为离子键,离子键无方向性和饱和性,因此离子晶体尽可能采取密堆积,以使得体系能量降低,达到稳定状态。
【过渡】我们知道晶体中最小的结构重复单元称为晶胞,将一个个晶胞上、下、前、后、左右并置起来,就构成整个晶体结构,那么NaCl晶胞是怎样的呢?【展示】NaCl的堆积模型请同学们观察NaCl晶胞,思考以下几个问题:1.NaCl晶体中Na+和Cl-的配位数分别为多少?2. NaCl晶体中在Na+周围与它最近且距离相等的 Na+共有几个?3.一个NaCl晶胞中含有的Na+和Cl-各是多少?4.“NaCl”这一化学式表示什么含义?学生看到屏幕上NaCl晶胞中体心上的Na+,6个面心上的Cl-不停地闪烁1.在NaCl晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,所以Na+、Cl-配位数均为62.12个3.Na+:12ⅹ1/4+1=4 Cl-:8ⅹ1/8+6ⅹ1/2=44.离子晶体中,并不存在单独的“NaCl”分子,在整个晶体Na+与Cl-的个数比为1:1,因此,“NaCl”这一化学式表示的只是氯化钠的组成。
3.3.2《离子晶体》教学设计2023-2024学年高二化学人教版(2019)选择性必修2
目标:通过具体案例,让学生深入了解离子晶体的特性和重要性。
过程:
选择几个典型的离子晶体案例进行分析。
详细介绍每个案例的背景、特点和意义,让学生全面了解离子晶体的多样性或复杂性。
引导学生思考这些案例对实际生活或学习的影响,以及如何应用离子晶体解决实际问题。
小组讨论:让学生分组讨论离子晶体的未来发展趋势或改进方向,并提出创新性的想法或建议。
简短介绍离子晶体的基本概念和重要性,为接下来的学习打下基础。
2.离子晶体基础知识讲解(10分钟)
目标:让学生了解离子晶体的基本概念、组成部分和原理。
过程:
讲解离子晶体的定义,包括其主要组成元素或结构。
详细介绍离子晶体的组成部分或功能,使用图表或示意图帮助学生理解。
通过实例或案例,让学生更好地理解离子晶体在实际应用或科学研究中的作用。
3.离子晶体的空间结构:离子晶体的空间结构主要有立方晶系、六方晶系等类型。不同的空间结构决定了离子晶体的不同性质和外观。
4.离子晶体的性质:离子晶体具有较高的熔点、硬度和导电性。这是因为离子键的强度大于共价键和金属键,使得离子晶体具有这些独特的物理性质。
5.离子晶体的实际应用:离子晶体在现实生活中有广泛的应用,例如在制造玻璃、陶瓷等材料中,以及在电池、催化剂等领域的应用。
强调离子晶体在现实生活或学习中的价值和作用,鼓励学生进一步探索和应用离子晶体。
布置课后作业:让学生撰写一篇关于离子晶体的短文或报告,以巩固学习效果。
知识点梳理
1.离子晶体的定义:离子晶体是由阳离子和阴离子通过离子键相互结合形成的晶体。
2.离子晶体的构成元素:离子晶体主要由金属元素和非金属元素组成。金属元素失去电子成为阳离子,非金属元素获得电子成为阴离子。
34离子晶体教案(人教版选修3).doc

NaCl 晶胞:(1) 1个NaCl 晶胞中,有 ________ 个NaS 有 ________ 个C 「。
(2) 在N“C1晶体中,Nf 的配位数为 ______ , C1 一的配位数为 ______ 。
说明:离子晶体中与某离子距离最近的异性离子的数目叫该离子的配位数。
(配位数缩写为C. N.)(3) 在NaCl 品体屮,每个NQ 周围与它最接近且距离相等的Nf 共有 _______ 个。
同理:每个C 「周围与它最接近且距离相等的ci —共有 ________个。
CsCl 晶胞:(1) 1个CsCl 品胞屮,有 _____ 个CsS 有 _____ 个C 「。
(2) 在CsCl 晶体中,Cs+的配位数为 ______ , C1-的配位数为 _______ o (3) 在CsCl 晶体中,每个Cs+周围与它最接近且距离相等的Cs+共有 _______ 个, 形成 ________________ 形。
同理:在CsCl 晶体中,每个C 厂周围与它最接近且距离相等的C1■共有 _____个。
【投影】CaF2晶胞 CaF2晶胞:(1) 1个cm 的晶胞中,有 ____________ 个c 『+, 有 __________ 个厂。
(2) CK 的晶体中,Cf 和厂的配位数不同,C 产配位数是 _________ ,厂的配位数是 ______ 。
思考:为什么NaCl 、CsCl 化学式相似,空间结构不同?【板书】3、影响离子晶体配位数的因素。
提出 问题 引导 学生观察 氯化 钠、 氯化 艳、 氟化 钙的 晶胞 结构 ,最 后归 纳得 出结 论。
(1)儿何因素・晶体屮正、负离子的半径比半径比(r+/r)0. 2 〜0.40. 4〜0.70. 7〜1.0〉1.0配位数46812代表物ZnS NaCl CsCl CsF结论:AB型离子晶体中,正、负离子的半径比越大,离子的配位数越大。
(2)电荷因素——品体中正、负离子的电荷比(3)键性因素 ----- 离子键的纯粹程度【巩固练习】1>已知KC1的晶体结构与NaCl的相似,则KC1晶体中K’的C.N.是________ , CT的C.N.是_____ o2、现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a 处于晶胞的中心),可推知:甲晶体中x与y的个数比是_____________ ,乙中a与b的个数比是 ______ ,丙晶胞中有________ 个c离子,有 ____________ 个d离子。
34离子晶体第1课时教案人教选修3.doc
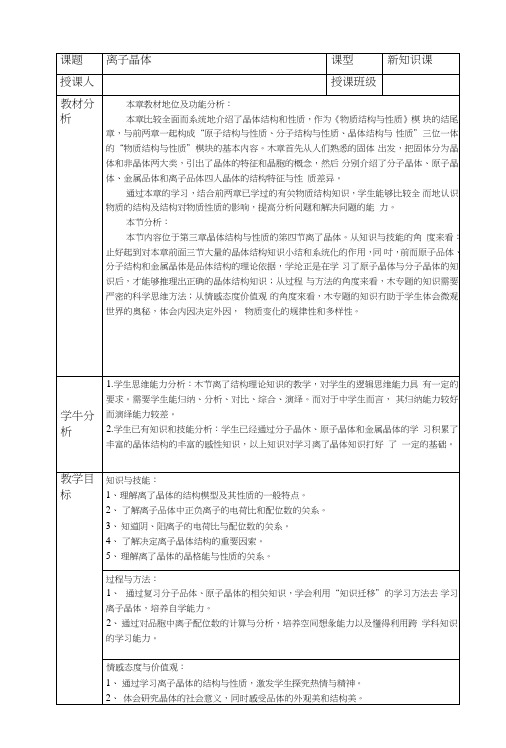
离子晶体(第一课时)教学设计流程图活动1.1.1:回顾已经学过的分子晶体、原子晶体的活动1.1.2:推导出离子晶体的概念及性质活动1.2.1:归纳常见的离了晶体概念与性质活动2.1.1:观看氯化锥的晶胞模型活动2.1. 2小组讨论分析氯化锥晶体中,艳离了和氯离了的位置,每个Cs+周围同时吸引着几个CL,每个CL周围同时吸引着儿个Cs"活动2.1.3:尝试为离了晶体中离了的配位数下定义活动2.1.1:观看氯化钠的晶胞模型活动2.1.1:讨论钠离了和氯离了的配位数各是多少活动2.2.1:阅读教材78页科学探究完成表格活动2.2.2:小组讨论为什么同是AB型离子晶体,CsCl与NaCl的晶体结构不同?活动223:总结出儿何因素活动2.2.4观看氟化钙的晶体模型,数出阴阳离子的配位数,小组讨论NaCl与CaF?的晶体结构为何不同?活动2.2.5:总结出正负离子电荷比的电荷因素活动2.3.1:课后制作CsCl与NaCl 的晶体模烈教学过稈学习任务或教学环板块1.建构离子品体的概念、性质任务1.1概念及性质任务1.2常见的离了品体教师活动复习前几节课学过的分了晶体、原了晶体的概念与性质小组讨论推导出离子品体的概念及性质板书:一、离子品体1.离子品体概念:由阳离子和阴离子通过离子键结合而成的晶体2.性质:熔沸点较高提问:构成离了晶体的粒了是什么?粒子间的相互作用是什么?提问:组成离子品体的物质有哪些?教师总结:常见的离子晶体有:从组成上看:活泼金属与活泼非金属元素组成的晶体。
从类别看:强碱:KOH、Ca(OH)2、NaOH、Ba(OH)2等。
大部分盐类:NaCl、CaF?、Na?SO4、CH3COONa^NH4CI 等。
某些金属氧化物:CaO> QO等板书:3、常见的离子品体讲述:在离子晶体中,阴、阳离子是按一定规律在空间排列的,卜-面就以NaCl和CsCl晶体为例来讨论在离子晶体中阴,阳离子是怎样排列的?实物及投影展示:CsCl的晶胞模型CsCl晶胞学生活动设计意图小组讨论总结学生冋答:构成离子晶体的粒子是阴、阳离子,粒子间的相互作用是离子键。
34离子晶体教案6(人教版选修3).doc

第三章第四节离子晶体第一课时教学目标1.使学生理解氯化钠、氯化铠等典型离子晶体的结构模型及其性质的一般特点。
2.使学生理解离子晶体的晶体类型与性质的关系。
3.复习已学过原子结构、元素周期表、化学键、分子极性等相关基础知识, 帮助学生形成知识网络。
4.掌握根据晶体结构模型计算微粒数的一般方法。
教学重点、难点:1、NaCl和CsCl的晶胞结构及离子晶体的物理性质的特点2、离子晶体配位数及其影响因素教学过程(一)引入新课[复习提问]]1、什么是离子键?什么是离子化合物?2、下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物?Na2O NH4C1 02 Na2SO4 NaCl CsCl CaF23、我们已经学习过儿种晶体?它们的构成微粒和微粒间的相互作用分别是什么?[课题板书]离子晶体一、离了晶体1、概念:离子间通过离子键形成的晶体2、空间结构以NaCl. CsCl为例来,以媒体为手段,攻克离子晶体空间结构这一难点[针对性练习][例1]如图为NaCl晶体中取出一部分的结构图,图中直线交点处为NaCl晶体中NJ与C1所处的位置(不考虑体积的大小)o• v -—夕—-(•O------------ -■¥(1)若该立方体中心处是一钠离子,请将图中代表N分的小圆用笔涂黑,以完成NaCl晶体结构示意图。
分析这个立方体示意图屮共有多少个“NaCl”单元?(2)从晶胞中分析周围与它最近且距离相等的N1共有多少个?[解析]下图中心圆甲涂黑为N『,与之相隔均要涂黑(1)图中大立方体是NaCl的晶胞。
由8个小立方体构成,由于顶点上的微粒是由八个相同的立方体共用、棱上的微粒是由四个相同的立方体共用、面上的微粒是由两个相同的立方体共用。
可如下计算晶胞中钠离子、氯离子个数:计算在该晶胞中含有Nd的数目。
在晶胞中心有1个Na ,在棱上共有12个Na ,又因棱上每个Na+又为周围4个晶胞所共有,所以该晶胞独占的是12X1/4=3个,该晶胞共有的N Q+为4个。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教学设计
《离子晶体》教学设计
五常市高级中学解晓丽
《离子晶体》教学设计
教材分析:关于离子晶体,教材以离子键的知识为基础,以学生比较熟悉的NaCl晶体为例子,介绍了离子晶体的结构模型,并对一些性质作了解释。
教材还通过举例归纳一些离子晶体的溶解性,使教材与初中内容衔接,帮助学生复习初中学过的知识。
该部分内容理论性较强,比较抽象,教材除了选择学生易接受的知识和使用通俗的语言外,还选配了较多的插图,以帮助学生理解知识,并提高兴趣。
学生分析:学生在高一曾学习了物质结构和元素周期律、离子键、共价键等知识,在此基础上,再学习离子晶体,不但可使学生对有关知识有更全面的了解,也可使学生进一步深化对所学知识的认识。
但由于该内容抽象,离子晶体的化学式所表示的含义,学生不易理解,均摊法求晶体的化学式也是对学生来说也是一大难点。
设计思路:
1、为了加强直观教学,尽可能把复杂问题简单化,抽象问题具体化,降低学生理解知识的难度,激发学生的兴趣,我利用3D动画把离子晶体的空间结构充分展示给学生,关于均摊法求化学式也就由难变易,有效地突破了难点;
2、这节课我大胆改革,是一节学生自主学习课,全部的课程内容都在课件中体现,无须教师讲解,学生只要操作电脑就可以把本节内容学习,并配有课堂练习、趣味化学等,使学生的学习不局限在书本上,教师只起到引导、适时点拔的作用。
(该课件在哈市课件大赛上获一等奖)
第一节离子晶体、分子晶体、原子晶体
1、定义
2、离子晶体的结构分析①NaCl晶体②CsCl晶体
3、用均摊法确定晶体的化学式
i处于顶点的粒子
ii处于棱上的粒子
iii处于面上的粒子
iv处于晶胞内部的粒子
4。
、离子晶体的物理性质
沸点较高,硬度较大;融状态下、水溶液能导电;。
