物理化学期末复习(第五版上)
物理化学第五版上册复习题及答案

第二章热力学第一定律一、选择题1、下列叙述中不具状态函数特征的是:()(A)系统状态确定后,状态函数的值也确定(B)系统变化时,状态函数的改变值只由系统的初终态决定(C)经循环过程,状态函数的值不变(D)状态函数均有加和性2、下列叙述中,不具可逆过程特征的是:()(A)过程的每一步都接近平衡态,故进行得无限缓慢(B)沿原途径反向进行时,每一小步系统与环境均能复原(C)过程的初态与终态必定相同(D)过程中,若做功则做最大功,若耗功则耗最小功3、如图,将CuSO4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行电解,可以看作封闭体系的是:()(A)绝热箱中所有物质(B)两个铜电极(C)蓄电池和铜电极(D) CuSO4水溶液5、在下列关于焓的描述中,正确的是()(A)因为ΔH=QP,所以焓是恒压热(B)气体的焓只是温度的函数(C)气体在节流膨胀中,它的焓不改变(D)因为ΔH=ΔU+Δ(PV),所以任何过程都有ΔH>0的结论6、在标准压力下,1mol石墨与氧气反应生成1mol二氧化碳的反应热为Δr H ,下列哪种说法是错误的? ()(A) ΔH 是CO2(g)的标准生成热(B) ΔH =ΔU(C) ΔH 是石墨的燃烧热(D) ΔU <ΔH7、在标准状态下,反应C2H5OH(l)+3O2(g) →2CO2(g)+3H2O(g)的反应焓为Δr H mθ, ΔC p>0, 下列说法中正确的是()(A)Δr H mθ是C2H5OH(l)的标准摩尔燃烧焓(B)Δr H mθ〈0(C)Δr H mθ=ΔrUmθ(D)Δr H mθ不随温度变化而变化8、下面关于标准摩尔生成焓的描述中,不正确的是()(A)生成反应中的单质必须是稳定的相态单质(B)稳态单质的标准摩尔生成焓被定为零(C)生成反应的温度必须是298.15K(D)生成反应中各物质所达到的压力必须是100KPa9、在一个绝热钢瓶中,发生一个放热的分子数增加的化学反应,那么:()(A) Q > 0,W > 0,∆U > 0 (B)Q = 0,W = 0,∆U < 0(C) Q = 0,W = 0,∆U = 0 (D) Q < 0,W > 0,∆U < 010、非理想气体进行绝热自由膨胀时,下述答案中哪一个是错误的? ( )(A) Q=0 (B) W=0 (C) ΔU=0 (D) ΔH=011、下列表示式中正确的是( )(A)恒压过程ΔH=ΔU+pΔV (B)恒压过程ΔH=0(C)恒压过程ΔH=ΔU+VΔp (D)恒容过程ΔH=012、理想气体等温反抗恒外压膨胀,则( )(A)Q>W (B)Q<W (C)Q=W (D)Q=△U13、当理想气体其温度由298K升高到348K,经(1)绝热过程和(2)等压过程,则两过程的()(A)△H1>△H2W1<W2(B)△H1<△H2 W1>W2(C)△H1=△H2 W1<W2(D)△H1=△H2 W1>W214、当理想气体从298K,2×105Pa 经历(1)绝热可逆膨胀和(2)等温可逆膨胀到1×105Pa时,则( )(A)△H1<△H2 W1>W2(B)△H1>△H2 W1<W2(C)△H1<△H2 W1<W2(D)△H1>△H2 W1>W215、对于封闭体系,在指定始终态间的绝热可逆途径可以有:( )(A) 一条(B) 二条(C) 三条(D) 三条以上16、实际气体绝热恒外压膨胀时,其温度将:( )(A) 升高(B) 降低(C) 不变(D) 不确定17、功的计算公式为W=nC v,m(T2-T1),下列过程中不能用此式的是()(A)理想气体的可逆绝热过程(B)理想气体的绝热恒外压过程(C)实际气体的绝热过程(D)凝聚系统的绝热过程18、凡是在孤立体系中进行的变化,其ΔU和ΔH的值一定是:( )(A) ΔU> 0 , ΔH > 0 (B) ΔU= 0 , ΔH = 0(C) ΔU< 0 , ΔH < 0 (D) ΔU= 0 , ΔH大于、小于或等于零不确定19、一定量的理想气体从同一始态出发,分别经(1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有:( )(A) H1> H2 (B) H1= H2 (C) H1< H2 (D) H1>=H220、将H2(g)与O2以2:1的比例在绝热刚性密闭容器中完全反应,则该过程中应有()(A)ΔT=0 (B)Δp=0 (C)ΔU=0 (D)ΔH=021、刚性绝热箱内发生一化学反应,则反应体系为( )(A)孤立体系(B)敞开体系(C)封闭体系(D)绝热体系22、理想气体可逆绝热膨胀,则下列说法中正确的是( )(A)焓总是不变(B)内能总是增加(C)焓总是增加(D)内能总是减少23、关于等压摩尔热容和等容摩尔热容,下面的说法中不正确的是( )(A)C p,m与C v,m不相等,因等压过程比等容过程系统多作体积功(B)C p,m–C v,m=R既适用于理想气体体系,也适用于实际气体体系(C)C v,m=3/2R适用于单原子理想气体混合物(D)在可逆相变中C p,m和C v,m都为无限大24、下列哪个过程的dT≠0,dH=0?( )(A)理想气体等压过程(B)实际气体等压过程(C)理想气体等容过程(D)实际气体节流膨胀过程25、隔离系统内发生一变化过程,则系统的:(A)热力学能守恒,焓守恒(B)热力学能不一定守恒,焓守恒(C)热力学能守恒,焓不一定守恒(D)热力学能、焓均不一定守恒二、判断题1、体系在某过程中向环境放热,则体系的内能减少。
(NEW)傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解

目 录第1章 气 体1.1 复习笔记1.2 课后习题详解1.3 名校考研真题详解第2章 热力学第一定律2.1 复习笔记2.2 课后习题详解2.3 名校考研真题详解第3章 热力学第二定律3.1 复习笔记3.2 课后习题详解3.3 名校考研真题详解第4章 多组分系统热力学及其在溶液中的应用4.1 复习笔记4.2 课后习题详解4.3 名校考研真题详解第5章 相平衡5.1 复习笔记5.2 课后习题详解5.3 名校考研真题详解第6章 化学平衡6.1 复习笔记6.2 课后习题详解6.3 名校考研真题详解第7章 统计热力学基础7.1 复习笔记7.2 课后习题详解7.3 名校考研真题详解第8章 电解质溶液8.1 复习笔记8.2 课后习题详解8.3 名校考研真题详解第9章 可逆电池的电动势及其应用9.1 复习笔记9.2 课后习题详解9.3 名校考研真题详解第10章 电解与极化作用10.1 复习笔记10.2 课后习题详解10.3 名校考研真题详解第11章 化学动力学基础(一)11.1 复习笔记11.2 课后习题详解11.3 名校考研真题详解第12章 化学动力学基础(二)12.1 复习笔记12.2 课后习题详解12.3 名校考研真题详解第13章 表面物理化学13.1 复习笔记13.2 课后习题详解13.3 名校考研真题详解第14章 胶体分散系统和大分子溶液14.1 复习笔记14.2 课后习题详解14.3 名校考研真题详解第1章 气 体1.1 复习笔记一、气体分子动理论1.理想气体理想气体:在任何压力、任何温度下都符合理想气体状态方程pV=nRT 的气体。
理想气体状态方程中,p为气体压力,单位是Pa;V为气体的体积,单位是m3;n为物质的量,单位是mol;T为热力学温度,单位是K;R是摩尔气体常数,。
2.气体分子动理论的基本公式(1)气体分子运动的微观模型①气体是大量分子的集合体;②气体分子不断地作无规则的运动,均匀分布在整个容器之中;③分子彼此的碰撞以及分子与器壁的碰撞是完全弹性的。
物理化学(天大第五版上册)概念、公式整理

p 55. 逸度因子 ϕ B = B pB
对混合气体化学势表达式的修正 56. 拉乌尔(Raoult)定律:稀溶液中溶剂的 蒸汽压等于同一温度下纯溶剂的饱和蒸汽 压与溶液中溶剂的摩尔分数的乘积。
p A = p* A xA
57. 亨利(Henry)定律:一定温度下气体在 液态中的溶解度与该气体的压力成正比。 58. 理想液态混合物:任一组分在全部组成 范围内都符合拉乌尔定律的液态混合物。 59. 理想稀溶液:即无限稀薄溶液,溶质的 相对含量趋于零的溶液。 60. 活度 f =
δQr T 物理意义:表征系统无序度的参量。 波尔兹曼定理: S = k ln Ω
第二章 热力学第一定律 14. 经典热力学只考虑平衡问题, 只考虑系 统由始态到末态的净结果, 至于由始态到末 态的过程是如何发生于进行的、沿什么途 径、变化的快慢等等一些问题,经典热力学 往往不予考虑。 15. 隔离系统;封闭系统;敞开系统 16. 状态函数:T、p、V、U、H、S、A、 G 17. 热力学能 U = f (T ) 18. 热力学第一定律 ∆U = Q + W 19. 恒容热 QV = ∆U 20. 恒压热 Q p = ∆H ; H = U + pV 21. 盖斯定律:一个确定化学反应的恒容热 或恒压热只取决于始末状态。
∑n
B
BXB
42. 能斯特热定理: lim ∆ r S = 0
T →0 K
52. 吉布斯-杜亥姆(Gibbs - Duhem)方程
(热力学第三定律的基础) 43. 热力学第三定律:纯物质、完美晶体、 0K 时的熵为零,即 S * (0 K , 完美晶体) = 0 44. 亥姆霍兹函数(根据克劳修斯不等式)
《物理化学(第五版)》第九章复习题答案
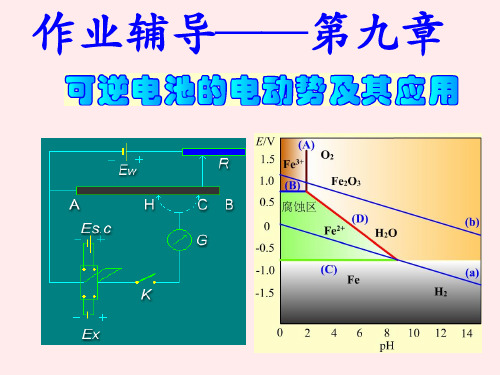
复习题
(1).H2O(1)的标准摩尔生成Gibbs自由能ΔfGmΘ (H2O,1); 电池:Pt|H2(pH2) | H+或OH-(aq) | O2(pO2)|Pt 净反应:H2(pΘ) + 1/2O2(pΘ) = H2O(l)
ΔfGmΘ (H2O,1)=-zEΘF
(2).H2O(1)的离子积常数KΘ; 电池:Pt|H2(pH2)|H+(aH+)||OH-(aOH-)|H2(pH2)|Pt 净反应:H2O(l) ⇔ H+(aH+) + OH-(aOH-)
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
RT m RT m E j= t -t ln = 2t -1 ln F m' F m'
E=E c+E j=
F
m ln m'
高价型:Mz+Az-(m1)|Mz+Az-(m2)
t t- RT m1 E j= - ln m2 z z- F
基本公式
用可逆电池的测定值计算热力学函数变化
值
r Gm zFE , r Gm zFE
RT E ln K a zF r Gm E r S m ( ) p zF ( ) p T T E QR T r Sm zFT ( ) p T
【通用】《物理化学(第五版)》第九章复习题答案.ppt
演示课件
复习题
7.在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ是否表示 该电池各物都处于标准态时,电池反应的 Gibbs自由能变化值?
答:在公式ΔrGmΘ=-zEΘF中,ΔrGmΘ表示该 电池各物都处于标准态时,在T,p保持不变 的条件下,按电池反应进行1mol的反应时 系统的Gibbs自由能变化值。
ln
m m'
高价型:Mz+Az-(m1)|Mz+Az-(m2)
E
j=
t z
- t- z 演示课-件
RT F
ln
m1 m2
基本公式
用可逆电池的测定值计算热力学函数变化
值
rGm zFE , rGm zFE
E
RT zF
ln
K
a
r Sm
( r Gm T
)p
E zF (T ) p
E
QR
T rSm
答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如:
Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极
反应所依附的惰性金属。
演示课件
复习题
2.什么叫电池的电动势?用伏特表侧得的电 池的端电压与电池的电动势是否相同?为何 在测电动势时要用对消法?
第五版物理化学复习资料
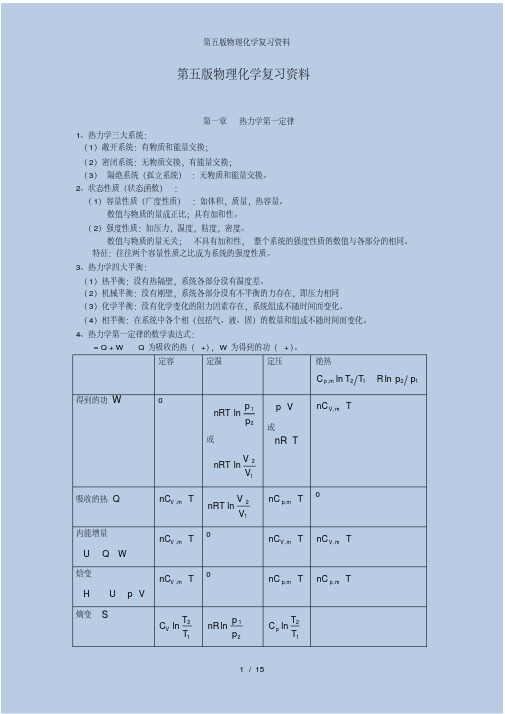
熵变 S
CV ln T2 T1
nR ln p 1 p2
C p ln T2 T1
1 / 15
第五版物理化学复习资料
亥姆霍兹(定温定 容)
A U TS
吉布斯(定温定压)
G H TS
或 nR ln V 2 V1
pdV nRT ln p2 p1
12、在通常温度下,对理想气体来说, 定容摩尔热容 为:
单原子分子系统
第五版物理化学复习资料
第五版物理化学复习资料
第一章 热力学第一定律
1、热力学三大系统: ( 1)敞开系统:有物质和能量交换;
( 2)密闭系统:无物质交换,有能量交换;
( 3) 隔绝系统(孤立系统) :无物质和能量交换。
2、状态性质(状态函数) :
( 1)容量性质(广度性质) :如体积,质量,热容量。
得到的功 W
0
nRT ln p 1 p2
或
pV
或
nR T
nRT ln V 2 V1
nCV,m T
吸收的热 Q
内能增量
U QW
nCV ,m T
nRT ln V 2 V1
nCV ,m T 0
nC p,m T 0 nCV ,m T nCV,m T
焓变
H
U pV
nCV ,m T 0
nC p,m T nC p,m T
16、气体的节流膨胀为一定焓过程,即
H 0。
2 / 15
第五版物理化学复习资料
17、化学反应热效应: 在定压或定容条件下, 当产物的温度与反应物的温度相同而在反应过 程中只做体积功不做其他功时, 化学反应所吸收或放出的热, 称为此过程的热效应, 或 “反应热”。
南京大学物理化学第五版上册复习题(PDF)

第二章 热力学第一定律一 判断题1. 理想气体经历绝热自由膨胀后,其内能变化为零。
2. 当系统的状态一定时,所有的状态函数都有一定的数值。
当系统的状态发生改变时,所有的状态函数的数值也随之发生变化。
3. 一定量的理想气体,当热力学能U 与温度确定后,则所有的状态函数也完全确定了。
4. 卡诺循环是可逆循环,当系统经一个卡诺循环后,不仅系统复原了,而且环境也复原了。
5. 理想气体非等压过程温度从T 1升至T 2,其焓变为ΔH =∫T1T2 C p dT6. 节流膨胀过程,不论是理想气体还是实际气体,也不论结果温度下降还是上升,都是等焓过程。
7. 稳定态单质的Δf H m O (500K) = 0 。
8. 热化学方程式 N 2(g )+3H 2(g)=2NH 3(g) Δr H m =-92.36kJ.mol -1其中的mol -1 意指每生成1mol NH 3(g)的热效应。
9. 因理想气体的热力学能与体积,压力无关,所以(ðU /ðV )P =0,(ðU /ðP )V =010. 1mol 水在101.325kPa 下由25ºC 升温至120ºC ,其ΔH =∫T1T2 C p,m dT 。
11. 因为内能和焓都是状态函数, 而恒容过程V U Q ∆=, 恒压过程p H Q ∆=, 所以Q p 何Q v是状态函数12. 恒温过程表示系统既不放热, 也不吸热13. 由于绝热过程Q=0, W=ΔU, 所以W 也是状态函数14. 当理想气体反抗一定的压力做绝热膨胀时, 其内能总是减小的.15. 理想气体的内能只是温度的函数, 当其做自由膨胀时, 温度何内能不变, 则其状态函数也不发生变化16. H 2O(1)的标准摩尔生成焓也是同温度下H 2(g)的标准摩尔燃烧焓17. CO 的标准摩尔生成焓 也就是同温度下石墨的标准摩尔燃烧焓18. 1mol 乙醇在等温变为蒸汽, 假设为理想气体, 因该过程温度不变, 故ΔU=ΔH=019. 系统的温度愈高, 热量就愈高, 内能就愈大20. 不可逆过程的特征是系统不能恢复到原态二 选择题1. 在绝热盛水容器中,浸有电阻丝,通以电流一段时间,如以电阻丝为体系,则上述过程的Q ,W 和体系的△U 值的符号为( )A :W =0,Q <0,△U <0B ;W <0,Q =0,△U >0C :W =0,Q >0,△U >0D :W <0,Q <0,△U >02. 隔离系统内 ( )A 热力学能守恒,焓守恒B 热力学能不一定守恒,焓守恒C 热力学能守恒,焓不一定守恒D 热力学能. 焓均不一定守恒3. 非理想气体在绝热条件下向真空膨胀后,下述答案中不正确的是( )A Q =0B W =0C ΔU =0D ΔH =04. 1mol 水银蒸气在正常沸点630K 时压缩成液体。
《物理化学(第五版)》第九章复习题答案

复习题
8.有哪些求算标准电动势EΘ的方法?在公式E zF ln K 中,EΘ是否是电池反应达平衡时的电动势?KΘ是否是
zE F K exp RT
a
复习题
(8).醋酸的解离平衡常数。 电池:Pt|H2(pΘ)|HAc(mHAc),Ac-(mAc-),Cl-(aCl)|AgCl(s)|Ag(s) 净反应:AgCl(s)+H2(pΘ)→H+(aH+)+Cl-(aCl-) +Ag(s
1.可逆电极有哪些主要类型?每种类型试举一例,并写 出该电极的还原反应。对于气体电极和氧化还原电极 在书写电极表示式时应注意什么问题? 答:可逆电极有三种类型: (1)金属气体电极 如Zn(s)|Zn2+ (m) Zn2+(m) +2e- = Zn(s) (2)金属难溶盐和金属难溶氧化物电极 如: Ag(s)|AgCl(s)|Cl-(m) AgCl(s)+ e- = Ag(s)+Cl-(m) (3)氧化还原电极 如: Pt|Fe3+(m1),Fe2+(m2) Fe3+(m1) +e- = Fe2+(m2) 对于气体电极和氧化还原电极,在书写时要标明电极 反应所依附的惰性金属。
RT a H aCl E E ln zF a 1 2 H2 E RT ln m zF m
复习题
(6)Ag2O(s)的标准摩尔生成焓ΔfHmΘ 和分解压。 电池:Ag(s)+Ag2O(s)|OH-(aOH-)|O2(pΘ )|Pt 净反应:Ag2O(s)→1/2O2(pΘ )+2Ag(s) E r H m zE F zFT T p
物理化学期末复习(第五版上)

物理化学期末复习(第五版上)第一章气体pVT性质1.对于真实气体,当处于()条件时,其行为与理想接近。
A.高温高压 B.高温低压 C.低温低压 D.低温高压答案2.某真实气体的压缩因子Z < 1,则表示该气体,() A.易被压缩 B.难于压缩 C.易液化 D.难液化答案 3.物质能以液态形式存在的最高温度是()T A.沸腾温度Tb B.临界温度Tc C.玻义尔温度TB D.凝固点温度f 答案 4.对比温度是其所处的温度T与()比值。
A.玻义尔温度TBB.临界温度TcC. 沸腾温度TbD.273 K 答案5.对于临界点的描述,下列说法中()是不正确的。
?p?2p()T?0,(2)T?0?V A.临界点处?VB.在临界点处,液体和蒸气具有相同的密度C.临界点所对应的温度是气体可以加压液化所允许的最高温度D.在临界参数中,临界体积是最易精确测定的答案6.理想气体的微观模型是()A.各种分子间的作用力相等,各种分子的体积大小相等B.所有分子都看作一个质点,它们具有相同的能量C.分子间无作用力,分子本身不占有体积D.处于临界温度以上的气体答案 7.描述真实气体的状态方程有许多种,但它们都有一个共同的特点是()pV?RTA.当压力趋近于零时,都可还原成mB.当温度越高时,都可还原成pV?nRTC.当压力趋于无穷大时,都可还原成pV?nRT(p?a)(Vm?b)?RT2Vm D.当压力趋近于零时,都可还原成范德华方程答案 8.对应状态原理的正确描述应该是() A.各种气体处于相同的温度和压力之下B.各种气体处于相同的对比压力和对比温度下具有近似相同的对比体积C.各种气体压缩因子都是1D.各种气体都处于临界温度以上第二章第一组1.热力学第一定律表达式为:?U?Q?W,其只适用于()A.单纯的pVT变化B.相变化C.化学变化D.封闭系统的任何变化答案2.()组成的封闭系统的热力学能和焓仅仅是温度的函数。
A.理想溶液 B.所有气体 C.稀溶液 D.理想气体答案 dH?Cp,mdT3公式m的适用条件应该是()A.等压过程B.恒外压过程C.无相变、无化学变化的恒压变温过程D.组成不变的均相系统的恒压过程答案4.公式?U?nCV,m(?T)适用条件应该是()A.恒容过程B.等容过程C.无相变、无化学变化和Wf?0且恒容过程D.任何变化CV,m为常数的答案 pp5.一定量的理想气体,从同一始态的压力1可逆膨胀到2,若将等温可逆膨胀后的体积与绝热可逆膨胀后的体积相比,则()A.前者大于后者B.前者小于后者C.二者相等D.无法判断差别答案 ??(6.理想气体的焦尔-汤姆逊系数A.??0B.??0C.视所处的压力和温度而定D. ??0答案7.理想气体经绝热可逆膨胀,其压力与体积的关系为()rrrpV?nRTpV?1pV?1111A.常熟 B. C. D.无一定关系答案 ?T)H?p是()8.下面摩尔反应焓中,其中()既为H2的燃烧焓,又为H2O(l)生成焓。
物理化学第五版上册公式归纳和知识点整理

定义式:H=U+pv=U+nRT G=H-TS=A+pv A=U-TS 基本公式: dU=TdS-pdv dH=TdS+vdp dA=-SdT-pdv dG=-SdT+vdp Maxwell 关系式:s v p s T v p TT p V S T v p S S p V T S v p T ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭⎛⎫∂∂⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭⎛⎫∂∂⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭v p s pU H C ,C T T ∂∂⎛⎫⎛⎫== ⎪ ⎪∂∂⎝⎭⎝⎭特征函数:U(S,v);H(S,p);A(T,v);G(T,p);S(U,v)等温可逆过程: △U=0,△H=0 W=-nRT lnQ=-W△A=△G=W 绝热可逆过程: Q=0, γ=,C p,m +C v,m =nR111122P T P T -γ-γ=△H=nC p,m (T 2-T 1) △U=n C,m (T 2-T 1) W=△U △S=0△A=△U-S △T △G=△H-S △T等外压膨胀: W=-p △V△H=nCp,m(T 2-T 1) △U=nC,m(T 2-T 1) Q=W+△U21T p,m T C dT S T∆=⎰△A=△U-△(TS) △G=△H-△(TS)多方可逆:111122P T P T -γ-γ=△H=nC p,m (T 2-T 1) △U=nC v,,m (T 2-T 1)21nRW (T T )1=--δRaoult 定律:p A =p A *x A =p A *(1-x B ) p=p A *x A +p B *x B Henry 定律: p=k x,B x B凝固点降低公式: △T f =k f m B =()()f B m B k M m A ⎛⎫ ⎪ ⎪⎝⎭ MB=()()f f K m B T m A ⎛⎫ ⎪ ⎪∆⎝⎭Kirchhiff 定律: △r H m (T)=pCdT ∆+⎰常数其余公式: Cp-Cv=nRQ dS=Tδ1.可逆热机的效率大于不可逆热机(η≤1)2.绝热真空(自由)膨胀,自发,△S>0,△A、△G<0,其余都等于03.二组分体系最低恒沸点物种数S=2,相态φ=2,独立变量n=0,自由度f=S-φ+n=04.保持温度、总压不变,增加惰性气体,效果相当于减压5.保持温度、总体积不变,增加惰性气体,效果相当于增压6.平衡常数KpΘ只与温度有关7.K<1,反应不能自发进行,△G>0;K=1,反应处于平衡状态,△G=0;K>1,反应有可能自发进行,△G<0 8.Z<1,真实气体易被压缩;Z>1,真实气体不易被压缩9.化学势越高,反应越容易自发进行10.二组分系统中相态数最多只能有3相11.平均平动能相同即温度相同12.三相点的自由度为0,温度、压力、组分均为固定值13.H=U-pv只适用于不做非体积功、等压的封闭系统14.△U=-P e(V2-V1)适用于不做非体积功、恒压、绝热的封闭系统15.隔离、封闭系统的熵变等于016.在等温过程中,系统△A 的减少值≥系统对外做的功17.任何循环过程的△(U、H、S、A、G)全为0 18.理想稀溶液中溶剂服从Raoult定律,溶质服从Henry定律19.熵变为可逆热温商之和,非状态函数20.对于封闭系统经历一个不作其他功的等压过程,其热量只决定于系统的始态和终态21.等温、等压、不做非体积功的可逆相变,△G=0定义式:H=U+pv=U+nRT G=H-TS=A+pv A=U-TS 基本公式: dU=TdS-pdv dH=TdS+vdp dA=-SdT-pdv dG=-SdT+vdp Maxwell 关系式:s v p s T v p TT p V S T v p S S p V T S v p T ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭⎛⎫∂∂⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭⎛⎫∂∂⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭v p s pU H C ,C T T ∂∂⎛⎫⎛⎫== ⎪ ⎪∂∂⎝⎭⎝⎭特征函数:U(S,v);H(S,p);A(T,v);G(T,p);S(U,v)等温可逆过程: △U=0,△H=0 W=-nRT lnQ=-W△A=△G=W 绝热可逆过程: Q=0, γ=,C p,m +C v,m =nR111122P T P T -γ-γ=△H=nC p,m (T 2-T 1) △U=n C,m (T 2-T 1) W=△U △S=0△A=△U-S △T △G=△H-S △T等外压膨胀: W=-p △V△H=nCp,m(T 2-T 1) △U=nC,m(T 2-T 1) Q=W+△U21T p,m T C dT S T∆=⎰△A=△U-△(TS) △G=△H-△(TS)多方可逆:111122P T P T -γ-γ=△H=nC p,m (T 2-T 1) △U=nC v,,m (T 2-T 1)21nRW (T T )1=--δRaoult 定律:p A =p A *x A =p A *(1-x B ) p=p A *x A +p B *x B Henry 定律: p=k x,B x B凝固点降低公式: △T f =k f m B =()()f B m B k M m A ⎛⎫ ⎪ ⎪⎝⎭ MB=()()f f K m B T m A ⎛⎫ ⎪ ⎪∆⎝⎭Kirchhiff 定律: △r H m (T)=pCdT ∆+⎰常数其余公式: Cp-Cv=nRQ dS=Tδ1.可逆热机的效率大于不可逆热机(η≤1)2.绝热真空(自由)膨胀,自发,△S>0,△A、△G<0,其余都等于03.二组分体系最低恒沸点物种数S=2,相态φ=2,独立变量n=0,自由度f=S-φ+n=04.保持温度、总压不变,增加惰性气体,效果相当于减压5.保持温度、总体积不变,增加惰性气体,效果相当于增压6.平衡常数KpΘ只与温度有关7.K<1,反应不能自发进行,△G>0;K=1,反应处于平衡状态,△G=0;K>1,反应有可能自发进行,△G<08.Z<1,真实气体易被压缩;Z>1,真实气体不易被压缩9.化学势越高,反应越容易自发进行10.二组分系统中相态数最多只能有3相11.平均平动能相同即温度相同12.三相点的自由度为0,温度、压力、组分均为固定值13.H=U-pv只适用于不做非体积功、等压的封闭系统14.△U=-P e(V2-V1)适用于不做非体积功、恒压、绝热的封闭系统15.隔离、封闭系统的熵变等于016.在等温过程中,系统△A的减少值≥系统对外做的功17.任何循环过程的△(U、H、S、A、G)全为018.理想稀溶液中溶剂服从Raoult定律,溶质服从Henry定律19.熵变为可逆热温商之和,非状态函数20.对于封闭系统经历一个不作其他功的等压过程,其热量只决定于系统的始态和终态21.等温、等压、不做非体积功的可逆相变,△G=0。
《物理化学》第五版-(傅献彩主编)复习题答案--(全)

微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享1
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享2
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享11
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享12
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享
第十一章 表面现象
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享45
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享46
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 第三章 热力学第二定律
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享9
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享10
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享 微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享13
微信搜索【大四学长】免费VIP版安卓苹果实用工具,学习资料,电脑软件分享
物理化学傅献彩第五版复习题答案

物理化学傅献彩第五版复习题答案物理化学是化学的一个重要分支,研究物质的性质和变化规律。
而傅献彩的《物理化学》第五版是一本经典的教材,被广大学生所使用。
复习题作为学习的重要辅助工具,帮助学生巩固知识、检验理解。
在这篇文章中,我将为大家提供物理化学傅献彩第五版复习题的答案,希望能够帮助大家更好地掌握相关知识。
1. 什么是物理化学?物理化学是研究物质的物理性质和化学性质以及物质之间的相互作用的科学。
它通过物理学和化学的原理和方法,解释和揭示物质的性质和变化规律。
2. 物理化学的基本概念物理化学的基本概念包括物质、能量、反应、化学平衡等。
物质是构成宇宙的基本要素,能量是物质变化和运动的基本原因,反应是物质之间的相互作用,化学平衡是指化学反应达到一种相对稳定的状态。
3. 物理化学中的基本定律物理化学中的基本定律包括质量守恒定律、能量守恒定律、熵增定律等。
质量守恒定律指出在封闭系统中,物质的质量不会凭空消失或增加。
能量守恒定律指出能量在封闭系统中不会凭空消失或增加。
熵增定律指出在孤立系统中,熵总是增加,系统趋向于无序状态。
4. 物理化学中的化学平衡化学平衡是指在封闭系统中,化学反应达到一种相对稳定的状态,反应物和生成物的浓度保持不变。
化学平衡的条件包括反应物浓度、温度和压力等因素。
5. 物理化学中的化学动力学化学动力学研究化学反应速率和反应机理。
反应速率受到反应物浓度、温度、催化剂等因素的影响。
物理化学通过实验和理论模型,揭示了化学反应速率的变化规律。
6. 物理化学中的量子力学量子力学是研究微观粒子行为的物理学理论。
它描述了微观粒子的波粒二象性、不确定性原理等基本概念。
量子力学对于解释物质的性质和变化规律,尤其是原子和分子的行为具有重要意义。
7. 物理化学中的热力学热力学研究能量转化和能量传递的规律。
它通过研究热力学系统的状态、过程和性质,揭示了物质的能量变化规律。
热力学中的基本概念包括热力学系统、热力学函数、热力学过程等。
物理化学(第五版)复习(附详细参考答案)

热力学第一定律练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、已知温度T时反应H2(g) + 12O2(g) == H2O(g) 的∆rH,则∆rH即为温度为T时H2(g)的∆C H。
()2、不同物质在它们相同的对应状态下,具有相同的压缩性,即具有相同的压缩因子Z。
( )。
3、d U = nC V,m d T这个公式对一定量的理想气体的任何p,V,T过程均适用,( )4、物质的量为n的理想气体,由T1,p1绝热膨胀到T2,p2,该过程的焓变化∆H n C TpTT=⎰,m d12。
()5、理想气体的热力学能和焓均只是温度的函数,而与压力或体积无关。
()6、在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的内能和焓也不变。
( )7、25℃∆f H(S ,单斜) = 0 。
()。
8、理想气体在恒定的外压力下绝热膨胀到终态。
因为是恒压,所以∆H = Q;又因为是绝热,Q = 0,故∆H = 0。
( )9、500 K时H2(g)的∆f H= 0 。
()10、在临界点,饱和液体与饱和蒸气的摩尔体积相等。
( )11、∆f H(C ,石墨, 298 K) = 0 。
()12、热力学标准状态的温度指定为25℃。
()13、100℃时,1 mol H2O(l)向真空蒸发变成1mol H2O(g),这个过程的热量即为H2O( l )在100℃的摩尔汽化焓。
()14、处在对应状态的两种不同气体,各自对于理想气体行为的偏离程度相同。
( )15、CO2(g)的∆f H(500 K) = ∆f H(298 K) +C Tp,m2KK(CO)d298500⎰。
()16、在p = p(环) = 定值下电解水制氢气和氧气则Q = ∆H。
()17、系统从同一始态出发,经绝热不可逆到达的终态,若经绝热可逆过程,则一定达不到此状态。
()18、化学反应热Q p其大小只取决于系统始终态;( )19、凡是化学反应的等压热必大于等容热;( )20、理想气体等容过程的焓变为21,md()TVTH nC T V p∆=+∆⎰;( )二、选择题1、对一个化学反应,若知其∑νB C p, m(B) > 0 ,则:()。
傅献彩物理化学-第五版总结

.
39
.
40
2. 写出电池 Zn(s)|Zn2+ (a Zn2+ =0.9 ) | Cu2+ (a Cu2+ =0.7 ) |Cu(s) 的电极反应和电池反应。 已知25℃时
Z 2n/Zn0.76V8 , C 2u/Cu0.34V0
求电池的电动势E和通电2F时的ΔG。
.
11
HT T 12nC P,mdT nC P,mT SVT T 12nTV C ,mdT nV C ,mlnT T1 2
AU(T)S
GH(T)S
理想气体等压可逆过程
WV2PdV PV V1
.
12
UT T 12nV C ,mdT nV C ,mT HQ PT T 12nP C ,m dT nP C ,m T SPT T 12nTC P,mdT nC P,mlnT T1 2
若反应的 B(g)RT 0
则 rH m (2K 9) 8 rU m (2K 9)8
熵函数、亥姆霍兹自由能、吉布斯自由能
定义及判据:
dS Qr
T SU,V 0
S 2 Qr
1T
自发过程 可逆过程
.
7
AUTS AU(T)S
恒温、恒容及无其它功, 自发过程
AT,V,W'0 0 可逆过程
GHTSGH(T)S
3. 实际气体液化的条件
.
2
TTC PPT*
必要条件 充分条件 二、热力学基础及应用
1. 热力学第一、二定律表述、数学表达式
第一类永动机不能实现 UQW
第二类永动机不能实现
dS Q
T
过程不可逆 过程可逆
《物理化学》第五版,(傅献彩主编)复习题答案(全)

第一章气体1. 两种不同的理想气体t 如果它们的平均平动能相同,密度也相同,则它们的压力是否相同?为什么?S :由于两种气体均为理想气体.根据理想气体的状态方程式PV^nRT式中材是物质的蚩"是压力,U 是气体的体积,丁是热力学温度.R 是摩尔气体常数.又因为材=舊=豁式中也为气体的质儀为气体分子的摩尔质量屮为气体的密声 PV=為R 丁两边同除以V*则得P=疇我们已知气休分子的平均动能是温度的函数,即丁所以气休分子的平均平动能仪与温度有 关.由题目中已知两种不同的理想气体•平均平动平动能相同,因此它们的温度相同*又因为它们的密度相 同*则通过上式P=疇可知压力P 仪与M 有关.因此得出结论,两种不同的理想气体在它们具有相同的平均平动能,相同密度的条件下.它们的压力不 同.压力与M 成反比,M 越大则P 越小.乂在两个体积相等、密封、绝热的容器中+装有压力相等的某理想气体.试问这两个容器中温度是否相等?答:根据理想气体的状态方程式pV=n RT假设在第一个容器中某种理想气体符合AV 1 =«L JJT 1则在第二个容器中存在p 2V 2^n z R‰又因为两容器的体积相等,装有的理想气体的压力也相尊所以P 严P 2 ¼=V≡则得n i RT 1 ^n 2RT i ,两边同除以R 则得 m T 1 T 2若两容器中装有相同物质的慑的该理想气体,则两个容器中温度相等;否则,两容器中温度不相等.3. DakOn 分压定律能否用于实际气体?为什么?答:根据气体分子动理论所导出的基本方程式PV=^mNU i式中0是N 个分子与器壁碰撞后所产生的总效应,它具有统计平均的意义平均压力是一个定值,是 一个宏观可测的物理量•对于一定量的吒体,当温度和体积一定时,它具有稳定的数值+因为通过气体分子动理论所导岀的D a ltOn 分压定律孕是或专=述4是摩尔分数)适用于实际气体,经得起实验的考验+4. 在273 K 时,有三种气体,HχQ 和CQ,试判别哪种气休的根均方速率最大?哪种气体的最概然速 率最小?最概然速率 班或咖=勺瞬可推知棍均方速率、最概然速率与质議的平方根成反比因此,在相同温度273 K 的条件M H 2=2X10^3kg ∙ moΓ1t M⅛ s =32×10^3kg ∙ mol~1t ‰, =44XlO^kg ∙ mol~,HZ 的根均方速率第大;GE 的最概然速率蜃小.5. 最概撚速率、根均方連度和数学平均速率•三者的大小关系如何?各有什么用⅞t?答:在M aX W 訓速率分布曲线上有一最高点*该点表示具有这种速率的分子所占的分数葩大,这个最高 点所对应的速率称之为最概然速率或%=JW答:根据’根均方程率分子的数学平均速率(S)为所有分子速率的数学平均值∕‰T根均方速率(Q是一个统计平均值•它与各个分子的速率有关•但又不等于任务单个分子的速率・三种速率之比在三者中•最概然速率最小,根均方速率最大,数学平均速率居中.6. 气体在電力场中分布的情况如何?用什么公式可以计算地球上某一高度的压力?这样的压力差能否用来发电?答:在重力场中,气体分子受到两种互相相反的作用.无规则热运动将使气体分子均匀分布于它们所能达到的空间,而重力的作用则要使重的气体分子向下聚集.由于这两种相反的作用,达到平衡时•气体分子在空间中并排均匀的分布,密度随高度的增加而减少・假定在O〜人的高度范围内温度不变,则P=PO exp(—箸)由于在上述公式的积分过程中,均将温度看作常数,所以只在高度相差不太大的范围内,可以计算地球上某一高度的压力.虽然存在这样的压力差,但是由于存在重力场的原因,在实际生活中我们不能用这样的压力差来进行发电.7. 在一个密闭容器内有一定凰的气体,若升高温度,气体分子的动能和碰撞次数增加,那分子的平均自由程将如何改变?答:在一密闭的容器内,若温度升高,碰據次数增加,平均速度匕增加根据,平均自由程(Z)7=予由于移动着的分子在单位时间内与其他分子相碰的次数<可以用含"的式子来表示,例如书中以分子平均以90°的角度互相碰撞为例,推导岀Z =》=需我们可以间接证明分子的平均自由程与温度无关.&什么是分子碰掠的有效截面积?如何计算分子的互碰频率?答:设分子的有效半径为r,有效直径为d.运动着的分子,其运动的方向与纸面垂直,以有效直径d(d =2刀为半径作虚线圆,这个面积称为分子碰撞的有效截面积Grd2).单位时间、单位体积中分子平均相撞的总次数Z应为Z=甌4^rI AnB式中,dAβ代表A,B分子的有效半径之和,“代表折合质量9.什么是气体的隙流?研究气体隙流有何用处?答:气体分子通过小孔向外流出称为隙流.Graharn的隙流定律是指隙流速度与其摩尔质憊的平方根成反比,若两种气体在相同的情况下进行比隙流定律可以用来求气体的摩尔质绘,即√ = n A用隙流作用也可以分离摩尔质量不同的气体混合物,这在同位素分离中得到了应用.10.Van der WaalS对实际气体作了哪两项校正?如果把实际气体看作刚球,则其状态方程的形式应该如何?SIV a n der W a aI S对实际气体的体枳和压力两项上提出了具有物理意义的修正因子α和趴这两个因子揭示了真实气悴与理想咒体有差别的根本原因•Van der WaaIS 方程式,即(P十豈)(V m—6) =J?T11.在同温、同压下,某实际气体的摩尔体积大于理想气体的摩尔体积,则该气体的压缩因子Z是大于1还是小于1?答:在压力轻高或温度较祗时,实际气休与理想气体的偏差较大.我们以书中提及的压蝇因子(Z)衡址偏差的大小忆=晋=需在同温•同压下,某实际气体的摩尔体积大于理想气休的摩尔体积.则该气体的压缩因子z>ι^vς> Rh实际气体的可压缩性比理想气体小.同理我们可以推岀在相同情况下,若实际气体的摩尔体积小于理想气体的摩尔怵积•则该气悴的压竭因子Z<∖,pV rn<RT.实际气体的可压缩性比理想气体大.12.压缩因子图的基本原理建立在什么原理的基础上?如果有两种性质不同的实际气体*其压力、摩尔体积和温度是否可能都相同?其压缩因子是否相同?为什么?答:凡是Van der W^IS气体都可以用统一的对比方程式表示D = Sr没有岀现气体的持性常数α •仏所以它是一个具有普遍性的方程式.但直接使用对比方程式似嫌太繁.特别是对高压气体的有关计算,常使用压缩因子图.其状态方程式仍保留理想气体方程式的形式"V* ZRT(Z=嘗).我们将范氏方程护十孟)仏一刃=RT展开后得必_瓷(卄竽)+讯計乎=0也可写成严ξ¾-荒假设两种性质不同的实际气体具有相同的V%和厂但是由于性质不同•它们分别的值不同.因而它们的P 值不同•所以说两种性质不同的实际气体*,Vπι和T值不可能同时相同.因为L护尸芒?尸£代入小修后得K许*孚又根据书中提及:諾=号已证明Van der W^I S气体的军背接近一个常数”所以两种性质不同的实际气体若具有相同的对比状态.即值相同’则它们的压缩因于相同;否则.压缩因子相同.第二章热力学第…定律1 •判断下列说法是否正确.G)状态给定后,状态函数就有一定的值,反之亦然.(2)状态函数改变后,状态一定改变.(3)状态改变后,状态函数一定都改变.(4)因为W=QMH=Q,,所以QSQP是特定条件下的状态函数.(5)恒温过程一定是可逆过程.(6)汽缸内有一定量的理想气体,反抗一定外压做绝热膨胀,则△ H=Qp=O.(7)根据热力学第一定律,因为能量不能无中生有,所以一个系统若要对外做功,必须从外界吸收热量.(8)系统从状态I变化到状态∏ ,若AT=O,则Q=0,无热量交换.(9)在等压下,机械搅拌绝热容器中的液体,使其温度上升,则AH=Q,=0.(10)理想气体绝热变化过程中,W=ΔU ,即WR=∆U=cv∆T, Vy IR=Δ(7=CVΔT,所以WR=W叫(11》有一个封闭系统,当始态和终态确定后:(a)若经历一个绝热过程,则功有定值;(b)若经历一个等容过程,则Q有定值(设不作非膨胀功);(C)若经历一个等温过程,则热力学能有定值;(d)若经历一个多方过程,则热和功的代数和有定值.(12)某一化学反应在烧杯中进行,放热Q ,熔变为AH∣,若安排成可逆电池,使始态和终态都相同,这时放热Q ,熔变为厶局,则∆Hι =∆H2・答:(1)对.(2)对.(3)错.若外界条件不变,即状态给定后,所有的状态函数都有一定的数值•当某一个或某几个状态函数发生变化时,状态一定改变;反之,当状态改变,状态函数中一定有某一个或某几个发生变化,而不一定是全部的状态函数都发生改变.(4)错.热力学能U和熔H是状态函数•它的改变值决定于系统的起始和终了的状态,与途径无关.功和热决定于引起状态发生变化的方法,于途径有关.在特定条件下,断定Q、QP就是状态函数是不充分的.(5)对.恒温过程是系统与环境的温度随时相等且恒定,是一个热平衡的过程.当系统的诸种性质不随时间而改变,则系统处于热力学平衡状态.满足可逆过程的要求,即保持连续平衡状态的过程.(6〉错.等外压与等压不是同一概念,勿混淆;绝热膨胀过程中Q=O,而不是Qp = O.熔是状态函数•在绝热膨胀过程压力由Pl至化,石至T2(p2<Z>l,T2<T1)可得出AHVO.(7)错.热力学第一定律说明热力学能(U)、热(Q)和功(W)可以互相转化,又表述了它们转化时的定掀关系,所以它又是一个能量守恒定律.因此可知,系统热力学能的变化是W=Q+W.所以功的转化形式不仅有热,也可通过热力学能.⑻错.热(Q)的变化值与具体的变化途径有关,它不是状态函数•当AT=O时,只说明初始和终了的温度相同,而不能说明整个过程的变化情况,故Q不一定为零.(9)错.'H=Qp是在没有其他功的条件下才存在的等式.题目中提及机械搅拌使液体升温•则说明存在机械功,即δ W z≠0.所以,上面等式'H=Qp不成立.(10)错.由同一状态I出发,经过绝热可逆过程达到的状态∏和经过绝热不可逆过程达到的状态U两状态的温度一定不相同,故AGH△乃R ,所以W R HW IR.(IlXa)对.绝热过程,W=譽三皆=G(T2 —「).(b)对.等容过程中(不作非膨胀功)Q∙ = ∆U.(C)错.等温过程,∆U=0.(d)对.多方可逆Q^W=∫ CvdT.(12)对.Q是非状态函数,由于经过的途径不同,则Q值将会不同.熔(H)是状态函数,只要始终态相同,不考虑所经过的过程,则两熔变值AH∣和 Z 相等.2.回答下列问题.(1)在盛水槽中放置一个盛水的封闭试管,加热盛水槽中之水,使其达到沸点•试问试管中的水是非会沸腾,为什么?(2)夏天将室内电冰箱的门打开,接通电源并紧闭门窗(设墙壁、门窗均不传热),能否使室内温度降低, 为什么?(3)可逆热机的效率最高,在其他条件都相同的前提下•用可逆热机去牵引火车,能否使火车的速度加快,为什么?(4)Zn与稀硫酸作用,(a)在敞口的容器中进行;(b)在密闭的容器中进行.哪一种情况放热较多,为什么?(5)在一铝制筒中装有压缩空气,温度与环境平衡.突然打开筒盖•使气体冲出,当压力一外界相等时, 立即盖上筒盖,过一会儿,筒中气体的压力有何变化?(6)在N2和H2的物质的量之比为1 : 3的反应条件下合成氨,实验测得在温度T l和T2时放出的热量分别为Q(C)和Q(T2),用KirChhOff定律验证时,与下述公式的计算结果不符,试解释原因∙Δr H m (T2) = ArH m(T1)+ F ∆r QdTJT I(7)从同一始态A岀发•经历三种不同途径到达不同的终态:(1)经等温可逆过程从Λ→β5(2)经绝热可逆过程从A-*C; (3)经绝热不可逆过程从AfD试问:(a)若使终态的体积相同,D点应位于BC虚线的什么位置,为什么?(b)若使终态的压力相同∙Γ>点应位于BC虚线的什么位置,为什么•参见图2-3.(8)在一个玻璃瓶中发生如下反应:H2(g)+Cl2(g)-^2HCl(g)反应前后T.p.V均未发生变化•设所有的气体都可看作是理想气体•因为理想气体的热力学能仅是温度的函数Q=U(T),所以该反应的∆U=0.这个结论对不对?为什么?答:(1)不会.由于水槽中的水与水的沸点相同,不满足只有环境的温度高于液体的沸点•液体才能沸腾的条件.所以试管中的水不会沸腾.(2)不能.由于墙壁、门窗不传热•则可把整个屋子看作是一个绝热等容的系统•又因为∆U=Q +W, 而Q =O(绝热过程)・电冰箱做电功,即环境对系统做功W>0,所以∆U>0,温度升高.(3)不能.热机效率v=g是指从高温热源所吸的热最大的转换成对环境所做的功.但是同时可逆热机循环一周是一个缓慢的过程,所需时间是无限的•又由P≈W∕t≈F "可推出P将无限的小•因此用可逆热机牵到火车的做法是不实际的,不能增加火车的速度只会降低.(4)在密闭的容器中进行的反应放热较多.这是由于在热化学中,Qp=Q∙+∆n(RT)而在这个反应中Zn÷H2SO4—ZnSa+出,0=1.又因为该反应为放热反应Q-Q的值均为负数・IQ I>∣Q, I.(5)简内的压力变化过程:当压缩空气气体冲出,在绝热可逆过程有PiTy=常数,当气体的压力与外界相等时,筒中温度降低.立即盖上筒盖,过一会儿,系统与环境的温度完全相等•温度升高•则压力也升高, 即大于环境中的标准大气压.(6)∆f实际上是指按所给反应式,进行兰为ImoI反应时的熔变,实验中测得的数值是反应达到平衡时放出的热量•此时∆eVlmol,因此经过计算使用Kir C hhOff定律计算的结果与实验不符.(a) (b)图2-4由各种过程的膨胀功计算中,我们可知绝热可逆膨胀的功最大•绝热过程中.W=Cv√T2-T1),由于是膨胀过程,所以WVO.又因IWRl> I Ww I,所以T2lfi>T2tt.又根据理想气体状态方程pV=nRT,当匕相同时叭>臥当仇相同时*V2ff f>,V2Λ. *绝热膨胀在实际过程中是一个降温过程,与等温可逆相比,T2∕R<T2w,同理,当匕相同时、皿>仇叭当PZ相同时,v2^>v2at.(8)∆LΓ=O这个结论不正确.根据热力学第一定律∆T=Q+W,由于反应前后的丁未变,Q=O,47= W.虽然整个反应中V未变,但此化学反应由于光照而引发,以这种的形式对反应做功•所以∆U≠0.3.可逆过程有哪些基本特征?请识别下列过程中哪些是可逆过程•(】)摩擦生热;(2)室温和大气压力(101. 3 kPa)下,水蒸发为同温、同压的气;(3)373 K和大气压力(Io1. 3 kPa)下,水蒸发为同温、同压的气;(4) 用干电池使灯泡发光;(5) 用对消法测可逆电池的电动势;(6) N 2(g),O 2(g)在等温、等压条件下温合;(7) 恒温下将1 mol 水倾入大量溶液中,溶液浓度未变;(8) 水在冰点时变成同温、同压的冰.答:可逆过程基本特征:① 过程中的每一步都可向相反的方向进行,而且,系统复原后在环境中并不引起其他变化.② 经过无限慢的膨胀与压缩•③ 在可逆膨胀中系统做的功最大,在系统复原可逆压缩过程中对环境做的功最小.(3) √5)和(8〉的过程为可逆过程,其余均不是.4. 试将如下的两个不可逆过程设计成可逆过程:⑴在298 KJOl. 3 kPa 压力下,水蒸发为同温、同压的气;(2〉在268 K,101.3 kPa 压力下,水凝结为同温、同压的冰.答I (1)H 2O(1,298K,101. 3kPa)― H 2O(g,298K,101. 3kPa)等压可逆升温] I 等压可逆降温H 2O(h373K,101. 3kPa)空鯉凹理翌JH2O(g,373K,lOl. 3kPa).⑵H2()(l,268K,101.3kPa)― H 2O(s,268KΛ01. 3kPa)等压可逆升温5.判断下列各过程中的Q,W,0U 和可能知道的值,用>0,VO 或=O 表示.(1) 如图2-5所示,当电池放电后,选择不同的对象为研究系统,① 以水和电阻丝为系统_② 以水为系统③ 以电阻丝为系统④ 以电池和电阻丝为系统⑤ 以水、电池和电阻丝为系统; ⑵Van der WaiiS 气体等温自由膨胀;(3) 密闭非绝热容器中盛有锌粒和盐酸,容器上部有可移动的活⑷ C 6 H 6 (s, 101. 3 kPa∙7})— C 6H 6(hl01.3 kPa, T f );(5) 恒容绝热容器中发生如下反应H 2(g)+Cl 2 (g)― 2HCl(g)(6) 恒容非绝热容器中,发生与(5)相同的反应,反应前后温度相同;(7) 在大量的水中,有一个含有H2(g),Q(g)的气泡,通一电火花使其化合变为水,以H2(g),Q(g)混 合气为系统,忽略电火花能量;(8) 理想气体JOUle-ThOmSOn 的节流过程.答:(1)①W>0,水和电阻丝为一整体看待Q=O,2=Q+W>0.② 以水为系统•对外不做功,W=O,系统吸热Q>0,故∆U=W+Q>O..等压可逆降温 H 2O(1,273K,101. 3kPa) 等温等压可逆凝结 H 2O(s,273K,101.3kPa).③以电阻丝为系统•电阻丝的状态未发生改变.所以∆L7=0.系统放热QCO,所以W>0.④以电池电阻丝为系统,不存在对外做功,W=O.系统为放热反应,Q<0,α=Q+WV0.⑤以电池水和电阻丝为系统•该系统成为孤立系统,2=0,Q=O,W=O.(2)外压为零的膨胀过程为自由膨胀,W=O.膨胀后体积增加,温度升高,是吸热反应,Q>0.所以可知,M∕=Q+W>0.(3)由于Zn÷2HCl==ZnCl2+ H2↑体积增加,活塞移动,对外做功,WV0.此反应为放热反应,所以Q<0.同理,∆U=Q+WV0.*(4)由固体变为液体,在凝固点和等压条件下,吸热.Q=Q f) =∆H>0. W= -^PV) = -P(V l-V t )< 0,Δ(7=Q÷UO0.(5)恒容绝热的容器中发生反应,Q=Q=0,W=0故∆T=0;因为该反应为放热反应,反应后温度升高•由理想气体状态方程可知P= 帶:V不变"随T增加而增加.又因AH=∆U+MpV)=V(3)>0.(6)恒容容器内W=O;由十是非绝热容器,该反应为放热反应,故Q=QVO;同理M<0. ΔH = ΔU< 0(由于系统最终能恢复原状态,Δ(pV)=O).(7)2H2÷O2—2H2O,W=-∕>(V2-V1)反应后气体体积滅血(以H2、Q为系统)所以W>0.该反应为吸热反应,Q<0热力学能减少,AUVO.(8)节流过程的特点是:①绝热过程②前后焙值相等.故Q=O,AH=O.又因为理想气体节流前后温度未发生改变,Δl∕=05同理由∆U=Q+W,可知W=O.6. 请列举4个不同类型的等熔过程.答:几种不同类型的等熔过程分别为:自由膨胀;等温可逆膨胀;等温可逆压缩Jo u Ie-Thomson节流过程.7. 在下列关系式中,请指出哪几个是准确的,哪几个是不准确的,并简单说明理由.(1)∆e⅛ (石墨,s) = Δ(Ht(CQ,g),(2)∆c肚(H2,g) = ∆f H=(HCXg),(3)ΔeH-(N2,g) = Δf H∙(2NO2,g),(4)∆c Hm(SC)2 ,g)=0,(5)Δ∣H^(H2O,g)=ΔfH∙(H2OJ)+∆,,p⅛(H2OJ),(6)Δc½(()2,g)=Δf H∙ (H2OJ).答:根据标准摩尔生成熔和标准摩尔燃烧的定义可知均指生成1 InOI纯物质的熔变.由此可知(1)和(2)正确;(3)错误.⑷由于so2÷yθ2-sα,so2在o2中可以完全燃烧生成sα,所以∆c H^(so2,g)≠o.(5)H2O(I)— H2O(g) ∆r⅛(373 K) = ∆vβp⅛(H2OJ) = ∆f H∙ (H2O,g)^∆f(H2OJ)结果正(6)根据定义ΔC W(H2,g) = Δf⅛(H2O,g)等式成立•所以题中表示结果错误•是否恒大于Cv.m?有一个化学反应,所有的气体都可以作为理想气体处理,若反应的∆Q,ro>0,则反应的AQm也一定大于零吗?≡:C^CV=(^-(^)V=(歌+(霍h (f⅛+M霁)厂(f⅛v= [?+(韵r](霁),对于理想气体T (黑)r = CL (等)广竽© -CY=nR C^rtI -CV hnl=J R可知永远大于C Vral⅛ C PllII>0时•则厲问也一■定大于零.第三章热力学第二定律∣∙指出下列公式的适用范围.<l)Δr⅛sιS =—尺工^Rlnj(2)∆S=nRln E+Ch ⅛= KRh ⅛ 十GlrL ⅞ JPΞJ 1 Vt 1 1C3)dL r^≡Td5-PtfVJC4)M∕ = IVιJ∕>;(3)∆S.∆A/G作为判据时必须満足的条件・答:门)理想气体的等温等压过程,井符合分体积定律•心=訂■存在的每种气体的压力祁粕等*且等于气体的总压力.(即适用于非等温过程中爛的变化值.在计算一定量的理想气体由狀态1 <Pit¼t LJ⅛变到状态U(∕⅛,Fp ,玛)时*可由两种可逆过程的加和而求得.等号两边是两种不同的分步计算方法.〔3)对于封闭系统只做体积功时适用.(4)对于等溫条杵下'封闭系统只做体积功时适用.(G購判撼:对于隔离系统或绝热系统.dS≥0Hdmhoi∣∕自曲能判据在等温等容下做其他功的条杵下,若系统任其自然+叫自发变化总是朝向A减少的方向进行,直至系统达到平衡.Gih氏自由能判据:在等温等压下,不做其他功,任期自然进行,则自发变化長朝G减少的方向进行,直至奈统达到平衡.1.判斷F列说法尼否正确*并说明原因.d)不可逆过程一定是处肆的,而自发过程一定是不可逆的*(2)Λ⅛增加过程都是⅛发过程;(3)不可逆过程的端永不减少:(4)系统达平衡时,爛值最大.Gibbs自由能最小;(G当某系统的热力学能和休积恒定时,△$<()的过程不可能发生匚<S)M⅛统从始态经过一个绝热不可逆过程到达终态*现在要在相同的始、终态之间设计一个绝热可逆过程;U)在一个绝热系统中.发主了一个可逆过程.系统从状态1变到『狀态2.不论用什么方法,系统再也回不到原来状态了*©)理想气休的等温膨胀过程,ZJJ=S系统所吸的热全部变成『功■这与KeIVin的说法不符匚(9)冷冻机可以从低温热源吸热放给髙温热源,这与CIa US iuS 的说法不符;(10) G 恒大于Cv.答:(1)错.自发过程一定是不可逆过程,而不是所有的不可逆过程都是自发的,有时需要环境对系统做 功,才可进行不可逆过程.(2) 错.爛判据使用是有条件的,适用于隔离系统或绝热系统.(3) 错.在隔离系统中,如果发生了不可逆变化,则爛增加.(4) 错.不应笼统的全部定义为系统.在绝热系统或隔离系统,当系统达到平衡状态之后,炳值最大;在 等温等压不做其他功的条件下,直至系统达到平衡后,Gibbs 自由能最小.(5) 错.不完全正确,这种说法只适用于隔离系统且不做非膨胀功的条件下才可以成立.(6) 错.绝热不可逆过程∆S>0.绝热可逆过程∆S=0.爛是一个状态函数,由于两过程有同样的始态. 同时∆S 值不同,则可以认为最终到达的终态的性质不同.故题中说法不能实现.(7〉对.在绝热系统中,从状态】到状态2 ∆S,2>0;而同样在该条件下,由状态2到状态1 S 21 >0.系统 的爛永远增加,故系统再也回不到原来状态了.(8) 错.Kelvin :不可能从单热源取出热使之完全变为功・而不发生其他变化.理想气体等温膨胀过程 中,AU=O,系统,所吸的热全部变成了体枳膨胀所做的体积功.这与keWin 记述相符.(9) 错.从低温热源吸热放给高温热源的过程中•环境对低温热源做功.这一过程与CI a U S i US 说法:不可 能把热从低温物体传到高温物体,而不引起其他的变化.相符.(ID)错.Cp-Cv V_ Z a(U+∕>p)、 (au、 一(dτ . (aT )V但HzO 在277. 15时,(等»=0・故Cp=G 故,题中说法过于武断.3.指岀下列各过程中,Q,W∙∆L∕dH∙∆S,∆A 和2等热力学函数的变供哪些为零•哪些绝对值相等?(1) 理想气体真空膨胀;(2) 理想气体等温可逆膨胀:(3) 理想气体绝热节流膨胀;(4) 实际气体绝热可逆膨胀;(5) 实际气体绝热节流膨胀;<6)H 2(g)和O 2(g)在绝热钢瓶中发生反应生成水;(7) H 2(g)和O2(g)在绝热钢瓶中发生反应生成HCKg)J(8) H 2Od,373 K,101 kPa)^H 2O(g,373 KUOl kPa);(9) 在等温、等压、不作非膨胀功的条件下,下列反应达到平衡3H 2 (g)+N 2(g)-2NH 3(g)G 恒大于GZ=(執+(執(10)绝热、恒压、不作非膨胀功的条件下,发生了一个化学反应.答:(1)理想气体真空膨胀W=Q=M=AH=O.(2)理气等温可逆膨胀ΔI7=0,∆H=0;Q=V V J∆G=∆A,∆S=0.(3)理气节流膨胀AH=0,∆U=0.(4)实际全体绝热可逆Q= AS=^=0,W=Q+W=W.(5)实气绝热节流Q I=O,Δ(7=0,Δ∕∕=0.(6)恒容过程∆L∕=O∆A=-WR=Q .(7)H2 (g)+Cl2 (^)=2HCL(g) 体积与压力不变.Δ(7=Q=^H, W=O .AA=AG(8)∆A = -W R4G=0,Δl 丿=O QH=O.(S)∆L∕=O.∆H=Qρ*∆A=∆G,(Io)Q=Oa=W.4. 将下列不可逆过程设计为可逆过程.(1)理想气体从压力为P向真空膨胀为仇;(2)将两块温度分别为T l ,T2的铁块(T1>T2)相接解•最后终态温度为T t(3)水真空蒸发为同温、同压的气,设水在该温度时的饱和蒸气压为AH20( 1,303 KJOO kPa)— H2O(g,303 KJOO kPa)(4)理想气体从∕>1 ,W .T1经不可逆过程达到PZ,X∙E ,可设计几条可逆路线•画出示意图・答:(i)等温可逆膨胀.(2)以无限小且无限缓慢的速度dT降温•最终达到T的终态,则此过程为可逆过程.O图3-1φ∕(pι .v1,T1AA,W,T2)仝亘樂∏(Z>2,V2,T2)③“ Q ・ W ・T l p2,½∙, T I∏(∕>2,V2,T2)Z . Tr T、等溫可逆Z-” T、等容可逆n/ . “ T、④1( p∖ ,V) , TI ) DC PD . V2 , Tl ) *, Ii(P2,v^2 , 了2 )5. 判断下列恒温、恒压过程中,爛值的变化,是大于零•小于零还是等于零,为什么?(1)将食盐放入水中;(2)HCKg)溶于水中生成盐酸溶液;(3)NH J Cl(S)― NH3 (g) + HCKg);(4)H2 (g) Q(g)— H2 O(I);(5) 1 dm3 (N2 ^g)÷l dm3(Ar,g)—2 dm3 (N2 ÷Ar,g);(6) 1 dm'(N2 ∙g) + l dn√(Ar,g)— 1 dm3 (N2÷Ar,g);(7) 1 dm3(N2,g)÷l dm3(N2,g)— 2 dm3(N2,g);(8)1 dm3(N2∙g) + l dm3(N2,g)― 1 dm3(N2,g).答:(1)盐溶解于水中,为放热过程Q<0,dS-^,∆S<0.(2)同理,HCKg)溶水中,Q<O,∆S<O.(3〉此化学反应过程为吸热过程Q>O,∆S>O.(4)此化学反应过程为放热过程QVo,ASVO.9V 9V 2V(5)∆S=∆S4V2+∆S zv=Wn y+/?lny = 2Rln ~>0.(6)两气体的始态,经态未发生改变AS=O.(7)同种气体等温等压下压缩,前后状态未发生改变AS=O.(8)∆S=r i Kln 彩=2Rn 寺VO.6. ⑴在298 K和IOO kPa时,反应H2()(l)― H2(g)÷y()2(g)的Sm>0∙说明该反应不能自发进行.但在实验室内常用电解水的方法制备氢气,这两者有无矛盾?(2〉请将CarnOt循环分别表达在以如下坐标表示的图上:T- p, T — S,S-U,U-S, T- H答:⑴这两者没有矛盾HO⑴一H2(g)+∙∣()2(g)是指在隔离系统内,不做其他非膨胀功的条件下,A<im>0.实验室内用电解水的方法剔备氢气•这个过程中存在电流做功的电功形式•这一反应不是自发进行的.(2)Carnet缩环表达坐标如图3—2.。
物理化学第五版上册复习题

物理化学第五版上册复习题物理化学是一门研究物质的物理性质与化学性质之间关系的科学,它在化学、物理、材料科学等领域有着广泛的应用。
以下是物理化学第五版上册的一些复习题,供同学们复习参考:# 第一章:热力学基础1. 定义内能、焓和熵,并解释它们在热力学过程中的作用。
2. 描述热力学第一定律,并给出一个实际应用的例子。
3. 解释什么是可逆过程,并讨论其在热力学中的重要性。
4. 计算理想气体在等压膨胀过程中的温度变化,如果初始温度为T1,最终压力为P2,初始压力为P1。
# 第二章:热力学第二定律1. 解释熵的概念,并讨论熵增原理在自然界中的意义。
2. 描述卡诺循环,并解释其效率与温度的关系。
3. 给出一个实际的不可逆过程,并计算其熵变。
# 第三章:多组分系统热力学1. 定义化学势,并解释它在多组分系统中的作用。
2. 解释拉乌尔定律和道尔顿定律,并给出它们在理想溶液中的应用。
3. 计算非理想溶液中溶质的化学势,如果已知溶质的活度系数。
# 第四章:相平衡1. 解释相平衡的条件,并给出一个实际的例子。
2. 描述莱·查特列原理,并解释其在相变过程中的应用。
3. 利用吉布斯相规则计算一个双组分系统中可能存在的相数。
# 第五章:化学平衡1. 定义化学平衡常数,并解释它如何随温度变化。
2. 利用范特霍夫方程计算反应的焓变。
3. 给出一个化学反应,并计算在不同温度下该反应的平衡常数。
# 第六章:电解质溶液1. 解释离子强度的概念,并讨论它对电解质溶液性质的影响。
2. 描述德拜-休克尔理论,并解释它如何用于计算强电解质溶液中的活度系数。
3. 计算给定浓度的电解质溶液的渗透压力。
# 第七章:表面现象1. 解释表面张力的物理意义,并讨论它如何影响液体的表面现象。
2. 描述杨氏方程,并解释它在润湿现象中的应用。
3. 计算给定温度下液体的表面张力,如果已知其摩尔面积。
# 结束语物理化学是一门综合性很强的学科,它要求我们不仅要理解概念,还要学会应用这些概念解决实际问题。
《物理化学(第五版)》第九章复习题答案

f
H
m
Ag2O ,
rH
m
1
K
p
pO2 p
2
exp
zE F RT
.
24
复习题
(7).反应Hg2Cl2(s)+H2(g)→2HCl(aq)+2Hg(l) 的标准平衡常数KaΘ;
电池:Pt|H2(pΘ)|HCl(aHCl)|Hg2Cl2(s)|Hg(l)
Ka
exp
zEF RT
7
基本公式
用可逆电池的测定值计算热力学函数变化
值
r
G
m
zFE
, rGm
zFE
E
RT zF
ln
K
a
rSm
( rGm T
)p
zF (E T
)p
QR
T
rSm
zFT
( E T
)p
rH
m
rGm
T
rSm
zFE
zFT
( E T
)p
.
8
基本公式
浓度积 pH值 膜电势
Ksp
exp
zEF RT
.
4
应用
(7)利用醌氢酿电极或玻璃电极测定溶液的pH。 (8)进行电势滴定,从滴定终点测定离子的浓度。 (9)利用电势—pH图,指导湿法冶金和金属防
腐等。
.
5
基本公式
电化学与热力学的联系公式
r G T ,P W f ,max ;
rG T ,P nEF ;
r Gm T ,P
净反应:H2O(l)
KW
⇔ H+(aHz+E) +OFH-(aOH-)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9. 对任意均相封闭系统,下面的偏微分小于零的是哪一个?( )
H A. T p ;
B.
G p
T
;
A C. V T ;
S D. T p
答案
答案
10.
克拉佩隆-克劳修斯方程
d
ln p dT
vap Hm RT 2
对于下述情况适用的是(
):
A. 水在 25℃、101.325 kPa 下在空气中的蒸发; B. 水在其沸点时的液-气平衡; C. 水在其冰点时的固-液相平衡; D. 水在三相点处的三相平衡
答案
1
1
7.在 298K 时,对于反应 2 H2 (g)+ 2 Cl2 (g)=HCl(g) 的 r Hm 为-92.5 kJ mol-1 ,则此
时反应的 rU m ( )
A.等于 r Hm B.小于 r Hm C.大于 r Hm D.无法判断
答案Βιβλιοθήκη 8.对于节流膨胀过程,下列表述中正确的有( ) A.节流膨胀过程中,系统的焓值不变 B.节流膨胀是绝热可逆过程 C.节流膨胀中系统的热力学能不变 D.节流膨胀中多孔塞两侧压力分别保持恒定
第二章
第一组
1.热力学第一定律表达式为: U Q W ,其只适用于( ) A.单纯的 pVT 变化 B.相变化 C.化学变化 D.封闭系统的任何变化
2.( )组成的封闭系统的热力学能和焓仅仅是温度的函数。 A.理想溶液 B.所有气体 C.稀溶液 D.理想气体
答案
答案
3 公式 dHm Cp,mdT 的适用条件应该是( ) A.等压过程 B.恒外压过程 C.无相变、无化学变化的恒压变温过程 D.组成不变的均相系统的恒压过程
答案
9.对于非理想气体进行绝热自由膨胀时,下述表达式中不正确的是( )
A. Q 0
B.W 0
C. U 0
D. H 0
10.下列表述中正确的有( )
A.理想气体的焦尔-汤姆逊系数恒等于零
B.真实气体的焦尔-汤姆逊系数一定不为零
C.理想气体不能作为制冷机的工质 D.真实气体的焦尔-汤姆逊系数为零时对应一组 p 和T 值
答案
8.下面摩尔反应焓中,其中( 1
A. H2 (g)+ 2 O2 (g)=H2O(g) 1
C. H2 (g)+ 2 O2 (g)=H2O(l)
答案
)既为 H2 的燃烧焓,又为 H2O(l) 生成焓。
B. 2H2 (g)+O2 (g)=2H2O(g) 1
D. H2O(l)=H2 (g)+ 2 O2 (g)
C.临界点所对应的温度是气体可以加压液化所允许的最高温度
D.在临界参数中,临界体积是最易精确测定的
答案
6.理想气体的微观模型是( ) A.各种分子间的作用力相等,各种分子的体积大小相等 B.所有分子都看作一个质点,它们具有相同的能量 C.分子间无作用力,分子本身不占有体积 D.处于临界温度以上的气体
第二组
1.对于某一化学反应,若 rCp,m >0,则( )
A. r Hm 随T 升高而减小
B. r Hm 随T 升高而增大
C. r Hm 不随T 而变化
D. r Hm 随 T 变化无规律
答案
答案
2.某化合物的标准摩尔生成焓的定义是( ) A.在 298K 和 100kPa 下由稳定单质生成 1mol 化合物时焓变 B.在温度T 和 1atm 下由稳定单质生成 1mol 化合物时焓变 C.在 1atm 下由单质生成 1mol 化合物时的焓变 D.在温度T 和各处于 100kPa 下的纯的稳定单质生成 1mol 处于 100kPa 下和指
答案
4.下面各摩尔反应焓中属于摩尔燃烧焓的有( )
A.
H2
(g)+
1 2
O2
(g)=H2O(l)
B. CH4 (g)+2O2 (g)=2H2O(g)+CO2 (g)
C. C(s)+O2 (g)=CO2 (g)
7 D. C2H5OH(g)+ 2 O2 (g) 2CO2 (g)+3H2O(l)
答案
5.对于下述各过程中, U =0 的有( )
答案
5.在一个恒容的绝热箱内有一绝热隔板,其两侧分别放有 n,T, p 皆不相同的 N2 (g) ,若该气体可视为理想气体,则抽去隔板达到平衡,则混合过程的 U( ), W ( ), Q ( ), H ( )。
A. > 0 B. < 0 C. =0 D.无法确定
答案
6.从焓的定义 H U pV 出发,判断下列说法中正确的是( ) A.焓是能量,它遵守热力学第一定律 B.焓是系统内含的热 C.焓的增量只与系统的始末状态有关 D.系统的焓等于系统的热力学能与体积
定状态下的化合物时的焓变
答案
3.下列对于焓变的描述,正确的是( )
A.系统的焓等于等压热
B.系统的焓变等于过程的等压热
C.系统的焓变等于系统的热 D.系统的焓等于恒压和非体积功为零时过程的热
答案
4.热力学第一定律表达式为 U Q W ,其只适用于( ) A.敞开系统 B.理想气体系统 C.封闭系统 D.孤立系统
答案
4.公式 U nCV ,m (T ) 适用条件应该是( ) A.恒容过程 B.等容过程 C.无相变、无化学变化和W f 0 且 CV ,m 为常数的
恒容过程 D.任何变化
答案
5.一定量的理想气体,从同一始态的压力 p1 可逆膨胀到 p2 ,若将等温可逆膨胀 后的体积与绝热可逆膨胀后的体积相比,则( )
A.前者大于后者 B.前者小于后者 C.二者相等 D.无法判断差别
答案
6.理想气体的焦尔-汤姆逊系数
( T p
)H
是(
)
A. 0
B. 0
C.视所处的压力和温度而定
D. 0
7.理想气体经绝热可逆膨胀,其压力与体积的关系为( ) A. pV r 常熟 B. p1V1r nRT C. p1V1r 1 D.无一定关系
第三章 热力学第二定律 (2)
选择填空: 1. 根据热力学第二定律可知,任一循环过程中的( )。
A. 功与热可以完全互相转换; B. 功与热不能完全互相转换; C. 功可以完全转变为热,热不能完全转变为功; D. 功不能完全转变为热,热可以完全转变为功
答案
2. 使用亥姆霍兹判据 A ≤0 来判断过程的方向和限度时,所需的过程条件( )。 A. 恒温恒容非体积功为 0; B. 恒温恒压非体积功为 0; C. 隔离系统中发生的过程; D. 绝热封闭系统中发生的过程
答案 D.凝固点温度T f
答案 4.对比温度是其所处的温度T 与( )比值。
A.玻义尔温度 TB B.临界温度 Tc C. 沸腾温度Tb D.273 K
答案
5.对于临界点的描述,下列说法中( )是不正确的。
p
2 p
( A.临界点处 V
)T
0, (V 2 )T
0
B.在临界点处,液体和蒸气具有相同的密度
答案
4. 热力学第三定律的表述为( )。
A. 0K 时固体的熵等于零;
B. 标准状态下固体的熵等于零;
B. 标准状态下完美晶体的熵等于零; D. 0K 时完美晶体的熵等于零
答案
5. 将 100℃、101.325 kPa 的 1 mol 水置于密闭真空容器中,蒸发为同温同压下的水蒸气,过 程的下列各量何者等于零?( ) A. G; B. H; C. S(系); D. S(环)
A.理想气体恒温变化
B.恒温下将水变为水蒸气(理想气体)
C.恒容绝热的一切非体积为零的过程 D.任何系统的循环过程
答案
6.理想气体恒温下反抗恒定外压膨胀,下述表达式中正确的有( ) A.W p( 环) V ; B. H U ( pV ), U 0, ( pV ) 0,H 0 C. H U ( pV ), U 0, ( pV ) 0,H 0 D. W p( 环) V
答案
7.描述真实气体的状态方程有许多种,但它们都有一个共同的特点是( )
A.当压力趋近于零时,都可还原成 pVm RT
B.当温度越高时,都可还原成 pV nRT
C.当压力趋于无穷大时,都可还原成 pV nRT
D.当压力趋近于零时,都可还原成范德华方程
(
p
a Vm2
)(Vm
b)
RT
答案
8.对应状态原理的正确描述应该是( ) A.各种气体处于相同的温度和压力之下 B.各种气体处于相同的对比压力和对比温度下具有近似相同的对比体积 C.各种气体压缩因子都是 1 D.各种气体都处于临界温度以上
第一章 气体 pVT 性质
1.对于真实气体,当处于( )条件时,其行为与理想接近。 A.高温高压 B.高温低压 C.低温低压 D.低温高压
答案 2.某真实气体的压缩因子 Z < 1,则表示该气体,( )
A.易被压缩 B.难于压缩 C.易液化 D.难液化
3.物质能以液态形式存在的最高温度是( ) A.沸腾温度Tb B.临界温度 Tc C.玻义尔温度 TB
6. 节流过程中系统的熵变 S( )。 A. > 0; B. < 0; C. = 0; D. 无法确定
答案
7.
理想气体
S p
T
(
)。
nR
nR
nR
A. p ; B. p ; C. V ;
nR D. V ;
答案
答案
8. 在恒温恒压非体积功为零的条件下,任一能自发进行的化学反应得 rHm( A. >; B. <; C. =; D. 无法确定
2. 封闭系统中任意绝热可逆过程的熵变 S( )。 A. >0; B. < 0; C. = 0; D. 无法确定
