2015版无菌检查法
2015年版《中国药典》无菌检查法解读

2015年版《中国药典》无菌检查法解读杨晓莉;李辉;绳金房;钱维清;胡昌勤【摘要】目的解读2015年版《中国药典》无菌检查法的主要增修订情况.方法对比2015年版《中国药典》无菌检查法与2010年版《中国药典》无菌检查法的主要差异.结果 2015年版《中国药典》无菌检查法在检查内容、检查方法、培养体系及质量控制理念等方面都作了较大修订.结论 2015年版《中国药典》将无菌检查法完善成为更加科学并与国际接轨的检查方法.【期刊名称】《中国药业》【年(卷),期】2015(024)024【总页数】5页(P7-11)【关键词】无菌检查法;2015年版《中国药典》;无菌药品;培养体系;质量控制【作者】杨晓莉;李辉;绳金房;钱维清;胡昌勤【作者单位】陕西省食品药品检验所,陕西西安 710065;陕西省食品药品检验所,陕西西安 710065;陕西省食品药品检验所,陕西西安 710065;上海市食品药品检验所,上海 201203;中国食品药品检定研究院,北京 100050【正文语种】中文【中图分类】R954;R921.2无菌检查法是指用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的方法[1],是药品微生物检查体系的重要组成部分,药品微生物是关系药品安全性的关键指标之一。
无菌药品的微生物污染是影响药品生产质量和引发临床不良事件的主要因素,近年来发生的“欣弗事件及刺五加事件”等严重药害事件都是无菌药品的微生物污染导致[2]。
目前,美国、欧盟、日本等国家或组织无菌检查法已协调一致[3]。
2010年版《中国药典》及之前版本收录的无菌检查法与国际通用的标准在检查理念、培养体系、方法要求等诸多方面有显著差异。
在国家药品安全规划与标准提高的目标下,2015年版《中国药典》借鉴国外药典先进技术经验,以新的控制理念为指导,结合我国国情对无菌检查法的检测范围及环境要求、培养体系、方法适用性、检查方法、偏差调查与过程控制等方面都做了较大修订,进一步完善了无菌检查法,修订后的无菌检查法正逐步与国际通用标准一致。
中国药典(2015年版)无菌检查法

中国药典(2015年版)无菌检查法是用于检查药典要求无菌的药品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
如果供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查法包括薄膜过滤法和直接接种法。
只要供试品性质允许,应采用薄膜过滤法。
薄膜过滤法一般应采用封闭式薄膜过滤器,无菌检查用的滤膜孔径应不大于0.45微米,直径约为50mm。
根据供试品及其溶剂的特性选择滤膜材质,使用时,应保证滤膜在过滤前后的完整性。
直接接种法适用于无法用薄膜过滤法进行无菌检查的供试品,即取规定量供试品分别等量接种至硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中。
2015年版药典 无菌检查法

灵敏度检査 菌 种 培养基灵敏度检查所用的菌株传代次数不得超过 5 代(从 菌 种 保 存 中 心 获 得 的 干 燥 菌 种 为 第 0 代 ),并 采 用 适 宜的菌种保藏技术进行保存,以保证试验 菌株的 生物 学特 性。 金 黄 色 葡 萄 球 菌 (Staphylococcus aureus ) C C M C C (B) 26 003〕 铜 绿 假 单 胞 菌 (Pseudomonas aeruginosa ) C C M C C ( B) 10 104〕 枯 草 芽 孢 杆 菌 仏 5)〔C M C C ( B ) 6 3 501〕 生 抱 梭 菌 sporogenes) C C M C C ( B ) 64 941〕 白 色 念 珠 菌 albicans) C C M C C ( F ) 98 001〕 黑 曲 霉 n ig e r) C C M C C ( F ) 98 003〕 苗 液 制 备 接 种 金 黄 色 葡 萄 球 菌 、铜 绿 假 单 胞 菌 、枯草 芽孢杆菌的新鲜培养物至胰酪大豆胨液体培养基中或胰酪大 豆 胨 琼 脂 培 养 基 上 ,接 种 生 孢 梭 菌 的 新 鲜 培 养 物 至 硫 乙 醇 酸 盐 流 体 培 养 基 中 ,30〜 35°C培 养 18〜 2 4 小 时 ;接 种 白 色 念 珠菌的新鲜培养物至沙氏葡萄糖液体培养基中或沙氏葡萄糖 琼 脂 培 养 基 上 ,20〜 25°C培 养 24〜 4 8 小 时 ,上 述 培 养 物 用 PH7. 0 无 菌 氣 化 钠 -蛋 白 胨 缓 冲 液 或 0. 9% 无 菌 氣 化 钠 溶 液 制 成 每 l m l 含 菌 数 小 于 lOOcfu( 菌 落 形 成 单 位 )的 菌 悬 液 。接 种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基上, 20〜25*C培 养 5〜7 天 ,加 人 3〜 5 m l含 a 0 5 % (m l/m l) 聚山 梨 酯 8 0 的 pH7. 0 无 菌 氣 化 钠 -蛋 白 胨 缓 冲 液 或 0. 9 % 无 菌 氣 化 钠 溶 液 ,将 孢 子 洗 脱 。然 后 ,采 用 适 宜 的 方 法 吸 出 孢 子 悬 液 至 无 菌 试 管 内 ,用 含 0.05% ( m l/m l) 聚 山 梨 醋 8 0 的 pH7. 0 无 菌 氣 化 钠 -蛋 白 胨 缓 冲 液 或 0. 9 % 无 菌 氣 化 钠 溶 液 制 成 每 l m l 含 孢 子 数 小 于 lOOcfu的 孢 子 悬 液 。 菌 悬 液 若 在 室 温 下 放 置 ,应 在 2 小 时 内 使 用 ;若 保 存 在 2〜8°C可 在 2 4 小 时 内 使 用 。黑 曲 霉 孢 子 悬 液 可 保 存 在 2 〜 8°C,在 验 证 过 的 贮 存 期 内 使 用 。 培 养 基 接 种 取 每 管 装 量 为 12ml的硫乙醇酸盐流体培 养 基 7 支 ,分 别 接 种 小 于 lO O c fu 的 金 黄 色 葡 萄 球 菌 、铜 绿 假 单胞菌、生 孢 梭 菌 各 2 支 ,另 1 支 不 接 种 作 为 空 白 对 照 ,培 养 3 天 ;取 每 管 装 量 为 9 m l的 胰 酪 大 豆 胨 液 体 培 养 基 7 支 ,分 别接种小 于lOOcfu的 枯 草 芽 孢 杆 菌 、白 色 念 珠 菌 、黑 曲 霉 各 2 支,另 1 支不接种作为空白对照,培 养 5 天 。逐 日观 察结果。 结 果 判 定 空 白 对 照 管 应 无 菌 生 长 ,若 加 菌 的 培 养 基 管 均 生 长 良 好 ,判 该 培 养 基 的 灵 敏 度 检 查 符 合 规 定 。
中国药典2015版无菌检查法与美、欧、日药典的差异分析与讨论_潘友文

中国药典2015版无菌检查法与美、欧、日药典的差异分析与讨论潘友文(罗氏/基因泰克,美国南旧金山,94080)2016年07月29日摘要目的:分析中国药典2015版无菌检查法与美、欧、日药典无菌检查法的之间的差异性,为评价不同药典中无菌检查法的等效性提供参考。
方法:对无菌检查法的主要实验步骤和参数进行一对一比较,对有差异的步骤和参数进行科学论证和评价。
结果:中国药典2015版无菌检查法与美、欧、日药典无菌检查法的主要参数和步骤是一致的,但中国药典无菌检查法还需要做阳性对照和厌氧需氧菌的额外培养。
并且,中国药典用大肠埃希菌代替美、欧、日药典中的铜绿假单胞菌参与无菌检查法的适用性试验。
结论:各药典的无菌检查法是等效的。
在不影响方法等效性的前提下,中国药典2015版无菌检查法在阳性对照和培养方法上还可以进一步简化。
关键词:无菌检查法;中国药典;美国药典;欧洲药典;日本药典Gap Assessment and Discussion on Sterility Tests in Chinese Pharmacopoeia 2015, United States Pharmacopoeia, European Pharmacopoeia, and Japanese PharmacopoeiaYouwen Pan (Genentech, a Member of Roche, South San Francisco, USA 94080)Abstract Objective:Gap assessment and discussion on the sterility test methods in Chinese Pharmacopoeia 2015 edition (CP2015), United States Pharmacopoeia (USP), European Pharmacopoeia (EP), and Japanese Pharmacopoeia (JP). Method:The test procedures and key parameters in the sterility test methods in different pharmacopoeia were compared step by step and the differences were identified. The identified differences are scientifically evaluated for their impact to the equivalence of the methods. Result:The sterility test method in CP2015 is largely harmonized with that in USP, EP and JP except for a few differences. Positive control and extra incubation bacteria are required in CP2015 only, and Escherichia coli is used in method suitability test in CP2015 while Pseudomonas aeruginosa is used in USP/EP/JP. Conclusion:The Sterility Test Methods in CP2015, USP, EP, and JP are equivalent. The method in CP2015 could be simplified more without compromising the validity, accuracy and reliability of the method.Key words:sterility test;Chinese Pharmacopoeia 2015;United States Pharmacopoeia;European Pharmacopoeia; Japanese Pharmacopoeia无菌检查法是用于检查药典规定的无菌物品是否被微生物污染的检测方法。
9-钱文静-2015版中国药典无菌检查法

(二)、无菌检查的特点和意义 由于抽样概率的限制,通过无菌检查发现产品 微生物污染的可能性极低,而当前坚持无菌检查的 意义在于: 产品上市前发现重大污染事件的最后一道关口; 通过无菌检查的执行情况可以窥视其无菌控制存 在的问题。
三、无菌检查法的有关概念和新理念
(三)、无菌检查的新理念 1.全过程控制
2014-9-16
(一) 2015年版无菌检查法主要修订的内容 3、培养基 ⑶灵敏度检查- ②菌液制备用培养基的修订
2010年版 1、接种金黄色葡萄球菌、铜绿假单胞 菌、枯草芽孢杆菌新鲜培养物 ——至营养肉汤培养基中或营养琼脂培 养基上; 2、接种生孢梭菌的新鲜培养物 ——至硫乙醇酸盐流体培养基中; 3、接种白色念珠菌的新鲜培养物 ——至改良马丁培养基中或改良马丁琼 脂培养基; 4、接种黑曲霉的新鲜培养物至 ——改良马丁琼脂斜面培养基上 ;
2010年版 1、硫乙醇酸盐流体培养基 ——金黄色葡萄球菌、铜绿 假单胞菌、枯草芽孢杆菌、 生孢梭菌 2、改良马丁培养基 ——白色念珠菌、黑曲霉 2015年版 1、硫乙醇酸盐流体培养基 ——生孢梭菌、金黄色葡萄球 菌、铜绿假单胞菌 2、胰酪大豆胨液体培养基 ——枯草芽孢杆菌、白色念珠 菌、黑曲霉
30
悬浮粒子最大允许数/立方米 洁 净 度 级 别 A级 B级 C级 D级 静态 ≥0.5 μm 3520 3520 352000
3520000
微生物监测的动态标准(1) 浮游 菌 cfu/ m3 1 10 100 200
沉降 菌 ( 90m m) cfu /4h(2)
动态 ≥5.0 μm 20 29 2900 ≥0.5 μm 3520 352000 3520000 ≥5.0 μm 20 2900 29000
2014-9-16
2015版《中国药典》无菌、洁净室测定

方法适用性试验中 的修订
——两种培养基接 入试验菌的调整
22
2010年版
2015年版
1.硫乙醇酸盐流体培养基 ——金黄色葡萄球菌、铜绿假单胞 菌、枯草芽孢杆菌、生孢梭菌 (4种菌)→(9支) 2.改良马丁培养基 ——白色念珠菌、黑曲霉 (2种菌)→(5支)
1.硫乙醇酸盐流体培养基 ——金黄色葡萄球菌、铜绿假单胞 菌、生孢梭菌 (3种菌)→(7支) 2.胰酪大豆胨液体培养基 ——枯草芽孢杆菌、白色念珠菌、 黑曲霉 (3种菌)→(7支)
6
逐版发展提高的主要部分:
实验环境、设施的无菌保证 培养基品种及适用性检查要求 检验数量、检验量的增加 检验方法和仪器发展 验证试验要求 培养时间保证受损微生物的生长 结果判断规定 取消复试、及重试的规定
发展宗旨:加强检验的过程控制、提高方法的检出率、 保证检验结果的可靠性。
局限性
微生物污染可以发生在生 产、储存、运输、货架、 使用等环节 任何时段, 产品中微生物的污染可以 是不均匀的。
8
比较项目
实验环境要求
2010
总体1000级、局部100级
USP35
应在无菌条件下进行
EP7.0
应在无菌条件下进行
人员要求
培养基、培养 条件与时间
具备微生物专业知识,并经过 无菌技术培训
1
2
无菌检查的起源 无菌检查的发展历史 无菌检查法的发展宗旨
3
与静脉输液的起源和应用有关
——1665年,欧洲勃兰登堡候国御医约翰▪西吉斯 蒙德▪埃尔斯霍尔茨发表了《新灌药法及其方式方 法》 ——1831年,西欧霍乱肆虐,为了拯救在死亡线 上挣扎的病人,苏格兰医生赖特大胆启用静脉输 液疗法,他将大量煮沸过的食盐水静脉输注给霍 乱病人使大部分病人得救。 ——赖特在实践中观察到了输液产生的“注射热” ——随着显微镜的发明和微生物的发现,人们开始 了输液无菌检查的研究。
无菌药品GMP检查指南 2015

无菌药品GMP检查指南2015年10月目录一、 .............................................................. 目的5本指南的主要目的是为检查员在实施无菌药品生产企业检查时提供指导。
检查组应参照本指南的要求检查无菌药品生产质量管理情况,评价企业无菌保证的能力,以确定企业是否符合《药品生产质量管理规范(2010年修订)》(以下简称GMP)的要求。
5二、 ................................................ 适用范围及检查依据5本指南适用于无菌药品的GMP检查,包括无菌制剂生产全过程和无菌原料药的灭菌和无菌生产过程。
(5)无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,通常包括大容量注射剂、小容量注射剂、粉针剂、冻干粉针剂、眼用制剂、耳用制剂、埋植剂、供雾化器用的液体制剂、冲洗剂、外用制剂、无菌原料药等。
无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
本指南适用于对上述不同生产工艺及不同类型的无菌药品的检查。
5检查过程中,检查员应依据《药品生产质量管理规范(2010年修订)》及其附录来确定检查缺陷所涉及的条款。
(5)三、 .............................................. 无菌药品生产工艺概述5无菌药品按生产工艺可分为最终灭菌产品和非最终灭菌产品两类,部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
无菌药品、直接接触药品的包装材料应尽可能采用热力灭菌方式进行最终灭菌。
采用湿热灭菌方法进行最终灭菌的,通常标准灭菌时间F0值应当大于8分钟,流通蒸汽处理不属于最终灭菌。
最终灭菌产品中的微生物存活概率(即无菌保证水平,SAL)不得高于10-6。
(5)(一) .................................................. 最终灭菌工艺6产品的无菌保证水平不能仅依赖最终灭菌。
中国药典2015版-微生物限度检查解析

*
*
注*:限度未做统一规定。
控制菌
*
不得检出沙门菌 (10g) ; 耐胆盐革兰阴性菌应小 于104(1 g)
执行及制定标准的注意事项
执行范围: 生产、贮存、销售过程中的药品 药用原料、辅料 中药提取物、中药饮片 新药标准 进口药品标准复核 药品质量考察及仲裁
标准执行的注意事项: 药典标准出处:中国药典通则项下【微生
或菌株已无使用需要时应及时灭菌销毁”; • 管理:应有程序文件,包括申购、操作、转种传代、纯度特性确认记录,注明名称、标准号、
接种日期、代数、培养基和培养条件、保藏的位置和条件等。
环境
• 实验室的布局和运行 • 环境监测 • 清洁、消毒和卫生
设备
建立仪器设备管理制度 清洁保养制度 操作规程 使用、监控的记录
器、天平、量器等等) 3.供应商评估与现场审计 使用正确的、有严格质量保障的产品
《中国药典》2015年版-微生物限度标准修订解析
标准修订内容 修订思路1 《中国药典》2010年版一、二、三部限度标准的相关内容合并。 修订思路2 参考EP7.0,USP35,JP X V标准,修订中国药典的微生物限度标准。
胆盐革兰阴性菌应小102
不含豆豉、神曲等发酵 5×102 原粉
102
液体口服给药
制剂
含豆豉、神曲等
发酵原粉
103
102
不得检出大肠艾希菌 不得检出沙门菌
耐胆盐革兰阴性菌应小 于 101
固体局部给药 表皮或粘膜不完整
104
102
不得检出金黄色葡萄球
制剂
菌、
表皮或粘膜完整
103
102
铜绿假单胞菌 ;阴道、
药品微生物检验的现状与发展
2015版无菌检查法

2015版无菌检查法
方法适用性试验
结果判断
与对照管比较,如含供试品各容器中的试 验菌均生长良好,则说明供试品的该检验 量在该检验条件下无抑菌作用或其抑菌作 用可以忽略不计,照此检查方法和检查条 件进行供试品的无菌检查。 如含供试品的 任一容器中的试验菌生长微弱、缓慢或不 生长,则说明供试品的该检验量在该检验 条件下有抑菌作用,应采用增加冲洗量、 增加培养基的用量、1使3 用中和剂或灭活剂2015版、无菌检查法
无菌性检查 每批培养基随机取不少于 5 支 (瓶),置各培养基规定的温度培养 14天, 应无菌生长。
6
2015版无菌检查法
培养基的适用性检查
灵敏度检查
菌液制备 接种金 黄色葡萄球菌、铜
7
2015版无菌检查法
培养基适用性检查直观区别
2010版 2015版
相应菌种接种所用 培养基
金黄色葡萄球菌、 铜绿假单胞菌、 枯草芽孢杆菌
胰酪大豆胨液体 培养基
营养肉汤培养基 调节 pH 值使灭 菌后 为 7.2 ± 0.2
胰酪大豆胨琼脂 培养基
营养琼脂培养基 调节pH 值使灭菌 沙氏葡萄糖液体 后为 7.2±0.2 培养基
改良马丁琼脂培 调节 pH值使灭菌 沙氏葡萄糖琼脂
养基
后为 6.4±0.2 培养基
5
调节 pH 使灭菌 后pH值为 7.3±0.2
照菌;抗厌氧菌的供试品,以生孢梭菌为
对照菌;抗真菌的供试品,以白色念珠菌
为对照菌。阳性对照试验的菌液制备同方
法适用性试验,加菌量小于 100cfu,供试
品用量同供试品无菌检查时每份培养基接
种的样品量。阳性对照管培养 48~72 小时
16
9
2015版无菌检查法
2015版中国药典微生物限度

1.4.2供试品检查
• 供试液制备
– ⑶油脂类供试品
• 取供试品,加入无菌十四烷酸异丙酯使溶 解,或与最少量并能使供试品乳化的无菌 聚山梨酯 80或其他无抑菌性的无菌表面 活性剂充分混匀。表面活性剂的温度一般 不超过 40℃(特殊情况下,最多不超过 45℃),小心混合,若需要可在水浴中进 行,然后加入预热的稀释液使成 1∶10供 试液,保温,混合,并在最短时间内形成 乳状液。必要时,用稀释液或含上述表面 活性剂的稀释液进一步 10倍系列稀释。
– 培养和计数 培养条件和计数方法同平皿计数 法,每张滤膜上的菌落数应不超过100cfu。
• 菌数报告规则
– 以相当于 1g、1ml 或10cm2 供试品的菌落数 报告菌数;若滤膜上无菌落生长,以﹤1 报 告菌数(每张滤膜过滤1g、1ml 或10cm2 供 试品),或﹤1 乘以最低稀释倍数的值报告菌 数。
1.4.2供试品检查
• 供试液制备
– ⑷需用特殊方法制备供试液的供试品
• 膜剂供试品 • 肠溶及结肠溶制剂供试品 • 气雾剂、喷雾剂供试品 • 贴膏剂供试品
1.4.2供试品检查
1. 平皿法
– 平皿法包括倾注法和涂布法。 – 除另有规定外,取规定量供试品,按方法适用性
试验确认的方法进行供试液制备和菌数测定,每 稀释级每种培养基至少制备2个平皿。 – 培养和计数 除另有规定外,胰酪大豆胨琼脂培养 基平板在30~35℃培养3~5天,沙氏葡萄糖琼脂 培养基平板在20~25℃培养5 ~7天, 观察菌落 生长情况,点计平板上生长的所有菌落数,必要时 可适当延长培养时间至7 天进行菌落计数并报告 。菌落蔓延生长成片的平皿不宜计数。点计菌落 数后,计算各稀释级供试液的平均菌落数,按菌 数报告规则报告菌数。 – 若同稀释级两个平皿的菌落数平均值不小于15, 则两个平皿的菌落数不能相差1 倍或以上。
药典三部(2015版)-通则-1101微生物检查法

1101 无菌检查法无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区、工作台面及环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。
隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
日常检验还需对试验环境进行监控。
培养基硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需氧菌培养;胰酪大豆胨液体培养基用于真菌和需氧菌的培养。
培养基的制备及培养条件培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基。
配制后应采用验证合格的灭菌程序灭菌。
制备好的培养基应保存在2~25℃、避光的环境,若保存于非封闭容器中,一般在3周内使用;若保存于密闭容器中,一般可在一年内使用。
1. 硫乙醇酸盐流体培养基胰酪胨15.0g 氯化钠2.5g酵母浸出粉 5.0g 新配制的0.1% 刃天青溶液1.0ml无水葡萄糖 5.0g 琼脂0.75gL-胱氨酸0.5g 水1000ml硫乙醇酸钠0.5g(或硫乙醇酸)(0.3ml)除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH,使灭菌后在25℃的pH值为7.1±0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100℃水浴加热至粉红色消失(不超过20分钟),迅速冷却,只限加热一次,并防止污染。
无菌检查法 版药典

除 葡 萄 糖 外 ,取 上 述 成 分 ,混 合 ,微 温 溶 解 ,滤 过 , 调 节 p H 使 灭 菌 后 在 2 5 C 的 p H 值 为 7.3±0.2,加人葡萄
糖 ,分 装 ,灭 菌 。 胰 酪 大 豆 胨 液 体 培 养 基 置 20〜25eC 培 养 。 3. 中和或灭活用培养基
培养基
硫 乙 醇 酸 盐 流 体 培 养 基 主 要 用 于 厌 氧 菌 的 培 养 ,也可用
于 需 氧 菌 培 养 ;胰 酪 大 豆 胨 液 体 培 养 基 用 于 真 菌 和 需 氧 菌 的
培养。
培养基的制备及培养条件
培 养 基 可 按 以 下 处 方 制 备 ,亦可使用按该处方生产的
符 合 规 定 的 脱 水 培 养 基 或 成 品 培 养 基 。配制后应采用验证 合 格 的 灭 菌 程 序 灭 菌 。制 备 好 的 培 养 基 应 保 存 在 2 〜
蛋 白 质 )。
•
ቤተ መጻሕፍቲ ባይዱ
供 试 品 羟 胺 残 留 量 — 供 试 品 的 残 留 羟 胺 浓 度 (nmol/ml) (nmol/mg蛋 白 质 ) 供 试 品 的 蛋 白 质 含 量 (mg/ml)
微生物检查法
1 1 0 1 无菌检查法
无 菌检 查法 系 用 于 检 查 药典 要 求 无 菌的 药 品 、生物制 品 、医 疗 器 具 、原 料 、辅 料及其他品种是否无菌的一种 方 法 。若 供 试 品 符 合 无 菌 检查 法的 规 定 ,仅表明了供试品在 该检验条件下未发现微生物污染。
结 果 判 定 空 白 对 照 管 应 无 菌 生 长 ,若加菌的培养基 管 均 生 长 良 好 ,判该 培 养 基 的灵 敏度 检査 符合规定 。
甲硝唑氯化钠注射液无菌检查方法适用性试验

甲硝唑氯化钠注射液无菌检查方法适用性试验目的按照《中国药典》2015版四部无菌检查法(通則1101)对甲硝唑氯化钠注射液进行无菌检查方法适用性试验,建立优化的甲硝唑氯化钠注射液无菌检查方法。
方法试验采用薄膜过滤法,以0.1%无菌蛋白胨水溶液为冲洗液,每膜冲洗量从100 mL开始递增,最大冲洗量为每膜1000 mL,分别进行3次试验,第1次使用冲洗液直接冲洗样品,第2次使用含0.13%聚山梨酯80的冲洗液,第3次使用含0.2%聚山梨酯80的冲洗液。
结果试验一:生孢梭菌试验组均不生长;试验二:当冲洗量达到最大值(每膜1000 mL)时,试验组生长良好;试验三:当冲洗量达到每膜500 mL时,可消除甲硝唑的抑菌性,试验组生长良好。
结论甲硝唑氯化钠注射液(100 mL:甲硝唑0.5 g与氯化钠0.8 g)可采用薄膜过滤法(每滤筒10瓶供试品,以含0.2%聚山梨酯80的0.1%无菌蛋白胨水溶液为冲洗液,冲洗5次,每膜100 mL/次)进行无菌检查,以生孢梭菌作为阳性对照菌。
[Abstract] Objective To establish optimized sterility test method of Metronidazole and Sodium Chloride Injection according to the suitability test of sterility test for Metronidazole and Sodium Chloride Injection by the sterility test method (general rule 1101)in Chinese Pharmacopoeia (2015). Methods The test applied membrane filtration method and used 0.1% sterile peptone solution as rinse solution. The rinsing amount of per membrane was increased from 100 mL to the maximum amount of 1000 mL per membrane. Three separate tests were performed. The sample was directly rinsed with the rinse solution for the first time,the rinse solution containing 0.13% and 0.2% polysorbate 80 were used for the second and third time respectively. Results In test one,the Clostridium sporogenes test group did not grow;in test two,the test group grew well when the rinsing amount reached the maximum (1000 mL per membrane);in test three,the antibacterial effect of Metronidazole could be eliminated and the test group grew well when the rinsing amount reached 500 mL per membrane. Conclusion Metronidazole Sodium Chloride Injection (100 mL:Metronidazole 0.5 g and Sodium Chloride 0.8 g)should be sterilized by membrane filtration (10 bottles for each filter cartridge,0.1% sterile peptone solution containing 0.2% polysorbate 80 as the rinse solution,rinsed for 5 times,100 mL/time per film),using Clostridium sporogenes as a positive control.[Key words] Metronidazole and Sodium Chloride Injection;Sterility test;Suitability test;Polysorbate 80甲硝唑氯化钠注射液主要用于治疗或预防部分厌氧菌引起的系统或局部感染[1]。
2015年版中国药典微生物限度检查法

1.1 总则:
• 环境: – 微生物计数试验环境应符合微生物限度检查的要 求。(在不低于GMP 现行版要求的D 级洁净环境 、局部洁净度不低于B 级的单向流空气区域内进 行)【10版:在环境洁净度10000级下的局部洁净 度100级的单向流空气区域内】。 – 检验全过程必须严格遵守无菌操作,防止再污染 ,防止污染的措施不得影响供试品中微生物的检 出。 – 单向流空气区域、工作台面及环境应定期进行监 测。
菌数报告规则
– 需氧菌总数测定宜选取平均菌落数小于 300cfu 的稀释级、霉菌和酵母菌总数测定宜 选取平均菌落数小于100cfu 的稀释级,作为 菌数报告(取两位有效数字)的依据。取最 高的平均菌落数,计算1g、1ml 或10 cm² 供 试品中所含的微生物数。 – 如各稀释级的平皿均无菌落生长,或仅最低 稀释级的平板有菌落生长,但平均菌落数小 于1 时,以﹤1 乘以最低稀释倍数的值报告菌 数。
1.4.2供试品检查
• 供试液制备 – ⑴ 水溶性供试品
• 取供试品,用 pH7.0 无菌氯化钠-蛋白胨 缓冲液,或pH7.2 磷酸盐缓冲液,或胰酪 大豆胨液体培养基溶解或稀释制成 1:10 供试液。若需要,调节供试液 pH 值至 6 ~8。必要时,用同一稀释液将供试液进 一步 10倍系列稀释。水溶性液体制剂也 可用混合的供试品原液作为供试液。
1.3.1菌液制备及使用
试验菌株 试验菌液的制备
金黄色葡萄球菌 〔CMCC(B) 26 003)〕
铜绿假单胞菌 〔CMCC(B)10 104〕 枯草芽孢杆菌 〔CMCC(B) 63 501〕 白色念珠菌 〔CMCC(F) 98 001〕
胰酪大豆胨琼脂培养基或胰酪大豆胨液体培 养基 【10版:营养肉汤或营养琼脂培养基】 30~35℃,18~24小时
中国药典2015版无菌检查方法适用性试验(直接接种法)
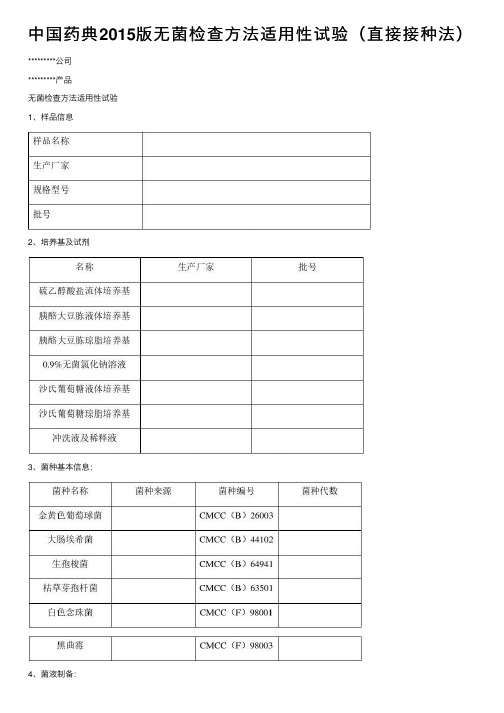
中国药典2015版⽆菌检查⽅法适⽤性试验(直接接种法)*********公司*********产品⽆菌检查⽅法适⽤性试验1、样品信息2、培养基及试剂3、菌种基本信息:4、菌液制备:2.1接种⾦黄⾊葡萄球菌、⼤肠埃希菌、枯草芽孢杆菌的新鲜培养物⾄胰酪⼤⾖胨培养基中或胰酪⼤⾖胨脂培养基上,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.2接种⽣孢梭菌的新鲜培养物⾄硫⼄醇酸盐流体培养基中,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.3接种⽩⾊念珠菌的新鲜培养物⾄沙⽒葡萄糖液体培养基或沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养24~48⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml 含菌数⼩于100cfu的菌悬液。
2.4接种⿊曲霉菌的新鲜培养物接种⾄沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养5~7天,加⼊3~5ml含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液,将孢⼦洗脱。
然后,采⽤适宜的⽅法吸出孢⼦悬液⾄⽆菌试管内,⽤含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌孢⼦悬液。
6、⽆菌检查直接接种法⽅法适⽤性试验6.1供试品制备:描述供试品制备过程(主要为每个样品的取样部位及⽤量)。
6.2试验组:取装量为 ml硫⼄醇酸盐流体培养基,接种规定的供试品量(同6.1),并接种⼩于100cfu的⾦黄⾊葡萄球菌;⼤肠埃希菌、⽣孢梭菌、枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉按照上述步骤操作,其中⼤肠埃希菌、⽣孢梭菌加⼊硫⼄醇酸盐流体培养基,枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉加⼊胰酪⼤⾖胨液体培养基。
6.3对照组:取装量为 ml硫⼄醇酸盐流体培养基3管,分别接种⼩于100cfu的⾦黄⾊葡萄球菌、⼤肠埃希菌、⽣孢梭菌;取相同装量的胰酪⼤⾖胨培养基3管,分别接种⼩于100cfu枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
培养及观察直观区别
2010版
培养 14天后,不能从外观上 判断有无微生物生长,可取 该培养液适量转种至同种新 鲜培养基中,细菌培养 2天、 真菌培养 3天,观察接种的同 种新鲜培养基是否再出现浑 浊
2015版
培养 14天后,不能从外观上 判断有无微生物生长,可取 该培养液适量转种至同种新 鲜培养基中,培养 3 天,观 察接种的同种新鲜培养基是 否再出现浑浊
2015版
无菌检查应在无菌条件下进行,试验环境必须达 到无菌检查的要求,检验全过程应严格遵守无菌 操作,防止微生物污染,防止污染的措施不得影 响供试品中微生物的检出。
培养基
硫乙醇酸盐流体培养基主要用于厌氧菌的 培养,也可用于需氧菌培养; 胰酪大豆胨液体培养基用于真菌和需氧菌 的培养。 制备好的培养基应保存在 2~25℃、避光 的环境,若保存于非密闭容器中,一般在 3 周内使用; 若保存于密闭容器中,一般可在一年内使 用。
供试品的无菌检查
培养及观察 将上述接种供试品后的培养基容器分别按各培 养基规定的温度培养 14天;一份置 30~35℃ 培养,一份置 20~25℃培养。培养期间应逐 日观察并记录是否有菌生长。如在加入供试品 后或在培养过程中,培养基出现浑浊,培养 14天后,不能从外观上判断有无微生物生长, 可取该培养液适量转种至同种新鲜培养基中, 培养 3 天,观察接种的同种新鲜培养基是否再 出现浑浊;或取培养液涂片,染色,镜检,判 断是否有菌。
供试品的无菌检查
结果判断 阳性对照管应生长良好,阴性对照管不得有菌生长。否则,试验无效。 若供试品管均澄清,或虽显浑浊但经确证无菌生长,判供试品符合规定; 若供试品管中任何一管显浑浊并确证有菌生长,判供试品不符合规定,除 非 能充分证明试验结果无效,即生长的微生物非供试品所含。当符合下列至 少 一个条件时方可判试验结果无效: (1)无菌检查试验所用的设备及环境的微生物监控结果不符合无菌检查 法的要求。 (2)回顾无菌试验过程,发现有可能引起微生物污染的因素。 (3)供试品管中生长的微生物经鉴定后,确证是因无菌试验中所使用的 物品和(或)无菌操作技术不当引起的。 试验若经确认无效,应重试。重试时,重新取同量供试品,依法检查,若 无菌生长,判供试品符合规定;若有菌生长,判供试品不符合规定。
方法适用性试验
结果判断 与对照管比较,如含供试品各容器中的试验菌 均生长良好,则说明供试品的该检验量在该检 验条件下无抑菌作用或其抑菌作用可以忽略不 计,照此检查方法和检查条件进行供试品的无 菌检查。 如含供试品的任一容器中的试验菌 生长微弱、缓慢或不生长,则说明供试品的该 检验量在该检验条件下有抑菌作用,应采用增 加冲洗量、增加培养基的用量、使用中和剂或 灭活剂、更换滤膜品种等方法,消除供试品的 抑菌作用,并重新进行方法适用性试验。
培养基接种直观区别
2010版
硫乙醇酸 盐流体培 养基 9支 金黄色葡萄球 菌、铜绿假单 胞菌、枯草芽 孢杆菌、生孢 梭菌
白色念珠菌、 黑曲霉
2015版
硫乙醇酸 盐流体培 养基 7支 金黄色葡萄球 菌、 铜绿假单胞菌、 生孢梭菌
枯草芽孢杆菌、 白色念珠菌、 黑曲霉
改良马丁 培养基
5支
胰酪大豆 胨液体培 养基
培养基适用性检查直观区别
2010版
相应菌种接种所用 培养基 金黄色葡萄球菌、 铜绿假单胞菌、 枯草芽孢杆菌 营养肉汤培养基中 或营养琼脂培养基
2015版
胰酪大豆胨液体培 养基中或胰酪大豆 胨琼脂培养基
பைடு நூலகம்
白色念珠菌
改良马丁培养基中 或改良马丁琼脂培 养基
改良马丁琼脂斜面 培养基 23~28℃
沙氏葡萄糖液体培 养基中或沙氏葡萄 糖琼脂培养基
沙氏葡萄糖琼脂斜 面培养基 20~25℃
黑曲霉 霉菌、酵母菌培养温度 稀释液
0.9%无菌氯化钠溶 pH7.0 无菌氯化钠液 蛋白胨缓冲液或 0.9%无菌氯化钠溶 液
培养基的适用性检查
培养基接种 取每管装量为 12ml 的硫乙醇酸盐流体培养 基 7 支,分别接种小于 100cfu 的金黄色葡 萄球菌、铜绿假单胞菌、生孢梭菌各 2支, 另 1支不接种作为空白对照,培养 3 天;取 每管装量为 9ml 的胰酪大豆胨液体培养基 7支,分别接种小于 100cfu的枯草芽孢杆菌、 白色念珠菌、黑曲霉各 2支,另 1支不接种 作为空白对照,培养 5天。逐日观察结果。
供试品的无菌检查
薄膜过滤法 薄膜过滤法应采用封闭式薄膜过滤器。无菌检查用 的滤膜孔径应不大于0.45μm。直径约为 50mm。根 据供试品及其溶剂的特性选择滤膜材质。使用时, 应保证滤膜在过滤前后的完整性。 水溶性供试液过滤前应先将少量的冲洗液过滤以润 湿滤膜。油类供试品,其滤膜和过滤器在使用前应 充分干燥。为发挥滤膜的最大过滤效率,应注意保 持供试品溶液及冲洗液覆盖整个滤膜表面。供试液 经薄膜过滤后,若需要用冲洗液冲洗滤膜,每张滤 膜每次冲洗量一般为 100ml,且总冲洗量不得超过 1000ml,以避免滤膜上的微生物受损伤。
7支
方法适用性试验
菌种及菌液制备 除大肠埃希菌(Escherichia coli)[CMCC(B) 44102〕外,金黄色葡萄球菌、枯草芽孢杆 菌、生孢梭菌、白色念珠菌、黑曲霉同培 养基灵敏度检查。大肠埃希菌的菌液制备 同金黄色葡萄球菌。
方法适用性试验
薄膜过滤法 取每种培养基规定接种的供试品总量按薄 膜过滤法过滤,冲洗,在最后一次的冲洗 液中加入小于 100cfu的试验菌,过滤。加 硫乙醇酸盐流体培养基或胰酪大豆胨液体 培养基至滤筒内。另取一装有同体积培养 基的容器,加入等量试验菌,作为对照。 置规定温度培养 3~5 天,各试验菌同法操 作。
谢谢!
2015版 无菌检查法
姜珊 2014.10.07
无菌检查法
无菌检查法系用于检查药典要求无菌的药 品、生物制品、医疗器具、原料、辅料及 其他品种是否无菌的一种方法。若供试品 符合无菌检查法的规定,仅表明了供试品在 该检验条件下未发现微生物污染
环境洁净度
2010版 无菌检查应在环境洁净度 10 000级下的局部洁 净度 100级的单向流空气区域内或隔离系统中进 行
供试品的无菌检查
无菌检查法包括薄膜过滤法和直接接种法。 只要供试品性质允许,应采用薄膜过滤法。 供试品无菌检查所采用的检查方法和检验 条件应与方法适用性试验确认的方法相同。 无菌试验过程中,若需使用表面活性剂、 灭活剂、中和剂等试剂,应证明有效性, 且对微生物无毒性。
供试品的无菌检查
检验数量 检验数量是指一次试验所用供试 品最小包装容器的数量 检验量 是指供试品每个最小包装接种至每 份培养基的最小量(g 或ml)。
培养基的适用性检查
灵敏度检查
菌液制备 接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的新鲜培养物 至胰酪大豆胨液体培养基中或胰酪大豆胨琼脂培养基上,接种生孢梭菌的新 鲜培养物至硫乙醇酸盐流体培养基中,30~35℃培养 18~24小时;接种白 色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中或沙氏葡萄糖琼脂培 养基上,20~25℃培养 24~48 小时,上述培养物用 pH7.0 无菌氯化钠-蛋白 胨缓冲液或 0.9%无菌氯化钠溶液制成每 1ml 含菌数小于 100cfu(菌落形成 单位)的菌悬液。接种黑曲霉的新鲜培养 物至沙氏葡萄糖琼脂斜面培养基上, 20~25℃培养 5~7 天,加入 3~5ml 含 0.05%(v/v)聚山梨酯 80 的 pH7.0无菌氯化钠-蛋白胨缓冲液或 0.9%无菌氯化钠溶液,将孢子洗脱。然后, 采用适宜的方法吸出孢子悬液至无菌试管内,用含 0.05%(v/v)聚山梨酯 80的 pH7.0 无菌氯化钠-蛋白胨缓冲液或 0.9%无菌氯化钠溶液制成每 1ml 含 孢子数小于 100cfu 的孢子悬液。
供试品的无菌检查
阳性对照 应根据供试品特性选择阳性对照菌:无 抑菌作用及抗革兰阳性菌为主的供试品,以金黄色 葡萄球菌为对照菌;抗革兰阴性菌为主的供试品以 大肠埃希菌为对照菌;抗厌氧菌的供试品,以生孢 梭菌为对照菌;抗真菌的供试品,以白色念珠菌为 对照菌。阳性对照试验的菌液制备同方法适用性试 验,加菌量小于 100cfu,供试品用量同供试品无菌 检查时每份培养基接种的样品量。阳性对照管培养 48~72 小时应生长良好。 阴性对照 供试品无菌检查时,应取相应溶剂和稀 释液、冲洗液同法操作,作为阴性对照。阴性对照 不得有菌生长。
供试品的无菌检查
水溶液供试品 取规定量,直接过滤,或混合至含不少于 100ml适宜稀释液的无菌容器中,混匀,立 即过滤。如供试品具有抑菌作用,须用冲 洗液冲洗滤膜,冲洗次数一般不少于三次, 所用的冲洗量、冲洗方法同方法适用性试 验。除生物制品外,一般样品冲洗后,1份 滤器加入 100ml硫乙醇酸盐流体培养基,1 份滤器加入 100ml胰酪大豆胨液体培养基。
培养基PH区别
2010版
改良马丁培养基 调节 pH 值使灭 菌后 为 6.4 ± 0.2 调节 pH 值使灭 菌后 为 7.2 ± 0.2
2015版
胰酪大豆胨液体 培养基 胰酪大豆胨琼脂 培养基 沙氏葡萄糖液体 培养基 调节 pH 使灭菌 后pH值为 7.3±0.2 调节 pH使灭菌 后在 25℃的pH 值为 7.3±0.2 调节 pH使灭菌 后在 25℃的pH 值为 5.6±0.2
营养肉汤培养基
营养琼脂培养基 调节pH 值使灭 菌后为 7.2±0.2
改良马丁琼脂培 养基
调节 pH值使灭 沙氏葡萄糖琼脂 菌后为 6.4±0.2 培养基
调节 pH使灭菌 后在25℃的pH值 为5.6±0.2
培养基的适用性检查
