3-磷酸甘油醛脱氢酶(GAPDH)活性检测试剂盒说明书 微量法
3磷酸甘油醛脱氢酶负协同效应

3磷酸甘油醛脱氢酶负协同效应1. 介绍3磷酸甘油醛脱氢酶(GAPDH)是一种广泛存在于生物体中的酶,参与细胞内糖酵解途径中的关键步骤。
磷酸甘油醛脱氢酶催化的反应是糖酵解过程中产生ATP的关键步骤之一。
然而,近年来的研究发现,GAPDH在细胞内还具有许多其他功能,其中之一就是负协同效应。
负协同效应是指某一物质在存在其他物质的情况下,其活性或功能受到抑制或降低的现象。
在GAPDH中,负协同效应主要指的是当细胞内存在某些调控因子时,GAPDH的酶活性会受到抑制或降低。
这些调控因子可以是其他酶、蛋白质、小分子化合物等。
2. 负协同效应的机制目前,关于GAPDH负协同效应的机制还存在一定的争议,但已经有一些研究取得了重要的进展。
以下是一些目前已知的GAPDH负协同效应的机制:2.1. 蛋白质相互作用GAPDH可以与许多其他蛋白质发生相互作用,这些相互作用可能导致GAPDH的酶活性受到抑制。
例如,研究发现,GAPDH可以与肿瘤抑制因子p53相互作用,并抑制其转录活性。
此外,GAPDH还可以与一些转录因子相互作用,影响其转录活性。
2.2. 磷酸化修饰磷酸化修饰是细胞内常见的一种调控机制,可以改变蛋白质的结构和功能。
研究表明,GAPDH的酶活性可以通过磷酸化修饰发生变化。
一些研究发现,当GAPDH被磷酸化时,其酶活性会受到抑制。
磷酸化修饰可以通过激酶的作用进行,也可以通过磷酸酶的作用进行逆反应。
2.3. 产物抑制在糖酵解过程中,GAPDH催化磷酸甘油醛与NAD+反应生成磷酸甘油酸和NADH。
研究发现,当NADH的浓度较高时,它可以与GAPDH结合形成复合物,从而抑制GAPDH的酶活性。
此外,其他代谢产物,如ATP、ADP等,也可以通过类似的机制抑制GAPDH的酶活性。
3. 生理意义GAPDH负协同效应在细胞内具有重要的生理意义。
首先,通过调控GAPDH的酶活性,细胞可以控制糖酵解过程的速率,以适应不同的代谢需求。
甘油醛3-磷酸脱氢酶

甘油醛3-磷酸脱氢酶甘油醛3-磷酸脱氢酶(GAPDH)是一种重要的蛋白质,它在生物体内起着重要的作用。
GAPDH存在于几乎所有生物种类,包括细菌、动物和植物。
它是一个由四个亚基组成的四聚体,每个亚基含有一个催化中心。
GAPDH可以在细胞内的糖酵解途径、Gluconeogenesis 途径和细胞凋亡中发挥重要的作用。
GAPDH在糖酵解途径中的作用是将葡萄糖转化为丙酮酸。
在这个过程中,GAPDH将葡萄糖分子氧化为葡萄糖6-磷酸酸,然后,葡萄糖6-磷酸酸进一步分解为丙酮酸和磷酸二羧酸,GAPDH就是催化葡萄糖6磷酸酸和磷酸二羧酸互相转化的关键酶。
这个过程同时释放了能量,产生ATP和NADH。
GAPDH还参与了细胞凋亡中的过程。
细胞凋亡是细胞程序性死亡的重要形式。
在细胞凋亡过程中,GAPDH通过与Siah1相互作用,促进了肿瘤坏死因子-α介导的细胞凋亡。
GAPDH与Siah1相互作用后,可以增强Cdk5激活的受体神经元1(NR1)的降解,从而加强细胞凋亡。
在Gluconeogenesis途径中,GAPDH的作用相当于磷酸甘油脱氢酶(G3PDH),它可以将丙酮酸还原为葡萄糖6磷酸酸,从而增加葡萄糖的储存量。
除此之外,GAPDH在细胞内通过与其他蛋白质的相互作用参与了很多其他的生物过程,例如运输、蛋白质合成等。
虽然GAPDH的作用十分重要,但是它也参与了一些其他非正常的生物过程中。
例如,当细胞受到压力时,会增加GAPDH的表达,这种过度表达会导致细胞的凋亡。
此外,GAPDH 还可以在疾病的发生发展中发挥作用。
例如,GAPDH的过度表达在癌细胞中广泛存在。
GAPDH还可以通过和其他蛋白质的相互作用参与神经性疾病的发生和发展。
综上所述,甘油醛3-磷酸脱氢酶(GAPDH)是一种常见的酶,参与了多种生物过程,包括糖酵解途径、Gluconeogenesis途径和细胞凋亡。
与此同时,GAPDH也参与了一些异常生物过程,包括癌症、神经性疾病等。
2024届辽宁省沈阳市东北育才学校高三上学期三模生物试题及答案

2023—2024 学年度东北育才学校高中部高三第三次模拟考试生物科试卷一、单选题(每小题只有一个正确选项,每小题2分,共30分)1. 已知生物毒素a 是由蛋白质b 经过糖链修饰后得到的糖蛋白,通过胞吞进入细胞,可专一性地抑制核糖体的功能。
为研究a 的结构与功能的关系,某小组取生物毒素a 、蛋白质b 和c(c 由a 经高温加热处理获得,糖链不变)三种蛋白样品,分别加入三组(对应a 、b 、c 组)等量的某种癌细胞(X)培养物中,适当培养后,检测X 细胞内样品蛋白的含量和X 细胞活力(初始细胞活力为100%),结果如图所示。
下列分析不合理的是( )A. 动物细胞中,蛋白质的糖链修饰可能发生在内质网中B. 糖蛋白a 进入细胞与蛋白质b 是否变性关系不大C. 生物毒素a 对细胞活力D. a 组细胞内蛋白质的合成量与c 组的差异不大2. 核基因编码的线粒体蛋白首先在核糖体上合成前体蛋白,前体蛋白由成熟蛋白和导肽序列共同组成。
导肽含有识别线粒体的信息,同时也具有牵引蛋白质靠近线粒体外膜与内膜间形成的接触点,并通过相应的通道进入线粒体基质的功能。
已知线粒体基质带负电荷。
下列叙述错误的是( )A. 导肽分子含有决定蛋白质去向的信息B. 导肽序列中的部分氨基酸可能带正电荷C. 细胞核也参与线粒体相关生命活动的控制D. 前体蛋白的加工需内质网和高尔基体参与3. 细胞膜H +-ATP 酶(PMA)是植物体内一类重要的质子泵,也是一种极其关键的转运蛋白。
PMA 通过消耗ATP 将细胞质中的H +排出,为养分离子的跨膜转运,以及有机酸和生物硝化抑制剂等物质的分泌提供细胞膜电位和质子驱动力。
PMA 通过维持细胞膜电位和细胞pH 的平衡,在植物根系生长,以及土壤中氮、磷、钾等营养成分的活化与吸收中发挥作用。
下列叙述不正确的是( )A. PMA 转运H +的方式属于主动运输B. PMA 活性受限制后会加重土壤酸化C. 蛋白质变性剂会影响细胞对离子的吸收D. PMA基因的表达会受环境因素的影响的4. 玉米等C4植物对空气中二氧化碳的浓度要求比较低,这主要与玉米的光合作用方式有关。
谷氨酸脱氢酶(GDH)活性检测试剂盒说明书__紫外分光光度法UPLC-MS-4442

4谷氨酸脱氢酶(GDH )活性检测试剂盒说明书货号:UPLC-MS-4442规格:50T/48S紫外分光光度法产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系工作人员。
试剂名称规格保存条件提取液液体60mL×1瓶4℃保存试剂一液体60mL×1瓶4℃保存试剂二粉剂×1瓶-20℃保存溶液的配制:工作液的配制:临用前将试剂一加入试剂二中混合溶解,置于37℃(哺乳动物)或25℃(其它物种)水浴5min 。
产品说明:GDH (EC 1.4.1.2)广泛分布于植物中,和谷氨酸合成酶(GOGAT )共同参与谷氨酸的合成,在氨同化和转化成有机氮化合物的代谢中起重要作用。
GDH 催化NH +、α-酮戊二酸和NADH ,生成谷氨酸和NAD +,引起340nm 吸光度下降。
通过测定340nm 吸光度的下降速率,计算GDH 活性。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:紫外分光光度计、台式离心机、水浴锅、移液器、1mL 石英比色皿、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1、收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入1mL 提取液,超声波破碎细菌或细胞(功率20%,超声3秒,间隔10秒,重复30次);8000g 4℃离心10分钟,取上清,置冰上待测。
2、称取约0.1g 组织,加入1mL 提取液进行冰浴匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。
二、测定步骤1.紫外分光光度计预热30min 以上,调节波长至340nm ,蒸馏水调零。
2.样本测定:取1mL 工作液和0.05mL 样本于光径为1cm 的1mL 石英比色皿中,混匀,加样本的同时开始计时,在340nm 波长下记录20秒时的初始吸光度A1和5分20秒时的吸光度A2,计算ΔA=A1-A2。
人甘油醛-3-磷酸脱氢酶(GAPDH)ELISA 试剂盒 使用说明书

人甘油醛-3-磷酸脱氢酶(GAPDH)ELISA试剂盒使用说明书产品编号:D711286包装规格:48 TESTS / 96 TESTS声明:使用前仔细阅读本说明书。
只能用于研究用途,不得用于医学诊断。
用途用于人血清、血浆或其他相关生物液体中甘油醛-3-磷酸脱氢酶的测定。
工作原理本试剂盒采用的是双抗夹心酶联免疫吸附检测技术(ELISA)。
测定样品中人甘油醛-3-磷酸脱氢酶水平。
向预先包被了抗人甘油醛-3-磷酸脱氢酶抗体的酶标孔中,加入标准品和样本,温育后,加入生物素标记的抗甘油醛-3-磷酸脱氢酶抗体。
再与HRP标记的链霉亲和素结合,形成免疫复合物,再经过温育和洗涤,去除未结合的酶,然后加入显色底物TMB,产生蓝色,并在酸的作用下转化成最终的黄色。
最后,在450 nm处测定反应孔样品吸光度(OD)值,样本中的人甘油醛-3-磷酸脱氢酶浓度与OD值成正比,通过绘制标准曲线计算出样本中人甘油醛-3-磷酸脱氢酶的浓度。
1 / 262 / 26原理图:试剂盒组成说明书1份1份封板膜5片5片预包被酶标板8孔X 6条8孔X 12条-20°C 标准品1瓶2瓶-20°C 标准品/样本稀释液SD120 mL X 1瓶20 mL X 1瓶2-8°C 浓缩生物素标记甘油醛-3-磷酸脱氢酶抗体(100X )60 μl120 μl-20°C生物素标记抗体稀释液SD214 mL X 1瓶14 mL X 1瓶2-8°C浓缩HRP 标记链霉亲和素(100X )60 μl120 μl-20°C (避光)HRP标记链霉亲和素稀释液SD314 mL X 1瓶14 mL X 1瓶2-8°C显色剂10 mL X 1瓶10 mL X 1瓶2-8°C (避光)终止液10 mL X 1瓶10 mL X 1瓶2-8°C浓缩洗涤液(25×)30 mL X 1瓶30 mL X 1瓶2-8°C需要而未提供的试剂和器材1.37°C恒温箱2.酶标仪(450 nm波长滤光片)3.精密移液器及一次性吸头4.去离子水或蒸馏水5.一次性试管6.洗板机或洗瓶,吸水纸注意事项1.试剂盒应在有效期内使用,请不要使用过期的试剂。
甘油醛-3-磷酸脱氢酶

甘油醛-3-磷酸脱氢酶乙二醇基-3-磷酸脱氢酶(glycerol-3-phosphate dehydrogenase,简称GPDH)是一种半胱氨酸腺嘌呤双加氧酶,它可以完成乙二醇-3-磷酸(glycerol-3-phosphate,简称G3P)和NAD+的氧化还原反应。
GPDH的氧化剂是NAD+,而被氧化反应物是G3P。
在泛素化过程中,GPDH还能够氧化G3P和NAD+合成二磷酸核糖腺嘌呤(DPGA)和NADH,换句话说,GPDH可以将G3P转换成DPGA。
GPDH是一种非常重要的酶,在多种生物体中都有所表现,它以各种形式存在于植物、动物和微生物的细胞中。
GPDH在细胞的代谢中发挥着重要作用,它可以调节氧化还原反应,从而维持细胞中能量的稳定性和正常的生物学功能;GPDH还可以通过DPGA的合成为糖异构酶(glycogen synthase)提供氮源,促进糖原的合成。
GPDH的结构丰富多变,有线粒体内GPDH、植物细胞质GPDH、植物细胞膜GPDH以及动物细胞膜GPDH等。
它们均为高度保守的多重位点型蛋白质,其分子大小均为50-60 kDa,分子量可以达到两万多。
GPDH可以经过典型性结构变换来完成其活性过程,这些结构变换通常由酶本身和周围环境(如pH值、温度、活性离子浓度)之间的相互作用来构建。
GPDH的活性是高度可调的,主要受周围环境中的酸碱度和温度影响,它可以在低温条件下(约4℃)保持其基本功能,在常温条件下(约37℃)保存最佳的活性。
通常情况下,pH值介于5.5-7.5之间都能够支持GPDH的最佳活性。
GPDH在活性过程中是特异性的,可以有效催化乙二醇-3-磷酸和NAD+之间的反应,但是它对于其他类似结构的供体或受体(如乙二醇-1-磷酸、乙二醇和NADP+)的作用很少。
GPDH的应用范围很广,它可以用来研究细胞的能量代谢以及糖原的合成和分解,也可以用来诊断肝病、心脏病和其他器官疾病,还可以用来建立发酵工艺,例如研究乳酸发酵,可用GPDH来检测活性乙二醇-3-磷酸和乙醇的代谢表达。
GAPDH
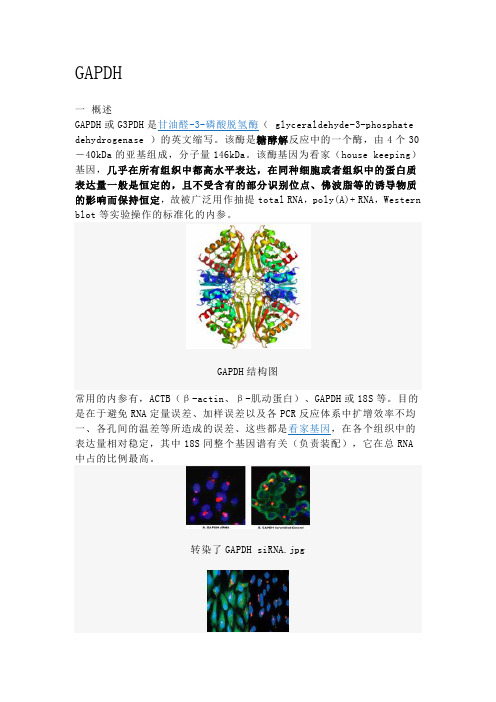
GAPDH一概述GAPDH或G3PDH是甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase )的英文缩写。
该酶是糖酵解反应中的一个酶,由4个30-40kDa的亚基组成,分子量146kDa。
该酶基因为看家(house keeping)基因,几乎在所有组织中都高水平表达,在同种细胞或者组织中的蛋白质表达量一般是恒定的,且不受含有的部分识别位点、佛波脂等的诱导物质的影响而保持恒定,故被广泛用作抽提total RNA,poly(A)+ RNA,Western blot等实验操作的标准化的内参。
GAPDH结构图常用的内参有,ACTB(β-actin、β-肌动蛋白)、GAPDH或18S等。
目的是在于避免RNA定量误差、加样误差以及各PCR反应体系中扩增效率不均一、各孔间的温差等所造成的误差、这些都是看家基因,在各个组织中的表达量相对稳定,其中18S同整个基因谱有关(负责装配),它在总RNA中占的比例最高。
转染了GAPDH siRNA.jpg转染了GAPDH siRNA的Hela细胞转染了GAPDH相关siRNA的HeLa细胞在转染后48小时后不断增殖。
红:被标记的siRNA;蓝:被染色的细胞核;绿色:GAPDH蛋白;(这些siRNA 锐博生物均可提供)阴性对照(scrambled siRNA)的导入(左)对GAPDH蛋白的表达没有影响,不过若转入一个以GAPDH(右)为靶标的siRNA,则会导致GAPDH蛋白表达水平的急剧下降。
二GAPDF作为内参GAPDH(甘油醛-3-磷酸脱氢酶)是参与糖酵解的一种关键酶,由4个30-40kDa的亚基组成,分子量146kDa,检测条带大约在36kDa。
GAPDH基因几乎在所有组织中都高水平表达,广泛用作Western blot蛋白质标准化的内参。
因为GAPDH 作为看家基因在同种细胞或者组织中的蛋白质表达量一般是恒定的,因此在使用GAPDH内参抗体时,将每个样品测得的目的蛋白含量与本样品的GAPDH含量相除,得到每个样品目的蛋白的相对含量,然后才进行样品与样品之间的比较。
糖酵解途径中3-磷酸甘油醛脱氢酶催化

糖酵解途径中3-磷酸甘油醛脱氢酶催化
糖酵解是一个非常重要的生化途径,它能够将葡萄糖等糖类分子转化为能量和有机物质。
该途径中的3-磷酸甘油醛脱氢酶(GAPDH)是一个重要的催化酶,它能够催化3-磷酸甘油醛与NAD+之间的氧化还原反应,从而生成1,3-二磷酸甘油和NADH。
GAPDH是一个由四个亚基组成的四聚体,每个亚基都含有一个催化位点。
该酶的催化作用可以分为三个步骤:底物结合、催化反应和产物释放。
在底物结合步骤中,3-磷酸甘油醛首先与GAPDH的活性位点结合,形成一个中间复合物。
该步骤是一个不可逆过程,越高的底物浓度会增加复合物的形成速率。
在催化反应步骤中,3-磷酸甘油醛与亚基中的催化位点发生氧化还原反应,将3-磷酸甘油醛氧化为1,3-二磷酸甘油。
该反应需要一个还原剂,而NAD+正好是这个还原剂。
GAPDH将NAD+还原为NADH,同时将3-磷酸甘油醛氧化为1,3-二磷酸甘油。
这个步骤是一个可逆过程,但是反应向前的趋势非常强。
在产物释放步骤中,1,3-二磷酸甘油脱离催化位点,转化为GAPDH上的另一个位点。
同时,NADH也释放出来,但是它还会停留在GAPDH附近的NADH位点上。
3-磷酸甘油醛脱氢酶(GAPDH)活性检测试剂盒说明书 紫外分光光度法

3-磷酸甘油醛脱氢酶(GAPDH)活性检测试剂盒说明书紫外分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC2210规格:25T/24S50T/48S产品内容:提取液:30mL×1瓶,4℃保存;试剂一:粉剂×1瓶,-20℃保存;试剂二:液体25mL×1瓶,4℃保存;试剂三:液体15µL×1支,4℃保存;临用前加入0.5mL蒸馏水充分混匀,或根据比例现配现用;用不完的试剂4℃保存一周。
产品说明:GAPDH(EC1.2.1.12)催化3-磷酸甘油醛氧化生成1,3-二磷酸甘油酸,是糖酵解途径的关键酶,与糖异生途径、体内血糖浓度的维持和糖尿病的发生密切相关,在机体糖、脂、蛋白代谢紊乱疾病中发挥重要作用。
3-磷酸甘油酸激酶催化三磷酸甘油酸和ATP生成1,3二磷酸甘油酸。
GAPDH逆向催化1,3二磷酸甘油酸和NADH生成3-磷酸甘油醛、无机磷和NAD+,340nm处测定NADH的减少量可反映GAPDH活性的高低。
试验中所需的仪器和试剂:紫外分光光度计、低温离心机、水浴锅、1mL石英比色皿、可调式移液枪、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、粗酶液提取:组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液)进行冰浴匀浆,然后8000g,4℃,离心20min,取上清,置冰上待测。
细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g4℃离心10min,取上清,置冰上待测。
血清(浆):直接检测。
二、测定步骤:1、分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
高级生物化学 实验报告

小鼠GAPDH基因的克隆、表达与鉴定学号学生姓名指导教师2016年4月12日摘要甘油醛-3-磷酸脱氢酶(glyceraldehyde-3·phosphate dehydrogenase,GAPDH)是一种分布在细胞质中、在糖酵解过程中起关键作用的酶。
但是近年来,越来越多的研究表明GAPDH 是一种多功能蛋白,参与tRNA出核、mRNA稳定性调节、DNA损伤修复、组蛋白转录调控、凋亡及神经退行性疾病发生等。
在细胞质和生物膜上也有重要作用。
本文主要介绍利用基因工程实验技术操作GAPDH基因,采用Trizol 法从小鼠肝脏组织中提取总RNA,并运用RT-PCR 方法克隆了GAPDH基因,连接到pET28a载体上, 并导入感受态的DH5α与BL21菌中筛选鉴定。
选取鉴定正确的转化BL21克隆诱导表达GAPDH蛋白质,用SDS-PAGE和Western Blot 鉴定。
关键词: 甘油醛-3-磷酸脱氢酶(GAPDH);基因表达; 载体;RT- PCR。
绪论甘油醛-3-磷酸脱氢酶(glyceraldehyde-3·phosphate dehydrogenase,GAPDH)是参与糖酵解的一种关键酶,催化3-磷酸甘油醛转变为l,3.二磷酸甘油醛,同时以NAD+为受氢体生成NADH。
由4个30-40kDa的亚基组成,分子量146kDa,检测条带大约在36kDa。
该酶基因为管家(house keeping)基因,几乎在所有组织中都高水平表达,在同种细胞或者组织中的蛋白质表达量一般是恒定的,且不受含有的部分识别位点、佛波脂等的诱导物质的影响而保持恒定,故被广泛用作抽提total RNA,poly(A)+ RNA,Western blot等实验操作的标准化的内参。
近年来,研究发现GAPDH在细胞质、细胞核及细胞膜上均有定位,其表达量在转录及转录后水平受到调节,mRNA水平和蛋白水平会随着各种刺激而变化。
3-磷酸甘油醛脱氢酶

3-磷酸甘油醛脱氢酶3-磷酸甘油醛脱氢酶(Glycerol-3-phosphate Dehydrogenase,或GPDH)是一种醛脱氢酶,它负责将3-磷酸甘油(Glycerol-3-phosphate,或G3P)分解成甘油二酸(Dihydroxyacetone phosphate,或DHAP)和质子(H+)。
该酶加氢反应中,G3P通过增加两个氢原子而转化为DHAP,同时生成氢阴离子。
同时,反应也向前发展,以相应的速率。
GPDH属于拟烷酸类的酶,这类酶在体内发挥重要作用。
它能够从血液流经的每一毫米里产生1.4毫伏特的电势,这是保证肌肉正常运动和完成其他机械任务所必需的。
GPDH是血液中最有效的酶之一,也是合成氧化物,乳酸,乙酰基转移酶,2-羟基乙酰辅酶A -- 甘油3-磷酸反应的一部分 -- 等的中间体。
GPDH可以在人体的大多数组织中发现,尤其集中在肝脏、心脏、肾脏和肌肉组织中。
该酶的水平受抗炎因素的影响,可能因肝脏疾病、心脏病和Lipopolysaccharide诱导性炎症而降低。
GPDH也可以用于诊断Lipopolysaccharide引起的炎症,可以将血液样本中的GPDH浓度用于监测其水平变化。
GPDH还可以作为调节血糖水平的中间体。
GPDH有助于血液中的葡萄糖水平,可以通过提高血液中 DHAP 和减少 G3P 的水平来调节含量。
此外,与G3P和DHAP的磷酸基可以通过GPDH分解成二磷酸,从而调节体内的磷酸盐水平。
总之,3-磷酸甘油醛脱氢酶是一种重要的调节醛解反应的醛脱氢酶。
它能够调节血液中的葡萄糖含量,以及体内的磷酸含量。
此外,它还可以用于诊断Lipopolysaccharide诱导性炎症,以及控制肌肉运动。
甘油三酯试剂盒(GPO-PAP法)标准化操作规程TG-SOP

甘油三酯试剂盒(GPO-PAP 法)标准化操作规程1 目的规范实验室操作,保证检验工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过的实验室检验人员。
3 适用范围试剂适用于体外定量检测人血清或血浆中甘油三酯的浓度。
4 检验方法本试剂盒采用氧化酶法测定甘油三酯的浓度。
5 检验原理样品中的甘油三酯在试剂中脂蛋白脂酶(LPL)的催化下水解成甘油和游离脂肪酸,在甘油激酶(GK)和三磷酸腺苷(ATP)的作用下生成的甘油被磷酸化,形成3-磷酸甘油,并经试剂中磷酸甘油氧化酶(GPO)的作用与氧产生过氧化氢和磷酸二羟丙酮,过氧化氢在过氧化物酶(POD)的催化下与苯胺类色原物质和4-氨基安替比林作用产生水和醌亚胺色素,醌亚胺色素的生成量与样品中甘油三酯的含量成正比,通过测定特定波长处反应最终生成的色素量,可以计算出样品中甘油三酯的浓度。
甘油三酯 + H 2O 甘油 + 游离脂肪酸甘油 + ATP 3-磷酸甘油 + ADP3-磷酸甘油 + O 2 GPO 磷酸二羟丙酮 + H 2O 2H 2O 2+ 4-氨基安替比林 + 苯胺类色原物质 POD 醌亚胺色素 + 水6 标本要求6.1样本为血清或血浆。
样本应在禁食10~14小时后采取,不应溶血。
采血管应避免使用甘油成分润滑的物品。
6.2血清分离后,请于当日测定,如当日不能完成测定,样本在2℃~8℃可稳定3天、-20℃可稳定数周。
6.3请勿在室温保存样本,以免引起测定值偏高。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司甘油三酯试剂盒(氧化酶法) 7.2试剂组成试剂盒组成 主要组成成份 浓度/范围 试剂1(R1)缓冲液100mmol/LLPL2Mg G K脂蛋白脂酶 ≥1250 U/L 甘油激酶 ≥1250 U/L硫酸镁 12.5mmol/L 三磷酸腺苷 0.70mmol/L EDTA 10mmol/LTOOS 1.875mmol/L 甘油磷酸氧化酶 ≥5000 U/L试剂2(R2)缓冲液 100mmol/LEDTA 10mmol/L 过氧化物酶 ≥750U/L 4-氨基安替比林 2.0mmol/L7.3试剂的稳定性与贮存:7.3.1试剂在2˚C~8˚C条件下,干燥、避光、密封贮存,有效期18个月。
植酸酶活性检测试剂盒说明书 微量法

植酸酶活性检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC3145规格:100T/48S产品内容:提取液:液体100mL×1瓶,4℃保存。
缓冲液:液体10mL×1瓶,4℃保存。
试剂一:粉剂×2支,4℃保存,临用前加缓冲液4mL配制,现用现配。
试剂二:液体10mL×1瓶,4℃保存。
试剂三:液体10mL×1瓶,4℃保存。
显色剂:粉剂×6瓶,4℃保存,临用前根据用量每瓶加0.4mL双蒸水溶解,再加1.6mL试剂三混匀。
样本处理产品说明:植酸酶(phytase)是催化植酸及其盐类水解为肌醇与磷酸(盐)的一类酶的总称,属磷酸单酯水解酶,它能将食品和饲料中植酸及其盐转化为可供有机体利用的有效磷,降低粪便中的磷含量,减轻对环境的污染,改善营养成分的吸收和利用,因此具有极其广泛的研究和应用价值。
测定原理植酸酶在一定温度和pH值条件下,水解底物植酸钠生成无机磷与肌醇衍生物,无机磷在酸性环境中与钼酸铵显色剂反应生成蓝色复合物,在700nm处有特征吸收峰,根据700nm处吸光值变化可计算得植酸酶活性。
自备实验用品及仪器天平、低温离心机、可见分光光度计/酶标仪、微量石英比色皿/96孔板、恒温水浴锅,超声溶解器,回旋式振荡器。
操作步骤:1.酶制剂:按照质量(g):提取液体积(mL)为1:500~1000的比例(建议称取约0.001g,加入1mL提取液)第1页,共4页加入提取液,在超声波溶解器上溶解15min,再用回旋式振荡器振荡15min,待测。
2.组织:按照质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)加入提取液,在超声波溶解器上溶解15min,再用回旋式振荡器振荡15min,4℃,4000g离心10min,取上清待测。
3.饲料样品:饲料烘干粉碎,过40目筛,按照质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)加入提取液,在超声波溶解器上溶解15min,再用回旋式振荡器振荡15min,4℃,4000g离心10min,取上清待测。
GAPDH抗体说明书

GAPDH抗体说明书注意:本说明书提供关于GAPDH抗体的相关信息,包括抗体的来源、性能、应用等。
请在使用前仔细阅读本文档,并按照说明进行实验操作。
如有任何疑问,请咨询我们的技术支持团队。
1. 抗体来源本抗体由优质小鼠单克隆抗体产生,经过多次和GAPDH蛋白免疫去正常反应并经ELISA、WB等方法筛选获得。
2. 抗体性能2.1 特异性GAPDH抗体具有良好的特异性,仅与目标蛋白GAPDH结合,不与其他蛋白发生交叉反应。
经过多次验证,本抗体在多种物种中展现出高度的特异性。
2.2 敏感性本抗体具有较高的敏感性,可以在低浓度目标蛋白的条件下检测到GAPDH的表达。
2.3 稳定性本抗体经过特殊处理,具有较好的稳定性。
久贮存后,抗体的免疫活性仍然能够保持较高水平。
3. 抗体应用3.1 免疫检测GAPDH抗体可用于WB(Western Blot)、IP(免疫沉淀)、IHC (免疫组化)、IF(免疫荧光)等实验技术中。
3.2 WB应用以下为WB实验操作步骤:a) 准备样品:将待检测的蛋白组织或细胞裂解,制备总蛋白提取液。
b) SDS-PAGE分离:将总蛋白提取液通过SDS-PAGE电泳分离。
c) 转膜:将分离得到的蛋白转移到聚丙烯酰胺膜上。
d) 阻断:用5%脱脂奶粉或3%BSA在室温下阻断非特异性结合位点。
e) 一抗孵育:添加稀释后的GAPDH抗体,于室温下孵育2小时或过夜。
f) 洗涤:用PBS-T洗涤膜上未与抗体结合的蛋白。
g) 二抗孵育:添加辣根过氧化物酶标记的抗小鼠二抗,于室温下孵育1小时。
h) 洗涤:用PBS-T洗涤膜上未与二抗结合的抗体。
i) 显色:加入ECL显色剂进行显色,观察目标蛋白是否有特异性表达。
4. 注意事项4.1 使用前请确保本抗体处于稳定的状态,并按照规定的方法进行保存和操作。
4.2 本抗体仅供科学研究使用,不可用于临床诊断。
4.3 不同实验条件下可能需要进行抗体的适应性优化,建议用户根据实际情况进行试验操作。
3磷酸甘油醛脱氢酶糖无氧氧化

3磷酸甘油醛脱氢酶糖无氧氧化(最新版)目录1.3-磷酸甘油醛脱氢酶简介2.糖无氧氧化过程3.3-磷酸甘油醛脱氢酶在糖无氧氧化中的作用4.3-磷酸甘油醛脱氢酶的应用5.结论正文3-磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,简称 GAPDH)是一种参与糖酵解途径的酶,主要作用是在细胞溶酶体内进行氧化还原反应。
糖无氧氧化是一种在无氧条件下将葡萄糖分解为乳酸或酒精和二氧化碳的过程,这一过程在生物体内有着重要的生理意义。
本文将从 3-磷酸甘油醛脱氢酶的角度,探讨糖无氧氧化的过程及其应用。
在糖无氧氧化过程中,葡萄糖首先被磷酸化为葡萄糖 -6-磷酸(G6P),然后转化为果糖 -6-磷酸(F6P),接着果糖 -1,6-双磷酸(F1,6BP)产生,这个过程需要消耗一个 ATP 分子。
随后,F1,6BP 裂解为两个三磷酸甘油醛(3-phosphoglyceraldehyde,3-PGAL),此时 3-磷酸甘油醛脱氢酶发挥作用,将一个 3-PGAL 转化为磷酸二羟基丙酮酸(DHAP),同时产生一个 ATP 分子。
然后,DHAP 通过一系列反应转化为丙酮酸,最后生成乳酸或酒精和二氧化碳。
3-磷酸甘油醛脱氢酶在糖无氧氧化过程中起到了关键作用,它将一个不稳定的化合物 3-PGAL 转化为稳定的 DHAP,同时产生一个 ATP 分子,为细胞提供了能量。
此外,3-磷酸甘油醛脱氢酶还有其他功能,例如参与氧化应激反应、调控细胞生长等。
3-磷酸甘油醛脱氢酶在生物体内有着广泛的应用。
首先,由于其在糖无氧氧化过程中的关键作用,3-磷酸甘油醛脱氢酶可以作为研究糖酵解途径的重要靶点。
其次,3-磷酸甘油醛脱氢酶的活性可以作为评估细胞状态的指标,例如在缺氧、氧化应激等条件下,3-磷酸甘油醛脱氢酶的活性会发生变化。
最后,3-磷酸甘油醛脱氢酶还可以应用于生物医学领域,例如在肿瘤诊断、评估治疗效果等方面有着潜在的应用价值。
3-磷酸甘油醛脱氢酶km值

3-磷酸甘油醛脱氢酶km值3-磷酸甘油醛脱氢酶(3-phosphoglyceraldehyde dehydrogenase,简称PGAPDH)是嗜热菌中的一种重要酶类。
它在三磷酸甘油醛(3-phosphoglyceraldehyde)的代谢途径中扮演着关键角色。
本文将以PGAPDH的Km值为主题,探讨其在酶催化反应中的重要性。
Km值是一个重要的酶动力学参数,用于描述底物与酶结合的亲和力。
Km值越小,酶与底物结合的亲和力越大,代表酶对底物的亲和力强;反之,Km值越大,酶与底物结合的亲和力越弱。
因此,Km值可以反映酶对底物的亲和性及底物浓度对酶活性的影响。
对于PGAPDH来说,其Km值与底物3-磷酸甘油醛的浓度相关。
当底物浓度低于Km值时,酶与底物的结合较弱,酶活性较低;而当底物浓度高于Km值时,酶与底物的结合较强,酶活性较高。
因此,Km 值可以反映PGAPDH在不同底物浓度下的活性变化。
Km值的测定通常是通过酶动力学实验来完成。
在实验中,可以固定酶的浓度,逐渐增加底物的浓度,然后测定反应速率。
将底物浓度作为横坐标,反应速率作为纵坐标,绘制酶动力学曲线。
曲线上的Km值即为半饱和底物浓度。
PGAPDH的Km值对于细胞内代谢途径和能量产生过程至关重要。
在嗜热菌中,PGAPDH参与糖酵解途径中糖分解的关键步骤。
在这一过程中,3-磷酸甘油醛通过PGAPDH的催化作用转化为1,3-二磷酸甘油(1,3-bisphosphoglycerate),并继续参与ATP的产生。
由于PGAPDH的活性与底物浓度密切相关,Km值的大小直接影响糖酵解途径的速率和能量产生效率。
值得注意的是,不同嗜热菌中PGAPDH的Km值可能存在差异。
这可能是由于嗜热菌栖息环境的差异导致PGAPDH在进化过程中发生了适应性变化。
不同的Km值可能使不同嗜热菌在不同环境条件下具有更高的适应性。
因此,研究不同嗜热菌中PGAPDH的Km值对于深入了解嗜热菌的代谢途径和适应性具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3-磷酸甘油醛脱氢酶(GAPDH)活性检测试剂盒说明书微量法
注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC2215
规格:100T/96S
产品内容:
提取液:液体100mL×1瓶,4℃保存。
试剂一:粉剂×1瓶,-20℃保存。
试剂二:液体20mL×1瓶,4℃保存。
试剂三:液体12uL×1支,4℃保存。
临用前加入0.4mL蒸馏水充分混匀,或根据比例现配现用;用不完的试剂4℃保存一周。
产品说明:
GAPDH(EC1.2.1.12)催化3-磷酸甘油醛氧化生成1,3-二磷酸甘油酸,是糖酵解途径的关键酶,与糖异生途径、体内血糖浓度的维持和糖尿病的发生密切相关,在机体糖、脂、蛋白代谢紊乱疾病中发挥重要作用。
3-磷酸甘油酸激酶催化三磷酸甘油酸和ATP生成1,3二磷酸甘油酸。
GAPDH逆向催化1,3二磷酸甘油酸和NADH生成3磷酸甘油醛、无机磷和NAD+,340nm处测定NADH的减少量可反映GAPDH活性的高低。
试验中所需的仪器和试剂:
紫外分光光度计/酶标仪、低温离心机、水浴锅、微量石英比色皿/96孔UV板、可调式移液枪、研钵/匀浆器、冰和蒸馏水。
操作步骤:
一、粗酶液提取:
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液)进行冰浴匀浆,然后,8000g,4℃,离心20min,取上清,置冰上待测。
细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g4℃离心10min,取上清,置冰上待测。
血清(浆):直接检测。
二、测定步骤:
1、分光光度计/酶标仪预热30min以上,调节波长至340nm,分光光度计蒸馏水调零。
2、工作液的配制:将试剂二全部倒入试剂一瓶中,充分溶解,根据需要取一定的量置于37℃(哺乳动物)
或25℃(其它物种)预热10min;用不完的试剂分装后-20℃保存,禁止反复冻融。
3、操作表:在微量石英比色皿或96孔板中分别加入下列试剂:
试剂名称空白管测定管
样本(µL)6
蒸馏水(µL)6
试剂三(µL)44
试剂五(µL)190190在微量石英比色皿/96孔UV板中分别加入上述试剂,充分混匀后于340nm处测定10s时的吸光值
A1,迅速置于37℃(哺乳动物)或25℃(其他物种)水浴或培养箱5min(酶标仪有控温功能可将温度调至37℃或25℃),拿出迅速擦干测定5min10s时的吸光值A2,计算△A测定管=A2测定-A1测定,△A空白管=A2空白-A1空白,△A=△A测定管-△A空白管。
空白管只需做一次。
三、GAPDH酶活计算:
1、按微量石英比色皿计算:
(1)按蛋白浓度计算
酶活定义:每mg组织蛋白每分钟消耗1nmol的NADH定义为一个酶活力单位。
GAPDH酶活(U/mg prot)=△A÷(ε×d)×109×V反总÷(V样×Cpr)÷T
=1072×△A÷Cpr
(2)按样本质量计算
酶活定义:每g组织每分钟消耗1nmol的NADH定义为一个酶活力单位。
GAPDH酶活(U/g鲜重)=△A÷(ε×d)×109×V反总÷(V样×W÷V样总)÷T
=1072×△A÷W
(3)按照细菌或细胞数量计算
酶活定义:每104个细菌或细胞每分钟消耗1nmol的NADH定义为一个酶活力单位。
GAPDH酶活(U/104cell)=△A÷(ε×d)×109×V反总÷(500×V样÷V样总)÷T
= 2.14×△A÷细胞数量
(4)按液体体积计算
酶活定义:每mL样本每分钟每分钟消耗1nmol的NADH定义为一个酶活力单位。
GAPDH酶活(nmol/min/mL)=△A÷(ε×d)×109×V反总÷V样÷T
=1072×△A
ε:NADH微摩尔消光系数,6.22×103L/mol/cm;d:比色皿光径,1cm;V反总:反应体系总体积,0.0002L;V样:反应体系中样本体积,0.006mL;V样总:加入提取液体积,1mL;Cpr:样本蛋白浓度,mg/mL,蛋白浓度需自行测定;W:样本质量,g,T:反应时间:5min;500:细菌或细胞总数,500万。
2、按96孔UV板计算:
将上述公式中的d-1cm改为d-0.6cm(96孔板光径)进行计算即可。
注意事项:
1、当A1小于0.8或△A大于0.7时(96孔板为A1小于0.4或△A大于0.4),建议将样品稀释后再进行测
定。
2、空白管为检测各试剂组分质量的检测孔,正常情况下,变化不超过0.02。
