无机化学课件--硼族
合集下载
无机化学-第六章-硼族元素

作润滑剂 (3) 立方晶型(类似于金刚石)
1
3
4
2
5
6
9
8
10
7
11
12
23-мар-22
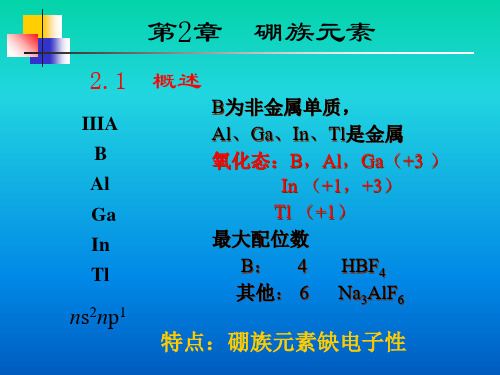
无机化学
硼的化学性质
晶体硼较惰性
(1)无定形硼较活泼,高温下能与N2、O2、 S、X2发 生反应,显还原性。
R.T. 973K
2B(s) + 3F2(g) ══ 2BF3 4B(s) + 3O2(g) ══ 2B2O3
B-O Si-O C-O 键能/kJ·mol-1 560-690 > 452 > 358
CuBO2
红
Cu(BO2)2
蓝
Fe(BO2)2
绿
Fe(BO2)3
棕
23-мар-22
无机化学
(1) BX3结构:
硼的卤化物
B:sp2杂化
(2) BX3性质:
BF3
室温下 聚集态
g
熔点/( /℃) -127.1
沸点/( /℃) -100.4
23-мар-22
BCl3 g
-107 12.7
BBr3
BI3
23-мар-22
无机化学
硼的制备 ➢ -菱形硼 12 BI3 = B12(s) + 18 I2(g) ➢无定形硼 Na2B4O7·10H2O+ 2HCl=4H3BO3+ 2NaCl+ 5H2O 2H3BO3 = B2O3 + 3H2O (800K) B2O3 + Mg = 3MgO + 2B (800K)
结构: B:sp2杂化
硼酸 H3BO3
引 导 语 : 心得 体会是 指一种 读书、 实践后 所写的 感受性 文字。 语言类 读书心 得 同 数 学 札 记相近 ;体会 是指将 学习的 东西运 用到实 践中去 。下面 是小编 为你带 来 的 医 生 的 岗前培 训心得 体会, 希望对 你有所 帮助。 从 那 天 起 ,我们 开始了 胸 科 医 院 的 培训, 前三天 的课程 让我懂 得了很 多以前 在书上 学不到 的东西 ,有院 领 导 的 亲 身 经历和 他们的 所见所 闻,对 医院的 故障制 度有了 一定认 识。这 次培训 中 我 学 到 了 很多知 识,但 感触最 深的是 每一位 领导基 本上都 提到一 个要求 ,那就 是 学 习 、 学 习、再 学习。 一刻也 不能放 松,不 仅要钻 研本专 业的知 识,还 要了解 其 他 专 业 的 知识, 比如说 我自己 ,就应 该多了 解医学 影像诊 断及技 术等方 面的知 识 ,这样 有利于 我提高 工作效 率与质 量。此 外,就 是希望 能尽快 地进入 工作状 态, 做 好 思 想 意 识的转 变,从 受者转 变成施 者。我 认为我 在这方 面做得 也比较 到位, 经 过 学 习 和 互动, 感觉现 在也慢 慢走上 正轨了 ,希望 我们能 脚踏实 地的工 作,养 成 良 好 的 工 作与生 活习惯 ,为自 己积累 资本、 为医院 创造价 值。 通 过 第 四和 第 五 天 的 培 训我明 白了什 么是沟 通,沟 通就是 人们在 互动过 程中通 过某种 途径将 一 定 的 信 息 从发送 者传递 给接收 者,并 获得理 解的过 程,双 方互动 的过程 。我们
1
3
4
2
5
6
9
8
10
7
11
12
23-мар-22
无机化学
硼的化学性质
晶体硼较惰性
(1)无定形硼较活泼,高温下能与N2、O2、 S、X2发 生反应,显还原性。
R.T. 973K
2B(s) + 3F2(g) ══ 2BF3 4B(s) + 3O2(g) ══ 2B2O3
B-O Si-O C-O 键能/kJ·mol-1 560-690 > 452 > 358
CuBO2
红
Cu(BO2)2
蓝
Fe(BO2)2
绿
Fe(BO2)3
棕
23-мар-22
无机化学
(1) BX3结构:
硼的卤化物
B:sp2杂化
(2) BX3性质:
BF3
室温下 聚集态
g
熔点/( /℃) -127.1
沸点/( /℃) -100.4
23-мар-22
BCl3 g
-107 12.7
BBr3
BI3
23-мар-22
无机化学
硼的制备 ➢ -菱形硼 12 BI3 = B12(s) + 18 I2(g) ➢无定形硼 Na2B4O7·10H2O+ 2HCl=4H3BO3+ 2NaCl+ 5H2O 2H3BO3 = B2O3 + 3H2O (800K) B2O3 + Mg = 3MgO + 2B (800K)
结构: B:sp2杂化
硼酸 H3BO3
引 导 语 : 心得 体会是 指一种 读书、 实践后 所写的 感受性 文字。 语言类 读书心 得 同 数 学 札 记相近 ;体会 是指将 学习的 东西运 用到实 践中去 。下面 是小编 为你带 来 的 医 生 的 岗前培 训心得 体会, 希望对 你有所 帮助。 从 那 天 起 ,我们 开始了 胸 科 医 院 的 培训, 前三天 的课程 让我懂 得了很 多以前 在书上 学不到 的东西 ,有院 领 导 的 亲 身 经历和 他们的 所见所 闻,对 医院的 故障制 度有了 一定认 识。这 次培训 中 我 学 到 了 很多知 识,但 感触最 深的是 每一位 领导基 本上都 提到一 个要求 ,那就 是 学 习 、 学 习、再 学习。 一刻也 不能放 松,不 仅要钻 研本专 业的知 识,还 要了解 其 他 专 业 的 知识, 比如说 我自己 ,就应 该多了 解医学 影像诊 断及技 术等方 面的知 识 ,这样 有利于 我提高 工作效 率与质 量。此 外,就 是希望 能尽快 地进入 工作状 态, 做 好 思 想 意 识的转 变,从 受者转 变成施 者。我 认为我 在这方 面做得 也比较 到位, 经 过 学 习 和 互动, 感觉现 在也慢 慢走上 正轨了 ,希望 我们能 脚踏实 地的工 作,养 成 良 好 的 工 作与生 活习惯 ,为自 己积累 资本、 为医院 创造价 值。 通 过 第 四和 第 五 天 的 培 训我明 白了什 么是沟 通,沟 通就是 人们在 互动过 程中通 过某种 途径将 一 定 的 信 息 从发送 者传递 给接收 者,并 获得理 解的过 程,双 方互动 的过程 。我们
第十六章-硼族元素PPT课件

-0.34
Tl3+ 1.25 Tl+ -0.336 Tl 1.36 TlCl -0.557
Tl(OH)3 -0.05 TlOH -0.344 Tl
Tl3+的化合物具有强氧化性
Tl+.的化合物特别稳定
8
§16-2 硼及其化合物
2-1 硼在自然界的存在
——以硼酸盐的形式存在
主要矿有:
硼砂—— Na2B4O7·10H2O
27
B2H6的结构由美国化学家—— 利普斯科姆(Lipscomb,W.N.)提出:
1949年后,利普斯科姆开始对硼烷、碳硼烷及其一系列 衍生物进行系统研究。关于硼烷的结构,早在半个世纪前
曾有人做过研究,但都未能真正解释明白硼烷及其衍生物 组分的多样化结构的复杂性。
利普斯科姆利用低温X 射线衍射方法等测定了多种硼烷 结构。根据他测定的结果,硼烷分子具有代表性的结构是
BF3 + F- BF4-
B(OH)3 + OH- [B(OH)4]单质硼和B化合物中还能形成多中心键
3c-2e 键 、 sp2杂化的硼化合物中的大键。
.
11
③ 多面体习性
——晶态B和许多硼的化合物为多面体或多面体的碎片, 形似笼状或巢状等结构。 这种多面体的习性同它能形成多种类型的键有关。
巢图状16硼-3 烷-结菱形构硼的结构
中除外向B—H键以外的其它类型的化学键。
键型
所用轨道数 所用电子数 键数
B—B
2
2
y
B—H—B
3
2
s
开口B—B—B
3
2
闭合B—B—B
3
t 2
B—H
2
2
硼族元素解析PPT课件

2021年4月8日5时48分
第19页/共32页
2、金属型化合物 第IVB~VllB及Vlll族元素的碳化物均为金属型 化合物。碳原子嵌在金属原子密堆积晶格中的多面 体孔穴内。 金属型碳化物的导电性好、熔点高,有的熔点 甚至超过原来的金属。如TiC、TaC、HfC的熔点在 3400K以上(接近4000K),硬度大,热膨胀系数小, 导热性好,可作高温材料,已用作火箭的心板和火 箭用的喷嘴材料。 用20%的HfC和80%的TaC制得的合金是已知物 中熔点最高的。
2021年4月8日5时48分
第16页/共32页
硼砂同B2O3一样,在熔融状态能溶解一些金属 氧化物,并依金属的不同而显出特征的颜色(硼酸也 有此性质)。例如:
Na2B4O7+CoO=2NaBO2·Co(BO2)2(蓝宝石色) 因此,在分析化学中可以用硼砂来作“硼砂珠 试验”,鉴定金属离子。在搪瓷等工业(上釉、着色) 和焊接金属(去氧化物)。硼砂还可以代替B2O3用于制 特种光学玻璃和人造宝石。
氢,其中的BO3结构单元开始通过氧原子,以B-O-B键形成链状
的根或为RO环偏状硼OB的 酸HO多骨-硼架酸。O根加,热B O其到-组57成8KOR可时用变B实为O验-B2式OO(3B,熔OO融BR2)HnO的n-,-B可2O知- O3多可-硼溶B酸解O2 许HHO出多H质CCR金子硼属OOOB,酸氧HHHO而是化+O物H是一+-B3,B由元OO用O-H于弱3 于H硼酸O制的,备HHB缺K耐OaCCR高电=- 温子6OO×的O性1O有0B,-H色B10它。O硼OO-加玻它OBCCR璃合H的O。了酸HHO来B性H+O自H不-+H+是+32OHHO给2+O
2021年4月8日5时48分
无机化学教学13章硼族元素PPT课件

镓的氧化物
镓的氧化物包括Ga₂O₃和GaO,它们具有高熔点和稳定性,可用于制备其他镓的化合物。镓的氧化物可以 由金属镓与氧气反应得到。
镓的硫化物和硒化物
镓的硫化物
镓的硫化物包括Ga₂S₃和GaS,它们具有较高的硬度、熔点和导电性。镓的硫化物可以 由金属镓与硫反应得到。
镓的硒化物
镓的硒化物包括Ga₂Se₃和GaSe,它们具有与硫化物类似的性质,如高熔点和导电性。 镓的硒化物可以由金属镓与硒反应得到。
有机镓化合物
有机镓酸酯
有机镓酸酯是一类重要的有机化合物, 它们可以通过酯交换反应制备。有机镓 酸酯在聚合反应中用作催化剂和添加剂 。
VS
其他有机镓化合物
除了有机镓酸酯外,还有许多其他有机镓 化合物,如有机镓醇、有机镓酸盐等。这 些化合物在医药、材料科学和催化等领域 有广泛的应用。
06 铟的化合物
铟的卤化物和氧化物
铟的卤化物
铟与卤素(如氟、氯、溴、碘)反应,生成 相应的卤化物。这些卤化物具有较高的熔点 和沸点,在常温下多为固态。
铟的氧化物
铟与氧气反应,可以生成多种氧化物,如 In2O3和In2O。这些氧化物具有不同的性 质和应用,例如In2O3是一种半导体材料, 可用于制备透明导电膜。
铟的硫化物和硒化物
无机化学的重要性
无机化学在化学学科中占据重要地位 ,是学习其他化学课程的基础。
无机化学在工业生产和科学研究中具 有广泛的应用,如制药、农业、能源 等领域。
02 硼族元素概述
硼族元素的定义
硼族元素
指周期表中第13族(ⅢA族)的元 素,包括硼(B)、铝(Al)、镓 (Ga)、铟(In)、铊(Tl)等元 素。
硼氢化合物和有机硼化合物
硼氢化合物
镓的氧化物包括Ga₂O₃和GaO,它们具有高熔点和稳定性,可用于制备其他镓的化合物。镓的氧化物可以 由金属镓与氧气反应得到。
镓的硫化物和硒化物
镓的硫化物
镓的硫化物包括Ga₂S₃和GaS,它们具有较高的硬度、熔点和导电性。镓的硫化物可以 由金属镓与硫反应得到。
镓的硒化物
镓的硒化物包括Ga₂Se₃和GaSe,它们具有与硫化物类似的性质,如高熔点和导电性。 镓的硒化物可以由金属镓与硒反应得到。
有机镓化合物
有机镓酸酯
有机镓酸酯是一类重要的有机化合物, 它们可以通过酯交换反应制备。有机镓 酸酯在聚合反应中用作催化剂和添加剂 。
VS
其他有机镓化合物
除了有机镓酸酯外,还有许多其他有机镓 化合物,如有机镓醇、有机镓酸盐等。这 些化合物在医药、材料科学和催化等领域 有广泛的应用。
06 铟的化合物
铟的卤化物和氧化物
铟的卤化物
铟与卤素(如氟、氯、溴、碘)反应,生成 相应的卤化物。这些卤化物具有较高的熔点 和沸点,在常温下多为固态。
铟的氧化物
铟与氧气反应,可以生成多种氧化物,如 In2O3和In2O。这些氧化物具有不同的性 质和应用,例如In2O3是一种半导体材料, 可用于制备透明导电膜。
铟的硫化物和硒化物
无机化学的重要性
无机化学在化学学科中占据重要地位 ,是学习其他化学课程的基础。
无机化学在工业生产和科学研究中具 有广泛的应用,如制药、农业、能源 等领域。
02 硼族元素概述
硼族元素的定义
硼族元素
指周期表中第13族(ⅢA族)的元 素,包括硼(B)、铝(Al)、镓 (Ga)、铟(In)、铊(Tl)等元 素。
硼氢化合物和有机硼化合物
硼氢化合物
第十四章硼族元素.ppt

四、对角关系
对比周期系中元素及相应化合物的性质,发现有些元 素及相应化合物的性质常与它右下方相邻的另一元素及相 应化合物的性质相似,这种关系称对角关系。
最明显的是周期系第二、三周期中的三对元素:
Li Be B C
Na Mg Al Si
1、Li-Mg的相似性 (1)单质在过量氧气中燃烧时,均只生成正常氧 化物。
1、掌握锡、铅氢氧化物的酸碱性;Sn(II)的还原性; Pb(Ⅳ)的氧化性;了解碳酸盐的性质,硅酸的性质,硅 酸盐晶体结构基本单元。
2、掌握正硼酸及四硼酸盐的性质;了解乙硼烷的结 构和性质,氢氧化铝及其盐的性质。
3、熟悉周期系中的对角关系。
2、氢氧化铝
性质:Al(OH)3难溶于水,是典型的两性氢氧化物之一。
H+
Al3+
Al(OH)3 OH-
[Al(OH)4]- 不是NaAlO2或Na3AlO3
固态NaAlO2要用Al2O3与强碱共熔而得: Al2O3(s)+2NaOH(s)→2NaAlO2(s)+H2O(g)
(五)铝盐
1、三氯化铝
第十四章 硼族元素
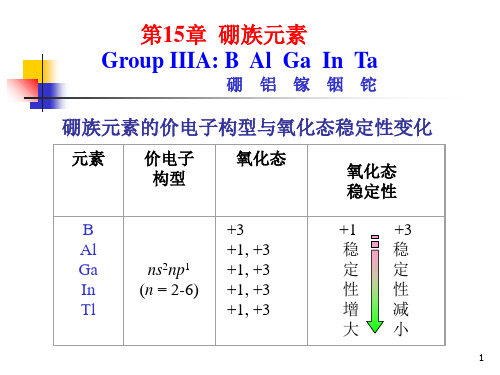
三、硼族元素 B、Al、Ga、In、Tl
(一)概述 ns2np1 除B外均为金属元素 氧化数:1、+3,从Ga→Tl由于惰性电子对效应+3化合物 稳定性降低,Tl3+有强氧化性,易转为Tl+的化合物。 化合物键型:B由于原子半径小,电负性大,其化合物场 均为共价型。其余多为离子型。 硼族元素原子的价电子数(3)<价层轨道数(4或9),这
(三)硼酸及其盐
硼硼酸的(含x氧B酸2O包3·y括H2偏O硼)酸等(。HBO2),正硼酸(H3BO3)和多 H3BO3结构:晶体结构单位是B(OH)3, 呈现平面三角形, B原子取sp2杂化,然后硼酸分子间以氢键互相连接成层状结
对比周期系中元素及相应化合物的性质,发现有些元 素及相应化合物的性质常与它右下方相邻的另一元素及相 应化合物的性质相似,这种关系称对角关系。
最明显的是周期系第二、三周期中的三对元素:
Li Be B C
Na Mg Al Si
1、Li-Mg的相似性 (1)单质在过量氧气中燃烧时,均只生成正常氧 化物。
1、掌握锡、铅氢氧化物的酸碱性;Sn(II)的还原性; Pb(Ⅳ)的氧化性;了解碳酸盐的性质,硅酸的性质,硅 酸盐晶体结构基本单元。
2、掌握正硼酸及四硼酸盐的性质;了解乙硼烷的结 构和性质,氢氧化铝及其盐的性质。
3、熟悉周期系中的对角关系。
2、氢氧化铝
性质:Al(OH)3难溶于水,是典型的两性氢氧化物之一。
H+
Al3+
Al(OH)3 OH-
[Al(OH)4]- 不是NaAlO2或Na3AlO3
固态NaAlO2要用Al2O3与强碱共熔而得: Al2O3(s)+2NaOH(s)→2NaAlO2(s)+H2O(g)
(五)铝盐
1、三氯化铝
第十四章 硼族元素
三、硼族元素 B、Al、Ga、In、Tl
(一)概述 ns2np1 除B外均为金属元素 氧化数:1、+3,从Ga→Tl由于惰性电子对效应+3化合物 稳定性降低,Tl3+有强氧化性,易转为Tl+的化合物。 化合物键型:B由于原子半径小,电负性大,其化合物场 均为共价型。其余多为离子型。 硼族元素原子的价电子数(3)<价层轨道数(4或9),这
(三)硼酸及其盐
硼硼酸的(含x氧B酸2O包3·y括H2偏O硼)酸等(。HBO2),正硼酸(H3BO3)和多 H3BO3结构:晶体结构单位是B(OH)3, 呈现平面三角形, B原子取sp2杂化,然后硼酸分子间以氢键互相连接成层状结
《硼族元素教学》PPT课件

36
⑵ 硼珠实验
熔融态的B2O3溶解金属氧化物 得到有特征 颜色的偏硼酸盐玻璃。
B2O3+CuO=Cu(BO2)(蓝色) B2O3+NiO=Ni(BO2)(绿色) ⑶ 与NH3反应
1/2xB2O3+XNH3→(BN)x+H2O(873K)
B
B
N
N
N
B
B
B
N
N
氮化硼,结构 与石墨相同 37
38
补充:无机苯(环硼氮烷)
3NH4CI+3LiBH4=B3N3H6+3LiCI+9H2
环硼氮烷的电子结构式和几何形状都与苯相似,化学
性质也相似,但更活泼,易加成、取代。
H
H CI
H N B N H HCI
HBH HN N H
H B BH N
CI B B H
HN
CI 39
H
HH
硼酸H3BO3
偏硼酸 (正)硼酸 多硼酸 HBO2 H3BO3 xB2O3·yH2O
蒸气的单分子构型
O 136pm
B
B 120pm
O
90-125°
O
35
制法
2H3BO3 △ B2O3+3H2O
4B(s)+3O2(g) 高温 2B2O3(s)
性质
⑴ 易溶于水
B2O3(晶状)+H2O(g)→2HBO2(g)(易挥发)
B2O3(无定形)+3H2O(l)→2HBO3(aq)
白色粉末状B2O3可用作吸水剂。
CI
AI
AI
CI
CI
CI
32
氯桥
AICI3:路易士酸,有机催化剂。易水解放 热,潮湿空气中冒烟。干法制。
化学竞赛无机化学绝密课件-硼族元素

O
O
BB
O
12. 3. 1 硼酸 H3BO3 硼酸为白色片层状物,易溶于水。
1. 硼酸的晶体结构
硼原子 氧原子 氢原子
硼酸 H3BO3
硼酸具有层状结构,层内有分 子间氢键。
层间通过分子间作用力结合, 不牢固,所以硼酸有滑腻感 。
B-B 2
2
2
4
氢桥键 3
2
4
8
硼桥键 3
2
2
4
闭合式 硼键
3
2
4
8
成键电子共 44
每个 B 有 3 个价电子 每个 H 有 1 个价电子 B10H14 共有 44 个价电子
每个 B 的电子怎样用在 化学键中?
激发杂化后,每个 B 有 3 个单电子。
每个 B-H 键都用掉 B 的 1 个电子。 另外 2 个价电子呢 ?
前后片层之间,通过 B-B 键结合。
这些 B 原子是 B12 结构单元中,前 部和后部的硼原子。
12. 1. 2 硼的化学性质 硼常温下不活泼,只能与 F2 反应
2 B + 3 F2 —— 2 BF3 硼的化学是高温化学 450℃ 硼与氧气反应
4 B + 3 O2 —— 2 B2O3
但生成的三氧化二硼覆盖层阻碍 进一步氧化,所以反应会逐渐停止下 来。
上述反应在常温下将以爆炸 方式猛烈进行。
3. 水解性 B2H6 具有水解性 B2H6 + 6 H2O —— 2 B(OH)3 + 6 H2 甲烷等烷烃不水解。
4. 路易斯酸反应 B2H6 缺电子,B 有得电子形 成 8 电子稳定结构的倾向,属于路 易斯酸。
而 LiH 中的氢负离子可以给 出电子对,属于路易斯碱。
高中化学竞赛 无机化学第2章硼族元素(共26页PPT)(共26张PPT)
2B + 2NaOH+3KNO3 === 2NaBO2+3KNO2+H2O
2. 硼酸
B:sp2杂化;存在分子间氢键; 层与层之间的分子作用力结合。
点击观看动画
H3BO3是路易斯酸,是一元酸
酸性很弱,Ka=5.8×10-10加入多羟基
化合物可增加酸性。
2
双烷氧基硼阴离子
H2SO4
H3BO3+3CH3OH== B(OCH3)3+3H2O
•燃烧绿色火焰 •鉴别硼酸及盐
3. 硼砂 (Na2B4O7·10H2O)
[B4O5(OH)4]2B: sp2杂化 sp3杂化
Na2B4O5(OH)4·8H2O
硼砂珠实验
冷却后为 蓝宝石色
硼砂珠实验:
△
Na2B4O7 ==B2O3+2NaBO2 +) CoO +B2O3 ==Co (BO2)2
Na2B4O7+CoO=2NaBO2·Co(BO2)
α-菱形硼
2 B + 3F2 == 2 BF3 4 B + 3O2 == 2 B2O3 2 B + N2 == 2 BN 2 B + 3 Cl2 == 2 BCl3 2 B + 3 S == B2S3 2 B + 6 H2O(g) == 2 B(OH)3 + 3 H2↑ B + 3 HNO3(浓) == B(OH)3 + 3 NO2↑ 2 B + 3 H2SO4 (浓) == 2 B(OH)3 + 3SO2↑
由于他的理论和实验研究的成功,利普斯科姆于1976年获 诺贝尔化学奖,并在后来的二十年期间给硼化学的发展带来了 重大的影响,从而开创了硼化学这一新领域。
2. AlCl3的成键特征 AlCl3中铝为sp3杂化
(GaCl3)2 (InCl3)2 (AlBr3)2 (AlI3)2 (GaBr3)2 除B的卤化物及ⅢA的氟化物以外,均为二聚形式。
2. 硼酸
B:sp2杂化;存在分子间氢键; 层与层之间的分子作用力结合。
点击观看动画
H3BO3是路易斯酸,是一元酸
酸性很弱,Ka=5.8×10-10加入多羟基
化合物可增加酸性。
2
双烷氧基硼阴离子
H2SO4
H3BO3+3CH3OH== B(OCH3)3+3H2O
•燃烧绿色火焰 •鉴别硼酸及盐
3. 硼砂 (Na2B4O7·10H2O)
[B4O5(OH)4]2B: sp2杂化 sp3杂化
Na2B4O5(OH)4·8H2O
硼砂珠实验
冷却后为 蓝宝石色
硼砂珠实验:
△
Na2B4O7 ==B2O3+2NaBO2 +) CoO +B2O3 ==Co (BO2)2
Na2B4O7+CoO=2NaBO2·Co(BO2)
α-菱形硼
2 B + 3F2 == 2 BF3 4 B + 3O2 == 2 B2O3 2 B + N2 == 2 BN 2 B + 3 Cl2 == 2 BCl3 2 B + 3 S == B2S3 2 B + 6 H2O(g) == 2 B(OH)3 + 3 H2↑ B + 3 HNO3(浓) == B(OH)3 + 3 NO2↑ 2 B + 3 H2SO4 (浓) == 2 B(OH)3 + 3SO2↑
由于他的理论和实验研究的成功,利普斯科姆于1976年获 诺贝尔化学奖,并在后来的二十年期间给硼化学的发展带来了 重大的影响,从而开创了硼化学这一新领域。
2. AlCl3的成键特征 AlCl3中铝为sp3杂化
(GaCl3)2 (InCl3)2 (AlBr3)2 (AlI3)2 (GaBr3)2 除B的卤化物及ⅢA的氟化物以外,均为二聚形式。
无机化学课件硼族元素

oxidation number
ⅢA —— ns2np1
0、+1、+3
其中铝是地壳中蕴藏最丰富的金属元素主要以铝矾 土矿(Al2O3·xH2O)存在铝是银白色、有光泽的轻金属 具有良好的导电性和延展性广泛用来作导线、结构材料 和器皿铝合金质轻又硬,用于飞机制造。
所以硼族元素有时称为土族元素,其中Al2O3为黏 土的主要成分,既难溶又难熔
第十三章 p区元素(一)
一. 硼族元素
二. 碳族元素
§13.1 硼族元素
(The Boron Family Elements)
本节要求:
1. 了解硼族元素的通性、硼单质的性质; 2. 掌握缺电子原子及其化合物的结构特点和性质; 3. 熟悉硼的典型化合物(硼酸、硼砂)的性质和硼砂 珠试验; 4. 熟悉铝的化合物的性质特点。
B2O3 + 3Mg
2B + 3MgO
KBF4 + 3Na
3NaF + KF + B
(2)工业上:从硼镁矿 → 单质硼 → 精制硼
Mg2B2O5·5H2O + 2NaOH
2NaBO2 + 2Mg(OH)2 + 4H2O
4NaBO2 + CO2 + 10H2O
Na2B4O7·10H2O + Na2CO3
硼的主要化合物有硼酸、硼砂、卤化硼
(一)、硼酸H3BO3 —— 分子结构如下:
B:sp2杂化;存在分子间氢键形成接近六角形的对称层 状结构;层与层之间的分子作用力结合——与石墨相似
能溶于水,为典型的Lewis一元弱酸,由sp2 →sp3:
B(OH)3 + H2O
[B(OH)4] - + H +
无机化学教学课件 13章 硼族元素

骨架电子对的总数应为 5 + 1
= 6 (或 n+ 1). 这正是闭合式簇
化物的特征. 这种闭合多面体
B5
只能是 5 个顶点的 ∆ 多面体,
因而无疑为三角双锥体.
2021/6/18
22
13-1-3 硼的含氧化合物
(1) B2O3:通过 B 与 O2 反应或 H3BO3 加热脱水得到. 加热脱水红热 时得玻璃态 B2O3 ,减压历时二周加热到 670 K 得晶体状B2O. 1273 K 以上得蒸气.
● 酸法:Mg2B2O5·H2O(硼镁矿) + 2H2SO4
2 H3BO3 + 2 MgSO4
虽一步可得到 H3BO3,但需耐酸设备等苛刻条件.
● 碱法:Mg2B2O5·H2O + 2 NaOH 2 NaBO2 + 2 Mg(OH)2
(浓)
↓ 结晶出来
浓的水溶液
4 NaBO2 + CO2 + 10 H2O
和核反应堆的控制棒. 前一种用途基于其优良的抗冲击性,
后一种用途基于硼吸收中子的能力.
2021/6/18
14
13-1-2 硼的氢化物——硼烷
(1) 分类:按组成可分为 BnHn+4 和 BnHn+6 两类 (2) 结构:B:利用 sp3 杂化轨道,与氢形成三中心两电子键(氢桥)
2021/6/18
美国物理化学家
第13章 硼族元素 Chapter 13 Boron family elements
2021/6/18
1
本章教学要求
1.了解硼族元素的特点; 2.了解硼族元素的存在、制备及用途; 3.掌握元素硼、铝的单质及其化合物的性质,会 用结构理论和热力学解释它们的某些化学现象; 4.从正硼烷的结构了解缺电子键和硼烷结构; 5.了解惰性电子对效应概念及其应用。
元素无机化学:第十三章 硼族元素

B
H 1
B
H
H2 1B H2
3
B 1
H
5
B
1
H
4B1 5 H H1 B
5 1B 4 H
2H 3 B1H
2H
5
B
1
开口的笼型结构 H
B10H14
层状石墨结构
B2H6 + NH3(g) → (BN)x(s) (Almost as hard as diamond)
B2H6 + NH3(g) → B3N3H6 (无机苯)
B2O3(熔融)+CuO ==Cu(BO2)2 (蓝色) 3B2O3(熔融)+Fe2O3 ==2Fe(BO2)3 (黄色)
硼珠试验 ,制备有色硼玻璃
结构:
B:sp2杂化
H O
硼 酸 Boracic acid
B
H
O
O
H
性质:
B(OH)3(aq) + 2 H2O(l)==== H3O+(aq) + [B(OH)4]-(aq)
4B+3O2 == 2B2O3 4B+N2 == 2BN
2B+3S == B2S3
2B+3X2 == 2BX3 (X=Cl, Br, I)
(3) 高2B温+Z下r =夺=取Zr氧B2化物中氧4(B硼+氧3键N的b键=能=很N大b)3B4
4B+3SiO2 == 2B2O3+3Si 10B+3P2O5 == 5B2O3+6P
O-B-O
O
400℃
OH
Na2B4O5(OH)4·8H2O ===Na2B4O7+10H2O
H 1
B
H
H2 1B H2
3
B 1
H
5
B
1
H
4B1 5 H H1 B
5 1B 4 H
2H 3 B1H
2H
5
B
1
开口的笼型结构 H
B10H14
层状石墨结构
B2H6 + NH3(g) → (BN)x(s) (Almost as hard as diamond)
B2H6 + NH3(g) → B3N3H6 (无机苯)
B2O3(熔融)+CuO ==Cu(BO2)2 (蓝色) 3B2O3(熔融)+Fe2O3 ==2Fe(BO2)3 (黄色)
硼珠试验 ,制备有色硼玻璃
结构:
B:sp2杂化
H O
硼 酸 Boracic acid
B
H
O
O
H
性质:
B(OH)3(aq) + 2 H2O(l)==== H3O+(aq) + [B(OH)4]-(aq)
4B+3O2 == 2B2O3 4B+N2 == 2BN
2B+3S == B2S3
2B+3X2 == 2BX3 (X=Cl, Br, I)
(3) 高2B温+Z下r =夺=取Zr氧B2化物中氧4(B硼+氧3键N的b键=能=很N大b)3B4
4B+3SiO2 == 2B2O3+3Si 10B+3P2O5 == 5B2O3+6P
O-B-O
O
400℃
OH
Na2B4O5(OH)4·8H2O ===Na2B4O7+10H2O
中山大学无机化学精品课程第15章硼族元素PPT课件
B
H BH
B
H
H
合计: 24 e, 占有12个成键分子轨道。
拓扑图
先易后难:先端基键,再3c-2e键,最后B-B键。
21
例2. 己硼烷-10( B6H10 )分子结构
(1) 价轨道数:46 +110 = 34 6B 10H
(2)价电子数 3×6 + 1×10 = 28 6B 10H
6个 B-H 2c-2e: 2e×6 =12 e 4个 B-H-B 3c-2e: 2e×4 = 8 e
11
12
5
3c-2e
1
3
4
2c-2e与上方B 2
5
6
9
8
1 0 2c-2e与下方B 7
11
12
(①21、)与7腰、部外1:2部、每B10个1、2 B成41)2与键单同元一6个平B面原内子相(1、②子顶与顶部上部(3一、和层8底、3部个9):和B原底子部或(5下、一6、层113)个各B3原个子B原共
2. 化性: (1) 溶于水形成H3BO3 或H3BO2 无定形 B2O3(s) + 2 H2O(l) = 2 H3BO3 △rH = - 76.6 kJ·mol-1 晶形 B2O3(s) + 2 H2O(g) = 2 H3BO2 (2) 与金属氧化物共熔
B2O3(s)+ M2O
M2O3
共熔
用于鉴别Mn+
(1)价轨道数:4×5 + 1×9 = 29
5B 9H (2)价电子数 3×5 + 1×9 = 24
5B 9H H
H
H
5个端基 B-H 2c-2e键: 2e×5 =10 e
B
4个桥式B-H-B 3c-2e键: 2e×4 = 8 e
第四章-硼族元素PPT课件

天然宝石: 透明氧化铝晶体含不同杂质而呈现鲜明颜色
红宝石(Cr3+)
蓝宝石(Fe3+)
18
绿宝石(Cu2+)
氢氧化铝
A l3 + + 3 H 2 O O H H + - A l( O H ) 3 O H H + - [ A l( O H ) 4 ] 两性 A l(O H )3 3 H A l3 + + 3 H 2 O
9
镓铟铊
均为银白色, 质软, 轻而有延展性的金属, 有毒 Ga: 熔点(303 K) ~ 沸点(2523 K)
液态范围在金属中最大,用在高温温度计
10
11.2.2 硼族元素的氢化物
一系列硼的氢化物, 20多种-----硼烷
◆ 组成 BnHn+4 类(稳定) BnHn+6 类
例: B2H6
最简单的硼
2B+ F2 ══室═温2BF3 2 B + 3 X 2 Δ 2 B X 3 ( X C l,B r ,I )
平面三角 形分子
6
③ 无定型B在赤热下同水蒸汽作用 2B + 6H2O ═══ 2H3BO3 + 3H2
④ 无定型B被热的浓H2SO4或浓HNO3氧化 2B + 3H2SO4(浓) ══ 2H3BO3 + 3SO2↑ B + 3HNO3(浓) ══ H3BO3 + 3NO2↑
(II) 与金属氧化物共熔
B2O3(s)+
M2O M2O3
共熔
硼酸盐(特征颜色) 硼玻璃
13
硼酸 H3BO3
H O B H
OO H
层状结构,似石墨,滑腻,有解离性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B-O、 Al-O键能大,B、Al为亲氧元素。
硼的单质 无定形硼 棕色粉末 晶形硼 黑灰色
化学活性高
熔点,
硬度大
α-菱形硼(B12) 原子晶体,正二十面体
沸点都很高 化学性质?
硼的化学性质 与O2
K 4B 3O2 973 2B2O3
与其它非金属
2B N2 2BN B F2 常温 BF3 B X2 BCl3 , BBr3
R'
OH OH
H H
C C
R'
R
O O
H HO H HO
B
OH H
O O
C C
R'
H H
H
R
H
H H
C C
R'
O O
B
O O
C C
R'
H 3H2 O H
• 与甲醇或乙醇→硼酸酯→绿色 火焰→鉴定硼化合物 H2SO 4 H3BO3 3CH3OH 浓 B(OCH3 )3 3H2O
H
要点:B的杂化方式, 三中心两电子键、氢桥键。
B4H10分子结构
H H H B H B B H H B H H H H
(a)
119pm
122
。
171pm
143pm
137pm
H
(b)
H B
硼烷分子中的五种键型: B H B B H B B 3c-2e 氢桥键 B
B
B 3c-2e开式 硼桥键
Ga,In,Tl:离子键为主,+3价易形成共价键。 从Al→Tl,离子性↑, ns2↑,Tl+离子稳定
21.2 硼族元素的单质
存在、主要矿物?
自然界中的存在、主要矿物?
硼: 硼砂 Na2B4O7 10H2O 方硼矿 2Mg3B8O15 MgCl2 硼镁矿Mg2B2O5 H2O 少量硼酸 H 3BO3 铝:铝矾土 Al2O3 xH2O 镓、铟、铊:稀有分散元素,无独立矿藏,与其它矿共生
Na2B4O7 NiO Ni(BO2 )2 2NaBO2 (绿色)
3.硼的卤化物
• BX3结构: B:sp2杂化
X
非极性分子
B
• BX3性质:
X
BF3 BCl3 BBr3 l -46 91.3 BI3 s 49.9 210
X
室温下 g g 聚集态 熔点/℃ -127.1 -107 沸点/℃ -100.4 12.7
(X Cl, Br, I)
氟硼酸 4BF H3BO3 3H[BF 3 3H2O 4]
BF3 HF [HF BF3 ]
•Lewis酸 酸性BF3< BCl3 < BBr3 < BI3
6 4 键依次 易打开
4.氮化物(BN)X
1、制备:
Na2 B4O7 2NH4Cl 2NaCl B2O3 2BN 4H2O
高温
Al2O3
Al(OH)3 →(400-500℃)
Al(OH)3、Al2(SO4)3、Al(NO3)3 →灼烧 六方紧密堆积 熔点高、硬度大、不溶于水酸 碱,耐腐蚀绝缘性好,密度大
或铝铵矿加热
六方面心立方堆积 质轻、硬度小、不溶于水,溶 于酸碱-活性氧化铝,粒子小、 表面积大、吸附力强
用作高硬质材料、耐磨、耐火 材料
作吸附剂、催化剂载体、色谱 柱
氢氧化铝:Al(OH)3
两性: Al(OH)3+ 3H+
Al(OH)3+ OH-
Al3+ + 3H2O
[Al(OH)4]-
在碱性溶液中存在[Al(OH)4]-或[Al(OH)6]33 简便书写为 AlO 2 或AlO3
2Al(OH)3 +12HF+3Na2CO3 =2Na3[AlF6] + 3CO2 +9H2O
△ rHm -2034kJ mol-1 高能燃料,剧毒
② 水解
mol-1 △ rHm -509.3kJ
③ 被氯氯化
B2H6 (g) 6Cl2 (g) 2BCl3 (l) 6HCl
•硼烷的制备:间接合成
△ rHm -1376kJ mol-1
乙醚 6LiH 4BF3 6Li[BF4 ] B2H6
第21章
硼族元素
21.1 硼族元素概述 21.2 硼族元素的单质 21.3 硼的化合物 21.4 铝的化合物 21.5 惰性电子对效应和 周期表中的斜线关系
教学目标:
◆了解硼族元素的通性、硼的缺电子性; ◆掌握硼族元素的单质及其化合物的性质; ◆了解惰性电子对效应。
本章重点:
◆硼和铝的化合物; ◆乙硼烷的结构、多中心键。
铝的卤化物 AlF3
离子键
AlCl3
AlBr3
共价键
AlI3
难溶于水 离子晶体
易溶 分子晶体 熔点低,易挥发, 易溶于有机溶剂,
Cl Cl
Al
Cl Cl
Al
Cl Cl
易形成双聚物。 Lewis酸,作催化剂
21.5 惰性电子对效应和 周期表中的斜线关系
惰性电子对效应——Sidgwick
同族元素自上而下,与族数相同的高氧化 态化合物稳定性依次减小,比族数小2 的低氧 化态稳定性增加的现象。
B H2O(g) H3BO3 H2
BS B2S3
与H2O 与酸
B HNO3 (浓) H3BO3 NO2
B H2SO 4 (浓) H3BO3 SO 2
与碱 2B 2NaOH 3KNO3 2NaBO2 3KNO2 H2O 硼的用途? 铝、镓、铟、铊?铝热还原法?用途? 硼的化合物?
21.3 硼的化合物
1.硼的氢化物
硼烷分类:BnHn+4和 BnHn+6 例: B2H6 乙硼烷 有CH4,但无BH3 B4H10 丁硼烷
H
H
最简单的硼烷:B2H6
其结构并非如右图所示:
H
B
H
B
H
H
• 硼烷的结构
B 2 s 22 p 1
H B
H B H H B H
B:利用sp3杂化轨道,与氢形成 4个B-H( 2c-2e )—— σ 键 2个三中心两电子键(3c-2e)——氢桥键 记作: H B
21.1 硼族元素概述
硼族(ⅢA):B,Al,Ga,In,Tl
价电子构型:ns2np1 缺电子元素:价电子数<价层轨道数
缺电子化合物:成键电子对数<价层轨道数
例如:BF3,H3BO3。
注意: HBF4不是缺电子化合物。 缺电子化合物特点:
a. 易形成配位化合物HBF4 HF b. 易形成双聚物Al2Cl6
21.2.4 铝的化合物
有些氧化铝晶体透明,因含有杂质而呈现鲜明颜色。
红宝石(Cr3+)
蓝宝石(Fe3+,Cr3+)
黄玉/黄晶(Fe3+)
刚玉——自然界α - Al2O3晶体,作磨料、耐火材料 刚玉粉——含微量Fe2O3 的 Al2O3,作抛光剂
氧化铝:Al2O3
Al2O3
Al + O2→燃烧
B B B 3c-2e闭式 硼桥键
2c-2e 硼氢键
2c-2e 硼硼键
•硼烷的性质: 无色气体,易燃、易水解,剧毒 ① 自燃
B2H6 (g) 3O2 (g) B2O3 (s) 3H2O(g)
B2H6 (g) 3H2O(l) 2H3BO3 (s) 6H2 (g)
水下火箭燃料
乙醚 3Li[AlH4 ] 4BCl3 3LiCl 3AlCl3 2B2H6
乙醚 3Na[BH4 ] BF3 3NaF 3 2B2 H6
B2H6 高级硼烷
2.硼的含氧化合物
① 三氧化二硼 B2O3
结构: 原子晶体:熔点460C;无定形体:软化 O2 +H2O H3BO3 B(无定形) B2O3 -H2O Mg或Al 2B2 O 3 (s) 制备: 4B(s) 3O2 (g)
2、存在 石墨型:不导电、耐热、耐腐蚀、润滑性能优良 金刚石型:硬度大于金刚石
21. 4 铝的单质 • • • • • • 1、铝的冶炼:电解法 2、铝的性质: (1)亲氧性:2Al+Fe2O3=Fe+Al2O3 4Al+3TiO2 +3C =Al2O3 +3TiC (2)两性: 2Al+6H+=3H2+2Al3+ 2Al+2OH-+3H2O =2[Al(OH)4]- +3H2
明显表现在哪几对? 三对 Li Na 如何解释?
用离子极化理论说明:原因在于相似的离子极化力(静电 场力)
Be Mg
B Al
C Si
问题
1、乙硼烷的结构如何?
2、乙硼烷的化学性质及有关反应?
3、硼的卤化物的结构?水解性?m.p,b.p?
4、硼酸是几元酸?酸性如何?
5、硼砂的化学式?硼珠实验?
6、铝化合物的两性? 如何分离Al3+和Mg2+?
2O 2O • 受热易分解 H3BO3 -H HBO2 -H B2O3 (玻璃态)
③ 硼砂 Na 2 B4 O7 10H2 O
Na 2 B4 O5 (OH)4 8H2 O
硼酸根的结构:
硼砂珠实验:用于定性分析或焊接除锈
Na2B4O7 CoO Co(BO2 )2 2NaBO2 (蓝色)
制取:B2O3 3H2SO 4 (浓) 3CaF2 BF3 3CaSO 3H2O
