《中国药典》2020版—甘精胰岛素国家药品标准公示稿
《中国药典》2020年版(三部)生物技术产品增修订概况

中国药品标准DrugStandardsofChina2021,22(1) ·5 · 第一作者简介:赵雄,副研究员,研究方向:生物制品研发及质量控制。
Tel:010 67079598;E mail:zhaoxiong@chp org cn 通讯作者简介:郭中平,研究员,研究方向:生物制品。
Tel:010 67079561;E mail:guozhongping@chp org cn《中国药典》2020年版(三部)生物技术产品增修订概况赵雄,王晓娟,曹琰,郭中平(国家药典委员会,北京100061)摘要:生物技术产业的快速发展推动了生物技术产品国家标准的不断提升。
本文介绍了《中国药典》2020年版(三部)生物技术产品及相关通用技术要求的增修订概况,阐释了增修订的考量和特点,旨在为正确理解和执行生物技术产品国家标准提供参考。
关键词:生物技术产品;国家标准;增修订中图分类号:R921 2 文献标识码:A 文章编号:1009-3656(2021)01-0005-05doi:10 19778/j chp 2021 01 001UpdatesandAmendmentsofBiotechnologyProductsintheChinesePharmacopoeia2020(VolumeⅢ)ZHAOXiong,WANGXiaojuan,CAOYan,GUOZhongping(ChinesePharmacopoeiaCommission,Beijing100061,China)Abstract:Therapiddevelopmentofthebiotechnologyindustryhaspromotedthecontinuousimprovementofnation alstandardsforbiotechnologyproducts TheupdatesandamendmentsofbiotechnologyproductsandgeneralrequirementsintheChinesePharmacopoeia2020(VolumeⅢ)areintroduced,andtheconsiderationsandcharac teristicsoftherevisionsareexplained Thataimstoprovideareferencefortheaccurateunderstandingandimple mentationofnationalstandardsforbiotechnologyproducts.Keywords:biotechnologyproducts;nationalstandards;updatesandamendments 生物技术产品是指采用生物技术制备的、临床上用于疾病治疗的大分子生物制品[1]。
《中国药典》2020版—精蛋白重组人胰岛素混合注射液 (30R)国家药品标准公示稿

精蛋白重组人胰岛素混合注射液 (30R) Jingdanbai Chongzu Ren Yidaosu Hunhe Zhusheye (30R) Mixed Protamine Recombinant Human Insulin Injection (30R)
本品为常规重组人胰岛素与精蛋白重组人胰岛素在灌装前混合而成的预混型制剂,其中常规重组人胰岛素占 30%,精蛋白重组人胰岛素占 70%。
1基本要求
生产和检定用设施、原辅料、水、器具等应符合“凡例”的相关要求。
2制造
2.1原料
应符合“重组人胰岛素项下”的规定。
2.2半成品
2.2.1配制与除菌
按照经批准的配方进行稀释、配制,除菌过滤后即为半成品,保存于适宜的温度。
2.2.2半成品检定
按3.1 项进行。
2.3成品
2.3.1分批
应符合“生物制品分批规程”规定。
2.3.2分装
应符合“生物制品分装和冻干规程”及通则 0102 有关规定。
2.3.3规格
3ml:300 单位
10ml:400 单位
2.3.4包装
应符合“生物制品包装规程”及通则 0102 有关规定。
3检定
3.1半成品检定。
甘精胰岛素含量的检测方案

胰岛素,可造成重组人胰岛素性低血糖症状。
血糖浓度持续降低而出现交感神经兴奋性增高和脑功能障碍症群而导致的综合症就是低血糖休克。
在实验条件下如果给动物注射过量的胰岛素,使动物体内胰岛素量骤然升高,可造成动物实验性低血糖,会使神经组织的正常代谢功能发生障碍,以至产生痉挛昏迷状况,在外部表现为惊厥,称之为胰岛素休克。
小鼠的低血糖休克实验属于经典实验传统的甘精胰岛素休克实验目的是观察人工胰岛素性低血糖休克以和注射葡萄糖后的消失过程,以加深对甘精胰岛素生理作用的理解但实验中一般不测定小白鼠血糖的变化,只是观察甘精胰岛素造成低血糖休克时的行为变化。
二、设计依据高效液相色谱法是将其中具有一定极性的单一溶剂或不同比例的混合有机溶液作为流动相,用泵将配好的流动相注入装有填有十八烷基硅烷键合硅胶为填充剂的色谱柱,注入的供试品被流动相带入色谱柱柱内进行分离后,各成分先后进入检测系统当中,用积分或者数据处理系统记录数据处理,得到测定的结果。
采用外标法来检测甘精胰岛素含量时,被检测的样品通过相关处理后配制成相应溶液,处理后的供试品注入液相色谱仪中从而各自成分被分离与检测。
外标法的最大优势就是无需校正因子,相对比较适合大规模的样品检测。
(检测标准:中国药典)根据2020年版《中国药典》第四部通则“胰岛素纯度与含量测定法”第二法,对甘精胰岛素进行溶出度的测定,然后参照《中华人民共和国药典》2020版第四部通则0512高效液相色谱法试验,将制备的供试品溶液放入高效液相色谱仪进行溶出测定,测定六个时间点的溶出度,依据各个时间点的溶出数据绘制溶出曲线,对溶出曲线进行分析,最后确定甘精胰岛素的最佳溶出时间点。
三、检测方案1.检测仪器及试剂、检验品仪器:安捷伦1260高效液相色谱仪、XSE205电子天平、PE20型pH计、超声波清洗器、容量瓶25ml、GM.05型真空泵。
试剂:纯化水、乙腈、二水磷酸二氢钠、磷酸、氯化钠、0.01mol/L盐酸溶液、甘精胰岛素工作对照品(来源:珠海联邦制药股份有限公司)企业标准,含量(96.5%)、甘精胰岛素干粉,(珠海联邦制药股份有限公司提供)批号:431210305。
《中国药典》2020版—甘精胰岛素国家药品标准公示稿

《中国药典》2020版—⽢精胰岛素国家药品标准公⽰稿⽢精胰岛素Ganjing YidaosuInsulin Glargine本品系由含有可⾼效表达⽢精胰岛素基因的⼯程化细胞,经发酵、分离、⾼度纯化、结晶和⼲燥制成。
⽢精胰岛素为21A -⽢氨酸-30B a-L-精氨酸-30B b-L-精氨酸-⼈胰岛素,在结构上与⼈胰岛素相⽐在链A的21位置由⽢氨酸代替门冬酰胺,在链B的C 末端增加了2个额外氨基酸,即精氨酸(B31)和精氨酸(B32)。
按⼲燥品计,含⽢精胰岛素应为95.0%~105.0%。
每1单位⽢精胰岛素相当于0.0364mg。
1基本要求⽣产和检定⽤设施、原材料及辅料、⽔、器具等应符合“凡例”的有关要求。
2制造2.1⼯程细胞本品为重组DNA技术⽣产的由53个氨基酸残基组成的蛋⽩质,⼯程菌菌种名称、来源及种⼦批检定应符合批准的要求。
2.2原料2.2.1种⼦液制备将检定合格的⼯作种⼦批细胞接种于适宜的培养基(可含适量抗⽣素)中培养。
2.2.2发酵⽤培养基采⽤适宜的不含抗⽣素的培养基2.2.3种⼦液接种及发酵培养2.2.3.1在灭菌培养基中接种适量种⼦液2.2.3.2在适宜的温度下进⾏发酵,应根据经批准的发酵⼯艺进⾏,并确定相应的发酵条件,如温度、pH值、溶解氧、补料、发酵时间等。
如系⼤肠杆菌表达,发酵液应定期进⾏质粒丢失率检查(通则3406)。
2.2.4发酵液处理⽤适宜的⽅法收集、处理细胞。
2.2.5初步纯化及⾼度纯化采⽤经批准的纯化⼯艺进⾏初步纯化和⾼度纯化,使其纯度达到规定的要求。
2.2.6过滤、结晶及⼲燥经初步纯化和⾼度纯化后,采⽤经批准的结晶⼯艺及⼲燥⼯艺对纯化收集物进⾏结晶和⼲燥,⼲燥品即原料。
2.2.7分批应符合“⽣物制品分批规程”规定。
2.2.8规格应为经批准的规格。
2.2.9包装应符合“⽣物制品包装规程”规定和批准的内容。
3检定3.1性状本品为⽩⾊或类⽩⾊的粉末。
3.2鉴别3.2.1在含量测定项下记录的⾊谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间⼀致。
《中国药典》(2020年版)复方磺胺恶唑片中的甲氧苄啶含量测

《中国药典》(2020年版)复方磺胺噁唑片中的甲氧苄啶含量测甲氧苄啶(Trimethoprim, TMP),又称为甲氧苄氨嘧啶、甲氧苄嘧啶,是一种抗菌增效药,与磺胺类药物联合使用时,能使磺胺类药物抗菌谱扩大、抗菌活性大大增强。
由于其独特的作用,甲氧苄啶在养殖业病害防治中被广泛应用。
迪信泰检测平台采用高效液相色谱(HPLC)和液相色谱-三重四极杆质谱(LC-MS/MS)法,可高效、精准的检测甲氧苄啶的含量变化。
此外,我们还提供其他抗生素检测服务,以满足您的不同需求。
HPLC和LC-MS测定甲氧苄啶样本要求:1. 请确保样本量大于0.2g或者0.2mL。
周期:2~3周项目结束后迪信泰检测平台将会提供详细中英文双语技术报告,报告包括:1. 实验步骤(中英文)2. 相关质谱参数(中英文)3. 质谱图片4. 原始数据5. 甲氧苄啶含量信息应用范围:本方法采用高效液相色谱法测定复方磺胺甲恶唑片中磺胺甲恶唑和甲氧苄啶的含量。
本方法适用于复方磺胺甲恶唑片。
方法原理:供试品加甲醇稀释,最终用流动相定量稀释后,进入高效液相色谱仪进行色谱分离,用紫外吸收检测器,于波长240nm处检测磺胺甲恶唑和甲氧苄啶的吸收值,计算出其含量。
试剂: 1. 0.1mol/L盐酸2. 乙腈3. 三乙胺4. 氢氧化钠试液5. 冰醋酸仪器设备: 1. 仪器1.1 高效液相色谱仪1.2 色谱柱十八烷基硅烷键合硅胶为填充剂,理论塔板数按磺胺甲恶唑峰计算不低于4000。
磺胺甲恶唑和甲氧苄啶的分离度应符合要求。
1.3 紫外吸收检测器2. 色谱条件2.1 流动相:水乙腈三乙胺=799 200 1(用氢氧化钠试液或冰醋酸调节pH 值至5.9。
)2.2 检测波长:240nm2.3 柱温:室温试样制备:1. 称取供试品取本品10片,精密称定,研细,精密称取适量(约相当于磺胺甲恶唑44mg)置100mL量瓶中。
2. 对照品溶液的制备精密称取磺胺甲恶唑对照品和甲氧苄啶对照品适量,用0.1mol/L盐酸溶液溶解并定量稀释制成每1mL中约含有磺胺甲恶唑0.44mg的和甲氧苄啶89µg的溶液。
《中国药典》2020—精蛋白重组人胰岛素混合注射液(50R)国家标准公示稿

精蛋白重组人胰岛素混合注射液(50R) Jingdanbai Chongzu Ren Yidaosu Hunhe Zhusheye (50R) Mixed Protamine Recombinant Human Insulin Injection (50R) 本品为常规重组人胰岛素与精蛋白重组人胰岛素在灌装前混合而成的预混型制剂,其中常规重组人胰岛素占 50%,精蛋白重组人胰岛素占 50%。
1基本要求
生产和检定用设施、原辅料、水、器具等应符合“凡例”的相关要求。
2制造
2.1原料
应符合“重组人胰岛素项下”的规定。
2.2半成品
2.2.1配制与除菌
按照经批准的配方进行稀释、配制,除菌过滤后即为半成品,保存于适宜的温度。
2.2.2半成品检定
按3.1 项进行。
2.3成品
2.3.1分批
应符合“生物制品分批规程”规定。
2.3.2分装
应符合“生物制品分装和冻干规程”及通则 0102 有关规定。
2.3.3规格
3ml:300 单位
2.3.4包装
应符合“生物制品包装规程”及通则 0102 有关规定。
3检定
3.1半成品检定。
甘精胰岛素注射液说明书
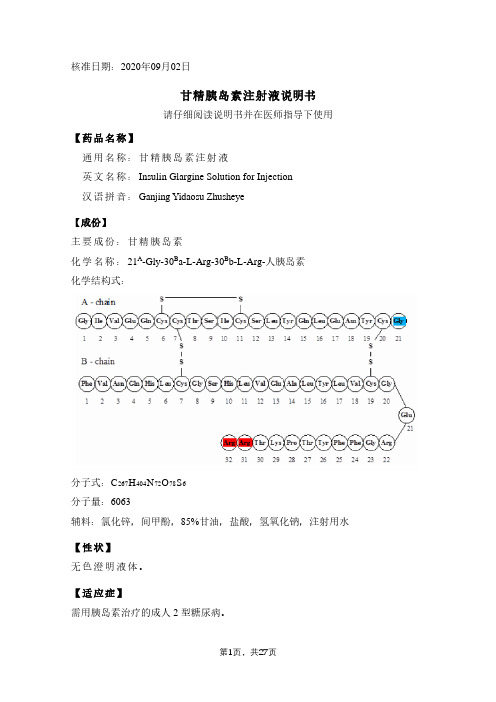
核准日期:2020年09月02日甘精胰岛素注射液说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:甘精胰岛素注射液英文名称:Insulin Glargine Solution for Injection汉语拼音:Ganjing Yidaosu Zhusheye【成份】主要成份:甘精胰岛素化学名称:21A-Gly-30B a-L-Arg-30B b-L-Arg-人胰岛素化学结构式:分子式:C267H404N72O78S6分子量:6063辅料:氯化锌,间甲酚,85%甘油,盐酸,氢氧化钠,注射用水【性状】无色澄明液体。
【适应症】需用胰岛素治疗的成人2型糖尿病。
【规格】1.5ml:450单位/预填充式注射笔。
每毫升注射液含300单位甘精胰岛素*(相当于10.91mg)。
每支笔含1.5 ml注射溶液,相当于450个单位。
* 甘精胰岛素由大肠埃希菌通过重组DNA技术生产。
【用法用量】剂量甘精胰岛素注射液300单位/毫升(下文简称甘精胰岛素U300)是一种基础胰岛素,每日给药一次,可在全天任意时间给药,最好在每天的同一时间给药。
给药方案(剂量和给药时间)应根据个体反应来进行调整。
对于2型糖尿病患者,甘精胰岛素U300可以和其他降糖药物一起联合使用。
甘精胰岛素U300的效价是以单位计,与国际单位或其他胰岛素类似物效价的单位不相同(参见[临床试验]和[药理毒理])。
给药时间的灵活性在需要时,患者可在常规给药时间前后3小时内皮下注射甘精胰岛素U300(参见[临床试验])。
对于漏掉一剂给药的患者,应检测血糖并恢复常规的每天给药一次方案。
应告知患者,如果忘记给药,不能通过注射双倍的剂量来补上漏掉的一剂。
起始剂量2型糖尿病患者推荐的起始剂量为0.2单位/公斤体重,根据个体情况调整剂量。
甘精胰岛素注射液100单位/毫升(下文简称甘精胰岛素U100)与甘精胰岛素U300之间的转换甘精胰岛素U100与甘精胰岛素U300不具备生物等效性,不能直接转换。
国家药品监督管理局总局国家药品标准(修订)颁布件(简版)

360㊀ ㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀中国药品标准DrugStandardsofChina2019ꎬ20(4)国家药品监督管理局总局国家药品标准(修订)颁布件(简版)㊀批件号:ZGB2016 ̄16实施日期:2016年11月11日颁布日期:2016年05月11日㊀修订内容与结论㊀㊀根据«药品管理法»及其有关规定ꎬ经审查ꎬ将ʌ含量测定ɔ项下蛇胆汁中牛磺胆酸的含量限度进行了修订ꎬ并对质量标准进行了文字规范ꎮ同意对质量标准进行修订ꎮ实施规定㊀㊀本标准自颁布之日起6个月内ꎬ生产企业按原标准生产的药品仍按原标准检验ꎬ按本标准生产的药品应按本标准检验ꎮ自本标准实施之日起ꎬ生产企业必须按照本标准生产该药品ꎬ并按照本标准检验ꎬ原标准同时停止使用ꎮ请各省(自治区㊁直辖市)食品药品监督管理局及时通知辖区内有关药品生产企业ꎬ自实施之日起执行修订后的国家药品标准ꎮ标准号:WS3 ̄B ̄1832 ̄94 ̄2016蛇胆川贝液ShedanChuanbeiYeʌ处方ɔ㊀蛇胆汁㊀10g㊀㊀㊀㊀平贝母㊀75gʌ制法ɔ㊀以上二味ꎬ取平贝母ꎬ加80%乙醇加热回流提取ꎬ提取液滤过ꎬ滤液浓缩成流浸膏ꎻ另取蔗糖560g和蜂蜜80gꎬ制成糖浆ꎬ加入蛇胆汁㊁平贝母流浸膏和杏仁水30mL及薄荷脑和防腐剂适量ꎬ混匀ꎬ加水使成1000mLꎬ即得ꎮʌ性状ɔ㊀本品为浅黄色至浅黄棕色的澄清液体ꎻ味甜㊁微苦ꎬ有凉喉感ꎮʌ鉴别ɔ㊀(1)取本品40mLꎬ用10%氢氧化钠溶液调节pH值至l2以上ꎬ用三氯甲烷振摇提取2次ꎬ每次25mLꎬ弃去三氯甲烷液ꎬ水液用盐酸 ̄水(1ʒ1)溶液调节pH值至2ꎬ用水饱和的正丁醇强力振摇提取3次(20mL㊁20mL㊁10mL)ꎬ合并正丁醇液ꎬ用水洗涤2次(20mL㊁15mL)ꎬ分取正丁醇液ꎬ蒸干ꎬ残渣加无水乙醇4mL使溶解ꎬ作为供试品溶液ꎮ另取蛇胆汁对照药材10mgꎬ加水40mL使溶解ꎬ同供试品溶液的制备方法制成对照药材溶液ꎮ再取牛磺胆酸钠对照品ꎬ加无水乙醇制成每1mL含1mg的溶液ꎬ作为对照品溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取供试品溶液2~5μL㊁对照药材溶液及对照品溶液各5μLꎬ分别点于同一Merck硅胶G高效板中ꎬ使成条状ꎬ以乙酸乙酯 ̄冰醋酸 ̄甲醇 ̄水(13ʒ1 5ʒ3ʒ1 5)为展开剂ꎬ展开8cmꎬ取出ꎬ晾干ꎬ喷以10%硫酸乙醇溶液ꎬ在105ħ中加热5分钟ꎬ置紫外光(365nm)下检视ꎮ供试品色谱中ꎬ在与对照品色谱相应的位置上ꎬ显相同颜色的荧光斑点ꎻ在与对照药材色谱相应的位置上ꎬ显三个或三个以上相同颜色的荧光斑点ꎬ且牛磺胆酸钠斑点下方应显两个相同颜色的荧光斑点ꎮ(2)取本品20mLꎬ通过D101型大孔吸附树脂柱(内径1 5cmꎬ柱高10cm)ꎬ用水50mL洗脱ꎬ弃去洗脱液ꎬ再用30%乙醇100mL洗脱ꎬ收集洗脱液ꎬ蒸干ꎬ残渣加甲醇1mL使溶解ꎬ作为供试品溶液ꎮ另取平贝母对照药材1 5gꎬ加甲醇30mLꎬ加热回流30分钟ꎬ放冷ꎬ滤过ꎬ滤液蒸干ꎬ残渣加甲醇1mL使溶解ꎬ作为对照药材溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取上述供试品溶液10~20μL㊁对照药材溶液5~10μLꎬ分别点于同一硅胶H薄层板上ꎬ以三氯甲烷 ̄乙酸乙酯 ̄甲醇 ̄浓氨试液(6ʒ10ʒ4ʒ1)为展开剂ꎬ展开ꎬ展距约13cmꎬ取出ꎬ晾干ꎬ喷以磷酸 ̄高氯酸 ̄乙酸酐(5ʒ20ʒ1)的混合溶液ꎬ在105ħ加热至斑点显色清晰ꎬ置紫外光(365nm)下检视ꎮ供试品色谱中ꎬ在与对照药材色谱相应的位置上ꎬ显两个或两个以上相同的黄至黄绿色荧光斑点ꎮʌ检查ɔ㊀相对密度㊀应为1 21~1 25(25ħ)(中国药典2015年版通则0601)ꎮ中国药品标准DrugStandardsofChina2019ꎬ20(4)㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀ 361㊀ pH值㊀应为3 5~5 5(中国药典2015年版通则0631)ꎮ其他㊀应符合糖浆剂项下有关的各项规定(中国药典2015年版通则0116)ꎮʌ含量测定ɔ㊀杏仁水㊀精密量取本品150mLꎬ置500mL凯氏烧瓶中ꎬ加水100mLꎬ连接冷凝管ꎬ通水蒸气蒸馏ꎮ馏出液导入10mL的90%乙醇溶液中ꎬ将接收瓶置冰浴中冷却ꎬ至馏出液全量达150mL时停止蒸馏ꎬ在馏出液中加入碘化钾试液与氨试液各2mLꎬ以硝酸银滴定液(0 01mol L-1)缓缓滴定至溶液中所产生的黄白色浑浊不消失时止ꎬ将滴定结果用空白试验校正ꎬ即得ꎮ每1mL硝酸银滴定液(0 01mol L-1)相当于0 5405mg的HCNꎮ本品每1mL含杏仁水以氢氰酸(HCN)计ꎬ应为10~30μgꎮ蛇胆汁㊀照高效液相色谱法(中国药典2015年版通则0512)测定ꎮ色谱条件与系统适用性试验㊀以十八烷基硅烷键合硅胶为填充剂ꎻ以乙腈 ̄0 4%磷酸溶液(30ʒ70)为流动相ꎻ检测波长为203nmꎮ理论板数以牛磺胆酸峰计算应不低于4000ꎮ对照品溶液的制备㊀取牛磺胆酸钠对照品适量ꎬ精密称定ꎬ加甲醇溶解制成每1mL含牛磺胆酸钠0 35mg的溶液ꎬ即得(牛磺胆酸重量=牛磺胆酸钠重量/1 0426)ꎮ供试品溶液的制备㊀精密量取装量差异项下的本品20mLꎬ用乙醚振摇提取2次(20mLꎬ15mL)ꎬ水液备用ꎬ合并乙醚液ꎬ用水洗涤2次ꎬ每次5mLꎬ分别分取水液ꎬ与备用水液合并ꎬ置水浴上蒸至无乙醚味ꎬ通过D101型大孔吸附树脂柱(内径1 5cmꎬ柱高10cm)ꎬ用水200mL洗脱ꎬ弃去水液ꎬ再用乙醇60mL洗脱ꎬ收集洗脱液ꎬ蒸干ꎬ残渣加甲醇溶解并转移至10mL量瓶中ꎬ加甲醇至刻度ꎬ摇匀ꎬ滤过ꎬ取续滤液ꎬ即得ꎮ测定法㊀精密吸取对照品溶液10μLꎬ供试品溶液10~20μLꎬ注入液相色谱仪ꎬ测定ꎬ即得ꎮ本品每1mL含蛇胆汁以牛磺胆酸(C26H45NO7S)计ꎬ不得少于105μgꎮʌ功能与主治ɔ㊀祛风止咳ꎬ除痰散结ꎮ用于风热咳嗽ꎬ痰多气喘ꎬ胸闷ꎬ咳痰不爽或久咳不止ꎮʌ用法与用量ɔ㊀口服ꎮ一次10mLꎬ一日2次ꎬ小儿酌减ꎮʌ规格ɔ㊀每支10mLʌ贮藏ɔ㊀密封ꎬ置阴凉处ꎮ国家药品监督管理局总局国家药品标准(修订)颁布件(简版)㊀批件号:ZGB2016 ̄17实施日期:2016年11月13日颁布日期:2016年05月13日㊀修订内容与结论㊀㊀根据«药品管理法»及其有关规定ꎬ经审查ꎬ同意修订ʌ性状ɔ㊁ʌ鉴别ɔ㊁ʌ含量测定ɔ项ꎮ实施规定㊀㊀本标准自颁布之日起6个月内ꎬ生产企业按原标准生产的药品仍按原标准检验ꎬ按本标准生产的药品应按本标准检验ꎮ自本标准实施之日起ꎬ生产企业必须按照本标准生产该药品ꎬ并按照本标准检验ꎬ原标准同时停止使用ꎮ请各省(自治区㊁直辖市)食品药品监督管理局及时通知辖区内有关药品生产企业ꎬ自实施之日起执行修订后的国家药品标准ꎮ标准号:YBZ11672006 ̄2009Z ̄2016排毒清脂片PaiduQingzhiPianʌ处方ɔ㊀大黄㊀540g㊀㊀㊀㊀西洋参㊀90g㊀㊀㊀㊀麦冬㊀360gʌ制法ɔ㊀以上三味ꎬ西洋参粉碎成细粉ꎻ大黄㊁麦冬粉碎成粗粉ꎬ加70%乙醇加热回流三次ꎬ第一次1 5小时ꎬ第二次1小时ꎬ第三次30分钟ꎬ滤过ꎬ滤液合并ꎬ滤液回收乙醇并浓缩至相对密度为1 31~1 35(60362㊀ ㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀中国药品标准DrugStandardsofChina2019ꎬ20(4)ħ)的稠膏ꎬ干燥ꎬ粉碎ꎬ过筛ꎬ加入上述西洋参细粉和淀粉适量ꎬ混匀ꎬ制颗粒ꎬ加入滑石粉ꎬ二氧化硅和硬脂酸镁ꎬ混匀ꎬ压制成1000片ꎬ包薄膜衣ꎬ即得ꎮʌ性状ɔ㊀本品为薄膜衣片ꎬ除去薄膜衣后显黄棕色至棕褐色ꎻ气微ꎬ味苦㊁甘ꎮʌ鉴别ɔ㊀(1)取本品3片ꎬ除去薄膜衣ꎬ研细ꎬ加甲醇20mLꎬ浸渍1小时ꎬ滤过ꎬ滤液蒸干ꎬ残渣加水10mL使溶解ꎬ再加盐酸2mLꎬ加热回流30分钟ꎬ冷却ꎬ用乙醚振摇提取2次ꎬ每次10mLꎬ合并乙醚液ꎬ蒸干ꎬ残渣加三氯甲烷1mL使溶解ꎬ作为供试品溶液ꎮ另取大黄对照药材1gꎬ加乙醇20mLꎬ浸渍1小时ꎬ滤过ꎬ滤液蒸干ꎬ残渣加水10mLꎬ同法制成对照药材溶液ꎮ再取大黄素对照品ꎬ加甲醇制成每1mL含1mg的溶液ꎬ作为对照品溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取供试品溶液2μL㊁对照药材溶液4μL及对照品溶液2μLꎬ分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上ꎬ以石油醚(30~60ħ) ̄甲酸乙酯 ̄甲酸(15ʒ5ʒ1)的上层溶液为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ置紫外光灯(365nm)下检视ꎬ供试品色谱中ꎬ在与对照药材色谱相应的位置上ꎬ显相同的五个橙黄色荧光主斑点ꎻ在与对照品色谱相应的位置上ꎬ显相同的橙黄色荧光斑点ꎬ置氨蒸气中熏后ꎬ斑点变为红色ꎮ(2)取本品5片ꎬ除去薄膜衣ꎬ研细ꎬ加甲醇60mLꎬ加热回流1小时ꎬ放冷ꎬ滤过ꎬ滤液蒸干ꎬ残渣加水20mL使溶解ꎬ用乙醚振摇提取2次ꎬ每次10mLꎬ水液用水饱和的正丁醇振摇提取3次ꎬ每次15mLꎬ合并正丁醇液ꎬ用5%碳酸钠溶液洗涤2次ꎬ每次15mLꎬ弃去洗液ꎬ再用水洗涤2次ꎬ每次10mLꎬ分取正丁醇液ꎬ蒸干ꎬ残渣加甲醇1mL使溶解ꎬ作为供试品溶液ꎮ另取西洋参对照药材1gꎬ同法制成对照药材溶液ꎮ再取人参皂苷Re对照品㊁人参皂苷Rg1对照品ꎬ加甲醇制成每1mL各含2mg的溶液ꎬ作为对照品溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取供试品溶液2μL㊁对照药材溶液及对照品溶液各3μLꎬ分别点于同一硅胶G薄层板上ꎬ以三氯甲烷 ̄甲醇 ̄水(13ʒ7ʒ2)10ħ以下放置12小时的下层溶液为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ喷以10%硫酸乙醇溶液ꎬ在105ħ加热至斑点显色清晰ꎮ供试品色谱中ꎬ在与对照药材色谱和对照品色谱相应的位置上ꎬ显相同颜色的斑点ꎮʌ检查ɔ㊀应符合片剂项下有关的各项规定(中国药典2015年版通则0101)ꎮʌ含量测定ɔ㊀照高效液相色谱法(中国药典2015年版通则0512)测定ꎮ色谱条件与系统适应性试验㊀用十八烷基硅烷键合硅胶为填充剂ꎻ以甲醇 ̄0 1%磷酸溶液(75ʒ25)为流动相ꎻ检测波长为254nmꎮ理论板数按大黄素峰计算应不低于2000ꎮ对照品溶液的制备㊀取芦荟大黄素对照品㊁大黄酸对照品㊁大黄素对照品㊁大黄酚对照品㊁大黄素甲醚对照品适量ꎬ精密称定ꎬ分别置于棕色容量瓶中ꎬ加甲醇分别制成每1mL含芦荟大黄素㊁大黄酸㊁大黄素㊁大黄素甲醚各40μg㊁大黄酚100μg的溶液ꎮ分别精密量取上述对照品溶液各2mLꎬ混匀ꎬ即得(每1mL含芦荟大黄素㊁大黄酸㊁大黄素㊁大黄素甲醚各8μgꎬ含大黄酚20μg)ꎮ供试品溶液的制备㊀取本品10片ꎬ除去薄膜衣ꎬ精密称定ꎬ研细ꎬ混匀ꎬ取约0 3gꎬ精密称定ꎬ精密加入甲醇25mLꎬ称定重量ꎬ加热回流1小时ꎬ放冷ꎬ再称定重量ꎬ用甲醇补足减失的重量ꎬ摇匀ꎬ滤过ꎬ精密量取续滤液5mLꎬ至烧杯中ꎬ挥去溶剂ꎬ加8%盐酸溶液10mLꎬ超声处理(功率250Wꎬ频率50kHz)2分钟ꎬ再加三氯甲烷10mLꎬ加热回流1小时ꎬ放冷ꎬ置分液漏斗中ꎬ用少量三氯甲烷洗涤容器ꎬ洗液并入分液漏斗中ꎬ分取三氯甲烷层ꎬ酸液再用三氯甲烷振摇提取3次ꎬ每次10mLꎬ合并三氯甲烷液ꎬ减压回收溶剂至干ꎬ残渣加甲醇使溶解ꎬ转移至10mL量瓶中ꎬ加甲醇至刻度ꎬ摇匀ꎬ滤过ꎬ取续滤液ꎬ即得ꎮ测定法㊀分别精密吸取对照品溶液与供试品溶液各10μLꎬ注入液相色谱仪ꎬ测定ꎬ即得ꎮ本品每片含大黄以芦荟大黄素(C15H10O5)㊁大黄酸(C15H8O6)㊁大黄素(C15H10O5)㊁大黄酚(C15H10O4)㊁大黄素甲醚(C16H12O5)的总量计ꎬ不得少于0 90mgꎮʌ功能与主治ɔ㊀化瘀降脂ꎬ通便消痤ꎮ用于浊瘀内阻所致的单纯性肥胖ꎬ高脂血症ꎬ痤疮ꎮʌ用法与用量ɔ㊀口服ꎮ一次2片ꎬ一日2~3次ꎮʌ注意ɔ㊀孕妇慎用ꎻ忌食辛辣及油腻食物ꎻ服药后轻度腹泻者宜减量服用ꎮʌ规格ɔ㊀每片重0 38gʌ贮藏ɔ㊀密封ꎮ中国药品标准DrugStandardsofChina2019ꎬ20(4)㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀ 363㊀国家药品监督管理局总局国家药品标准(修订)颁布件(简版)㊀批件号:ZGB2016 ̄18实施日期:2016年11月20日颁布日期:2016年05月20日㊀修订内容与结论㊀㊀根据«药品管理法»及其有关规定ꎬ经审查ꎬ将ʌ鉴别ɔ中对照药材 生姜 改为 干姜 ꎮ同意对标准进行修订ꎮ实施规定㊀㊀本标准自颁布之日起6个月内ꎬ生产企业按原标准生产的药品仍按原标准检验ꎬ按本标准生产的药品应按本标准检验ꎮ自本标准实施之日起ꎬ生产企业必须按照本标准生产该药品ꎬ并按照本标准检验ꎬ原标准同时停止使用ꎮ请各省(自治区㊁直辖市)食品药品监督管理局及时通知辖区内有关药品生产企业ꎬ自实施之日起执行修订后的国家药品标准ꎮ标准号:WS3 ̄B ̄1499 ̄93 ̄4 ̄2016小柴胡颗粒XiaochaihuKeliʌ处方ɔ㊀柴胡㊀240g㊀㊀㊀㊀姜半夏㊀90g㊀㊀㊀㊀黄芩㊀90g㊀㊀㊀㊀党参㊀90g甘草㊀90g生姜㊀90g大枣90gʌ制法ɔ㊀以上七味ꎬ除姜半夏㊁生姜外ꎬ其他柴胡等五味ꎬ加水12倍量ꎬ煎煮二次ꎬ每次1 5小时ꎬ合并煎液ꎬ滤过ꎬ滤液浓缩至适量ꎮ姜半夏㊁生姜用70%的乙醇作溶剂ꎬ浸渍24小时后ꎬ以每分钟1~3mL的速度缓缓渗漉ꎬ收集渗漉液约900mLꎬ回收乙醇ꎬ与上述浓缩液合并ꎬ浓缩至相对密度为1 15~1 20(50ħ)的清膏ꎬ喷雾干燥ꎬ浸膏粉加辅料ꎬ混匀ꎬ干法制成颗粒390gꎬ即得ꎮʌ性状ɔ㊀本品为浅灰色至浅棕色颗粒ꎻ味微酸甜㊁微辛ꎮʌ鉴别ɔ㊀(1)取本品1袋ꎬ研细ꎬ加乙醚40mLꎬ置水浴上加热回流30分钟ꎬ滤过ꎬ弃去乙醚液ꎬ药渣挥干乙醚ꎬ加3%吡啶甲醇溶液40mLꎬ置水浴上加热回流1小时ꎬ滤过ꎬ滤液蒸干ꎬ残渣加水10mL使溶解ꎬ通过已处理好的D101大孔吸附树脂柱(内径1 0cmꎬ长9cm)ꎬ用0 5mol/L氢氧化钠溶液100mL洗脱ꎬ弃去碱液ꎬ用水洗至中性ꎬ再用乙醇50mL洗脱ꎬ收集洗脱液ꎬ蒸干ꎬ残渣加甲醇2mL使溶解ꎬ作为供试品溶液ꎮ另取柴胡对照药材1gꎬ加甲醇20mLꎬ置水浴上加热回流1小时ꎬ滤过ꎻ滤液蒸干ꎬ残渣加甲醇5mL使溶解ꎬ作为对照药材溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取上述二种溶液各6μLꎬ分别条带状点于同一硅胶G薄层板上ꎬ以三氯甲烷 ̄甲醇 ̄水(7ʒ3ʒ1)的下层溶液为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ喷以2%对二甲氨基苯甲醛的40%硫酸溶液ꎬ60ħ加热至斑点显色清晰ꎮ供试品色谱中ꎬ在与对照药材色谱相应的位置上ꎬ显相同的红色斑点ꎮ(2)取本品ꎬ研细ꎬ取约2gꎬ加甲醇20mLꎬ超声处理20分钟ꎬ滤过ꎬ滤液蒸干ꎬ残渣加甲醇1mL使溶解ꎬ作为供试品溶液ꎮ另取甘草对照药材粉末1g(60目)ꎬ加乙醚40mLꎬ置水浴上加热回流1小时ꎬ滤过ꎬ弃去乙醚液ꎬ药渣挥干乙醚ꎬ再加甲醇20mLꎬ置水浴上加热回流1小时ꎬ滤过ꎬ滤液蒸干ꎬ残渣加甲醇5mL使溶解ꎬ作为对照药材溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取上述二种溶液各6μLꎬ分别点于同一硅胶G薄层板上ꎬ以乙酸乙酯 ̄甲酸 ̄冰醋酸 ̄水(15ʒ1ʒ1ʒ2)为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ喷以10%硫酸乙醇溶液ꎬ加热至斑点显色清晰ꎮ供试品色谱中ꎬ在与对照药材色谱相应的位置上ꎬ显相同的黄色斑点ꎮ置紫外光灯(365nm)下检视ꎬ显相同颜色的荧光斑点ꎮ(3)取本品1袋ꎬ研细ꎬ加甲醇40mLꎬ置水浴上加热回流1小时ꎬ放冷ꎬ滤过ꎬ滤液蒸干ꎬ残渣加水20mL使溶解ꎬ用乙醚振摇提取2次ꎬ每次20mLꎬ合并乙醚液ꎬ低温挥干乙醚ꎬ残渣加三氯甲烷1mL使溶解ꎬ作为供试品溶液ꎮ另取干姜对照药材0 2gꎬ加乙醚40mLꎬ置水浴上加热回流1小时ꎬ滤过ꎬ滤液蒸干ꎬ残渣加三364㊀ ㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀中国药品标准DrugStandardsofChina2019ꎬ20(4)氯甲烷1mL使溶解ꎬ作为对照药材溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取供试品溶液6μL㊁对照药材溶液1μLꎬ分别点于同一硅胶G薄层板上ꎬ以正己烷 ̄乙酸乙酯 ̄甲酸(8 5ʒ1 5ʒ0 2)为展开剂ꎬ展开ꎬ展距9cmꎬ取出ꎬ晾干ꎬ置紫外光灯(365nm)下检视ꎮ供试品色谱中ꎬ在与对照药材色谱相应的位置上ꎬ显相同颜色的荧光斑点ꎮʌ检查ɔ㊀应符合颗粒剂项下有关的各项规定(中国药典2015年版通则0104)ꎮʌ含量测定ɔ㊀照高效液相色谱法(中国药典2015年版通则0512)测定ꎮ色谱条件与系统适用性试验㊀以十八烷基硅烷键合硅胶为填充剂ꎻ以甲醇 ̄水 ̄磷酸(47ʒ53ʒ0 2)为流动相ꎻ检测波长为280nmꎮ理论板数按黄芩苷峰计算应不低于3000ꎮ对照品溶液的制备㊀取黄芩苷对照品约2mgꎬ精密称定ꎬ置25mL量瓶中ꎬ加甲醇溶解ꎬ并稀释至刻度ꎬ摇匀ꎬ精密量取3mLꎬ置10mL量瓶中ꎬ用70%甲醇稀释至刻度ꎬ摇匀ꎬ即得(每1mL含黄芩苷24μg)ꎮ供试品溶液的制备㊀取装量差异项下的本品ꎬ研细ꎬ取约0 12gꎬ精密称定ꎬ置具塞锥形瓶中ꎬ精密加入70%甲醇25mLꎬ密塞ꎬ称定重量ꎬ超声处理(功率100Wꎬ频率40kHz)20分钟ꎬ放冷ꎬ再称定重量ꎬ用70%甲醇补足减失的重量ꎬ摇匀ꎬ滤过ꎮ精密量取续滤液4mLꎬ置10mL量瓶中ꎬ用70%甲醇稀释至刻度ꎬ摇匀ꎬ滤过ꎬ取续滤液ꎬ即得ꎮ测定法㊀分别精密吸取对照品溶液与供试品溶液各20μLꎬ注入液相色谱仪ꎬ测定ꎬ即得ꎮ本品每袋含黄芩以黄芩苷(C21H18O11)计ꎬ不得少于30mgꎮʌ功能与主治ɔ㊀解表散热ꎬ疏肝和胃ꎮ用于寒热往来ꎬ胸胁苦满ꎬ心烦喜吐ꎬ口苦咽干ꎮʌ用法与用量ɔ㊀温开水冲服ꎬ一次1袋ꎬ一日3次ꎮʌ规格ɔ㊀每袋装5gʌ贮藏ɔ㊀密封ꎮ国家药品监督管理局总局国家药品标准(修订)颁布件(简版)㊀批件号:ZGB2016 ̄19实施日期:2016年11月20日颁布日期:2016年05月20日㊀修订内容与结论㊀㊀根据«药品管理法»及其有关规定ꎬ经审查ꎬ修订了何首乌㊁赤芍的TLC鉴别及何首乌的HPLC含量测定ꎻ新增了泽泻的TLC鉴别ꎮ经复核ꎬ方法可行ꎮ同意对标准进行修订ꎮ实施规定㊀㊀本标准自颁布之日起6个月内ꎬ生产企业按原标准生产的药品仍按原标准检验ꎬ按本标准生产的药品应按本标准检验ꎮ自本标准实施之日起ꎬ生产企业必须按照本标准生产该药品ꎬ并按照本标准检验ꎬ原标准同时停止使用ꎮ请各省(自治区㊁直辖市)食品药品监督管理局及时通知辖区内有关药品生产企业ꎬ自实施之日起执行修订后的国家药品标准ꎮ标准号:YBZ05362004 ̄2016蒲参胶囊PushenJiaonangʌ处方ɔ㊀何首乌㊀135g㊀㊀㊀㊀蒲黄㊀110g㊀㊀㊀㊀丹参㊀66g㊀㊀㊀㊀川芎㊀66g赤芍㊀66g山楂㊀66g泽泻㊀110g党参㊀36gʌ制法ɔ㊀以上八味ꎬ何首乌粉碎成细粉ꎻ其余蒲黄等七味加5倍量水煎煮二次ꎬ每次2小时ꎬ合并煎液ꎬ滤过ꎬ滤液减压浓缩至相对密度为1 30~1 32(60ħ)的稠膏ꎬ与何首乌细粉混匀ꎬ干燥ꎬ粉碎成细粉ꎬ加糊精适量ꎬ制粒ꎬ干燥ꎬ装入胶囊ꎬ制成1000粒ꎬ即得ꎮ㊀ 中国药品标准DrugStandardsofChina2019ꎬ20(4)㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀ 365ʌ性状ɔ㊀本品为硬胶囊ꎬ内容物为黄色至棕黄色的粉末ꎻ气微香㊁味微苦ꎮʌ鉴别ɔ㊀(1)取本品内容物5gꎬ加三氯甲烷20mLꎬ超声处理45分钟ꎬ滤过ꎬ滤液蒸干ꎬ残渣加三氯甲烷 ̄甲醇(1ʒ1)1mL使溶解ꎬ作为供试品溶液ꎮ另取何首乌对照药材0 5gꎬ同法制成对照药材溶液ꎮ再取大黄素对照品㊁大黄素甲醚对照品ꎬ加甲醇制成每1mL各含1mg的混合溶液ꎬ作为对照品溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取上述三种溶液各5μLꎬ分别点于同一硅胶G薄层板上ꎬ以环己烷 ̄乙酸乙酯 ̄甲酸(17ʒ3ʒ1)的上层溶液为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎮ供试品色谱中ꎬ在与对照药材色谱和对照品色谱相应的位置上ꎬ显相同的黄色斑点ꎻ置紫外光灯(365nm)下检视ꎬ供试品色谱中ꎬ在与对照药材色谱和对照品色谱相应的位置上ꎬ显相同颜色的荧光斑点ꎮ(2)取本品内容物6gꎬ加70%乙醇50mLꎬ加热回流1小时ꎬ放冷ꎬ滤过ꎬ滤液蒸至无醇味ꎬ加水20mLꎬ用稀盐酸调节pH值为1~2ꎬ用乙酸乙酯20mL振摇提取ꎬ提取液蒸干ꎬ残渣加无水乙醇1mL使溶解ꎬ作为供试品溶液ꎮ另取原儿茶醛对照品ꎬ加甲醇制成每1mL含0 5mg的溶液ꎬ作为对照品溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取上述两种溶液各5μLꎬ分别点于同一硅胶G薄层板上ꎬ以三氯甲烷 ̄丙酮 ̄甲酸(8ʒ1ʒ1)的上层溶液为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ喷以5%三氯化铁乙醇溶液ꎮ供试品色谱中ꎬ在与对照品色谱相应的位置上ꎬ显相同颜色的斑点ꎮ(3)取本品内容物2gꎬ加乙醇20mLꎬ超声处理30分钟ꎬ滤过ꎬ滤液蒸干ꎬ残渣加无水乙醇1mL使溶解ꎬ作为供试品溶液ꎮ另取赤芍对照药材0 5gꎬ同法制成对照药材溶液ꎮ再取芍药苷对照品ꎬ加甲醇制成每1mL含1mg的溶液ꎬ作为对照品溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取上述三种溶液各5μLꎬ分别点于同一硅胶G薄层板上ꎬ以三氯甲烷 ̄乙酸乙酯 ̄甲醇 ̄甲酸(40ʒ5ʒ10ʒ0 2)为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ喷以5%香草醛硫酸溶液ꎬ在105ħ加热使斑点显色清晰ꎮ供试品色谱中ꎬ在与对照药材色谱和对照品色谱相应的位置上ꎬ显相同颜色的斑点ꎮ(4)取本品内容物2gꎬ加乙酸乙酯30mLꎬ加热回流30分钟ꎬ滤过ꎬ滤液蒸干ꎬ残渣加甲醇1mL使溶解ꎬ作为供试品溶液ꎮ另取泽泻对照药材0 5gꎬ同法制成对照药材溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)试验ꎬ吸取上述两种溶液各5μLꎬ分别点于同一硅胶G薄层板上ꎬ以二氯甲烷 ̄甲醇(8ʒ1)为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ喷以10%硫酸乙醇溶液ꎬ在105ħ加热使斑点显色清晰ꎮ供试品色谱中ꎬ在与对照药材色谱相应的位置上ꎬ显相同颜色的斑点ꎮʌ检查ɔ㊀应符合胶囊剂项下有关的各项规定(中国药典2015年版通则0103)ꎮʌ含量测定ɔ㊀照高效液相色谱法(中国药典2015年版通则0512)测定ꎮ色谱条件与系统适用性试验㊀以十八烷基硅烷键合硅胶为填充剂ꎻ以乙睛 ̄水(17ʒ83)为流动相ꎻ检测波长为320nmꎻ理论板数按2ꎬ3ꎬ5ꎬ4ᶄ ̄四羟基二苯乙烯 ̄2 ̄O ̄β ̄D葡萄糖苷计算应不低于4000ꎮ对照品溶液的制备㊀取2ꎬ3ꎬ5ꎬ4ᶄ ̄四羟基二苯乙烯 ̄2 ̄O ̄β ̄D葡萄糖苷对照品适量ꎬ精密称定ꎬ加甲醇制成每1mL含60μg的溶液ꎬ摇匀ꎬ即得ꎮ供试品溶液的制备㊀取装量差异项下的本品ꎬ研匀ꎬ取约0 1gꎬ精密称定ꎬ置具塞锥形瓶中ꎬ精密加入50%乙醇25mLꎬ称定重量ꎬ加热回流1小时ꎬ取出ꎬ放冷ꎬ再称定重量ꎬ用50%乙醇补足减失的重量ꎬ摇匀ꎬ取上清液ꎬ滤过ꎬ取续滤液ꎬ即得ꎮ测定法㊀精密吸取对照品溶液与供试品溶液各10μLꎬ注人液相色谱仪ꎬ测定ꎬ即得ꎮ本品每粒含何首乌以2ꎬ3ꎬ5ꎬ4ᶄ ̄四羟基二苯乙烯 ̄2 ̄O ̄β ̄D葡萄糖苷(C20H22O9)计ꎬ不得少于1 1mgꎮʌ功能与主治ɔ㊀活血祛瘀ꎬ滋阴化浊ꎮ用于高血脂症的血瘀证ꎮ症见头晕目眩㊁头部刺痛㊁胸部刺痛㊁胸闷憋气㊁心悸怔忡㊁肢体麻木ꎻ舌质紫暗或有瘀点ꎬ脉象细涩ꎮʌ用法与用量ɔ㊀口服ꎬ一次4粒ꎬ一日3次ꎮʌ规格ɔ㊀每粒装0 25gʌ贮藏ɔ㊀密闭ꎬ防潮ꎮ366㊀ ㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀中国药品标准DrugStandardsofChina2019ꎬ20(4)国家药品监督管理局总局国家药品标准(修订)颁布件(简版)㊀批件号:ZGB2016 ̄20实施日期:2016年11月20日颁布日期:2016年05月20日㊀修订内容与结论㊀㊀根据«药品管理法»及其有关规定ꎬ经审查ꎬ新增了茯苓的显微鉴别ꎬ茯苓㊁广金钱草的TLC鉴别ꎬ广金钱草的HPLC含量测定方法ꎮ经复核ꎬ方法可行ꎮ同意对标准进行修订ꎮ实施规定㊀㊀本标准自颁布之日起6个月内ꎬ生产企业按原标准生产的药品仍按原标准检验ꎬ按本标准生产的药品应按本标准检验ꎮ自本标准实施之日起ꎬ生产企业必须按照本标准生产该药品ꎬ并按照本标准检验ꎬ原标准同时停止使用ꎮ请各省(自治区㊁直辖市)食品药品监督管理局及时通知辖区内有关药品生产企业ꎬ自实施之日起执行修订后的国家药品标准ꎮ标准号:YBZ01552006 ̄2009Z ̄2016结石通胶囊Jieshitongjiaonangʌ处方ɔ㊀广金钱草㊀285g㊀㊀㊀㊀玉米须㊀188 8g㊀㊀㊀㊀石韦㊀142 5g㊀㊀㊀㊀鸡骨草㊀142 5g茯苓㊀142 5g车前草㊀103 1g海金沙草㊀103 1g白茅根㊀142 5gʌ制法ɔ㊀以上八味ꎬ取茯苓120g粉碎成细粉ꎬ剩余茯苓与其余玉米须等七味ꎬ加水煎煮二次ꎬ每次3小时ꎬ合并煎液ꎬ滤过ꎬ滤液浓缩至相对密度为1 19~1 20(90ħ)的清膏ꎬ加茯苓细粉ꎬ混匀ꎬ干燥ꎬ粉碎成细粉ꎬ过筛ꎬ加适量辅料ꎬ混匀ꎬ制粒ꎬ干燥ꎬ整粒ꎬ装入胶囊ꎬ制成1000粒ꎬ即得ꎮʌ性状ɔ㊀本品为硬胶囊ꎬ内容物为棕褐色的颗粒和粉末ꎻ味略苦ꎮʌ鉴别ɔ㊀(1)取本品ꎬ置显微镜下观察:不规则分枝状团块无色ꎬ遇水合氯醛液溶化ꎻ菌丝无色或淡棕色ꎬ直径4~6μm(茯苓)ꎮ(2)取本品内容物1 8gꎬ加甲醇30mLꎬ超声处理30分钟ꎬ滤过ꎬ滤液浓缩至约1mLꎬ作为供试品溶液ꎮ另取茯苓对照药材0 5gꎬ加甲醇30mLꎬ同法制成对照药材溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)ꎬ吸取供试品溶液10μL㊁对照药材溶液5μLꎬ分别点于同一硅胶G薄层板上ꎬ以甲苯–乙酸乙酯–甲酸(20ʒ3ʒ0 5)为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ置紫外光灯(365nm)下检视ꎮ供试品色谱中ꎬ在与对照药材色谱相应的位置上ꎬ显相同颜色的荧光斑点ꎮ(3)取本品内容物0 7gꎬ加甲醇20mLꎬ超声处理15分钟ꎬ滤过ꎬ滤液蒸干ꎬ残渣加水20mL使溶解ꎬ用乙酸乙酯振摇提取2次ꎬ每次10mLꎬ弃去乙酸乙酯液ꎬ水层用水饱和的正丁醇振摇提取2次ꎬ每次20mLꎬ合并正丁醇液ꎬ蒸干ꎬ残渣加甲醇1mL使溶解ꎬ作为供试品溶液ꎮ另取广金钱草对照药材0 2gꎬ加甲醇20mLꎬ超声处理15分钟ꎬ滤过ꎬ滤液浓缩至约1mLꎬ作为对照药材溶液ꎮ再取夏佛塔苷对照品ꎬ加甲醇制成每1mL含0 1mg的溶液ꎬ作为对照品溶液ꎮ照薄层色谱法(中国药典2015年版通则0502)ꎬ吸取上述三种溶液各1μLꎬ点成条状ꎬ分别点于同一聚酰胺薄膜上ꎬ以冰醋酸–水(3ʒ17)为展开剂ꎬ展开ꎬ取出ꎬ晾干ꎬ喷以2%三氯化铝乙醇溶液ꎬ热风吹干ꎬ置紫外光灯(365nm)下检视ꎮ供试品色谱中ꎬ在与对照药材色谱和对照品色谱相应的位置上ꎬ显相同颜色的荧光斑点ꎮʌ检查ɔ㊀应符合胶囊剂项下有关的各项规定(中国药典2015年版通则0103)ꎮʌ含量测定ɔ㊀照高效液相色谱法(中国药典2015年版通则0512)测定ꎮ色谱条件与系统适用性试验㊀以十八烷基硅烷键合硅胶为填充剂ꎻ以乙腈﹣0 5%磷酸溶液(7ʒ93)为流动相ꎻ检测波长为326nmꎮ理论板数按绿原酸峰计算应不低于10000ꎮ。
国家药监局关于发布仿制药参比制剂目录(第三十五批)的通告-国家药品监督管理局公告2020年第92号

国家药监局关于发布仿制药参比制剂目录(第三十五批)的通告正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家药品监督管理局公告2020年第92号国家药监局关于发布仿制药参比制剂目录(第三十五批)的通告经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第三十五批)。
特此通告。
附件:仿制药参比制剂目录(第三十五批)国家药监局2020年12月29日附件仿制药参比制剂目录(第三十五批)序号药品通用名称英文名称/商品名规格持证商备注1备注235-1注射用六氟化硫微泡Sulfur Hexafluoride Microbubbles for Injection/ SonoVue(声诺维)59 mgBracco International B.V.国内上市的原研药品原研进口35-2注射用利培酮微球Risperidone for Depot Suspension/ Risperdal Consta25 mgJanssen-Cilag AG/Janssen Pharmaceutica N.V.国内上市的原研药品原研进口35-3注射用利培酮微球Risperidone for Depot Suspension/ Risperdal Consta37.5 mgJanssen-Cilag AG/Janssen Pharmaceutica N.V.国内上市的原研药品原研进口35-4注射用利培酮微球Risperidone for Depot Suspension/ Risperdal Consta 50 mgJanssen-Cilag AG/Janssen Pharmaceutica N.V.国内上市的原研药品原研进口35-5注射用利培酮微球Risperidone Long-acting Injection/ Risperdal Consta 12.5mgJanssen Pharmaceuticals, Inc.未进口原研药品美国橙皮书35-6注射用利培酮微球Risperidone Long-acting Injection/ Risperdal Consta 25 mgJanssen Pharmaceuticals, Inc.未进口原研药品美国橙皮书35-7注射用利培酮微球Risperidone Long-acting Injection/ Risperdal Consta 37.5 mgJanssen Pharmaceuticals, Inc.未进口原研药品美国橙皮书35-8利培酮微球Risperidone Long-acting Injection/ Risperdal Consta50 mgJanssen Pharmaceuticals, Inc.未进口原研药品美国橙皮书35-9注射用利培酮微球Risperidone powder and solvent for depot suspension for Injection/ Risperdal Consta 25 mgJanssen-Cilag GmbH未进口原研药品欧盟上市35-10注射用利培酮微球Risperidone powder and solvent for depot suspension for Injection/ Risperdal Consta 37.5 mgJanssen-Cilag GmbH未进口原研药品欧盟上市35-11注射用利培酮微球Risperidone powder and solvent for depot suspension for Injection/ Risperdal Consta 50 mgJanssen-Cilag GmbH未进口原研药品35-12普拉曲沙注射液Pralatrexate Injection/Folotyn20mg/mlAcrotechBiopharma LLC未进口原研药品美国橙皮书35-13酒石酸匹莫范色林片Pimavanserin Tartrate Tablets/Nuplazid 10mg(以匹莫范色林计)AcadiaPharmaceuticals Inc未进口原研药品美国橙皮书35-14注射用苯唑西林钠Oxacillin Sodium for Injection以C19H19N3O5S计1.0gSagentPharmaceuticals Inc国际公认的同种药品美国橙皮书35-15注射用苯唑西林钠Oxacillin Sodium for Injection以C19H19N3O5S计2.0gSagentPharmaceuticals Inc国际公认的同种药品美国橙皮书35-16盐酸去氧肾上腺素注射液Phenylephrine Hydrochloride Injection/Vazculep 10mg/mlAvaedl Legacy未进口原研药品美国橙皮书35-17小儿复方氨基酸注射液(20AA)Amino Acid Solution for Infusion/Primene10%(100ml/250ml)Baxter未进口原研药品欧盟上市35-18小儿复方氨基酸注射液(20AA)Amino Acid Intravenous Infusion/Primene10%(100ml/250ml)Baxter HealthcarePty Ltd未进口原研药品澳大利亚上市35-19琥珀酸呋罗曲坦片Frovatriptan Tablet/Isimig2.5mgMenarini International Operations Luxembourg SA未进口原研药品欧盟上市35-20间苯三酚口服冻干片Phloroglucinol Oral Lyophilisates/ Spasfon Lyoc160mgTeva Sante未进口原研药品欧盟上市35-21复方磺胺甲噁唑注射液Sulfamethoxazole and Trimethoprim Injection/Bactrim 5ml,磺胺甲噁唑80mg/ml,甲氧苄啶16mg/mlRoche S.p.A未进口原研药品欧盟上市35-22依托芬那酯凝胶Etofenamate Gel/Traumon5%(50g,100g)MEDA Manufacturing GmbH未进口原研药品欧盟上市35-23依托芬那酯凝胶Etofenamate Gel/Traumon10%(50g,100g)MEDA Manufacturing GmbH未进口原研药品欧盟上市35-24盐酸非索非那定干糖浆Fexofenadine Hydrochloride Dry Syrup/Allegra1g中含盐酸非索非那定50mgサノフィ株式会社(赛诺菲株式会社)未进口原研药品日本上市35-25甲基多巴片Methyldopa Tablets/Aldomet250mg株式会社ミノファーゲン製薬未进口原研药品日本上市35-26注射用盐酸罗沙替丁醋酸酯Roxatidine Acetate Hydrochloride For Injection/Altat 75mgあすか製薬株式会社未进口原研药品35-27瑞卢戈利片Relugolix Tablets/Relumina40mg武田药品工业株式会社/あすか制药株式会社未进口原研药品日本上市35-28拉考沙胺注射液Lacosamide Injection/Vimpat10mg/mlUCB Pharma S.A.国内上市的原研药品原研进口35-29注射用醋酸卡泊芬净Caspofungin Acetate for Injection/Cancidas 50mgMerck and Co INC未进口原研药品美国橙皮书35-30注射用醋酸卡泊芬净Caspofungin Acetate for Injection/Cancidas 70mgMerck and Co INC未进口原研药品35-31注射用唑来膦酸浓溶液Zoledronic Acid Concentrated Solution for Injection/Zometa 5ml:4mgNovartis Pharmaceuticals Corp未进口原研药品美国橙皮书35-32盐酸多塞平片Doxepin Hydrochloride Tablets /Silenor6mgCurrax Pharmaceuticals LLC未进口原研药品美国橙皮书35-33氯氮平片Clozapine Tablets/Clozaril0.1gHeritage Life Sciences Barbados INC未进口原研药品美国橙皮书35-34麦考酚钠肠溶片Mycophenolate Sodium Enteric-coated tablets/Myfortic180mgNovartis Pharmaceuticals Corporation未进口原研药品美国橙皮书35-35盐酸二甲双胍缓释片Metformin Hydrochloride Extended-release Tablets/Fortamet 1gAndrx Labs LLC未进口原研药品美国橙皮书35-36司来帕格片Selexipag Tablets/ Uptravi0.4mgJanssen-Cilag International NV未进口原研药品欧盟上市35-37左氧氟沙星氯化钠注射液Levofloxacin and Sodium Chloride Injection /Tavanic50ml:250mgSanofi-Aventis Deutschland GmbH未进口原研药品德国上市35-38托拉塞米片Torasemide Tablets /Unat5mgMEDA Pharma GmbH & Co. KG未进口原研药品德国上市35-39紫杉醇注射液Paclitaxel Injection/Taxol16.7ml:100mgBristol-Myers Squibb S.R.L.未进口原研药品瑞士上市35-40氨甲环酸注射液Tranexamic Acid Injection/Transamin 5%(5ml:0.25g)第一三共株式会社未进口原研药品日本上市35-41氨甲环酸注射液Tranexamic Acid Injection/Transamin 10%(2.5ml:0.25g、10ml:1g)第一三共株式会社未进口原研药品日本上市35-42氨甲环酸注射液Tranexamic Acid Injection/Cyklokapron 5ml:0.5g、10ml:1gPfizer未进口原研药品欧盟上市35-43氨甲环酸注射液Tranexamic Acid Injection/Cyklokapron 10ml:1gPharmacia and Upjohn Co未进口原研药品美国橙皮书8-88利巴韦林片Ribavirin Tablets/Copegus0.2gRoche Products Limited/Roche S.p.A/Roche Pharma AG欧盟上市增加持证商Roche S.p.A/Roche Pharma AG;不限定产地8-179盐酸替扎尼定片Tizanidine Hydrochloride Tablets /Sirdalud2mgNovartis Pharma GmbH欧盟上市修订,不限定产地8-147硝苯地平控释片Nifedipine Controlled-release Tablets/Adalat 30mgBayer Pharma AG /Bayer AG原研进口持证商变更,增加变更后持证商Bayer AG8-236硝苯地平控释片Nifedipine Controlled-release Tablets/Adalat60mgBayer Pharma AG /Bayer AG原研进口持证商变更,增加变更后持证商Bayer AG22-40丙戊酸钠注射用浓溶液Sodium Valproate Concentrated Solution for Injection /Depacon5ml:500mgABBVIE INC未进口原研药品修订药品通用名称及英文名称为丙戊酸钠注射用浓溶液及Sodium Valproate Concentrated Solution for Injection23-334丙戊酸钠注射用浓溶液Sodium Valproate Concentrated Solution for Injection /Orfiril3ml:300mgDesitin Arzneimittel GmbH修订药品通用名称及英文名称为丙戊酸钠注射用浓溶液及Sodium Valproate Concentrated Solution for Injection23-335丙戊酸钠注射用浓溶液Sodium Valproate Concentrated Solution for Injection /Orfiril10ml:1gDesitin Arzneimittel GmbH修订药品通用名称及英文名称为丙戊酸钠注射用浓溶液及Sodium Valproate Concentrated Solution for Injection26-15丙戊酸钠注射用浓溶液Sodium Valproate Concentrated Solution for Injection /Ergenyl100mg/ml(以丙戊酸钠计)(4ml)Sanofi-Aventis Deutschland GmbH修订药品通用名称及英文名称为丙戊酸钠注射用浓溶液及Sodium Valproate Concentrated Solution for Injection29-85丙戊酸钠注射用浓溶液Sodium Valproate Concentrated Solution for Injection100mg/ml(以丙戊酸计)(5ml)Hikma Farmaceutica (Portugal)SA国际公认的同种药品修订药品通用名称及英文名称为丙戊酸钠注射用浓溶液及Sodium Valproate Concentrated Solution for Injection30-147ω-3鱼油中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液ω-3 Fish Oil Medium and Long Chain Fat Emulsion/Amino Acids(16)/Glucose(36%)Injection 1250ml、1875ml、2500mlB. Braun Melsungen AG未进口原研药品修订,不限定商品名31-96ω-3鱼油中长链脂肪乳/氨基酸(16)/葡萄糖(36%)注射液ω-3 Fish Oil Medium and Long Chain Fat Emulsion/Amino Acids (16)/Glucose(36%)Injection 625mlB. Braun Melsungen AG未进口原研药品修订,不限定商品名32-65盐酸法舒地尔注射液Fasudil Hydrochloride Injection/Eril2ml:30mgAsahi Kasei Pharma Corporation未进口原研药品修订持证商为Asahi Kasei Pharma Corporation备注1.未在国内上市品种,需参照原总局2015年第230号公告等的相关要求开展研究,通用名、剂型等经药典委核准后为准。
《中国药典》2020版—聚山梨酯85—羟丙甲纤维素国家药用辅料标准

附件:聚山梨酯85Jushanlizhi 85Polysorbate 85本品系油酸山梨坦和环氧乙烷聚合而成的聚氧乙烯20三油酸山梨坦。
【性状】本品为黄色透明油状液体。
本品在乙醇、三氯甲烷、甲醇和丙酮中易溶,在水中极微溶解。
相对密度本品的相对密度(通则0601)在25℃为1.01~1.04。
黏度本品的黏度(通则0633 第一法),在25℃时为240~340mm2/s。
酸值本品的酸值(通则0713)不得过2.0。
皂化值本品的皂化值(通则0713)为80~95。
羟值本品的羟值(通则0713)为40~55。
碘值本品的碘值(通则0713)为30~45。
过氧化值本品的过氧化值(通则0713)不得过5。
【鉴别】(1)取本品的水溶液(1→20)5ml,加氢氧化钠试液5ml,煮沸数分钟,放冷,用稀盐酸酸化,显乳白色浑浊。
(2)取本品的水溶液(1→20),滴加溴试液,溴试液即褪色。
(3)取本品6ml,加水4ml混匀,呈胶状物。
(4)取本品的水溶液(1→20)10ml,加硫氰酸钴铵溶液(取硫氰酸铵17.4g与硝酸钴2.8g,加水溶解成100ml)5ml, 混匀,再加三氯甲烷5ml,振摇、混合,静置后,三氯甲烷层显蓝色。
【检查】酸碱度取本品0.50g,加水10ml溶解后,依法测定(通则0631),pH 值应为5.0~7.5。
颜色取本品10ml,与同体积的对照液(取比色用重铬酸钾液8.0ml与比色用氯化钴液0.8ml,加水至10ml)比较,不得更深。
乙二醇、二甘醇和三甘醇取本品约4g,精密称定,置100ml量瓶中,精密加入内标溶液(取1,3-丁二醇适量,用无水乙醇稀释制成每1ml中约含4mg的溶液)1.0ml,加无水乙醇稀释至刻度,摇匀,作为供试品溶液;另取乙二醇、二甘醇和三甘醇对照品适量, 精密称定,加无水乙醇稀释配制成每1ml含乙二醇、二甘醇、三甘醇各4mg 的溶液,再精密量取该溶液1.0ml,置100ml量瓶中,精密加入内标溶液1.0ml,加无水乙醇稀释至刻度,摇匀,作为对照品溶液。
2020版药典新增及变化全汇总

新增制剂:116个,具体清单如下:
二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
2020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
65.枸橼酸坦度螺酮
66.枸橼酸坦度螺酮胶囊
67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]
68.枸橡酸钾颗粒
69.氟尿苷(曾用名:氟脲苷)
70.复方氨基酸(15)双肽(2)注射液
71.美司钠
72.美司钠注射液
73.盐酸乙哌立松
48.更昔洛韦胶囊
49.来曲唑
50.来曲唑片
51.吲哚美辛片
52.佐米曲普坦分散片
53.阿托伐他汀钙
54.阿利沙坦酯
55.阿利沙坦酯片
56.阿那曲唑片
57.苯磺酸左氨氯地平
58.苯磺酸左氨氯地平片
59.拉西地平
60.拉西地平片
61.依巴斯汀
62.依巴斯汀片
63.草酸艾司西酞普兰
64.草酸艾司西酞普兰片
2020药典(一 ~ 四部),新增、变化全汇总!

020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
新增了药材:裸花紫珠。
新增制剂:116个,具体清单如下:二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
在药品有效性控制方面,要求将药品质量和疗效一致性评价的成果体现在相关制剂的质量标准提高中,进一步完善了常规固体制剂溶出及释放度检测方法,且在整体质量控制方面进一步借鉴国际要求。
2020年版药典二部新增品种(117个),与一部新增品种居然一样!未收载品种(8个),名称变化的品种(5个)。
具体清单如下:未收载品种(8个)本版药典(二部)未收载2015年版药典(二部)中的品种名单:•鱼肝油•重组人生长激素•注射用重组人生长激素•重组人胰岛素•重组人胰岛素注射液•精蛋白重组人胰岛素注射液•盐酸吡硫醇注射液•注射用盐酸吡硫醇新增品种(117个)本版药典(二部)新增品种名单:1.注射用门冬氨酸鸟氨酸2.马来酸氟伏沙明3.马来酸氟伏沙明片4.扎来普隆5.乌苯美司片6.丙戊酸钠缓释片(I)7.丙泊酚乳状注射液(曾用名:丙泊酚注射液)8.丙酸氟替卡松9.左卡尼汀10.左甲状腺素钠11.左甲状腺素钠片12.右佐匹克隆13.右佐匹克隆片14.卡培他滨15.卡培他滨片16.甲钴胺片17.甲钴胺注射液18.甲磺酸多沙唑嗪19.甲磺酸多沙唑嗪片20.甲磺酸多沙唑嗪胶囊21.甲磺酸瑞波西汀22.甲磺酸瑞波西汀片23.甲磺酸瑞波西汀胶囊24.兰索拉唑肠溶胶囊25.矛头蝮蛇血凝酶(曾用名:蛇毒血凝酶、血凝酶)26.注射用矛头蝮蛇血凝酶(曾用名:注射用蛇毒血凝酶、注射用血凝酶)27.地红霉素肠溶片28.地红霉素肠溶胶囊29.西尼地平胶囊30.西吡氯铵31.西吡氯铵含漱液32.西咪替丁注射液33.西洛他唑片34.托拉塞米35.托拉塞米片36.托拉塞米胶囊37.注射用托拉塞米38.吗替麦考酚酯分散片39.伏格列波糖40.伏格列波糖片41.伏格列波糖胶囊42.米氮平43.米氮平片44.那他霉素45.那他霉素滴眼液46.坎地沙坦酯片47.克霉唑阴道膨胀栓[曾用名:克霉唑栓(指含膨胀棉条的克霉唑栓)]48.更昔洛韦胶囊49.来曲唑50.来曲唑片51.吲哚美辛片52.佐米曲普坦分散片53.阿托伐他汀钙54.阿利沙坦酯55.阿利沙坦酯片56.阿那曲唑片57.苯磺酸左氨氯地平58.苯磺酸左氨氯地平片59.拉西地平60.拉西地平片61.依巴斯汀62.依巴斯汀片63.草酸艾司西酞普兰64.草酸艾司西酞普兰片65.枸橼酸坦度螺酮66.枸橼酸坦度螺酮胶囊67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]68.枸橡酸钾颗粒69.氟尿苷(曾用名:氟脲苷)70.复方氨基酸(15)双肽(2)注射液71.美司钠72.美司钠注射液73.盐酸乙哌立松74.盐酸乙哌立松片75.盐酸左布比卡因76.盐酸左布比卡因注射液77.盐酸托烷司琼片78.盐酸托烷司琼胶囊79.盐酸曲普利啶80.盐酸伊达比星81.注射用盐酸伊达比星82.盐酸奈福泮胶囊83.盐酸度洛西汀84.盐酸度洛西汀肠溶片85.盐酸度洛西汀肠溶胶囊86.盐酸羟甲唑啉87.盐酸羟甲唑啉喷雾剂88.盐酸羟甲唑啉喷鼻液89.盐酸羟苄唑90.盐酸羟苄唑滴眼液(曾用名:羟苄唑滴眼液)91.盐酸奥布卡因92.盐酸奥布卡因滴眼液93.氨糖美辛肠溶片94.氨糖美辛肠溶胶囊95.脂肪乳注射液(C14~24)(曾用名:脂肪乳注射液)96.酒石酸溴莫尼定97.酒石酸溴莫尼定滴眼液98.酚磺乙胺99.注射用酚磺乙胺100.铝碳酸镁101.铝碳酸镁咀嚼片102.葡萄糖酸钙氯化钠注射液103.硝酸益康唑阴道膨胀栓[曾用名:硝酸益康唑栓(指含膨胀棉条的硝酸益康唑栓)] 104.氯沙坦钾105.氯沙坦钾片106.氯沙坦钾胶囊107.酮咯酸氨丁三醇108.酮咯酸氨丁三醇注射液109.腺苷110.腺苷注射液[曾用名:腺苷注射液(供诊断用)]111.去氨加压素片(曾用名:醋酸去氨加压素片)112.注射用去氨加压素(曾用名:注射用醋酸去氨加压素)113.磷酸氟达拉滨114.注射用磷酸氟达拉滨115.磷酸腺嘌呤(曾用名:维生素b4)116.磷酸腺嘌呤片(曾用名:维生B4片)117.碘帕醇注射液三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。
甘精胰岛素的质量标准

甘精胰岛素的质量标准甘精胰岛素是一种常用的胰岛素制剂,被广泛用于治疗糖尿病。
作为一种重要的药物,甘精胰岛素需要符合一定的质量标准,以确保其安全性、有效性和稳定性。
以下是关于甘精胰岛素质量标准的详细说明。
1.药品名称和规格:甘精胰岛素应在药品包装上明确标注药品名称和规格,以便患者正确使用。
常见的规格有U40、U100等,表示每毫升溶液中含有的胰岛素单位数。
2.外观性状:甘精胰岛素应呈无色或微黄色透明液体。
外观应清澈,不得有悬浮物或沉淀物存在。
3.胰岛素单位含量:甘精胰岛素的胰岛素单位含量是指每毫升溶液中所含的胰岛素单位数。
该值应与药品包装上标注的规格相一致,并符合相关药典标准。
4.pH值:甘精胰岛素的pH值应在一定范围内,通常为5.0-7.5。
过高或过低的pH值可能影响胰岛素的稳定性和活性。
5.结晶度:甘精胰岛素的结晶度应符合相关药典标准。
结晶度是指药物中结晶形态和结晶大小的特征,对药物的溶解度和吸收速度等性质具有重要影响。
6.含水量:甘精胰岛素的含水量应符合相关药典标准。
过高的含水量可能导致药物的稳定性下降,而过低的含水量可能导致药物的结晶度增加,影响其可溶性和吸收性。
7.溶解度:甘精胰岛素的溶解度应符合相关药典标准。
药物的溶解度对其在体内的吸收和生物利用度具有重要影响。
8.活性:甘精胰岛素的活性是指其刺激葡萄糖摄取和代谢的能力。
甘精胰岛素的活性应符合相关药典标准,并经过严格的活性测定验证。
9.纯度:甘精胰岛素的纯度应符合相关药典标准。
包括胰岛素的主要成分含量、杂质含量等方面的检验。
10.稳定性:甘精胰岛素的稳定性是指在规定条件下,药物贮存期间保持活性和质量的能力。
药品应经过一系列的稳定性试验,包括温度、湿度、光照等条件下的稳定性评价。
总结起来,甘精胰岛素的质量标准涵盖了药品的外观性状、胰岛素单位含量、pH值、结晶度、含水量、溶解度、活性、纯度和稳定性等多个方面。
这些标准的制定旨在确保甘精胰岛素的质量稳定、活性可靠,并符合临床使用的要求。
赛益宁 甘精胰岛素利司那肽注射液(Ⅰ)说明书

核准日期:2023年01月10日修改日期:2023 年02 月15 日甘精胰岛素利司那肽注射液(Ⅰ)说明书请仔细阅读说明书并在医师或药师指导下使用【药品名称】通用名称:甘精胰岛素利司那肽注射液(Ⅰ)商品名称:赛益宁/SOLIQUA英文名称:Insulin Glargine and Lixisenatide Injection(Ⅰ)汉语拼音:Ganjing Yidaosu Lisinatai Zhusheye(Ⅰ)【成份】*和利司那肽。
本品为复方制剂,其活性成份为甘精胰岛素每支注射笔含有:300单位甘精胰岛素和300 μg利司那肽*甘精胰岛素由大肠埃希菌通过重组DNA技术生产。
辅料:85%甘油,甲硫氨酸,间甲酚(抑菌剂,0.27%),氯化锌,盐酸(pH 调节剂),氢氧化钠(pH调节剂),注射用水【性状】应为无色至几乎无色的澄明溶液。
【适应症】本品适用于血糖控制不佳的成人2型糖尿病患者,在饮食和运动基础上联合其他口服降糖药物,改善血糖控制。
【规格】预填充笔,3ml:300单位甘精胰岛素+ 300 μg利司那肽【用法用量】本品现有两种注射笔可供选用,分别提供不同的剂量范围:•甘精胰岛素利司那肽注射液(Ⅰ):预填充笔,3ml:300单位甘精胰岛素+ 300 μg利司那肽(1:1注射笔)-本品1剂量单位包含1单位的甘精胰岛素和1 μg的利司那肽-使用本品每日注射5-20剂量单位(甘精胰岛素5-20单位/利司那肽5-20 μg)•甘精胰岛素利司那肽注射液(Ⅱ):预填充笔,3ml:300单位甘精胰岛素+ 150 μg利司那肽(2:1注射笔)-本品1剂量单位包含1单位的甘精胰岛素和0.5 μg的利司那肽-使用本品每日注射10-40剂量单位(甘精胰岛素10-40单位/利司那肽5-20 μg)为避免用药错误,处方医生需确保处方上清晰标注正确的甘精胰岛素利司那肽注射液(Ⅰ)(1:1注射笔,5-20剂量单位)或甘精胰岛素利司那肽注射液(Ⅱ)(2:1注射笔,10-40剂量单位)以及正确的注射剂量(见【注意事项】)。
《中国药典》2020版—Plist121 中文通用名公示稿
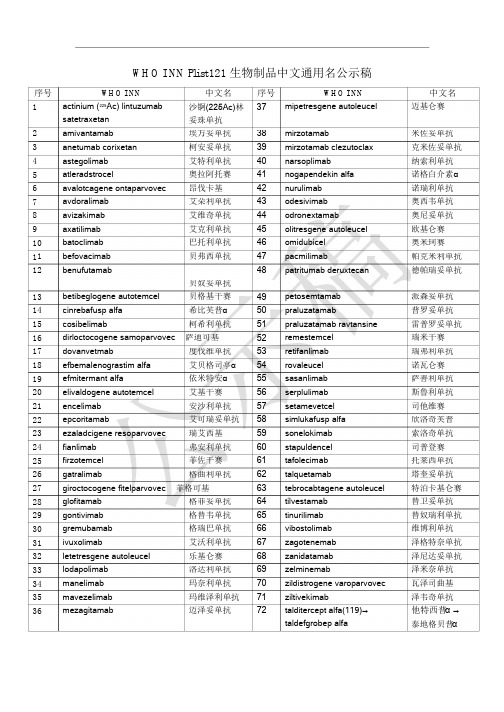
W H O IN N P l i s t121 生物制品中文通用名公示稿序号W H O IN Nactinium (225Ac) lintuzumabsatetraxetan 中文名序号W H O IN N中文名迈基仑赛1 沙锕(225Ac)林37 mipetresgene autoleucel妥珠单抗2 3 4 5 6 7 8 9 1 1 1 amivantamab 埃万妥单抗柯安妥单抗艾特利单抗奥拉阿托赛昂伐卡基3839404142434445464748mirzotamab 米佐妥单抗克米佐妥单抗纳索利单抗诺格白介素α诺瑞利单抗奥西韦单抗奥尼妥单抗欧基仑赛anetumab corixetanastegolimabmirzotamab clezutoclaxnarsoplimabatleradstrocelavalotcagene ontaparvovecavdoralimabnogapendekin alfanurulimab艾朵利单抗艾维奇单抗艾克利单抗巴托利单抗贝弗西单抗odesivimabavizakimab odronextamabaxatilimab olitresgene autoleucelomidubicel0 1 2 batoclimab 奥米珂赛befovacimab pacmilimab 帕克米利单抗德帕瑞妥单抗benufutamab patritumab deruxtecan贝奴妥单抗贝格基干赛希比芙普α柯希利单抗131415161718192021222324252627282930313233343536 betibeglogene autotemcelcinrebafusp alfacosibelimab495051525354555657585960616263646566676869707172petosemtamab 派森妥单抗普罗妥单抗雷普罗妥单抗瑞米干赛praluzatamabpraluzatamab ravtansineremestemceldirloctocogene samoparvovec 萨迪可基dovanvetmab 度伐维单抗艾贝格司亭α依米特安α艾基干赛retifanlimab 瑞弗利单抗诺瓦仑赛efbemalenograstim alfaefmitermant alfaelivaldogene autotemcelencelimabrovaleucelsasanlimab 萨善利单抗斯鲁利单抗司他维赛serplulimab安沙利单抗艾可瑞妥单抗瑞艾西基setamevetcelepcoritamab simlukafusp alfasonelokimab欣洛奇芙普索洛奇单抗司普登赛ezaladcigene resoparvovecfianlimab 弗安利单抗菲佐干赛stapuldencelfirzotemcel tafolecimab 托莱西单抗塔奎妥单抗特泊卡基仑赛替卫妥单抗替奴瑞利单抗维博利单抗泽格特奈单抗泽尼达妥单抗泽米奈单抗瓦泽司曲基泽韦奇单抗他特西普α→泰地格贝普αgatralimab 格曲利单抗talquetamabgiroctocogene fitelparvovec 菲格可基tebrocabtagene autoleuceltilvestamabglofitamab 格菲妥单抗格替韦单抗格瑞巴单抗艾沃利单抗乐基仑赛gontivimab tinurilimabgremubamab vibostolimabivuxolimab zagotenemabletetresgene autoleucellodapolimabmanelimabzanidatamab洛达利单抗玛奈利单抗玛维泽利单抗迈泽妥单抗zelminemabzildistrogene varoparvovecziltivekimabmavezelimabmezagitamab talditercept alfa(119)→taldefgrobep alfa。
2020年版《中国药典》目录三部

附件32020年版《中国药典》目录三部目录生物制品通则目次1生物制品通用名称命名原则2生物制品生产用原材料及辅料质量控制3生物制品生产检定用菌毒种管理及质量控制4生物制品生产检定用动物细胞基质制备及质量控制5血液制品生产用人血浆6生物制品国家标准物质制备和标定7生物制品病毒安全性控制8生物制品分包装及贮运管理总论目次9人用疫苗总论10人用重组DNA蛋白制品总论11人用重组单克隆抗体制品总论12人用聚乙二醇化重组蛋白及多肽制品总论13人用基因治疗制品总论14螨变应原制品总论15人用马免疫血清制品总论16微生态活菌制品总论各论目次Ⅰ预防类17伤寒疫苗18伤寒甲型副伤寒联合疫苗19伤寒甲型乙型副伤寒联合疫苗20伤寒Vi多糖疫苗21重组B亚单位/菌体霍乱疫苗(肠溶胶囊)22A群脑膜炎球菌多糖疫苗23A群C群脑膜炎球菌多糖疫苗24A群C群脑膜炎球菌多糖结合疫苗25ACYW135群脑膜炎球菌多糖疫苗2623价肺炎球菌多糖疫苗27b型流感嗜血杆菌结合疫苗28吸附白喉疫苗29吸附白喉疫苗(成人及青少年用)30吸附破伤风疫苗31吸附白喉破伤风联合疫苗32吸附白喉破伤风联合疫苗(成人及青少年用)33吸附百日咳白喉联合疫苗34吸附百白破联合疫苗35吸附无细胞百白破联合疫苗36无细胞百白破b型流感嗜血杆菌联合疫苗37皮上划痕用鼠疫活疫苗38皮上划痕人用炭疽活疫苗39皮上划痕人用布氏菌活疫苗40皮内注射用卡介苗41钩端螺旋体疫苗42乙型脑炎减毒活疫苗43冻干乙型脑炎灭活疫苗(Vero细胞)44森林脑炎灭活疫苗45双价肾综合征出血热灭活疫苗(Vero细胞)46双价肾综合征出血热灭活疫苗(地鼠肾细胞)47双价肾综合征出血热灭活疫苗(沙鼠肾细胞)48黄热减毒活疫苗49冻干人用狂犬病疫苗(Vero细胞)50冻干人用狂犬病疫苗(人二倍体细胞)51冻干甲型肝炎减毒活疫苗52甲型肝炎灭活疫苗(人二倍体细胞)53重组乙型肝炎疫苗(酿酒酵母)54重组乙型肝炎疫苗(汉逊酵母)55重组乙型肝炎疫苗(CHO细胞)56甲型乙型肝炎联合疫苗57麻疹减毒活疫苗58腮腺炎减毒活疫苗59风疹减毒活疫苗(人二倍体细胞)60水痘减毒活疫苗61麻疹腮腺炎联合减毒活疫苗62麻疹风疹联合减毒活疫苗63麻腮风联合减毒活疫苗64流感全病毒灭活疫苗65流感病毒裂解疫苗66口服脊髓灰质炎减毒活疫苗(猴肾细胞)67脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞)68脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)69Sabin株脊髓灰质炎灭活疫苗(Vero细胞)70口服Ⅰ型Ⅲ型脊髓灰质炎减毒活疫苗(人二倍体细胞)Ⅱ治疗类71白喉抗毒素72冻干白喉抗毒素73破伤风抗毒素74冻干破伤风抗毒素75马破伤风免疫球蛋白F(ab')2 76多价气性坏疽抗毒素77冻干多价气性坏疽抗毒素78肉毒抗毒素79冻干肉毒抗毒素80抗蝮蛇毒血清81冻干抗蝮蛇毒血清82抗五步蛇毒血清83冻干抗五步蛇毒血清84抗银环蛇毒血清85冻干抗银环蛇毒血清86抗眼镜蛇毒血清87冻干抗眼镜蛇毒血清88抗炭疽血清89抗狂犬病血清90人血白蛋白91冻干人血白蛋白92人免疫球蛋白93冻干人免疫球蛋白94乙型肝炎人免疫球蛋白95冻干乙型肝炎人免疫球蛋白96静注乙型肝炎人免疫球蛋白(pH4)97冻干静注乙型肝炎人免疫球蛋白(pH4)98狂犬病人免疫球蛋白99冻干狂犬病人免疫球蛋白100破伤风人免疫球蛋白101冻干破伤风人免疫球蛋白102静注人免疫球蛋白(pH4)103冻干静注人免疫球蛋白(pH4)104人凝血因子Ⅷ105人纤维蛋白原106人纤维蛋白粘合剂107人凝血酶108人凝血酶原复合物109抗人T细胞猪免疫球蛋白110抗人T细胞兔免疫球蛋白111注射用人促红素112人促红素注射液113注射用人干扰素α1b114人干扰素α1b注射液115人干扰素α1b滴眼液116注射用人干扰素α2a117人干扰素α2a注射液118人干扰素α2a栓119注射用人干扰素α2b120人干扰素α2b注射液121人干扰素α2b滴眼液122人干扰素α2b栓123人干扰素α2b乳膏124人干扰素α2b凝胶125人干扰素α2b喷雾剂126人干扰素α2b软膏127人干扰素α2b阴道泡腾片128注射用人干扰素γ129注射用人白介素-2130人白介素-2注射液131注射用人白介素-2(Ⅰ)132注射用人白介素-11133人粒细胞刺激因子注射液134注射用人粒细胞巨噬细胞刺激因子135外用人粒细胞巨噬细胞刺激因子凝胶136牛碱性成纤维细胞生长因子外用溶液137外用牛碱性成纤维细胞生长因子138牛碱性成纤维细胞生长因子凝胶139牛碱性成纤维细胞生长因子滴眼液140外用人表皮生长因子141人表皮生长因子外用溶液(Ⅰ)142人表皮生长因子凝胶143人表皮生长因子滴眼液144尼妥珠单抗注射液145康柏西普眼用注射液146人胰岛素147人胰岛素注射液148精蛋白人胰岛素注射液149精蛋白人胰岛素混合注射液(30R)150精蛋白人胰岛素混合注射液(50R)151甘精胰岛素152甘精胰岛素注射液153赖脯胰岛素154赖脯胰岛素注射液155注射用人生长激素156注射用鼠神经生长因子157注射用A型肉毒毒素158治疗用卡介苗Ⅲ体内诊断类159结核菌素纯蛋白衍生物160卡介菌纯蛋白衍生物161布氏菌纯蛋白衍生物162锡克试验毒素Ⅳ体外诊断类163乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)164丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)165人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)166人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)167乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒Ⅰ型核酸检测试剂盒168梅毒螺旋体抗体诊断试剂盒(酶联免疫法)169抗A抗B血型定型试剂(单克隆抗体)通则和指导原则制剂通则1片剂2注射剂3胶囊剂4颗粒剂5眼用制剂6鼻用制剂7栓剂8软膏剂乳膏剂9喷雾剂10凝胶剂11散剂12涂剂分光光度法13紫外-可见分光光度法14荧光分光光度法15原子吸收分光光度法16火焰光度法色谱法17纸色谱法18高效液相色谱法19离子色谱法20分子排阻色谱法21气相色谱法电泳法22电泳法23毛细管电泳法物理检查法24pH值测定法25渗透压摩尔浓度测定法26溶液颜色检查法27澄清度检查法28不溶性微粒检查法29可见异物检查法30崩解时限检查法31融变时限检查法32片剂脆碎度检查法33最低装量检查法34粒度和粒度分布测定法含量测定法35氮测定法36蛋白质含量测定法37干燥失重测定法38固体总量测定法39唾液酸测定法40磷测定法41硫酸铵测定法42亚硫酸氢钠测定法43氢氧化铝(或磷酸铝)测定法44氯化钠测定法45枸橼酸离子测定法46钾离子测定法47钠离子测定法48辛酸钠测定法49乙酰色氨酸测定法50苯酚测定法51间甲酚测定法52硫柳汞测定法53对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法54O-乙酰基测定法55已二酰肼含量测定法56高分子结合物含量测定法57人血液制品中糖及糖醇测定法58人血白蛋白多聚体测定法59人免疫球蛋白类制品lgG单体加二聚体测定法60人免疫球蛋白中甘氨酸含量测定法61人粒细胞刺激因子蛋白质含量测定法62组胺人免疫球蛋白中游离磷酸组胺测定法63lgG含量测定法64单抗分子大小变异体测定法65抗毒素/抗血清制品分子大小分布测定法66单抗电荷变异体测定法67单抗N糖谱测定法化学残留物测定法68氰化物检查法69水分测定法70炽灼残渣检查法71残留溶剂测定法72乙醇残留量测定法73聚乙二醇残留量测定法74聚山梨酯80残留量测定法75戊二醛残留量测定法76磷酸三丁酯残留量测定法77碳二亚胺残留量测定法78游离甲醛测定法79人血白蛋白铝残留量测定法80羟胺残留量测定法微生物检查法81无菌检查法82非无菌产品微生物限度检查:微生物计数法83非无菌产品微生物限度检查:控制菌检查法84非无菌药品微生物限度标准85抑菌效力检查法86异常毒性检查法87热原检查法88细菌内毒素检查法89支原体检查法90外源病毒因子检查法91鼠源性病毒检查法92SV40核酸序列检查法93猴体神经毒力试验94血液制品生产用人血浆病毒核酸检测技术要求95黄热减毒活疫苗猴体试验96禽源性病毒荧光定量PCR(Q-PCR)检查法生物测定法97免疫印迹法98免疫斑点法99免疫双扩散法100免疫电泳法101肽图检查法102质粒丢失率检查法103外源性DNA残留量测定法104抗生素残留量检查法105激肽释放酶原激活剂测定法106抗补体活性测定法107牛血清白蛋白残留量测定法108大肠埃希菌菌体蛋白质残留量检测法109假单胞菌菌体蛋白质残留量测定法110酵母工程菌菌体蛋白质残留量测定法111类A血型物质测定法112鼠lgG残留量测定法113无细胞百日咳疫苗鉴别试验114抗毒素、抗血清制品鉴别试验115A群脑膜炎球菌多糖分子大小测定法116伤寒Vi多糖分子大小测定法117b型流感嗜血杆菌结合疫苗多糖含量测定法118人凝血酶活性检查法119活化的凝血因子活性检查法120肝素含量测定法121抗A、抗B血凝素测定法122人红细胞抗体测定法123人血小板抗体测定法124人免疫球蛋白类制品lgA残留量测定法125免疫化学法生物活性/效价测定法126胰岛素生物测定法127生长激素生物测定法128重组乙型肝炎疫苗(酵母)体外相对效力检查法129甲型肝炎灭活疫苗体外相对效力检查法130人用狂犬病疫苗效价测定法131吸附破伤风疫苗效价测定法132吸附白喉疫苗效价测定法133类毒素絮状单位测定法134白喉抗毒素效价测定法135破伤风抗毒素效价测定法136气性坏疽抗毒素效价测定法137肉素抗毒素效价测定法138抗蛇毒血清效价测定法139狂犬病免疫球蛋白效价测定法140人免疫球蛋白中白喉抗体效价测定法141人免疫球蛋白Fc段生物学活性测定法142抗人T细胞免疫球蛋白效价测定法(E玫瑰花环形成抑制试验)143抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验)144人凝血因子Ⅱ效价测定法145人凝血因子Ⅶ效价测定法146人凝血因子Ⅸ效价测定法147人凝血因子Ⅹ效价测定法148人凝血因子Ⅷ效价测定法149人促红素体内生物学活性测定法150干扰素生物学活性测定法151人白介素-2生物学活性测定法152人粒细胞刺激因子生物学活性测定法153人粒细胞巨噬细胞刺激因子生物学活性测定法154牛碱性成纤维细胞生长因子生物学活性测定法155人表皮生长因子生物学活性测定法156鼠神经生长因子生物学活性测定法157尼妥珠单抗生物学活性测定法158人白介素-11生物学活性测定法159A型肉毒毒素效价测定法160Sabin株脊髓灰质炎灭活疫苗效力试验161康柏西普生物学活性测定法特定生物原材料/动物及辅料162生物制品生产及检定用实验动物质量控制163重组胰蛋白酶164新生牛血清165细菌生化反应培养基166氢氧化铝佐剂试剂试液标准品167试药168试液169试纸170缓冲液171指示剂与指示液172滴定液173生物制品国家标准物质目录其他174灭菌法175生物检定统计法指导原则176分析方法验证指导原则177药品微生物检验替代方法验证指导原则178药品微生物实验室质量管理指导原则179生物制品生物活性/效价测定方法验证指导原则180生物制品稳定性实验指导原则生物制品术语附表181原子量表。
甘精胰岛素肽图分析方法研究

甘精胰岛素肽图分析方法研究王绿音;杨慧敏;李晶;张慧;李懿;张伟;梁成罡【期刊名称】《生物技术通讯》【年(卷),期】2018(029)005【摘要】目的:探索并确定甘精胰岛素的最佳酶解条件,建立酶解更完全、特异性更强的甘精胰岛素肽图分析方法.方法:采用0.4 mol/L Tris-HCl(pH9.0)溶液作为酶解缓冲液,V8蛋白酶与甘精胰岛素之比为1 U:10 μg,于37℃反应1h后加入磷酸终止反应,采用RP-HPLC分离目标肽段,采用液相色谱-质谱联用(LC-MS)方法鉴定酶解产生的肽段.结果:甘精胰岛素基本完全酶解,未消化的主成分较《欧洲药典》9.5版(EP9.5)方法大幅减少,时间缩短了1/2,酶解的完全性与有效性大幅提高.产生的4个目标肽段可通过RP-HPLC清晰呈现并有效分离,肽段Ⅱ和Ⅲ的分离度大于25.0,拖尾因子均小于1.5,且各肽段与对照品的相对保留时间在1.00±0.01范围内.4个目标肽段和2个非特异肽段均由质谱鉴定出.较好地克服了现行EP9.5甘精胰岛素分析方法酶解反应的完全性较差、非特异酶解肽段含量较高、理论目标肽段Ⅳ及Ⅰ含量过低等不利于表征目标肽段并确证其氨基酸序列正确性的缺陷.选取B32脱精氨酸甘精胰岛素评价方法的专属性,证实本方法专属性良好;6次重复测定各肽段的保留时间及峰面积的RSD为0.05%~0.20%,考察不同实验人员在不同时间处理样品得到结果的变异程度,RSD为0.01%~0.36%,表明方法的中间精密度较好.V8酶量为15~25 U、柱温为38~42℃、采用3个不同厂家的色谱柱时测定的相对保留时间的RSD为0.12%~0.26%,表明方法的耐用性较好.酶解后的样品于6℃存放24 h及-20℃储存7d,稳定性较好.结论:实现了甘精胰岛素主成分的高效特异酶解及目标肽段的有效分离,该方法专属性、重复性、中间精密度及耐用性均表现良好,可用于甘精胰岛素的结构确证及专属性鉴别.【总页数】10页(P667-676)【作者】王绿音;杨慧敏;李晶;张慧;李懿;张伟;梁成罡【作者单位】中国食品药品检定研究院,北京102629;中国药科大学生命科学与技术学院,江苏南京210009;中国食品药品检定研究院,北京102629;中国食品药品检定研究院,北京102629;中国食品药品检定研究院,北京102629;中国食品药品检定研究院,北京102629;中国食品药品检定研究院,北京102629;中国药科大学生命科学与技术学院,江苏南京210009【正文语种】中文【中图分类】R932【相关文献】1.重组人促卵泡激素(rhFSH)肽图分析方法研究 [J], 梁成罡;沈舒;杨化新2.甘精胰岛素与磷酸西格列汀二联疗法对老年T2DM患者糖代谢及空腹C肽和餐后2hC肽的影响分析 [J], 金洁如3.甘精胰岛素联合磷酸西格列汀对T2DM患者糖代谢、C肽及用药安全性的作用分析 [J], 林爱蔷4.利拉鲁肽联合甘精胰岛素对于新诊断2型糖尿病患者降糖调脂作用的临床分析[J], 聂礼强;周立新;翟云;买买提明·喀迪尔5.单纯使用二甲双胍血糖控制不佳的2型糖尿病患者联合利拉鲁肽及甘精胰岛素治疗的临床疗效与安全性分析 [J], 田苗苗因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘精胰岛素
Ganjing Yidaosu
Insulin Glargine
本品系由含有可高效表达甘精胰岛素基因的工程化细胞,经发酵、分离、高度纯化、结晶和干燥制成。
甘精胰岛素为21A -甘氨酸-30B a-L-精氨酸-30B b-L-精氨酸-人胰岛素,在结构上与人胰岛素相比在链A的21位置由甘氨酸代替门冬酰胺,在链B的C 末端增加了2个额外氨基酸,即精氨酸(B31)和精氨酸(B32)。
按干燥品计,含甘精胰岛素应为95.0%~105.0%。
每1单位甘精胰岛素相当于0.0364mg。
1基本要求
生产和检定用设施、原材料及辅料、水、器具等应符合“凡例”的有关要求。
2制造
2.1工程细胞
本品为重组DNA技术生产的由53个氨基酸残基组成的蛋白质,工程菌菌种名称、来源及种子批检定应符合批准的要求。
2.2原料
1。
