物理化学期末复习(医院药学专业)
物理化学C药学考试题及答案

物理化学C药学考试题及答案一、选择题(每题2分,共20分)1. 在药物的溶解度-分配系数模型中,药物的生物利用度与以下哪个因素无关?A. 药物的脂溶性B. 药物的分子量C. 药物的溶解度D. 药物的分配系数答案:B2. 药物的稳定性通常受到哪些因素的影响?A. 温度B. 湿度C. 光照D. 所有以上因素答案:D3. 以下哪种药物属于前药?A. 阿司匹林B. 布洛芬C. 可待因D. 普鲁卡因胺答案:D4. 药物的酸碱性对其吸收和分布有何影响?A. 酸性药物在酸性环境中吸收好B. 碱性药物在碱性环境中吸收好C. 酸性药物在碱性环境中吸收好D. 碱性药物在酸性环境中吸收好答案:C5. 药物的首过效应主要发生在哪个部位?A. 肝脏B. 胃肠道C. 肺D. 肾脏答案:A6. 药物的血浆蛋白结合率对其药效有何影响?A. 结合率高,药效增强B. 结合率高,药效减弱C. 结合率低,药效增强D. 结合率低,药效减弱答案:B7. 以下哪种药物属于β-内酰胺类抗生素?A. 四环素B. 红霉素C. 青霉素D. 氯霉素答案:C8. 药物的半衰期是指药物浓度下降到多少所需的时间?A. 50%B. 25%C. 10%D. 5%答案:A9. 药物的生物等效性是指:A. 两种药物的化学结构相同B. 两种药物的药效相同C. 两种药物的生物利用度相同D. 两种药物的剂量相同答案:C10. 药物的溶解度与药物的生物利用度之间的关系是:A. 溶解度越高,生物利用度越高B. 溶解度越低,生物利用度越高C. 溶解度与生物利用度无关D. 溶解度与生物利用度的关系不确定答案:A二、填空题(每题2分,共20分)1. 药物的溶解度是指药物在________中的最大溶解量。
答案:溶剂2. 药物的分配系数是指药物在________和________中的分配比例。
答案:油相、水相3. 药物的首过效应是指药物在________后,进入全身循环前被________代谢的过程。
药学物化试题及答案

药学物化试题及答案一、选择题(每题2分,共20分)1. 药物的溶解性主要取决于药物的()。
A. 化学结构B. 物理性质C. 制剂工艺D. 生产厂家答案:A2. 下列哪种药物属于非极性药物?()A. 阿司匹林B. 硫酸镁C. 盐酸普鲁卡因D. 地塞米松答案:D3. 药物的生物利用度主要受哪些因素影响?()A. 药物的溶解性B. 药物的稳定性C. 药物的剂型D. 所有以上因素答案:D4. 药物的稳定性主要受哪些因素影响?()A. 温度B. pH值C. 光照D. 所有以上因素答案:D5. 下列哪种药物属于酸性药物?()A. 阿莫西林B. 硫酸钠C. 盐酸氨溴索D. 氢氧化铝答案:C6. 药物的溶解速率主要受哪些因素影响?()A. 药物的溶解性B. 药物的粒径C. 药物的晶型D. 所有以上因素答案:D7. 药物的渗透性主要取决于()。
A. 药物的分子量B. 药物的脂溶性C. 药物的极性D. 药物的分子结构答案:B8. 下列哪种药物属于碱性药物?()A. 硫酸阿托品B. 盐酸普鲁卡因C. 氢氧化铝D. 硫酸镁答案:C9. 药物的生物等效性是指()。
A. 药物的疗效相同B. 药物的安全性相同C. 药物的体内过程相同D. 药物的剂型相同答案:C10. 药物的稳定性试验通常包括哪些内容?()A. 加速试验B. 长期试验C. 影响因素试验D. 所有以上因素答案:D二、填空题(每空1分,共20分)1. 药物的溶解性是指药物在溶剂中的最大浓度。
答案:溶解2. 药物的溶解速率是指单位时间内药物的质量。
答案:溶解3. 药物的生物利用度是指药物进入的量与给药量的比例。
答案:体循环4. 药物的稳定性是指药物在储存和使用过程中的保持程度。
答案:化学性质5. 药物的渗透性是指药物通过的能力。
答案:生物膜6. 药物的生物等效性试验通常包括试验和试验。
答案:药动学;药效学7. 药物的稳定性试验中,加速试验通常在条件下进行。
答案:高温高湿8. 药物的溶解性受的影响较大。
药剂专业 涉及的物理化学知识

药剂专业涉及的物理化学知识
药剂专业涉及的物理化学知识主要包括以下几个方面:
1. 热力学:包括热力学基本概念、热力学平衡、热力学过程等。
药剂专业需要了解物质的热力学性质,如热容、焓、熵等,并能够应用热力学原理进行药剂的稳定性研究、配方优化等。
2. 物理化学平衡:包括化学平衡、离子平衡、溶解度平衡、酸碱平衡等。
药剂专业需要了解溶液的物理化学平衡关系,如酸碱平衡对药物的溶解度、稳定性等的影响,以及药物离子的溶解度规律。
3. 色谱分析:包括气相色谱、液相色谱等。
药剂专业需要掌握色谱分析技术,用于药物的纯度检测、分析等。
4. 电化学:包括电解质溶液中的电解、电位、电动势等。
药剂专业需要了解电化学反应对药物混合溶液中的影响,如pH值、电解质浓度等的调控。
5. 反应动力学:包括化学反应速率、速率方程等。
药剂专业需要了解药物的反应动力学特性,并进行药剂的速率研究及药物配方的优化。
这些物理化学知识对于药剂专业的学习和研究都具有重要的作用,可以帮助药剂师有效地控制药物的性质、研制高质量的药物配方。
13药学本科物理化学复习题含部分答案

13药学专业物理化学复习题一、选择题和O2在绝热钢瓶中生成水,A. △H=0B.△U=0C.△S=0D.△G=0答:钢瓶的体积固定,与外界没有功和热的交换,则△U=0和O2混合气体的绝热可逆压缩,A. △U=0B. △F=0C.△S=0D.△G=03.某体系进行不可逆循环过程的熵变为A.△S(体)>0,△S(环)=0B. △S(体)=0,△S(环)>0C. △S(体)=0,△S(环)=0D. △S(体)>0,△S(环)>0 答:体系进行不可逆循环时,体系回到原状态,而熵是状态函数,所以△S体=0。
因为是不可逆过程,故△S环>0。
4A.蒸汽压B.汽化热C.熵D.吉布斯自由能E.内能F.体积6.在α、β两相中都含有A和B两种物质,当达到相平衡时,下列哪种情况是正确的?A. μαA=μαBB.μαA=μβAC.μαA=μβB7.纯物质在其三相点时的自由度为A . 4 B. 3 C. 2 D. 1 E. 08.任何一个化学变化,影响平衡常数数值的因素是A.反应物浓度B.催化剂C.反应产物浓度D.温度9.某一反应在一定条件下的转化率为%,当有催化剂存在时,其转化率应当( )% 。
A.大于B.小于C.等于10.一级反应的半衰期与反应物的最初浓度A无关 B. 成正比 C. 成反比 D.平方根成反比11.零级反应是直线关系。
A. C—t —t C—t12.光化学反应A+hν=产物,其速率与A.反应物A的浓度无关B.反应物A的浓度有关C.反应物A的浓度和hν有关13.对于有过量KI存在的AgI溶胶,下列哪种电解质的聚沉能力最强?A.K3[Fe(CN)6]14.宜作油包水型(w/o)乳化液的乳化剂的HLB值的范围是A.2~6 B。
8~12 C。
14~1815.加入表面活性物质,使液体的表面张力A.增加 B. 降低 C. 不变,但使表面稳定 D. 不一定16.已知一个系统过程的熵变为10J/K,则该过程为A.自发过程 B. 平衡过程 C. 非自发过程 D. 无法判断17.电池反应达平衡时,电池电动势E有A. E>0B. E<0C. E=E0D. E=018.对大多数液体,其表面张力随温度升高而A.增大B.减小C.不变D. 不确定19.一定温度下,一定量PCl5(g)在一密闭容器中达到分解平衡。
10级(80学时)药学、药剂、制药、中药专业物化期末考试复习提纲

热力学第二定律
可逆与不可逆过程中熵变的特点,以及熵变的计算
绝热过程(可逆,不可逆),及其相关计算 G的定义式,以及△G的应用
理想气体化学势的表示方法和相关计算, 化学势作为判据的应用
第四章和第五章
化学平衡基本知识,化学反应等温方程式,平衡常数表 示法,标准反应吉布斯能变化等。 体系独立组分数的判断,相律的应用(条件自由度) 克拉贝龙方程 克劳修斯-克拉贝龙方程 (定积分和不定积分形式) 正常沸点 完全互溶双液系统和完全不互溶双液系统基本知识。 第六章
第八章
表面张力与表面吉布斯能 影响表面张力大小的因素 弯曲液面的蒸气压 铺展与润湿 物理吸附与化学吸附的特点 兰格缪尔吸附等温式
第九章 亲液溶胶和憎液溶胶 布朗运动的实质 溶胶的光学性质 溶胶电学性质(胶团、电泳、电渗、聚沉值与聚沉能力的关 系)
简答题复习
热力学第一定律;熵增加原理;吉布斯能;
相律的应用;
表面吉布斯能、表面张力;弯曲表面的性质; 光化反应和热反应的区别 物理吸附与化学吸附的区别 ;
计算复习
第一章 化学反应热效应的计算;理想气体pVT 以及W、Q、Δ U和Δ H; 第二章和第四章 Δ H、Δ S、Δ G的有关计算; 化学反应等温方程式,平衡常数。 第五章 克劳修斯-克拉贝龙方程,特鲁顿规则。 第七章 一级反应,阿仑尼乌斯公式,温度对 速率常数的影响等。
离子的电迁移和迁移数,以及电解过程中影响阴阳极 电解质浓度变化的因素
电导、电导率、摩尔电导率和无限稀释摩尔电导率的 相关计算
第七章 基元反应 ,反应分子数,反应级数 质量作用定律 化学反应速率常数和反应级数 化学反应的速率方程的表示方法 温度对反应速率的影响(阿仑尼乌斯公式) 活化能、半衰期 催化剂对化学反应的影响 光化反应与热反应
物理化学期末复习(医学院)

2F
2F
金属过电势忽略,同时用浓度代替活度(系数接近1)
可以看出,随着Cu的析出,溶液中铜离子浓度下 降,阴极电势随之下降。
22
电解时的阴极反应
如果电解时有多种离子,则析出电势越高的离子
越易获得电子,优先还原。例:电解液中含有活度均
为1的Ag +、Cu2+、Cd2+,则析出电势等于该离子标准
电极电势。 Ө(Ag+ /Ag)=0.799V, Ө(Cu2+ /Cu)=0.337V,
E
E
RT 2F
ln
a(H )2 a(Cu) a(H2 ) a(Cu2 )
a(H2 ) p(H2 ) p 1 a(H ) 1
16
电极电势的能斯特公式
公式改写成:
(Cu 2
Cu) (Cu2
RT a(Cu) Cu) 2F ln a(Cu2 )
其中: (Cu2 Cu) E
推广到任意电极:
微溶氧化物电极:以汞-氧化汞电极为例 酸性:Hg-HgO H+ HgO + 2H+ + 2e Hg + H2O 碱性:Hg-HgO OH HgO + 2H2O + 2e Hg + 2OH
11
电池表示法
对一个电池若都要象原来一样画图表示不方便 科研,所以人们规定了电池的科学表示方法。
1、以化学式表示电池中各物质的组成,并注明相态, 对气体要求注明压力,溶液注明浓度。 2、以“”表示不同物相之间的界面,盐桥用“”表示 (连接电池中的两种溶液,以消除溶液接界处的电势)。 3、各化学式和符号的排列顺序要真实反映电池中各种 物质的接触次序。 4、电池中的负极写在左方,正极写在右方。
药学本科(物理化学)试题
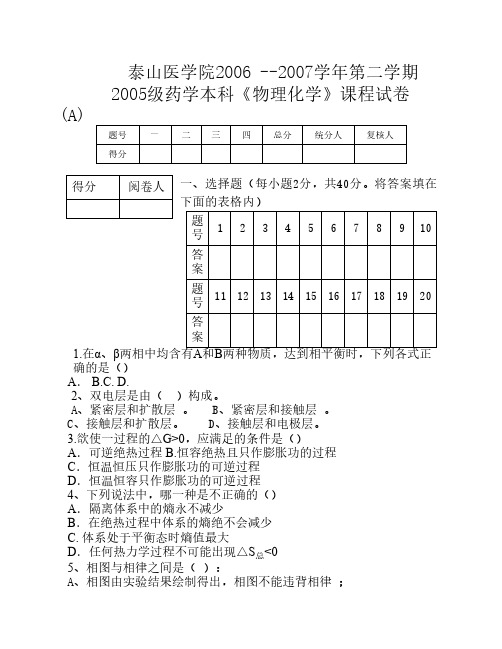
B、相图由相律推导得出; C、相图由实验结果绘制得出,与相律无关 ; D、相图决定相律 。 6、在101.325kPa下,-10℃时过冷水结成冰是一个自发过程,该过程 中() A △S=0,△G=0 B △S>0△G<0 C △S<0,△G<0 D △S>0,△G>0 7、熵增原理只适用与( )体系。 A、 敞开。B、封闭。C、孤立。D、循环
1、解释人工降雨的工作原理。(5分)
2、指出下列个系统的主分数和自由度数。 (5分) (1) 在抽空的容器中,NH4Cl(s) 分解成NH3(g) 和HCl(g),并 达到分解平衡 (2) 在抽空的容器中CaCO3(s)达到分解平衡 (3) C(s)和CO(g)、CO2(g)、O2(g)在700℃混合并达到平衡
3、(1)写出下列相图中的三相线的状态。(2)画出P点的步冷曲线。 (6分)
4.如何得到强电解质的无限稀释摩尔电导,如何得到弱电解质的无限 稀释摩尔电导。
(写出有关的公式和原理)(4分)
得分 阅卷人
四、计算题:(30分) 1、 1mol苯在其沸点353.4K时蒸发成气体
(视为理想气体),蒸发热为 394.97KJ.Kg-1。试计算此过程的Q、W、 △U、△H、△S及△G。(本题5分)
泰山医学院2006 --2007学年第二学期 2005级药学本科《物理化学》课程试卷 (A)
题号 一 二 三 四 总分 统分人 复核人
得分
得分
阅卷人 一、选择题(每小题2分,共40分。将答案填在 下面的表格内)
题 号
1
2
3
4
5
6
7
8
9 10
答 案
题 号
11
12
药学物理化学大一知识点

药学物理化学大一知识点在药学领域中,物理化学是一门重要的学科,它研究了药物的物理性质和化学反应规律。
在大一阶段,学生需要掌握一些基础的药学物理化学知识点,以建立坚实的基础。
本文将围绕药学物理化学大一知识点展开讨论。
1. 药物的物理性质药物的物理性质包括溶解度、极性、表面张力等。
溶解度是指在一定温度下,溶质在溶剂中单位体积中能溶解的最大量。
影响药物溶解度的因素有分子结构、温度、pH值等。
极性是指分子中正负电荷的分布情况,与溶解度和药物渗透性密切相关。
表面张力则是指液体表面上的分子受力情况,影响着液体的润湿性和浸透性。
2. 平衡反应与化学平衡常数在化学反应中,当反应物生成产物的速度与产物生成反应物的速度相等时,即达到平衡状态。
平衡反应可以通过化学平衡常数来描述,常用化学平衡常数包括酸碱离子解离常数(Ka、Kb)、配位溶液中配体和金属离子的络合反应常数(Kf)、药物与受体结合的结合常数(Kd)等。
了解平衡反应和化学平衡常数有助于理解药物的稳定性和活性。
3. 电解质与非电解质根据溶解时产生的离子数量和能否导电,物质可分为电解质和非电解质。
电解质在水溶液中能够完全或部分解离成离子,可以导电;而非电解质在水溶液中几乎不发生解离,不能导电。
对于药物来说,电解质性质的了解对于药物的溶解性、吸收性和稳定性的评价非常重要。
4. 氧化还原反应氧化还原反应是指物质之间的电子转移过程,包括氧化和还原两个基本过程。
在药学中,氧化还原反应常常涉及药物的氧化降解和抗氧化性评价。
药物的氧化降解会导致其活性的变化和药效的降低,因此了解氧化还原反应对于药物的稳定性和药效的保持非常重要。
5. pH值与离子化pH值是衡量溶液酸碱性的指标,可以影响药物的溶解度、吸收性和稳定性。
药物在不同的pH条件下会发生离子化或解离,离子化程度与药物的溶解度和吸收性密切相关。
掌握药物的离子化规律有助于合理使用药物,优化药物的治疗效果。
6. 固体药物的晶体结构与多态性固体药物的晶体结构和多态性对于药物的溶解度、生物利用度和物理稳定性具有重要影响。
药学专业分析化学期末复习题(含参考答案)

药学专业分析化学复习题一单项选择题1 重量分析中样品杂质被其沉淀属于AA 方法误差B 仪器误差C 试剂误差D 操作误差2 用加热法驱除水分以测定CaSO4·1/2H2O中结晶水的含量,称取试样0.2000g,已知天平的称量误差为±0.1mg,问分析结果应以几位有效数字报出DA 1B 2C 3D 43在下列各组酸碱物质中,哪些属于共轭酸碱对DA H3PO4--Na2HPO4B H2SO4--SO42-C H2CO3-CO32-D (CH2)6N4H+--(CH2)6N44标定EDTA时常用基准物质BA 无水Na2CO3B ZnOC NaClD Na2C2O45 用配位滴定法测Al3+采用BA 直接滴定法B返滴定法 C 置换滴定法D间接滴定法6 在EDTA法中,K MIn>K MY时会产生CA 僵化现象B 氧化变质现象C 封闭现象D 掩蔽现象7 下列因素使配位滴定突跃变小的是CA 配合物的稳定常数越大B 溶液PH越大C 配位效应影响越大D 被滴定金属离子浓度越大8 用基准K2Cr2O7标定Na2S2O3溶液属于何种滴定方式CA 直接B 剩余C 置换D 间接9氧化还原滴定突跃范围大小与哪一个因素有关AA △φ’B △φ’InC φInD 标准电极电位10 间接碘量法滴至终点后,若产生即时“回蓝”现象,可能是由于CA 试样中杂质的干扰B 空气中氧气氧化碘离子C 第一步反应不完全D 淀粉指示剂变质11关于氧化还原指示剂,说法不正确的是BA 指示剂的变色点时φIn=φ’InB 指示剂在作用时不消耗标准溶液C 氧化态与还原态颜色应明显不同D 是通用型指示剂12下列可在弱碱性条件下进行的是DA 用Na2S2O3溶液测CuSO4·5H2O含量B 间接碘量法C KMnO4法D 直接碘量法13银量法中三种指示剂法都不能在何种溶液中进行CA 强酸性B 弱碱性C 强碱性D 弱酸性14 形成晶形沉淀的条件CA 稀快搅热陈B 浓快搅热陈C 稀慢搅热陈D 浓慢搅热陈15沉淀生成速度过快,易形成DA 吸附B 后沉淀C 混晶D吸留二 填空1 从碘量法本身来说, 间接碘量法中引入误差的主要因素是__I 2_的挥发_和__I -_被氧气氧化_______________.2 氧化还原滴定法的指示剂分为_氧化还原指示剂,__自身指示剂,__特殊指示剂_.3 恒重是指试样_连续两次干燥或灼烧后的质量差不超过±0.3mg 即为恒重。
大学《物理化学(药学专)》试题库及答案

1.下面说法不正确的是:A弯曲液面的表面张力2.用超显微镜可以观察到:C胶粒的带电3.化学反应的等压热效应和等容热效应,以下叙述错误的是:B等压热效应4.对于难溶性固体药物,当其粒径小到一定程度时,随着粒径的减小,则其溶解度D增大5.关于化学变化,以下叙述错误的是:D大于0 正向自发6.对于稀溶液,有关原盐效应的叙述错误的是:D对于同种速率也小7.关于化学反应的说法正确的是:B对于基元反应8.某一封闭体系,从始态到终态的ΔG<0,则:B此过程正向9.夏季有时久旱无雨,甚至天空有乌云仍不下雨。
从表面化学的观点来看其原因是D形成无运动10.分散系静置时,成半固体状态,振摇时成流体,这属于A触变型11.蛋白质等电点的定义是 D PH值12.关于表面活性剂的亲水亲油平衡值HLB的叙述错误的是D亲油性越强13.关于可逆过程的特点,以下叙述错误的是:D体系复原14.将水银滴在玻璃板上,平衡时其接触角A90-180度之间15.定温下,某种电解质溶液的浓度由1mol/L增大到2mol/L时,其摩尔电导率 C 减小16.理想气体反应:2A+B=C是吸热反应,当反应达到平衡时,可采用下列哪组条件,使平衡向右移动(即提高反应物的转化率)D升高温度和增大总压17.pH计中的玻璃电极属于D离子选择性电击18.在一定温度压力条件下,某一化学反应,判断其反应方向时用 D Gm19.关于一级反应的特点,以下叙述错误的是: C 呈直线关系20.关于溶胶的ξ电位,下列说法不正确的是D电位是粒子表面21.关于化学反应速度的描述正确的是:A越大越大22.标准氢电极的电极电势等于零是指:D在任一温度时23.定温定压下,溶质分配地溶入两种互不相溶溶剂中,当溶质在两种溶剂中的分子大小相同,溶质在两相的浓度比是: A 常数24.下列措施不一定使溶胶发生凝结的是A加大分子25.有一自发原电池,已知其温度系数为负值,则该电池反应的ΔH是A<026.可逆电池中发生失电子反应的电极是:D负极27.关于零级动力学的特点,以下叙述正确的是:C 无关28.关于功的叙述,以下错误的是:D 功市状态函数29.化学电池不可逆放电时,其吉布斯自由能降低与所做功的关系C大于30.溶胶和大分子溶液的本质区别是A热力学稳定性不同31.一封闭体系,从A态出发,经一循环过程回到A态,则下列何者为零()C Q-W32.吉布斯吸附等温式中吸附量Γ的意义为C表面超量33.可逆电池中盐桥的作用是C液接电势34.既是胶体相对稳定存在的因素,又是胶体遭破坏的因素D胶粒的布朗运动35.某化学反应的速率常数k的单位是mol/(L.S),该反应级数是:B零级36.某化学反应的半衰期与反应物的初始浓度没有关系,则该反应为D一级37.关于胶体分散体系的特点,以下不正确的是C在显微镜下鞥看到38.水蒸气蒸馏时,馏出物中包含高沸点液体和水,则C因其在低温下39.朗格缪尔吸附等温式C对单分子层40.沸点组成图上有最低恒沸点的溶液精馏,如最低恒沸物为C,组成在A和C之间的溶液,精馏后只能得到:B纯A和最低41.关于状态函数的特征,以下叙述错误的是:B状态函数的改变值42.在一定温度下,平衡体系CaCO3(s) =CaO(s) +CO2 (g)的组分数、相数及自由度数分别为() D 23043.44.判断题全是错45.弱电解质的电离度和电离常数可用电导法测定。
药学类专业物理化学复习题集

例6:80oC时,N2O5气相分解的速率常数为1.39min-1, 活化能为103.3kJ·mol-1,求(1)65oC时的速率常数k及 t1/2;(2) 65oC时当N2O5分解掉99%所需要的时间。
,该反应为一级反应。 解: (1) 从速率常数的单位可知 ln k2 Ea 1 1 ( ) k1 R T1 T2
ln
p2 sub H m (T2 T1 ) , p1 R T1T2
8.314 273.2 293.2 12.30103 1 sub H m ln J · mol 293.2 273.2 3.27 103 44.12kJ · mol1
z =2 ΔrGm= -ZFE=-296500Cmol-1 0.372V=-71.80kJmol-1
E r S m zF T
2 10-4 V K -1
1 2 96500 C mol p
38.6J K -1 mol-1
E r H m zF T C mol1 E 2 96500 T p [298.15K 2 10-4 V K -1 0.372V]
60.29kJ mol-1
Qr=TrSm=298.15K38.6JK-1mol -1 =11.508kJmol -1
例3: 298K时将电导率为0.141 S m 装入电导池,测得其电阻为
1
525Ω,再换用0.1mol dm NH3.H2O溶液,测得其电阻为2030Ω。 3
求: (1)电导池常数K(l/A); (2) NH3.H2O溶液的电导率; (3) NH3.H2O溶液的摩尔电导率和( 导率 解:(1)K(l/A)=κR = 0.141*525=74.03m
制药工程物理化学复习资料整理版

第一章热力学第一定律·系统和环境·能量形式:热力学能热功·热力学第一定律①封闭系统:ΔU=Q+W ②孤立系统:ΔU=0·焓:H=U+pVΔH=Δ(pV) =ΔU+pΔV+VΔpeg:设有一电炉丝浸入水中,接上电源,试问ΔU,Q,W为正,为负还是为零?(1)以电炉丝为系统(2)以电炉丝和水为系统(3)以电炉丝,水,电源其他一切有影响的部分为系统(1)ΔU=0,Q<0,W>0(电炉丝状态未变)(2)ΔU>0,Q=0,W>0(绝热)(3)ΔU=0,Q=0,W=0(隔绝系统)·状态与状态函数状态状态函数·过程函数:功,热·状态函数法ΔZ=Z2-Z1·状态变化及过程简单pVT变化等温过程(T始=T终=T环)等容过程(V始=V终)等压过程(P始=P终=P环)绝热过程(Q=0)循环过程(∫Δ(状态函数)=0)相变化(等温等压)化学变化(等温等压或等温等容)·可逆过程可逆过程的特点:(1)组成:整个过程是由一串非常接近于平衡的状态组成,系统在整个可逆过程中始终处于平衡态(2)方式:状态变化时推动力与阻力相差无限小(3)结果:在反向过程中,用同样的手段,系统沿原来路径按同样方式回到始态时,则可使系统和环境均恢复原态,即不留下任何痕迹(4)做功:等温可逆过程中,系统对环境作最大功,环境对系统作最小功·热力学能要会计算在不同条件下的热力学能,通过看例题理解记忆这些公式1-2,1-3,1-5,1-7,1-8ΔU=Q+W (封闭系统任何过程)ΔU=Q V(封闭系统,等容,W′=0)ΔU=Q V=∫C V dT (理想气体的任何过程)·焓ΔH=ΔU+Δ(pV )ΔH=Q P (封闭系统,等容,W ′=0)ΔU=Q V =∫C P dT (无相变无化学变化的封闭系统,等压) ΔU=∫C P dT (理想气体的任何过程) 做完例题后来梳理这个表格第二章 热力学第二定律·热力学第二定律·S 函数物理意义熵增意义 ①ΔS ≥0 ②ΔS 孤立=S 系统+ΔS 环境≥0(S 判据)2-1,2-2,2-5,2-7基本计算式:ΔS=∫δQr/T ,ΔS 环境= -Q 实际/T 环·F 函数定义式:F=U-TSF 判据:ΔF T,V ,W`=0≥0基本计算式:ΔF=ΔU-Δ(TS) ,dF= -SdT-pdV·G 函数定义式:G=H-TSG 判据:ΔG T,V ,W`=0≤0 学会运用F 判据和G 判据,判断反应进行的方向基本计算式:ΔG=ΔU-Δ(TS) ,dG= -SdT+Vdp不同过程中,ΔS, ΔF, ΔG 的计算 例2-10,2-11·偏摩尔量X B ,m定义 物理意义·化学势μB定义及物理意义化学势判据及其应用 ①判据0dn B B B ≤∑μ②应用:相平衡,化学平衡第三章 化学平衡·化学反应方向判据RTlnQp rG m rG m +∆=∆θ·平衡常数的表示方法气相反应:Kn Kx Kp K θKn ~Kx ~ Kp ~ K θ的关系液相反应:浓度逸度 复相反应: K θ与分解压的关系·θrGm ∆=RTln θK·影响平衡因素 出在选择题,给出一个反应,让你判断以下因素对反应平衡的影响温度(唯一对θK 有影响)压力惰性气体反应物的投料比第四章 相平衡 很重要·相律 会求相律·相图读图的一般原则和步骤确定相图的类型相图的静态分析(指出各点线面的Ф,f )相图的动态分析克莱修斯-克拉珀龙方程 很重要,必考,利用杆杠规则进行计算 , 相图的应用·相图类型 物系点 相点2 相点1单组分系统相图找到书上的图,看看这几种相图是怎么样的,轴代表什么?怎样用杠杆规则理想的完全互溶双液系统相图简单低共熔相图·复杂相图具有最高(低)恒沸混合物相图真实液态混合物产生偏差的原因能由相图看出是正偏差还是负偏差生成稳定化合物相图·杆杠规则物系点相点计算·应用蒸馏和精馏上学期有考水蒸气蒸馏重结晶第五章电化学·电解质溶液导电性质:G,к,Δm的定义离子独立运动定律·原电池电池与反应的互译可逆电池热力学·电极的极化和超电势超电势极化曲线电极阳极阴极反应氧化还原电解池正极,电势高负极,电势低原电池负极,电势低正极,电势高移动离子(= =看不清楚)负离子正离子第六章 化学动力学·基本概念基元反应和总包反应,反应分子数和反应级数,质量作用定律等·简单级数反应微分式,积分式,动力学特征,计算 ,记住P224表格7-1会计算半衰期 ·温度对反应速率的影响阿伦尼乌斯公式 上学期有考·典型的复杂反应动力学特征温度的影响第七章 表面现象 后面几章的复习,主要以了解为主,找到相关的概念理解一下,有个印象·表面积与表面吉布斯能▪ 定义表面吉布斯能,比表面吉布斯能▪ 表面张力▪ 弯曲表面下的附加压力▪ 毛细现象 上学期有考,出了一道简答题▪ 溶液的表面吸附 会判断是正吸附还是负吸附,可能会有选择题▪ 表面张力等温线(表面非活性和表面活性物质)▪ 正吸附和负吸附第八章 吉布斯公式: 第九章 表面活性剂(定义、种类)表明的热力学关系式·弯曲表面的性质拉普拉斯公式,开尔文公式亚稳状态和新相的生成·溶液的表明吸附·表面活性剂 定义?种类?·气体在固体上的吸附第十章 胶体分散系统·溶胶的基本特性·溶胶的性质动力性质光学性质电学性质▪ ·溶胶的聚沉溶胶的电学性质: 分清以下几种性质的区别1.电泳:胶粒在电场中运动2. 电渗:介质在电场中运动3. 流动电势:使介质移动,产生电场4. 沉降电势:使胶粒移动,产生电场电动现象说明:溶胶质点与介质分别带电,在电场中发生移动,或移动时产生电场 ▪ 溶胶的电动现象;溶胶粒子表面电荷来源T c RT c Γ⎪⎪⎭⎫ ⎝⎛∂∂-=B B σ表面活度 T c ⎪⎪⎭⎫ ⎝⎛∂∂B σ▪溶胶的稳定性▪胶团的结构,稳定剂的影响▪聚沉,聚沉值和聚沉能力的大小判断▪大分子溶液和小分子溶液及溶胶的区别。
药学本科《物理化学》考试(含答案)

药学本科《物理化学》上学期参考试卷及答案一、是非题1.熵增加的过程都是自发过程。
( )2.根据热力学第一定律,因为能量不能无中生有,所以一个系统若要对外作功,必须从外界吸收热量。
( )3.气体经绝热自由膨胀后,因Q=0,W=0,所以∆U=0,气体的温度不变。
( )4.若一个过程是可逆过程,则该过程中的每一步都是可逆的。
( )5.在298K 下,氢气的标准燃烧焓就是水的标准生成焓。
( )6.任何化学反应的Q p 总是大于Q v 。
( )7.不作非体积功的等容过程的热只由系统的始、终态决定。
( )8.反应A+B = C+D 达平衡时,各物质的化学势一定相等。
( )9.计算绝热不可逆过程的熵变,可以在相同的始、终态间设计一条绝热可逆途径来计算。
( )10.理想气体向真空膨胀Q=0,所以∆S=0。
( )11.对于纯组分,化学势等于其摩尔吉布斯能。
( )12.热是由于温差而传递的能量形式,它总是倾向于从含热较多的高温物体流向含热较少的低温物体。
( )13.恒容条件下,一定量的理想气体,温度升高时,热力学能将增加。
( )14.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
( )15.任意体系经一循环过程则其∆U ,∆H ,∆S ,∆G ,∆A 均为零。
( )16.相图中的点都是代表系统状态的点。
( )17.根据二元液系的p-x 图可以准确地判断该系统的液相是否为理想液体混合物。
( )18.任何一个化学反应都可以用r m G θ∆来判断其反应进行的方向。
19.在等温、等压、只作体积功的条件下,反应的∆G m <0时,若其数值越小,反应自发进行的趋势也越强,反应进行得越快。
( )20.恒沸物的组成不变。
( )二、单选题1. 对实际气体的节流膨胀过程,有( )A. △H = 0B. △S = 0C. △G = 0D. △U = 02. 下列纯物质两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B. 熔点将随压力增加而升高C.蒸气压将随温度升高而加大D. 升华温度将随压力增大而升高3. NH 4HS(s) 和任意量的 NH 3(g) 及 H 2S(g) 达平衡时有( )A. K = 2,φ= 2,f = 2B. K = 1,φ= 2,f = 1C. K = 2,φ= 3,f = 2D. K = 3,φ= 2,f = 34.使一过程的△G=0应满足的条件是 ( )A.可逆绝热过程B.等容绝热且只做膨胀功的过程C.等温等压且只做膨胀功的可逆过程D.等温等容且只做膨胀功的可逆过程5.对于理想气体,下列关系式中哪个不正确?( ) A. 0)(=∂∂V T U B. ()0T U V ∂=∂ C.0)(=∂∂T P H D. 0)(=∂∂T PU 6.在298K 时反应C 6H 5COOH (l )+7.5O 2(g )=7CO 2(g )+3H 2O (l ),设各气体皆为理想气体,则等压反应热∆H 与等容反应热∆U 之差等于(KJ ⋅mol -1)( )。
医药类大学物理化学重点 考点

【P5】:1、理想气体模型(条件):1分子大小可以忽略,2:无分子作用力。
高温,低压状态的气体看做理想气体。
2、理想气体状态方程:PV二nRTP—压力—Pa V—体积—m3 n—物质的量—摩尔T—温度—温度—KR—摩尔气体常数—8.314[J/(mol*K)]【P7】:混合气体定律适用条件:理想气体的混合物1、道尔顿分压定律:某一气体在气体混合物中产生的分压等于在相同温度下它单独占有整个容器时所产生的压力;而气体混合物的总压强等于其中各气体分压之和,这就是气体分压定律。
Pa=naP/n =xaP2、阿马格定律:而气体混合物的总体积等于其中各体积之和,这就是气体分体积定律。
Va=naP/n=xaV Vi/V=ni/n=PiP【P15】:状态函数:只由体系状态确定的体系的各种热力学性质,称为体系的状态函数。
状态函数改变~状态改变。
状态改变~状态函数不一定改变。
(X\T) 常用的状态函数,T、P是强度性质;V、U、H、S、G广度性质。
热和功不是状态函数。
特征:殊途同归,值变相等。
周而复始,值变为零。
【P17:】功:非体积功,表面功、电功。
1、体积功:①向真空膨胀W=0,温度不变则热力学能保持不变。
∆T=0,Q=0,∆H=02、恒外压W=—P外∆V3、恒压P=P1=P2=P外:W=—P∆V④4、Wr=-nRTLn(V1/V2) (条件:理想、等温、可逆)【P23】:热力学可逆过程的特点:(可逆过程效率最高)(1)可逆过程是以无限小的变化进行的,体系始终无限接近于平衡态。
(2)循与过程原来途径相反的方向,可以使系统和环境完全恢复到原来的状态,而无任何耗散效应。
(3)在等温可逆膨胀过程中系统对环境做最大功,在等温可逆压缩过程中环境对系统做最小功。
【P24】:体积热力学能的变化,∆U=U2-U1=Q+W。
1、∆U=Qv等容. 条件:.没有非体积功的等容过程2、定压热Qp=H2一U1、∆H=Qp、焓的定义:H=U+PV恒压热=焓变条件:①Wf=o.没有非体积功的等压过程3、双原子分子Cpm=7R/2、Cv.m=5R/2、单原子分子Cvm=3R/2,Cpm=5R/2。
大一医学生物理化学知识点

大一医学生物理化学知识点医学生物理化学是医学专业中的重要课程之一,为了帮助大一医学生更好地掌握相关知识点,下面将介绍一些大一医学生物理化学的核心内容。
一、基本概念1. 原子结构:了解原子的构成、原子核、电子云等基本概念。
2. 元素周期表:掌握元素周期表的基本构造,了解元素的周期性和元素的周期趋势。
3. 化学键:了解化学键的形成原理,包括离子键、共价键和金属键。
4. 化学反应:熟悉化学反应的基本概念,如化学方程式、化学平衡等。
二、物质的量和摩尔质量1. 物质的量:了解物质的量的概念和计量单位,如摩尔和分子数。
2. 摩尔质量:熟悉摩尔质量的概念和计算方法,理解相对分子质量和相对原子质量的关系。
三、溶液和溶解度1. 溶液的基本概念:了解溶液的组成和特性。
2. 溶解度:掌握溶解度的概念和测定方法,理解溶解度与温度、压力等因素的关系。
四、化学反应速率和化学平衡1. 化学反应速率:了解化学反应速率的概念和影响因素,如浓度、温度、催化剂等。
2. 化学平衡:熟悉化学平衡的概念和平衡常数的计算方法,理解平衡位置和平衡常数与温度的关系。
五、酸碱中和反应1. 酸碱的定义:掌握酸碱的定义和性质,理解酸碱中和反应的原理。
2. pH值和酸碱指示剂:了解pH值的概念和计算方法,熟悉常用的酸碱指示剂及其颜色变化。
六、化学反应的能量变化1. 焓变:了解焓变的概念和计算方法,理解化学反应的放热和吸热过程。
2. 化学反应热力学:熟悉热力学第一定律和第二定律的基本内容,如内能、焓等。
七、电解质溶液的电导性质1. 电解质:了解电解质的概念和分类,理解电解质溶液的电离现象。
2. 电导率:掌握电导率的概念和测定方法,了解电解质溶液的电导性质。
八、氧化还原反应1. 氧化还原反应:了解氧化还原反应的概念和特点,理解氧化还原反应的电子转移过程。
2. 氧化还原反应的应用:熟悉电池、冶金和电解等领域中的氧化还原反应应用。
九、分子结构与化学键1. 分子结构:了解分子结构和分子间相互作用力的概念,包括范德华力、氢键等。
医学物理化学学复习资料

医学物理化学学复习资料医学物理化学学复习资料医学物理化学学是医学生必修的一门课程,涉及到医学中的物理和化学知识应用。
在医学领域中,物理化学学的重要性不言而喻。
它不仅可以帮助医学生更好地理解和应用医学知识,还能够为医学研究和临床实践提供有力的支持。
一、物理化学在医学中的应用物理化学学在医学中的应用非常广泛。
首先,它可以帮助医学生理解和解释生物体内的各种物理现象。
例如,通过学习物理化学知识,我们可以了解到人体内的电解质平衡与酸碱平衡的关系,从而更好地理解和处理酸碱失衡相关的疾病。
其次,物理化学学还可以帮助医学生理解和应用医学影像学。
医学影像学是一门通过不同的物理手段来观察和诊断人体内部结构和功能的学科。
例如,通过学习放射性同位素的衰变规律和成像技术,我们可以了解到放射性同位素在医学影像学中的应用,如放射性核素扫描和正电子发射断层扫描。
另外,物理化学学还可以帮助医学生理解和应用药物学知识。
药物学是研究药物的性质、制备、质量控制、药物代谢和药物作用机制的学科。
通过学习物理化学知识,我们可以了解到药物的溶解度、分配系数、酸碱性质等,从而更好地理解和应用药物学知识。
二、医学物理化学学的学习方法医学物理化学学是一门理论性较强的学科,需要医学生具备一定的学习方法。
首先,要注重理论知识的学习。
医学物理化学学的知识体系庞大,需要医学生掌握大量的理论知识。
因此,医学生要注重课堂学习,认真听讲,做好笔记,及时复习。
其次,要注重实践应用。
医学物理化学学的知识不仅仅是理论知识,还需要通过实践应用来加深理解。
医学生可以通过参加实验课程、临床实习等方式,将理论知识与实际应用相结合,加深对医学物理化学学的理解。
另外,要注重综合能力的培养。
医学物理化学学不仅仅是一门单一的学科,还需要与其他学科相结合,形成综合能力。
医学生要注重培养自己的综合能力,包括思维能力、分析能力、解决问题的能力等。
三、医学物理化学学的学习资料推荐在学习医学物理化学学时,选择合适的学习资料是非常重要的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
无数实验事实
第零定律
第一定律
第二定律
第三定律
组成不变的均 相封闭系统
组成可变的多相 系统
电化学系统
界面系统
第一章 热力学第一定律
基本概念
系统与环境 广度性质与强度性质 热力学平衡态
热平衡(T) 力学平衡(p) 物质平衡(μ),包括相平衡和化学平衡
第一章 热力学第一定律
能量形式:热力学能、热、功 封闭系统:ΔU=Q+W 热力学第一定律 孤立系统:ΔU=0 焓:H=U+pV ΔH=ΔU+Δ(pV)=ΔU+pΔV+VΔp 问题:比较化学反应的ΔrH与ΔrU的关系
理想气体在不同过程中Q、W、Δ U、Δ H的计算
物理量 定义式 过程 Q W ΔU ΔH
U W
p e dV
Q+W
U pV
0
单 纯 状 态 变 化
等 可逆 温 恒外压
自由膨胀 等压
-nRT ln(V2 / V1 )
Q W
-pe (V2 V1 )
0 -p(V2 V1 )
物理化学期末复习
2012.06
概述
物理化学又名理论化学,是化学、化工 、能源、生工、材料、医药、轻工、环 保和冶金等专业的理论基础。 物理化学在将实验结果上升成理论时, 通常采用两种方法:
归纳和演绎法——应用于热力学; 假设和模型法——应用于物理化学的各个 领域。
热力学方法 ——从热力学定律出发,运用演绎法,建
绝热
0(可逆)
——
可逆相变
等温反应
Qp W
r Hm (n)RT
H(相变)
H/T
0
r Hm TrSm
v H or v H
B f m B c
v S
B
B m,B
m
第二章 热力学第二定律
不同过程中ΔS、ΔF、ΔG的计算 若不可逆过程,要在始终态间设计可逆过 程来计算。 一些不可逆过程: 理想气体反抗外压绝热膨胀 101325Pa、268K下过冷液态苯变为固 态苯 373K和100kPa的水向真空蒸发变为 373K和100kPa的水蒸气
阳
j/Am2
E不可逆
E不可逆
阴
阴
E可逆
阳
j/Am2
E可逆
阴 /V
阳
阳
阴 /V
电解池的极化曲线
电极 反应 电解池 原电池 趋向离子 阳极 氧化 正极、电势高 负极、电势低 负离子
原电池的极化曲线
阴极 还原 负极、电势低 正极、电势高 正离子
v H or v H
B f m B c
m
第二章 热力学第二定律
S函数
定义
ΔS绝热≥0
熵增原理 ΔS孤立=ΔS系统+ΔS环境≥0(S判据)
基本计算式:ΔS=∫δQr/T,ΔS环境=-Q实际/T环 S的物理意义
第二章 热力学第二定律
F函数
定义式:F=U-TS -ΔFT ≤-W的物理意义 F判据:ΔFT,V,W'=0≤0 基本计算式:ΔF=ΔU-Δ(TS),dF=-SdT-pdV
第一章 热力学第一定律
状态与状态函数
状态 状态函数
过程函数:热、功 状态函数法
Z Z2 Z1
评述:循环过程法可用来解决任何问题,这在物理化学解题中经 常用到,在热力学研究的初期广泛地应用了这种方法,但它有一 个缺点,就是为了探索某种规律,必须选择适当的可逆循环,这 对解决问题至关重要,但如何选取无章可循。
物系点 相点 计算
第六章 电化学
电解质溶液
强电解质溶液中电解质的活度和活度系数
电解质的活度与离子平均活度、平均活度系数 及平均质量摩尔浓度的关系及计算 离子强度的定义及计算(6-28)
原电池
由电池书写电池反应 能斯特方程 可逆电池热力学
电极的极化和超电势
超电势和极化曲线
nCv,m (T2 -T1 )
ΔU
QW
ΔH
U pV
ΔS
dS= QR /T
nR ln(V2 / V1 )
ΔG
H (TS)
-TSor nRTln(V1/V2 )
0
0
nCp,m ln(T2 / T1 )
—— ——
nCp,m (T2 -T1 )
nCV ,m ln(T2 / T1 )
0
等容
绝热
Qp H Qv U
0 Qp H
0
W=U -p(V2 V1 )
nCv,m (T2 -T1 ) nCp,m (T2 -T1 )
Qp W
r Hm (n)RT
可逆相变 化学 等温等压 变化 等温等容
H(相变)
Qp r Hm r Um Qp Qv r Um 0
定义式:G=H-TS -ΔGT,p, ≤-W'的物理意义 G判据:ΔGT,p,W'=0≤0 基本计算式: ΔG=ΔH-Δ(TS),dG=-SdT+Vdp
G函数
不同过程中ΔS、ΔF、ΔG的计算
理想气体在不同过程中Δ U、Δ H、Δ S、Δ G的计算
物理量 定义式 过程 单 纯 pV T 变 化 等温 等压 等容
第七章 化学动力学
反应速率方程
基元反应、反应分子数、反应级数、速率常数
积分式、动力学特征、计算 反应级数的确定 阿伦尼乌斯公式及活化能对反应速率的影响 动力学特征及温度的影响
简单级数反应
温度对反应速率的影响
典型的复杂反应
链反应和催化反应
第八章 表面现象
表面积与表面吉布斯能
分散度增大对表面积、表面能等的影响 表面张力及其影响因素 表面的热力学关系式 拉普拉斯公式、开尔文公式及亚稳状态
弯曲表面的性质
润湿
固体润湿的类型及其过程吉布斯能的变化 毛细现象和毛细管凝结
第八章 表面现象
表面活性剂 气体在固体上的吸附
第九章 胶体分散系统
溶胶的基本特性 溶胶的净化 溶胶的性质
第三章 多组分系统热力学
偏摩尔量XB,m
定义(3-6) 物理意义 集合公式(3-9)
定义(3-12)
化学势B
dn 判据:
B B
B
0(
等温等压非 体积功为零)Biblioteka 化学势判据及其应用
z 应用:相平衡条件(3-24)、 化学平衡条件(3-27)
第四章 化学平衡
化学反应方向判据
动力性质、光学性质、电学性质
胶束结构 溶胶的稳定性 舒尔茨-哈代规则
溶胶的稳定性和聚沉
确定相图的类型 相图的静态分析(指出各点线面的Φ、f) 相图的动态分析
利用杠杆规则进行计算
相图的应用
第五章 相平衡
相图类型
单组分系统相图 理想的完全互溶双液系统相图 简单低共熔相图
复杂相图
具有最高(低)恒沸混合物相图 生成稳定化合物相图
第五章 相平衡
克劳修斯-克拉珀龙方程 杠杠规则
第一章 热力学第一定律
状态变化及过程
简单状态变化
等温过程(T始=T终=T环) 等容过程(V始=V终) 等压过程(p始=p终=p环) 绝热过程(Q=0) 循环过程(∮(状态函数)=0)
相变过程(等温等压) 化学变化过程(等温等压或等温等容)
第一章 热力学第一定律
热化学 化学反应的热效应 等压热效应与等容热效应的关系 (1-35) 反应热效应的计算 赫斯定律 标准摩尔生成焓的定义 标准摩尔燃烧焓的定义 如何由生成焓、燃烧焓求反应热
影响化学平衡的因素
ΔrGm =ΔrGmθ +RTlnQp
ΔrGθm=-RTlnKθ
标准平衡常数
温度 压力 惰性气体 反应配比
定义(4-15) 气相反应: Kθ ~Kp~Kx~Kn的关系 复相反应:Kθ 与分解 压的关系
第五章 相平衡
相律 相图读图的一般原则和步骤
