有机物分子式的确定 规律总结
浅析化学分子式的规律

106神州教育浅析化学分子式的规律刘逸洋内蒙古包头市第一中学摘要:化学分子式是化学学习中比较基础的知识,对于我们学好化学内容有着重要意义。
化学分子式其本身具有一定的规律,本文主要从高中生的角度出发,分析化学中分子式的相关规律,以期望能够帮助更多的同学更好学习化学。
关键词:化学;分子式;规律一、引言化学分子式主要是指用化学符号表示物质分子组成的一种式子,它们体现的是构成该化合物的成分。
另外,化学分子式还体现了各成分之间的原子数比例及重量总和,它们跟别的化学表达式之间存在很大的差异。
二、化学分子式的相关规律(一)有机物的化学分子式的规律通常有机物C.H.O.N等成分是排在第一位的,除了特殊的乙酸NA,是乙酸排于首位,NA紧随其后,除此之外的盐酸基本上是先写阳离子。
分子式和其他的表达式之间存在很大的差异,对于常见的化合物而言,分子式和其他化学表达式之间有一定的关联,也可以说它的相对分子质量和其他化学表达式之间有关联。
只有相对分子质量和其他化学表达式的相对分子质量一样时,他们所表达的含义才是一样的。
我们学习的化学分子式中,有些化合物的分子式与化学表达式是一样的。
例如:氧的分子式是O2,体现的是1个氧分子由2个氧原子构成,分子量都是31.9988。
另外,乙酸的分子式是C2H4O2,意味着1个乙酸分子由2个碳原子、4个氢原子和2个氧原子结合而成,他的分子式和最简式就是不相同的。
水分子可以写成H2O,其体现的是1个水分子由2个氢原子和1个氧原子结合而成。
氯化氢分子可以写成HCl,其体现的是1个氯化氢分子由1个氢原子和1个氯原子结合而成,HCl的分子式和化学表达式写出来是一样的。
分子式展示给我们的是该化合物的名字、相对分子质量、涵盖的成分以及数量。
在化学学习的过程中,分子式通常都是用分子晶体来表达的,而分子晶体基本上都是由各个分子之间的相互作用而形成的。
我们在学习化学的过程中,往往可以通过燃烧得到的产物判断出物质,因为这是这些元素共有的规律。
有机物分子式的确定规律总结

有机物分子式的确定一.有机物组成元素的判断某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。
欲判定该有机物中是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将碳、氢元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧;否则,原有机物的组成含氧。
二、有机物分子式的确定1、根据最简式和分子量确定分子式例1:某有机物中含碳40%、氢6.7%、氧53.3%,且其分子量为90,求其分子式。
例2:某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59g/L,写出该烃的分子式。
注意:(1)某些特殊组成的最简式,在不知化合物相对分子质量时,也可根据组成特点确定其分子式。
例如最简式为CH3的在机物,其分子式可表示为(CH3)n,仅当n=2时,氢原子已达饱和,故其分子式为C2H6。
同理,最简式为CH3O的有机物,当n=2时,其分子式为C2H6O2 (2)部分有机物的最简式中,氢原子已达饱和,则该有机物的最简式即为分子式。
例如最简式为CH4、CH3Cl、C2H6O、C4H10O3等有机物,其最简式即为分子式。
2、根据各元素原子个数确定分子式例1:吗啡分子含C:71.58% H:6.67% N :4.91% , 其余为氧,其分子量不超过300。
试确定其分子式。
例2:实验测得某烃A中含碳85.7%,含氢14.3%。
在标准状况下11.2L此化合物气体的质量为14g。
求此烃的分子式。
3、根据通式确定分子式烷烃CnH2n+2 烯烃或环烷烃CnH2n炔烃或二烯烃CnH2n-2 苯及同系物CnH2n-6用CnH2n-x(-2≤x≤6)和相对分子量可快速确定烃或分子式如某烃的相对分子质量为M,则有:12n+2n-x=M,整理得x=14n-M,当x=-2时,则为烷烃;当x=0时,则为烯烃或环烷烃;当x=2时,则为炔烃或二烯烃;当x=6时,则为苯及同系物。
有机物分子式和结构式的确定

有机物分子式和结构式的确定有机物是化学中的一个重要分支,它主要研究含碳元素的化合物。
有机物的分子式和结构式是用来描述有机物化学组成和空间构型的重要工具。
下面我将就有机物分子式和结构式的确定进行详细的介绍。
一、有机物分子式的确定:步骤一:根据元素的相对原子质量及元素在分子式中的相对数量,计算出每个元素的相对原子数目。
步骤二:将每个元素的原子数目按照化学符号的顺序写在元素符号的右下角。
步骤三:将写出的元素符号及其相对原子数目按照化学符号的习惯顺序排列,并在各元素符号之间加上符号连接符号。
举例来说,对于乙烯分子(C2H4),可以按照以上步骤确定其分子式。
乙烯分子中含有碳和氢两个元素,根据它们的相对原子质量,可以得到碳的相对原子质量为12,氢的相对原子质量为1、根据乙烯分子中碳和氢的相对原子数目,可以得到碳的相对原子数目为2,氢的相对原子数目为4、将这些数据按照步骤二和步骤三的要求排列,可以得到乙烯分子的分子式为C2H4二、有机物结构式的确定:有机物结构式是用来表示有机物分子中原子间连接关系的化学式。
步骤一:确定有机物分子中各原子的相对位置及连接关系。
步骤二:根据有机物分子的分子式和阴离子的电子离对数,确定有机物分子中各原子间的化学键的种类(如单键、双键、三键等)。
步骤三:根据有机物分子中原子间的连接关系,使用化学键的表示方法(如普通线条、斜线、双线等)来表示有机物分子的结构式。
举例来说,对于乙烯分子(C2H4),可以按照以上步骤确定其结构式。
根据乙烯分子的分子式C2H4,可以确定乙烯分子中含有两个碳原子和四个氢原子。
根据碳原子间的相对位置及连接关系,可以知道乙烯分子中两个碳原子之间存在一个双键,碳原子与氢原子之间存在单键。
根据这些信息,可以使用普通线条来表示乙烯分子的结构式,即H-C=C-H。
总结起来,有机物分子式和结构式的确定是通过确定有机物分子中各原子的种类、个数和原子间连接关系,从而准确描述有机物的化学组成和空间构型。
有机物实验式和分子式的确定

有机物实验式和分子式的确定
1)实验式的确定:通过燃烧法测定水和二氧化碳的质量比,从而测出碳、氢、氧三种元素在该有机物的最简比。
2)分子式的确定
(1)直接法
如果给出一定条件下的密度(或相对密度)及各元素的质量比(或百分比),可直接求算出1mol气体中各元素原子的物质的量,推出分子式。
密度(或相对密度)﹣﹣→摩尔质量﹣﹣→1mol气体中各元素原子各多少摩﹣﹣→分子式。
(2)最简式法
根据分子式为最简式的整数倍,因此利用相对分子质量(可用质谱法测定)及求得的最简式可确定其分子式。
如烃的最简式的求法为:
C:H:a:b,最简式为C a H b,则分子式为(C a H b)n,n=M/(12a+b)(M为烃的相对分子质量,12a+b为最简式的式量)。
(3)商余法
①用烃的相对分子质量除14,视商数和余数。
A…
其中商数A为烃中的碳原子数。
此法运用于具有确定通式的烃(如烷、烯、炔、苯的同系物等)。
②若烃的类别不确定:C x H y,可用相对分子质量M除以12,看商和余数。
(4)化学方程式法
利用燃烧反应方程式,抓住以下关键:①气体体积变化;②气体压强变化;③气体密度变化;④混合物平均相对分子质量等,同时可结合差量法、平均值法、十字交叉法、讨论法等技巧来求得有机物的分子式。
根据题意给的条件依据下列燃烧通式所得的CO2和H2O的量求解x、y:
C x H y+(x)O2xCO2H2O
C x H y O z+(x)O2xCO2H2O。
有机物分子式及结构式的确定方法

专题讲座(三) 有机物分子式及结构式的确定方法一、有机物分子式的确定1.最简式的确定。
(1)燃烧法。
则n (C)=m (CO 2)44 g·mol -1,n (H)=m (H 2O )18 g·mol -1×2,n (O)=m 有机物-n (C )×12 g·mol -1-n (H )×1 g·mol -116 g ·mol -1由它们的物质的量之比等于原子个数比可确定最简式。
(2)计算法。
根据有机物中C 和H 的质量分数来计算。
n (C)∶n (H)∶n (O)=w (C )12∶w (H )1∶1-w (C )-w (H )16。
2.相对分子质量的确定。
利用公式:a.M =m n ,b.ρ1ρ2=M 1M 2,c.M =ρ(标况)×22.4 L ·mol -1。
3.分子式的确定。
(1)由最简式和相对分子质量确定。
(2)根据计算确定1 mol 有机物中含有的各原子的数目。
(3)根据相对分子质量计算。
二、有机物结构式的确定1.根据价键规律确定:某些有机物根据价键规律只存在一种结构,则直接根据分子式确定其结构式。
例如C2H6,只能为CH3CH3。
2.通过定性实验确定。
实验→有机物表现的性质及相关结论→官能团→确定结构式。
如能使溴的四氯化碳溶液褪色的有机物分子中可能含有,不能使溴的四氯化碳溶液褪色却能使酸性高锰酸钾溶液褪色的可能是苯的同系物等。
3.通过定量实验确定。
(1)通过定量实验确定有机物的官能团,如乙醇结构式的确定;(2)通过定量实验确定官能团的数目,如1 mol某醇与足量钠反应可得到1 mol气体,则可说明该醇分子中含2个—OH。
4.根据实验测定的有机物的结构片段“组装”有机物。
实验测得的往往不是完整的有机物,这就需要我们根据有机物的结构规律,如价键规律、性质和量的规律等来对其进行“组装”和“拼凑”。
有机物分子式和结构式的确定

有机物分子式和结构式的确定有机物是由碳、氢和其他元素组成的化合物。
它们可以通过确定其分子式和结构式来进行鉴定和描述。
分子式是描述化合物中原子种类和数量的表示方式,而结构式则显示了原子之间的连接方式和化学键的类型。
确定有机物的分子式和结构式是有机化学中的重要任务之一,它们可以提供有关化合物性质和反应性的重要信息。
确定有机物的分子式和结构式通常通过实验技术和理论计算方法来完成。
下面将介绍一些常用方法和技术,以帮助确定有机物的分子式和结构式。
1.元素分析:元素分析是确定化合物中碳、氢、氧、氮等元素的相对含量的一种实验方法。
通过测定有机物中各元素的质量百分比,可以计算出简单的分子式,例如乙醇(C2H6O)和甲酸(HCOOH)。
2.红外光谱(IR):红外光谱是一种常用的实验方法,通过测量有机物与红外辐射的相互作用,可以确定有机物中的功能团和官能团。
例如,苯酚(C6H6O)和苯胺(C6H7N)可以通过其特征性的红外吸收峰进行鉴定。
3.质谱(MS):质谱是一种用于测定有机物中各个原子的相对质量的实验方法。
质谱图可以提供化合物的分子量和分子结构信息。
通过测量化合物中分子离子的质荷比,并进行分析和比较,可以确定有机物的分子式和结构式。
4.核磁共振(NMR):核磁共振是一种通过测量原子核的磁性行为来确定有机物分子结构的方法。
通过观察有机化合物中氢、碳、氧等原子核的化学位移和耦合常数,可以确定有机物的分子式和结构式。
5.X射线结构分析:X射线结构分析是一种用于确定有机物分子结构的高分辨率实验方法。
通过测定化合物晶体中X射线的衍射图样,可以确定有机物的原子排列方式和化学键长度。
除了上述实验方法外,理论计算方法如量子力学和分子力学也可以用于预测和确认有机物的分子式和结构式。
例如,计算化学方法可以用来优化化合物的几何构型,预测各个原子之间的键长和化学键角度。
综上所述,确定有机物的分子式和结构式是有机化学中的重要任务。
通过实验技术和理论计算方法,可以鉴定和描述有机物的化学结构,从而揭示其性质和反应性。
有机物分子式的确定

确定有机物分子式的方法小结一、最简式法根据有机物各元素的质量分数求出分子组成中各元素的原子个数之比(最简式),分子式为最简式的整数倍。
有机物最简式的求法为:c b a O H C O N H N C N ::16)(:1)(:12)()(:)(:)(==ωωω(最简整数比),最简式为C a H b O c ,则分子为(C a H b O c )n ,得c b a M n 1612++=(M 为有机物的相对分子质量)。
【例1】某有机物组成中含碳54.5%, 含氢9.1%,其余为氧,又知其蒸汽在标准状况下的密度为3.94 g·L -1,试求其分子式。
【解析】此有机物的摩尔质量为:M=ρ×V m =3.94 g/L×22.4 L/mol = 88 g/mol 。
C 、H 、O 的个数比为:1:4:216%1.9%5.541:1%1.9:12%5.54)(:)(:)(=--=O N H N C N 此有机物的最简式为C 2H 4O ,设其分子式为(C 2H 4O)n 。
则有:M=(12×2+1×4+16)×n=88,解得:n=2。
所以该有机物的分子式为C 4H 8O 2。
二、直接法直接计算出1mol 气体中各元素原子的物质的量,即可推出分子式。
同例1【解析】此有机物的摩尔质量为:M=ρ×V m =3.94 g/L×22.4 L/mol = 88 g/mol,,所以该有机物的分子式为C 4H 8O 2。
三、燃烧法根据有机物完全燃烧反应的通式及反应物和生成物的质量、物质的量或体积求出 1 mol 有机物所含C 、H 、O 原子的物质的量,从而求出分子式。
如烃和烃的含氧衍生物的通式可设为C x H y O z (z =0为烃),根据燃烧通式:C x H y O z +(x +4y -2z )O 2 −−→−点燃 x CO 2+2y H 2O进行计算,解出x 、y 、z 最后求得分子式。
有机物分子式的确定

有机物分子式的确定
有机物是指以碳元素为基本组成元素的化合物,基本上都在微生物、植物和动物体内发挥重要作用,其中以烃、醛、酮、酰胺和其他衍生物等成分构成。
有机物分子式确定是一项复杂的任务,它涉及到各种反应机理及化学原理的应用,并需要通过合理的化学结构来反映分子结构,以便得到完整的信息。
确定有机物分子式的最常用的方法是利用质谱和红外光谱技术。
其中质谱技术可以得出有机物的分子量大小,从而根据比例关系计算出分子中各元素的原子个数,辅以红外光谱及核磁共振等技术,可以反映分子内原子之间的配位关系,最终计算出有机物的分子式。
当然,确定有机物分子式还需要考虑反应机理,比如氧化反应、还原反应等来引导有机物发展特性,使得有机物的确切结构得以明确解析。
此外,另一种确定有机物分子式的简易方法是基于碳烃序数的概念,其基本思想是碳原子按照其在分子中的序数排列,通过键的数量和类型来代表分子的结构,于是得出的有机物分子式大体接近实际结构,但是比质谱和红外等技术反映的数据要少得多。
在高等化学领域仍了解到并应用这种方法,对于有机物分子式确定是一种简便的方式。
总而言之,有机物分子式确定是一个复杂的过程,需要综合运用化学原理和分析技术,结合具体的反应机制,才能得出准确无误的结果。
尽管大多数人在应用碳烃序数的概念时可以得出基本的有机物分子式,但其仍不能取代质谱、红外光谱及核磁共振等主流分析技术,这些方法可全面而准确地反映出有机物的分子结构。
有机物分子式、结构式的确定

C4H10O3等有机物,其实验式即为分子式核磁共振谱(PMR): 化合物分子中 的氢原子核,所处的化学环境
(即其附近的基团)不同,表现出的核磁性就不 同,代表它的峰在共振谱图中的横坐标位置就 不同,峰的强度与结构中氢原子数成正比。
③ 此外还有质谱法和紫外光谱法等。
P149 典例3 P150 应用3
有机物分子式 结构式的确定
1.实验式(最简式)法
由元素的 种类和含 量
相对原子质量
相对分子质量
实验式
分子式
相对分子质量的基本求法:
a. 定义法:M= m n
b.标况下气体密度ρ:M=22.4*ρ
c.相对密度法(d):M=d*M
注意:
(1)某些特殊组成的最简式,在不知化合物的相对 分子质量时,也可根据组成特点确定其分子式。 例(C如H3:)n 最当简n=式2时为,C氢H原3的子烃已,达其饱分和子,故式其可分表子示式为为 C2H6。
例上观分察子到式氢为原C子3H峰6O的2强的度有为机3物:3,,则若结在构P简MR式谱可
能为?
CH3COOCH3
若给出峰的强度为3:2:1,则可能为?
CH3CH2COOH、 HCOOCH2CH3、 CH3COCH2OH
② 红外光谱(IR):确证两个化合物是 否相同,也可确定有机化合物中某 一特殊键或官能团是否存在。
有机物分子式和结构式的确定方法

有机物分子式和结构式的确定方法有机物分子式和结构式的确定方法是化学研究的重要内容之一,它对有机化学的发展和应用起着重要的推动作用。
有机物的分子式和结构式表示了有机物分子中原子的种类、数量以及它们之间的连接方式。
下面将介绍几种确定有机物分子式和结构式的常用方法。
一、元素分析元素分析是确定有机物分子式的最基本方法,其原理是分析有机物样品中的碳、氢、氧、氮、硫等元素的含量,并据此计算出分子中不同元素的比例,从而得到该有机物的分子式。
例如,对于一个有机物样品经元素分析得到的结果为:C62.14%、H10.43%、O27.43%,可以根据C:H:O的比例计算出其分子式为C4H8O。
二、质谱分析质谱分析是一种通过测定有机分子在高真空条件下,通过电子轰击产生的碎片离子的质荷比,以及测定碎片离子的相对丰度,从而确定有机物的分子式和结构的方法。
质谱仪测定到的质荷比,往往能反映出有机分子的相对分子量或碎片离子的相对原子量,通过测出的质谱图的特征峰的相对丰度,可以进一步得到有机物的分子式和一些结构信息。
三、红外光谱分析红外光谱是确定有机物结构的常用方法之一、有机分子在吸收红外辐射时,会引起分子内部化学键的振动、扭转和拉伸等。
每种具有特定化学键类型的振动都会对应产生一个特定的红外吸收峰,从而提供了有机物分子中特定键的信息。
根据吸收峰的位置和强度,可以初步推断有机物中存在的官能团,从而确定有机物的结构类型。
四、核磁共振(NMR)分析核磁共振是一种利用分子中的核自旋能级差异导致的能量吸收和释放现象以及核自旋与周围电子的相互作用来研究分子结构的分析方法。
核磁共振仪测定得到的谱图,包括质子谱、碳谱、氮谱等。
通过对NMR谱图的分析,可以确定有机物中原子的化学环境和化学位移,从而进一步获得有机物分子的结构信息。
五、X射线衍射分析X射线衍射是一种利用波长短于可见光的X射线对物质进行结构表征的方法。
通过对物质样品进行X射线的照射,观察并测定样品产生的衍射图样,然后运用数学方法对衍射峰的位置和强度进行分析,可以确定有机物的晶体结构和分子结构。
有机物确定分子式的方法

CO2→m(C) H2O→m(H) 若m(C)+m(H)=m(有机物)→只含C、H 若m(C)+m(H)< m(有机物)→含C、H、O
(2)确定分子式的方法:
→ ①直接法:有机物的密度(或相对密度) 摩尔质量→1 mol 有机 物中各原子的物质的量→分子式。 摩尔质量 ②最简式法:各元素的质量分数→最简式 ―― → 分子式。
14,看商数和余数。 ③ 余数法:用烃的相对分子质量除以
③ 余数法:用烃的相对分子质量除以14,看商数和余数。
其中商数A为烃中的碳原子数,此法适用于具有特定通式的烃 如烷烃、烯烃、炔烃、苯和苯的同系物等 余数为2,则为烷烃 除尽则为单烯烃或者环烷烃 差2则为炔烃或者二烯烃
差6则为苯或者苯的同系物
④化学方程式法:利用有机反应中反应物、生成物 “量” 之间的关系求分子式的方法。
例:某化合物 6.4 g 在氧气中完全燃烧,生成 8.8 g CO2 和 7.2 g H2O,下列说法中正确的是( ) A.该化合物含碳、氢两种元素 B.该化合物中碳、氢原子个数比为 1:4 C.无法确定该化合物是否含有氧元素 D.该化合物一定是 C2H8O2
8.8 g 【解析】 n(CO2)= =0.2 mol, 知 m(C)=0.2 mol×12 1 - 44 g· mol 7.2 g 1 - g· mol =2.4 g,n(H2O)= mol 1=0.4 mol,知 m(H)=1 g· - 18 g· mol
-1×0.8
mol=0.8 g;则 m(C)+m(H)=2.4 g+0.8 g=3.2 g,3.2 g<6.4
g,故该化合物中含氧元素,其质量为 6.4 g-3.2 g=3.2 g,其物质 3.2 g 的量 n(O)= 1=0.2 mol。n(C):n(H) :n(O)=1:4:1, - 16 g· mol 实验式为 CH4O, 分子式一定不是 C2H8O2, 因为实验式中 H 原子已 饱和。 【答案】 B
期末君之讲稿(十八)有机物分子式和结构式的确定

【知识梳理】 有机物分子式的确定----------八种方法一、摩尔质量法(相对分子质量法) 直接计算出1mol 气体中各元素原子的物质的量,即可推出分子式。
如给出一定条件下的密度(或相对密度)及各元素的质量比(或质量分数比),求算分子式的途径为: 密度(或相对密度)-- 摩尔质量 1mol --气体中各元素原子物质的量 -- 分子式二、商余法(只适用于烃的分子式的求法)(1) 用烃的相对分子质量除以12,商为碳数和余数为氢数。
如:CxHy ,可用相对分子质量M 除以12,看商和余数。
即余y ,分子式为CxHy 。
(2)增减法:由一种烃的分子式,求另一种烃可能的分子式可采用增减法推断。
即减少一个碳原子必增加12个氢原子;反之,增加一个碳原子要减少12个氢原子。
三、最简式法根据分子式为最简式的整数倍,因此利用相对分子质量及求得的最简式可确定其分子式。
如烃的最简式的求法为C :H = (碳的质量分数/12):(氢的质量分数/1)= a :b (最简整数比)最简式为CaHb ,则分子式为(CaHb )n ,n=M/(12a+b ),其中M 为烃的式量。
四、燃烧通式法(1)两混合气态烃,充分燃烧后,生成CO 2气体的体积小于2倍原混合烃的体积,则原混合烃中必有CH 4;若生成水的物质的量小于2倍原混合烃的物质的量,则原混合烃中必有C 2H 2。
(2)气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,则原混合烃中的氢原子平均数大于4;若体积缩小,则原混合烃中氢原子平均数小于4,必有C 2H 2。
(温度在100℃以上)五、讨论法当条件不足时,可利用已知条件列方程,进而解不定方程,结合烃CxHy 中的x 、y 为正整数,烃的三态与碳原子数相关规律(特别是烃为气态时,x≤4)及烃的通式和性质,运用讨论法,可简捷地确定烃的分子式。
六、平均分子式法平均分子式法求判断混合烃的组成(分子式)和物质的量之比使用条件:由两种或两种以上的烃组成的混合气,欲确定各烃的分子式时,可采用此法。
高中化学有机物分子式的确定方法

高中化学有机物分子式的确定方法高中有机化学内容,知识脉络比较清晰,有机物的相互转化关系比较容易理清。
但有一部分题目,方法性较强,比如有机物分子式的确定。
有机物分子式的确定是有机化学常考的内容之一,对于刚接触有机化学的高一学生,可以在讲完烃的内容之后,通过对烃分子式的确定来归纳总结,以提高学生解化学题的水平,并且培养他们的化学思维。
高中化学有机物分子式的确定方法一、直接求算法直接计算出1mol气体中各元素原子的物质的量,推出分子式。
步骤为:密度(或相对密度)→摩尔质量→1mol气体中各元素的原子个数→分子式。
例1.0.1L某气态烃完全燃烧,在相同条件下测得生成0.1LCO2和0.2L 水蒸气且标准状况下其密度为0.717g / L,该烃的分子式是:( )A. CH4B. C2H4C. C2H2D. C3H6解析:由M=0.717g /L*22.4 L/mol=16 g/mol,可求N(C)= 0.1 L/0.1 L=1, N(H)= 0.2 L*2/0.1 L=4,即1mol该烃中含1mol C, 1mol H,则其分子式为CH4,高中化学有机物分子式的确定方法二、最简式法通过有机物中各元素的质量分数或物质的量,确定有机物的最简式(即各原子最简整数比),再由烃的相对分子质量来确定分子式。
烃的最简式的求法为:N(C):N(H)=(碳的质量分数/12):(氢的质量分数/1)=a:b(最简整数比)。
例1.某气态烃含碳85.7%,氢14.3%。
标准状况下,它的密度是1.875 g /L,则此烃的化学式是_______。
解析:由M=1.875g /L*22.4 L/mol=42g/mol,N(C):N(H)=( 85.7%/12):(14.3%/1)=1:2, 最简式为CH2,该烃的化学式可设为(CH2)n,最简式式量为14,相对分子质量为42,n=3,此烃为C3H6。
练习:某烃完全燃烧后生成8.8gCO2和4.5g水。
有机物分子式和结构式的确定方法
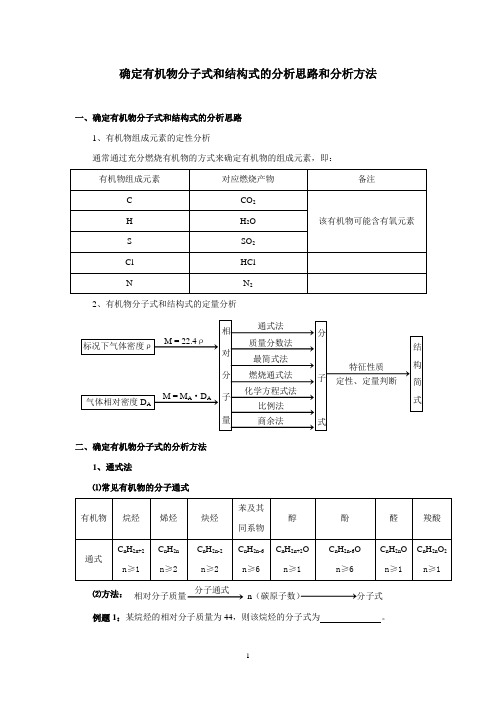
确定有机物分子式和结构式的分析思路和分析方法一、确定有机物分子式和结构式的分析思路1、有机物组成元素的定性分析通常通过充分燃烧有机物的方式来确定有机物的组成元素,即:2、有机物分子式和结构式的定量分析二、确定有机物分子式的分析方法1、通式法⑴常见有机物的分子通式分子通式⑵方法:相对分子质量n(碳原子数)分子式例题1:某烷烃的相对分子质量为44,则该烷烃的分子式为。
解析:烷烃的通式为C n H 2n+2 ,则其相对分子质量为:14n + 2 = 44 ,n = 3 ,故该烷烃的分子式为:C 3H 82、质量分数法 方法:相对分子质量C 、H 、O 等原子数分子式例题2:某有机物样品3g 充分燃烧后,得到4.4g CO 2 和1.8g H 2O ,实验测得其相对分子质量为60,求该有机物的分子式。
解析:根据题意可判断该有机物分子中一定含有C 和H 元素,可能含有氧元素。
样品 CO 2 H 2O 3g 4.4g 1.8g 则:m(C) = g g 2.144124.4=⨯m(H) = g g 2.01828.1=⨯根据质量守恒可判断该有机物分子中一定含有O 元素,则该有机物分子中C 、H 、O 元素的质量分数依次为:ω(C) =%40%10032.1=⨯ggω(H) =%67.6%10032.0=⨯ggω(O) = 1 - 40% - 6.67% = 53.33%则该有机物的一个分子中含有的C 、H 、O 原子数依次为:N(C) =212%4060=⨯N(H) = 41%67.660≈⨯N(O) =216%33.5360≈⨯ 故该有机物的分子式为C 2H 4O 2 。
3、最简式法方法:质量分数、质量比原子数之比 → 最简式分子式(最简式)n = 分子式有时可根据最简式和有机物的组成特点(H 原子饱和情况)直接确定分子式,如:例题:如例题2 ,该有机物分子中各元素原子的数目之比为: N(C) ∶N(H) ∶N(O) =12%40∶1%67.6∶16%33.53≈ 1∶2∶1故该有机物的最简式为:CH 2O ,则:(12 + 1×2 + 16)× n = 60 ,n = 2 则该有机物的分子式为:C 2H 4O 2 。
有机物分子式的确定

有机物分子式的确定,即是确定有机物分子里所含元素的种类及各原子的数目。
有机物分子式的确定是有机物学习中,最为重要的知识点之一。
关于确定有机物分子式的计算题目,也是有机物计算题目当中的重要考题之一。
那么,如何确定有机物的分子式呢?总体来讲,先得确定有机物的组成元素,然后再确定各原子的数目从而确定有机物的分子式。
下面笔者重点介绍一下在确定有机物分子式的计算当中的一些具体计算方法。
1、确定元素的组成一般来说,有机物完全燃烧后,各元素对应的产物为C→CO2,H→H2O。
若有机物完全燃烧后的产物只有CO2和H2O,则其组成的元素可能为C、H或C、H、O。
欲判断该有机物是否含有氧元素,首先应求出产物中CO2中的碳元素质量及H2O中的氢元素的质量,然后将这两种元素的质量相加,再和原有机物的质量进行比较,若相等,则原有机物中不含氧元素,若不相等则原有机物中必定含有氧元素。
2、确定分子式在确定有机物的组成元素之后,接下来根据题目条件来最终确定这几种元素构成的物质的分子式。
在确定分子式进行计算的时候,通常可以采用以下几种计算方法。
方法一、实验式法(即最简式法)根据有机物的分子式为最简式的整数倍,利用其相对分子质量及求得的最简式便可确定其分子式。
如烃的最简式求法为:例1:某含C、H、O三元素的有机物,其C、H、O的质量比为6:1:8,该有机物蒸汽的密度是相同条件下的H2密度的30倍,求该有机物的分子式。
【解析】该有机物中的原子个数比为故其实验式为CH2O,设其分子式为(CH2O)n,根据题意得:。
则该有机物的分子式为C2H4O2。
方法二、单位物质的量法根据题目中的已知条件,确定有机物的元素组成后,直接求出1mol该有机物中各元素原子的物质的量,即可推算出分子式。
若给出一定条件下该有机物气体的密度(或相对密度)及各元素的质量分数,则求解分子式的基本途径为:密度(或相对密度)→M→1mol有机物气体中各元素原子的物质的量→分子式。
有机物分子式的确定

3.商余法
①:若烃的类别不确定:CxHy,可用相 对分子质量M除以12,看商和余数.商数 和余数就是碳氢原子个数。
②:由一种烃的分子式,求另一可能烃的分子式可采用
例1. 某烃含碳92.3%,已知280 ml烃蒸气的质量是 0.975g(换算到标态),求该烃的分子量和分子式。 例2. 已知某有机物中含有6.67%的氢和53.33%的氧, 该有机物的蒸气对氢气的相对密度为15,求它的 分子式。
例3. 某气态烃 2.2g 在空气中充分燃烧,生成6.6gCO2 和3.6g水 。 在S.T.P下,该烃的密度为1.96g/L, 求该烃的分子式。
C2H4O2
练习4:1924年我国药物学家从中药麻黄中提取了 麻黄素,并证明麻黄素具有平喘作用。将10克麻黄 素完全燃烧可得26.67gCO2和8.18gH2O.测得麻黄 素中含氮8.48%,它的实验式为CxHyNzOn,已知 C10H15NO 其实验式即为分子式,求麻黄素的分子式。
某些特殊组成的最简式,在不知化合物的相对分 子质量时,也可根据组成特点确定其分子式。 例如:最简式为CH3的烃,其分子式可表示为 (CH3)n 当n=2时,氢原子已达饱和,故其分子式 为 C 2H 6。
A 、CH4
B、C2H4
C、C3H4
D、C6H6
( 2)质量相同的烃燃烧时,y/x越大,耗氧量越大
例2:下列质量相同的烃完全燃烧时消耗氧气的量由多到少的顺 ① ④ ② ③ ⑤。 序是----------------
①CH4
②C2H4
③C3H4
④C2H6
有机物分子式的确定方法

有机物分子式的确定方法一,“单位物质的量”法根据有机物的摩尔质量(分子量)和有机物中各元素的质量分数,推算出1 mol有机物中各元素原子的物质的量,从而确定分子中各原子个数,最后确定有机物分子式。
1.某化合物由碳、氢两种元素组成,其中含碳的质量分数为85.7%,在标准状况下11.2L 此化合物的质量为14g,求此化合物的分子式.二,最简式法根据有机物各元素的质量分数求出分子组成中各元素的原子个数之比(最简式),然后结合该有机物的摩尔质量(或分子量)求有机物的分子式。
三,燃烧通式法根据有机物完全燃烧反应的通式及反应物和生成物的质量或物质的量或体积关系利用原子个数守恒来求出1 mol有机物所含C、H、O原子的物质的量从而求出分子式。
如烃和烃的含氧衍生物的通式可设为C x H y O z(Z=0为烃),燃烧通式为C x H y O z+(x+y/4-z/2)O2→xCO2+y/2H2O【例2】某有机物0.6g完全燃烧后生成448mL(标准状况)CO2和0.36g水。
已知该物质的蒸气对氢气的相对密度为30,求有机物的分子式。
四,平均值法根据有机混合物中的平均碳原子数或氢原子数确定混合物的组成。
平均值的特征为:C小≤C___≤C大H小≤H__≤H大【例3】某混合气体由两种气态烃组成,取0.1 mol 该混合气态烃完全燃烧后得4.48LCO2(标准状况)和3.6gH2O则这两种气体可能是()A.CH4和C3H8B.CH4和C3H4C.C2H4和C3H4 D.C2H2和C2H6五,商余通式法(适用于烃类分子式的求法)根据烷烃(C n H 2n+2),烯烃和环烷烃(C n H 2n ),炔烃和二烯烃(C n H 2n -2),苯和苯的同系物(C n H 2n -6)的通式可以看出这些烃类物质的分子中都有一个共同的部分为C n H 2n ,这部分的式量为14n ,因此用烃的分子量除以14就可以得到分子所含碳原子数即n 值,再根据余数就可以求得烃的分子式。
有机物分子式结构式的确定

有机物分子式结构式的确定有机物是由碳元素与氢元素以及其他各种元素通过共价键结合而成的化合物。
由于碳元素具有四个价电子,能够与其他许多元素形成多种多样的化学键,因此在有机化学中,存在着大量种类繁多的有机化合物。
有机化合物的分子式和结构式是用来描述有机物分子化学组成和结构的标记。
有机物的分子式是由化学元素符号和表示原子数目的下标组成的标记,用来表示有机物分子中的原子元素组成和原子比例关系。
例如,甲烷的分子式为CH4,表示该化合物中含有1个碳原子和4个氢原子。
苯的分子式为C6H6,表示该分子中含有6个碳原子和6个氢原子。
有机物分子式的确定可以根据实验数据和化合物的基本性质进行推导。
例如,可以通过燃烧分析测定有机物中碳、氢和氧元素的质量百分比,从而推算出有机物的分子式。
此外,还可以通过光谱分析等方法确定有机物的分子式。
有机物的结构式是用来描述有机物分子中原子之间的连接方式和空间排列的标记。
它可以分为分子结构式和简化结构式两种形式。
分子结构式使用直线和点代表连接的键,用来表示原子之间的键合关系和空间位置。
简化结构式则更加简洁,只使用线段代表键,省略了一部分碳原子和氢原子的符号,仅保留了有机物分子中的功能团和主链。
对于比较简单的有机物,可以通过它们的分子式推导出结构式。
例如,对于乙醇(C2H5OH)来说,根据分子式可以知道它由两个碳原子和一个氧原子组成,其中一个碳原子上连接着一个甲基基团(CH3),另一个碳原子上连接着一个羟基团(OH)。
因此,乙醇的结构式可以表示为CH3CH2OH。
而对于较为复杂的有机物,如苯(C6H6),由于分子中存在环状结构,因此分子式无法直接推导出结构式。
在这种情况下,需要通过实验数据和化学性质等来确定有机物的结构式。
在苯的结构中,每个碳原子上连接着一个氢原子,而所有碳原子之间是通过共享电子形成π键的,因此苯的结构可以表示为一个六边形的环状结构。
总之,有机物分子式和结构式是用来描述有机化合物化学组成和结构的标记。
有机物分子式和结构式的确定

2. 实验式和分子式的区别
2. 实验式和分子式的区别
实验式(即最简式)表示化合物分子所 含元素的原子数目最简单整数比的式子。 分子式表示化合物分子所含元素的原子种 类及数目的式子。
2. 实验式和分子式的区别
实验式(即最简式)表示化合物分子所 含元素的原子数目最简单整数比的式子。 分子式表示化合物分子所含元素的原子种 类及数目的式子。
4. 已知有机物的相对分子质量或摩尔质量求分 子式的方法: (1) 最简式法 先求最简式 n(C):n(H):n(O)
(C) : (H) : (O)
12 1 16
= m:n:p
由此得该有机物的最简式为CmHnOp 后求分子式,设为(CmHnOp)x
x
Hale Waihona Puke 相对分子质量 最简式量 12m
M n
16p
4. 已知有机物的相对分子质量或摩尔质量求分 子式的方法:
3. 化合物相对分子质量的确定
2. 实验式和分子式的区别
实验式(即最简式)表示化合物分子所 含元素的原子数目最简单整数比的式子。 分子式表示化合物分子所含元素的原子种 类及数目的式子。
3. 化合物相对分子质量的确定
Mm n
M=22.4
d 1 M1 2 M2
例题:
3. 某混合气体在标准状况下的密度为0.821g/L, 该混合气体的平均相对分子质量为______.
4. 某卤代烃的蒸气密度是相同状况下甲烷密度 的11.75倍,该卤代烃的摩尔质量为:
___1_8_8_g_/_m__o_l___。
5. 如果ag某气体中含b个分子,则1摩该气体的 质量为_____a_N_A_/_b_g_____。
4. 已知有机物的相对分子质量或摩尔质量求分 子式的方法: (1) 最简式法
有机化合物分子式的元素排列

有机化合物分子式的元素排列有机化合物是由碳(C)、氢(H)、氧(O)、氮(N)以及其他一些元素组成的化合物。
它们是生命体系中至关重要的成分,也是许多化学和生物过程的基础。
有机化合物分子式的元素排列具有一定的规律,可以通过以下几个方面来探讨。
1. 简化式与分子式有机化合物的化学式通常用简化式或分子式表示。
简化式是用一个化学符号表示一个元素,然后跟上一个数字表示该元素的原子数。
例如,甲烷的简化式为CH4,表示一个碳原子和四个氢原子。
分子式是用化学符号表示每个元素,并用一个下标表示每个元素的原子数。
例如,甲烷的分子式为CH4。
2. 元素的排列顺序有机化合物的分子式中,元素的排列顺序通常按照C、H、O、N的顺序排列。
碳原子常作为主要结构骨架的构成元素,因此在分子式中通常排在首位。
氢原子数一般比较多,紧随其后。
氧和氮原子数相对较少,排在最后。
3. 元素的次序在同一个元素的原子数较多的情况下,有机化合物分子式中,通常将该元素的所有原子数写在一起,以简化表示。
例如,苯的简化式为C6H6,表示苯环中有六个碳原子和六个氢原子。
在分子式中,C和H 的顺序可以不作要求,因为它们是主要的构成元素。
4. 元素的下标有机化合物分子式中,元素的下标表示该元素的原子数。
下标直接写在元素符号的右下方。
例如,乙醇的分子式为C2H5OH,表示两个碳原子、六个氢原子和一个氧原子。
氧原子的下标表示氧原子只有一个。
5. 元素的分组有机化合物的分子式中,元素可以按照其所在的功能性团或官能团进行分组。
官能团是有一定化学性质和化学反应的结构单位。
例如,乙醇的分子式可以按照羟基(-OH)和烷基(-CH2-)进行分组,分别写为C2H5和OH。
总结:有机化合物分子式的元素排列按照化学式的规则进行,通常按照C、H、O、N的顺序排列。
元素的次序和下标也遵循一定的规律,可以根据化合物的结构和功能性团进行分组。
这种排列方式有助于我们理解有机化合物的组成结构,并为有机化学研究和应用提供了理论基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机物分子式的确定
一.有机物组成元素的判断
某有机物完全燃烧后若产物只有CO2和H2O,则其组成元素可能为C、H或C、H、O。
欲判定该有机物中是否含氧元素,首先应求出产物CO2中碳元素的质量及H2O中氢元素的质量,然后将碳、氢元素的质量之和与原有机物质量比较,若两者相等,则原有机物的组成中不含氧;否则,原有机物的组成含氧。
二、有机物分子式的确定
1、根据最简式和分子量确定分子式
例1:某有机物中含碳40%、氢6.7%、氧53.3%,且其分子量为90,求其分子式。
例2:某烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度是2.59g/L,写出该烃的分子式。
注意:(1)某些特殊组成的最简式,在不知化合物相对分子质量时,也可根据组成特点确定其分子式。
例如最简式为CH3的在机物,其分子式可表示为(CH3)n,仅当n=2时,氢原子已达饱和,故其分子式为C2H6。
同理,最简式为CH3O的有机物,当n=2时,其分子式为C2H6O2 (2)部分有机物的最简式中,氢原子已达饱和,则该有机物的最简式即为分子式。
例如最简式为CH4、CH3Cl、C2H6O、C4H10O3等有机物,其最简式即为分子式。
2、根据各元素原子个数确定分子式
例1:吗啡分子含C:71.58% H:6.67% N :4.91% , 其余为氧,其分子量不超过300。
试确定其分子式。
例2:实验测得某烃A中含碳85.7%,含氢14.3%。
在标准状况下11.2L此化合物气体的质量为14g。
求此烃的分子式。
3、根据通式确定分子式
烷烃CnH2n+2 烯烃或环烷烃CnH2n
炔烃或二烯烃CnH2n-2 苯及同系物CnH2n-6
用CnH2n-x(-2≤x≤6)和相对分子量可快速确定烃或分子式
如某烃的相对分子质量为M,则有:12n+2n-x=M,整理得x=14n-M,
当x=-2时,则为烷烃;
当x=0时,则为烯烃或环烷烃;
当x=2时,则为炔烃或二烯烃;
当x=6时,则为苯及同系物。
例:已知某烃的相对分子量为56,且此烃碳原子数为4,确定此烃的结构简式?
根据燃烧产物CO2和H2O的相对大小来判断烃或混合烃的组成.
分析主要各类烃燃烧生成的CO2和H2O量的关系:
烷烃C n H2n+2~nCO2 ~(n+1)H2O
烯烃C n H2n~nCO2~nH2O
炔烃C n H2n-2~nCO2 ~(n-1)H2O
苯及其共同物C n H2n-6~nCO2~(n-3)H2O
4、商余法确定分子式
①M/12得整数商和余数,商为可能的最大碳原子数,余数为最小的H原子数。
②若H原子个数未达到饱和,则将碳原子数依次减少一个,每减少1个碳原子即增加12个H原子,直到分子中H原子数达到饱和。
例:相对分子量为128的烃的分子式是什么?
5、根据化学方程式确定分子式
利用燃烧的化学方程式进行计算推断,要抓住以下关键:
①气体体积的变化②气体压强的变化③气体密度的变化④混合物平均式量。
同时可结合适当的方法,如平均值法、十字交叉法、讨论法等技巧。
规律如下:
(1)当烃为混合物时,一般是设平均分子式,结合反应方程式和体积求出平均组成,利用平均值的含义确定混合烃可能的分子式。
有时也利用平均分子量来确定可能的组成,此时,采用十字交叉法计算较为简捷。
例有A、B两种气态烃组成的混合气体,对H2的相对密度为17.常温常压下,取这种混合气体10 mL与80 mL O2(过量)混合,当完全燃烧后恢复到原状态,测得气体的体积为70 mL.
求:(1)混合气体的平均组成;(2)两种烃的可能组成及体积比.
解得x=2.5.
平均组成为C2.5H4.由此可知一定含有炔烃.
可能的组合及体积比为:
(2)两混合烃,若平均分子量小于或等于26,则该烃中必含甲烷。
(3)两混合气态烃,充分燃烧后,生成CO2气体的体积小于2倍原混合烃的体积,则原混合烃中必有CH4;若生成水的物质的量小于2倍原混合烃的物质的量,则原混合烃中必有C2H2。
(4)(温度在100℃以上)气体混合烃与足量的氧气充分燃烧后,若总体积保持不变,则原混合烃中的氢原子平均数为4;若体积扩大,则原混合烃中的氢原子平均数大于4;若体积缩小,则原混合烃中氢原子平均数小于4,必有C2H2。
根据混合链烃完全燃烧生成的nCO2和nH2O的多少来判断混合烃的可能组成.(1)当nH2O>nCO2时,一定会有烷烃,也可能有烯烃、炔烃.
可能组合及各类烃的关系:
(2)当nH2O=nCO2,其可能的组合为
①均为烯烃
(3) 当nCO2>nH2O可能组合,则一定有炔烃.
思考:以上的各种关系如何推出?
提示:设烷烃含x mol,烯烃含y mol,炔烃z mol.
每一种烃燃烧生成的nH2O-nCO2=△n
C n H2n+2~nCO2+(n+1)H2O △n1
1 1
x x
C n H2n~nCO2+nH2O △n2
1 0
y 0
C n H2n-2~nCO2+(n-1)H2O △n3
1 -1
z -z
(1)若组成为烷烃和烯烃的混合物
总:nH2O-nCO2=△n1+△n2=x=n烷
(2)若组成为烷烃和炔烃的混合物
总:nH2O-nCO2=△n1+△n3=x-z=n烷-n炔
其它同理可得.
例充分燃烧3L甲烷、乙烯、乙炔组成的混合物气体,生成7LCO2和4.82g水(气体体积为S.T.P测定),则原混合物气体中甲烷、乙烯、乙炔的体积比可能是()
A.1:1:1 B.1:2:3 C.3:2:1 D.3:1:2
∵nCO2>nH2O
∴n烷<n炔∴正确答案:B.
(5)当条件不足时,可利用已知条件列方程,进而解不定方程,结合烃C x H y中的x、y为正整数,烃的三态与碳原子数相关规律(特别是烃为气态时,x≤4)及烃的通式和性质,运用讨论法,可简捷地确定烃的分子式。
6、运用等效原理推断有机物的分子组成
进行等量代换确定出同式量其他烃或烃的衍生物的化学式:
(1)1个C原子可代替12个H原子;
(2)1个O原子可代替16个H原子或1个“CH4”基团;
(3)1个N原子可代替14个H原子或1个“CH2”基团,注意H原子数要保持偶数。
例:某有机物分子中含有40个电子,它燃烧时只生成等体积的CO2和H2O(g),该有机物若为烃,分子式为______________________
若为烃的衍生物,分子式为______________
解析:①先求出烃的分子式. 根据题意,生成的CO2和H2O(g)体积相等,可设该烃分子式为(CH2)n,而CH2含8e.故为C5H10.
②推断烃的含氧衍生物
一个O原子含8e,正好相当于CH2所含电子数(等效原理)
即O~CH2 故可用一个O代替一个CH2进行变换
若已知有机物的式量、耗氧量、电子数,均可据CH2的式量(14)、耗氧量(1.5)、电子数(8)确定有机物的分子式。
如:
(1)某烃的式量是128,则128/14=9……2,则此烃则此烃含9个CH2和2个H,其分子式为C9H20、C10H8
(2)某烃1mol充分燃烧耗氧7.5mol则7.5/1.5=5,则此烃分子含5个CH2,其分子式为C5H10,由等量变换(4个H耗氧量与1个C同)可得变式C6H6。
(3)某烃分子中含42个电子,则42/8=5……2,5表示该烃含5个CH2,2表示余2个电子即表示除5个CH2外还有2个H,其分子式为C5H12,由等量变换(6个H含电子数与1个C同)可得变式C6H6。
例:常温有A、B两份混和气体,A是烷烃R与足量O2的混合气体;B是烷烃R与炔烃Q及足量O2的混合气体,各取2.24升A、B引燃,充分燃烧后气体总体积A仍为2.24升,B为2.38升.(同温同压且t>100℃)
求:①烷烃R和炔烃Q的分子式
②2.24升B中,R所允许最大值.
解∵A燃烧前后△Vg=0且t>100℃
∴烷烃R中H原子数为4,可推出R一定为CH4.
又B燃烧V后-V前=△Vg>0,设B的平均组成为CxHy.则y>4
Q的通式为C n H2n-2.
∵Q为气态(常温).∴n≤4而y>4.
即2n-2>4.n>3
∴Q只能为C4H6.
设C4H6为xL,CH4为yL.C4H6完全燃烧耗O2 zL.
2C4H6+11O2→ 8CO2+6H2O(g) △Vg
2 11 1
x z 2.38-2.24
x=0.28L z=1.54L
CH4~2O2
y 2y
3y≤2.24-0.28-1.54=0.42
y≤0.14L
答:(1)R为CH4.Q为C4H6.
(2)2.24LB中,R所允许的最大值为0.14L.。
