第四章 水环境化学
环境化学 课件第一章

近年来,全世界平均每年约发生200多起
严重公害事件。世界瞩目的有下面7起
(1)意大利塞维索化学污染事故。1976年7月10日意大利北部塞维索地区的一家 农药厂爆炸,导致剧毒化学品二恶英的污染,使许多人中毒,附近居民被迫迁走, 几年内当地畸形儿的出生率大为增加。 (2)美国三里岛核电站泄露事故。这次事故发生在1979年3月28日,直接经济 损失达10多亿美元。 (3)墨西哥的液化气爆炸事故。1984年11月19日,墨西哥国家石油公司所属 的液化气供应中心发生爆炸,死亡1000多人,伤400多人,3万多人无家可归。 (4)印度博帕尔农药泄漏事故。1984年12月3日,美国联合碳化物公司设在博 帕尔市的农药厂的剧毒化学品异氰酸甲酯罐爆裂外泄,受害人数20万,死亡 3000人以上。 (5)原苏联切尔诺贝利核电站泄露事故。1986年4月26日位于基辅地区的切尔 诺贝利核电站四号反应堆爆炸,造成重大放射性污染,周围十多万居民被疏散, 伤数百人,死亡31人。 (6)莱茵河污染事故。1986年11月1日,瑞士巴塞赞德兹化学公司的仓库起火, 使大量有毒化学品随灭火用水流进莱茵河,造成西欧10年来最大的污染事故。 (7)海湾战争造成的环境污染。1991年的海湾战争历时42天,期间油井大火昼 夜燃烧,是迄今历史上最大的石油火灾及海洋石油污染事故,也是人类历史上最 严重的一次环境污染,其污染程度超过切尔诺贝利核电站发生的核泄漏事故。这 次战争所造成的环境污染是灾难性的,已给世界带来了影响。
洪灾等。
次生环境问题:人类生产、生活引起生态破坏和环境污染,反过来危
及人类生存和发展的现象,也称第二类环境问题。又包括:环境污染 和生态破坏。目前的环境问题一般都是次生环境问题。
生态破坏:人类活动直接作用于自然生态系统,造成生态系统的生产能力显著 减少和机构显著该变,如草原退化、物种灭绝、水土流失等。
《水环境化学》课件

水环境化学的重要性 和应用
水环境化学对于保护水资 源、维护环境、促进可持 续发展具有重要的意义。
水的物理化学性质
溶解度溶解度是指单位体Fra bibliotek溶液中 最多能溶解多少物质,它是 表征物质在水中溶解程度的 重要参数。
离子强度
水中的离子强度是所有阴离 子和阳离子的浓度之和和它 们的电荷平方和之比的平方 根。
pH值
水环境监测方法
通过水质监测,及时发现水体 污染的情况,采取有效的技术 措施来防治和修复水体污染。
水环境化学的未来
1 水环境化学的发展趋势
未来水环境化学将逐渐转向绿色、可持续和低碳化发展。
2 水环境化学的应用前景
水环境化学需求将继续增长,未来将更多地应用于水资源保护、净化和开发领域。
3 水环境化学的挑战与机遇
水环境化学
水是地球上最珍贵的资源之一,水环境化学是研究水体的化学性质、污染及 其净化和水质监测的学科。
水环境化学简介
什么是水环境化学?
水环境化学是研究水及其 体系在自然界和生产生活 中的各种过程所涉及到的 化学现象的学科。
水环境化学的研究对 象和内容
研究水环境中各种物质的 迁移、转化和去除,以及 不同水环境对生态环境的 影响。
3
物理污染物
有些物理污染物如悬浮物、浮游生物、颗粒物或沉积物都会影响水的质量和可用性。
水的净化与处理
常见水污染物的去除方法
颗粒物、悬浮物主要通过过滤 和沉淀去除,生物污染物主要 通过消毒去除,化学污染物主 要依靠氧化、还原、沉淀和离 子交换等方法除去。
常见水处理技术及其原理
如生物处理、深度处理、反渗 透等技术,利用技术手段将水 中的污染物清除或降低到符合 生产和生活需求的标准。
水资源与水环境,第四章(天然水化学)

☆大气降水中所含溶解气体十分稳定,浓度几乎不变,但CO2成分不稳定。
☆大气降水中二氧化硅含量很小,一般不超过0.5mg/L。
大气降水的pH值一般为5.5-7.0左右。
☆目前,酸雨已成为全球性的重大环境问题之一。
海水占地球总水量的97.2%,世界各地海洋水质基本相似和稳定。
各种天然存在的元素,在海水中几乎都能发现,它们以单离子、络合离子、分子等各种形式存在。
海水占地球总水量的97.2%,世界各地海洋水质基本相似和稳定。
各种天然存在的元素,在海水中几乎都能发现,它们以单离子、络合离子、分子等各种形式存在。
34g 3☆宏量组分海水中宏量组分的含量按其顺序为Cl、Na、SO4、Mg、Ca、K、HCO3、Br,它们的总量占海水溶解物质的绝大部分,即99.94%。
☆中量组分它们是指含量为0.1-10mg/L的组分,这些组分是:Sr、SiO2、B、F、NO3、Li、Rb、C(有机)。
☆微量组分它们是指其含量小于0.1mg/L的组分。
它们包括P、I、Ba、Zn、Ni、As等30多种。
☆海水的含盐度大到在34‰-36‰范围内,只有含量范围变化很大,Na和Cl比也有些变化。
☆海水中含有溶解的和悬浮的有机物,一般有机碳含量在0.1-2.7mg/L范围。
2、海水的成分特征2、海、海水的成分特征3、河水的成分特征☆不同地区的岩石、土壤组成决定着该地区河水的基本化学成分。
在结晶岩地区,河流水中溶解离子含量较少;在石灰岩地区,河水中富含Ca2+及HCO3;若河流流经白云岩及燧石层时,水中Mg、Si含量增高;河流流经石膏层时,使水中富含SO4,且总含盐量有所增加;富含吸附阳离子的页岩及泥岩地区则向河水提供大量溶解物质,如Na、K、Ca、Mg。
☆河水中总含盐量在100-200mg/L间,一般不超过500mg/L,有些内陆河流可以有较高的含盐量。
河水中主要离子关系与海水相反,即其次序为Ca>Na,HCO3> SO4>Cl。
《水环境化学》课程标准

《水环境化学》课程标准一、前言(一)课程基本信息1.课程名称:水环境化学2.课程类别:专业基础课3.学时:60-804.适用专业:水环境监测与治理/城市水净化技术(二)课程性质本课程是高职高专水环境监测与治理专业基础课程。
本课程是培养和锻炼学生水环境污染分析能力的核心课程,使学生了解常见化学污染物质在水体环境中的行为、效应及其影响因素,掌握典型水污染事件的分析方法,获得水质关键指标的测定分析能力。
通过对《水环境化学》这门课程的学习,将使学生了解当代水环境问题,熟悉和掌握有关污染物在水环境介质中迁移、转化规律的基本知识、基本理论、基本技能和基本方法,使学生今后能够在水文水资源工程的专业岗位上,对各自区域内的水质和水量问题和水质问题作本课程以《分析化学》、《有机化学》和《仪器分析》等课程的学习为基础,为进一步学习《水质检验技术》、《给水处理》、《水污染控制技术》和《工业废水处理》等专业技术课程服务,为学生练就水质与水环境分析、水净化工程设计和水处理设施运行维护等岗位工作能力奠定知识和能力基础。
(三)课程标准的设计思路1.课程设置的依据经过企业调研、往届毕业生就业岗位调研和行业专家座谈,决定把水质检验分析岗位、水净化工程、水处理设施运行维护和水质工程辅助设计岗位作为城市水净化技术专业的就业核心岗位群,把水环境化学课程作为培养学生水质及水环境污染分析能力的核心专业基础课程。
2.课程改革的基本理念课程以工作任务确定职业能力,以职业能力为目标,对接行业标准,关注职业素养,构建由项目带动、任务驱动的工作过程化课程;教学中贯穿工学结合,体现工作过程,达到教、学、做的融合;注重运用多媒体教学、现场教学等教学手段;实施多元评价,全方位关注学生对知识和技能的掌握。
以现实存在的水环境污染事件为载体组织课程内容和课程教学,让学生在完成具体案例分析的过程中掌握知识和技能,通过一个个污染事件的分析、讨论和总结训练最终提高学生的行业知识和分析能力。
水环境化学-天然水中的氧化还原平衡
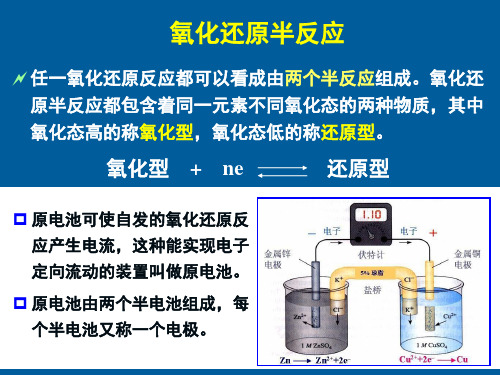
半反应的平衡常数: K [Re d ]
[Ox ][ e]n
电子活度和氧化还原电位的关系
• pE0 = E0 F / 2.303RT = E0 /0.059=16.92E0 ( 25℃ ) pE = E F / 2.303 RT = E /0.059=16.92E ( 25℃ )
pE = pE0 + 1/n lg [Ox]/[Red]
pE pE0 1 lg J n
水中常见氧化还原反应的pE0
3、天然水体的电位
自然环境中最重要的氧化剂
在自然环境中最重要的氧化剂是大气圈中的自由氧 和水圈的溶解氧,其次是三价铁、四价锰、六价的硫、 铬、钼及五价的氮、钒、砷等也都是自然界的氧化剂。
自然环境中最重要的还原剂
自然环境中最主要的还原剂是二价铁、负二价硫及 许多有机化合物;此外,二价锰、三价铬、三价钒等也 都是自然环境中的还原剂。
NH4+-NO2--NO3--H2O体系的pE-lgc图(pH=7)
(pE0 = 0, PH2=1atm) •pEH+/H2 = -pH (氢线)
边界条件
(2)1/4 O2 + H+ + e- ==1/2 H2O (pE0 = 20.75, PO2=1atm) pEO2/H2O = 20.75 - pH (氧线)
pEH+/H2 = -pH (氢线) pEO2/H2O = 20.75 – pH(氧线)
E E 2.303RT lgJ nF
E E 2 .303 RT lg c (还原型 )
nF
c (氧化型 )
半反应: 氧化型 + ne 还原型
E E 2 .303 RT lg c (还原型 )
养殖水环境化学知识点

养殖水环境化学知识点水环境在养殖过程中起着至关重要的作用,对养殖生物的生长发育、养殖水质的稳定性和品质都具有直接影响。
了解养殖水环境的化学知识点,有助于养殖人员更好地维护和管理水质,提高养殖效益。
下面将介绍几个重要的养殖水环境化学知识点。
一、pH值pH值是指养殖水中氢离子活性的酸碱度指标。
pH值的变化直接影响养殖水中营养物质的溶解度、养殖生物的生理代谢以及细菌、病原微生物的繁殖情况。
不同的养殖对象对pH值的要求也有所不同,因此养殖水的pH值需要根据具体情况进行调节和控制。
二、氨氮氨氮是常见的养殖水环境指标之一,主要来自养殖生物的代谢废物和饲料残留物。
过高的氨氮含量会对养殖生物的呼吸和免疫系统造成一定的压力,甚至导致养殖生物的死亡。
因此,合理控制和监测养殖水中的氨氮含量,是维持养殖水质的关键。
三、硫化氢硫化氢是一种具有剧毒的气体,常常由于底泥产生并溶解到养殖水中。
硫化氢对养殖生物的呼吸和生理机能产生严重影响,高浓度的硫化氢还可导致养殖生物的中毒和死亡。
因此,定期清除底泥、增加氧气供应和保持充足的水流是减少硫化氢的重要措施。
四、溶解氧溶解氧是养殖水中最为重要的物理化学指标之一,是维持养殖生物呼吸和健康生长的关键因素。
养殖池塘、养殖箱或养殖槽等养殖设施的氧气供应方式和水流状况会影响养殖水中溶解氧的含量。
充足的溶解氧有利于提高养殖水的质量,减少氨氮和硫化氢含量。
五、硬度水的硬度主要由溶解在水中的钙、镁等离子所决定,是衡量水中钙、镁离子含量的指标。
水的硬度对养殖生物的生长和骨骼发育很重要。
不同的养殖对象对水的硬度要求不同,因此根据养殖对象的要求,适当调节养殖水的硬度是必要的。
综上所述,养殖水环境的化学知识点包括pH值、氨氮、硫化氢、溶解氧和水的硬度等。
合理控制和管理这些指标,可以提高养殖水质,保障养殖生物的生长和养殖效益。
希望本文所介绍的养殖水环境化学知识点能对养殖人员提供一定的参考和帮助。
水环境化学参考答案

水环境化学参考答案《水环境化学》重点习题及参考答案1.请推导出封闭和开放体系碳酸平衡中[H2CO3*]、[HCO3-]和[CO32-]的表达式,并讨论这两个体系之间的区别。
解:(1)封闭体系(溶解性CO2与大气没有交换)中存在下列平衡CO2 + H2O H2CO3* pK0=1.46H2CO3* HCO3- + H+pK1=6.35HCO3-CO32- + H+pK2=10.33其中K1=[HCO3-][H+] / [H2CO3*] ,K2=[CO32-][H+] / [HCO3-]用α0、α1和α2分别表示三种碳酸化合态在总量中所占比例,得下面表达式α0= [H2CO3*]/{[H2CO3*] + [HCO3-] + [CO32-]} α1= [HCO3-]/{[H2CO3*] + [HCO3-] + [CO32-]}α2= [CO32- ]/{[H2CO3*] + [HCO3-] + [CO32-]}把K1、K2的表达式代入以上三式,得α0= (1 + K1/[H+] + K1K2/[H+]2)-1α1= (1 + [H+]/ K1 + K2/ [H+] )-1α2= (1 + [H+]2/ K1K2 + [H+]/ K2)-1设C T = [H2CO3*] + [HCO3-] + [CO32-],则有[H2CO3*] = C T(1 + K1/[H+] + K1K2/[H+]2)-1[HCO3-] = C T(1 + [H+]/ K1 + K2/ [H+] )-1[CO32- ] = C T(1 + [H+]2/ K1K2 + [H+]/ K2)-1(2)开放体系中CO2在气相和液相之间平衡,各种碳酸盐化合态的平衡浓度可表示为P CO2和pH的函数。
依亨利定律:[CO2(aq)]=K H·P CO2溶液中,碳酸化合态相应为:C T = [CO2]/ α0= K H·P CO2/ α0[HCO3-]= (α1/ α0 )K H·P CO2= (K1/[H+])K H·P CO2[CO32-]= (α2/ α0 ) K H·P CO2= (K1K2/[H+]2)K H·P CO2(3)比较封闭体系和开放体系可发现,在封闭体系中,[H 2CO 3*]、[HCO 3-]、[CO 32-]等可随pH 值变化,但总的碳酸量C T 始终不变。
完整版一到四章《环境化学》(戴树桂_第二版)课后习题解答

《环境化学》(戴树桂第二版)课后部分习题解答第一章绪论4、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课?环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。
其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。
5、环境污染物有哪些类别?主要的化学污染物有哪些?按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:1.元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等3.有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、PAH等;4.金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;5.含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;6.含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;7.有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;8.有机硫化物:硫醇、二甲砜、硫酸二甲酯等;9.有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。
第水环境化学(共10张PPT)

cp—单位溶液理体积论上颗,粒物即的浓非度k离g/L子; 性有机化合物可通过溶解作用分配到土壤
有机质中,并经一定时间达到分配平衡,此时有机化合物
在土壤有机质和水中含量的比值称分配系数。
第5页,共10页。
▪实际上,有机化合物在土壤(沉积物)中的吸着存在着二种主要机
作用、挥发作用、水解作用、光解作用、生物富集和生物降 解作用等过程进行迁移转化。
第4页,共10页。
二、分配作用
1.分配理论
▪近20年来,国际上对有机化合物的吸附分配理论开展了
使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解,酸性增强情况下,金属Hg容易甲基化;
②靠吸范附 德作华用力,,广即后在者泛非则研极是性各究有种机化。溶学剂键结中力果,如土氢均壤键矿、表物离明质子对偶,有极机键颗化、合配粒物位物的键表及(面π沉键吸作积附用作物的用结或或果于。土土壤壤矿物)从质对水有机中化合吸物的表面吸附作用,前者主要
cT = cs·cp+cw 式中:cT—单位溶液体积内颗粒物上和水中有机毒物质量的总和ug / L;
cs—有机毒物在颗粒物上的平衡浓度,ug/kg;
cp—单位溶液体积上颗粒物的浓度kg/L;
cw—有机毒物在水中的平衡浓度,ug/L。
此时水中有机物的浓度(cw)为:cw =cT / (Kp cp十1)
第7页,共10页。
▪一般吸附固相中含有有机碳(有机碳多,则Kp大),为了在类型各异组分复 杂的沉积物或土壤之间找到表征吸着的常数,引入标化分配系数(Koc):
➢ 使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解, 酸性增强情况下,金属Hg容易甲基化; ➢ 静止水体的富营养化。
水环境化学知识点总结

易水解的有机污染物:卤代烷烃 酰胺 胺 羧酸酯 氨基甲酸盐 环氧化物 腈类 有机磷酸酯 尿素类 磺 酸酯 酐
29、简述有机配位体对水体中重金属迁移的影响。
答:水溶液中共存的金属离子和有机配位体经常 生成金属配合物,这种配合物能够改变金属离子 的特征从而对重金属离子的迁移产生影响,起通 过影响颗粒物对重金属的吸附和影响重金属化合 物的溶解度来实现。
19、微生物代谢途径:〔1〕通过酶催化的亲核 水解反响〔2〕利用氧的亲电行为的氧化反响〔3〕 通过氢化物亲核行为或复原金属的复原反响〔4〕 加成反响或自由基H提取和富里酸加成反响
20、降水中主要的阴离子有 硫酸根离子 、氯离 子 、硝酸根离子 、亚硝酸根离子 。
21、pH<pK1 6.35时,溶液中主要以H2CO3*为 主; pH>pK2 10.33时,溶液中主要以CO32-为主; pH介于pK1与pK2之间时,溶液中主要以HCO3为主。
14、沉淀物中重金属重新释放诱发因素:①盐浓 度升高:碱金属和碱土金属阳离子可将被吸附在 固体颗粒上的金属离子交换出来。②氧化复原条 件的变化:有机物增多,产生厌氧环境,铁猛氧 化物复原溶解,使结合在其中的金属释放出来。 ③pH值降低:氢离子的竞争吸附作用、金属在低 pH值条件下致使金属难溶盐类以及配合物的溶解。 ④增加水中配合剂的含量:天然或合成的配合剂 使用量增加,能和重金属形成可溶性配合物,有 时这种配合物稳定性较大,以溶解态形式存在, 使重金属从固体颗粒上解吸下来。
13、腐殖质的组成:由生物体物质在土壤、 水体和沉积物中经腐败作用后的分解产物, 是一种凝胶性有机高分子物质。分为腐殖 酸:溶于稀碱但不溶于酸的局部;富里酸: 即可溶于碱又可溶于酸的局部; 腐黑物:
水环境化学有机物挥发作用水解光降解

实际上,水解速率与pH有关: Kh = Kn + Ka[H+]+ Kb[OH-]
Kh为水解反应速率常数。从上式看出,在一 定温度下水解速率取决于其类别(Kn、Ka、Kb 值不同)、浓度和介质的pH。
介质pH改变可引起水解速率的变化,其变化值可通过计算
Kh求得。水解常数与的关系,作lg Kh -pH图。从图中可知,
对于有机污染物的挥发作用及挥发速率人们更 为关注。
例如,大部分卤代脂肪烃及芳香烃化合物具有挥发性, 有从水体向大气挥发的倾向。
美国环保局确定的114种优先有机污染物中,具有挥发 作用的为31种,约占27%。
虽然这些有机物也能被微生物不同程度地降解,但在 流速较快的河流中,挥发到大气中是它们的主要迁移 途径。
1. 大多数环氧化物具有高度的反应性,因为它们 含有张力环。
2. 环氧化物可发生中性、酸催化、和碱催化反应, 多数情况下生成二醇,有时也生成酮。
3. 环氧化物的“短寿”也有例外,如有机氯杀虫 剂(如狄试剂 )。狄试剂由于具有两个碳环骨 架,从而产生了空间位阻(steric hinderance ), 因此是一种非常稳定的环氧化物。
挥发速率方程
c t
KV Z
(C
p KH
)
K
V
(C
p KH
)
式中 C 表示溶解相(水)中有机物的浓度 Kv 表示挥发速率常数 Kv′表示单位时间混合水体的挥发速率常数 Z 表示水体混合深度 P 表示水体上方有机物的大气分压 KH 表示亨利定律常数
多数情况下大气中有机化合物的分压几乎为零, 则该方程可简化为:
实验证明:DDT、2,4-D、辛硫磷、三硝基甲苯、苯 并(a)蒽、多环芳烃等均可发生光化学反应。如有人用 波长254 nm的紫外光照射DDT的己烷溶液,发现15 min内DDT损失43%;1 h内损失70%;4 h内损失97%; 其光化学反应的主要产物是DDE和DDD。反应过程可 表示如下:
水环境化学

环境化学-绪论 PPT课件

环境问题
• 人类生活和生产活动不断影响和改变环境条件,甚至引起环 境污染。
• 工业化过程中的处置失当,特别是对自然资源的不合理开发 利用,造成了全球性的环境污染和生态破坏。 空气、水和土地污染的环境退化现象 臭氧层破坏 气候变化 水资源的短缺和污染 有毒化学品和团体废弃物的危害 生物多样性的损伤
2. 造成环境污染的三因素 物理的
噪声、震动等 化学的
九大类 生物的
大米草、水葫芦、赤藻等
温室效应
酸雨
光化学烟雾
伦敦烟雾事件
臭氧空洞
海洋污染
赤潮
农药污染
3. 认识环境问题的三个阶段
环境问题并非只限于环境污染,人们对现代环境 问题的认识有个发展过程。 第一阶段:在20世纪60年代人们把环境问题只当成一 个污染问题,认为环境污染主要指的是城市和工农业 发展带来的对大气、水质、土壤、固体废弃物和噪声 的污染。对土地沙化、热带森林破坏和野生动物某些 品种的濒危灭绝等并未从战略上予以重视。我国当时 以污染控制为中心进行环境管理,曾对改善城市和人 民生活的环境质量起了重要作用。 存在问题:没有把环境问题与自然生态联系起来,低 估了环境污染的危害性和复杂性,没有把环境污染与 社会因素相联系,未能追根寻源。
每年有600万公顷具有生产力的旱地变成沙漠
有1100多万公顷的森林遭到破坏
在非洲,干旱将3500万人置于危难之中
在印度,博帕尔农药厂化学品泄漏造成两千人死亡
在墨西哥城,液化气罐爆炸使千人遇难
在前苏联,切尔诺贝利核反应堆爆炸使核尘埃遍布欧洲
在瑞士,农用化学品、溶剂和录污染了莱茵河,使数百万 尾鱼被毒死
样是热门课题。
(2)各圈层环境化学
水环境化学名词解释

水环境化学名词解释名词解释总硬度HT:在一般天然水中,主要是Ca2+和Mg2+,其他离子含量很少。
通常,水中Ca2+和Mg2+的总含量称为水的总硬度ht碳酸盐硬度(hc):由于水中含有ca(hco3)2和mg(hco3)2而形成的硬度,经煮沸后可把硬度去掉,这种硬度称为碳酸盐硬度,亦称暂时硬度。
非碳酸盐硬度(HN):由于水中含有CaSO4(CaCl2)和MgSO4(MgCl2)等盐类物质而形成的硬度,煮沸后无法去除。
这种硬度称为非碳酸盐硬度,也称为永久硬度。
当量粒子:对于还原性物质,一个当量粒子是指与1个氢原子具有相同的还原能力的粒子毫克当量:对于还原性物质,与1mg(1mmol)氢的还原能力相等的物质叫做1毫克当量。
含水率定义:树脂含水率一般以每克湿树脂(在水中充分膨胀)所含水分的百分比表示(约50%),并且相应地反映了树脂网架中的孔隙率溶胀性定义:树脂体积变化的现象称为溶胀总交换容量:一定量树脂的活性基团或可交换离子的总数。
工作交换容量:给定工作条件下的实际可用交换容量。
完交换容量:完全交换容量也称最大容量、理论容量,是干燥恒重的单位质量h型或cl型树脂中可交换离子(离子基团)的总数量。
固定床:在离子交换器中填充离子交换树脂(或磺化煤)。
在操作过程中,树脂不会被输送出去,因此被称为固定床复床指阳、阴离子交换器串联使用,达到水的除盐的目的。
半透膜:只允许溶质或溶剂透过的膜称为半透膜。
半透膜属于选择透过性膜。
选择渗透膜:如生物膜和细胞膜。
扩散方法包括自由扩散、辅助扩散和主动运输。
透析如果用膜把一个容器分隔成两部分,在膜的一侧放入溶液,在膜的另一侧放入纯水,则把小分子溶质透过膜向纯水侧的迁移过程称为渗析(溶质透过膜的现象)。
渗透如果只有纯水侧的纯水通过膜迁移到溶液侧,但溶质不穿透,则此过程称为渗透(溶剂穿透膜的现象)。
水面的综合散热系数:在单位时间内、水面温度变化1oc时,水体通过单位表面散失的热量变化量,单位:w/(m2?oc)湿空气:干空气和水蒸气的混合物。
养殖水环境化学 -回复

养殖水环境化学 -回复
养殖水环境化学是关于养殖水环境中化学成分以及其相互作用和变化的研究。
在养殖水体中,化学物质的存在和变化会直接影响养殖生物的健康和生产效益。
养殖水环境化学主要研究以下几个方面:
1. 水质成分:包括水中的无机盐、溶解氧、氨氮、硫化物、硝酸盐和磷酸盐等化学物质的含量和浓度。
这些物质的变化可能会对养殖生物的生长、免疫力和生殖力产生影响。
2. 水体酸碱度:水体的酸碱度会影响水中溶解氧量、鱼类的呼吸和养殖水生物的适应能力。
酸性或碱性过高的水体会导致养殖生物的生长受限甚至死亡。
3. 水体有机物:包括有机废物和残留的兽药等有机化合物。
有机废物的积累会增加水体的污染风险,而兽药残留可能对水生生物和人类健康造成危害。
4. 水体污染物:包括重金属、农药、抗生素和工业废水排放物等。
这些污染物的积累和浓度超标可能会对养殖生物造成伤害,甚至引发生态系统的紊乱。
养殖水环境化学研究的目标是通过控制和调节养殖水质环境中的化学参数,提高养殖生物的健康和养殖效益,同时减少对环境的影响和污染。
水环境化学2000字介绍

水环境化学2000字介绍水环境化学是研究水圈中的化学物质在水中迁移、转化和积累的学科,涉及到水圈中的大气降水、地表水和地下水等各个领域。
随着人类活动对水环境的破坏日益严重,水环境化学的研究越来越重要。
本文将介绍水环境化学的基本概念、研究内容和应用价值,以及当前水环境化学研究的热点和挑战。
一、水环境化学的基本概念水环境化学是研究水圈中的化学物质在水中迁移、转化和积累的学科。
水圈中的化学物质包括自然因素和人类活动所排放的化学物质,如氮、磷、重金属、有机污染物等。
这些物质在水中会通过各种途径进行迁移和转化,例如通过地表水的流淌、地下水的渗透等方式进入水环境,也可以通过生物、化学等过程进行转化和降解。
水环境化学研究的主要目的是了解这些物质在水中的分布、迁移和转化规律,从而为环境保护和治理提供科学依据。
二、水环境化学的研究内容水环境化学的研究内容涵盖了水圈中的各个方面。
以下是一些主要的研究内容:1. 大气降水和地表水的化学组成及变化规律大气降水和地表水是水环境中最为重要的组成部分。
水环境化学研究大气降水和地表水的化学组成及变化规律,可以了解水圈中化学物质的分布和变化趋势,为环境保护和治理提供科学依据。
2. 地下水的化学组成及地下水污染修复地下水是许多城市和农村的重要水源,但是人类活动所排放的化学物质也可能导致地下水的污染。
水环境化学研究地下水的化学组成及地下水污染修复,可以帮助人们了解地下水的水质状况,制定有效的地下水污染防治措施,以及地下水的修复和治理方案。
3. 水环境中的生物群落和代谢过程水环境中的生物群落和代谢过程对水环境的化学稳定性具有重要影响。
水环境化学研究水环境中的生物群落和代谢过程,可以揭示人类活动对水环境中生物群落和代谢过程的影响,以及水环境中生物群落和代谢过程对化学物质的转化和降解作用。
三、水环境化学的应用价值水环境化学的研究可以为环境保护和治理提供科学依据,同时也具有广泛的应用价值。
以下是一些主要的应用价值:1. 水质监测水质监测是水环境化学研究中最基本的应用之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•可用亨利定律(Henry’s law)表示:
•
Pg = KHCequil
Cequil= KH Pg
•式中:Pg — 溶液中溶质在气相中的平衡分压, kPa;
KH — 亨利常数, kPa•m3/g; Cequil — 液相中污染气体的浓度,g/m3。
表3-1 25℃时一些气体在水中的亨 利定律常数
淡水占总水量的2.7%。
分布
▪ 但是这些淡水的99%却难以直接被人们利 用.因为地球南、北极的冰帽和高山的冰 川储存了淡水的77%,地下水占22%,容 易利用的江河湖水及浅层地下水仅约占总 淡水量的1%.人们正是利用这些少量淡水, 解决生活和工农业生产的用水要求.
▪ 我国淡水资源年供应量约为2.8×1015kg,居 世界各国的第六位.但由于人口众多,国土辽 阔,平均每人占有的水资源量远远低于世界的 平均水平.我国水资源的分布随地域和季节有 很大差异.洪涝灾害和干旱缺水在我国普遍而 经常地出现.供水短缺,将是我国在21世纪所 面临的重大问题.
b)离子交换软化法. 使水通过钠型的
聚苯乙烯磺酸型离子交 换树脂,使水中Ca2+置 换 树 脂 上 的 Na+ 而 除 去 Ca2+.当树脂被Ca2+饱 和而失去交换能力时, 通 浓 食 盐 水 让 Na+ 置 换 Ca2+而再生。
B 海水
▪ 从长远看,海水最有价值的组分是淡水.海水 淡化已在某些地区进行工业化生产.主要方法 有二:
0—4 ° 4—8 ° 8一16 ° 16—30 ° >30 °
很软水 软水 中硬水
Hale Waihona Puke 硬水 很硬水含HCO3-的水称为暂时硬水,因加热时它会发生 如下化学反应而使之软化:
Ca2++2HCO3- CaCO3 + CO2+H2O 含Cl-,SO42-的水不能通过加热除去,叫永久硬 水.
▪ 硬水有两大危害: ▪ i)Ca2+、Mg2+、Fe2+等离子能和肥皂
6.40×10-9 1.97×10-8 9.74×10-8 4.84×10-4
2.07 6.12×10-4 1.22×10-5
例;与水接触大气压力101.325千帕时,计算25℃时氧气 在水中溶解度(mg/L)?25℃水的饱和蒸汽压为3.167千 帕。
解:查出25℃时KH=1.2633×10-5mol/升·千帕,O2在干 空气中的含量为20.95%(V/V)。
氧气在空气中分压为Po2=(P-PH2O)×V/V总=(101.3253.167)×0.2095=20.5622(千帕)
根据亨利定律,[O2]=1.2633×10-5×20.5622×32 =8.31(mg/L)
水中溶解氧的数量DO(dissolvedoxygen)是 水质的重要指标.
碳酸平衡
在水体中存在着CO2、H2CO3、HCO3-、 CO32—等四种化合态,常把CO2、H2CO3合并为 H2CO3,H2CO3含量极低,主要是溶解性气体 CO2。
▪ 一.蒸馏法脱盐 充分利用热能的物理过程; ▪ 二.反渗透法脱盐 依靠选择性薄膜(如醋酸纤维
素膜),只让水通过而不让盐通过,将盐水加 压(大于3MPa)超过海水渗透压,盐不能通过, 水可通过,就得到淡水.
反渗透法脱盐示意图
>3MPa
海水
含盐多的海水
H2O
淡水
(2).水中的气体
水中氧溶量
天然水中一般溶入的气体有O2,CO2,N2, H2S,CH4等,其中最重要的是O2和CO2.
气体 KH[mol/(L·Pa)] 气体 KH[mol/(L·Pa)]
O2 O3 CO2 CH4 C2H4 H2 H2O2
1.26×10-8 9.16×10-8 3.34×10-7 1.32×10-8 4.84×10-8 7.80×10-9 7.01×10-1
N2 NO
NO2 HNO2 HNO3 NH3 SO2
(C17H35COONa)产生沉淀(C17H35COO) 2Ca,能和 许多化学试剂配位络合,影响产品的品质. ▪ ii)暂时硬水加热时产生的碳酸盐在锅炉内壁上形成 锅垢,不但阻碍传热,消耗燃料,而且会堵塞管道, 导致爆炸.
水的软化
将钙、镁等可溶盐从硬水中除去的过程叫做水的 软化.软化方法很多,例如:
第四章 水环境化学
▪ 一 、天然水的基本特征 ▪ 二、水中污染物
一 、天然水的基本特征
人类的生存离不开水,人体的 59%-66%由水组成.工农业生产 也离不开水.水的环境化学涉及环 境科学各个方面, 是环境化学的最 基本最重要的内容。
1水的数量和分布
地球上水的总量是巨大 的,达到 1.4×1021kg.
例如, l dm3水中含CaO为100mg,MgO为50mg, 则该水的硬度可计算如下:
CaO:100mg/10mg=10° MgO:[(50mg /MMgO )(MCaO)]/10mg =50mg [(56g·mol-1)/( 40g·mol-1)]/10mg =7 ° 该水硬度为17 °
通常规定水的硬度如下:
a)加入药剂软化法.加入一定数量的碳酸钠、石 灰 乳 [Ca(OH)2] 、 磷 酸 三 钠 (Na3PO4) 、 磷 酸 二 氢 钠 (NaH2PO4),使钙、镁离子沉淀出来使水软化:
CaSO4+Na2CO3 CaCO3+Na2SO4 Ca(HCO3)2+Ca(OH)2 2CaCO3 +2H2O 3Ca2++2 Na3PO4 Ca3(PO4)2 +6Na+ 若在水中加入少量三聚磷酸钠(Na5P3O10),它将和 硬水中的Ca2+,Mg2+络合, 不再和肥皂产生沉淀, 也不会生成锅垢.
▪ 当前我国解决水短缺的基本措施是: ▪ (1)巩固和改善现有水利工程,疏浚河湖,并新
建必要的工程,增强蓄水、防洪和供水能力. ▪ (2)加强污水处理,有效保护水源. ▪ (3)注意节约用水和综合利用水源,提高水的使
用价值. ▪ (4)加强水资源的管理.
长远的根本措施:除切实做好上述几点外,要加 强种树种草,绿化国土,保持水土.
图3-2
All gases are also in a equilibrium between air and water
Carbonate equilibrium in Natural Water Systems:
