实验6弱酸解离常数的测定
醋酸解离常数的测定实验报告

醋酸解离常数的测定实验报告醋酸解离常数的测定实验报告引言:醋酸是一种常见的有机酸,广泛应用于食品、医药、化妆品等领域。
醋酸的解离常数是衡量其酸性强弱的重要指标,也是研究其化学性质的基础。
本实验旨在通过测定醋酸的电导率,计算出其解离常数,从而探究醋酸的酸性特性。
实验步骤:1. 实验前准备:准备所需的实验器材和试剂,包括电导仪、电导池、醋酸溶液、去离子水等。
2. 样品制备:取适量的醋酸溶液,用去离子水稀释至一定浓度,以保证实验的准确性和可重复性。
3. 测定电导率:将电导池浸入稀释后的醋酸溶液中,打开电导仪,记录电导率的数值。
为了提高实验的准确性,需重复测量多次,取平均值。
4. 数据处理:根据电导率的测定结果,利用电导率与浓度之间的关系,计算出醋酸的解离度。
实验结果与分析:根据实验测得的电导率数据,我们可以计算出醋酸的解离度。
解离度是指溶液中解离物的浓度与总浓度之比,可以用来表示酸性的强弱。
根据测定的电导率和浓度数据,我们可以得到醋酸溶液的电导率与浓度之间的线性关系,进而推算出醋酸的解离度。
通过计算,我们得到了醋酸的解离常数。
解离常数是描述酸或碱在溶液中解离程度的指标,它越大表示酸性或碱性越强。
醋酸的解离常数可以用来评价其酸性的强弱,也可以作为比较不同酸的酸性强弱的依据。
实验误差与改进:在实验过程中,可能会存在一些误差,如仪器误差、操作误差等。
为了减小误差,可以采取以下改进措施:1. 保持实验环境的稳定,避免温度和湿度的变化对实验结果的影响。
2. 严格控制实验操作的步骤和时间,避免操作不当导致误差的产生。
3. 增加重复实验次数,取平均值,提高实验结果的可靠性。
结论:通过本实验测定,我们成功得到了醋酸的解离常数。
该实验结果可为研究醋酸的酸性特性提供重要依据。
同时,本实验还展示了电导率测定方法在化学实验中的应用,为进一步研究酸碱性质提供了思路和方法。
总结:本实验通过测定醋酸的电导率,计算出其解离度,进而得到醋酸的解离常数。
醋酸解离常数的测定实验报告数据
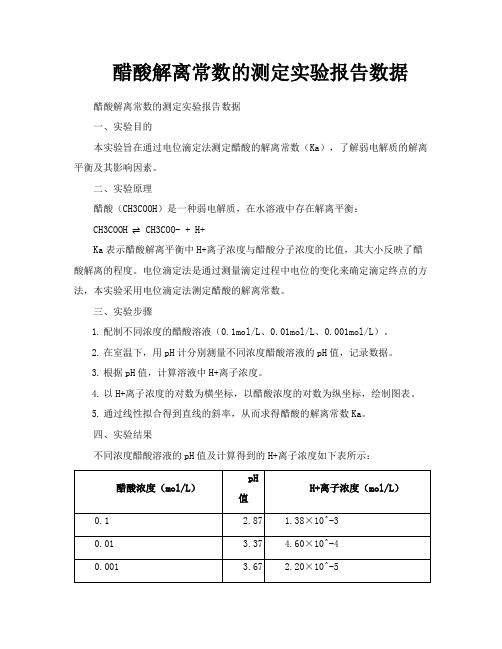
醋酸解离常数的测定实验报告数据醋酸解离常数的测定实验报告数据
一、实验目的
本实验旨在通过电位滴定法测定醋酸的解离常数(Ka),了解弱电解质的解离平衡及其影响因素。
二、实验原理
醋酸(CH3COOH)是一种弱电解质,在水溶液中存在解离平衡:
CH3COOH ⇌ CH3COO- + H+
Ka表示醋酸解离平衡中H+离子浓度与醋酸分子浓度的比值,其大小反映了醋酸解离的程度。
电位滴定法是通过测量滴定过程中电位的变化来确定滴定终点的方法,本实验采用电位滴定法测定醋酸的解离常数。
三、实验步骤
1.配制不同浓度的醋酸溶液(0.1mol/L、0.01mol/L、0.001mol/L)。
2.在室温下,用pH计分别测量不同浓度醋酸溶液的pH值,记录数据。
3.根据pH值,计算溶液中H+离子浓度。
4.以H+离子浓度的对数为横坐标,以醋酸浓度的对数为纵坐标,绘制图表。
5.通过线性拟合得到直线的斜率,从而求得醋酸的解离常数Ka。
四、实验结果
不同浓度醋酸溶液的pH值及计算得到的H+离子浓度如下表所示:
以H+离子浓度的对数为横坐标,以醋酸浓度的对数为纵坐标,绘制图表如下:
(请在此处插入图表)
通过线性拟合得到直线的斜率为-1.76,从而求得醋酸的解离常数Ka为
1.76×10^-5。
五、实验结论
本实验通过电位滴定法测定了醋酸的解离常数Ka为1.76×10^-5。
实验结果表明,醋酸在水溶液中存在解离平衡,其解离程度受到溶液浓度的影响。
通过本实验,我们加深了对弱电解质解离平衡的理解,并掌握了电位滴定法在化学分析中的应用。
实验 醋酸解离度和解离常数的测定【仅供参考】

实验 醋酸解离度和解离常数的测定一、实验目的1、了解电导率法测定醋酸解离度和解离常数的原理和方法;2、加深对弱电解质解离平衡的理解;3、学习电导率仪的使用方法,进一步学习滴定管、移液管的基本操作。
二、提 要醋酸CH 3COOH 即HA C ,在水中是弱电解质,存在着下列解离平衡:)1(O H )q (HAc 2+α )q (Ac )q (O H 3α+α-+或简写为)q (HAc α )aq (Ac )aq (H -++其解离常数为{}{}{}θθ-θ+=αc )c HA (c c )c A (c c )H (c)c HA (K eq eq eq(2.1)如果HAc 的起始溶度为c o ,其解离度为α,由于,)()(0a c Ac c H c eq eq ==-+代入式(2.1)得:θθαα-α=α-α=c)1(c c )c c ()c ()HAc (K 200020 (2.2)某一弱电解质的解离常数K a 仅与温度有关,而与该弱电解质溶液的浓度无关;其解离度α则随溶液浓度的降低而增大 。
可以有多种方法用来测定弱电解质的α和K a ,本实验采用的方法是用电导率测定HAc 的α和K a 。
电解质溶液是离子电导体,在一定温度时,电解质溶液的电导(电阻的倒数)λ为 l kA =λ (2.3)式中,k 为电导率...(电阻率的倒数),表示长度l 为1m 、截面积A 为1m 2导体的电导;单位为S·m -1。
电导的单位为S[西(门子)]。
在一定温度下,电解质溶液的电导λ与溶质的性质及其溶度c 有关。
为了便于比较不同溶质的溶液的电导,常采用摩尔电导m λ。
它表示在相距1cm 的两平行电极间,放置含有1单位物质的量电解质的电导,其数值等于电导率k 乘以此溶液的全部体积。
若溶液的浓度为)dm ·mol (c 3-,于是溶液的摩尔电导为 c k 10kV 3m -==λ (2.4)m λ的单位为12mol ·m ·S -。
弱酸的解离常数的测定

否则调节定位调节器。
5)清洗电极,并吸干电极球泡表面的余水。
② 二点校正法——用于分析精度要求较高的情况。 1)仪器插上电极,选择开关置于p档,仪器斜率 调节器调节在100%位置。 2)选择二种缓冲溶液(也即被测溶液的pH值在 该二种之间或接近的情况,如pH = 4和pH = 7)。 3)把电极放入第一缓冲溶液(pH = 7),调节温 度调节器,使所指示的温度与溶液相同。 4)待读数稳定后,该读数应为缓冲溶液的pH值, 否则调节定位调节器。
5)把电极放入第二种缓冲溶液(如pH = 4),摇动 试杯使溶液均匀。
6)待读数稳定后,该读数应为缓冲溶液的 pH值,否则调节定位调节器。
7)清洗电极,并吸干电极球泡表面的余水。 8)测量仪器标定后即可用来测量被测溶液。 ① 定位调节旋钮及斜率调节旋钮,不应变 动。 ② 将电极夹向上移出,用蒸馏水清洗电极 头部,并用滤纸吸干。 ③ 把电极插在被测溶液内,摇动试杯使溶 液均匀,读数稳定后,读出该溶液的pH值。
其电离常数的表达式为:
Kθ HAc
c(H )c(Ac ) c(HAc)
(1)
设醋酸的起始浓度为c,平衡时c (H+) = c ( Ac-) = x,代
入上式(1),可得到:
Kθ HAc
x2 cx
(2)
❖ 在一定温度下,用酸度计测定一系列已知浓 度的醋酸的pH值,根据pH= -lg c(H+),换算 出c(H+),代入式(2)中,可求得一系列对 应的值,取其平均值,即为该温度下醋酸的 电离常数。
一、弱酸的解离常数的测定
一、实验目的
1.掌握pH值法测定弱酸解离平衡常数的 原理和 方法,进一步加深对解离常数的理解。
乙酸的电位滴定分析及其离解常数的测定

乙酸的电位滴定分析及其离解常数的测定一、实验目的(1)学习电位滴定的基本原理和操作技术。
(2)运用pH-V 曲线法确定滴定终点。
(3)学习弱酸离解常数的测定方法。
二、实验原理乙酸CH 3COOH (简写为HAc )为一种弱酸,其p K a = 4.74,当以标准碱溶液滴定乙酸试液时,在化学计量点附近可以观察到pH 值的突跃。
在试液中插入复合玻璃电极,即组成如下工作电池:Hg ,Cl Hg )饱和KCl(试液HAc 玻璃膜/L)HCl(0.1mol AgCl Ag,22该工作电池的电动势在pH 计上表示为滴定过程中的pH 值,记录加入标准碱溶液的体积V 和相应被滴定溶液的pH 值,然后由pH-V 曲线或(△pH/△V )-V 曲线来求得终点时消耗的标准碱溶液的体积,也可用二次微分法,于△2pH/△V 2=0处确定终点。
根据标准碱溶液的浓度、消耗的体积和试液的体积,即可求得试液中乙酸的浓度或含量。
根据乙酸的离解平衡:-Ac H HAc +=+其离解常数:[HAc]]Ac ][H [K -a +=当滴定分数为50%时,[HAc] =[Ac -],此时]H [K a +=, 即pH pK a =因此,在滴定分数为50%处的pH 值,即为乙酸的p K a 值。
三、仪器1. pH 计,复合玻璃电极。
2. 50mL 容量瓶,5mL 移液管,20mL 碱式滴定管。
四、试剂1. 0.1000 mol/L 草酸标准溶液;2. 0.1 mol/L NaOH 标准溶液(浓度待标定);3. 乙酸试液(浓度约0.1 mol/L );4. 0.05 mol/L 邻苯二甲酸氢钾溶液,pH=4.00(20℃);5. 0.05 mol/L Na2HPO4 + 0.05 mol/L KH2PO4混合溶液,pH =6.88(20℃)。
五、实验步骤1. 打开pH 计电源开关,预热30min 。
接好复合玻璃电极。
2. 用pH=6.88(20℃)和pH=4.00(20℃)的缓冲溶液对pH 计进行两点定位。
电导滴定法测定醋酸的解离常数

电导滴定法测定醋酸的解离常数一、实验目的1.熟悉电导滴定法的基本原理;2.掌握电导滴定法测定弱酸解离常数的实验方法。
二、实验原理溶液的电导随离子的数目、电荷和大小而变化,也随着溶剂的某些特性如粘度的变化而变化。
这样可以预料,不同品种的离子对给定溶液产生不同的电导。
因此,如果溶液里一种离子通过化学反应被另一种大小或电荷不同的离子取代,必然导致溶液的电导发生显著变化。
电导滴定法正是利用这一原理完成欲测物质的定量测定。
一个电解质溶液的总电导,是溶液中所有离子电导的总和。
即:(2-1)式中c i为第i种离子的浓度(mol∙L-1),λi为其摩尔电导,θ为电导池常数。
弱酸的解离度α与其电导的关系可表示为:(2-2)G c为任意浓度时实际电导值,它是从实验中实际测量的,G100%为同一浓度完全解离时的电导值,它可从不同的滴定曲线计算而得。
醋酸在溶液中的解离平衡为:解离常数K a为:(2-3)根据电解质的电导具有加和性的原理,对任意浓度醋酸在完全解离时的电导值,能从有关滴定曲线上求得。
假如选用氢氧化钠滴定醋酸和盐酸溶液,可从滴定曲线上查得有关电导值后,按下式计算醋酸在100%解离时的电导值。
(2-4)式中G NaAc为醋酸被氢氧化钠滴定至终点的电导值,G NaCl为盐酸被滴定至终点的电导值。
(注意:所述电导值应按式(2-1)校正至相同的物质的量浓度,式(2-4)才成立)。
三、仪器与试剂1.DZDS-A电导仪(南京多助科技发展有限公司);DJ51C型电导电极(铂黑电极)(南京多助科技发展有限公司);2.电磁搅拌器(78-1磁力加热搅拌器)(金台市富华仪器有限公司);3.碱式滴定管(50ml);4.NaOH标准溶液:0.2000mol∙L-1;醋酸溶液:~0.1mol∙L-1;盐酸溶液:~0.1mol∙L-1。
四、实验步骤1.预热电导仪,联接电导电极。
2.醋酸电导测定(1)溶液配制;移取约0.1mol∙L-1醋酸溶液20mL于300mL的烧杯中,加蒸馏水170mL,放烧杯在电磁搅拌器上,插入洗净的电导电极,注意不能影响搅拌磁子的转动。
弱酸解离常数的测定

弱酸解离常数的测定
弱酸解离常数的测定是有机物合成反应分析中常见的方式。
它可以帮助研究人员评价有机物的稳定性、活性、合理性以及是否存在任何有害物质等。
本文将详细介绍弱酸解离常数的测定方法。
弱酸解离常数的测定一般分三步进行:信息获取、测定指标准备和测定。
首先,实验人员根据反应的机理,了解有机物质的基本信息,掌握和评估它们的物理性质,以及反应温度、催化剂使用量、体系pH值等活性因素,并根据实验条件准备必要的试液。
其次,在准备完试液后,实验人员将有机物质加入指定容器中,并将容器放入高精度pH电极法测定仪中。
然后,根据实验要求,在有机物质及其衍生物不稳定的情况下,再次加热至指定温度,保持固定的pH值,并反复测试,一旦满足特定的条件,即可计算出有机物质的弱酸解离常数。
最后是人工数据处理,根据试验结果,实验人员计算得到有机物质的弱酸解离常数以及其他相关性能指标,比如吸附性、活性体积等,以及准确的结构特点等,以用于有机物质的后续评估分析、调节酯化催化体系及有机物质的合理储存。
总之,弱酸解离常数的测定是有机合成反应分析中必不可少的一步,为实验人员了解有机物的物理性质,反应温度、催化剂使用量、体系pH值等活性因素,提供了有效的参考数据。
此外,弱酸解离常数的测定过程中,还可以获取有机物质的吸附性、活性体积等性能指标,从而评估有机物质的合理性,甚至可以发现可能存在的有害物质,为反应合成提供一份十分有价值的参考依据。
弱酸解离常数实验报告

弱酸解离常数实验报告弱酸解离常数实验报告引言:弱酸解离常数是描述弱酸在水溶液中解离程度的重要物理量。
本实验旨在通过测定弱酸醋酸的解离度,计算出其解离常数,并通过实验结果验证理论计算的准确性。
实验方法:1. 实验仪器与试剂准备:实验仪器:酸度计、电子天平、移液器等。
试剂:浓度已知的醋酸溶液、NaOH溶液、去离子水等。
2. 实验步骤:1) 首先,使用电子天平称取一定质量的醋酸溶液,记录其质量。
2) 将称取的醋酸溶液转移至酸度计中,记录其初始酸度。
3) 通过滴定法,逐渐加入NaOH溶液至酸度计中,记录每次滴定后的酸度。
4) 当酸度计示数不再明显变化时,停止滴定,记录此时的酸度。
5) 根据滴定过程中酸度的变化,计算出醋酸的解离度及解离常数。
实验结果与分析:1. 实验数据处理:通过实验测得的酸度变化数据,可以绘制出酸度随滴定体积变化的曲线图。
根据曲线图,可以确定滴定终点,进而计算出醋酸的解离度。
2. 解离度的计算:解离度(α)的计算公式为:α = (C0 - C)/ C0其中,C0为初始酸度,C为滴定终点时的酸度。
3. 解离常数的计算:弱酸的解离常数(Ka)的计算公式为:Ka = α^2 * C0 / (1 - α)其中,α为解离度,C0为初始酸度。
实验结果:通过实验测得的酸度变化数据,绘制出了酸度随滴定体积变化的曲线图。
根据曲线图,确定了滴定终点,并计算出醋酸的解离度为0.032。
根据解离度的计算结果,进一步计算出醋酸的解离常数为2.56×10^-5。
讨论与结论:本实验通过测定弱酸醋酸的解离度,计算出其解离常数,并与理论值进行对比。
实验结果与理论值相近,验证了理论计算的准确性。
然而,实验中可能存在一些误差,如滴定过程中滴定剂的加入速度、酸度计示数的准确性等。
此外,实验中使用的醋酸溶液可能存在浓度不准确的情况,也会对实验结果产生一定的影响。
总结:本实验通过测定弱酸醋酸的解离度,计算出其解离常数,并验证了理论计算的准确性。
醋酸解离度和解离常数的测定操作流程

醋酸解离度和解离常数的测定操作流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!醋酸解离度与解离常数的测定操作流程醋酸是日常生活中常见的弱酸,其在水溶液中的解离行为是化学反应动力学的重要研究对象。
醋酸解离度和解离常数的测定

醋酸解离度和解离常数的测定
实验目的
1.学习测定弱酸解离度和解离常数的方法
2.进一步熟悉滴定管和移液管的使用方法。
实验原理
醋酸是弱酸,在水溶液中存在解离平衡:
HAc=H+ + Ac-
若HAc的起始浓度为c,α为解离度,Ka为解离常数。
则
Ka=([H+][Ac-])/[HAc]
=[H+]²/(c-[H+])
α=[H+]²/c×100%
当α<5%时,Ka≈[H+]²/c
因此,测定出已知浓度的HAc溶液的pH,即可计算其解离度和解离常数。
实验步骤
1.NaOH溶液的标定
2.醋酸的标定
(同NaOH的标定类似,用移液管准确移取25ml 0.1mol/L的HAc 溶液于250ml的锥形瓶中,加几滴酚酞指示剂,用已标定的NaOH 去滴定此溶液至微红色,30s不退色即为终点。
重复滴定3次,计算此HAc溶液的浓度。
3.配制不同浓度的HAc溶液
用移液管分别量取上述HAc标准溶液25ml,10ml,和5ml,置于50ml容量瓶中,分别用蒸馏水稀释到刻度,摇匀。
4.测定不同浓度HAc溶液的pH
将原溶液及上述3种不同浓度的HAc溶液分别转入4只干燥的50ml 烧杯中,按照由稀至浓的顺序用pH计分别测定它们的pH,纪录数据和室温。
计算HAc的解离度和解离常数。
弱酸电离度与电离常数的测定实验报告优质范文.doc

弱酸电离度与电离常数的测定实验报告范文篇一:无机化学实验六醋酸电离度和电离常数的测定一、实验目的1.测定醋酸的电离度和电离常数;2.学习pH计的使用。
[教学重点]醋酸的电离度、电离常数的测定 [教学难点] pH计的使用 [实验用品]仪器:滴定管、吸量管(5mL)、容量瓶(50 mL)、pH计、玻璃电极、甘汞电极药品:0、200 mol·L-1HAc标准溶液、0、200 mol·L-1NaOH标准溶液、酚酞指示剂、标准缓冲溶液(pH=6、86、pH=4、00)二、基本原理HAc → H++ Ac-C:HAc的起始浓度;[H+]、[Ac-]、[HAc]:分别为平衡浓度;α:电离数;K:平衡常数α =× 100%Ka = =当α小于5时,C - [H+]≈C,所以Ka≈根据以上关系,通过测定已知浓度HAc溶液的pH值,就可算出[H+],从而可以计算该HAc溶液的电离度和平衡常数。
(pH=-lg[H+],[H+]=10-pH)三、实验内容1.HAc溶液浓度的测定(碱式滴定管)以酚酞为指示剂,用已知浓度的NaOH溶液测定HAc的浓度。
滴定序号CNaOH(mol·L-1) VHAc(mL VNaOH(mL CHAc测定值平均值25、0012 25、0025、0032.配制不同浓度的HAc溶液用移液管或吸量管分别取2、50 mL、5、00 mL、25、00 mL已测得准确浓度的HAc溶液,分别加入3只50 mL容量瓶中,用去离子水稀释至刻度,摇匀,并计算出三个容量瓶中HAc溶液的准确浓度。
将溶液从稀到浓排序编号为:1、2、3,原溶液为4号。
3.测定HAc溶液的pH值,并计算HAc的电离度、电离常数把以上四种不同浓度的HAc溶液分别加入四只洁净干燥的50 L杯中,按由稀到浓的顺序在pH计上分别测定它们的pH值,并记录数据和室温。
将数据填入下表(p、9、),计算HAc电离度和电离常数。
电位滴定法测定弱酸离解常数

电位滴定法测定弱酸离解常数指导老师:周群 实验人:王壮 同组实验:余晓波 实验时间:一.实验目的1. 掌握电位滴定法测定弱酸解离常数;2. 掌握确定电位滴定终点的方法;3. 学习使用自动电位滴定计。
.实验原理用电位滴定法测定弱酸离解常数 K a ,组成的测定电池为pH 玻璃电极 |H (c x) || KCI (s), Hg z CbHg点时弱酸盐浓度c 盐,再根据下式算出弱酸离解常数 K aK w c 盐[OH ]2三.仪器及试剂仪器:自动电位滴定仪,复合玻璃电极。
试剂:mol/L NaOH ,弱酸溶液。
四.实验内容pHE 电池x E 电池s pH s 0.0592当用NaOH 标准溶液滴定弱酸溶液时,仪器可直接给出 pH 值随NaOH 体积变化的pH V 滴定曲线。
通过微分可得到滴定终点时消耗的NaOH 体积,并由此计算出终 [OH ]1.用pH 4.01和pH 9.18的标准缓冲溶液校准仪器。
2.打开ZDJ-4A程序,通过预滴定程序测pH V曲线,即向50ml L的HA溶液中滴加标准的mol/L的NaO溶液,随NaO的滴入,溶液的pH值升高,仪器自动绘制NaOH 体积随电位值变化的pH V曲线,使用仪器自身程序找出滴定突越点的pH值和消耗的NaO体积,保存实验数据。
3•试验后处理:将反应器和电极表面清洗至pH值7,然后将电极浸入3M的KCl溶液中。
五•结果处理利用ZDJ-4A软件绘制的滴定曲线如下图1.滴定pH V曲线微分V (ml)在微分曲线上找到尖峰的最高点所对应的V,即滴定终点所消耗的 NaOH 的体积。
利用 Origin 软件找到尖峰所对应终点体积 V f =10.746ml ,再利用终点体积在 pH V 曲线上找 到终点时的pH = 8.36。
终点时[OH ] 1014 pH 10 14 8.362.29 10 6mol / L V f C NaOH 10.746 0.1000计算出醋酸的浓度 c HAc = ---------- = =0.02149mol/ L We 50.00终点醋酸盐浓度 c 盐=C H A C V H A C 0.02149 50.00 0.01769mol/L六. 注意事项1. 复合玻璃电极极易碎,使用时应小心七. 思考题1.测定未知溶液的pH 时,为什么要用pH 标准缓冲溶液进行校准答:进行两点标定12 -10 --210 15 20图2.滴定pHV 曲线一阶微分图象_14K w C 盐 _ 10 0.01769 [OH ]2 (2.29 10 6)23.37 10 50.00 10.746 V HAC V f2. 测得的Ka 与文献值进行比较和分析。
醋酸解离度、解离常数的测定

醋酸解离度、解离常数的测定一 、实验目的1、加深对弱电解质解离平衡、同离子效应的理解;2、了解pH 计的原理及其使用;3、学习用pH 计测定醋酸解离度和解离常数。
二、实验原理醋酸(HAc )是弱电解质,在溶液中存在如下解离平衡:-23HAc H OH O Ac +++或写成-HAcH Ac ++在一定温度下,达到平衡后,溶液中[H +]=[Ac -]=[HAc]已解离,[HAc]=[HAc]起始-[HAc]已解离。
若用c 表示[HAc]起始,则[H ]=100%cα+⨯=已解离的分子数溶质分子总数22a [H ][Ac ][H ][H ]([H ])[HAc][H ]K c c c+-++++==≈-当时在醋酸—醋酸钠(NaAc )体系中,NaAc 完全解离,产生大量的Ac -,因此,[HAc]已解离= [H +]≠[Ac -]。
由于同离子效应,[Ac -]=[NaAc]。
所以,该体系中[H ]cα+= a [H ][Ac ][H ][NaAc][H ][NaAc]([H ])[HAc][H ]K c c c+-++++==≈-当时三、实验步骤1、测定不同浓度醋酸的pH①用吸管分别吸取25.00 mL 、5.00 mL 、2.50 mL 0.10 mol·L -1(需标定)的HAc 溶液于三个50mL 容量瓶中,用纯水稀释至标线,摇匀。
编号为2、3、4 ,0.10 mol·L -1 HAc 溶液编号为1。
②用pH计由稀到浓分别测定HAc溶液的pH。
2、同离子效应分别吸取25.00 mL 0.10 mol·L-1 HAc 溶液、5.00 mL 0.10 mol· L-1 NaAc 溶液于同一个50 mL容量瓶中,用纯水稀释至标线,摇匀。
编号为5,测定pH 。
四、实验数据记录与处理c(HAc):c(NaAc):温度:。
电位滴定法测定弱酸离解常数

电位滴定法测定弱酸离解常数指导老师:周群实验人:王壮同组实验:余晓波实验时间:2016.3.7一. 实验目的1. 掌握电位滴定法测定弱酸解离常数;2. 掌握确定电位滴定终点的方法;3. 学习使用自动电位滴定计。
二.实验原理用电位滴定法测定弱酸离解常数a K ,组成的测定电池为pH 玻璃电极22|()||(),,H c x KCl s Hg Cl Hg +=0.0592x s x s E E pH pH -=+电池电池 当用NaOH 标准溶液滴定弱酸溶液时,仪器可直接给出pH 值随NaOH 体积变化的pH V -滴定曲线。
通过微分可得到滴定终点时消耗的NaOH 体积,并由此计算出终点时弱酸盐浓度c 盐 ,再根据下式算出弱酸离解常数a K 。
[]OH -==2[]w a K c K OH -=盐三.仪器及试剂仪器:自动电位滴定仪,复合玻璃电极。
试剂:0.1000 mol/L NaOH ,弱酸溶液。
四.实验内容1. 用 4.01pH =和9.18pH =的标准缓冲溶液校准仪器。
2. 打开ZDJ-4A 程序,通过预滴定程序测pH V -曲线,即向50ml 0.02mol/L 的HAc 溶液中滴加标准的0.1 mol/L 的NaOH 溶液,随NaOH 的滴入,溶液的pH 值升高,仪器自动绘制NaOH 体积随电位值变化的pH V -曲线,使用仪器自身程序找出滴定突越点的pH 值和消耗的NaOH 体积,保存实验数据。
3. 试验后处理:将反应器和电极表面清洗至pH 值7≈,然后将电极浸入3M 的KCl 溶液中。
五.结果处理利用ZDJ-4A 软件绘制的滴定曲线如下图1.滴定pH V -曲线对滴定曲线作一阶微分 05101520-2246810121416p H V (ml)图2.滴定pH V -曲线一阶微分图象0510152024681012p HV (ml)在微分曲线上找到尖峰的最高点所对应的V ,即滴定终点所消耗的NaOH 的体积。
实验6弱酸解离常数的测定

实验6 弱酸解离常数的测定一.实验目的1. 了解弱酸解离常数的测定方法2. 加深对电离平衡基本理论的理解二.背景知识及实验原理1. 背景知识在农业生产和科学实验中,人类与溶液有着广泛的接触,许多反应是在溶液中进行的,许多物质的性质也是在溶液中体现的。
我们还会遇到许多存在于水溶液中的化学平衡,如电解质在溶液中的解离。
强电解质在水溶液中是完全解离的;而弱电解质在水溶液中存在着分子与其解离离子之间的平衡,其平衡常数称为解离平衡常数。
弱酸性电解质的解离平衡常数用K aΘ表示,弱碱性电解质解离平衡常数用K bΘ表示。
与其它平衡常数一样,解离平衡常数是化学平衡理论中重要的概念之一。
其值越大,表明平衡时离子的浓度越大,电解质解离程度越大,即弱电解质解离得越多,因此可根据解离常数值得大小比较相同类型的弱电解质解离度的大小,即弱电解质的相对强弱。
弱电解质的解离平衡常数应用较广。
比如缓冲溶液的选择和配制,解离平衡常数值是选择和配制缓冲溶液的K aΘ或K bΘ值以及缓冲对的两种物质浓度比。
因此在选择具有一定pH 值的缓冲溶液时,应选用弱酸(或弱碱)的K aΘ(或K bΘ)值等于或接近于所需[H+](或[OH-])的共轭酸碱对组成的混合溶液,即pH≈p K aΘ或pOH≈p K bΘ。
弱电解质解离常数的数值可以通过热力学数据计算求得,也可以通过一些物理化学实验方法测定。
这些物理化学方法是借助物理和几何方法来研究化学平衡体系性质变化和组成关系的,通过组成性质的研究可以了解平衡体系所发生的化学变化。
在研究电解质溶液的各种化学性质时,也可以采取这些方法。
因为随着溶液组分发生变化,体系的某些性质也相应地发生变化。
比如溶液的导电行为导电性质是一个能直接反映出电解质本性的重要理化性质,它随着溶液组成的变化发生相应变化。
而通过直接测定溶液的电导值以确定溶液中被测离子的浓度的方法称为电导分析法。
2. 实验原理一元弱酸弱碱的解离平衡常数KΘ与解离度α有一定的关系。
醋酸解离常数实验报告

一、实验目的1. 学习溶液的配制方法及有关仪器的使用。
2. 掌握醋酸解离常数的测定方法。
3. 理解弱酸解离平衡的原理。
4. 学习酸度计的使用方法。
二、实验原理醋酸(CH3COOH)是一种一元弱酸,在水溶液中存在如下解离平衡:CH3COOH(aq) ⇌ H+(aq) + CH3COO-(aq)其解离常数(Ka)的表达式为:Ka = [H+][CH3COO-] / [CH3COOH]在一定温度下,通过测定不同浓度的醋酸溶液的pH值,可以计算出醋酸的解离常数。
三、实验仪器与试剂1. 仪器:酸度计、碱式滴定管、锥形瓶、移液管、吸量管、容量瓶、烧杯。
2. 试剂:醋酸溶液、NaOH标准溶液、酚酞指示剂。
四、实验步骤1. 配制不同浓度的醋酸溶液:取一定量的醋酸固体,溶解于少量蒸馏水中,转移至容量瓶中,用蒸馏水定容至所需浓度。
2. 测定pH值:使用酸度计,分别测定不同浓度醋酸溶液的pH值,记录数据。
3. 计算解离常数:根据pH值,计算[H+]浓度,再根据Ka表达式计算醋酸的解离常数。
五、实验数据与结果1. 醋酸溶液的配制:- 0.1000 mol/L 醋酸溶液:称取0.10 g 醋酸固体,溶解于少量蒸馏水中,转移至100 mL 容量瓶中,用蒸馏水定容。
- 0.0500 mol/L 醋酸溶液:取上述0.1000 mol/L 醋酸溶液,转移至50 mL 容量瓶中,用蒸馏水定容。
- 0.0250 mol/L 醋酸溶液:取上述0.0500 mol/L 醋酸溶液,转移至25 mL 容量瓶中,用蒸馏水定容。
2. 醋酸溶液的pH值测定:- 0.1000 mol/L 醋酸溶液:pH = 2.43- 0.0500 mol/L 醋酸溶液:pH = 3.27- 0.0250 mol/L 醋酸溶液:pH = 4.103. 醋酸解离常数的计算:- 0.1000 mol/L 醋酸溶液:Ka = 1.8 × 10^-5- 0.0500 mol/L 醋酸溶液:Ka = 1.8 × 10^-5- 0.0250 mol/L 醋酸溶液:Ka = 1.8 × 10^-5六、实验结果分析1. 通过实验,成功配制了不同浓度的醋酸溶液。
弱酸解离常数的计算公式

弱酸解离常数的计算公式弱酸解离常数是描述酸性弱的化合物在溶液中离解程度的参数。
它通常表示为Ka,是反应物和生成物浓度比值的乘积除以反应物初浓度得到的,其计算公式为:Ka = [H+][A-]/[HA],其中[H+]为氢离子浓度,[A-]为反应物中离子的浓度,[HA]为反应物中未离子化部分的浓度。
那么,如何计算弱酸解离常数呢?我们来看一个具体的例子。
以乙酸为例,其化学式为CH3COOH。
我们需要先确定化学反应方程式:CH3COOH + H2O ⇌ CH3COO- + H3O+。
接下来,我们设定反应物浓度为c1 mol/L,产物浓度为c2 mol/L,则反应的平衡常数Kc为:Kc = [CH3COO-][H3O+]/[CH3COOH]。
由于酸性弱,可以近似将水的浓度视为不变,即[H2O] ≈ 1mol/L。
该式可以改写成:Kc = [H3O+][CH3COO-]/[CH3COOH] × 1。
由于酸性弱,假设反应在平衡时仅有很少的CH3COO-离子和H3O+离子产生,可以近似认为反应物的浓度变化量相对于反应物浓度很小,所以反应物的初始浓度与反应平衡浓度相差很小。
即[CH3CO OH] ≈ c1 - x,[CH3COO-] ≈ x,[H3O+] ≈ x,其中x 是反应平衡时的变化量。
代入反应式中,得到:Kc = x^2/(c1 - x)。
由于Kc表达式中有未知数x,我们需要寻找一种方法求解该方程。
由于Kc是比例常数,即Kc值一旦确定,对于该化学反应是固定的。
因此,我们可以通过实验的方法测定酸的某一浓度下pH值,得到[H3O+]的浓度,从而计算出x的值。
进而求出Ka值。
综上,弱酸解离常数的计算需要根据具体的化学反应式,结合实验数据进行求解。
其结果可以指导我们了解酸在溶液中离解的程度,为我们的化学实验和研究提供重要的参考。
弱酸解离常数实验报告

弱酸解离常数实验报告弱酸解离常数实验报告引言实验目的实验原理实验步骤实验结果与分析实验结论参考文献引言弱酸解离常数是描述弱酸在水中解离程度的物理量,它反映了酸的强弱程度。
在本次实验中,我们将通过测定弱酸乙酸在水中的解离程度,计算出其解离常数。
实验目的1. 了解弱酸解离常数的概念和计算方法;2. 学习使用酸碱指示剂和pH计测定酸碱溶液的pH值;3. 掌握实验操作技巧,培养实验思维和实验数据处理能力。
实验原理弱酸解离常数K_a是指弱酸HA在水中发生解离反应时,酸解离度α与未解离酸HA浓度C之比的平方根,即K_a = √(α/C)。
在实验中,我们将通过测定弱酸乙酸溶液的pH值,来计算出其解离常数。
实验步骤1. 准备工作:清洗玻璃仪器,用去离子水冲洗干净容器;2. 配制乙酸溶液:取一定量的乙酸溶液,加入适量的去离子水,制备成一系列浓度不同的乙酸溶液;3. 测定pH值:使用pH计分别测定不同浓度乙酸溶液的pH值,并记录下来;4. 绘制曲线:将浓度与pH值绘制成曲线图;5. 计算解离常数:根据曲线图,计算出乙酸的解离常数K_a。
实验结果与分析在实验中,我们测得了乙酸溶液的pH值,并绘制了浓度与pH值的曲线图。
根据曲线图,我们可以看出随着乙酸浓度的增加,其pH值逐渐下降,说明乙酸的解离程度增加。
根据实验数据,我们可以计算出乙酸的解离常数K_a。
实验结论通过本次实验,我们成功测定了乙酸的解离常数K_a,并得出了乙酸在水中的解离程度与其浓度之间的关系。
实验结果表明,乙酸的解离程度随着浓度的增加而增加,乙酸的解离常数K_a也相应增大。
参考文献1. 《化学实验指导书》2. 《无机化学实验教程》3. 《物理化学实验教程》结语通过本次实验,我们深入了解了弱酸解离常数的概念和计算方法,并学习了使用酸碱指示剂和pH计测定酸碱溶液的pH值。
实验过程中,我们掌握了实验操作技巧,培养了实验思维和实验数据处理能力。
这些实验技能对我们今后的学习和科研工作都具有重要意义。
弱酸电离度与电离常数的测定实验报告范文

弱酸电离度与电离常数的测定实验报告范文篇一:无机化学实验六醋酸电离度和电离常数的测定一、实验目的1.测定醋酸的电离度和电离常数;2.学习pH计的使用。
[教学重点]醋酸的电离度、电离常数的测定[教学难点]pH计的使用[实验用品]仪器:滴定管、吸量管(5mL)、容量瓶(50mL)、pH计、玻璃电极、甘汞电极药品:0、200mol·L-1HAc标准溶液、0、200mol·L-1NaOH标准溶液、酚酞指示剂、标准缓冲溶液(pH=6、86、pH=4、00)二、根本原理HAc→H++Ac-C:HAc的起始浓度;[H+]、[Ac-]、[HAc]:分别为平衡浓度;α:电离数;K:平衡常数α=某100%Ka= =当α小于5时,C-[H+]≈C,所以Ka≈根据以上关系,通过测定浓度HAc溶液的pH值,就可算出[H+],从而可以计算该HAc溶液的电离度和平衡常数。
(pH=-lg[H+],[H+]=10-pH)三、实验内容1.HAc溶液浓度的测定(碱式滴定管)以酚酞为指示剂,用浓度的NaOH溶液测定HAc的浓度。
滴定序号CNaOH(mol·L-1)VHAc(mLVNaOH(mLCHAc测定值平均值25、0012 25、0025、0032.配制不同浓度的HAc溶液3.测定HAc溶液的pH值,并计算HAc的电离度、电离常数把以上四种不同浓度的HAc溶液分别参加四只洁净枯燥的50L杯中,按由稀到浓的顺序在pH计上分别测定它们的pH值,并记录数据和室温。
将数据填入下表(p、129、),计算HAc电离度和电离常数。
溶液C(mol·L-1)pH[H+]α(%)电离常数K四、提问1/20CHAc1/10CHAc1/2CHAcCHAc(mol·L-1)测定值平均值K值在1、0某10-5~2、0某10-5范围内合格(文献值25℃1、76某10-5)1.烧杯是否必须烘干?还可以做怎样的处理?答:不需烘干,用待测溶液荡洗2~3次即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验6 弱酸解离常数的测定
一.实验目的
1. 了解弱酸解离常数的测定方法
2. 加深对电离平衡基本理论的理解
二.背景知识及实验原理
1. 背景知识
在农业生产和科学实验中,人类与溶液有着广泛的接触,许多反应是在溶液中进行的,许多物质的性质也是在溶液中体现的。
我们还会遇到许多存在于水溶液中的化学平衡,如电解质在溶液中的解离。
强电解质在水溶液中是完全解离的;而弱电解质在水溶液中存在着分子与其解离离子之间的平衡,其平衡常数称为解离平衡常数。
弱酸性电解质的解离平衡常数用K aΘ表示,弱碱性电解质解离平衡常数用K bΘ表示。
与其它平衡常数一样,解离平衡常数是化学平衡理论中重要的概念之一。
其值越大,表明平衡时离子的浓度越大,电解质解离程度越大,即弱电解质解离得越多,因此可根据解离常数值得大小比较相同类型的弱电解质解离度的大小,即弱电解质的相对强弱。
弱电解质的解离平衡常数应用较广。
比如缓冲溶液的选择和配制,解离平衡常数值是选择和配制缓冲溶液的K aΘ或K bΘ值以及缓冲对的两种物质浓度比。
因此在选择具有一定pH 值的缓冲溶液时,应选用弱酸(或弱碱)的K aΘ(或K bΘ)值等于或接近于所需[H+](或[OH-])的共轭酸碱对组成的混合溶液,即pH≈p K aΘ或pOH≈p K bΘ。
弱电解质解离常数的数值可以通过热力学数据计算求得,也可以通过一些物理化学实验方法测定。
这些物理化学方法是借助物理和几何方法来研究化学平衡体系性质变化和组成关系的,通过组成性质的研究可以了解平衡体系所发生的化学变化。
在研究电解质溶液的各种化学性质时,也可以采取这些方法。
因为随着溶液组分发生变化,体系的某些性质也相应地发生变化。
比如溶液的导电行为导电性质是一个能直接反映出电解质本性的重要理化性质,它随着溶液组成的变化发生相应变化。
而通过直接测定溶液的电导值以确定溶液中被测离子的浓度的方法称为电导分析法。
2. 实验原理
一元弱酸弱碱的解离平衡常数KΘ与解离度α有一定的关系。
例如醋酸(HAc)溶液:
HAc(aq) H+(aq) + Ac-(aq)
起始浓度/(mol/L) c 0 0
平衡浓度/(mol/L) c-c α c α c α
αααααα-=-=-==ΘΘΘΘΘ-Θ+Θ
11)/()1)(/()/(]/)([]/)(][/)([2
222c c c c c c c c HAc c c Ac c c H c K (1) 解离度可通过测定溶液的电导来求得,从而求出解离常数。
电解质溶液导电能力的大小,通常用电导G 表示。
电导等于电阻的倒数,G=1/R ,其单位是Ω-1。
和金属导体一样,电解质溶液的电阻也符合欧姆定律。
温度一定时,两极间溶液的电阻与两极间的距离L 成比,与电极面积A 成反比。
R ∝A L 或R=A
L ρ (2) 式中ρ—电阻率,其倒数称为电导率,用χ表示,所以 G=L A χ
(3) 电导率是指长1m 、截面积为1m 2的导体的电导。
它不仅与温度有关,而且还与溶液的浓度有关,χ的单位为Ω-1·m -1。
测定溶液电导使用电导率仪及电导电极。
电导电极由两块面积约1cm 2、间距约1cm 的铝片平行镶嵌在玻璃架上构成。
每个电导电极的L
A 为一常数,称为电极常数。
它可直接测量定出,亦可通过测量已知电导率的KCl 溶液的电导,按式(3)求出。
在一定温度下,同一类电解质不同浓度的溶液电导与两个因素有关:①溶液中溶解的电解质的量;②电解质的解离度。
若使前一因素固定,则溶液的电导就只与电解质的解离度有关,为此,人们引进了摩尔电导率的概念。
将含有1mol 电解质的溶液全部置于相距1m 的两个平行电极之间所表现出来的电导,称为摩尔电导率。
设溶液中某物质的量浓度为c ,单位为mol·L -1,则含1mol 电解质溶液的体积3101⨯=
c
V m ,固溶液的摩尔电导率λm 为 3101-⨯=c m χλ (4) λm 的单位是Ω-1·m 2·mol -1。
对于弱电解质来说,在无限稀释时,可看做完全解离,这时溶液的摩尔电导率称为极限摩尔电导率。
以∞
m λ表示。
在一定温度下,弱电解质的极限摩尔电导率是一定的,表1列出无限稀释时醋酸的极限摩尔电导率。
表1 不同温度下醋酸的极限摩尔电导率
对于弱电解质来说,某浓度时的电离度等于该浓度时的摩尔电导率与极限摩尔电导率之比。
即
α=∞
m
m λλ (5) 将(4)式代入(1)式得
)(122
m m m m c c K λλλλαα-=-=∞∞Θ
(6) 这样,可以从实验中测定出浓度为c 的HAc 溶液的电导率χ后,代入式(5)中,算出λm ,再将λm 值代入式(6),即可算出HAc 的K a Θ值。
三.实验仪器及药品
1. 仪器
电导率仪、水浴锅、温度计、100mL 容量瓶4个、洗瓶。
2. 药品
醋酸溶液。
四.实验内容与操作
1. 不同浓度HAc 溶液的配制
将3个洗净的100mL 容量瓶编号成2、3、4号,再依次用50mL 、25mL 、10mL 移液管吸取准确浓度的HAc 溶液,分别置于2、3、4号容量瓶中,然后用蒸馏水稀释至刻度,混合均匀。
算出各瓶溶液的准确浓度,记录在表2中(或实验报告相应的表格中)。
(1号原液为实验室已配好的准确浓度的HAc 溶液)
表2 实验数据记录表
注:实验测出的χ数值,其单位是μΩ-1·cm-1。
需换算成Ω-1·m-1后,再填入表2中(1μΩ-1·cm-1=10-4Ω-1·m-1)
2. 不同浓度HAc溶液电导率的测定
测定不同浓度HAc溶液的电导率时,应该按由稀到浓的顺序依次进行。
将待测溶液倒入50mL烧杯中,然后把烧杯放入恒温水浴(水温为18℃、25℃或30℃),稳定3~5min后,搅拌溶液(玻璃棒用前应用滤纸擦干),轻轻落下用待测溶液洗过的电极,使液面高于电极1~2cm,进行测量,连续测定2次,取平均值。
用同样方法测出其它各号溶液的电导率,将数据记录在表2中(或实验报告相应的表格中)。
全部测定后,拆下电极,用蒸馏水洗涤数次,放回电极盒中。
五.结果与讨论或数据处理
将溶液浓度和测得电导率值代入式(4)中求得λm,再通过(5)式求得α,进而通过(6)式求得4个K HAcΘ值,将其加和平均,即得HAc的解离常数测定值。
六.注意事项
1. 电导率测定时由稀到浓的顺序
2. 电极测定前用待测液润洗
七.思考题
1. 电解质溶液的电导与哪些因素有关?
2. 测定HAc溶液的电导时,为什么要按由稀到浓的顺序进行?
3.标准平衡常数KΘ值与浓度是否有关?。
