piRNA研究进展概述
新型非编码小RNA_Piwi_interactingRNA_piRNA_

2007; 34 (3)
李培旺等: 新型非编码小 RNA— ——Piwi-inter acting RNA (piRNA)
· 235 ·
平上对相关基因的表达进行调控. 因此,piRNA 的 生物学功能主要是通过转录水平调控哺乳动物配子 发生过程中相关基因的表达,从而影响哺乳动物配 子的发生. 另外,由重复序列编码的 piRNA 则可能 与 rasiRNA 具有相同的作用,即保护单倍体基因组 使其免于由转座元件引起的重排作用发生.
Mini-reviews 微型述评
生物化学与生物物理进展 Progress in Biochemistry and Biophysics 2007, 34(3): 233 ̄235 www.pibb.ac.cn
新型非编码小 RNA — ——Piwi-inter acting RNA (piRNA)
李培旺 1) 卢向阳 2) 李昌珠 1) 田 云 2)*
2 Girard A, Sachidanandam R, Hannon G J, et al. A germline-specific class of small RNAs binds mammalian Piwi proteins. Nature, 2006, 442 (7099): 199~202
piRNA 主要在哺乳动物的精母细胞和成熟的 精细胞中表达,同时它能与 Argonaute 蛋白家族的 PIWI 亚家族蛋白相互作用,通过对 PIWI 亚家族蛋 白的遗传分析以及 piRNA 积累的时间特性研究发 现,piRNA-PIWI 复合物在配子发生过程中起着十 分重要的作用,piRNA 则可能参与配子发生过程 中基因表达模式以及基因组染色体结构的调节. C57BL/6J 雄鼠中已克隆的 piRNA 根据其长度主要 分为两大类:第一类 piRNA 主要与 MIWI 蛋白结 合 , 长 度 为 29 ~31 nt, 其 表 达 的 时 间 特 异 性 与 MIWI蛋白相同,主要从减数分裂的粗线期到早期 的圆形精细胞阶段,15 天的 C57BL/6J 雄鼠中就可 以检测到这类 piRNA,到 18 天时其积累达到最 大;第二类 piRNA 的长度主要为 26~28 nt,它更 偏爱与 MILI 蛋白相互作用,14 天的 C57BL/6J 雄 鼠中就能检测到大量的该类 piRNA,其表达从早 期的精原细胞阶段开始,到圆形精细胞阶段就开始 下降[3]. 在成熟 C57BL/6J 雄鼠的睾丸组织中,第一 类 piRNA 的表达远远多于第二类 piRNA 的表达, 但这两类 piRNA 可能在同一位置因经过不同的加 工方式而产生. Lau 等[4]从 SD 大鼠睾丸组织中分离 纯 化 的 piRNA 复 合 物 不 仅 含 有 RIWI, 还 含 有 rRecQ1.RIWI 是人 PIWI 的同源蛋白,PIWI 蛋白与 基因转录沉默密切相关,因此,piRNA 在哺乳动 物的基因转录沉默中具有重要作用. 人体中的 RecQ1 是 一 种 依 赖 于 ATP 的 DNA 解 旋 酶 , 与 piRNA 相互结合的 rRecQ1 既具有 ATPase 活性又 具 有 DNA 解 旋 活 性 , 但 分 析 表 明 , rRecQ1 与 piRNA 的 作 用 不 如 RIWI 强 , 因 此 rRecQ1 对 于 piRNA 的功能行使可能不具有重要作用[4]. Grivna 等[5]为了检测 piRNA 是否能与多聚核糖体相互结 合,对正常三周龄成年小鼠以及 miwi+ / - 、miwi - /- 三周龄成年小鼠的睾丸组织提取物进行分级分离纯 化,结果发现,piRNA 在核糖核蛋白、单核糖体 以及多聚核糖体组分中的相对含量分别为 38%、 28%和 34%,表明 piRNA 的潜在功能是在转录水
piRNA研究进展概述
PiRNA 研究进展非编码小RNA在正常的生物学过程和人类疾病中均有重要作用(Esteller, M et al., 2011),主要包括microRNAs(miRNA)、short-interfering RNAs (siRNA)和PIWI-interacting RNAs(piRNA)。
piRNA的发现得益于PIWI蛋白家族的研究,这种蛋白是动物繁衍后代所必须的。
目前,保守估计真核生物基因组上大约具有20,000个piRNA(Moyano, M et al., 2015)。
piRNA首次在果蝇的睾丸中被鉴定为一种新的长的siRNA( long siRNA),可以沉默位于果蝇X染色体上的多拷贝基因Stellate (Arvain et al, 2001)。
后因与Argonaute蛋白家族亚族PIWI相结合发挥作用而得名,由Arvain等采用层析柱法从小鼠睾丸细胞中分离得到(Arvain et al, 2006)。
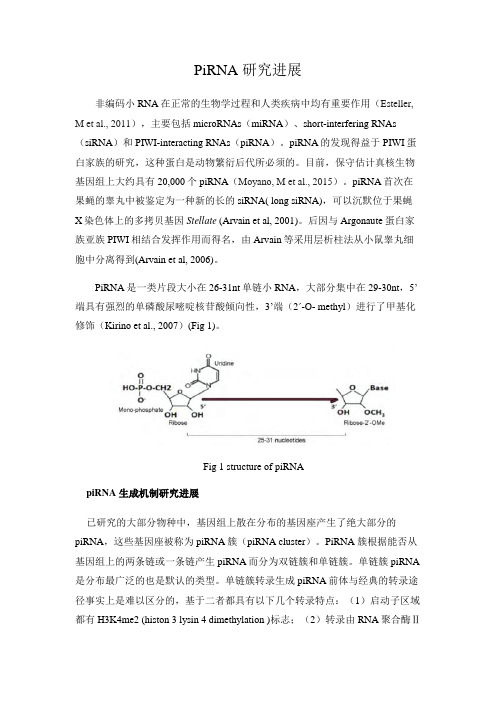
PiRNA是一类片段大小在26-31nt单链小RNA,大部分集中在29-30nt,5’端具有强烈的单磷酸尿嘧啶核苷酸倾向性,3’端(2ʹ-O- methyl)进行了甲基化修饰(Kirino et al., 2007)(Fig 1)。
Fig 1 structure of piRNApiRNA 生成机制研究进展已研究的大部分物种中,基因组上散在分布的基因座产生了绝大部分的piRNA,这些基因座被称为piRNA簇(piRNA cluster)。
PiRNA 簇根据能否从基因组上的两条链或一条链产生piRNA而分为双链簇和单链簇。
单链簇piRNA 是分布最广泛的也是默认的类型。
单链簇转录生成piRNA前体与经典的转录途径事实上是难以区分的,基于二者都具有以下几个转录特点:(1)启动子区域都有H3K4me2 (histon 3 lysin 4 dimethylation )标志;(2)转录由RNA聚合酶Ⅱ(pol Ⅱ)负责;(3)经典的RNA转录后加工(5’端帽子修饰、剪切、多聚腺苷酸修饰)(Goriaux C et al., 2014)。
小分子RNA家族新成员:piRNA

1 沉默转录基因过程
在果蝇中的研究已经表明Piwi和rasiRNA的作 用是沉默重复元件。在裂殖酵母( Schizosaccharomycespombe)中,小RNA和 RNAi途径涉及到了转录基因沉默(TGS)。 在研究哺乳动物中TGS的因子时,纯化得到 了一个包含小RNA和Riwi的复合物(与人类 Piwi同源),该复合物称为piRNA复合物。它 的制备物中包含rRecQ1,与脉孢菌( Neurospora)qde?3基因的表达蛋白同源,而 该基因参与沉默途径。因此推断,哺乳动物 的piRNA可能在TGS中起作用。
piRNA生源论的ping-pong模型
piRNA的生物信息学研究
最近,印度科学家SaiLakshmiS及其合作者建立 了一个piRNA数据库———piRNABank,以保存 新发现的piRNA序列。piRNABank是一个高度用 户友好的资源,它收录了包括人、小鼠和大鼠的 近2000万个piRNA相关序列,经过同源序列去除 、基因组定位等筛选,最近得到10万多个在基因 组中具有唯一靶位点的piRNA序列。数据库支持 物种和染色体方式的多种的搜索方式,包括登录 号、染色体定位、基因名或符号,基于同源性的 序列检索,簇和相应基因及重复元件。它也可以 在基因组大图谱上显示每个piRNA或piRNA簇。 数据库内的信息也将随着新的研究进行不断更新 ,果蝇和其它物种的piRNA信息也将会被收录, 作者还计划增加一些序列和结构预测的软件,更 方便科研人员使用。
比起已发现的其他小分子RNA,30 个核苷酸左右的piRNA要稍长。格 雷格•汉农等发现piRNA大小约为 29—30个核苷酸,而托马斯等人的 结果稍有出入,在26—31个核苷酸 左右。
piRNA的生物学功能
piRNA从后生程序化和抑制转录到转录 后调控可能会有不同的功能。根据Piwi 蛋白已知的功能推测piRNA的功能可能 有3个方面。 1 沉默转录基因过程 2 维持生殖系和干细胞功能 3 调节翻译和mRNA的稳定性
PRNs 基因家族研究进展

生物技术进展2022年第12卷第3期325~331Current BiotechnologyISSN 2095‑2341进展评述ReviewsPRNs 基因家族研究进展樊锦瑞,王磊,邹俊杰*中国农业科学院生物技术研究所,北京100081摘要:Pirins (简称PRNs 、PIRs )是含有Cupin 结构域的基因家族,属于功能各异的Cupin 超家族成员之一。
PRN 蛋白的N 端结构域含有金属离子结合位点,在原核和真核生物中高度保守。
人hPRN 可作为转录因子辅因子和氧化还原感受器参与癌症发生过程,是癌症治疗的潜在靶点。
植物PRNs 基因家族一般含有多个成员,其生物学功能尚未得到深入研究。
概述了PRNs 蛋白的基本结构及其生化特征,并综述了PRNs 在人、微生物和植物中的生物学功能,以期为进一步解析水稻等作物中PRNs 的功能提供一定线索,并为基因编辑等生物育种技术改良作物提供新的靶点。
关键词:PRNs 基因家族;金属离子;转录因子辅因子;氧化还原感受器;靶点DOI :10.19586/j.2095⁃2341.2021.190中图分类号:Q501文献标志码:AResearch Progress on PRNs Gene FamilyFAN Jinrui ,WANG Lei ,ZOU Junjie *Biotechnology Research Institute ,Chinese Academy of Agricultural Sciences ,Beijing 100081,ChinaAbstract :Pirins (PRNs ,PIRs )are gene family containing cupin domain and belong to the functionally diversity cupin superfamily.The N -terminal domain of PRN contains a metal -ion binding site ,which is highly conserved in prokaryotes and eukaryotes.Human hPRN could participate in cancer development as transcriptional regulator and redox sensor ,suggesting that hPRN is a potential therapeutic target.In plants ,there are several members in PRNs gene family ,whereas their biological func‐tions remain largely unknown.This paper outlined the basic structure and biochemical characteristic of PRNs ,and reviewed the biological research progresses in human ,microorganism and plants ,in order to provide clues to clarify the PRNs molecular mechanism of crop such as rice ,and provide target genes for the genetic improvement of crops production or adapation by gene editing and other molecular breeding techniques.Key words :PRNs gene family ;metal ions ;transcriptional regulator ;redox sensor ;targetPirin (PRN 、PIR )蛋白在人类中最初是通过酵母双杂交筛选发现的,其与转录因子NFI/CTF1(nuclear factor I/CCAAT box transcription factor )相互作用,发挥相关功能[1]。
家禽piRNAs(PIWI-interacting RNA)的研究进展

其作 用与 D i c e r 酶无 关。在生 殖细胞的发 育 、 转座子 沉默 、 减数 分裂和 精子 发生 等过程 中, p i R N A具有 多种 生物 学功能 。文 中综述 了近 年 来禽 类在 p i R N A方 面的研 究进展 。 关键 词 p i R N A; 家禽 ; 生 殖; 进展 中 图分 类号 S 1 8 8 文献标识码 A 文章编 号 0 5 1 7— 6 6 1 1 ( 2 0 1 3 ) 1 5 — 0 6 6 0 3 — 0 1
a r e g e n e r a t e d f r o m 1 o n g g e n o mi c c l u s t e r s ,s p e c i f i c t o t h e a d u l t t e s t i s .a n d ma y b e i n v o l v e d i n t e s t i s d e v e l o p me n t a n d s p e r ma t o g e n e s i s .T h e f u n c t i o n o f P i wi / p i RNA c o mp l e x e s i S n o t f u l l y u n d e  ̄t o o d a s o f y e t .b u t s o me s t u d i e s p o i n t t o a p o s s i b l e r o l e i n t h e e p i g e n e t i c r e g u l a t i o n o f t r a n s p o s a b l e e l e me n t s i n t h e g e r ml i n e,p l a y i n g a r o l e n o t wi t h Di c e r e n z y me,b u t wi t h c o mb i n a t i o n o f Pi wi p r o t e i n f a mi l y me mb e r s .T h e pr e s e n t s t u d i e s o f p i RNA f u n c t i o n a r e ba s i c a l l y l i mi t e d t o t h e r e p r o d u c t i v e c e i l s .Th i s r e v i e w i S a bo u t t h e pr o g r e s s i v e s t u d y o n t h e p o u l t r y o f p i RNA. Ke y wo r d s p i RNA :P o hr y;Re p r o d u c t i o n;P r o g r e s s
piRNA的形成及其在雌性动物中生物学功能研究进展

ResearchProgressonPiRNAFormationandFunctioninFemaleAnimals
LIChun-yan1,2,REN Chun-huan2,LIU Qiu-yue1,HU Wen-ping1,WANG Xiang-yu1, CAO Xiao-han1,ZHANGZi-jun2,DIRan1* ,CHU Ming-xing1*
期 10
李春艳等:piRNA 的形成及其在雌性动物中生物学功能研究进展
1787
中piRNA 通常与 蛋 Argonaute 白中 亚 Piwi 家族成
员 特 异 性 结 合 分 别 形 成 (Piwi、Aub、Ago3)
,
Piwi-
类复合体 其 piRNA、Aub-piRNA、Ago3-piRNA3
。
中 和 中 来 源 于 ,Piwi-piRNA Aub-piRNA piRNA
(Vret、Mino、Gasz
等)作用下可形成中间体piRNA 的5′U 位点,再产
生 次级结构 对 序列剪切 piRNA
,Zuc Piwi-piRNA
形成 末 3′ 端,并通过外切酶 作 trimmer、Papi 用切割
Piwi-piRNA 的成熟位点,接着发生 Hen1介导的甲
基化,最后成熟的 Piwi-piRNA 复合物进入细胞核
C57BL/6J
性小鼠为研究对象,利用吸附柱离心法从输精管中
分离得到一种小 并通 RNA, 过蛋白印记法检测到这
种高表达量的小 RNA 与 一 MILI( 种 亚 Piwi 蛋白)
相 互 作 用 ,他们将其 命 名 为 piRNA。 之 后,对 piRNA
的生物学来源研究发现,基因组上基因间区大量的
文献解读PiRNApiwi复合物在癌症中的新作用

文献解读PiRNApiwi复合物在癌症中的新作用论文:The emerging role of the piRNA/piwi complex in cancer(PiRNA/piwi复合物在癌症中的新作用)摘要Piwi相互作用RNA(PiRNAs)是一种长度约为24-31个核苷酸的新型非编码RNA分子,常与皮维蛋白家族成员结合,发挥调节作用。
最近,新的证据表明,除了哺乳动物的生殖细胞外,pRNAs也以一种组织特异性的方式在多种人类组织中表达,并在转录或转录后水平上调节关键的信号通路。
此外,越来越多的研究表明,在各种癌症中异常表达的pRNA和PIWI蛋白可能成为肿瘤诊断和治疗的新的生物标志物和治疗靶点。
然而,pRNAs在癌症中的作用及其潜在机制尚不完全清楚。
在本文中,我们讨论了有关pRNA生物遗传过程、功能和在癌症中新出现的角色的最新发现,为pRNAs和piwi蛋白在癌症诊断和临床治疗中的潜在应用提供了新的见解。
PRNA簇的转录一大部分可以唯一定位的pRNAs来自两种类型(高达200 kb)的基因组位点,称为piRNA簇。
与编码基因类似,单链簇含有PolⅡSer5P和H3K4me2标记的启动子,它们通过rna聚合酶II产生转录本,而RNA聚合酶II通过RNA聚合酶II完成5-末端盖层、3-末端多腺苷化和有时选择性剪接。
相反,双链簇是从两个基因组链中转录出来的,依赖于附近编码基因的启动子来启动转录,而不是经过相应的处理。
piwi蛋白在肿瘤中的作用及机制a。
在TGS水平上,pRNA-蛋白质复合物吸收沉默的机械成分,将抑制性H3K9me3标记引入到目标DNA体内,并从启动子区域去除活性H3K4me2标记。
此外,pRNAs/piwi复合物还会使DNMT基因在CpG位点发生甲基化。
b。
在PTGS水平上,pRNAs/piwi复合物与靶RNA结合,并通过序列互补阻碍其功能。
c。
PRNAs/piwi复合物-蛋白质相互作用。
肿瘤研究之piRNA生物标记物研究方案

肿瘤研究之piRNA生物标记物研究方案1.研究背景迄今为止,对于晚期的癌症尚无有效的治疗措施,癌症的死亡率居高不下。
因此,癌症的早期诊断和预后显得尤为重要。
癌症的生物标记物是癌症直接产生或由身体对癌症特定响应分泌的物质,这些物质或过程的存在表明癌症存在于人体。
研究癌症生物标志物的方法由多种,包括特异性分子、基因和蛋白表达、影像学、生理学、以细胞为基础的标志物及其他的形式。
大量研究发现,人类PIWI蛋白在多种肿瘤中均有异常表达,如乳腺癌、胰腺癌、肝癌等(Lee JH et al., 2006 ; Zeng Y et al., 2011)。
但是,PIWI蛋白的异常表达是如何影响肿瘤的临床特性却是未知的。
尽管piRNA在癌症中还未被广泛研究,但是仅有的少数研究表明,癌症中piRNA表达谱发生了变化。
乳腺癌中发现了数百个特异的piRNA序列,其中差异表达的有6个。
采用RT-PCR技术在大样本中验证,证实其中4个确实发生了显著性变化(Huang G et al., 2013)。
有报道表明,piR-823在胃癌组织中表达显著降低,并且表达水平与胃癌分期相关,piR-823水平上调会导致胃癌细胞生长抑制(ChengJ et al., 2011)。
此外,胃癌患者外周血中piR-823明显低于对照组,说明piR-823具有作为胃癌诊断标志物的潜能。
PiR-823也被证明和多发性骨髓瘤相关。
有研究表明piR-823在多发性骨髓瘤中显著上调并与临床分期呈正相关。
在多发性骨髓瘤细胞沉默piR-823诱导细胞凋亡相关蛋白表达,促进癌细胞死亡。
进一步研究发现,piR-823通过表观修饰抑制抑癌基因的表达(Yan H et al., 2015)。
piR651被发现也和胃癌相关。
在胃癌组织中,piR651表达上调,上调水平也与胃癌分期相关。
可作为胃癌诊断治疗的潜在靶点(Cheng J, et al., 2011)。
piRNA在肿瘤中异常表达的现象已多有报道,但有关piRNA调控肿瘤进展的机制研究较少。
小RNA的进展研究

因此本文本献中作者正是通过实验去研究这个问题。
首先,提出研究假设:
是Mili和Miwi核酸内切酶的活性导致了: 1、piRNA大量扩增; 2、LINE1、IAP转座子的沉默。
其次,实验方法及过程
采用进来常被用来研究 Ago2蛋白亚家族(piwi) 核酸内切酶的研究方法来研究Mili和Miwi核酸内切酶。 1、采用点突变技术对小鼠的Mili和Miwi2的基因组进 Ago蛋白的亚族是Piwi蛋白,而Piwi蛋白有包括Mili、 行修饰,从而将第二位的天冬氨酸改变成了丙氨酸, Miwi和Miwi2三种,在小鼠中只有Mili和Miwi2两种。 以此来消除它两的催化作用,但是同时又必须保证既 不影响Mili和Miwi2表达量又不影响体内其他蛋白质的 功能。突变后分别成为MiliDAH和MiwiDAH。 2、设置野生型小鼠作为对照。
返回
间接免疫荧光(indirect immunofluorescence )
定义:直接免疫荧光技术的改进。待检细胞首先用未标记的 抗体处理,使之与特异的抗原形成复合物,然后再用抗抗体 的荧光标记抗体着色,即可检测出特异抗原在细胞中的存在 部位,具有荧光增强效应。
返回
点突变(point mutation)
果然发现了分别与两类酶结合的piRNA存在结构上的不同:
与两类核酸酶(Mili和Miwi)结合的piRNA基 因结构不同之处: LINE1和IAP沉默途径中野生型与突变型与Mili结合的piRNA 基因结构不同(数据d)
在LINE1和IAP沉默途径中与Mili结合的piRNA 结构组成的不同(数据c) 分别与Mili和Miwi结合的piRNA不同(数据e)
斯坦福医学院病理学 和遗传学教授
Craig C. Mello
piRNA在生殖系统中的研究进展

piRNA在生殖系统中的研究进展赵鸿娟;王亚楠;高树军;张媛媛;李光鹏;王煜【期刊名称】《国际妇产科学杂志》【年(卷),期】2016(043)005【摘要】Piwi蛋白相互作用RNA(piRNA)是一类长度约为30个核苷酸的非编码RNA。
目前研究提示piRNA通过与PIWI蛋白家族成员结合后,参与异染色质形成、生殖细胞的发育和维持DNA的完整性。
piRNA与小干扰RNA (siRNA)及微小RNA(miRNA)均是近些年发现的非编码小RNA,在功能、分布和分子特征等方面存在着显著不同。
piRNA在精子的发生过程中起着重要的生理调节作用,目前对于piRNA的研究逐渐深入,认识也进一步提高。
例如, piRNA的结构特点,发挥功能相关作用蛋白,在体内的分布与表达,在生物体内与PIWI发挥作用的方式以及功能。
piRNA数据库的建立将对此类小分子RNA的研究有很大的促进作用。
%Piwi-interacting RNA (piRNA) is a group of small RNAs about 30 nucleotides length that isolated from mammalian reproductive cells, which could bind to the Piwi proteins and regulate its corresponding function. piRNA mainly participates in the process of development of germ cells, silence of transposon, formation of heterochromatin, DNA integrity of germ cells, and so on. It contributes to steady heredity of hereditary substance. As small interfering RNA (siRNA), microRNA (miRNA) and piRNA is a kind of non-coding small RNAs founded in recent years. However, they are different in functions, gene distributions and characteristics. piRNA is essential for physiological modulation ofspermiogenesis. The research of piRNA was further investigated, such as structural features, distribution and interactions with PIWI proteins. Furthermore, establishment of piRNA database will facilitate scientific research of piRNA.【总页数】5页(P576-580)【作者】赵鸿娟;王亚楠;高树军;张媛媛;李光鹏;王煜【作者单位】010050 呼和浩特,内蒙古医科大学附属医院;内蒙古大学实验动物中心;内蒙古大学生命科学学院;内蒙古大学生命科学学院;内蒙古大学实验动物中心;010050 呼和浩特,内蒙古医科大学附属医院【正文语种】中文【相关文献】1.piRNA/PIWI 在肝癌发生发展中的机制研究进展 [J], 周代兵;张凌云;许国雄2.piRNA在生殖系统中的功能研究进展 [J], 张燕;樊伯珍;童晓文3.女性生殖系统肿瘤患者的微生物群在肿瘤中的作用的研究进展 [J], 唐杰;何京4.piRNA在阿尔兹海默症中的研究进展 [J], 孙添怡5.PIWI/piRNA在妇科恶性肿瘤中的研究进展 [J], 许瑞雪;毛奕文;马洋洋;蒋学风因版权原因,仅展示原文概要,查看原文内容请购买。
piRNA生物学起源及功能研究进展

中国生物工程杂志 C h i n a B i o te c h n o lo g y,2021,41 (5 ) :45-50D O I:10. 13523/j.c b.2101014piRNA生物学起源及功能研究进展颜愈佳邹玲*(四川大学华西口腔医院牙体牙髓病科口腔疾病研究国家重点实验室国家口腔疾病临床医学研究中心成都610041)摘要p i R N A属于非编码小R N A的一员,常见于生殖系干细胞中。
既往学者们认为它主要在维持干细胞功能、配子的形成以及沉默外来转座子等方面发挥作用。
但近来在体细胞系中的发现,使得人们对它的生物起源以及功能行使有了更大的兴趣。
就p i R N A的发现、结构特征、功能与基因调控等进行了综述。
关键词 p i R N A P I W I表观遗传调控转录后水平调控中图分类号Q819根据能否行使指导蛋白质合成的功能,生物体内 R N A被分为了编码R N A与非编码K N A两大类。
非编 码R N A中有许多种小R N A,如m i R N A、s i R N A。
高等生 物的体内存在着大量的非编码小R N A,它们并不能被 翻译表达。
研究发现它们的一大功能即为与协同蛋白 质组装成名为R N A诱导沉默复合体(R N A-i n d u c e d silencing c o m p l e x,R I S C)的功能单位,通过小R N A与目 标m R N A碱基互补配对锚定,切割或抑制它的翻译,这 一转录后水平的基因沉默又被称为R N A干扰(R N A i)。
参与复合体组装的非编码R N A有m i R N A、s i R N A,它们 组成了细胞中高度复杂的R N A调控网络K。
后续研究在果蝇、小鼠以及大鼠等物种〜的生殖 系干细胞内均发现了一类新型的小分子非编码R N A,因为它们能与P I W I蛋白质相互作用故被命名为P1W1相互作用 R N A( PlWI-interacting R N A),简称 p i R N A。
piRNA的生物学功能及研究进展

聚 类分 析 表 明绝 大 部 分 MI L I i n t e r a c t i n g R N A序 列来 自
基 因 同一 区域 , 由于 与这 些小 RN A作用 的 Mi l i 蛋 白属 于 P I WI ( P — e l e me n t i n d u c e d w i mp y t e s t i s ) 蛋 白家 族 成 员 , 故 将 该 小 RN A类 群 命 名 为 P I WI — i n t e r a c t i n gR N A 即
p i R N A f P I WI — i n t e r a c t i n g RN A ) 是2 0 0 6年 被 发 现 的
一
p i RN A。与此 同时 ,G i r a r d p 等 在提 取小 鼠睾丸 总 R N A
时 也 发 现 了 这 种 与 MI L I 蛋 白 互ຫໍສະໝຸດ 作 的 小 RN A, 并 将 小
类 新 的 非 编 码 RN A( n o — c o d i n g RN A,n c R N A) ,主 要
来 源 于基 因 组 中 的 p i R N A簇 f c l u s t e r ) ,通 过 长 单链 初
鼠 、大 鼠和人 染 色体 上该 类小 RN A进 行 比对 分析 ,发 现 这些 MI L I i n t e r a c t i n g R N A 的大 部 分基 因簇 都 出 现在 同线 位 置 。证 明这种 小 R N A在不 同物 种 间的 相似性 较 高 。此外 , 在小 鼠 、 果 蝇 及线 虫等模 式生 物 的生精 细胞 、 生殖 系细 胞和 睾丸组 织 中也 发现 了此 类小 R N Al 4 卅。
piRNA 综述

piRNA:一类新的非编码小RNA黄雪梅张守涛 王芳刘伟张一折(郑州大学生物工程系郑州450001)摘要piRNA(Piwi-interactingRNA)是从哺乳动物生殖细胞中分离得到的一类长度约为30nt的小RNA,并且这种小RNA与PIWI蛋白家族成员相结合才能发挥它的调控作用。
目前,越来越多的文献表明piRNA在生殖细胞的生长发育中的调控是由于Piwi?piRNA复合物引起的基因沉默导致的,但由于对piRNA的研究尚处于初级阶段,它的一些具体的功能和生源论尚在研究当中。
综述了piRNA的最新研究进展。
关键词piRNA非编码小RNA生殖细胞发育中图分类号Q74生物体中RNA可以分成两大类:编码RNA和非编码RNA。
非编码RNA中有许多种小RNA,在高等生物体内存在着大量的非编码小RNA,它们组成了细胞中高度复杂的RNA调控网络,在调节时序发育、细胞增殖、不对称发育、树突状脊的发育、胚胎早期发育、肿瘤的发生发展、干细胞分化及抗病毒等整个细胞水平的几乎所有事件中起着重要的调控作用。
在非编码小RNA的研究中,小干扰RNA(siRNA)和微小RNA(microRNA,miRNA)的研究起步较早、研究也较深入。
siRNA是一类约21~25nt的RNA分子,由Dicer(RNAaseⅢ家族中对双链RNA具有特异性的酶)加工而成,通过完全互补配对的方式与目标mRNA结合,引起其降解,从而导致靶基因的的沉默。
miRNA是一种长度为21~25nt的单链小分子R NA。
它广泛存在于真核生物中,成熟的miRNA,5′端有一个磷酸基团,3′端为羟基,它是由70~90个碱基、具发夹结构单链RNA前体(pre miRNA)经过Dicer酶加工而成,主要通过与靶标基因不完全互补结合,进而抑制翻译或促进mRNA聚腺苷酸尾巴(polyAtail)的去除等方式调控靶基因的表达[1]。
但最近的相关研究发现,生物体内还存在与前两种小RNA长度不同的另一类非编码小RNA,它们的长度约为30nt,通过与Argonaute家族蛋白等结合来调控mRNA的稳定性、蛋白质的合成、染色质组织和基因组的结构。
【课外阅读】耶鲁大学科学家发现RNA对基因的操控作用

耶鲁大学科学家发现RNA对基因的操控作用纽黑文– piRNA 是RNA中十分微小的一部分,前不久才刚刚被发现。
日前,在耶鲁大学干细胞中心的新科研成果中,原本鲜为人知的piRNA在基因中所起的关键作用首次得以展现。
这一出乎意料的发现对解开基因之谜意义重大。
«自然»对本次发现进行了报道。
耶鲁大学医学院细胞生物学教授、干细胞中心总监,林海帆,当初带领中心发现了piRNA的存在。
此前,piRNA被科学界归为“垃圾DNA”,因此一直无人问津。
直到林海帆和他的团队在哺乳动物生殖细胞中发现了他们并将其命名为piRNA,这才引起基因学家和分子生物学家的广泛关注。
实验室本次的研究结果表明piRNA对干细胞的命运以及组织形成都起着关键作用。
这一发现为通过治理、干预干细胞行为医治疾病的新技术鉴定了基石。
piRNA的生物合成及其在生殖细胞中的功能

piRNA的生物合成及其在生殖细胞中的功能Carla Klattenhoff and William Theurkauf*小干扰RNA和微小RNA是由双链的RNA前体经核酸内切酶Dicer切割生成的,并与Argonaute家族蛋白共同作用破坏转录物或沉默翻译。
一类清楚的RNA核苷酸长度为24-30个,通过Dicer依赖型机制生产,与Argonaute蛋白家族中的Piwi蛋白结合。
关于苍蝇、鱼和小鼠的研究暗示了Piwi蛋白结合RNAs (piRNA)在生殖细胞发育、沉默自私DNA元件和维持种系DNA完整性中的功能。
然而,无论是piRNA染色质主要控制机制、基因转录、RNA稳定性或RNA翻译,还是piRNA的生物合成都不是很清楚。
在这里,我们回顾了近期的关于piRNA生成和功能的研究,并讨论关于这个耐人寻味的新型小RNA的悬而未决的问题。
前言1993年,安布罗斯和他的同事发现,线虫的lin-4基因通过负调控编码一个小调控RNA并与lin-14的转录单元互补(Lee等人,1993)。
这些开创性的研究确定了第一个微小RNA(miRNA)。
在动物和植物实验室中,非编码的小RNA 随后成为强大的实验工具和关键的发育调节者(Baulcombe,2004;汉农,2002;Kloosterman和Plasterk,2006;梅洛和康特,2004)。
目前,21个核苷酸(nt)的小干扰RNAs(siRNAs)被频繁用于实验性的操纵基因表达,它是通过Dicer 核酸内切酶处理长双链RNA(dsRNA)的前体得到的,随后形成中间体RNA-蛋白质复合体。
该中间体取代RNA的其中一条链(被称为“过客链”),并产生成熟的RNA诱导的沉默复合体(RISC),其中包含一条能够与Argonaute蛋白家族结合的单链(“引导链”)。
当siRNA的引导链与靶RNA完全互补时,Argonaute 蛋白识别特异性序列并切割(Hannon,2002;Meister和Tuschl,2004)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PiRNA 研究进展非编码小RNA在正常的生物学过程和人类疾病中均有重要作用(Esteller, M et al., 2011),主要包括microRNAs(miRNA)、short-interfering RNAs (siRNA)和PIWI-interacting RNAs(piRNA)。
piRNA的发现得益于PIWI蛋白家族的研究,这种蛋白是动物繁衍后代所必须的。
目前,保守估计真核生物基因组上大约具有20,000个piRNA(Moyano, M et al., 2015)。
piRNA首次在果蝇的睾丸中被鉴定为一种新的长的siRNA( long siRNA),可以沉默位于果蝇X染色体上的多拷贝基因Stellate (Arvain et al, 2001)。
后因与Argonaute蛋白家族亚族PIWI相结合发挥作用而得名,由Arvain等采用层析柱法从小鼠睾丸细胞中分离得到(Arvain et al, 2006)。
PiRNA是一类片段大小在26-31nt单链小RNA,大部分集中在29-30nt,5’端具有强烈的单磷酸尿嘧啶核苷酸倾向性,3’端(2ʹ-O- methyl)进行了甲基化修饰(Kirino et al., 2007)(Fig 1)。
Fig 1 structure of piRNApiRNA 生成机制研究进展已研究的大部分物种中,基因组上散在分布的基因座产生了绝大部分的piRNA,这些基因座被称为piRNA簇(piRNA cluster)。
PiRNA 簇根据能否从基因组上的两条链或一条链产生piRNA而分为双链簇和单链簇。
单链簇piRNA 是分布最广泛的也是默认的类型。
单链簇转录生成piRNA前体与经典的转录途径事实上是难以区分的,基于二者都具有以下几个转录特点:(1)启动子区域都有H3K4me2 (histon 3 lysin 4 dimethylation )标志;(2)转录由RNA聚合酶Ⅱ(pol Ⅱ)负责;(3)经典的RNA转录后加工(5’端帽子修饰、剪切、多聚腺苷酸修饰)(Goriaux C et al., 2014)。
单链簇转录模式在果蝇中研究的比较清楚。
目前,已发现的主要有两个单链簇20A 和flam(Brennecke J et al., 2007)20A 在体细胞滤泡细胞(somatic follicle cell)和生殖细胞中均表达,flam只在滤泡细胞中表达。
Flam具有几个显著的特点(Fig 2): (1) 位于常染色质和异染色质的边界;(2)flam中含有gypsy家族的TEs ;(3) 启动子具有H3K4me2标记,簇体具有H3K9me2标记。
Flam的转录需要转录因子Ci (Cubitus interruptus)的参与,piRNA前体的剪切产生多个异构体,这些异构体可以通过UAP56和转运蛋白Nxf1和Nxt1转运到细胞质中的Yb小体进行piRNA的成熟和加工(Fig 3)。
Fig 2 flam cluster in the follicle cells of Drosopbila ovaryFig 3 the transcription of flam cluster双链簇是果蝇生殖细胞中piRNA生成的主要方式。
顾名思义,piRNA前体可以从基因组的两条链生成。
这种方式有别于经典的转录方式,是一种启动子非依赖的转录方式,并且不需要剪切和多聚腺苷酸形式的加工。
多项研究表明,Rhino(特异性的结合到piRNA簇的H3K9me2标记),一种异染色体蛋白1(HP1)的同源物(Yu, B et al., 2015),是双链簇转录的灵魂蛋白。
Rhino被认为是一种“锚”,与Deadlock (Del) 和Cutoff (Cuff) 组成复合物。
Rhino-Del 招募Moonshiner 和TATA box 结合蛋白相关因子2(Trf2)到簇的YR元件起始转录(Malone, C. D. et al,2009; Andersen, P. R et al.,2015 )。
Rhino-Del-Cuff通过抑制剪切和转录终止来确保簇的转录的不断延伸。
转录完成后,piRNA前体通UAP5转运到胞质的nuage区域进行加工(Fig4)。
Fig 4 Fly germline dual-strand clusters’s transcriptionspiRNA前体的加工、成熟发生在特定的亚细胞区域,动物生殖细胞中称作nauge,需要PIWI蛋白的参与(Brennecke J et al.,2007; Lim AK et al., 2007 )。
体细胞来源的果蝇卵泡细胞中被所谓的“Yb 小体”替代,位于核膜的胞质一侧(Murota Y et al., 2014; Qi H et al., 2011 )。
依据最新的研究表明,成熟piRNA的生成根据是否依赖于Zuc而分成两种途径,一种是Zuc介导的途径,另一种是Zuc非依赖的生成途径。
核酸内切酶Zuc/MitoPLD,位于线粒体外膜,通过结构及小RNA遗传与生信分析表明。
其在piRNA生成途径中的核心地位。
Zuc不仅参与到了piRNA 5’端的形成,还直接或间接的参与到3’端的产生(Han, B. W et al., 2015)。
随着piRNA簇每隔25nt进行剪切时,果蝇中Zuc的活性表现出一种显著的持续性bi 变化。
此外,在整个加工过程中PIWI蛋白都参与其中,但是PIWI的加载和Zuc剪切之间的关联还不清楚。
Zuc介导的途径主要由以下两个阶段合作完成:(1)“乒乓循环机制”;(2)Zuc依赖的拖尾piRNA生成途径。
“乒乓循环机制”剪切piRNA前体转录本,产生5’端单磷酸基团的pre-pre-piRNA,为Zuc依赖的拖尾piRNA生成途径提供底物。
“乒乓循环机制”具体过程(Fig 5 ):(1)Aub结合到piRNA(反义链)形成复合物去识别并剪切转座子mRNA,随后较短的剪切产物被装载到Ago3蛋白,发生剪切并产生Ago3-piRNA(正义链)复合体前体,通过Nbr对3’端进行修饰成熟。
成熟的Ago3-piRNA(正义链)复合体识别和剪切piRNA前体转录本,剪切的产物又可以起始新一轮的循环,不断的产生Zuc依赖的拖尾piRNA生成途径的底物。
整个循环过程中,特定的复合物(如Vasa、Krimp、Qin、Spn-E)的装载确保剪切产物被装载到不同的PIWI蛋白(Aub/Ago3)上。
PiRNA的生成以3’方向的形式进行,Zuc以每隔25nt的形式剪切产生拖尾piRNA,该过程中由多个因子参与其中,但是其中的具体机制还不清楚(Fig 5 )。
最后,Hen1 对拖尾piRNA进行修饰产生成熟的piRNA。
Fig 5 Biogenesis of piRNAs by Zuc-dependent pathwayZuc非依赖的piRNA生成途径主要在果蝇的卵巢中发现,哺乳动物和家蚕中很稀有。
上文提到,“乒乓循环机制”与Zuc介导的途径共同完成成熟piRNA的产生,事实上,“乒乓循环机制”也可以独立发挥功能。
Zuc不存在时,piRNA 5’端通过正常的剪切产生,3’端通过Nbr去尾修饰(Hayashi R et al., 2016)。
秀丽引杆线虫(C.elegans)中不存在“乒乓循环机制”,piRNA (21U-RNAs) 的产生于25-29nt前体,通过前体前两个核苷酸的切除和3’端修饰成熟(Gu W et al., 2012)。
PiRNA 功能研究进展PiRNA首先在生殖细胞中被发现大量表达,其功能是抑制转座子,维持基因组结构的稳定性。
随着体细胞和癌细胞中piRNA的发现,凸显了piRNA功能的多样性和重要性。
下文就piRNA已知的几项主要功能进行阐述。
转座子剪切通过研究piRNA序列发现,生殖系统来源的极大部分piRNA 是被从基因间区转录出来的,基因间区序列富集着大量的转座子序列碎片(Gunawardane LS et al., 2007)。
PiRNA对转座子剪切功能的实现主要体现在piRNA对反转座子RNA进行识别,识别后利用核酸内切酶活性对转座子进行切割,达到抑制反转座子转座目的。
生殖细胞发育过程中对反转座子进行调控是piRNA的主要功能之一。
果蝇的卵泡细胞中,piRNA-PIWI复合物通过识别转座子的初生转录本定位到转录位点,进而招募组蛋白甲基转移酶对H1组蛋白进行H3K9甲基化修饰从而抑制转录(Huang XA et al., 2013)。
PiRNA也可以通过诱导DNA发生甲基化而抑制其转座。
在小鼠的精细胞中,piRNA-PIWI复合体进入细胞核后识别LINE-1的初生转录本,通过一系列反应引起LINE-1 DNA 发生甲基化抑制其表达(Aravin AA et al., 2008)。
大量研究发现,piRNA在其生成过程中伴随着在转录后水平上对转座子的剪切。
这一过程主要通过“乒乓循环”生成途径完成(Saito K et al., 2009)。
表观调控近期研究表明,piRNA途径通过组蛋白修饰和DNA甲基化进行表观调控。
果蝇中,PIWI和Aub蛋白被发现是位置效应斑(position-effect variegation)的调控者,提示piRNA途径通过促进染色体的异染色质化沉默基因表达(Pal-Bhadra,M et al., 2004)。
在小鼠的配子发生中,卵母和精母细胞阶段PIWI和piRNA集中高表达,而这个阶段恰是这两种细胞处于表观修饰最低水平的状态,如DNA甲基化修饰、组蛋白的甲基化修饰等(Sasaki H et al., 2008)。
在诱导多功能干细胞(iPSC)中也发现有piRNA的存在。
iPSC具有分化成各类细胞的潜能,其中表观修饰决定着细胞分化的命运,piRNA与染色体和DNA的表观修饰有关,通过参与这一过程,使得细胞向定向的方向进行分化(Wang Y et al ., 2014)。
除了对基因组的转座子区域进行表观修饰,研究发现,在神经细胞中piRNA通过DNA甲基化影响神经突触的可塑性(Rajasethupathy, P et al., 2012)。
转录后水平调控piRNA对基因的转录后水平调控不局限于转座子。
果蝇卵巢、小鼠生殖组织、非洲爪蛙卵中发现一些编码蛋白的mRNA 3’ UTR区域同样可以产生piRNA。
这些3’ UTR区域含有转座子重复序列,提示,piRNA具有调控mRNA水平的潜能(Robine, N et al., 2009)。
多项实验证明,piRNA pathway 与 P-bodies 紧密相连,P-bodies 是一种胞质复合物-参与翻译调控。
