实验六 水果中总酸及pH的测定
果汁中总酸度及有效酸度的测定 自己做的

QS NO 2012003 实验报告专业:工业分析与检验课程:食品分析班级:XXXXXXXXXX姓名:XX学号:************实验日期:2012/4/11XXXX职业技术学院化工系实验一:果汁中总酸度及有效酸度的测定实验目的:1)掌握食品中有效酸度及总酸度的概念。
2)掌握并运用测定食品中有效酸度及总酸度的方法。
实验原理:食品中的有机弱酸在用标准碱液滴定时,被中和成盐类,用酚酞作指示剂,当地定制终点(PH8.2,指示剂显红色)时,根据滴定时小号的标准碱液的体积,可计算出样品中的总酸量,其反应式为ORCOOH+NaOH →ROOHNa+H2实验仪器及试剂:仪器:碱式滴定管、锥形瓶、烧杯、水浴锅、量筒、玻璃棒、万方式电炉、PHS-4型酸度计试剂:(1)0.1000mol/LNaOH标准滴定溶液。
配置:称取氢氧化钠110g,溶于100mL无水二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
取上层清夜5.4mL,用无水二氧化碳的水稀释至1000mL,摇匀。
标定:精密称取0.75g预先于105-110度烘箱中干燥至恒重的基准邻苯二甲酸氢钾,加无水二氧化碳的水50mL,振摇使其溶解,加2滴酚酞指示剂,用配置的NaOH标准溶液滴定至溶液呈红色30s不褪色,同时作空白试验。
计算:22.204)(10000⨯-⨯=v v m c式中C---氢氧化钠标准溶液的摩尔浓度,mol/L ;m --基准试剂邻苯二甲酸氢钾的质量,g ;V 0 -----空白试验所消耗用氢氧化钠标准溶液的体积,mL ;V----标定时所消耗氢氧化钠标准溶液的体积,mL ;204.22--邻苯甲酸氢钾的摩尔质量,g/L ;(2)1%酚酞乙醇溶液:称取酚酞1g 溶解于100mL 95%乙醇中。
实验步骤:(一)食品中总酸度的测定①样品制备液体样品:不含二氧化碳的样品,充分混合均匀,备用;含二氧化碳的样品,至少取200g 样品于500mL 烧杯中,置于电炉上,边搅拌边加热至微沸腾,保持2min ,称量,用煮沸过的水补充至煮沸前的质量,置于密闭玻璃容器内,备用。
水果中总酸度的测定方法

实训一:水果中总酸度的测定一、目的要求:1.学会水果样品的预处理方法2.掌握用酸碱滴定法测水果样品中总酸度的原理和方法3、学会合理制定分析项目的顺序,做到合理安排分析时间,合理处理样品。
4、能熟练制备实训过程中所需要的标准溶液。
5、能规范记录数据并进行数据处理。
二、实训原理:1. NaOH标准溶液的标定NaOH易吸收水分及空气中的CO2,因此,不能用直接法配制标准溶液。
需要先配成近似浓度的溶液,然后用邻苯二甲酸氢钾为基准物进行标定。
以酚酞为指示剂,当滴定至终点溶液呈浅红色,且30S不褪色时。
反应如下:KHC8H4O4+NaOH=KNaC8H4O4+ H2O2.水果总酸度的测定根据酸碱中和原理,用碱标准溶液滴定试样液中的酸时,以酚酞威指示剂。
当滴定至终点溶液呈浅红色,且30S不褪色时,根据滴定时消耗的标准NaOH溶液的体积,可算出试样中的总酸度。
其反应如下:HAC+NaOH→NaAc+H2O三、实训所需仪器、试剂:洗仪器:袁驰仪器:酸碱式滴定管、锥形瓶、移液管、量筒、烧杯、容量瓶、胶头滴管、洗耳球、水浴锅、铁架台、电子天平、玻璃棒、小纸片、干燥的纱布、试剂: 0.1000mol/LNaOH溶液、邻苯二甲酸氢钾、酚酞指示剂、水果试样、的蒸馏水、无水CO2四、实验步骤:1. 0.1000mol/LNaOH标准溶液的配制和标定配制:马佳红称取固体NaOH约2g放置在500ml的烧杯中,先加入100ml少溶解,再加水稀释成500ml溶液,混匀,放入烧杯中,待标定。
标定:曹芬芳用减量法准确称取0.41~0.45g邻苯二甲酸氢钾3份,分别放入250ml锥形瓶中,加25mL无CO2蒸馏水溶解。
然后加1-2滴酚酞指示剂,用NaOH标准溶液滴定至终点(至粉红色,并保持30s不褪色为终点)。
记录每次消耗NaOH溶液的体积。
2.试样处理:榨汁:袁驰取水果试样,需去皮、去柄、去核,切成块状,置于搅拌机中捣碎并混匀。
准确移取25ml水果试样,加100mL无CO2的蒸馏水,稀释定容为250ml溶液。
水果总酸度的测定

实训一:水果总酸度的测定一、实验目的1、学会水果样品的预处理方法2、掌握用酸碱滴定法测定水果样品中总酸度的原理和方法3、学会合理指定分析项目的顺序,做到合理安排分析时间,合理处理样品。
4、能熟练纸杯实过程中所需要的标准溶液。
5、能规范记录数据并进行数据处理。
二、实验原理• 1. NaOH标准溶液的标定NaOH易吸收水分及空气中的CO2,因此,不能用直接法配制标准溶液。
需需要先配成近似浓度的溶液,然后用邻苯二甲酸氢钾为基准物进行标定。
以酚酞为指示剂,当滴定至终点溶液呈浅红色,且30S不褪色时。
反应如下:•KHC8H4O4+NaOH=KNaC8H4O4+ H2O• 2.水果总酸度的测定根据酸碱中和原理,用碱标准溶液滴定试样液中的酸时,以酚酞为指示剂。
当滴定至终点溶液呈浅红色,30s不褪色时,根据滴定时消耗的标准碱溶液的体积,可算出试样中的总酸度。
其反应如下:•HAc+NaOH →NaAc+H2O三、实验仪器及试剂•试剂:0.1000mol/LNaOH标准溶液、邻苯二甲酸氢钾、酚酞指示剂、无CO2的蒸馏水、水果试样(梨)•仪器:洗耳球、玻璃棒、量筒、移液管、电子天平、•水浴锅、锥形瓶、容量瓶、酸碱滴定管、烧杯、小纸片、胶头滴管、干燥的纱布、铁架台四、实验步骤•1、0.1000mol/LNaOH标准溶液的标定:(顾嘉俊王英权)•0.1000mol/lNaoH标准溶液已经配制好,待标定。
•用减量法准确称取0.4—0.45g邻苯二甲酸氢钾三份,分别放入250ml锥形瓶中,加25ml无CO2的蒸馏水溶解。
•然后加1—2d 酚酞指示剂,用NaOH溶液滴定至终点(至粉红色,并保持30s不褪色为终点)。
•记录每次消耗NaOH溶液的体积。
•2、试样的处理:(朱方灵、陈鹏)•取梨试样500g,去皮、去柄、去核,切成块状,置于搅拌机中捣碎并混匀。
移取梨试样50ml稀释定容为250ml溶液至容量瓶中,然后倒入到烧杯中在75 ~80℃的水浴上加热30分钟。
实验六 果蔬中含酸量的测定

实验六果蔬中含酸量的测定实验目的:掌握测定果蔬中含酸量的方法,了解水果和蔬菜中不同含酸量的差异。
实验原理:酸碱滴定法是一种重要的分析化学技术,它可以用于测定生物和食品中酸的含量。
在该方法中,酸和碱之间的反应被利用来确定溶液中酸的浓度。
为了测定酸的量,需要先用一种酸性指示剂,例如酚酞,将pH值调整到适当的范围。
然后通过逐滴加入一定浓度的碱溶液,同时观察颜色变化,来测定溶液中的酸量。
当溶液中的所有酸已经被中和时,反应达到了终点。
终点时的溶液颜色可以用于计算酸的浓度。
实验步骤:1. 准备0.1mol/L的NaOH标准溶液。
将精密天平上取约4g NaOH,加入100ml水中,搅拌至溶解,定容以1000ml瓶子中,摇匀即制得0.1mol/L的NaOH标准溶液。
2. 准备酸性指示剂。
将酚酞2.5g粉末加入100ml酒精中,摇匀并通过滤纸过滤,即制得酸性指示剂。
注: 酚酞是一种广泛使用的指示剂,它能够承受高酸度,适用于pH值在8.2至10之间的中和反应。
3. 准备水果和蔬菜样品。
将所选的水果和蔬菜样品洗净,去皮去核,切成小块,并在一定量的水中煮沸10分钟,以使维生素C和其他不稳定的化合物被破坏。
4. 测定含酸量。
取50ml的水果汁,加入适量的酸性指示剂,使其变红,再逐滴加入0.1mol/L的NaOH溶液,慢慢搅拌,观察溶液颜色。
当溶液由红色变为粉红色时,记录NaOH溶液的体积,即可计算出水果汁中的酸含量。
5. 重复上述步骤,对其他水果和蔬菜样品进行测定,得出它们的酸含量。
注意每次测定后必须冲洗装置。
实验结果与分析:1.测定出的含酸量数据应该写在实验报告的表格中。
2.分析不同水果和蔬菜中酸的含量的结果,可以发现不同种类的水果和蔬菜之间存在很大的差异。
例如,草莓和柠檬中的含酸量高于西瓜和甜菜的含酸量。
实验注意事项:1. 操作时要注意安全,避免NaOH的直接接触皮肤和眼睛,注意氢氧化物的腐蚀性。
2.实验操作应该认真仔细,记录每次试验的体积。
水果中总酸度的测定ppt课件

-0.0001000
陈佳佳
测定次数 倾出前WKHC8H4O4(g) 倾出后WKHC8H4O4(g) NaOH 标 mKHC8H4O4质量(g) 准 消耗NaOH的体积V(ml) 溶 CNaOHmol/L 液 的 CNaOHmol/L 标 绝对偏差di 定 绝对平均偏差d 相对平均偏差Rd(%)
Ⅰ
26.3117 25.8886 0.4231 19.21
Ⅱ
25.8886 25.4653 0.4233 19.12
Ⅲ
25.4653 25.0418 0.4235 19.28
0.1080
0.1085
0.1081
0.1077
-0.0001000
0.0004000
0.0003000 0.28%
-0.0004000
蓝丽君
第一次数据 CNaOHmol/L CNaOHmol/L 0.1065
四、实验步骤:
1、0.1000mol/LNaOH标准溶液的标定:(陈佳佳
蓝丽君)
0.1000mol/lNaoH标准溶液已经配制好,待标定。 用减量法准确称取0.4—0.45g邻苯二甲酸氢钾三份,分别 放入250ml锥形瓶中,加25ml无CO2的蒸馏水溶解。 然后加1—2d 酚酞指示剂,用NaOH溶液滴定至终点(至粉 红色,并保持30s不褪色为终点)。 记录每次消耗NaOH溶液的体积。
根据酸碱中和原理,用碱标准溶液滴定试样液中的 酸时,以酚酞为指示剂。 当滴定至终点溶液呈浅红 色,30s不褪色时,根据滴定时消耗的标准碱溶液的 体积,可算出试样中的总酸度。其反应如下:
HAc+NaOH →NaAc+H2O
三、实训所需仪器、试剂:
试剂:0.1000mol/LNaOH标准溶液、邻苯二甲酸氢 钾、酚酞指示剂、无CO2的蒸馏水、水果试样(桃 子)、 仪器:洗耳球、玻璃棒、量筒、移液管、电子天平、 水浴锅、锥形瓶、容量瓶、酸碱滴定管、烧杯、小 纸片、胶头滴管、干燥的纱布、铁架台
果汁的实验报告

一、实验目的1. 掌握果汁中总酸度及有效酸度的测定方法。
2. 了解果汁中酸度对口感、保存期等的影响。
3. 培养实验操作技能,提高分析能力。
二、实验原理1. 总酸度:果汁中的总酸度是指所有酸性物质的总量,通常以克当量(g当量)表示。
测定总酸度采用酸碱滴定法,即用标准碱液滴定果汁中的酸性物质,根据消耗的标准碱液的量计算出果汁中的总酸度。
2. 有效酸度:果汁中的有效酸度是指果汁在口感上能感知到的酸度,通常以pH值表示。
测定有效酸度采用pH计法,即用pH计直接测定果汁的pH值。
三、实验仪器与试剂1. 仪器:酸度计、滴定管、锥形瓶、移液管、pH计、电子天平、烧杯、玻璃棒等。
2. 试剂:0.1mol/L NaOH标准溶液、1%酚酞指示剂、邻苯二甲酸氢钾标准物质、果汁样品、蒸馏水等。
四、实验步骤1. 果汁总酸度的测定(1)准确量取果汁样品10.0mL,置于锥形瓶中。
(2)加入2~3滴酚酞指示剂。
(3)用0.1mol/L NaOH标准溶液滴定,直至溶液颜色由无色变为浅红色,且半分钟不褪色。
(4)记录消耗的标准碱液体积。
2. 果汁有效酸度的测定(1)将果汁样品用蒸馏水稀释至一定倍数。
(2)用pH计测定稀释后果汁的pH值。
五、实验数据记录与处理1. 果汁总酸度测定数据记录样品名称:________________________消耗NaOH标准溶液体积:________________________mLNaOH标准溶液浓度:0.1mol/L总酸度:________________________g当量/100mL2. 果汁有效酸度测定数据记录样品名称:________________________pH值:________________________六、实验结果与分析1. 果汁总酸度分析根据实验数据,计算出果汁的总酸度。
总酸度越高,说明果汁中的酸性物质含量越高,口感越酸。
2. 果汁有效酸度分析根据实验数据,计算出果汁的有效酸度。
(完整word版)果汁饮料中总酸、PH值测定及可溶性固形物含量的测定(60分)
(三)滴定操作
20分
正确、熟练(18—-20分)
基本正确、较熟练(11--17分)
不熟练、终点控制差(10分以下)
二、实验数据
(一)数据处理
8分
有效数字正确、记录清楚(7——8分)
有效数字不正确、错一处扣1分
(二)结果
12分
结果误差<2%(12分)
结果误差2—5%(6-—11分)
结果误差>5%(6分以下)
三、要求:
1、样品测定平行做3份并计算结果
2、完成时间:2小时以内
四、评分记录表
考核要素
评分要素
配分
评分标准
扣分
得分
一、基本操作
(一)移液管使用
10分
正确、熟练、规范(9—10分)
基本正确、较熟练(6—8分)
不熟练、明显不规范(5分以下)
(二)容量瓶使用
10分
正确、熟练(9—10分)
基本正确、较熟练(6—8分)酱油中氨基酸态氮含量的测来自(60分)一、材料准备:
1、酱油一份
2、0.05mol/LNaOH标准液、360g/L甲醛溶液
二、设备、器具准备
1、1个滴定工作台,10ml微量滴定管1支、250ml锥形杯3只、磁力搅拌器
2、酸度计一台、200ml烧杯2只、100ml容量瓶1个、20ml移液管1个、5mL吸量管1根、10ml量筒一只、洗瓶1个
实验六 水果中总酸及pH的测定

实验六水果中总酸及pH的测定实验六水果中总酸及ph的测定实验六水果中总酸和pH值的测定一、目的要求1.更加熟悉和规范滴定操作。
2.学习及了解碱滴定法测定总酸及有效酸度的原理及操作要点。
3.掌握水果中总酸度及有效酸度的测定方法和操作技能。
4.掌握ph计的维护和使用方法。
二、实验原理1.总酸测定原理当用标准碱液滴定时,水果中的有机酸被中和成盐。
以酚酞为指示剂滴定,直至溶液变红,30s不褪色为终点。
根据消耗标准碱液的浓度和体积,计算水果中总酸的含量。
2.有效酸测定原理用PH计测量水果的有效酸度(PH)是将玻璃电极和饱和甘汞电极插入挤压果汁中,形成一个主电池。
电池的电动势与果汁的pH值有关。
也就是说,在25℃下,每个pH单位差将产生59.1mv的电池电动势。
电池电动势由酸度计测量,并直接以pH值表示,因此可以直接从酸度计中读取果汁的pH值。
3、仪器和试剂1仪器水浴锅,酸度计,玻璃电极,饱和甘汞电极,现在多用复合电极。
2.试剂0.1mol/lnaoh标准溶液,酚酞乙醇溶液,pH=4.01标准缓冲溶液。
4、实验步骤1总酸度的测定(1)样液制备将样品用组织捣碎机捣碎并混合均匀。
称取适量样品,用15ml无co2蒸馏水将其移入250ml容量瓶中,在75~80℃水浴上加热0.5h,冷却后定容,用干滤纸过滤,弃去初始滤液25ml,收集滤液备用。
(2)准确吸取上述制备的滤液50ml,加入3~4滴酚酞指示剂,用0.1mol/lnaoh标准溶液滴定至微红不褪色30s。
记录消耗的NaOH标准溶液的体积。
2.水果中有效酸度(PH)的测定(1)样品处理将水果样品榨汁后,取汁液直接进行ph测定。
(2)酸度计的校正① 打开pH计电源,预热30分钟,连接玻璃和甘汞电极,并将读数开关降至零。
②测量标准缓冲溶液的温度,调整pH计的温度补偿旋钮。
③将二电极浸入缓冲溶液中,按下读数开关,调节定位旋钮使ph计指针在缓冲溶液的ph上,放开读书开关,指针回零,如此重复操作二次。
水果中总酸度的测定

倾出后WKHC8H4O4(g)
2、总酸度的测定: P=C· · · · V2 K F 1000/m C---NaOH标准溶液的浓度 F---试样的稀释倍 V2---消耗NaOH的体积
m---试样质量或体积 k---换算为主要酸的系数
水果稀释液的体积
水 果 总 酸 度 测 定
20.00
2、试样处理: 取水果试样,需去皮、去柄、去核,切成 块状,置于搅拌机中捣碎并混匀。 准确称取适量样品,加100ml蒸馏水,稀释 定容为250ml溶液。 然后倒入到烧杯中在75 ~80℃的水浴上加 热30分钟。冷却后过滤,滤液倒入容量瓶 中备用。
3、滴定:
准确吸取20ml滤液于锥形瓶中,加 20ml水溶解。 加2滴酚酞指示剂,用NaOH标准溶液 滴定,至微红色30s不褪色。 记录NaOH消耗量V2,平行3次。
水果中总酸度的测定
一、实验目的:
1、学会水果样品的预处理方法。
2、掌握用酸碱滴定法测定水果样品中总酸度的原理 和方法。
3、学会合理制定分析项目的顺序,做到合理安排分 析时间,合理处理样品。 4、能熟练制备实训过程中所需要的标准溶液。 5、能规范记录数据并进行数据处理。
二、实训原理:
根据酸碱中和原理,用碱标准溶液滴定试样液中的 酸时,以酚酞为指示剂。当滴定至终点溶液呈浅红 色,30s不褪色时,根据滴定时消耗的标准碱溶液 的体积,可算出试样中的总酸度。其反应如下: RCOOH+NaOH →RCOON体积 V(ml) P(g/L) P(g/L) 绝对偏差di 绝对平均偏差d
相对平均偏差Rd (%)
三、实训所需仪器、试剂:
0.1000mol/LNaOH标准溶液、邻苯二甲酸氢钾、 酚酞指示剂、酸碱滴定管、水浴锅、水果试样。
水果蔬菜中总酸的测定

实验水果、蔬菜中总酸的测定(学号:030212011031,030212011026 李欣钰和郎琳)【实验目的】1、利用标准液滴定水果蔬菜,测定不同水果蔬菜中总酸度2、练习利用滴定管滴定溶液3、练习移液管的使用4、练习pH计的使用【实验原理】1、水果和蔬菜中含有各种不同的有机酸,主要为苹果酸,柠檬酸,酒石酸,草酸等。
果树的种类不同,含有机酸的种类和数量也不同。
果汁或菜汁的酸性取决于游离态的酸或酸式盐的存在数量。
这些算都是有机弱酸,所以在测定时,有氢氧化钠标准溶液滴定就能测出酸度。
这样测得的数据是总酸度,包含了未离解酸和已离解酸的浓度。
用下式计算:总酸度(%)=(V样/W样)x(V NaOH xc NaOH x折算系数/V取样)x100式子中V样为样品稀释总体积;V取样为滴定时取样体积;W样为样品的质量。
折算系数为不同有机酸的毫摩尔质量2、食品中的总算度往往根据算韩算的不同,而取其中某种主要有机酸计量。
食品中常见的有机酸及其毫摩尔质量折算系数如下苹果酸——0.067(苹果,梨,西红柿)酒石酸——0.075(葡萄)柠檬酸——0.090(柑橘类)【仪器试剂】烧杯(100ml)(3-5只),洗耳球,移液管(25ml),容量瓶(250ml)(3只),滤纸,铁架台,滴定管夹,碱式滴定管,玻璃棒,胶头滴管,电子天平,研钵,酚酞指示剂,NaOH标准溶液(约为0.2mol/l),西红柿,葡萄,橘子(自备),塑料袋若干(自备),小刀(自备)【实验内容】1.准确称取混合均匀磨碎的样品10g2.转移到250ml容量瓶中,加纯水至刻度线,摇匀3.吸取50ml溶液于锥形瓶中,加入两滴酚酞试剂4.用NaOH标准溶液滴定溶液至淡红色,并且在30s内不退色,即到达终点。
5.记下所用的NaOH体积。
重复测定三次取平均值。
6.利用同样的方法测定剩余的两种水果或蔬菜。
并记录实验数据7.用pH计测出样品稀释液的pH8.处理实验数据,比较所测的西红柿,葡萄,橘子的总酸度的不同实验数据处理表。
最新果汁饮料中总酸及pH的测定

(3)结果计算
公式中:
X----挥发酸含量(以醋酸计),g/100g(或g/100mL)
X(V1V2)m c0.06100VVm12--------------样样空品液白质滴滴量定定或消消体耗耗积标标,准准gNN或aamOOHHL;的 的体 体积 积,,mmLL;;
c----- 标准NaOH溶液的浓度,mol/L;
直接法:是通过水蒸气蒸馏或溶剂萃取把挥发酸分离出 来,然后用标准碱滴定。
间接法:是将挥发酸蒸发排除后,用标准碱滴定不挥发 酸,最后从总酸度中减去不挥发酸即为挥发酸含量。
直接法操作方便,较常用,适用于挥发酸含量较高的 样品。若蒸馏液有所损失或被污染,或样品挥发酸含量较 少,宜用间接法。
食品安全检验技术(理化部分)果汁饮料中总酸及pH的测定
电位法适用于各类饮料、果蔬及其制品,以及肉、蛋 类食品中pH值的测定。测定值可准确到0.01pH单位。故有 准确度高、操作简便、不受试样本身颜色的影响等优点, 在食品检验中得到广泛的应用。 (1)原理 以玻璃电极为指示电极,饱和甘汞电极为参比 电极,插入待测样液中组成原电池,该电池电动势大小与 溶液pH值有直线关系: E=E0-0.0591pH(250C)。即在250C 时,每相差一个pH值单位就产生59.1mV的电池电动势,利 用酸度计测量电池电动势并直接以pH表示,故可从酸度计 上读出样品溶液的pH值。
酚酞指示剂3~4滴,用0.1mol/LNaOH标准溶液滴定至微红色 30秒不褪,记录消耗0.1mol/LNaOH标准溶液的体积(mL)。
食品安全检验技术(理化部分)果汁饮料中总酸及pH的测定
③结果计算 :
式中:
X cVKV0 100 m V1
X----总酸度,g/100g(或g/100mL)
苹果中总酸的测定

苹果中总酸的测定
实验原理:苹果中的有机酸,用酸碱滴定,被中和生成盐类。
RCOOH+NaOH==RCOONa+H2
一、试剂:1、氢氧化钠标准溶液的配制与标定
在粗天平上称取固体氢氧化钠1克,加蒸馏水溶解并稀释至250毫升,摇匀,备用。
在分析天平上准确与105-110℃至恒重的邻苯二甲酸氢钾0.3-0.5克于250毫升的锥形瓶中,加蒸馏水100毫升溶解,加两滴酚酞指示剂,用配用的氢氧化钠标准溶液滴定至溶液呈微红色,同时做空白试验。
C(NaOH)=m/【(V-V o)*0.2042】
式中;C(NaOH)---氢氧化钠标准溶液的物质的量浓度,mol/L V o---空白试验氢氧化钠标准溶液的用量,ml
M---邻苯二甲酸氢钾的质量,g
0.2042---邻苯二甲酸氢钾的摩尔质量,Kg/mol
2、酚酞指示剂(10g/L)
二、测定方法:
将苹果洗净,取可使用部分切碎,加等量水打碎,与粗天平上称取50g,移入250毫升容量瓶中,约2/3的蒸馏水,摇匀,与75-80℃水浴中浸提30分钟,冷却至室温加水定容到刻度,摇匀,过滤。
用吸管吸取滤液50毫升于250毫升锥形瓶中加2滴酚酞指示剂,用氢氧化钠标准溶液滴定至溶液呈微红色。
三、计算:
总酸(以苹果酸计)%=C*V*0.067*20
式中:C--氢氧化钠标准溶液的物质的量浓度,mol/L
V---氢氧化钠标准溶液的用量,ml
0.067---苹果酸的系数。
四、说明:
1、平行试验结果容许差为0.5%
2、酸度包括总酸(可滴定酸度),有效酸(氢离子活度,即PH值)和挥发酸。
总酸是指所有酸性成分的总量,通常用碱液来滴定,并以样品中所含主要酸的百分数表示。
测定水果ph 实验报告

测定水果ph 实验报告一、引言pH是指溶液中酸碱性的度量,它是一个表示酸碱程度的指标。
在食品科学和营养学中,测定水果的pH对于评估其质量和品质具有重要意义。
水果的pH值不仅可以影响水果的新鲜度和口感,还可以作为判断水果是否合适保存和加工的依据。
因此,本实验旨在使用pH计来测定不同水果的pH值,以评估它们的酸碱程度。
二、实验目的1. 了解pH的概念和测定方法;2. 掌握使用pH计测定水果pH的操作技巧;3. 比较不同水果的酸碱程度,并分析其相关性。
三、实验仪器与试剂1. 实验仪器- pH计:用于测定溶液的pH值;- 电极盖:用于保护pH电极,避免损坏。
2. 实验试剂- 不同种类的水果:例如橙子、苹果、草莓等;- 蒸馏水:用于稀释和清洗。
四、实验步骤1. 样品准备1. 将不同种类的水果洗净;2. 将每种水果分别切成适量的块状。
2. pH测定1. 将pH计的电极盖取下,插入pH计的电极接口;2. 打开pH计电源,进入标定模式,并使用蒸馏水进行电极的标定;3. 将pH计的电极放入洗净的蒸馏水中,等待pH计稳定后记录标定值;4. 取一块水果样品,用蒸馏水冲洗,确保无残留物;5. 用刀将水果样品捣碎,使其释放出汁液;6. 将电极浸入水果汁液中,等待pH计稳定并记录测定值;7. 重复上述步骤,测定其他水果样品的pH值。
五、实验数据与结果1. 实验数据以下是使用pH计测定不同水果pH的实验数据:水果pH值-橙子 3.2苹果 3.5草莓 3.0蓝莓 2.8香蕉 5.5西瓜 6.02. 结果分析根据实验数据,我们可以得到如下结论:1. 橙子、苹果、草莓和蓝莓都属于酸性水果,其pH值均在3.0到3.5之间;2. 香蕉和西瓜属于中性水果,其pH值分别为5.5和6.0;3. 水果的pH值与其酸碱程度相关,pH值越低表示越酸,pH值越高则越碱性;4. 水果的pH值与其品种和成熟度有关,不同品种和成熟度的水果可能具有不同的pH值。
实验六果蔬中含酸量的测定

实验六果蔬中含酸量的测定(中和法)一、目的及原理果蔬中含有各种有机酸,主要有苹果酸、柠檬酸、酒石酸等。
由于果蔬种类不同,含有机酸的种类也不同;同一果蔬品种,其成熟度不同,有机酸的含量也有很大差异。
果蔬中含酸量的多少亦是衡量其品质优劣的一个重要指标,它与新鲜果蔬及加工处理后成品的风味关系密切。
因此,了解其含量对鉴定果蔬品质及进行合理加工有重要作用.通过实验,使学生了解果蔬总酸量测定的原理,学会并掌握果蔬含酸量测定的方法。
果蔬含酸量的测定是根据酸碱中和的原理,即用已知浓度的氢氧化钠溶液滴定,并根据碱溶液用量,计算出样品的含酸量。
所测出的酸又称总酸度或可滴定酸。
还有少量的酸,由于受果蔬中缓冲物质的影响,不易测出.计算时以该果实所含的主要酸来表示,如仁果类、核果类主要含苹果酸,以苹果酸计算,其毫摩尔质量为0.067g;柑桔类以柠檬酸计算,其毫摩尔量为0。
064g;葡萄以酒石酸计算,其毫摩尔量为0.075g;蔬菜中主要含草酸,其毫摩尔量为0。
045g.二、药品与器材桃、杏、葡萄、番茄、莴苣等;0。
1N氢氧化钠、1%酚酞指示剂;50ml或10ml滴定管、200ml容量瓶、20ml移液管、100ml烧杯、研钵、分析天平、漏斗、棉花或滤纸、小刀、白瓷板、滴定管。
三、操作与步骤称取均匀样品20g,置研钵中研碎,注入200mL容量瓶中,加蒸馏水至刻度。
混合均匀后,用棉花或滤纸过滤到干燥的250 ml烧杯中.吸取滤液20ml放入100mL烧杯中,加酚酞指示剂2滴,用0.1N NaOH滴定,直至成淡红色为止。
记下NaOH液用量。
重复滴定三次,取其平均值。
某些果蔬容易榨汁,而其汁液含酸量能代表果蔬含酸量,可以榨汁,取定量汁液(10ml)稀释后(加蒸馏水至20ml),直接用0.1N NaOH液滴定。
计算:V xCx折算系数 B果蔬含酸量%= ――――――― x ― x100b AV = NaOH液用量(毫升)C = NaOH液当量浓度(mol/L)A = 样品克数B = 样品液制成的总毫升数b = 滴定时用的样品液毫升数折算系数 = 以果蔬主要含酸种类计算,一般苹果为0.067,柑橘为0。
果汁总酸与PH的测定报告

项目 样品V/ml
NAOH消耗量 V/ml 空白消耗NAOH 的量V/ml
1
2
3 25
4
5
6
9.18
9.19
9.19
9.19 0.02
9.19
9.18
2.计算公式
x--总酸含量(以柠檬酸计),g/100ml; C--NaOH标准溶液的浓度,mol/L; V--NaOH标准溶液的用量,ml; 0.064 --换算成柠檬酸的系数,1 mol/LNaOH 相当于柠檬酸的质量,g; 25--样品制备液取用量,ml。
7.果汁饮料中有效酸度(pH)的测定 (刘海妍)
(1)酸度计的校正 ① 开启酸度计电源,预热30min,连接玻璃电极及甘汞电极 ,在读数开关放开的情况下调零。 ② 测量标准缓冲溶液的温度,调节酸度计温度补偿旋钮。 ③ 将两电极浸入缓冲液中,按下读数开关,调节定位旋钮, 使pH计指针在缓冲液的pH上,放开读数开关,指针回零, 重复操作2次。 (2)果汁饮料pH的测定(0.01pH单位) ① 用无CO2的蒸馏水淋洗电极,并用滤纸吸干,再用制备好 的果汁饮料冲洗2电极,浸入样液。 ② 根据果汁饮料温度调节酸度计温度补偿旋钮,将两电极插 入果汁中,按下读数开关,稳定1min,酸度计指针所指pH即 为果汁饮料的pH。 测量完毕后,将电极和烧杯清洗干净,并妥善保管。
1,查看相关国标;全体成员 2,实验数据分析与评估;全体成员 3,制作报告PPT;全体成员
一.实验目的与要求
(1) 进一步熟悉及规范滴定操作。 (2) 学习及了解碱滴定法测定总酸及有效 酸度的原理及操作要点。 (3) 掌握果汁饮料总酸度及有效酸度的测 定方法和操作技能。 (4) 学会使用pH计。
二.实验原理
;
果汁饮料中总酸度的测定实验报告

果汁饮料中总酸度的测定实验报告果汁饮料总酸度的测定果汁饮料总酸度的测定一实验内容用碱滴定法测定果汁饮料的总酸度二实验目的1 正确理解总酸度的概念2 掌握总酸度测定的原理和方法三实验原理食品中的总酸度是指所有酸性物质总量,用标准碱滴定时,被中和成盐类.RCOOH+NaOH——RCOONa+H2O以酚酞为指示剂,滴定至溶液呈淡红色半分钟不褪为终点.根据所耗标准碱液的浓度和体积,可计算出样品中酸的含量.四仪器及试剂1 仪器⑴碱式滴定管⑵250mL锥形瓶⑶25mL移液管2 试剂⑴1% 酚酞乙醇溶液称取1g酚酞,用9 5%乙醇溶解并定容到100mL.⑵0.1mol/L NaOH标准溶液称取4g NaOH,加水约100mL,溶解后移入1000mL容量瓶中,用蒸馏水定容到刻度,贮存于橡胶塞试剂瓶中.标定方法:将邻苯二甲酸氢钾于1 2 0℃烘1小时至恒重,准确称取0.3~0.4g于250mL锥形瓶中加入100mL蒸馏水,溶解后滴定3滴酚酞指示剂,用以上配好的氢氧化钠溶液滴定至微红色半分钟不褪色为终点.按下式计算氢氧化钠标准溶液的摩尔浓度.式中: m——邻苯二甲酸氢钾的质量,g;V——滴定时耗用氢氧化钠溶液的体积,mL;0.2042——邻苯二甲酸氢钾的毫摩尔当量,mmol/L.五实验步骤准确吸取25mL饮料于250mL锥形瓶中加入25mL蒸馏水,加酚酞3~5滴用氢氧化钠标准溶液滴定至微红色半分钟不褪为终点再重复测定2次.六结果计算N一一NaOH标准溶液的mol/L浓度V ——滴定时耗用NaOH标准溶液的量,mL;K ——换算为柠檬酸的换算系数:K=0.064七说明1 碳酸饮料需先在5 0℃水浴上加热3 0分钟以上除去CO2,冷却至室温后测定.2 如饮料颜色较深,可加入等量蒸馏水稀释后在滴定.终点不易辨认时可用原试样溶液作对比判断终点.3 所用蒸馏水应是新煮沸并冷却的蒸馏水以除去CO2.篇二:果汁饮料中总酸及pH的测定实验果汁饮料中总酸及pH的测定一、实验内容(1) 用碱滴定法测定果汁饮料的总酸度。
用身边的水果确定常见水果酸碱性的实验
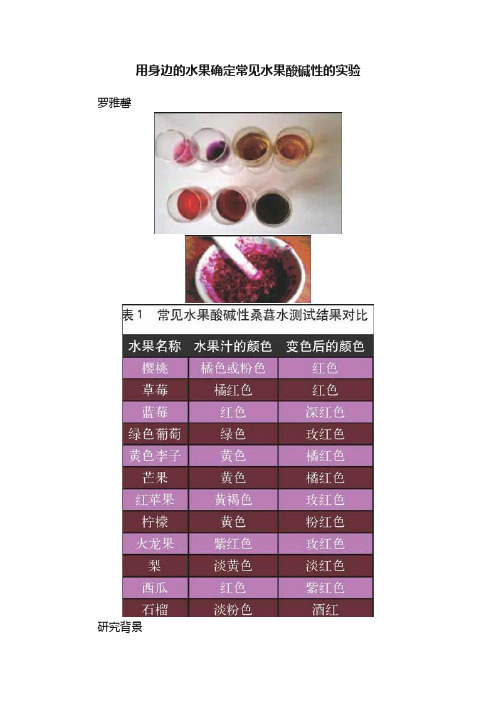
用身边的水果确定常见水果酸碱性的实验罗雅馨研究背景现在人们越来越注重饮食的健康,常说要健康就要饮用碱性水,多吃碱性食品,多喝梓檬水。
但是,很多人并不清楚食物的酸碱性,有些人对食物的酸碱性认识错误,还盲目跟从市场上一些宣传,乱吃食物或片面追求吃某些食物。
其实,我们吃进去的每种食物,都不仅提供能量和营养,同时也会产生很多酸性物质或碱性物质。
如果片面追求碱性食品或酸性食品,人体的各种代谢就可能发生紊乱。
酸性物质如果在我们体内积累过多,就会不断堆积,甚至让人生病。
据统计,85%的痛风、髙血压、癌症、髙血脂症患者,都属于酸性体质者。
健康人血液呈弱碱性,pH值大约在7.35?7.45。
大家都知道用试纸或pH 值计可以测定食物的酸碱性,但还没有见到采用简单、易取、环保的桑葚水测定水果酸碱性的报道。
人们经常要吃水果,那么有没有方法,可以让不了解化学用品或不接触化学的人,也能便捷地测定出水果的酸碱性呢?本项目利用水果中的桑葚榨汁对市场上常见的水果进行酸碱性的实验测定,方法简单快捷。
实验原理桑葚、黑枸杞中含有花青素。
花青素遇酸性物质会变成红色,遇碱性物质则变成绿色。
花青素是一种水溶性色素,属类黄酮化合物,分子式为C15H11〇6。
实验原料、工具与试剂:樱桃、草莓、西瓜等市场上能购买到的水果;桑葚、黑枸杞;玻璃杯、研钵、滤纸、漏斗、pH值试纸;食用白醋、氢氧化钠。
选择桑葚的理由及实验许多水果中都含有花青素。
我从市场上购买了紫葡萄、桑葚、蓝莓和黑枸杞(干)分别榨汁、浸泡,取对应的溶液进行了实验。
实验结果说明,紫葡萄的榨取液对酸碱变色不敏感;蓝莓虽然花青素含量高,但由于本身呈酸性,且价格昂贵,不适宜普通百姓选用。
黑枸杞的浸泡液与碱反应先变成绿色,后变成黄色,变色不稳定,见图1。
因为桑葚既便宜,且花青素含量还很髙,其本身还是中性水果,而且变色也比较稳定,所以我选用桑葚做水果酸碱性实验。
实验步骤将4?5颗桑葚放入研钵中研碎(见图2),将研磨后的桑葚汁转移到玻璃容器中并加入300毫升水过滤,得到紫色的桑葚水。
果汁饮料中总酸及pH的测定

(3)结果计算
公式中:
X----挥发酸含量(以醋酸计),g/100g(或g/100mL)
X(V1V2)m c0.06100VVm12--------------样样空品液白质滴滴量定定或消消体耗耗积标标,准准gNN或aamOOHHL;的 的体 体积 积,,mmLL;;
c----- 标准NaOH溶液的浓度,mol/L;
RCOOH+NaOH RCOONa + H2O
(2)操作方法
①样品处理: 包括固体样品、干鲜果蔬、蜜饯及罐头样品;含CO2的饮料、 酒类;调味品及不含CO2的 饮料、酒类;咖啡样品;固体饮 料。
②滴定: 准确吸取上法制备好的滤液50mL于250mL锥形瓶中,加
酚酞指示剂3~4滴,用0.1mol/LNaOH标准溶液滴定至微红色 30秒不褪,记录消耗0.1mol/LNaOH标准溶液的体积(mL)。
肉类制品:称取10克已除去油脂并捣碎的样品于250mL锥形 瓶中,加入100mL无CO2蒸馏水,浸泡15分钟并随时摇动,过 滤后取滤液测定。
罐头制品(液固混合样品):先将样品沥汁液 ,取浆汁液测 定;或将液固混合捣碎成浆状后,取浆状物测定。若有油脂, 则应先分离出油脂。
含CO2的液体样品(如碳酸饮料、啤酒等):同“总酸度测 定”方法排除CO2后再测定。
(2)仪器 酸度计,也称pH计,它是由电计和电极两部分组成。 电极与被测液组成工作电池,电池的电动势用电计测量。常见 的酸度计如pHS—25型酸度计。
(3)食品pH的测定
①样品处理:
果蔬样品:将果蔬样品榨汁后,取其汁液直接进行pH测定, 对于果蔬干制品,可取适量样品,并加数倍的无CO2蒸馏水, 于水浴上加热30分钟,再捣碎、过滤取滤液测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验六水果中总酸及pH的测定
一、目的要求?
1.?进一步熟悉及规范滴定操作。
?
2.?学习及了解碱滴定法测定总酸及有效酸度的原理及操作要点。
?
3.?掌握水果中总酸度及有效酸度的测定方法和操作技能。
?
4.?掌握pH计的维护和使用方法。
二、实验原理?
1.?总酸测定原理
水果中的有机酸在用标准碱液滴定时,被中和成盐类。
以酚酞为指示剂,滴定至溶液呈现微红色,?
30s不褪色为终点。
根据消耗标准碱液的浓度和体积,计算水果中总酸的含量。
?
2.?有效酸测定原理
利用pH计测定水果中的有效酸度?(pH),是将玻璃电极、饱和甘汞电极插入榨取的果汁中组成原电池,该电池电动势的大小与果汁pH有关。
即在25℃时,每相差一个pH单位就产生的电池电动势,利用酸度计测量电池电动势并直接以pH表示,故可从酸度计上直接读出果汁的pH。
三、仪器与试剂?
1.?仪器
水浴锅,酸度计,玻璃电极,饱和甘汞电极,现在多用复合电极。
?
2.?试剂?
?/?L?NaOH标准溶液,酚酞乙醇溶液,pH=?标准缓冲溶液。
四、实验步骤?
1.?总酸度的测定?
(1)?样液制备将样品用组织捣碎机捣碎并混合均匀。
称取适量样品,用15mL无CO2?蒸馏水将其移入250mL容量瓶中,在75~80℃水浴上加热,冷却后定容,用干滤纸过滤,弃去初始滤液25mL,收集滤液备用。
?
(2)?滴定准确吸取上述制备滤液50mL加入酚酞指示剂3~4滴,用/LNaOH标准溶液滴定至微红色30s不褪为终点。
记录消耗NaOH标准溶液的体积。
?
2.?水果中有效酸度?(pH)?的测定?
(1)?样品处理将水果样品榨汁后,取汁液直接进行pH测定。
?
(2)?酸度计的校正
①开启酸度计电源,预热30min,连接玻璃及甘汞电极,在读数开关放开的情况下调零。
②测量标准缓冲溶液的温度,调节酸度计温度补偿旋钮。
③ 将二电极浸入缓冲溶液中,按下读数开关,调节定位旋钮使pH 计指针在缓冲溶液的pH 上,放开读书开关,指针回零,如此重复操作二次。
?
(3)?果汁pH 的测定
① 用无CO2蒸馏水淋洗电极,并用滤纸吸干,再用制备好的果汁冲洗电极。
② 根据果汁温度调节酸度计温度补偿旋钮,将两电极插入果汁中,按下读数开关,稳定?1min ,酸度计指针所指pH 即为果汁的pH 。
五、结果处理?
2.?计算结果?
式中:?X —总酸含量?(以某酸计),g /100 g 或?g?/?mL ;?
c —NaOH 标准溶液的浓度,mol ?/?L ;?
V —氢氧化钠标准溶液的用量,mL ;?
V 0—样品稀释液总体积,mL ;?
V 1—滴定时吸取的样液体积,mL ;?
K —换算成为主要酸的系数,即1mmol 氢氧化钠相当于主要酸的质量,g ;?
m —样品的质量,g 或mL 。
1001
0⨯⨯⨯⨯=V V m K V c X。
