原电池、电解原理及其应用专讲义题8.ppt
合集下载
原电池与电解复习ppt
3、2NH4HSO4 + 2NaOH == (NH4)2SO4 + Na2SO4+ 2H2O 为什么?
原电池反应的基础是氧化还原反应,故从理论上说任何一个自 发进行的氧化还原反应因都会有电子转移的存在,都可能成为 原电池反应
双液原电池
(1)盐桥? (2)作用? 导线的作用是传递电子, 沟通外电路。 盐桥的作用:1.连接内电 路,形成闭合回路 2.平 衡电荷,使原电池不断产 生电流
第三步:根据电池总反应式和正极反应式写出电池的负极反应式 电池的总反应和正、负极反应之间有如下关系:电池的总反应式=电池正极反应式+ 电池负极反应式故根据第一、二步写出的反应,有:电池的总反应式-电池正极反应 式=电池负极反应式,注意在将两个反应式相减时,要约去正极的反应物O2。
银锌电池(电解质为KOH)
_正__(A__g_)__电极。
原电池的设计
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设 计一个单液原电池,一个双液原电池画出原电
池的示意图,并写出电极反应。
参
(-)
Zn
盐桥
C (+)
FeCl3 溶液
ZnCl2溶液
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
虑氢、氧的氧化还原):
(1)放电时电解液中 H2SO4 的浓度将变_____小_________;
当外电路通过 1 mol 电子时,理论上负极板的质量增加
____4__8__g。
(2)在完全放电耗尽 PbO2 和 Pb 时,若按右图连接,电解
一段时间后,则在 A 电极上生成___P__b___,B 电极上生 成对___P_换_b__O__2___,此时铅蓄电池的正负极的极性将
原电池反应的基础是氧化还原反应,故从理论上说任何一个自 发进行的氧化还原反应因都会有电子转移的存在,都可能成为 原电池反应
双液原电池
(1)盐桥? (2)作用? 导线的作用是传递电子, 沟通外电路。 盐桥的作用:1.连接内电 路,形成闭合回路 2.平 衡电荷,使原电池不断产 生电流
第三步:根据电池总反应式和正极反应式写出电池的负极反应式 电池的总反应和正、负极反应之间有如下关系:电池的总反应式=电池正极反应式+ 电池负极反应式故根据第一、二步写出的反应,有:电池的总反应式-电池正极反应 式=电池负极反应式,注意在将两个反应式相减时,要约去正极的反应物O2。
银锌电池(电解质为KOH)
_正__(A__g_)__电极。
原电池的设计
利用反应Zn+2FeCl3=2FeCl2+ZnCl2 ,设 计一个单液原电池,一个双液原电池画出原电
池的示意图,并写出电极反应。
参
(-)
Zn
盐桥
C (+)
FeCl3 溶液
ZnCl2溶液
FeCl3溶液
负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Pt或C):2Fe3++2e-=2Fe2+(还原反应)
虑氢、氧的氧化还原):
(1)放电时电解液中 H2SO4 的浓度将变_____小_________;
当外电路通过 1 mol 电子时,理论上负极板的质量增加
____4__8__g。
(2)在完全放电耗尽 PbO2 和 Pb 时,若按右图连接,电解
一段时间后,则在 A 电极上生成___P__b___,B 电极上生 成对___P_换_b__O__2___,此时铅蓄电池的正负极的极性将
化学课件《电解原理及应用》优秀ppt 人教版

85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
《原电池与电解池》课件

02
电解池基本概念
电解池定义
总结词
电解池是一种通过外加电流使电解质 溶液中的阴阳离子发生定向移动,从 而在电极上发生氧化还原反应的装置 。
详细描述
电解池由电源、电极和电解质溶液组 成。当电源通电后,阳离子向阴极移 动,阴离子向阳极移动,在电极上发 生氧化还原反应,生成相应的产物。
电解池工作原理
C. 阳极材料得电子 简答题:写出电解池的电极反应式,并解释其原理。
THANKS
感谢您的观看
《原电池与电解池》 ppt课件
目录
CONTENTS
• 原电池基本概念 • 电解池基本概念 • 原电池与电解池的区别与联系 • 原电池的应用 • 电解池的应用 • 习题与思考
01
原电池基本概念
原电池定义
总结词
原电池是一种将化学能转化为电 能的装置。
详细描述
原电池由两个电极(正极和负极 )和电解质溶液组成。在原电池 中,化学反应在电极之间产生电 位差,从而产生电流。
电解池的组成
总结词
电解池的组成包括电源、电极和电解质溶液。电极分为阴阳两极,电解质溶液中包含阴 阳离子。
详细描述
电解池的核心部分是电极和电解质溶液。电极分为阳极和阴极,通常由惰性材料制成, 如石墨或金属铂。电解质溶液包含阴阳离子,这些离子在通电后发生定向移动并在电极 上发生氧化还原反应。此外,还需要一个外部电源提供直流电,以驱动电解池的正常工
电解法制备物质是一种通过电解反应合成新物质的化学 过程。在电解过程中,电流通过电解质溶液,在电极上 发生氧化还原反应,生成所需的物质。这种方法可以用 于制备金属单质、无机非金属材料、有机化合物等,广 泛应用于化学工业和实验室研究。
06
原电池的工作原理PPT课件

答案 B
第28页/共33页
【课后作业】把a、b、c、d四块金属片浸
入稀硫酸中,用导线两两相连组成原电池。若a、
b相连时,a为负极;c、d相连时,电流由d到c;
a、c相连时,c极上产生大量气泡,b、d相连
时,b上有大量气泡产生,则四种金属的活动性
顺序由强到弱的为 (
)
Ab【.课a >后b反>思c】> d
(3)将两极电极反应式相加即得原电池 的总反应式
第12页/共33页
[探究原电池构成条件] 【质疑】 1.你认为构成原电池的条件是什么? 2.请你判断下列装置能否产生电流?是否 【是实原验电探池究?】并引通导过学实生验交验流证实你验的结判论断及发。现的 问题,根据实验现象修正对“原电池的构成条 件”的认识。
第13页/共33页
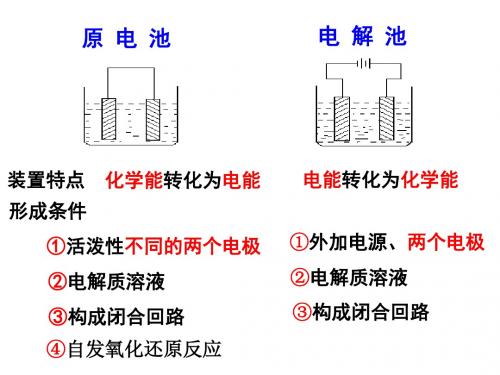
4、原电池的构成条件
(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性 强的金属与电解质溶液反应)。 (2)二看两电极:一般是活泼性不同的两电极。 (3)三看是否形成闭合回路,形成闭合回路需三个条件: ①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。
B.a > c > d >
C1..查c 漏> 知a 识> 点b .:> d
a
D.b > d > c >
2.主要错题:
第29页/共33页
【课后作业】
1.根据自己的实际设计一个切实可行的原电池,同时 请同学们再次查找相关资源,了解我国的能源分布和利 用情况 2.课外探究:普通干电池的组成、工作原理。 搜集的有关信息池 的应用相关视频搜索视频资源→橙子电池,用多少橙子 可以给iPhone 充电?
电解原理及应用PPT课件

解法指导 定性分析与定量分析结合
定性:阳离子放电顺序:Cu2+>H+>Na+ 阴离子放电顺序:Br->Cl->OH-
定量:当电路中通过0.1mol电子时: 电解0.05molCuBr2 继续通过0.1mol电子时: 电解0.05molCuCl2 再通过0.1mol电子时: 电解0.1molNaCl
最后通过0.1mol电子时:电解0.05molH2O
重 点
编辑版pppt
10
离子放电顺序: 阴离子失去电子而阳离子得到电子的过程叫放电。
①用惰性电极(Pt、Au、石墨、钛等)时: 阳极:溶液中阴离子的放电顺序(由难到易)是:
S 2->SO32->I ->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离子)>F-
阴极: 阳离子在阴极上放电顺序是:
D 的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni B 电解过程中,阳极质量的减少与阴极质量的增加相等 C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D 电解后,电解槽底部的阳极泥中只有Cu和Pt
编辑版pppt
31
电极性质
第四类:放氢生碱型: NaCl 活泼金属的无氧酸盐
编辑版pppt
16
电解原理的应用1——氯碱工业
编辑版pppt
17
离子交换膜法制烧碱 +
【习题2】 含有某些含氧酸根杂质的氯化
淡盐水
Cl2 H2
钠,可用离子交换膜法电解提
纯。电解槽内装有阳离子交换 A
Na+
膜(只允许阳离子通过),其
定性:阳离子放电顺序:Cu2+>H+>Na+ 阴离子放电顺序:Br->Cl->OH-
定量:当电路中通过0.1mol电子时: 电解0.05molCuBr2 继续通过0.1mol电子时: 电解0.05molCuCl2 再通过0.1mol电子时: 电解0.1molNaCl
最后通过0.1mol电子时:电解0.05molH2O
重 点
编辑版pppt
10
离子放电顺序: 阴离子失去电子而阳离子得到电子的过程叫放电。
①用惰性电极(Pt、Au、石墨、钛等)时: 阳极:溶液中阴离子的放电顺序(由难到易)是:
S 2->SO32->I ->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离子)>F-
阴极: 阳离子在阴极上放电顺序是:
D 的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni B 电解过程中,阳极质量的减少与阴极质量的增加相等 C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D 电解后,电解槽底部的阳极泥中只有Cu和Pt
编辑版pppt
31
电极性质
第四类:放氢生碱型: NaCl 活泼金属的无氧酸盐
编辑版pppt
16
电解原理的应用1——氯碱工业
编辑版pppt
17
离子交换膜法制烧碱 +
【习题2】 含有某些含氧酸根杂质的氯化
淡盐水
Cl2 H2
钠,可用离子交换膜法电解提
纯。电解槽内装有阳离子交换 A
Na+
膜(只允许阳离子通过),其
原电池电解原理及其应用

搭建实验装置
将电极插入电解质溶液中,并用导线连接电极和电流表,以测量电 流的大小和方向。
观察和记录实验现象和数据
观察电极反应
在通电后,观察铜电极上有气泡 产生,而锌电极上则逐渐溶解。 这表明铜电极上发生了还原反应, 而锌电极上发生了氧化反应。
记录电流数据
通过电流表记录电流的大小和方 向。通常情况下,电流从铜电极 流向锌电极,表明铜电极是正极, 锌电极是负极。
总结原电池工作原理
原电池的工作原理是基于氧化还原反应的。在本实验中, 锌电极作为负极失去电子被氧化,铜电极作为正极得到电 子被还原。电子通过导线从负极流向正极,形成了电流。 同时,电解质溶液中的离子也参与了反应,形成了闭合的 回路。
探讨原电池应用
原电池作为一种将化学能转化为电能的装置,在日常生活 和工业生产中有着广泛的应用。例如,干电池、蓄电池等 都是利用原电池原理制成的。此外,原电池还可以用于电 解、电镀等工艺中。
谢谢
THANKS
在原电池中,电子通过外部电路从负 极传递到正极,构成闭合回路。这也 是原电池能够产生持续电流的原因。
02 电解过程详解
CHAPTER
电解定义及分类
电解定义
电解是指在外加直流电场作用下,电 解质溶液或熔融电解质中的阴阳离子 发生定向迁移,并在电极上发生氧化 还原反应的过程。
电解分类
根据电解质的不同,电解可分为水溶 液电解、熔融盐电解和固体电解质电 解三类。
燃料电池应用
燃料电池具有高效、环保、节能 等优点,被广泛应用于交通、电 力、航空航天等领域。例如,氢 燃料电池汽车、燃料电池发电站
等。
锂离子电池技术
锂离子电池概述
锂离子电池是一种由锂金属或锂合金为负极材料、使用非 水电解质溶液的电池。其基本原理是锂离子在正极和负极 之间移动,实现电能的储存和释放。
将电极插入电解质溶液中,并用导线连接电极和电流表,以测量电 流的大小和方向。
观察和记录实验现象和数据
观察电极反应
在通电后,观察铜电极上有气泡 产生,而锌电极上则逐渐溶解。 这表明铜电极上发生了还原反应, 而锌电极上发生了氧化反应。
记录电流数据
通过电流表记录电流的大小和方 向。通常情况下,电流从铜电极 流向锌电极,表明铜电极是正极, 锌电极是负极。
总结原电池工作原理
原电池的工作原理是基于氧化还原反应的。在本实验中, 锌电极作为负极失去电子被氧化,铜电极作为正极得到电 子被还原。电子通过导线从负极流向正极,形成了电流。 同时,电解质溶液中的离子也参与了反应,形成了闭合的 回路。
探讨原电池应用
原电池作为一种将化学能转化为电能的装置,在日常生活 和工业生产中有着广泛的应用。例如,干电池、蓄电池等 都是利用原电池原理制成的。此外,原电池还可以用于电 解、电镀等工艺中。
谢谢
THANKS
在原电池中,电子通过外部电路从负 极传递到正极,构成闭合回路。这也 是原电池能够产生持续电流的原因。
02 电解过程详解
CHAPTER
电解定义及分类
电解定义
电解是指在外加直流电场作用下,电 解质溶液或熔融电解质中的阴阳离子 发生定向迁移,并在电极上发生氧化 还原反应的过程。
电解分类
根据电解质的不同,电解可分为水溶 液电解、熔融盐电解和固体电解质电 解三类。
燃料电池应用
燃料电池具有高效、环保、节能 等优点,被广泛应用于交通、电 力、航空航天等领域。例如,氢 燃料电池汽车、燃料电池发电站
等。
锂离子电池技术
锂离子电池概述
锂离子电池是一种由锂金属或锂合金为负极材料、使用非 水电解质溶液的电池。其基本原理是锂离子在正极和负极 之间移动,实现电能的储存和释放。
电解原理PPT教学课件

• 干扰素是由效应T细胞产生的糖蛋白,可阻 断细胞分裂间期,抑制DNA复制,从而可用 于治疗疾病。但干扰素在体外很难保存。
• 玉米中赖氨酸的含量比较低
• 在已研究过的几千种酶中,只有极少数可以应用 于工业生产,绝大多数酶都不能应用于工业生产, 这些酶虽然在自然状态下有活性,但在工业生产 中没有活性或活性很低。这是因为工业生产中每 一步的反应体系中常常会有酸、碱或有机溶剂存 在,反应温度较高,在这种条件下,大多数酶会 很快变性失活。提高蛋白质的稳定性是工业生产 中一个非常重要的课题。一般来说,提高蛋白质 的稳定性包括:延长酶的半衰期,提高酶的热稳 定性,延长药用蛋白的保存期,抵御由于重要氨 基酸氧化引起的活性丧失等。
应
用
电解质和溶剂均不变:电解精炼铜、电镀
熔融电解:NaCl、MgCl2 、Al2O3
淡盐水
阳极 金属钛网
Cl2 +
Cl2
Cl—
H2 -
H+ Na+
NaOH溶液
阴极 碳钢网
OH—
精制饱和 NaCl溶液
离子交换膜
H2O(含少量NaOH)
-e- +
阴极 Fe C 阳极
oooooooooooo ooooooooooo
离子
放
金属越不活泼的对应阳离子越容易得电子;
电 ①阴极: H+(水)
顺
序 ②阳极: 金属(除Pt、Au外)>S2->I->Br->Cl-
>
OH-(水)>NO3->SO42->F-
电
电解质变化,溶剂不变:CuCl2、HCl
解 原
电解溶质和水:NaCl、CuSO4、AgNO3
理
专题四电解池及其应用PPT

②惰性电极(离子的放电顺序) 阳极: 阴极:
一般情况下,离子按上述顺序放电,但如果离子浓度相差十分悬殊,离子浓度 大的也可以先放电。如理论上H+的放电能力大于Fe2+、Zn2+,但在电解浓度大的硫 酸亚铁或硫酸锌溶液时,由于溶液中c(Fe2+)或c(Zn2+)≫c(H+),则先在阴极上放电 的是Fe2+或Zn2+,因此阴极上的主要产物为Zn和Fe。但在水溶液中,Al3+、Mg2+、 Na+等是不会在阴极上放电的。
含Cu2+的电解质溶液
含含CCuu22②++的的是电电_解解水_质质__溶溶溶_液液__液还是__熔___融__物_,分为阴、
含Cu2+的电解质溶液 含Cu2+的电解质溶液
含含CCuu22++的的电电B解解. 质质电溶溶解液液 过程中溶液的pH不断升高
含Cu2+的电解质溶液
含含CCuu22++的的电电C解解. 质质此溶溶时液液 向溶液中加入适量的Cu2O固体可使溶液恢复到电解前的状况
含Cu2+的电解质溶液
D. 电解后两极产生的气体体积比为2∶1
阴极:_2_H__+_+__2_e_-_=_=_=_H__2↑___ (氢氟酸除 HCl
电解 外)
总反应: 通电
电解
_2_H__C_l_=_=_=_=_=_H__2↑__+__C__l2_↑____
质型 不活泼金
阳极:_2_C__l-_-__2_e_-_=_=_=__C_l_2↑__
阴极:_C_u_2_+_+__2_e_-_=_=_=_C__u___ 属的无氧 CuCl2
水
型
属的含 氧酸盐
KNO3
总反应:通电 __2_H_2_O_=_=__=_=_=_2_H__2↑__+__O__2↑___
_减___小___ _增___大___
2020届高考电解池的工作原理及其应用专题复习 优秀课件 PPT(共16张)

A.逸出气体的体积:a电极的小于b电极的 B.一电极逸出无味气体,另一电极逸出刺激性气味气体 C.a电极附近呈红色,b电极附近呈蓝色 D.a电极附近呈蓝色,b电极附近呈红色
3、Cu2O是一种半导体材料,基于绿色化学理念 设计的制取Cu2O的电解池示意图如下, 电解总反应为:2Cu+H2O =Cu2O+H2↑。下列 说法正确的是(A )
❖
2.俗话说“蛇不知道自己有毒,人不知 道自己 有错”, 还有一 句俗话 说“穷 养富养 ,不如 有教养” ,无论 贫穷还 是富裕 ,孩子 有教养 ,即使 再平凡 的躯体 ,也能 因此增 色不少 。 在孩子成长过程中,家长的引导是十分 重要的 。
❖
3.任务驱动型材料作文更能贴近社会 生活, 注重材 料的启 发和引 导作用 ,更能 体现学 生分析 问题、 解决问 题的能 力,同 时在角 度、立 意、文 体和标 题等方 面,给 考生留 出更大 的自主 选择空 间。
A.石墨电极上产生氢气 B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
4、用铜作电极电解盐酸溶液 阳极反应式______________________; 阴极反应式______________________; 总反应离子方程式 _____________________。
电解池分析的一般方法和步骤:
一判(判断阴、阳极)、 二看(看清阳极材料)、 三分(分清放电离子)、 四写(写出电极反应)
注意:
①阴极不管是什么材料,电极本身都不反应,一定 是溶液(或熔融电解质)中的阳离子放电,如:外加电源阴极 保护法。阳极材料,活泼金属先放电。
②熟练掌握常见离子放电顺序 ③电解水溶液时,K+~Al3+不可能在阴极放电,即不可 能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
3、Cu2O是一种半导体材料,基于绿色化学理念 设计的制取Cu2O的电解池示意图如下, 电解总反应为:2Cu+H2O =Cu2O+H2↑。下列 说法正确的是(A )
❖
2.俗话说“蛇不知道自己有毒,人不知 道自己 有错”, 还有一 句俗话 说“穷 养富养 ,不如 有教养” ,无论 贫穷还 是富裕 ,孩子 有教养 ,即使 再平凡 的躯体 ,也能 因此增 色不少 。 在孩子成长过程中,家长的引导是十分 重要的 。
❖
3.任务驱动型材料作文更能贴近社会 生活, 注重材 料的启 发和引 导作用 ,更能 体现学 生分析 问题、 解决问 题的能 力,同 时在角 度、立 意、文 体和标 题等方 面,给 考生留 出更大 的自主 选择空 间。
A.石墨电极上产生氢气 B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
4、用铜作电极电解盐酸溶液 阳极反应式______________________; 阴极反应式______________________; 总反应离子方程式 _____________________。
电解池分析的一般方法和步骤:
一判(判断阴、阳极)、 二看(看清阳极材料)、 三分(分清放电离子)、 四写(写出电极反应)
注意:
①阴极不管是什么材料,电极本身都不反应,一定 是溶液(或熔融电解质)中的阳离子放电,如:外加电源阴极 保护法。阳极材料,活泼金属先放电。
②熟练掌握常见离子放电顺序 ③电解水溶液时,K+~Al3+不可能在阴极放电,即不可 能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
指电池单位质量或单位体积所能输出功率的大小
③电池的储存时间的长短
11
(一) 一次电池
1、干电池(普通锌锰电池)
干电池用锌制桶形外壳作 负极,位于中央的顶盖有 铜帽的石墨作正极,在石 墨周围填充NH4Cl、 ZnCl2和淀粉作电解质溶 液填,充还MnO2的黑色粉末吸收正极放出的H2,防止产生 极化现象。电极总的反应式为:
为了避免发生这种现象,设计如下图所示的原电池装置, 你能解释它的工作原理吗?
6
锌半电池, 铜半电池
此电池的优点: 能产生持续、稳定的电流。7
实验探索
实验:
实验现象: 有盐桥存在时电流计指针发
生偏转,即有电流通过电路。 取出盐桥,电流计指针即回
到零点,说明没有电流通过。
分析:改进后的装置为什么能够持续、稳定的产生电流? 盐桥在此的作用是什么?
3、原电池的形成条件: 两极一液一连线 ✓(1)有两种活动性不同的金属(或一种是非金属单质 或金属氧化物)作电极。 ✓ (2)电极材料均插入电解质溶液中。 ✓ (3)两极相连形成闭合电路。 ✓ (4)内部条件:能自发进行氧化还原反应。
4
4、原电池的正负极的判断方法
微观判断 电子流出的极 ——负极
(2)当电解质溶液为CuSO4溶液时: Zn电极 是____极,其电极反应为_____________, 该反应是________反应;Cu电极是____极, 其电极反应为_______________,该反应_________反应.
2
2、原 电 池 原 理
失e,沿导线传递,有电流产生
外电路
氧化反应 Zn-2e=Zn2+
ቤተ መጻሕፍቲ ባይዱ
(根据电子流动
方向)
电子流入的极 ——正极
宏观判断:
较活泼的电极材料 ——负极 ①根据电极材料
较不活泼的电极材料——正极
②根据原电池电极 发生氧化反应的极 ——负极
发生的反应
发生还原反应的极 ——正极 质量增加的电极
——正极
③根据电极增重还是减重 工作后
质量减少的电极 ——负极
④根据电极有气泡冒出: 工作后,有气泡冒出的电极为正极 5
精品
原电池、电解原理及其应用专题8.ppt
一、原电池
1、概念:原电池是___将__化__学__能__转__化__为__电__能___的装置。 原电池反应的本质是_____氧__化__还__原__反__应_____反应。
例:如右图所示,组成的原电池: (1)当电解质溶液为稀H2SO4时: Zn电极是____(填“正”或“负”)极, 其电极反应为_______________,该反应 是______(填“氧化”或“还原”,下同)反应; Cu电极是______极,其电极反应为 _______________,该反应是_________反应。
负极 铜锌原电池 正极
阳离子 电解质 溶液
阴离子 盐桥 阳离子
还原反应 Cu2++2e- =Cu
内电路
电 负极:Zn-2e- =Zn2+ (氧化反应)
极 反 应
正极:Cu2++2e- =Cu (还原反应)
总反应: Zn+Cu2+=Zn2++Cu
(离子方程式)
Zn+CuSO4=ZnSO4+Cu (化学方程式)3
盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),
将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将 KCl或NH4NO3的饱和溶液装入U形管,用棉花都住管口即可。 8
得出结论
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
(2)平衡电荷。 在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完
二、对原电 池工作原理的进一步探究
?提出问题: 右图是我们在必修2中学习过的将锌片和铜 片置于稀硫酸的原电池,如果用它做电池, 不但效率低,而且时间稍长电流就很快减 弱,因此不适合实际应用。这是什么原因 造成的呢?有没有什么改进措施?
造成的主要原因:由于在铜极上很快就聚集了许多氢气 泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内 阻,使电流不能畅通。这种作用称为极化作用。
通常我们可以通过干电池的外观上的哪些变
化判断它已经不能正常供电了? __锌_筒__变__软__,__电_池__表__面__变__得_不__平__整____我们在
使用干电池的过程中并没有发现有气体产生,
③燃料电池
①能量转换效率高,供能稳定可靠。
3)优点:
②可以制成各种形状和大小、不同容量和电压的电池
和电池组,使用方便。 ③易维护,可在各种环境下工作。
4)电池优劣的判断标准:
①比能量 [符号(A· h/kg),(A· h/L)]
指电池单位质量或单位体积所能输出电能的多少
②比功率 [符号是W/kg,W/L)]
9
[学与问]在日常生活和学习中,你用过哪些电池,你知 道电池的其它应用吗?
化学电池
将化学能转换成电能的装置
电池
太阳能电池
将太阳能转换成电能的装置
原子能电池
将放射性同位素自然衰变时产生的热 能通过热能转换器转变为电能的装置
10
知识点1:化学电池
1)概念: 将化学能变成电能的装置
①一次电池又称不可充电电池——如:干电池 2)分类: ②二次电池又称充电电池——蓄电池
成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶 液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+ 变为Cu ,使得 SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻 止电子从锌片流向铜片,造成电流中断。
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩 散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的 电荷,保持溶液的电中性,因而放电作用不间断地进行,一直到 锌片全部溶解或 CuSO4溶液中的 Cu2+几乎完全沉淀下来。若电解 质溶液与KCl溶液反应产生沉淀,可用NH4NO3代替KCl作盐桥。
2NH4Cl+Zn+2MnO2=ZnCl2+2NH3↑+Mn2O3+H2O
请写出各电极的电极反应。
12
练:写出锌锰干电池的电极反应和总化学反
应方程式。
负极————Zn—-2—e—-=Z—n—2+——————— 正极———2—N—H4—++—2—e-=—2—N—H3—+H—2———
总反应—Z—n—+2—N—H—4+=—Z—n2—++—2—NH—3—+H—2—
