怎样把羧酸还原成醛
羧酸的还原反应

羧酸的还原反应一、引言羧酸是一类含有羧基(-COOH)的有机化合物,常见于生物体内和化学实验中。
其还原反应是指将羧酸分子中的羧基还原成醛基或甲基,生成相应的醛或醇。
这种反应在有机合成和生物化学研究中具有重要的应用价值。
二、还原反应机理羧酸的还原反应通常采用还原剂进行。
常用的还原剂包括金属碱金属(如钠、锂)、金属铝、氢气等。
这些还原剂可以将羧基上的氧化态还原为较低的氧化态,从而实现羧酸分子中的羧基还原。
以钠为例,其与羧酸发生反应时,首先钠离子被水分子包围形成氢氧化钠(NaOH),然后NaOH与羧酸发生反应,使得羧基上的氢离子被取代,生成相应的盐类和水:RCOOH + Na → RCOO^- Na+ + 1/2H2↑此时,由于产生了水和氢气,在实验室中可以通过观察水溶液中是否产生白色沉淀或气泡来判断反应是否进行。
三、还原反应条件1.还原剂的选择:常用的还原剂包括金属碱金属、金属铝、氢气等。
选择还原剂时需要考虑反应物的性质和反应条件,以及产物的需要。
2.反应溶剂:羧酸的还原反应通常在水或有机溶剂中进行。
不同的溶剂对于反应速率和产物选择有一定影响。
3.温度和压力:羧酸的还原反应通常在室温下进行,但是有些情况下需要加热或者高压操作以促进反应进行。
4.催化剂:有些情况下,为了使得羧酸分子更容易被还原,可以添加一些催化剂如铁粉、铜粉等。
四、具体实验操作以苯甲酸为例,介绍羧酸的还原实验操作步骤:1.准备苯甲酸样品和钠片,并在实验室通风橱内称取适量苯甲酸(0.5g)并放入干燥瓶中备用。
2.称取适量钠片(0.5g),并将其放入实验室通风橱内的干燥器中,使其充分干燥。
3.将干燥后的钠片放入干燥瓶中,然后加入适量无水乙醇(10mL),并用玻璃棒搅拌均匀。
4.将苯甲酸样品加入到钠和乙醇混合物中,并用玻璃棒搅拌均匀。
5.将反应混合物加入到沸腾水浴中,并加盖。
反应进行时会产生氢气和白色沉淀,需要注意安全。
6.反应结束后,将反应混合物过滤,并用水洗涤沉淀。
经典化学合成反应标准操作醛酮的合成

经典化学合成反应标准操作醛酮的经典合成目录1.前言 (4)2.由醇合成醛酮 (4)2.1铬(VI)试剂 (4)2.1.1 Jones氧化(Cr2O3/H2SO4/acetone) (4)2.1.2 Collins氧化(Cr2O3.2Py) (5)2.1.3 PCC(Pyrindium Chlorochromate)氧化 (8)2.1.4 PDC(Pyrindium Dichromate)氧化 (9)2.2 用活性MnO2氧化 (10)2.2.1 用活性MnO2氧化示例一: (10)2.3用DMSO氧化 (11)2.3.1 DMSO-(COCl)2氧化(Swern Oxidation) (11)2.3.2 DMSO-SO3-Pyridine (12)2.4 用氧铵盐氧化 (13)2.4.1 用氧铵盐氧化示例: (13)2.5 用高价碘试剂氧化 (14)2.5 .1 Dess-Martin氧化反应示例: (14)2.5.2 IBX氧化反应示例: (15)2.6 亚硝酸钠和醋酐氧化 (15)2.6.1 亚硝酸钠和醋酐氧化示例 (15)2.6 TPAP-NMO 氧化 (16)2.6.1 TPAP-NMO 氧化示例 (16)2.7 1,2-二醇的氧化 (16)2.7.1 1,2-二醇的氧化示例一: (17)2.7.1 其他1,2-二醇的氧化相关文献: (18)3.由卤化物合成醛酮 (18)3.1 由伯卤甲基和仲卤甲基的氧化合成醛酮 (18)3.1.1 用DMSO氧化(Kornblum反应) (18)3.1.2用硝基化合物氧化(Hass反应) (20)3.1.3用乌洛托品氧化(Sommelet反应) (21)3.1.4用对亚硝基二甲苯胺氧化吡啶翁盐氧化(Kröhnke反应) (22)3.1.5用胺氧化物氧化 (22)3.2 由二卤甲基或二卤亚甲基合成醛酮 (23)3.2.1 由二卤甲基合成醛反应示例: (23)3.3 由有机金属化合物的酰化合成醛酮 (24)3.3.1 由有机金属化合物的酰化合成醛酮示例 (25)3.4 由Pd催化反应合成醛 (25)4.由活泼甲基或活泼亚甲基烷烃合成醛酮 (25)4.1 用SeO2氧化合成醛酮 (26)4.1.1 用SeO2氧化合成醛酮示例 (26)4.2用空气氧化合成酮 (26)4.2.1用空气氧化合成酮反应示例: (27)4.3 用铬酸氧化合成酮 (27)4.3.1 用铬酸氧化合成酮示例 (27)4.4用高锰酸盐氧化合成酮 (29)4.5 用醌氧化合成酮 (29)5.由羧酸及其衍生物合成醛酮 (30)5.1由羧酸合成醛 (30)5.1.1用金属氢化物还原 (30)5.1.2由脱CO2合成醛 (31)5.1.3由羧酸合成酮 (31)5.2由酰氯及酸酐合成醛酮 (33)5.2.1用Rosenmund法合成 (33)5.2.2用金属氢化物还原 (34)5.3由酯及内酯合成醛 (35)5.3.1 酯通过DIBAL还原为醛示例: (36)5.4由酰胺合成醛酮 (36)5.4.1 由酰胺合成醛酮 (37)5.4.2 McFadyen-Stevens Reaction (38)5.5由酯或酰氯经Weinreb酰胺合成醛酮 (39)5.5.1 由Weinreb酰胺还原合成醛反应示例一 (40)5.5.2由Weinreb酰胺还原合成酮反应示例: (41)5.6由氰合成醛酮 (41)5.6.1DIBAL 还原腈到醛示例(最重要的方法) (42)5.6.2Li(EtO)3AlH 还原腈到醛示例(较重要的方法) (43)5.6.3Ranney Ni 加氢还原氰到合成醛示例 (43)5.6.4有机金属试剂对腈加成合成酮示例 (44)6. 由烯烃、芳环合成醛酮 (46)6.1 由烯烃臭氧氧化合成醛 (46)6.2 烯烃用OsO4/NaIO4氧化合成醛 (47)6.3 烯烃经由有机硼化合物中间体的烯烃甲酰化合成醛 (47)6.5 由烯烃的甲酰化合成醛 (48)6.5.1 Vilsmeyer反应 (48)6.5.2 Duff’s 甲酰化 (51)6.5.3 Reimer-Tiemann 甲酰化 (52)6.5.4 Gattermann甲酰化 (53)6.5.5 多聚甲醛/甲醇镁苯酚甲酰化 (53)6.5.6氯化锡/多聚甲醛苯酚甲酰化 (54)6.5.7重氮化后甲酰化 (54)6.6烯烃经加成-氧化反应合成酮 (56)6.6.1 烯烃经加成-氧化反应合成酮示例 (56)7. 由炔烃合成醛酮 (57)7.1 由加成-氧化反应合成醛酮 (57)7.2 由氧化反应合成酮 (57)7.3 由加成-水解反应合成酮 (58)7.4 由加成-还原反应合成酮 (59)7.5 由加成-烷基化,酰化等反应合成酮 (59)8. 由醚及环氧化合物合成醛酮 (59)8.1 Claisen重排 (59)8.2酸催化下环氧化物重排 (61)8.2.1 酸催化下环氧化物重排合成醛酮示例一 (61)8.3氧化法 (61)8.4 水解法缩醛或酮合成醛酮 (61)9. 由胺合成醛 (62)9.1胺的氧化 (62)9.1.1 胺的氧化合成醛反应示例: (63)9.2 由胺经由西佛碱的方法 (64)9.2.1 由胺经由西佛碱合成醛示例 (64)9.3 自苯胺衍生物合成 (64)10. 由硝基化合物合成醛酮 (64)11. 由Friedel-Crafts反应合成芳基酮 (65)11.1 由Friedel-Crafts反应合成芳基酮示例 (68)12. Dieckmann 缩合脱酸 (69)13. 由合成子合成醛酮 (71)14. 由砜合成醛酮 (71)15. Michael 反应和类似反应(Addition, Condensation) (71)1.前言醛和酮是一类重要的有机化合物,其合成在有机合成中占有非常重要的地位。
温和的还原羧基方法

温和的还原羧基方法羧基是有机化合物中的一个官能团,常见的有机酸中就含有羧基。
在有机合成中,还原羧基是一个常见的反应,可以将羧基还原为相应的醇。
本文将介绍几种温和的还原羧基方法,并分析其反应机理和适用范围。
1. 亚硼酸酯还原法亚硼酸酯还原法是一种常用的还原羧基的方法,它可以将羧基还原为醇。
该方法的优点是反应条件温和,产率较高。
反应通常在室温下进行,反应物通常是亚硼酸酯和羧酸,在碱性条件下反应。
反应机理是亚硼酸酯先与羧酸发生酯化反应,然后经过亚硼酸酯的还原作用,将羧基还原为醇。
2. 氢化铝锂还原法氢化铝锂还原法是一种常用的还原羧基的方法,它可以将羧基还原为醇。
该方法的优点是反应条件温和,产率较高。
反应通常在低温下进行,反应物通常是氢化铝锂和羧酸,在乙醚或四氢呋喃中反应。
反应机理是氢化铝锂先与羧酸发生加成反应,然后经过氢化还原作用,将羧基还原为醇。
3. 环丙醇还原法环丙醇还原法是一种温和的还原羧基的方法,它可以将羧基还原为醇。
该方法的优点是反应条件温和,产率较高。
反应通常在室温下进行,反应物通常是环丙醇和羧酸,在酸性条件下反应。
反应机理是环丙醇先与羧酸发生酯化反应,然后经过环丙醇的还原作用,将羧基还原为醇。
4. 还原醛法还原醛法是一种常用的还原羧基的方法,它可以将羧基还原为醇。
该方法的优点是反应条件温和,产率较高。
反应通常在室温下进行,反应物通常是还原醛和羧酸,在酸性条件下反应。
反应机理是还原醛先与羧酸发生缩醛反应,然后经过还原作用,将羧基还原为醇。
总结起来,温和的还原羧基方法有亚硼酸酯还原法、氢化铝锂还原法、环丙醇还原法和还原醛法。
这些方法都具有反应条件温和、产率较高的优点,适用于不同类型的羧酸。
在有机合成中,选择合适的还原方法可以提高反应的效率和产率,减少副反应的发生。
需要注意的是,羧基还原反应中常常伴随着一些副反应的发生,如酯化、缩醛等。
为了提高产率和选择性,可以在反应中加入适当的配体或选择合适的溶剂。
羧酸反应总结

.精品羧酸反应总结PCl 3PCl 5 POCl 3 + HClSOCl 2SO 2 + HClH 3PO 3回流C O HO R'C O R O C 25C OR NH 2H NH 2H OR'C OR OR'+ H 2OH C OR OH+O R'COCl R+羧酸与氨或胺作用生成羧酸铵,加热后脱水得酰胺或N-取代酰胺。
R C O OH+NH 3R C OONH 4R C ONH 2+H 2O+CH 3C O OHNH 2OHOH-H 2O ΔCH 3C O NH羧基难还原,需用强还原剂LiAlH4可见,LiAlH4不还原孤立的>C=C<,B2H6能还原孤立的>C=C<。
脱羧反应(1)羧酸盐脱羧(2)α-碳原子上连有吸电子基的羧酸,受热易脱羧(3) Kolbe 反应电解羧酸盐溶液,在阳极发生烷基的偶合,生成烃。
(4)汉斯狄克法(5)二元酸加热后的变化规律Blanc 规则:在可能成环时总是较易形成较稳定的五元或六元环状化合物。
α-氢原子的卤代反应生成的α-卤代酸可以转化成各种取代酸:羧酸的制法伯醇或醛的氧化烃的氧化腈的水解由格氏试剂制备(CH 3)3C COOH(CH 3)3C CH 2OH LiAlH 4H 3O+Cl 3C COOH△CHCl 3 + CO 2C=O CH 2COOHC=O CH 3△+ CO 22 CH 3(CH 2)12COONa 电 解CH 3(CH 2)24CH 3CH 3Cl 2P Cl2P CH 2CHCOOH ClCCOOHClClCl Cl 2CH 3CH 2CH 2CH 2CH 3CH 2CH 2COOHCH 3CH 2CH 2KMnO 4H SO 4KMnO 4H SO 4KMnO 4CO 2H RCH 2+RCOOH H 2O++精品RCOOHH 2ORC OMgClO CO 2+RMgCl C 2H 5OC 2H 5甲基酮氧化羧酸衍生物酯与醇作用,仍生成酯,故又称为酯交换反应。
还原反应(2)
9.4 羧酸及其衍生物的还原羧酸及其衍生物易被还原成醛,并可进一步还原为醇。
由羧酸及其衍生物还原是药物合成中获得醛的重要方法。
羧酸及其衍生物的还原活性依还原方法而异。
一般而言,酰氯活性最高,然后依次为酯、酰胺、酸酐和腈,羧酸本身活性较低,但采用高活性的还原剂及剧烈的反应条件也可实现还原。
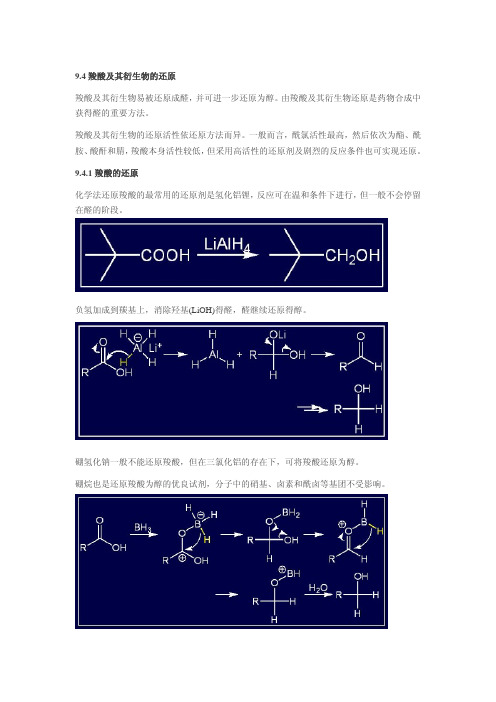
9.4.1 羧酸的还原化学法还原羧酸的最常用的还原剂是氢化铝锂,反应可在温和条件下进行,但一般不会停留在醛的阶段。
负氢加成到羰基上,消除羟基(LiOH)得醛,醛继续还原得醇。
硼氢化钠一般不能还原羧酸,但在三氯化铝的存在下,可将羧酸还原为醇。
硼烷也是还原羧酸为醇的优良试剂,分子中的硝基、卤素和酰卤等基团不受影响。
硼烷还原羧基的速度比还原其它基团快,因此,控制硼烷的用量及反应温度,可以在底物分子中含氰基、酯基或醛、酮羰基时还原羧基。
硼烷还原羧基的反应速度,脂肪酸大于芳香酸,位阻小的酸大于位阻大的酸。
脂肪酸酯反应速度很慢,芳香酸酯几乎不反应。
9.4.2 酰卤的还原化学法还原酰卤为醛的最常用的还原剂是金属氢化合物,如三叔丁氧基氢化铝锂或三丁基锡氢。
在低温下,还原芳酰卤和杂环酰卤的收率较高,而且不影响底物分子中的硝基、氰基、酯基、双键和醚键等。
负氢加成到羰基上、消除卤素(卤化锂)得醛。
9.4.3 酯和酰胺的还原依反应条件的不同,酯可被还原为醇、醛和双分子偶联反应。
(1) 酯还原为醇已有多种化学方法可将酯还原为醇,其中应用最为广泛的是金属氢化合物,其中又以氢化铝锂为最。
①金属氢化合物作还原剂酯用0.5eq.的氢化铝锂还原,可得伯醇。
负氢加成到羰基上,消除烷氧基(烷氧基锂)得醛,醛继续还原得醇。
在氢化铝锂还原时加入三氯化铝或定量的乙醇(用氯或烷氧基替换其1~3个氢原子),可以提高其还原的选择性。
如以下alpha,beta-不饱和酯的还原,若单用氢化铝锂还原,则生成饱和醇。
②金属钠/醇作还原剂:Bouveault-Blanc反应高级脂肪酸酯用金属钠和无水醇直接还原生成相应的伯醇的反应,称为Bouveault-Blanc反应。
醛和醛的反应

醛和醛的反应
醛是一类具有羰基的有机化合物,常常被用作各种化学反应的反
应物。
醛的反应可以分为氧化、还原、加成和缩合四种基本类型。
氧化反应是醛的一种常见反应,这种反应可以通过将醛暴露在空
气中或加催化剂,在氧气的作用下氧化成相应的羧酸。
此外,醛也可
以被过氧化氢等强氧化剂氧化成相应的羧酸。
还原反应是醛的另一种重要反应,通常需要用到还原剂,例如氢气、硼氢化钠等。
在还原剂的作用下,醛可以被还原成相应的醇,这
种反应也被称为醛的羟甲基化反应。
加成反应是醛的一种重要反应,它可以通过在醛分子上加入一些
具有特定反应活性的分子来实现。
例如,对羟基苯甲酸酯进行醛的反应,可以得到相应的醇酸分子。
此外,醛还可以通过在分子中引入氨基、酰基、烷基等官能团实现功能扩展。
缩合反应是醛的最后一种反应类型,它通常需要用到弱酸或碱催
化剂。
在这种反应中,醛可以和醛、胺或其他亲核试剂发生缩合反应,形成更复杂的分子。
例如,醛和胺的反应可以得到相应的亚胺化合物,这是一种常见的氮杂环结构。
总之,醛的反应种类繁多,每种反应都有其独特的反应条件和机理。
对于有机化学研究或者有关实验,深入了解醛的反应机理和反应
规律非常重要,尤其是对于醛的反应途径、反应物、催化剂以及反应
条件等方面,都需要进行深入研究和了解。
只有这样,才能更好地应用醛的各种反应,为有机化学研究和实践中的化学制品设计、药物开发等工作提供更多的帮助。
羧酸的还原

羧酸的还原一、羧酸的概念和性质羧酸是一类含有羧基(-COOH)的有机化合物。
羧基是由碳原子和氧原子通过双键连接,以及氧原子上的一个氢原子组成的。
羧酸具有以下的性质: 1. 羧酸分子中的羧基具有极性,通过羧基的氧原子可以形成氢键; 2. 羧酸可以与碱发生酸碱中和反应,生成相应的盐和水; 3. 羧酸可以通过还原反应进行还原,还原产物一般为醛或醇。
二、羧酸还原的反应机理羧酸的还原反应一般可以通过催化剂或者还原剂来实现。
常用的催化剂包括贵金属催化剂如铂、钯等。
还原剂可以选择亚砜、硼氢化钠等。
在还原反应中,羧酸的羧基被还原成醛或醇的同时,还原剂本身也会被氧化。
羧酸的还原反应可以分为两个步骤: 1. 首先,还原剂被氧化,生成一种中间体,释放出氢离子; 2. 然后,羧酸的羧基与中间体反应,形成醛或醇。
三、羧酸还原的应用羧酸的还原反应在有机合成中有着广泛的应用。
下面列举了一些典型的应用例子:1. 羧酸酯的还原羧酸酯是一类含有羧酸基和醇基的化合物。
通过还原反应,可以将羧酸酯还原成相应的醛和醇。
这种还原反应在合成中间体和药物合成中非常常见,具有重要的应用价值。
2. 无机化学中的羧酸还原在无机化学中,羧酸的还原反应也有重要的应用。
例如,苯甲酸可以还原成苯甲醛,该反应常用于制备苯甲醛,并且苯甲醛还可以用于制备其他有机化合物。
3. 羧酸的电化学还原羧酸的电化学还原是一种通过电解的方式实现的还原反应。
该方法可以在溶液中进行,通过施加适当的电势,使羧酸发生还原反应。
这种方法具有操作简便、对环境友好等优点,被广泛应用于合成化学和材料科学领域。
4. 羧酸的光化学还原羧酸的光化学还原是一种利用光辐射的能量实现还原反应的方法。
通过光照,羧酸可以被激发到激发态,然后发生还原反应。
这种方法在有机光化学反应中起到重要的作用,用于合成复杂的有机分子。
四、羧酸还原反应中的注意事项羧酸的还原反应在实验室中需要注意以下几点:1. 催化剂的选择催化剂的选择对于羧酸还原反应十分重要。
羰基还原汇总

羰基的还原字体: 小中大| 打印发表于: 2007-8-18 19:26 作者: Free☆Style 来源: 小蚂蚁化学门户网站最近看了几本有机考研参考书,将那些书上总结的羰基还原反应我自己再概括了一下,如下若有错误还请指正,谢谢!1)催化氢化用Pt,Pb,Ni等作催化剂,醛酮很容易还原成醇;若分子中有C=C,则C=C比C=O更容易被还原.2)用氢化锂铝还原分子中的C=C不被还原;氢化锂铝还能还原酯基等,但三叔丁基氢化锂铝可以选择性还原羰基而不还原酯基3)用硼氢化钠还原与羰基不共轭的C=C不被还原,但有C=O共轭的C=C可被还原;硼氢化钠除还原羰基以外还可以还原酰氯,但不能还原酯基4)用乙硼烷还原乙硼烷除还原羰基以外还可以还原碳碳不饱和键5)酮的双分子还原用活泼金属可将醇还原为频那醇,若分子中有与羰基共轭的C=C,一般是C=C先被还原6)用醇铝还原异丙醇铝是一个选择性很高的醛酮还原剂,异丙醇铝将氢负离子转移给醛酮.使醛酮还原,而自身边成丙酮7)克莱门森Clemmenen还原法醛或酮与锌汞试剂和浓盐酸一起加热,C=O被还原成—CH[size=10.5pt]2—8)Wolff—Kishner—黄鸣龙还原法将醛或酮,氢氧化钠,肼和一缩二乙二醇一同加热,可将C=O还原成—CH[size=10.5pt]2—以上几点的羰基不包括羧基中的羰基羧酸不易被还原,但用LiAlH[size=10.5pt]4 可把羧酸直接还原成醇图片1(在下面)用锂—甲胺还原羧酸可得醛图片2(在下面)NaBH[size=10.5pt]4只能还原醛酮和酰氯不能还原酯,Zn—Hg/浓HCl可将醛酮还原为亚甲基LiAlH[size=10.5pt]4 既可将醛酮还原又可还原酯另:酰氯的一些反应1.酰氯用三叔丁基氢化铝锂在低温下还原得醛2.在Pd/PdSO4催化下,酰氯用氢气还原则生成醛-------称为Rosenmund还原3.酰氯与等摩尔的格式试剂在低温下,特别是无水FeCl3存在下,产物为酮.若格式试剂过量则生成的酮继续反应生成叔醇4.用二烃基酮锂还原得酮5.用有机镉化合物还原也得酮6.用氢化铝锂还原生成醇[本帖最后由Free☆Style 于2007-8-19 05:10 PM 编辑]。
大学有机化学复习总结醛酮与羧酸的性质与反应

大学有机化学复习总结醛酮与羧酸的性质与反应一、醛酮的性质与反应1. 结构与物理性质醛酮是含有羰基(C=O)官能团的有机化合物,在结构上可以分为醛和酮两类。
由于羰基的存在,醛酮具有许多特殊的物理性质,如较高的沸点、溶解性较好等。
2. 醛酮的还原反应醛酮具有被还原为醇的反应性质。
在还原反应中,醛酮可以和还原剂如氢气、金属还原剂等发生反应,生成相应的醇。
这种反应常用于制备醇类化合物。
3. 醛酮的氧化反应醛酮也可以发生氧化反应。
在氧化反应中,醛可以被氧化成为羧酸,而酮则不易发生氧化。
常用的氧化剂有酸性高锰酸钾(KMnO4)、过氧化氢(H2O2)等。
4. 醛酮的加成反应醛酮具有多种加成反应,其中包括亲核加成和亲电加成。
亲核加成指的是醛酮中的羰基受到亲核试剂的进攻,生成产物;亲电加成则是亲电试剂攻击醛酮中的羰基,形成新的化学键。
5. 醛酮的缩合反应醛酮通过缩合反应可以形成α,β-不饱和醛和酮。
这种反应可以通过存在碱性条件下进行,如使用极性溶剂催化的aldol缩合反应。
二、羧酸的性质与反应1. 结构与物理性质羧酸是含有羧基(-COOH)官能团的有机化合物。
羧酸在结构上可分为脂肪族羧酸和芳香族羧酸两类。
由于羧基的存在,羧酸具有特殊的物理性质,如较高的沸点、溶解性较好等。
2. 羧酸的酸碱特性羧酸具有明显的酸性,其酸碱性主要表现在羧基的质子化,生成共轭碱。
当羧酸溶于水中时,会产生酸性溶液,如乙酸的水溶液呈现酸性。
3. 羧酸的酯化反应羧酸可以发生与醇的酯化反应。
在酯化反应中,羧酸与醇经酯键的形成生成相应的酯。
酯化反应常以强酸或酸催化下进行。
4. 羧酸的氨解反应羧酸可以与氨或氨的衍生物发生反应,生成相应的酰胺。
这种反应称为氨解反应,可由酸催化或碱催化完成。
5. 羧酸的酰卤化反应羧酸可以与卤素(如氯、溴等)反应,生成相应的酰卤。
这种反应通常以无水物质存在下进行,如使用磷酰氯(POCl3)或羰基二氯化钛(TiCl2)催化。
生成缩醛的条件

生成缩醛的条件
缩醛是一类有机化合物,其分子结构中含有醛基(-CHO)。
生成缩醛的条件可以根据不同的反应类型进行分类,主要包括氧化反应、氢化反应和羰基化合反应。
下面将分别介绍这些条件。
一、氧化反应生成缩醛
氧化反应是一种常见的生成缩醛的方法。
常用的氧化剂包括氧气、过氧化氢、过氧化苯甲酰和过氧化乙酰等。
在氧化反应中,氧化剂会将醇或醚中的羟基氧化为醛基,从而生成缩醛。
二、氢化反应生成缩醛
氢化反应是将羧酸或酮还原为缩醛的方法。
常用的还原剂有氢气和金属铝或亚磷酸酯。
在氢化反应中,还原剂会将羧酸或酮中的羰基还原为醛基,从而生成缩醛。
三、羰基化合反应生成缩醛
羰基化合反应是一类将羰基化合物转化为缩醛的方法。
常用的反应包括氨基化、硫醇化和硒醇化等。
在羰基化合反应中,反应物与氨基、硫醇或硒醇反应,羰基会被还原为醛基,从而生成缩醛。
总结
生成缩醛的条件主要包括氧化反应、氢化反应和羰基化合反应。
在氧化反应中,氧化剂将醇或醚中的羟基氧化为醛基;在氢化反应中,还原剂将羧酸或酮中的羰基还原为醛基;在羰基化合反应中,反应物与氨基、硫醇或硒醇反应,羰基被还原为醛基。
这些反应条件的选择取决于反应物的特性和需要制备的缩醛种类。
在实际应用中,可以根据需要选择适合的反应条件进行缩醛的合成。
最新苏教版选修五《醛 羧酸》(第3课时重要有机物之间的相互转化)教案

最新苏教版选修五《醛 羧酸》(第3课时重要有机物之间的相互转化)教案1.掌握有机化学反应的主要类型的原理及应用,2.3.在掌握各类有机物的性质、反应类型、相互转化的基础上,初步学习设计合理的有机合成路线。
人类运用有机化学手段合成出许许多多的物质,合成有机化合物需要考虑哪些问题呢?①CH3CH3+Br2−→−光CH3CH2Br+HBr②CH2==CH2+H2−−→−催化剂CH3CH3CH ≡CH+2H2−−→−催化剂CH3CH3④CH ≡CH+H2−−→−催化剂CH2==CH2⑤CH3CH2Br+NaOH CH2===CH2↑+NaBr+H2O⑥CH3CH2Br+NaOHCH3CH2OH+NaBr⑦CH3CH2OH+HBr CH3CH2Br+H2O⑧CH3CH2OHCH2==CH2↑+H2O⑨2CH3CH2OH+O22CH3CHO+2H2O⑩CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O○11 CH3CHO+2Cu (OH )2Cu2O ↓+CH3COOH+2H2O若由乙醇制备乙二酸乙二酯(),提示:乙醇−−→−消去乙烯−−→−加成1,2-二溴乙烷−−→−水解乙二醇−−→−氧化乙二醛−−→−氧化乙二酸课堂师生互动知识点11.(1)CH3CH3+Cl2−−→−光照HCl+CH3CH2Cl(还有其他的卤代烃)(还有其他的氯代苯甲烷)CH2==CH —CH3+Cl2−−−−→−600℃~500℃CH2==CH —CH2Cl+HCl(2)CH2==CHCH3+Br2−→−CH2Br —CHBrCH3CH2==CHCH3+HBr −→−CH3—CHBrCH3CH ≡CH+HCl −−→−催化剂CH2==CHCl (3)R —OH+HX R —X+H2O2.(1CH2==CH2+H2OCH3CH2—OHCH3CH2—Br+H2O −−→−NaOHCH3CH2—OH+HBrCH3CHO+H2CH3CH2—OHCH3COCH3+H2CH3COOCH2CH3+H2O CH3COOH+CH3CH2—OH(2①酚钠盐溶液中通入CO2②苯的卤代物水解生成苯酚,3. (1)①醇的消去反应引入CH3CH2OH CH2==CH2↑+H2O②卤代烃的消去反应引入。
醛和羧酸反应

醛和羧酸反应
醛和羧酸反应是有机化学中的一种常见反应,也被称为酯化反应。
这种反应可以将一个醛和一个羧酸反应生成一个酯。
下面将对醛和羧酸反应进行详细介绍。
一、反应机理
醛和羧酸反应的机理是酸催化下的加成-消除反应。
首先,酸催化下的加成反应将羧酸的羟基与醛的羰基发生加成反应,形成一个酸酐中间体。
然后,中间体中的羰基与羟基发生消除反应,生成酯和水。
二、反应条件
醛和羧酸反应需要酸催化,常用的催化剂有硫酸、盐酸、甲酸等。
反应温度一般在室温下进行,但也可以在加热的条件下进行。
此外,反应中需要使用惰性溶剂,如二甲基甲酰胺、乙醇等。
三、反应实例
1. 乙酸和乙醛的酯化反应
乙酸和乙醛在硫酸催化下反应,生成乙酸乙酯和水。
2. 苯甲酸和苯甲醛的酯化反应
苯甲酸和苯甲醛在甲酸催化下反应,生成苯甲酸苯甲酯和水。
四、反应应用
醛和羧酸反应在有机合成中有广泛的应用。
例如,它可以用于合成酯类化合物,如香精、药物等。
此外,醛和羧酸反应还可以用于合成酯基化聚合物,如聚酯类材料等。
总之,醛和羧酸反应是有机化学中的一种重要反应,它可以用于合成酯类化合物和酯基化聚合物等。
在实际应用中,需要注意反应条件的选择和催化剂的使用。
第七章 醛

铬酰氯亦是芳烃侧链氧化成醛的良好试剂。一般是将芳烃慢慢加到铬酰氯的 氯仿或四氯化碳溶液中,首先生成络合物,继而酸性水解成醒,被称为Etard反 应。
在硫酸溶液中,活性二氧化锰可直接将芳烃的侧链氧化成芳醛。为了防止醛 的进一步氧化,二氧化猛的用量仅与芳烃等当量
第二节 还原反应 羧酸、酰卤、酰胺、腈均具有较高的氧化状态,它们易被还原成醛,醛亦可进 一步还原成醇。因此利用还原法合成醛时,必须选择反应性能温和、选择性较好的 还原试剂并控制适当的反应条件。 酰卤在适当的条件下,可被催化氢化成醛;利用还原试剂亦可达到同样目的。 由于羧酸不易被一般试剂还原成醛,因此借酰卤的还原方法可使羧酸转变成醛。 酯、酰胺被金属氢化物的还原是合成醛的新方法。 若将腈转变成它的某些衍生物,再进行还原,即可避免腈直接还原时生成胺的 副反应。
3、铬酰氯氧化
末端双键控可与铬酰氯反应,使双键氧化断裂即可转变为醛
三、从卤代烃制醛 1、Sommelet 反应 苄卤化合物与六亚甲基四胺在乙醇中反应,首先生成铵盐,继而水解,生 成芳醛,这一反应被称为Sommelet反应。
反应的中间体铵盐不需祈离,即可用50%乙酸水溶液直接水解。苄卤反应收率 80%左右,其它卤代烃的反应收率在50%左右。
4、DMSO 氧化 二甲基亚矾(DMSO)被多种亲电试剂活化后,与伯醇反应生成烷氧基硫盐,接着 发生消除反应,生成醛与二甲硫醚,是氧化伯醇的温和试剂,可广泛用于甾 族、生物 碱及碳水化合物等许多对一般氧化剂敏感的化合物的氧化。
在磷酸或三氟乙酸吡啶盐的存在下,二甲基亚砜-双环己基碳二亚胺(DCC), 是氧化伯醇的温和试剂。分子中存在的双键、叁键、酯、磺酸酯、酰胺、叠氮、糖 苷键等不受影响。
H3C DMSO,(COCl)2 OH H3C O Et3N,-60 C H3C H3C CH3 O O O CH3 O CHO
醛类化合物的性质和应用

抗病毒剂:一些醛类化合物具 有抗病毒作用,可用于治疗病 毒感染。
抗菌剂:醛类化合物具有抗菌 作用,可用于制作抗菌药物。
抗炎剂:醛类化合物具有抗炎 作用,可用于缓解炎症和疼痛。
抗肿瘤剂:一些醛类化合物具 有抗肿瘤作用,可用于治疗癌
症。
杀虫剂:醛类化合物可以合成多种杀虫剂,如有机磷杀虫剂、氨基甲酸酯类杀虫剂等。 杀菌剂:醛类化合物也可以用作杀菌剂,如多菌灵、甲霜灵等。 除草剂:某些醛类化合物可以作为除草剂,如草甘膦等。 植物生长调节剂:某些醛类化合物可以作为植物生长调节剂,调节植物的生长和发育。
香料合成:醛类化合物可用于合成香精香料,如香草醛、肉桂醛等。
农药合成:某些醛类化合物可以作为农药合成的中间体,如苯甲醛、邻苯甲醛等。
工业助剂:醛类化合物在工业生产中可作为催化剂、稳定剂、防腐剂等,如甲醛、乙醛等。
生物医药:某些醛类化合物具有生物活性,可用于药物合成,如甾体激素类药物中的孕烯醇酮 等。
穿戴防护服和手套
佩戴呼吸器
避免直接接触
储存于阴凉通风处
PART FIVE
醛类化合物的合成方法研究 醛类化合物的反应机理研究 醛类化合物的应用领域拓展 醛类化合物在医药、农药等领域的应用前景
新型醛类化合物的合成与开发 醛类化合物在医药、农药等领域的应用拓展 醛类化合物在绿色化学中的重要地位和作用 醛类化合物与其他化合物的反应研究进展
XX,a click to unlimited possibilities
汇报人:XX
CONTENTS
PART ONE
醛类化合物是含有醛基的一类化合物,其结构式为R-CHO。 醛基是一个活性基团,容易发生氧化、还原、加成等反应。 醛类化合物通常具有特殊的气味,且在水中有一定的溶解度。 醛类化合物在自然界中广泛存在,如甲醛、乙醛、丙酮等。
羧酸的还原方法_李媛

羧酸的还原方法李 媛 张 萍 董玉环# 周 蕾 王亚英(河北师范大学化学系 石家庄 050016; #唐山师范学院化学系 唐山 063000)李 媛 女,44岁,教授,从事有机合成研究。
河北省自然基金资助项目(200154)2001-09-13收稿,2001-11-28修回摘 要 羧酸的还原是有机化学中的一类重要反应,有着广泛的用途。
氢化铝锂是还原羧酸的常用试剂。
但是,该试剂能还原多种官能团,因此选择性较差。
近年来,化学工作者研究并报道了许多新的还原方法,如用NaB H 4 I 2、NaB H 4 H 2SO 4、NaBH 4 B OP 体系等还原羧酸成醇以及还原羧酸成醛的特殊方法。
本文拟对这些新的研究进展作一介绍。
关键词 还原反应 羧酸 醇 醛A bstract The reduction of carboxylic acid is an important reaction in organic chemistry and has extensiveapplication in organic synthesis .Lithium aluminium hydride is commonly used to effect this reaction ,but many otherfunctional groups are also reduced by this reagent ,so the reagent is a poor chemoselective one .Recently ,several newreductive methods of carboxy lic acids ,includin g the reduction of carboxylic acid with NaBH 4 I 2,NaB H 4 H 2SO 4,NaB H 4 BOP reagent s y stems and some special methods of reduction of carboxylic acids to aldehydes have been studiedand reported .The progress in the field is reviewed .Key words Reductive reaction ,Carboxylic acid ,Alcohols ,Aldehydes羧酸还原是有机合成的重要反应之一。
羧基还原成醛基

羧基还原成醛基羧基还原成醛基是有机化学中一个重要的反应过程,常用于合成和转化有机物。
本文将详细介绍羧基还原成醛基的原理、方法和应用。
一、原理羧基还原成醛基是通过还原剂的作用将羧基转化为醛基。
常用的还原剂有金属铝、金属锌、氢气等。
在反应中,还原剂与羧基发生氧化还原反应,羧基上的氧原子失去一个电子形成醛基。
二、方法羧基还原成醛基的方法多种多样,以下是几种常见的方法:1. 邻氨基苯甲酸酯还原法:将邻氨基苯甲酸酯与还原剂反应,生成相应的醛。
2. 羧酸与亲核试剂反应:将羧酸与亲核试剂如硫酸亚铁、亚砜等反应,生成相应的醛。
3. 羧酸与无机还原剂反应:将羧酸与无机还原剂如亚硫酸钠、亚硫酸氢钠等反应,生成相应的醛。
4. 羧酸与金属还原剂反应:将羧酸与金属还原剂如铝、锌等反应,生成相应的醛。
三、应用羧基还原成醛基的反应在有机合成中有着广泛的应用。
以下是几个典型的应用案例:1. 羧基还原合成醛类化合物:羧酸经过还原反应可以得到相应的醛类化合物,这是一种常用的合成方法。
醛类化合物在有机合成中具有重要的地位,广泛用于制药、农药、香料等行业。
2. 羧基还原制备醇类化合物:羧酸经过还原反应可以得到相应的醇类化合物。
醇类化合物是有机合成中常见的中间体,可用于进一步合成其他有机化合物。
3. 羧基还原制备醚类化合物:羧酸经过还原反应可以得到相应的醚类化合物。
醚类化合物在药物合成和有机合成中有着重要的应用。
四、总结羧基还原成醛基是一种重要的有机化学反应,广泛应用于有机合成中。
通过不同的方法和还原剂,可以有效地将羧基转化为醛基。
羧基还原成醛基的反应具有方便、高效、选择性好等优点,对于有机化学研究和工业生产具有重要意义。
以上是关于羧基还原成醛基的详细介绍,希望可以对读者有所帮助。
通过了解羧基还原的原理、方法和应用,可以更好地理解有机化学中的反应过程,并应用于实际的合成和转化中。
羧基还原成醛基

羧基还原成醛基简介羧基还原成醛基是一种有机化学反应,它通过去除羧基的一个氧原子来将羧酸转化为醛。
这个反应对于有机合成具有重要意义,因为醛化合物可以作为合成其他有机物的中间体,同时也具有一定的生理活性。
反应机制羧基还原成醛基的反应机制主要涉及两个步骤:羧基的失去和还原。
下面我们将详细介绍这两个步骤。
羧基失去羧基可以通过酸催化或还原剂促进失去一个氧原子。
在酸催化下,醛基上的氧原子与酸形成酯中间体,并释放出一个酸性质的氢离子。
这个过程称为酸催化羧基失去。
羧基还原在还原剂的作用下,醛基上的氧原子与还原剂发生反应,生成一个醇基中间体,并释放出一个还原剂上的氧原子。
这个过程称为还原剂促进的羧基还原。
反应条件和方法羧基还原成醛基的反应条件和方法根据反应类型和底物的不同而有所不同。
下面列举了几种常用的方法和条件。
酸催化羧基失去•反应条件:温和酸性条件下,通常在室温至反应底物的沸点范围内进行。
•催化剂:常用的催化剂包括硫酸、盐酸、磷酸等。
•应用范围:适用于具有羧基的化合物,如羧酸、羧酸酯等。
还原剂促进的羧基还原•反应条件:还原剂通常在碱性条件下进行,反应温度较高。
•还原剂:常用的还原剂包括亚砜类化合物、硼氢化钠、过量的氢气等。
•应用范围:适用于具有羧基的化合物,如羧酸、羧酸酯等。
实验操作根据不同的反应类型,下面分别列出了酸催化羧基失去和还原剂促进的羧基还原的实验操作步骤。
酸催化羧基失去1.将羧酸溶解在酸性条件下的溶剂中。
2.加入适量的催化剂。
3.反应底物加热于适当温度下,通常在室温至反应底物的沸点范围内进行。
4.反应结束后,对产物进行适当的处理和纯化。
还原剂促进的羧基还原1.将反应底物溶解在碱性溶剂中。
2.加入适量的还原剂。
3.反应底物加热至适当温度,通常较高。
4.反应结束后,对产物进行适当的处理和纯化。
应用与意义羧基还原成醛基的反应在有机合成中具有广泛的应用与意义。
以下列举了几种典型的应用与意义。
1.中间体合成:羧基还原成醛基是一种重要的中间体合成方法。
羧基还原成醛基

羧基还原成醛基羧基(carboxyl group)是有机化合物中一种常见的官能团,它由一个羰基和一个氢氧根离子组成。
而醛基(aldehyde group)是有机化合物中的另一种官能团,由一个羰基和一个氢原子组成。
本文将探讨如何将羧基还原成醛基。
羧基的还原可以通过多种方法实现,其中最常见的是用还原剂进行反应。
常用的还原剂包括金属还原剂(如锂铝氢化物)和氢气。
在反应中,羧基中的氧原子会被还原为一个氢原子,形成醛基。
我们来看一种常见的还原方法——用锂铝氢化物(LiAlH4)还原羧酸。
锂铝氢化物是一种强还原剂,可以与羧酸反应生成相应的醛。
该反应的步骤如下:1. 将锂铝氢化物与干燥剂(如氯化钠)混合,使其完全干燥。
2. 将混合物与无水溶剂(如二甲基甲酰胺)混合,形成反应溶液。
3. 向反应溶液中加入羧酸,使其与锂铝氢化物反应。
4. 反应结束后,用酸(如硫酸)中和反应溶液,使其达到中性。
通过该方法,我们可以将羧酸还原为相应的醛。
这种方法适用于大多数羧酸,但对于部分含有其他官能团的羧酸可能会有限制。
除了锂铝氢化物还原法,氢气还原法也是将羧基还原为醛基的常用方法之一。
该反应需要催化剂的存在,常用的催化剂包括铂、钯等贵金属。
反应步骤如下:1. 将羧酸与催化剂置于密封的反应容器中。
2. 向反应容器中通入氢气,并加热反应容器。
3. 反应进行一段时间后,停止通入氢气,冷却反应容器。
4. 反应结束后,用适当的方法分离醛基产物。
氢气还原法可以将羧酸直接还原为相应的醛,反应条件相对温和,适用于大多数羧酸的还原。
除了上述两种方法,还有其他一些方法可以将羧基还原为醛基,如用亚磷酸酯还原、用硼氢化物还原等。
这些方法各有特点,适用于不同的反应条件和具体应用。
总结起来,羧基还原成醛基是有机化学中常见的转化之一。
通过选择合适的还原剂和反应条件,可以实现高效、高选择性的羧基还原。
这为有机合成和药物研发等领域提供了重要的工具和方法。
希望本文对羧基还原成醛基的过程和方法有所了解,并能在实际应用中加以运用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羧酸还原成醛
羧酸不易被一般还原剂还原成醛,必须选用合适的还原剂来还原,比如1,1,2-三甲丙基硼烷是羧酸还原成醛的良好试剂:
n-C5H11COOH→→n-C5H11CHO 98%
1. (CH3 ) 2 CHC( CH3 ) 2BHBrPCH3SCH3 体系催化剂
Jin 等发现了一类将羧酸还原成醛的理想试剂, 即溴代烷基硼烷P二甲基硫醚还原体系。
该还原剂对脂肪酸的还原非常有效, 在室温下反应1h, 产率达92% ~ 99% , 对脂肪二酸、A, B2不饱和脂肪酸的还原反应产率也都在90% 以上。
通过研究还发现此试剂具有较高的化学选择性, 即当) COCl、C =C 等与羧基共存时, 只将羧基还原成羰基。
然而溴代烷基硼烷P二甲基硫醚对芳香酸的还原不很理想, 还原速度慢、还原剂用量大, 产率也远低于脂肪酸被还原的产率。
另外, 溴代烷基硼烷P二甲基硫醚室温下不还原C= C , 而氯代烷基硼烷P二甲基硫醚室温下则还原C =C 。
92BBNPLi 92BBN体系
2.
溴代( 氯代) 烷基硼烷P二甲基硫醚还原体系解决了把羧酸还原成醛这一在有机合成领域长期存在的重要问题, 因此得到广泛的应用。
Jin 等在进行上述研究的基础上又进一步发现92BBN( 92硼双环[ 31311] 壬烷) 和Li 92BBN( 92硼双环[ 31311] 壬烷基锂) 体系与溴代烷基硼烷P二甲基硫醚相似,能有效地还原羧酸至
:
醛。
反应机理如下Array
92BBNPLi 92BBN 还原脂肪酸产率很高( 85% ~ 99% ) , 且反应很快。
与脂肪酸
相比, 芳香酸的还原反应速度较慢, 其产率虽不及脂肪酸还原的产率高, 但仍可达
到76% 以上。
3.
醛是有机合成中一类很重要的化合物, 但是一般很难由羧酸直
接还原制备, 因为醛比羧酸更易被还原。
Fujisawa 等报道了将
羧酸、N, N2二甲基氯亚胺盐酸盐和三叔丁氧基氢化铝锂一锅
反应, 高产率地将羧酸还原成醛, 从而为醛的合成提供了一条有
价值的途径。
可能的反应机理如下:
上述还原剂可有效地将脂肪族和芳香族羧酸还原成醛, 而且当Cl、
NO2、 OCH3、杂环、
C =C 与羧基共存时, 只有羧基被还原。
进一步研究还发现, 该还原体
系的最适宜溶剂是乙腈和四氢呋喃混合溶剂, 若用NaBH4 或
NaBH(OMe) 3 代替LiAlH(OBu2t) 3 , 羧酸则被还原成醇。
4. LiPCH3NH2 体系
Burgstahler 等研究了LiPCH3NH2 体系对羧酸的还原反应, 发现此还原剂可以把羧酸还原成醛。
尽管脱氢松香酸的还原产率达到了80% , 但其它羧酸的还原产率都较低。
另一项研究表明 , 用LiPCH3NH2 还原羧酸得到醇和醛的混合物, 而醛大多是以其衍生物的形式分离出来的, 未得到单纯的醛。
经过进一步的研究发现过量羧酸的加入, 可得到纯的醛( 而非其衍生物) , 同时有痕量的醇生成。
该反应生成中间体亚胺, 后者在中性水溶液中缓慢氧化成醛, 在酸性水溶液中则迅速氧化成醛, 在LiPCH3NH2 或还原剂作用下转化成胺。
如下所示:
5
Corriu 等报道了一种经过一个羧酸硅酯中间体将羧酸一步还原成
醛的方法, 整个反应不需要分离出硅酯中间体, 在相对低的温度
( 110~ 160 e ) 下加热硅酯生成醛, 产率在50% ~ 95%。
因为
F、 NO2、 CN、杂环等不与硅烷反应, 所以具有这些官能团的
羧酸的还原具有选择性, A, B2不饱和酸还原成A,B2不饱和醛。
该还原反应的可能机理是:
6. i2C3H7CH2MgBrP(G52C5H5 ) 2TiCl2 体系
Sato 报道了在二氯二茂钛的催化下, 用格氏试剂还原羧酸成醛的
方法:
这一试剂对脂肪酸和芳香酸还原产率中等, 但对A,B2不饱和酸产率是零。
参考文献
李媛《羧酸的还原方法》化学通报 2002.7黄宪《新编有机合成化学》化学工业出版社。
