广东省广州市2020届高三化学3月综合测试试题(一)(含解析)
广东省2020年高考理综-化学三模考试试卷

广东省2020年高考理综-化学三模考试试卷姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分)下列说法不正确的是()A . 碳化硅可作砂纸、砂轮的磨料B . 地沟油没有利用价值,可用燃烧法处理C . 食盐、食醋、纯碱、小苏打是常见的厨房用品D . 开发和利用太阳能是节约化石能源,弥补能源不足的途径2. (2分) (2015高二上·丹东月考) 下列属于水解离子方程式且正确的是()A . HCO +H2O⇌H3O++COB . NH3+H2O⇌NH +OH﹣C . CO +2H2O⇌H2CO3+2OH﹣D . Al3++3H2O⇌Al(OH)3+3H+3. (2分) (2018高三上·佛山期中) 下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是()A . 配制溶液B . 制取收集干燥氨气C . 除去粗盐中的不溶物D . 观察Fe(OH)2的生成4. (2分) (2016高一下·三门峡期中) 在元素周期表中金属元素与非金属元素的分界处,可以找到()A . 合金B . 半导体材料C . 催化剂D . 农药5. (2分) (2015高二上·丰台期末) 有机物,有多种同分异构体,其中属于酯且含有苯环结构的共有()A . 3种B . 4种C . 5种D . 6种6. (2分) (2015高一上·莆田月考) 如图所示装配仪器,接通电流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生的气体是()A . Cl2B . O2C . H2D . HCl7. (2分) (2018高二上·湖北期中) 常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示[Ksp(CaSO4)=9×10﹣6].下列说法正确的是()A . b点对应的Ksp等于a点对应的KspB . d点溶液通过蒸发可以变到c点C . b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定等于3×10﹣3 mol•L﹣1D . 在任何溶液中,c(Ca2+)、c(SO42﹣)均相等.二、综合题 (共4题;共22分)8. (3分) (2019高二下·杭州月考) 为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:已知:气体A为单质,标准状况下的密度为1.25g/L。
2020年广东省广州市天河区高考化学三模试卷
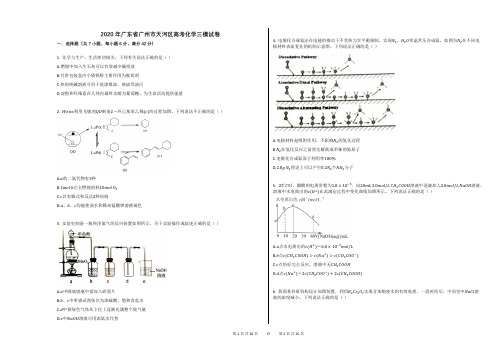
2020年广东省广州市天河区高考化学三模试卷一、选择题(共7小题,每小题6分,满分42分)1. 化学与生产、生活密切相关。
下列有关说法正确的是()A.燃煤中加入生石灰可以有效减少碳排放B.月饼包装盒内小袋铁粉主要作用为脱氧剂C.热的纯碱溶液可用于洗涤煤油、柴油等油污D.淀粉和纤维素在人体内最终水解为葡萄糖,为生命活动提供能量2. Weiss利用光敏剂QD制备2−环已基苯乙烯(c)的过程如图。
下列说法不正确的是()A.a的二氯代物有3种B.1mol b完全燃烧消耗10mol O2C.c具有顺式和反式2种结构D.a、b、c均能使溴水和稀高锰酸钾溶液褪色3. 实验室制备一瓶纯净氯气的反应装置如图所示。
关于实验操作或叙述正确的是()A.a中圆底烧瓶中需加入碎瓷片B.b、c中所盛试剂依次为浓硫酸、饱和食盐水C.d中黄绿色气体从下往上逐渐充满整个集气瓶D.e中NaOH溶液可用浓氨水代替4. 电催化合成氨法在电能的推动下不受热力学平衡限制,实现N2、H2O常温常压合成氨,如图为N2在不同电极材料表面复化的机制示意图。
下列说法正确的是()A.电极材料起吸附作用,不影响N2的氢化过程B.N2在氢化反应之前需先解离成单独的氮原子C.电催化合成氨原子利用率100%D.2.8g N2理论上可以产生0.2N A个NH3分子5. 25∘C时,醋酸的电离常数为1.8×10−5.向20mL 2.0mol/L CH3COOH溶液中逐滴加入2.0mol/L NaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如图所示。
下列说法正确的是()A.a点水电离出的c(H+)=6.0×10−3mol/LB.b点c(CH3COOH)>c(Na+)>c(CH3COO−)C.c点恰好完全反应,溶液中无CH3COOHD.d点c(Na+)=2c(CH3COO−)+2c(CH3COOH)6. 我国某科研机构设计如图装置,利用K2Cr2O7实现含苯酚废水的有效处理,一段时间后,中间室中NaCl溶液的浓度减小。
广东省广州市达标名校2020年高考三月适应性考试化学试题含解析

广东省广州市达标名校2020年高考三月适应性考试化学试题一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为9;W与Y同族;W与Z形成的离子化合物可与水反应,其生成的气体可使酸性高锰酸钾溶液退色。
下列说法正确的是()A.生物分子以W为骨架B.X的氧化物常用于焊接钢轨C.Z的硫化物常用于点豆腐D.Y的氧化物是常见的半导体材料2.按照物质的组成分类,SO2属于()A.单质B.酸性氧化物C.碱性氧化物D.混合物3.造纸术是中国古代四大发明之一。
古法造纸是将竹子或木材经过蒸解、抄纸、漂白等步骤制得。
下列说法正确的是()A.“文房四宝”中的宣纸与丝绸的化学成分相同B.“竹穰用石灰化汁涂浆,入木桶下煮”,蒸解过程中使纤维素彻底分解C.“抄纸”是把浆料加入竹帘中,形成薄层,水由竹帘流出,其原理与过滤相同D.明矾作为造纸填充剂,加入明矾后纸浆的pH变大4.常温常压下,某烧碱溶液与0.05mol氯气恰好完全反应,得到pH=9的混合溶液(溶质为NaC1与NaC1O)。
下列说法正确的是(N A代表阿伏加德罗常数)A.氯气的体积为1.12L B.原烧碱溶液中含溶质离子0.2N AC.所得溶液中含OH-的数目为1×10-5N A D.所得溶液中ClO-的数目为0.05N A5.25℃时,关于某酸(用H2A表示)下列说法中,不正确的是()A.pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14B.将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸C.测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸D.0.2 mol·L-1 H2A 溶液中的c(H+)=a,0.1 mol·L-1H2A溶液中的c(H+)=b,若a<2 b,则H2A为弱酸6.25℃时,改变某醋酸溶液的pH,溶液中c(CH3COO-)与c(CH3COOH)之和始终为0.1mol·L-1,溶液中H+、OH-、CH3COO-及CH3COOH浓度的常用对数值(lgc)与pH的关系如图所示。
广东省广州市2022届高三化学3月综合测试试题(一)(含解析)

广东省广州市2022届高三化学3月综合测试试题(一)(含解析)1.明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。
实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:下列叙述错误的是A. 回收处理废易拉罐有利于保护环境和资源再利用B. “沉淀”为Al2(CO3)3C. “操作a”中包含蒸发浓缩、冷却结晶D. 上述流程中可用过量CO2代替NH4HCO3【答案】B【解析】【详解】A、可回收物是指各种废弃金属、金属制品、塑料等可回收的垃圾,废易拉罐属于可回收垃圾,回收处理废易拉罐有利于保护环境和资源再利用,选项A正确;B、偏铝酸钠与碳酸氢铵发生反应生成碳酸钠、碳酸铵和氢氧化铝,故“沉淀”为Al (OH)3,选项B错误;C、沉淀溶解于稀硫酸,再加入硫酸钾,“操作a”中包含蒸发浓缩、冷却结晶,最后得到明矾,选项C正确;D. 上述流程中可用过量CO2代替NH4HCO3,过量二氧化碳与偏铝酸钠溶液反应得到氢氧化铝沉淀,选项D正确。
答案选B。
2.N A是阿伏加德罗常数的值,下列说法正确的是A. 10 gD2O中含有的质子数与中子数均为5N AB. 标准状况下,22.4LCHC13中含C-Cl键的数目为3N AC. 密闭容器中,1mol NH3和1molHCl反应后气体分子总数为N AD. l00mL1.0 mol/L FeC13溶液与足量Cu反应,电子转移数为0.2N A【答案】A【解析】【详解】A. 10 gD2O 中含有的质子数与中子数均为5N A,选项A正确;B. CHC13标准状况下是液体,22.4LCHC13中含C-Cl键的数目大于3N A,选项B错误;C. NH3和HCl反应生成氯化铵固体,故1mol NH3和1molHCl反应后气体分子总数为0,选项C错误;D. l00mL1.0 mol/L FeC13溶液与足量Cu反应,铁由+3价变为+2价,电子转移数为0.1N A,选项D错误。
2020届广东省广州市普通高中高三综合测试(一)理科综合化学试卷及答案

2020届广东省广州市普通高中高三综合测试(一)理科综合化学试卷★祝考试顺利★2020.4.30 相对原子质量:H1 Li7 N14 O16 Ni59 Zn65 Cd112 La139 单选题每题6分7.我国古代优秀科技成果对人类文明进步做出巨大贡献,下列有关说法错误的是 A.烧制“青如天,明如镜,薄如纸,声如磬”的瓷器的主要原料为黏土B.记载“伦乃造意,用树肤……以为纸”中的“树肤”的主要成分含纤维素 C.古代“黑火药”是由硫磺、木炭、硝酸三种物质按一定比例混合制成D.“司南之杓,投之于地,其柢指南”中的“杓”的主要成分是天然磁铁(Fe3O4)8.关于化合物1,4-二氢萘(),下列说法错误的是A.能使酸性高锰酸钾溶液褪色B.分子中所有原子均处同一平面C.一氯代物有4种(不考虑立体异构)D.与互为同分异构体9.实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl2可用于吸收氨气),下列说法错误的是A.装置①、②、⑤依次盛装碱石灰、无水CaCl2、NaOH溶液B.装置③中气体呈红棕色C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成D.通空气的主要作用是鼓出氨气,空气可用N2代替10.一种矿石[Y3Z2X5(XW)4]的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,其中W、X、Z分别位于不同周期,其中Z核外最外层电子数是X核外电子数的一半, 1个W2X分子含有10个电子。
下列说法正确的是A.原子半径:Y>Z>X>WB.Y与X可形成共价化合物C.Z的最高价氧化物的水化物是中强酸D.简单氢化物的沸点:Z>X11.我国科学家设计了一种太阳能驱动从海水中提取金属锂的装置,示意图如图所示。
该装置工作时,下列说法正确的是A.铜箔上的电势比催化电极上的高B.海水的pH变大C.若转移1mol电子,理论上铜箔增重7gD.固体陶瓷膜可用质子交换膜代替12.已知邻苯二甲酸(H2A)的Ka1=1.1×10−3,Ka2=3.9×10−6。
广东省广州市2021届高三化学下学期毕业班综合测试(一模)试题(一)

20XX年复习资料教学复习资料班级:科目:广东省广州市2021届高三化学下学期毕业班综合测试(一模)试题(一)本试卷共10页,21小题,满分100分。
考试用时75分钟。
注意事项:1.答卷前,考生务必将自己的姓名、考生号、试室号和座位号填写在答题卡上。
用2B铅笔将试卷类型(A)填涂在答题卡相应位置上,并在化学答题卡相应位置上填涂考生号。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡对应题目选项的答案信息点涂黑:如需改动,用橡皮擦干净后,再选涂其他答案。
答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上:如需改动,先划掉原来的答案,然后再写上新答案;不准使用铅笔和涂改液。
不按以上要求作答无效。
4.考生必须保持答题卡的整洁。
考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H1 B11 C12 N14 O16 Al27 Ge73一、选择题:本题共16小题,共44分。
第1~10小题,每小题2分:第11~16小题,每小题4分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.关于下列诗句或谚语隐含的化学知识,说法错误的是A.“爆竹声中一岁除”,爆竹中的火药含有硫黄B.“木棉花落絮飞初”,“絮”的主要成分是纤维素C.“谷雨种甘蔗”,甘蔗中的蔗糖是多糖D.“雷雨发庄稼”,该过程有硝酸生成2.2020年我国北斗三号全球卫星导航系统正式开通,其中“铷(Rb)原子钟”被誉为卫星的“心脏”,下列有关说法错误的是A.铷元素位于IA族B.铷的金属性比钠弱C.8537Rb的中子数为48D.8537Rb和8737Rb具有相同的电子数3.“打造青山常在,绿水长流、空气常新的美丽中国”。
下列水处理方法错误的是A.用臭氧进行自来水消毒B.用硫酸铁除去水中的悬浮物C.用Na2SO4除去硬水中的Mg2+和Ca2+D.用Na2S除去工业废水中的Cu2+和Hg2+4.下列应用不涉及氧化还原反应的是A.小苏打用作食品膨松剂B.工业合成氨实现人工固氮C.烟气脱硫(SO2)生产硫酸D.利用铝热反应焊接钢轨5.锂碘电池可用于心脏起搏器,电池反应可简化为:2Li+I2=2Lil。
广东省广州市白云区2020届高三3月训练习试题(一)理综化学(解析版)

白云区2020届高三年级训练试题理科综合试题本试卷分第1卷(选择题)和第II卷(非选择题)两部分。
共16页300分,请考生把答案填写在答题纸上。
相对原子质量: H 1 O 16 S 32 Fe 56 Cu 64第Ⅰ卷(选择题共126分)一、选择趣:本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.选现象或事实解释项A 纳米铁粉可将水体中 NO3-转化为 N2纳米铁粉具有还原性B 84 消毒液被广泛用于物体表面的消毒NaClO的水解产物有强酸性C 利用 SiO2和焦炭混合物在高温下制粗碳元素的非金属性比硅强硅D 任何浓度的乙醇都有消毒作用乙醇可使病毒蛋白质变性死亡A. AB. BC. CD. D8.阿伏加德罗常数值为 N A,下列说法中正确的是()A.14g14C 中含有的中子数为1N AB.1L0.1 mol/L 硫化钠溶液中含S2-的数目为0.1N AC.2.9g异丁烷和正丁烷混合物含有C-H 键的数目为0.5N AD.标准状况下,22.4LSO2 与足量O2 反应转移的电子数为0.2N A9.关于化合物苯乙醛(),下列说法正确的是()A. 不能使稀高锰酸钾溶液褪色B. 可以发生加成聚合反应C. 分子中所有原子共平面D. 可溶于乙醇10.短周期主族元素 W、X、Y、Z 的原子序数依次增大,它们原子的最外层电子数之和为20.W的某些氧化物可形成酸雨,X氢化物的水溶液能与石英反应产生气体,Z 的K层和L层电子数之和是M层电子数的2倍。
下列说法正确的是()A. Y、X 的水溶液呈碱性B. 氢化物的沸点:Z>WC. W 在它的二氧化物中满足 8 电子稳定结构D. Z 的最高价氧化物的水化物是强酸11.高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含 Fe、Al、Mg、Zn、Si 等元素)制备,工艺如图所示。
关于流程中滤渣主要成分的说法错误的是()已知:①相关金属离子[c(Mn+)=0.1 mol•L-1]形成氢氧化物沉淀的 pH 范围如表:金属离子Mn2+ Fe2+Fe3+Al3+Mg2+Zn2+开始沉淀的 pH 8.1 6.3 1.5 3.4 8.9 6.2沉淀完全的 pH 10.1 8.3 2.8 4.7 10.9 8.2物质ZnS MgS ZnF2 MgF2在水中溶解情况Ksp=1.2×10-23 易水解微溶难溶A.“滤渣1”含有SiO2 或不溶性硅酸盐B.“滤渣2”为Fe(OH)3C.“滤渣3”为ZnSD.“滤渣4”为MgF212.海水淡化是解决沿海城市饮用水问题的关键技术。
2020届高三化学三轮大题难点突破《物质结构中晶胞密度、边长、距离的计算》

2020届高三化学三轮大题难点突破《物质结构中晶胞密度、边长、距离的计算》1.已知:A、B、C、D四种元素,原子序数依次增大。
A是短周期元素中金属性最强的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。
试回答下列有关问题:由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。
如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:晶胞中距离一个A+最近的C−有______个,这些C−围成的图形是________;若晶体密度为ρg·cm−3,阿伏加德罗常数的值用N A表示,则A+的离子半径为_______cm(用含N A与ρ的式子表达)。
2.深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。
其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]2(CN)2↑+12KCN+N2↑+Fe3C+C。
请回答下列问题:Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。
晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。
由于晶体缺陷,在晶体中Fe 和O的个数比发生了变化,变为Fe x O(x<1),若测得某Fe x O晶体密度为5.71g•cm﹣3,晶胞边长为4.28×10﹣10 m,则Fe x O中x=____。
(用代数式表示,不要求算出具体结果)。
3.含第V A族的磷、砷(As)等元素的化合物在研究和生产中有许多重要用途。
回答下列问题:砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。
推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。
已知砷化镓的晶胞结构如图乙,晶胞参数a= 565pm。
①砷化镓的化学式为____,镓原子的配位数为____。
广东省2020版高考理综-化学三模考试试卷

广东省2020版高考理综-化学三模考试试卷姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分) (2016高一上·吉安期末) 在某些工厂中常用高压电对气溶胶作用来除去大量的烟尘.以减少污染,这种做法所应用的原理是()A . 电泳B . 胶体的聚沉C . 布朗运动D . 电解2. (2分) (2018高三上·曹县期中) 我国有广阔的海上疆域,海水综合利用要符合可持续发展的要求,其联合工业体系(部分)如图所示,下列说法错误的是()A . 从苦卤中制溴和制盐的过程中都存在氧化还原反应B . 海水淡化的方法中,以日光为能源的蒸馏法最符合可持续发展的要求C . 海水制镁过程中用到的沉淀剂是石灰乳D . 氯碱工业的产品可用于生产盐酸、漂白液等3. (2分) NA表示阿伏加德罗常数,下列计算结果正确的是()A . 3g福尔马林所含氧原子数为0.1 NAB . 1mol C4H10中含有的极性共价键数目为13NAC . 1L 0.1mol/L的Na2CO3溶液中,阴离子数大于0.1NAD . 1L密度为1.84g/cm3、98%的硫酸溶液中,所含氢原子数为36.8 NA4. (2分)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn+2MnO2+H2O=Zn(OH)2+MnOOH下列说法中,错误的是()A . 电池工作时,锌失去电子B . 电池正极的电极反应式为:MnO2+H2O+e-=MnOOH+OH-C . 电池工作时,电子由正极通过外电路流向负极D . 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g5. (2分)(2018·濮阳模拟) 短周期主族元素W、X、Y、Z、R原子序数依次增大。
考古时利用W的一种同位素测定一些文物的年代,X是地壳中含量最多的元素,Y、Z的质子数分别是W、X的质子数的2倍。
2020届广东省广州市普通高中高三综合测试(一)理科综合化学试卷及答案

2020届广东省广州市普通高中高三综合测试(一)理科综合化学试卷★祝考试顺利★相对原子质量:H1 Li7 N14 O16 Ni59 Zn65 Cd112 La139 单选题每题6分7.我国古代优秀科技成果对人类文明进步做出巨大贡献,下列有关说法错误的是 A.烧制“青如天,明如镜,薄如纸,声如磬”的瓷器的主要原料为黏土B.记载“伦乃造意,用树肤……以为纸”中的“树肤”的主要成分含纤维素 C.古代“黑火药”是由硫磺、木炭、硝酸三种物质按一定比例混合制成D.“司南之杓,投之于地,其柢指南”中的“杓”的主要成分是天然磁铁(Fe3O4)8.关于化合物1,4-二氢萘(),下列说法错误的是A.能使酸性高锰酸钾溶液褪色B.分子中所有原子均处同一平面C.一氯代物有4种(不考虑立体异构)D.与互为同分异构体9.实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl2可用于吸收氨气),下列说法错误的是A.装置①、②、⑤依次盛装碱石灰、无水CaCl2、NaOH溶液B.装置③中气体呈红棕色C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成D.通空气的主要作用是鼓出氨气,空气可用N2代替10.一种矿石[Y3Z2X5(XW)4]的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,其中W、X、Z分别位于不同周期,其中Z核外最外层电子数是X核外电子数的一半,1个W2X分子含有10个电子。
下列说法正确的是A.原子半径:Y>Z>X>WB.Y与X可形成共价化合物C.Z的最高价氧化物的水化物是中强酸D.简单氢化物的沸点:Z>X11.我国科学家设计了一种太阳能驱动从海水中提取金属锂的装置,示意图如图所示。
该装置工作时,下列说法正确的是A.铜箔上的电势比催化电极上的高B.海水的pH变大C.若转移1mol电子,理论上铜箔增重7gD.固体陶瓷膜可用质子交换膜代替12.已知邻苯二甲酸(H2A)的Ka1=1.1×10−3,Ka2=3.9×10−6。
高考化学复习考点知识专题提升训练03 阿伏加德罗常数(解析版)

高考化学复习考点知识专题提升训练专题3——阿伏加德罗常数1、(2020年全国卷II)已知N A是阿伏加德罗常数的值,下列说法错误的是A. 3g 3He含有的中子数为1N AB. 1 L 0.1 mol·L−1磷酸钠溶液含有的34PO-数目为0.1N AC. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A 【答案】B【解析】A. 3He的中子数为3-2=1,则3g3He的中子数为3g3g/mol AN⨯=NA,A项正确; B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×NA mol-1 =0.1NA,B项错误;C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3,1mol重铬酸钾转移的电子数为3mol×2×NA mol-1 =6NA,C项正确;D. 正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g正丁烷与10g异丁烷所得的混合物中共价键数目为48g+10g 58g/mol ×13×NAmol-1 =13NA,D项正确。
2、(2020年全国卷III)设N A为阿伏加德罗常数值。
关于常温下pH=2的H3PO4溶液,下列说法正确的是A. 每升溶液中的H+数目为0.02N AB. c (H +)= c (24H PO -)+2c (24HPO -)+3c (34PO -)+ c (OH −)C. 加水稀释使电离度增大,溶液pH 减小D. 加入NaH 2PO 4固体,溶液酸性增强 【答案】B【解析】A 、常温下pH =2,则溶液中氢离子浓度是0.01mol/L ,因此每升溶液中H +数目为0.01N A ,A 错误;B 、根据电荷守恒可知选项B 正确;C 、加水稀释促进电离,电离度增大,但氢离子浓度减小,pH 增大,C 错误;D 、加入NaH 2PO 4固体,H 2PO 4-浓度增大,抑制磷酸的电离,溶液的酸性减弱,D 错误。
广州市2020届高三年级阶段性训练题 化学参考答案

2020年3月广州市高三阶段性测试理科综合-化学试题评分细则2020.3.29 7.D8.C9.B10.D11.C12.A13.B26.(14分)(1)2Fe(OH)2+H2O2=2Fe(OH)3(2分)①方程式中物质错0分,配平错扣1分。
②若多写“2H2O2=2H2O+O2↑”不扣分、不得分。
③若将2Fe(OH)2+H2O2=2Fe(OH)3和“2H2O2=2H2O+O2↑”合并写得1分。
煮沸(2分)①写“加热”得1分。
②“加入带电离子,使胶体聚沉”得1分。
(2)H2C2O4(2分)①答案唯一,正确2分,写名称不得分。
(3)蒸发浓缩、冷却结晶(2分)①“蒸发浓缩”、“冷却结晶”各得1分。
②“加热浓缩、降温结晶”得2分。
③“蒸发结晶”给0分,“蒸发”给0分。
除去结晶表面的水分(1分)①“除去水分”或“便于干燥”均得1分(4)①CO2(2分)酸式(1分)①“二氧化碳”给2分。
“酸式”答案唯一,有误不得分。
②5561001000cVm⨯⨯⨯%(2分)ራ㘈 、 hራ㘈 hhh hh 等合理得2分。
不写100%不扣分。
(1)+3(2分)①答案唯一,正确得2分。
②写“3”得2分。
(2)将+3价Mn元素还原成Mn2+(2分)①“将+3价Mn元素还原”得2分。
写“还原剂”得1分②“将Fe2+氧化”或“氧化剂”不得分。
③“作反应物”不得分。
(3)Fe(OH)3、Al(OH)3(2分)①Fe(OH)3或Al(OH)3写对一个得1分。
②多写Mn(OH)2不得分不扣分。
③写“Fe(OH)3、SiO2”或“Al(OH)3、SiO2”或“Fe(OH)3、Al(OH)3、SiO2”均得1分。
(4)(NH4)2SO4(2分)①(NH4)2SO4或硫酸铵得2分。
②多写“NH3·H2O”不得分不扣分。
③写NH4SO4或硫酸氨不得分。
写Mn SO4不得分。
加热到213-308℃分解生成氨气和NH4HSO4,分别循环到沉锰和溶浸中或加H2SO4生成NH4HSO4循环到溶浸中(2分)①“加热到213-308℃分解生成氨气循环到沉锰中”得1分。
(广东版)2020届全国高三化学第三次大联考试卷(无答案)

【学易大联考】 2020 年第三次全国大联考【广东卷】理科综合能力测试化学试题考试范围:高考所有内容;考试时间:题号120 分钟;一二总分得分注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
2.答题前考生务必用0.5 毫米黑色墨水署名笔填写好自己的姓名、班级、考号等信息3.考试作答时,请将答案正确填写在答题卡上。
第一卷每题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑;第Ⅱ卷请用直径0.5 毫米的黑色墨水署名笔在答题卡上各题的答题地区内作答,高出答题地区书写的答案无效,在试题卷、底稿纸上作答无效。
4.以下数据可供解题时参照:可能用到的相对原子质量:H-1 O-16 第 I 卷(选择题共36分)一、单项选择题(此题包含 6 小题,每题P-31Zn- 654 分,共 24 分。
每题只有一个选项切合题意)7.生活中到处有化学。
以下说法正确的选项是()A.三大营养物质糖类、油脂、蛋白质均能发生水解反响B.为节俭原资料、提升原子利用率,可用废旧皮革生产药用胶囊C.CO2 合成可降解的聚碳酸酯类塑料,实现“碳循环”,可有效减少“白色污染”D.用海水为原料可制得精盐,再电解纯净的NaCl 溶液即可制得金属钠8.水溶液中能大批共存的一组离子是()A. Na+、 K+、 AlO2-、 HCO3-B.Cu2+、 Na+、 HS-、 SO42-C.Ca2+、 NH4+、 I-、 ClO—D. K+、 Fe2+、 NO3-、 Cl-9.以下陈说Ⅰ、Ⅱ正确而且有因果关系的是()选项陈说Ⅰ陈说ⅡA 苯不存在碳碳双键苯不可以发生氧化反响B 氧化铝很牢固、熔点高氧化铝用来制造耐火坩埚等实验仪器C HCl 与 Na2S 溶液反响生成 H2S 用饱和 Na2S 溶液除掉 H2S 中的少许 HClD 二氧化锰拥有较强的的氧化性二氧化锰可作 H2O2 分解的氧化剂10.设 NA 为阿伏加德罗常数的数值,以下说法正确的选项是()A.标准情况下,NA 个 SO3分子的体积约是22. 4LB.0 .5mol/LCuCl2 溶液含有的Cu2+数小于NAC.标准情况下,1. 8gH2O 与 Na2O2 完整反响,反响中转移的电子数为0. 1NAD.室温下, 31.0g 白磷中含有的共价键数量为11.工业上,在强碱性条件下用电解法除掉废水中的NACN—,装置以下图,挨次发生的反响有:① CN——2e—+2OH—= CNO—+H2O② 2Cl—一 2e═= Cl2↑③3Cl2 +2CNO— +8OH-=N2+6Cl—十 2CO32—+4H2O 以下说法不正确的选项是()A . a 是电源的正极B .铁电极上发生的电极反响式为2H ++ 2e — =H2↑C .为了使电解池连续工作,需要不停增补NaOHD .除掉 1molCN —,电解过程中共产生标准情况下 11. 2L 气体 12.以下相关电解质溶液中粒子浓度关系不正确的选项是( )A . pH = 1 的 NaHSO4 溶液: c ( H+)= c ( SO42-)+ c ( OH -)B .25℃时, 0.1 mol/L 醋酸与 0. 1 mol/LNaOH 溶液等体积混淆所得溶液: c ( Na+)> c ( CH3COO -)> c ( OH -)> c ( H+)C .Ca ( ClO ) 2 溶液中通入少许 CO2,溶液的导电性和酸性均加强D . 25℃时, pH = 12 的 Na2CO3 溶液: c (HCO3-)+ c ( H +)+ 2c ( H2CO3)= 0. 01mol/L二、双项选择题(此题包含2 小题,每题 6 分,共 12 分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
广东省广州市2020届高三化学3月综合测试试题(一)(含解析)1.明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。
实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:下列叙述错误的是A. 回收处理废易拉罐有利于保护环境和资源再利用B. “沉淀”为Al2(CO3)3C. “操作a”中包含蒸发浓缩、冷却结晶D. 上述流程中可用过量CO2代替NH4HCO3【答案】B【解析】【详解】A、可回收物是指各种废弃金属、金属制品、塑料等可回收的垃圾,废易拉罐属于可回收垃圾,回收处理废易拉罐有利于保护环境和资源再利用,选项A正确;B、偏铝酸钠与碳酸氢铵发生反应生成碳酸钠、碳酸铵和氢氧化铝,故“沉淀”为Al (OH)3,选项B错误;C、沉淀溶解于稀硫酸,再加入硫酸钾,“操作a”中包含蒸发浓缩、冷却结晶,最后得到明矾,选项C正确;D. 上述流程中可用过量CO2代替NH4HCO3,过量二氧化碳与偏铝酸钠溶液反应得到氢氧化铝沉淀,选项D正确。
答案选B。
2.N A是阿伏加德罗常数的值,下列说法正确的是A. 10 gD2O中含有的质子数与中子数均为5N AB. 标准状况下,22.4LCHC13中含C-Cl键的数目为3N AC. 密闭容器中,1mol NH3和1molHCl反应后气体分子总数为N AD. l00mL1.0 mol/L FeC13溶液与足量Cu反应,电子转移数为0.2N A【答案】A【解析】【详解】A. 10 gD2O中含有的质子数与中子数均为5N A,选项A正确;B. CHC13标准状况下是液体,22.4LCHC13中含C-Cl键的数目大于3N A,选项B错误;C. NH3和HCl反应生成氯化铵固体,故1mol NH3和1molHCl反应后气体分子总数为0,选项C 错误;D. l00mL1.0 mol/L FeC13溶液与足量Cu反应,铁由+3价变为+2价,电子转移数为0.1N A,选项D错误。
答案选A。
【点睛】本题考查了阿伏加德罗常数的应用,主要考查气体摩尔体积的条件应用,质量换算物质的量计算微粒数,关键是D2O中质子数与中子数相同。
3.工业上用乙苯经催化脱氢生产苯乙烯,下列说法错误的是A. 乙苯可通过石油催化重整获得B. 乙苯的同分异构体超过四种C. 苯乙烯与氯化氢反应可生成氯代苯乙烯D. 乙苯和苯乙烯分子所有碳原子均可处于同一平面【答案】C【解析】【详解】A.石油催化重整可获得芳香烃,所以通常可通过石油的催化重整来获取乙苯,选项A正确;B.苯可连接乙基或2个甲基,2个甲基在苯环上有邻、间、对三种位置,则乙苯的同分异构体中属于芳香烃的共有四种,还有含有碳碳三键等链烃的同分异构体,故乙苯的同分异构体超过四种,选项B正确;C、苯乙烯与氯化氢发生加成反应,可生成氯代苯乙烷,选项C错误;D.乙苯中侧链2个C均为四面体构型,但碳碳单键可以旋转,分子内所有碳原子有可能共平面;苯乙烯中苯环、双键均为平面结构,分子内所有原子有可能共平面,选项D正确;答案选C。
4.联合国宣布2020年为“国际化学元素周期表年”。
元素W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为 18。
下列说法正确的是A. 简单氢化物沸点:Y>WB. 原子半径:Z>Y>XC. 氧化物的水化物的酸性:W<XD. 推测Z是半导体材料,Z与Y可形成化合物ZY4【答案】D【解析】【分析】元素W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为 18,设W的最外层电子数为x,则X、Y的最外层电子数分别为x+1、x+2,故x+x+1+x+2=18,解得x=5,故W、X、Y分别为N、S、Cl,因此可推知Z为Ge,据此分析。
【详解】元素W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为 18,设W的最外层电子数为x,则X、Y的最外层电子数分别为x+1、x+2,故x+x+1+x+2=18,解得x=5,故W、X、Y分别为N、S、Cl,因此可推知Z为Ge。
A. 由于NH3存在分子间氢键,简单氢化物的沸点: W > Y,选项A错误;B. 同周期元素从左到右原子半径依次减小,同主族元素从上而下原子半径依次增大,故原子半径:Z >X>Y,选项B错误;C. 元素非金属性越强,最高价氧化物的水化物的酸性越强,若不是最高价则不一定,如硝酸的酸性强于亚硫酸,选项C错误;D. 根据上述分析可知,Z是Ge,为半导体材料,Z与Y可形成化合物ZY4,即GeCl4,选项D 正确。
答案选D。
5.用下列实验装置进行相应实验,能达到实验目的的是A. 用装置甲过滤海带灰的浸泡液以获得含I-的溶液B. 用装置乙蒸干氯化铵饱和溶液制备NH4Cl晶体C. 用装置丙将Cl2与HCl混合气体纯化得到纯净的Cl2D. 用装置丁收集铜粉与稀硝酸反应产生的NO【答案】A【解析】【详解】A、海带灰的浸泡液用装置甲过滤可以获得含I-的溶液,选项A正确;B.NH4Cl受热易分解,应采用冷却热NH4Cl饱和溶液制备NH4Cl晶体,选项B错误;C、用装置丙只能将Cl2与HCl混合气体中的氯化氢除去,但没有干燥,不能得到纯净的Cl2,选项C错误;D、NO能与空气中的氧气反应生成二氧化氮,不能用排空气法收集,选项D错误。
答案选A。
6.镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。
下列说法错误的是A. 放电时,外电路电子由镁电极流向多孔碳材料电极B. 放电时,正极的电极反应式为O2+ 4e—+ 2H2O =4OH¯C. 理论上,外电路中流过2 mol电子时,负极质量增加58 gD. 电池反应产物Mg(OH)2经过灼烧与还原可制成镁锭循环利用【答案】C【解析】【分析】先根据题目叙述和对应的示意图,判断出电池的正负极,再根据正负极的反应要求进行电极反应方程式的书写。
【详解】A、通氧气的电极为正极,因为多孔碳电极为正极,放电时,外电路电子由镁电极流向多孔碳材料电极(由负极流向正极),选项A正确;B. 放电时,多孔碳电极为正极,碱性条件下正极上氧气得电子产生氢氧根离子,电极反应式为O2+ 4e-+ 2H2O =4OH-,选项B正确;C、根据负极反应式:Mg-2 e-+ 2 OH¯═Mg(OH)2,当外电路流过2mol电子时,负极质量增加34 g,选项C错误;D. 电池反应产物Mg(OH)2经过灼烧得到氧化镁,再还原可制成镁锭循环利用,选项D正确。
答案选D。
【点睛】本题考查原电池原理,关键是正负极的判断,很明显是空气中的氧气得电子,所以通氧气的为正极,单质镁就一定为负极,注意负极增加的是OH-的质量。
7.常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。
下列叙述错误的是A. K a(HA)的数量级为10-5B. N点,C. P—Q过程中,水的电离程度逐渐增大D. 当滴定至溶液呈中性时,c(A-)>c(HA)【答案】B【解析】【详解】A. 根据图a可知,中和百分数为50%时溶液的pH=4.74,此时溶液的组成为等物质的量浓度的NaA和HA,由于A-的水解和HA的电离都是微弱的,c(A-)≈c(HA),K a(HA)=,故K a(HA)的数量级为10-5,选项A正确;B. N点,根据电荷守恒有,即,选项B错误;C. P—Q过程中,随着氢氧化钠溶液的滴入,酸不断消耗,溶液的酸性逐渐减弱,水的电离程度逐渐增大,选项C正确;D. 根据图b可知当lg(即)时,溶液呈酸性,当滴定至溶液呈中性时,溶液中c(A-)>c(HA),选项D正确。
答案选B。
【点睛】本题考查了酸碱混合的定性判断及溶液电离平衡常数的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握水的电离及其影响,试题培养了学生的分析能力及灵活应用能力。
8.二氧化钒(VO2)是一种新型热敏材料。
+4价的钒化合物在弱酸性条件下易被氧化。
实验室以V2O5为原料合成用于制备VO2的氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:回答下列问题:(1) VOC12中V的化合价为 ________。
(2)步骤i中生成VOC12的同时生成一种无色无污染的气体,该化学方程式为___。
也可只用浓盐酸与V2O5来制备VOC12溶液,该法的缺点是 _______(3)步骤ii可在下图装置中进行。
①反应前应通入CO2数分钟的目的是 ________。
②装置B中的试剂是____。
(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量ag样品于锥形瓶中,用20mL蒸馏水与30 mL混酸溶解后,加0.02 mol/LKMnO4溶液至稍过量,充分反应后继续加1 %NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。
滴定反应为:VO2++Fe2++2H+=VO2++Fe3++H2O.①KMnO4溶液的作用是_______ 。
NaNO2溶液的作用是______ 。
②粗产品中钒的质量分数的表达式为_________ 。
【答案】 (1). +4 (2). 2V2O5+N2H4•2HCl+6HCl=4VOCl2+N2↑+6H2O (3). 有氯气生成,污染空气 (4). 排除装置中的空气,避免产物被氧化 (5). 饱和NaHCO3溶液 (6). 将+4的钒化合物氧化为VO2+ (7). 除去过量的KMnO4 (8).【解析】【详解】(1) 根据氧的化合价为-2,氯的化合价为-1,化合物中各元素化合价代数和为0可得,VOC12中V的化合价为+4价;(2)步骤i中V2O5中加入N2H4•2HCl和盐酸反应生成VOC12的同时生成一种无色无污染的气体,V2O5被还原为VOCl2,则气体为N2,反应的化学方程式为2V2O5+N2H4•2HCl+6HCl=4VOCl2+N2↑+6H2O;也可只用浓盐酸与V2O5来制备VOC12溶液,V2O5被还原为VOCl2,则浓盐酸被氧化有氯气生成,污染空气;(3)①+4价钒化合物在弱酸性条件下易被氧化,为防止+4价钒化合物被氧化,反应前应通入CO2数分钟排除装置中的空气,避免产物被氧化;②装置B中的试剂用于除去二氧化碳中的氯化氢气气,故所装试剂为饱和NaHCO3溶液;(4)测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量ag样品于锥形瓶中,用20mL蒸馏水与30 mL混酸溶解后,加0.02 mol/LKMnO4溶液至稍过量,充分反应后继续加1 %NaNO2溶液至稍过量,再用尿素除去过量的NaNO2,最后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。
