第19章 配位化合物
《配位化合物》课件

负离子
非金属元素形成的阴离子在配合物中带有负 电荷。
稀土金属配离子
稀土金属作为特殊的金属离子在配合物中具 有重要的应用价值。
配合物的合成方法
直接溶液法
通过将金属离子和配体直接 溶解在溶剂中形成配位化合 物。
配体置换法
通过将原有配体置换为新的 配体来合成具有不同结构和 性质的配位化合物。
3 重要性
配位化合物广泛应用于医药、化妆品、催化剂等众多领域。
配位基概述
配体定义
配体是指能够通过一个或多 个配位键与金属离子结合的 化学物质。
配位键
配位键是指配体与金属离子 之间共享的电子对。
配位数
配位数指配位中心金属离子 周围配位体的个数。
金属配离子概述
正离子
金属离子在配合物中带有正电荷。
零价配离子
气相法
通过在气相中使金属原子与 配体反应生成配位化合物。
配合物的分类
1 单核配合物
配位中心金属离子与多 个配体结合形成。
3 簇合物
多个金属离子通过配位 键相互连接形成。
配位数与配位几何
1
配位几何
2
配位几何是指配合物中配体排列的空
间结构。
3
六配体
4
六配体通常呈现八面体或六面体配位 几何。
《配位化合物》PPT课件
本课件旨在介绍配位化合物的基本概念和性质,以及其在不同领域的应用。 通过清晰的内容和生动的图像,希望您能对配位化合物有一个全面而深入的 了解。
初识配位化合物
1 定义
配位化合物是指通过配位键将中心金属离子与一个或多个配体结合形成的化合物。
2 历史
配位化合物的研究始于18世纪,为现代配位化学的奠基。
配位反应及配位滴定法

第九章 配位反应及配位滴定法配位化合物简称配合物,是一类组成比较复杂的化合物,它的存在和应用都很广泛。
生物体内的金属元素多以配合物的形式存在。
例如叶绿素是镁的配合物,植物的光合作用靠它来完成。
又如动物血液中的血红蛋白是铁的配合物,在血液中起着输送氧气的作用;动物体内的各种酶几乎都是以金属配合物形式存在的。
当今配合物广泛地渗透到分析化学、生物化学等领域。
我国著名科学家徐光宪教授作了如下的比喻:把21世纪的化学比作一个人,那么物理化学、理论化学和计算化学是脑袋,分析化学是耳目,配位化学是心腹,无机化学是左手,有机化学和高分子化学是右手,材料科学是左腿,生命科学是右腿,通过这两条腿使化学科学坚实地站在国家目标的地坪上。
配位化学是目前化学学科中最为活跃的研究领域之一。
本章将介绍配合物的基本概念、结构、性质和在定量分析化学中的应用。
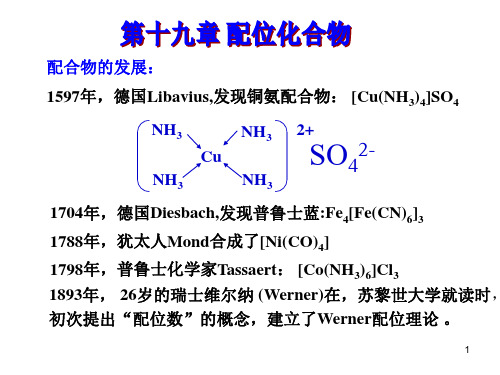
§9-1 配合物的组成与定义一、配合物及其组成例如在硫酸铜溶液中加入氨水,开始时有蓝色Cu 2(OH)2SO 4沉淀生成,当继续加氨水过量时,蓝色沉淀溶解变成深蓝色溶液。
总反应为:CuSO 4 + 4NH 3 = [Cu(NH 3)4]SO 4 (深蓝色)此时在溶液中,除SO 42-和[Cu(NH 3)4]2+外,几乎检查不出Cu 2+的存在。
再如,在HgCl 2溶液中加入KI ,开始形成桔黄色HgI 2沉淀,继续加KI 过量时,沉淀消失,变成无色的溶液。
HgCl 2 + 2KI = HgI 2↓+ 2KCl HgI 2 + 2KI = K 2[HgI 4]象[Cu(NH 3)4]SO 4和K 2[HgI 4]这类较复杂的化合物就是配合物。
配合物的定义可归纳为:由一个中心元素(离子或原子)和几个配体(阴离子或分子)以配位键相结合形成复杂离子(或分子),通常称这种复杂离子为配离子。
由配离子组成的化合物叫配合物。
在实际工作中一般把配离子也称配合物。
由中心离子和配体以配位键结合成的分子,如[Ni(CO)4]、[Co(NH 3)3Cl 3]也叫配合物。
第19章配位化合物-无机化学

(3) 键合异构
配体中有两个配位原子,但这两个原子不同 时配位,这样的配体称为两可配体。
如 NO2- 属于两可配体
N 为配位原子
硝基
O 为配位原子 亚硝基
— NO2- — ONO-
配位原子的不同导致 [ Co(NO2)(NH3)5 ]Cl2 和 [ Co(ONO)(NH3)5 ]Cl2
互为键合异构体
4p 4s 3d 杂化
sp3 3d
33
由于中心 sp3 杂化轨道在空间呈正四 面体分布,故 [ N(i CO)4 ] 形成正四面体 构型。
[ N(i CO)4 ] 中配体的电子对配入中 心的外层空轨道,即 ns np 杂化轨道,形 成外轨型配位化合物。
34
例19―1和例19―2的共同点是,配体的 孤对电子配入中心的外层轨道,形成外轨型 配位化合物。
Pt2+ 的电子构型 5d8 CN– 为强场配体,使 Pt2+ 的 8 个 d 电 子重排,空出的 1 个 5d 轨道参与杂化,中 心采取 dsp2 杂化。
38
6p 6s 5d 重排
6p 6s 5d 杂化
dsp2 5d
39
由于中心 dsp2 杂化轨道在空间呈正 方形分布,故 [ Pt(CN)4 ]2-形成正方形构 型。
例19―3 和例19―4,杂化轨道均用 到了(n―1)d 内层轨道, 配体的孤对 电子对配入中心的内层,形成内轨型配位 化合物,它较外轨型配位化合物稳定。
40
19―2―3 配位化合物的磁性
化合物中成单电子数和宏观实验现象中 的磁性有关。
测出物质的磁矩 和单电子数 n 有如
下关系
= n( n + 2) B 式中 B 是磁矩 的单位,称为玻尔磁子。
配位化合物知识总结

VS
磁性配合物在磁学、磁记录、信息存 储和分子基磁体等领域有广泛的应用 前景。
Part
04
配位化合物的应用
在化学反应中的作用
催化反应
配位化合物可以作为催化剂,通 过与反应物结合,改变反应途径,
降低反应活化能,从而加速化学 反应的进行。
分离和提纯
利用配位化合物的独特性质,如选 择性络合、稳定性差异等,可以实 现化学物质的分离和提纯。
配位化合物的稳定性取决于多个因素 ,包括中心离子的性质、配位体的类 型和数量、以及配位环境等。
稳定性规律
一般来说,中心离子的电荷数越高、 半径越小,配位化合物的稳定性越强 ;配位体的电子给予能力越强、数目 越多,稳定性也越高。
配位化合物的合成方法
有机合成
通过有机合成方法,可以制备出结构复杂、功能多样的配 位化合物。常见的合成方法包括重氮化反应、氧化还原反 应等。
配位化合物的分类
按中心原子分类
根据中心原子的种类,可以将配位化合物分为金属配位化合物和非金属配位化合物。金属配位化合物是指中心原 子为金属元素的配位化合物,如铜、钴、铁等;非金属配位化合物是指中心原子为非金属元素的配位化合物,如 硫、氮、磷等。
按配位数分类
根据配位数的大小,可以将配位化合物分为低配位数(2-4)和高配位数(≥6)的配位化合物。低配位数配位化 合物是指中心原子周围参与配位的配位体数目较少的配位化合物;高配位数配位化合物是指中心原子周围参与配 位的配位体数目较多的配位化合物。
02
动态配位化合物
03
超分子配位化合物
具有可逆的结构变化和反应性, 可用于传感器、分子机器等领域。
由多个分子或离子通过非共价相 互作用形成的复杂结构,具有独 特的物理和化学性质。
配位化合物

例4. 下列物质中具有顺磁性的( C )。
(A)[Co(NH3)6]3+ (C)[Cu(NH3)4]2+ (B)[Zn(NH3)4]2+ (D)[Ag(NH3)2]+
例5. Fe(en)32+ μ=5.5 , 判断该配离子杂化类型,空间 构型. 解: Fe2+ (3d6) 有4个成单电子, ∵μ=5.5≈4.90 , ∴ n=4 Fe2+的d轨道没有发生重排,其杂化类型为sp3d2,正八 面体.
Fe3+ 与CN-结合时, 能以d2sp3杂化方式参与组 成六个配位键,所形成的[Fe(CN)6]3-属内轨型.
3d d2sp3 4d
1.配位键型与配合物稳定性的关系: 当形成相同配位数的配离子时,一般内轨型要比 外轨型稳定. 2.配合物磁性: 物质的磁性可用磁矩µ 的大小来衡量. µ 反磁性(没有未成对的单电子) =0, µ 顺磁性(有未成对的单电子) >0,
dsp2
dsp3 d 4s sp3d2 d2sp3
Ni(CN)42–
Ni(CN)53– ,Fe(CO)5 TiF52– FeF63– ,AlF63- ,SiF62- ,PtCl64Fe (CN)63 – ,Co(NH3)6
6
【例】 MA2B2C2类型的化合物具有几种几何异构体?
C B A M C A B B A M B C A C A B M A C B C A C M A B C B A A M B C C B
9.配离子的电荷: 配离子的电荷等于中心离子和配位体电荷的 代数和
六氰合铁(III)酸钾:中心离子电荷为 +3,CN-带一个负电荷,配离子电荷数 为-3,正好与外层3个K+电荷平衡。
K3[Fe(CN)6]
配位化合物的命名

配位化合物的命名配位化合物的命名一般分为俗名和系统命名两大类。
本章主要参照IUPAC 无机物命名委员会所采用的命名法,讨论系统命名的基本原则。
1. 内外界顺序与一般无机物的命名原则相同。
若配离子为阳离子,外界离子在前,配离子在后,命名为“某化某”或“某酸某”;若配离子为阴离子,配离子在前,外界离子在后,命名为“某酸某”。
2. 内界中各物质的命名顺序为:配体数(汉字数字)—配体名称(不同配体间用中圆点分开)—合—中心原子名称—中心原子氧化值(罗马数字)。
3. 不同配体的先后顺序按下列原则进行命名:(1)若配离子中既有无机配体又有有机配体。
则无机配体排列在前,有机配体排列在后。
(2)若同时存在阴离子配体和中性分子配体,则先阴离子配体后中性分子配体。
(3)若都为同类配体,则按配位原子的元素符号在英文字母的顺序排列。
(4)若同类配体中配位原子相同,配体中含原子的数目也相同,则按在结构式中与配位原子相连的原子的元素符号的英文字母顺序排列。
(5)若同类配体中配位原子相同,配体中含原子的数目不同,则将较少原子数的配体排在前面,较多原子数的配体列后。
下面是一些配合物的命名实例:[Cu(NH3)4]2+ 四氨合铜(Ⅱ)离子[CoCl2(NH3)4]+二氯·四氨合钴(Ⅲ)离子[Fe(en)3]Cl3 三氯化三(乙二胺)合铁(Ⅲ)[Ag(NH3)2]OH 氢氧化二氨合银(I)H2[PtCl6] 六氯合铂(Ⅳ)酸[Co(ONO)(NH3)5]SO4 硫酸亚硝酸根·五氨合钴(Ⅲ)[Co(NH3)5(H2O)]2(SO4)3硫酸五氨·水合钴(Ⅲ)[Co(NH3)2(en)2]Cl3氯化二氨·二(乙二胺)合钴(Ⅲ)NH4[Co(NO2)4(NH3)2] 四硝基·二氨合钴(Ⅲ)酸铵NH4[Cr(NCS)4(NH3)2] 四(异硫氰酸根) ·二氨合铬(Ⅲ)酸铵没有外层的配合物,中心原子的氧化值可不必标明,如:[Ni(CO)4] 四羰基合镍[PtNH2(NO2)(NH3)2] 氨基·硝基·二氨合铂。
无机化学综合复习资料

元素无机化学
*
第12章 卤 素 小 结
1、掌握卤素元素的基本性质及氟的特殊性; 2、掌握卤素单质的制备及其反应方程式; 3、理解卤素单质及其重要化合物的氧化-还原性质: (1)卤素单质的氧化性及卤离子的还原性规律; (2)卤素的歧化与逆歧化反应及其发生的条件; (3)卤素含氧酸盐的氧化性规律及其理论解释; (4)氢卤酸及含盐酸的酸性及非金属性;
碱性增强
还原性增强 酸性增强
四、掌握VA-VIIA氢化物酸碱性、还原性变化规律
*
五、掌握NO(g)和NO2(g)分子结构和化学性质 1. 奇电子化合物,顺磁,双聚。 2. NO还原性为主,与Fe2+发生“棕色环反应”, 检NO3-。 3. NO2氧化性为主。 六、理解HNO2及其盐分子结构和化学性质 1. NO2-、O3、SO2等电子体; 2. 酸介质氧化性显著,碱介质还原性为主; 3. M-NO2-或M-ONO-; 4. NO2-、NO2、NO2+键级、键长、键角的比较。
电极反应: m (ox) + n e = q (red)
(五)多重平衡计算(重点)
*
氧化-还原平衡与电离平衡共存;
氧化-还原平衡与配位平衡共存;
氧化-还原平衡与沉-溶平衡共存;
3个或更多个平衡共存。
*
*
练习1:求 [Fe(CN)6)3-/ Fe(CN)6)4-](衍生电位) 已知: (Fe3+/Fe2+) = 0.77 V (母体电位),
*
(二)氧化还原反应概念和方程式的配平
*
氧化还原反应凡有电子得失或共用电子对偏移发生的反应。
氧化失去电子或共用电子对偏离的变化,相应的物质称为“还原剂”;
配位化合物命名

H
46
H
22
配位数 立体构型
三角双锥 5
四方锥 正八面体(Oh) 6
三角棱柱
中心金属原 子杂化轨道
dsp3或sp3d
d2sp3或sp3d2 d4sp
五角双锥
7 一面心三角棱柱
一面心八面体
H
结构举例 Ni(CN)53MnCl53-
[Re(S2C2Ph2)3] K3[UF7],[UO2F5]3-
[NbF7]2-,[TaF7]2[NbOF6]3-
• 配体是饱和的
• 中心原子有明确的氧化态
H
35
H
36
多齿配体
CH
N
CH
N
C
CH
HC
C
C
HC
C
CH
CH
CH
ortho-phenanthroline
邻-二氮杂菲
H2N-CH2-CH2-NH2
ethylenediamine
O
O
O C CH2
CH2 C O
N CH2 CH2 N
O C CH2
CH2 C O
H
14
配位数的大小取决于中心原子的大小。 各族元素都是原子序数较大,有较高的配位数
中心原子氧化数越高,配位数也越高 对任何一种中心原子,无固定的配位数 同一中心原子与不同配体键合时,配位数不一定相同
H
15
配位数
立体构型
中心金属原 子杂化轨道
中心原子
结构举例
2
直线形
sp或dp
限于IB、 +1的价金属离 [CuCl2]-、[Ag(NH3)2]+、
[Cr(NH3)6][Co(CN)6] 六氰合钴(III)酸六氨合铬(III)
无机化学下册:第十九章 配位化合物

特殊的稳定性
螯合物 Kf 一般配合物 Kf [Cu(en)2]2+ 1.0×1020 [Cu(NH3)4]2+ 2.09×1013 [Zn(en)2]2+ 6.8×1010 [Zn(NH3)4]2+ 2.88×109
[Co(en)2]2+ 6.6×1013 [Co(NH3)4]2+ 1.29×105 [Ni(en)2]2+ 2.1×1018 [Ni(NH3)4]2+ 5.50×108
几何构型 由于中心(原子或离子)的杂化轨道具有一定的伸展方 向性,使形成的配合物具有一定的几何构型。
形成配离子的轨道示意图 3d Fe3+ ↑ ↑ ↑↓ ↑ ↑ ↑ ↑↓ ↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ 4s 4p
螯合物比非螯形配合物稳定
多核配合物
两个或两个以上中心原子结合所形成的配合物。
5+
OH
(H3N)5Cr Cr(NH3)5
O C C O
O
2-
O
羰合物(羰基化合物)
以CO为配体的配合物
M←C间的σ键—C原子提供孤对电子,中心金属原子提 供空杂化轨道
M→C的反馈π键—CO分子提供空的π*(2p)反键轨道,金 属原子提供d轨道上的孤电子对。
(sp-sp反键)
(二重简并)
(sp(C))
(二重简并)
(sp-sp成键)
(sp(O))
原子簇状化合物(簇合物)
具有金属-金属(M-M键)直接结合而形成的化合物。
同多酸、杂多酸型配合物
同多酸型配合物-有多核配离子形成的同多酸及 其盐。 K2Cr2O7,其中Cr2O72-为多核离子
杂多酸型配合物——由不同酸根组成的配合物
1第19章 配位化合物习题(2)配合物平衡

配位化合物之配位平衡习题目录一判断题;二选择题;三填空题;四计算和回答问题一判断题(返回目录)1 在1.0L0.10mol·L-1[Ag(NH3)2]Cl溶液中,通入2.0molNH3(g)达到平衡时各物质浓度大小的关系是c(NH3)>c(Cl-)≈c([Ag(NH3)2]+)>c(Ag+)。
()2 某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K=K·K·K·K。
()3 某配离子的逐级不稳定常数分别为K、K、K、K,则该配离子总的稳定常数K=1/(K·K·K·K)。
()4 在1.0L6.0mol·L-1氨水溶液中溶解0.10molCuSO4固体,假定Cu2+全部生成[Cu(NH3)4]2+,则平衡时NH3的浓度至少为5.6mol·L-1。
()5 金属离子A3+、B2+可分别形成[A(NH3)6]3+和[B(NH3)6]2+,它们的稳定常数依次为4⨯105和2⨯1010,则相同浓度的[A(NH3)6]3+和[B(NH3)6]2+溶液中,A3+和B2+的浓度关系是c(A3+)>c(B2+)。
()6 已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
()7 对于电对Ag+/Ag来说,当Ag(Ⅰ)生成配离子时,Ag的还原性将增强。
()8 对于电对Cu2+/Cu来说,当Cu(Ⅱ)生成配离子时,Cu(Ⅱ)的氧化性将增强。
()9 在某些金属的难溶盐中,加入含有可与该金属离子配位的试剂时,有可能使金属难溶盐的溶解度增大。
()10 所有物质都会因生成某一配合物而使溶解度增大。
()11 所有配合物在水中都有较大的溶解度。
()12 在含有少量AgCl沉淀的溶液中,加入适量的氨水,可以使AgCl溶解,如果再加入适量的HNO3溶液,又可看到AgCl沉淀生成。
第十九章配合物

例:
o /J
P/J 场
Co3+的价电子构型
[Co(CN)6]367.524 ×10-20 35.250 ×10-20
[CoF 6] 325.818 ×10-20 35.250 ×10-20
八面体场中 d 电子排布 未成对电子数 实测磁矩/B.M 自旋状态 杂化方式
0
5.62
解:
o /J
P/J 场
(1) 中心M离子: 电荷Z增大, o增大
主量子数n增大, o增大 [Cr(H2O)6]3+ [Cr(H2O) 6]2+ 17600 14000 [Fe(H2O) 6]3+ [Fe(H2O) 6]2+ 13700 10400 [CrCl6]313600 [MoCl6]319200
o /cm-1
有内层轨道参与杂 (2)内轨型配合物:
化而形成的配合物 如;dsp2杂化 d2sp3杂化
特点:中心离子原有电子构型发生变化, 未成对电子数减少。 即:磁矩减小(有抗磁性),稳定性强。
4. 如何判断外轨型配合物和内轨型配合物 依据:由磁性进行判断
(1)由磁矩计算出未成对电子数
(2)磁矩: n (n 2)
(3)八面体场中心离子的d 电子分布
a.排布原则:(1)能量最低原理 (2)Hund规则 (3)Pauli不相容原理 b.电子成对能(Ep):两个电子进入同一轨 道时需要消耗的能量。 c. 强场:o > Ep 弱场:o < Ep
八面体场中电子在t2g和eg轨道中的分布
八面体场中电子在t2g和eg轨道中的分布
Ag ( NH 3 ) 2 Cl 一氯化二氨合银(Ⅰ) Cu( NH 3 ) 4 SO4 硫酸四氨合铜(Ⅱ) 2 Cu( NH 3 ) 4 四氨合银铜(Ⅱ)配阳离子 Co( NH 3 )5 ( H 2O)Cl3
配位化合物

6 配位体异构
这是由于配位体本身存在异构体, 导致配合单 元互为异构。如: 1, 3-二氨基丙烷(H2N-CH2-CH2-CH2-NH2) 1, 2-二氨基丙烷(H2N-CH2-CH(NH2)-CH3) 是异构的配位体, 它们形成的化合物 [Co(H2N-CH2-CH2 -CH2-NH2)Cl2]及 [Co(H2N-CH2-CH(NH2)-CH3)Cl2]互为异构体。
配位化合物
二、配位化合物的异构现象
配位化合物有两种类型的异构现象:
化学结构异构(构造异构)
立体异构
化学结构异构是化学式相同, 原子排列次序不同的 异构体。 立体异构是化学式和原子排列次序都相同 , 仅原子
在空间的排列不同的异构体。包括几何异构和光学异
构。
(一) 配合物的立体异构
一般分为 : 几何异构和对映异构体(或旋光 异构)两类
象称为顺-反异构。
配体如果处于相邻的位置, 称之为顺式结构; 如果 配体处于相对的位置, 称之为反式结构。 配位数为2的配合物, 配体只有相对的位置, 没有顺 式结构, 配位数为3和配位数为4的四面体, 所有的配
位位置都是相邻的, 因而不存在反式异构体.
平面四边形和八面体配位化合物中, 顺-反异构
是很常见的。
H2O
N
N-N 对位
N
O
N
N
O
O
N
Cu O
H2O
H2 O
H2O
H2 O
O
Cu N O
N
Cu N O
H2O
Hቤተ መጻሕፍቲ ባይዱ O
H2O
Cu H2 O O
N
N
N-O 对位
O-O 对位
3) 手性配体的配位使配合物具有手性
配位化合物的结构

cM M cL L
3. 螯合配位体:一个配位体的几个配位点能直接和同一个金属离子配位。
不带电的单核螯合分子,水中难溶,易溶于有机溶液中,常作萃取络合剂, (如:乙酰丙酮铝Al(acac)3 ,) 带电的单核螯合离子一般很难从水中沉淀出来,这种配位体可作掩蔽剂,如 酒石酸盐、EDTA等都是这类掩蔽剂。
★右图示出[Co(EDTA)]-配位 离子中,一个EDTA螯合配位 体和Co3+螯合的情况。
第六章
配位化合物的结构和性质
6.1 概述
●配位化合物:又称络合物,是一类含有中心金属原子(M)和若干配位体 (L)的化合物(MLn )。 ★中心原子M通常是过渡金属元素的原子(或离子),具有空的价轨道。 ★配位体L则有一对或一对以上孤对电子。 ★ M和L之间通过配位键结合,成为带电的配位离子,配位离子与荷异性电荷 的离子结合,形成配位化合物。
配位离子的电子组态和几何构型
配位离子 Fe(CN)64-
3d
Co(NH3)63+
Co(CN)64-
Ni(CN)42FeF63Ni(NH3)62+
4s 4p 5s
杂化轨道 几何形状
d2sp3 d2sp3
八面体 八面体
d2sp3
八面体
dsp2
平面四方
—
八面体
—
八面体
2. 晶体场理论 ●晶体场理论的内容:
●金属离子和不同的配位体结合后,性质不相同,可以进行溶解、沉淀、萃取, 以达到合成制备、分离提纯、分析化验等目的。
●配位化学是湿法冶金的重要基础。
1. 配位体
●每个配位体至少有一个原子具有一对(或多对)孤对电子,或分子中有π 电 子。如,N、O、C、P、S、Cl、F等。
19.第十九章 配位化合物
4
4 5
正四面体
四方形 三角双锥
sp3
dsp2 dsp3
Zn(NH3)42+
Ni(CN)42Ni(CN)53-
Cd(CN)42Fe(CO)5
5
6 6
四方锥
八面体 八面体
d4s
sp3d2 d2sp3
TiF52FeF63- AlF63- SiF62- PtCl64Fe (CN)63 Co(NH3)6
四方形和八面体配合物,含2种以上配位体时,有同分异构体。
4
(2)L-配位体ligand(提供电子对)P862表19-1 配位体中与中心离子(或原子)直接相连的原子叫配位原子。 1个配位原子仅提供一对电子(或电子对),形成配位键。
各种配位体(p862表19-1):
单基(齿)配体:指仅含一个配位原子的离子或分子,如:
X OH C N SCN CO NO H2 O NH3 NCS
(2) 配合物的异构现象 化学式相同,而结构不同的化合物其性质不同,这种现 象叫同分异构(分为立体异构、结构异构)。 ① 顺反异构(属于立体异构) 四方形 [Pt(NH3)2Cl2]的顺反异构:
棕黄色,m > 0 S = 0.2523 g/100g H2O 具抗癌活性 (干扰DNA复制)
淡黄色,m = 0 S = 0.0366 g/100g H2O 不具抗癌活性
其中 2 个 N ,4 个 -COO中的 O- 均可配位。
HOOCH2C
CH2COOH
(3)配位数(P846) 直接与中心离子(或原子)相连的配位原子的数目叫配位数 。 ① 配位体为单基配体时:配位数=配位体数 如:[HgI4]2-、[Ag(NH3)2]+、[Fe(SCN)6]3-
(完整版)配位化合物习题(1)

第19章配位化合物习题目录一判断题;二选择题;三填空题;四计算并回答问题一判断题(返回目录)1 价键理论认为,配合物具有不同的空间构型是由于中心离子(或原子)采用不同杂化轨道与配体成键的结果。
()2 价键理论能够较好地说明配合物的配位数、空间构型、磁性和稳定性,也能解释配合物的颜色。
()3 价键理论认为,在配合物形成时由配体提供孤对电子进入中心离子(或原子)的空的价电子轨道而形成配位键。
()4 同一元素带有不同电荷的离子作为中心离子,与相同配体形成配合物时,中心离子的电荷越多,其配位数一般也越大。
()5 在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。
因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。
()6 所有八面体构型的配合物比平面四方形的稳定性强。
()7 所有金属离子的氨配合物在水中都能稳定存在。
()8 价键理论认为,所有中心离子(或原子)都既能形成内轨型配合物,又能形成外轨型配合物。
()9 所有内轨型配合物都呈反磁性,所有外轨型配合物都呈顺磁性。
()10 内轨型配合物往往比外轨型配合物稳定,螯合物比简单配合物稳定,则螯合物必定是内轨型配合物。
()11 内轨型配合物的稳定常数一定大于外轨型配合物的稳定常数。
()12 不论配合物的中心离子采取d2sp3或是sp3d2杂化轨道成键,其空间构型均为八面体形。
13 [Fe(CN)6]3-和[FeF6]3-的空间构型都为八面体形,但中心离子的轨道杂化方式不同。
()14 [Fe(CN)6]3-是内轨型配合物,呈反磁性,磁矩为0。
()15 K3[FeF6]和K3[Fe(CN)6]都呈顺磁性。
()16 Fe2+的六配位配合物都是反磁性的。
()17 在配离子[AlCl 4]-和[Al(OH)4]-中,Al 3+的杂化轨道不同,这两种配离子的空间构型也不同。
()18 已知E (Cu 2+/Cu) = 0.337V ,E ([Cu(NH 3)4]2+/Cu) = -0.048V ,则E ([Cu(CN)4]2-/Cu) < -0.048V 。
配位化合物

课后练习: 课后练习:
一、指出下列配合物的中心离子(或原子)、配体、 配位数、配离子电荷及名称: 1. [Cu(NH3)4](OH)2; 2. [CrCl(NH3)5]Cl2;
3. [CoCl(NH3)(en)2]Cl2; 4. [PtCl2(OH)2(NH3)2]; 5. Ni(CO)4; 6. K3[Fe(CN)5(CO)]
配 位 原 子
C
N P
O S
H F C l B r
(2)配体 )
单齿配体 N ( 一个配位原子 CO 一个配位原子) (羰基) O(硝基) H O
X
• • • • • • − 2 2 • −
内界
O H− (羟基) C N− SCN− (硫氰根) N H3
•
配体的 分类: 分类:
N CS− (异硫氰根)
中心原子绝大多数是带正电荷的阳离子, 中心原子绝大多数是带正电荷的阳离子,其中 以过渡金属离子居多, 以过渡金属离子居多,如Fe3+、Cu2+、Co2+、Ag+ 区金属离子); 等(d区、ds区、 f区、 p区金属离子); 区 区 区 区金属离子 少数高氧化态的非金属元素也可作中心原子, 少数高氧化态的非金属元素也可作中心原子, 中的B(Ⅲ 、 Ⅳ 等 如BF4-、SiF62-中的 Ⅲ)、Si(Ⅳ)等。
二、命名下列各配合物和配离子
1. (NH4)3[SbCl6] 2. Li[AlH4] 3. [Cr(H2O)(en)(C2O4)(OH)] 4. [Co(H2O)4Cl2]Cl 5. [Cr(H2O)4Br2]Br·2H2O 6. [Co(en)3]Cl3 7. [Cr(Py)2(H2O)Cl3] 8. [Ni(NH3)2(C2O4)]
配位化合物知识总结

Ni(CO)4 都是配位化合物。关键在于是否含有配位单元。
2 组成 (Composition)
(1) 内界与外界 内界是配位单元,外界是简单离子。
[Co(NH3)6] Cl3
K3[Cr(CN)6]
内界 外界
外界 内界
可以无外界,如 Ni(CO)4 。但不能没有内界 。 内外界 之间是完全电离的。
[Co(NH3)5H2O]Cl3 三氯化五氨·水合钴 ( III )
3 配体的名称
4 配体的先后顺序 下述的每条规定均在其前一条的基础上: 1° 先无机配体后有机配体。 PtCl2( Ph3P)2 二氯 ·二 (三苯基膦)合铂(II)
2° 先阴离子类配体,后阳离子类配体,最后分子类配体 。 K [ PtCl3(NH3)] 三氯 ·氨合铂 ( II ) 酸钾
Fe(CO) 5
Co(NO 2 ) 3 (NH 3 ) 3
Ca(EDTA)
2
硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾 六氯合铂(Ⅳ)酸 氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾 硝酸羟基•三水合锌(Ⅱ) (三)氯化五氨•水合钴(Ⅲ) 五羰(基)合铁 三硝基•三氨合钴(Ⅲ) 乙二胺四乙酸根合钙(Ⅱ)
价键理论 (Valence Bond Theory)
同一原子内,轨道的杂化和不同原子间轨道的重 叠构成了共价键理论的核心论点之一。这里把s-p 杂化轨道扩大到d轨道上,形成s-p-d杂化轨道。
价键理论的要点: 1. 形成体(M):有空轨道
配位体(L):有孤对电子 二者形成配位键ML 2. 形成体(中心离子)采用杂化轨道成键 3. 杂化方式与空间构型有关
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 中心离子的配位数影响因素:中心离子和配位体的电荷、体积、 电子层结构以及它们之间相互影响的情况和配合物形成时的条件, 特别是浓度和温度。 • 通常中心离子的电荷越高,则吸引配位体的数目越多。不同电荷 的中心离子与电荷为-1的配位离子所形成的配合物,较常见的 配位数如下: • 中心离子电荷 +1 +2 +3 +4 • 常见的配位数 2 4(6) 6(4) 6(8) • 配位体的负电荷增加时,总结果使配位数减小,如Zn(NH3)62+和 Zn(CN)42-,SiF62-和SiO44-。 • 中心离子的半径越大,往往配位数也越大,如AlF63-、BF4-。 但如中心离子的半径过大,反而会减弱它和配位体的结合,使配 位数降低,如CdCl64-和HgCl42-。 • 配位体的半径越大,配位数越小。如AlF63-、AlCl4-和AlBr4-。 • 一般来讲,增大配位体的浓度,有利于形成高配位数的配合物, 如Fe(SCN)n3-n (n=1-6)。 • 温度升高时,常使配位数减小。 • 通常在一定范围的外界条件下,某一中心离子有一个特征的配位 数。
二、配位化合物的组成
内界(配离子) 外界离子 [Co(NH3)6]Cl3 中心离子 配位体 配位数
1. 中心离子(或原子)
配合物的中心一般都是带正电的阳离子,但也有电中性的原子 甚至还有极少数的阴离子,如:Fe(CO)5、Cr(CO)6、 HCo(CO)4。配合物的中心绝大多数是金属离子,而过渡金属离 子最常见,此外,少数高氧化态的非金属元素也能作中心离子, 如SiF62-、PF6-。
μ s=√n(n+2) μ B μ B 单位为玻尔磁子(B.M.) , eh 1 B.M.= 2mc
第十九章 配位化合物
§19-1 配位化合物的基本概念
一、配位化合物的定义
由中心原子(或离子)和配位体(阴离子或分子)以配 位键的形式结合而成的复杂离子(或分子),通常称这 种复杂离子为配位单元。凡是含有配位单元的化合物都 称配合物。
• [Co(NH3)6]Cl3和K2[HgI4] 配离子存在于晶体及水溶液 中 • LiCl· CuCl2· 2O和KCl· 3H CuCl2 只有在晶体中存在 CuCl3-配离子 • 光卤石KCl· MgCl2· 2O和钾镁矾K2SO4· 6H MgSO4· 2O 6H 在晶体及水溶液中均不存在配离子,是复盐但不属于配 合物
3. 中心离子利用哪些空轨道进行杂化,与中心离子的电 子层结构及配位体中配位原子的电负性有关。杂化方 式有两种: (a)配位原子的电负性很大,如卤素、氧等,中心离子 仅用外层空轨道ns,np,nd进行杂化,得到外轨型配合 物。高自旋。
如:[FeF6]3-配离子 Fe3+: [FeF6]3: sp3d2 杂化 外轨型配合物的键能小,不稳定,在水中易离解。
2. 配位体
• 配位体可为阴离子如X-、OH-、CN-、RCOO-、C2O42-、 PO43-,也可为中性分子如H2O、NH3、CO、醇、胺、醚等。 • 配位体中直接与中心离子(或原子)配合的原子,叫配位原子。 配位原子必须含有孤对电子,配位原子常为第五到第七主族的元 素。 • 单基配位体(一齿体):只含一个配位原了的配位体。如H2O、 NH3、X-。 • 多基配位体(多齿体):含有多个配位原子的配位体。这类多基 配位体能与中心原子(离子)形成环状结构,因此被称为螯合剂。 如C2O42-、H2N-CH2-CH2-NH2(简写为en)
同种配体全在顺位,二者互成镜影
配合物内界组成同异构体数量的关系
配合单元类 立体异构 型 体数目 MX4 1 MX3Y 1 MX2Y2 2 MX2YZ 2 MXYZK 3 MX6 1 配合单元类 型 MX5Y MX4Y2 MX3Y3 MX4YZ MX3Y2Z MX2Y2Z2 立体异构 体数目 1 2 2 2 3 5
例:[PtBrCl(NH3)Py]有三种异构体,可知为平面正方形 结构。
§19-2 配合物的化学键理论
一、价键理论 主要内容如下: 1. 中心离子(或原子)M必须具有空轨道,以接纳配位体授予 的孤电子对,形成s配位共价键(M←L),简称 s 配键。
2. 当配位体接近中心离子时,为增加成键能力,中心离子或原子 M用能量相近的空轨道(如第一过渡系列的3d,4s,4p,4d)杂 化,配位体的孤电子对填到中心离子或原子已杂化的空轨道 中形成配离子。配离子的空间结构、配位数及稳定性等主要 决定于杂化轨道的数目和类型。
4. 多酸型配合物
若一个含氧酸中的O2-被另一含氧酸取代,则形成多酸型配合物,若二个含氧 酸根相同,则形成的酸为同多酸如P2O72-,若酸根中的一个O2-被其它酸取代, 则形成杂多酸,如PO43-中的一个O2-被Mo3O102-取代成[PO3(Mo3O10)]3-。 多酸型配合物是多核配合物的特例。多酸氧化能力增强,可用于氧化反应中。
四、配合物的类型 1. 简单配位化合物 指由单基配位体与中心离子配位而成的配合物,也称维 尔纳型配合物。在溶液中逐级电离成配位数不同的配离 子。 2. 螯合物 具有环状结构的配合物叫螯合物或内配合物。
如: H2 H2 H2C-N N-CH2 Cu H2C-N N-CH2 H2 H2
2+
H2 O=C-O N-CH2 Cu H2C-N O-C=O H2
O H2N-(CH2)2-NH2 O M M C―C O O
• 有些配位体虽然也具有两个或多个配位原子,但在一定条件下, 仅有一种配位原子与金属配位,这类配位体称为两可配位体。如 硝基(-NO2-,以N配位)与亚硝基(-O-N=O-,以O配 位),硫氰根(SCN-,以S配位)与异硫氰根(NCS-,以N配 位)。 • 配合物内界中的配位体种类可相同,也可不同。 • 配位体中多数是向中心离子(或原子)提供孤电子对,但没有孤 电子对的配位体却能提供出π键上的电子,如C2H4、环戊二烯离 子(C5H5-)、苯等。 3. 配位数 • 直接同中心离子(或原子)配位的原子数目叫中心离子(或原 子)的配位数。 • 配位数与配位体的数目不一定相等。 • 中心离子的配位数一般为2、4、6、8等,其中最常见的是4和6, 5和7的不常见。
配合物内界的命名顺序: 配位体数→配位体名称→合→中心离子(氧化数)。如: Cu(NH3)42+叫做四氨合铜(II)离子 若配离子中的配体不止一种,则命名顺序为: 1. 无机配体在前,有机配体在后; 2. 同为无机配体或同为有机配体,先负离子,而后中性分子; 3. 同类配体的名称按配位原子的元素符号在英文字母中的顺序排列; 4. 同类配体若配位原子相同,则含原子数少的配体排在前面; 5. 同类配体,若配体中含有原子数目相同,则在配体结构式中与配位原子相连 的原子的元素符号在英文字母中排在前面的先读。 例:H[AuCl4] 四氯合金(Ⅲ)酸 K2[Co(SO4)2] 二硫酸根合钴(II)酸钾 [CrCl2(NH3)4]Cl· 2O 二水合一氯化二氯四氨合铬(Ⅲ) 2H CiS-[PtCl2(Ph3P)2] 顺式二氯二(三苯基膦)合铂(II) K[PtCl3NH3] 三氯一氨合铂(II)酸钾 [Co(NH3)5H2O]Cl3 三氯化五氨一水合钴(Ⅲ) [Pt(NO2)(NH3)(NH2OH)(Py)]Cl 一氯化一硝基一氨一羟胺一吡啶合铂(II) [Pt(NH2)(NO2)(NH3)2] 一氨基一硝基二氨合铂(II) Co2(CO)8 八羰合二钴
(b)配位原子的电负性较小,如C(CN-,以C配位)、N(- NO2-,以N 配位)等,用(n-1)d,ns,np轨道杂化,形成内轨型 配合物。低自旋。
如:[Fe(CN)6]3-配离子
d2sp3 杂化 内轨型配合物的键能大,稳定,在水中不易离解。
例:[Ni(CN)4]2内轨型配合物,Ni2+:dsp2杂化,配离子为平面正方形。 [NiCl4]2外轨型配合物,Ni2+:sp3杂化,配离子为四面体形 形成内轨型配合物时,要违反洪特规则使原来的成单电子强行在 同一d轨道中配对,在同一轨道中电子配对所需要的能量,叫做 成对能(用P表示)。
杂化轨道类型与配合单元空间结构的关系
配位数 杂化轨道 空间结构 2 sp
直线 形
3 sp2
平面三 角形
4 sp3
四面体
4 dsp2 或 sp2d
正方形
5 dsp3 或 sp3d2
正八面体
• 如何判断配合物是内轨型还是外轨型? 按磁矩大小来判断。物质的永磁矩 与原子或分子中未 成对电子数n有如下近似关系:
2. 配合物的异构现象
化学式相同而结构不同的化合物其性质必然不同,这种现象叫做同分异构现 象。这些化合物称为同分异构体。 配位体在中心原子周围因排列方式不同而产生的异构现象叫立体异构现象,它 包括顺-反异构与旋光异构。 (a)顺-反异构 顺式:同种配位体处于相邻位置 反式:同种配位体处于对角位置
例:平面正方形的[PtCl2(NH3)2]有两种异构体: H3N Cl H 3N Cl Pt Pt H3N Cl Cl NH3 顺式 反式 顺式:棕黄色,>,时溶解度为g/100g 水,经 Ag2O 处理后转变为顺式 [Pt(OH)2(NH3)2],两相邻氢氧根可被草酸根离子取代成[Pt(NH3)2C2O4]。 反式:淡黄色,=,时溶解度为g/100g 水,经 Ag2O 处理后转变为反式 [Pt(OH)2(NH3)2],两氢氧根处于对角位置,不与草酸根离子起反应。
五、空间结构与异构现象 1. 配合单元的空间结构 为减小配体间的排斥作用,配位体要互相尽量远离,因 而在中心原子周围采取对称分布的状态。
不同配位数的配合单元的空间结构
配位数 2 3 4 5 6 7 配合单元的空间结构 直线形 平面三角形 四面体 平面正方形 三角双锥 四方锥形 正八面体 五角双锥 实 例 Ag(NH3)2+,Ag(CN)2HgI3-(极少) ZnCl42-,Cd(NH3)42+,Cd(CN)42-,CoCl42PtCl42-,PdCl42-,[PtCl2(NH3)2],Ni(CN)42Fe(CO)5,CuCl53-,Ni(CN)53-(极少) [VO(AcAc)2],[Ni(PEt3)2Br3](Et=C2H5-) Co(NH3)63+,PtCl62-,AlF63-…… ZrF73-,UF73-,[UO2F5]3-(较少)
