离子晶体(优秀版)ppt课件
合集下载
离子晶体PPT下载优秀课件2

返回
食盐硬度
食盐熔点
返回
返回
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
离子晶体熔、沸点的高低取决于离子键 的强弱,而离子晶体的稳定性又取决于 什么?在离子晶体中,构成晶体的粒子和 构成离子键的粒子是相同的,即都是阴、 阳离子。离子晶体发生三态变化,破坏 的是离子键。也就是离子键强弱即决定 了晶体熔、沸点的高低,又决定了晶体 稳定性的强弱。
一般地讲,化学式与结构相似的离子晶 体,阴、阳离子半径越小,离子电荷数 越高,离子键越强,熔、沸点越高。
练习
某物质的晶体中含A、B、C三种元素,其排 列方式如图所示(其中前后两面心上的B原子 未能画出),晶体中A、B、C的中原子个数之 比依次为 A.1:3:1 B.2:3:1 C.2:2:1 D.1:3:3
A
练习
NaF,NaI,MgO均为离子化合物,根据下列数据,
这三种化合物的熔点高低顺序是( B )
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
食盐硬度
食盐熔点
返回
返回
1.我公司将积极配合监理工程师及现 场监理 工程师 代表履 行他们 的职责 和权力 。
2.我公司在开工前,将根据合同中明 确规定 的永久 性工程 图纸, 施工进 度计划 ,施工 组织设 计等文 件及时 提交给 监理工 程师批 准。以 使监理 工程师 对该项 设计的 适用性 和完备 性进行 审查并 满意所 必需的 图纸、 规范、 计算书 及其他 资料; 也使招 标人能 操作、 维修、 拆除、 组装及 调整所 设计的 永久性 工程。
离子晶体熔、沸点的高低取决于离子键 的强弱,而离子晶体的稳定性又取决于 什么?在离子晶体中,构成晶体的粒子和 构成离子键的粒子是相同的,即都是阴、 阳离子。离子晶体发生三态变化,破坏 的是离子键。也就是离子键强弱即决定 了晶体熔、沸点的高低,又决定了晶体 稳定性的强弱。
一般地讲,化学式与结构相似的离子晶 体,阴、阳离子半径越小,离子电荷数 越高,离子键越强,熔、沸点越高。
练习
某物质的晶体中含A、B、C三种元素,其排 列方式如图所示(其中前后两面心上的B原子 未能画出),晶体中A、B、C的中原子个数之 比依次为 A.1:3:1 B.2:3:1 C.2:2:1 D.1:3:3
A
练习
NaF,NaI,MgO均为离子化合物,根据下列数据,
这三种化合物的熔点高低顺序是( B )
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
《离子晶体》完美版课件1

离子晶体中离子的配位数(C.N.)是指一个 离子周围最邻近的异电性离子的数目
③阴、阳离子的配位 数
都是 6 ④每个Na+同时吸引的6
个Cl-围成的空间结构 是__正_八__面____
体
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
(3)等距离相邻的离子: 与一个Na+相邻最近 且距离相等的Na+有 多少个?
---Cl— ---Cs+
①每个Cs+相邻最近且距离相等的Cl—有_8___个 每个Cl—相邻最近且距离相等的有_8___个
②阴、阳离子的配位数都是 8
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
(3)等距离相邻的离子:
与Cs+等距离且最近的 Cs+有几个、与Cl—等 距离且最近的Cl—各 有几个?
强碱: KOH、Ca(OH)2、Ba(OH)2、NaOH
活泼金属氧化物: K2O、CaO、BaO、
Na2O2、MgO、Al2O3 K、Ca、Ba、Na、Mg
部分盐类: NaCl、MgSO4、CsCl、
CaF2 KNO3 、CaCO3、
同种元素形成的晶体可以是不同的晶体类型
(1)AlCl3 分子晶体
熔沸点 MgO >NaCl NaCl >CsCl
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
(2)离子晶体硬而脆
当晶体受到冲击作用力时,部分离 子键发生断裂,各层离子的位置会 发生错动,导致晶体易破碎。
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
①取一支试管,加入
③阴、阳离子的配位 数
都是 6 ④每个Na+同时吸引的6
个Cl-围成的空间结构 是__正_八__面____
体
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
(3)等距离相邻的离子: 与一个Na+相邻最近 且距离相等的Na+有 多少个?
---Cl— ---Cs+
①每个Cs+相邻最近且距离相等的Cl—有_8___个 每个Cl—相邻最近且距离相等的有_8___个
②阴、阳离子的配位数都是 8
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
(3)等距离相邻的离子:
与Cs+等距离且最近的 Cs+有几个、与Cl—等 距离且最近的Cl—各 有几个?
强碱: KOH、Ca(OH)2、Ba(OH)2、NaOH
活泼金属氧化物: K2O、CaO、BaO、
Na2O2、MgO、Al2O3 K、Ca、Ba、Na、Mg
部分盐类: NaCl、MgSO4、CsCl、
CaF2 KNO3 、CaCO3、
同种元素形成的晶体可以是不同的晶体类型
(1)AlCl3 分子晶体
熔沸点 MgO >NaCl NaCl >CsCl
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
(2)离子晶体硬而脆
当晶体受到冲击作用力时,部分离 子键发生断裂,各层离子的位置会 发生错动,导致晶体易破碎。
人教版化学选修三3.4离子晶体_2
人教版化学选修三3.4离子晶体_2
①取一支试管,加入
离子晶体ppt推荐人教版高中化学选修三
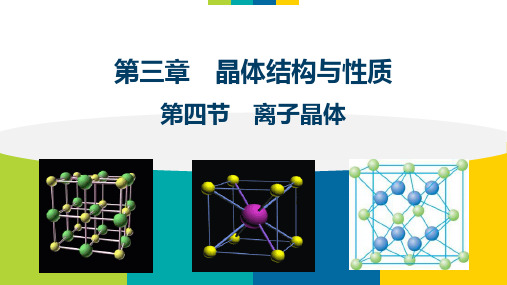
(3)CaF2晶体
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
④Ca2+的配位数: 8
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
二、典型的离子晶胞
(3)CaF2晶体
④F-的配位数: 4
Ca2+
F-
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
③在每个Cl-周围距离相等且 最近的Cs+共有 8 个;
④与Cs+ 最近且等距离的Cs+有 6 个,与Cl-最近 等距离的Cl-有 6 个
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
二、典型的离子晶胞
(3)CaF2晶体
科学探究 1.找出NaCl、CsCl两种离子晶体中阳离 子和阴离子的配位数,它们是否相等?
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
二、典型的离子晶胞
NaCl
CsCl
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
CaF2
ZnS
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
1.下列性质中,可以证明某化合物内一定 存在离子键的是( D ) A.晶体可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电 2. 离子晶体不可能具有的性质是( B ) A. 较高的熔、沸点 B. 良好的导电性 C. 溶于极性溶剂 D. 坚硬而易粉碎
《离子晶体》优质课件1

判断下列晶体的类型?
物质 铜
干冰
金刚石 氯化钠
晶体 类型
金属晶体
分子晶体
原子晶体
思考与交流:
氯化钠晶体的构成微粒是什么? 构成晶体的微粒间的相互作用力是什么?
夯实基础:
一、离子晶体的相关概念
离 子 二、离子晶体判定方法
晶 体
三、离子晶体熔沸点高低的判定
四、晶格能
一、离子晶体
1.定义:由阳离子和阴离子通过离子键结合而 成的晶体。
人教版化学选修三第三章第三节离子 晶体
6.离子晶体的结构特点 (1).阴阳离子间只存在离子键;
(2).不存在小分子,为“巨分子”,化学式仅表 示晶体中阴阳离子个数比的最简比;
(3).阴阳离子采用不等直径圆球的密堆积方式。
人教版化学选修三第三章第三节离子 晶体
科学探究: NaCl和CsCl的结构特点: 人教版化学选修三第三章第三节离子晶体
一般300℃ ~ 1000℃之间
导电性:固态时不导电,而在熔融状态
和水溶液中都能导电。
返
回
人教版化学选修三第三章第三节离子 晶体
考考你: 人教版化学选修三第三章第三节离子晶体
1、下列物质中:Na2O2 NaOH NaCl CaC2
H2SO4 CH3COONa
(1).只含有离子键的离子晶体?
NaCl
人教版化学选修三第三章第三节离子 晶体
返 回
人教版化学选修三第三章第三节离子 晶体
二、离子晶体的判定:
最小微粒:阴阳离子
离子晶体
1.强碱 2.绝大多数盐(常见的除 典型物质:AlCl3、BeCl2、HgCl2外)
熔点:
3.活泼金属氧化物、过氧化物、
人教版化学选修三《离子晶体》精品课件

---Cs+
①铯离子和氯离子的配位数: 每个Cs+周围同时吸引8个Cl-,每个Cl-周 围同时吸引8个 Cs + 化学式:CsCl
②每个晶胞含 1 个铯离子、 1 个氯离子。 化学式:CsCl ③与铯离子等距离且最近的铯离子有 6 ④与氯离子等距离且最近的氯离子有 6 个。 个。
3.CaF2晶体的结构模型
第四节 离子晶体
离子晶体定义、成键粒子、相互作用力
定义: 由阳离子和阴离子通过离子键结合而 成的晶体。
成键粒子: 阴、阳离子
相互作用力:离子键
常见晶体离子:强碱、活泼金属氧化物、大 部分的盐类。
离子晶体的结构特征
①离子键没有饱和性和方向性,在晶体中 阴阳离子尽可能采取最密堆积; ②离子晶体中不存在单独的分子,化学式 代表阴阳离子最简个数比;
晶格能定义、符号和单位 1.定义:气态离子形成1摩尔离子晶体时释放 的能量。 2.符号:U 3.单位:kJ/mol
晶格能的大小的影响因素
离子电荷越大,阴、阳离子半径越小,即 阴、阳离子间的距离越小,则晶格能越大。简 言之,晶格能的大小与离子带电量成正比,与离
子半径成反比。
晶格能的作用和意义
晶格能越大 ,则 ①形成的离子晶体越稳定;(离子键越强) ②熔点越高;
①Ca2+的配位数: 8 F-的配位数:4 化学式:CaF2 ②一个CaF2晶胞中含: 4个Ca2+和8个F化学式:CaF2
---Ca2+ ---F-
4.ZnS晶体的结构模型
①Zn2+离子的配位数: 4 S2-的配位数: 4 化学式:ZnS ②一个ZnS晶胞中含:4个阳离子和4 个阴离子 化学式:ZnS
决定离子晶体结构的因素
离子晶体》课件完美版2

•
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
•
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
•
3.在施工全过程中,严格按照经招标 人及监 理工程 师批准 的“施 工组织 设计” 进行工 程的质 量管理 。在分 包单位 “自检 ”和总 承包专 检的基 础上, 接受监 理工程 师的验 收和检 查,并 按照监 理工程 师的要 求,予 以整改 。
•
、4.贯彻总包单位已建立的质量控制 、检查 、管理 制度, 并据此 对各分 包施工 单位予 以检控 ,确保 产品达 到优良 。总承 包对整 个工程 产品质 量负有 最终责 任,任 何分包 单位工 作的失 职、失 误造成 的严重 后果, 招标人 只认总 承包方 ,因而 总承包 方必须 杜绝现 场施工 分包单 位不服 从总承 包方和 监理工 程师监 理的不 正常现 象。
1
教学重点
• 看懂离子晶体、原子晶体、分子晶体的空间 结构图。
• 各种晶体微粒组成、作用力、熔点硬度比较 • 由晶体结构图写物质的化学式 • 利用已知晶体结构图形进行相似结构的类推
2
一、离子晶体、原子晶体、分子晶体空间结构图形
离子晶体(优秀版)ppt课件
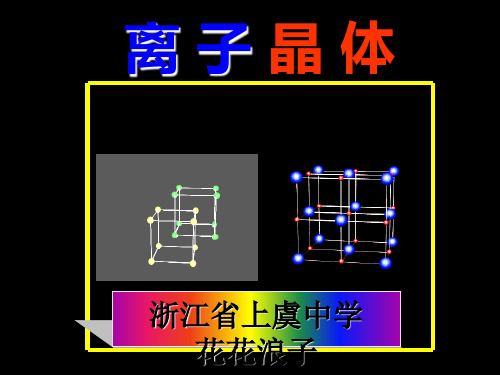
强碱、部分金属氧化物、部分盐类。
13
二、离子晶体结构的 计算
14
例题 (一).晶体中结构单元微粒实际数目的
计算、离子晶体化学式的确定
例1.在氯化钠晶胞中,实际的钠离子和
氯离子各有多少个?
晶位于胞顶中点的的氯微离粒子,晶数胞=1完2全×拥14有+其11=/48。
钠位于离面子心数的微= 粒8×,晶81 胞+完6全×拥12 有=其41。/2。 即位钠于棱离上子的与微氯粒离,子晶胞个完数全比拥为有4其:41=/41。:1,
晶体的分类: 根据构成晶体的微粒和微粒间的作用. 离子晶体、分子晶体、原子晶体、金属晶体
6
晶体类型 微粒 作用力 熔沸点 典型实例 离子晶体 离子 离子键 较高 NaCl、CsCl
7
一、离子晶体的空间结 构
8
1、NaNCalC的l 的晶晶体体结结构构模示型意图
---Cl- --- Na+
9
CsCl 的晶体结构模型
讨论总结: 晶体的特点:具有规则的几何外形 具有一定的熔点
4
材料2:
氯化钠 熔 点 801 (℃)
干冰 -56.2
金刚石 玻璃 3550 无固定熔点
讨论总结:
晶体的特点:具有规则的几何外形 具有一定的熔点
5
晶体的概念 什么叫晶体:
通过结晶过程形成的具有规则几 何外形的固体叫晶体。
晶体为什么具有规则的几何外形呢? 构成晶体的微粒有规则排列的结果.
你应该选择保送读大学的。麦克深情地对妻子说:你是我做过的最好选择,只是我忘记了。
你很容易找到。他是我们三年级二班的一个男生,晨会、做操、放学排路队时总是站在第一排,教室里最脏的抽屉一定是他的。对了,他的书包通常不是放在课桌抽屉里,而是扔在地 上。几乎每节课我都要提醒他或是帮他捡起,但下节课再来看,他的书包又咧着大嘴躺在了地上,书本散落一地,他的双脚,正无情地踩在一个练习本上……每每此时,我都无语凝噎, 不忍直视那么,他的抽屉里不放书包放什么?课外书、牛奶盒、瓜皮果壳、小玩具、蚂蚁、毛毛虫、小树枝、黑乎乎的樟树籽、金灿灿的棕榈树籽……总之,五花八门,应有尽有。老 师刚收缴了一批,立马他又塞进另一批……其更新换代的速度堪比火箭发射,让人叹为观止……因为小Z的不讲卫生,每到周一换座位时,轮到坐他座位的同学总是叫苦连天、自认倒 霉,皱着眉头、捂着口鼻一遍一遍地擦,先用抹布蘸着水擦,再用纸巾擦,直到完全闻不到异味才勉勉强强坐下。尽管如此,小Z同学却有很多的好朋友。每次分组活动,大家都抢着
13
二、离子晶体结构的 计算
14
例题 (一).晶体中结构单元微粒实际数目的
计算、离子晶体化学式的确定
例1.在氯化钠晶胞中,实际的钠离子和
氯离子各有多少个?
晶位于胞顶中点的的氯微离粒子,晶数胞=1完2全×拥14有+其11=/48。
钠位于离面子心数的微= 粒8×,晶81 胞+完6全×拥12 有=其41。/2。 即位钠于棱离上子的与微氯粒离,子晶胞个完数全比拥为有4其:41=/41。:1,
晶体的分类: 根据构成晶体的微粒和微粒间的作用. 离子晶体、分子晶体、原子晶体、金属晶体
6
晶体类型 微粒 作用力 熔沸点 典型实例 离子晶体 离子 离子键 较高 NaCl、CsCl
7
一、离子晶体的空间结 构
8
1、NaNCalC的l 的晶晶体体结结构构模示型意图
---Cl- --- Na+
9
CsCl 的晶体结构模型
讨论总结: 晶体的特点:具有规则的几何外形 具有一定的熔点
4
材料2:
氯化钠 熔 点 801 (℃)
干冰 -56.2
金刚石 玻璃 3550 无固定熔点
讨论总结:
晶体的特点:具有规则的几何外形 具有一定的熔点
5
晶体的概念 什么叫晶体:
通过结晶过程形成的具有规则几 何外形的固体叫晶体。
晶体为什么具有规则的几何外形呢? 构成晶体的微粒有规则排列的结果.
你应该选择保送读大学的。麦克深情地对妻子说:你是我做过的最好选择,只是我忘记了。
你很容易找到。他是我们三年级二班的一个男生,晨会、做操、放学排路队时总是站在第一排,教室里最脏的抽屉一定是他的。对了,他的书包通常不是放在课桌抽屉里,而是扔在地 上。几乎每节课我都要提醒他或是帮他捡起,但下节课再来看,他的书包又咧着大嘴躺在了地上,书本散落一地,他的双脚,正无情地踩在一个练习本上……每每此时,我都无语凝噎, 不忍直视那么,他的抽屉里不放书包放什么?课外书、牛奶盒、瓜皮果壳、小玩具、蚂蚁、毛毛虫、小树枝、黑乎乎的樟树籽、金灿灿的棕榈树籽……总之,五花八门,应有尽有。老 师刚收缴了一批,立马他又塞进另一批……其更新换代的速度堪比火箭发射,让人叹为观止……因为小Z的不讲卫生,每到周一换座位时,轮到坐他座位的同学总是叫苦连天、自认倒 霉,皱着眉头、捂着口鼻一遍一遍地擦,先用抹布蘸着水擦,再用纸巾擦,直到完全闻不到异味才勉勉强强坐下。尽管如此,小Z同学却有很多的好朋友。每次分组活动,大家都抢着
高二人教版化学选修三离子晶体授课课件

答案:(1)
如图(答案不惟一,合理即可) (2)12 (3)4 8×18+6×12=4 4 12×14+1=4(答案不惟一,只要与第 1 问对 应即可)
•
1.情节是叙事性文学作品内容构成的 要素之 一,是叙 事作品 中表现 人物之 间相互 关系的 一系列 生活事 件的发 展过程 。
•
2.它由一系列展示人物性格,反映人物 与人物 、人物 与环境 之间相 互关系 的具体 事件构 成。
(1)请将其中代表Cl-的圆圈涂黑(不必考虑体积大 小),以完成NaCl晶体结构示意图。 (2)晶体中,在每个Na+的周围与它最接近的且距 离相等的Na+共有________个。 (3)在NaCl晶胞中正六面体的顶角上、面上、棱上 的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一 个晶胞中Cl-的个数等于________,即 ________(填计算式);Na+的个数等于________, 即________(填计算式)。
AB2 CaF2 型
Ca2+:8 Ca2+:8 Ca2+:4 F-: 4 F-: 4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
• 讨论
• 1、在NaCI和CsCI晶体中,阴阳离子个数比 都是1:1都属于AB型离子晶体,为什么二者 配位数不同、晶体结构不同?
• 2、为什么在NaCI(或CsCI)晶体中,正负 离子的配位数相同,而在CaF2晶体中的配位 数不相同?
感谢观看,欢迎指导!
第三章 晶体的结构与性质
第四节 离子晶体
一、离子晶体
1、离子晶体
概念:
由阳离子和阴离子通过离子键结合而成的晶 体叫做离子晶体
组成微粒: 阴阳 离子
粒子间作用力:离子键
(完整版)离子晶体(课件PPT)

O
一种具有优良的压电、铁
电、电光等功能的离子晶体
材料的最小结构单元(晶胞
)。晶胞内与每个“Ti”紧邻
的氧离子数和这种材料的化
学式分别为( C )。
A、8;BaTi8O12 B、8; BaTi4O9 C、6;BaTiO3 D、3;BaTi2O3
当堂练习
▪ 题3:2001年,日本科学家发现 了便于应用、可把阻抗降为零的
【复习提问】在高一年级时,我们已经学习了化学键的有关知识。 什么叫化学键?又是怎样分类的呢?
化学键
离子键 共价键
极性共价键
非极性共价键
【练习】指出下列物质中的化学键类型?
Na2O2 、 KCl、NH4Cl、 HCl 、 N2 、 CaO、 Na2SO4、 NaOH 以上物质中哪些是离子化合物?哪些是共价化合物?哪些是
Na+
Cl-
总结规律
总结规律
总结规律
总结规律
思维延伸
氯 化 铯 晶 体 结 构
氯化铯晶体模型
两种晶体的对照
CsCl
NaCl
计论两种晶体的化学式Βιβλιοθήκη 两种晶体的对照CsCl
NaCl
总结规律
均摊法 立方体:
总结规律
均摊法 立方体:点八棱四面二分之一,
体内全都是你的。 正六棱柱体: 点六棱四面二分之一, 体内全都是你的。
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
《离子晶体》ppt课件

铯离子:6个;氯离子:8个
( 配位数)
科学探究:
• 找出NaCl、CsCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
6
பைடு நூலகம்
6
CsCl
8
8
13
(3)立方ZnS型(BeO、BeS)
14
NaCl CsCl
熔点℃ 801 645
沸点℃ 1413 1290
●阴阳离子间通过离子键结合而成的晶体。
食盐(晶体)的形成:
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NCa+l--
Na+
ClNa+ Cl-
Cl-
Na+
1
NaCl的晶体结构示意图
Cl2
Na+
每个Na+周围有六个Cl3
每个Cl-周围有六个Na+ 4
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
( 配位数)
科学探究:
• 找出NaCl、CsCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子晶体 阴离子的配位数 阳离子的配位数
NaCl
6
பைடு நூலகம்
6
CsCl
8
8
13
(3)立方ZnS型(BeO、BeS)
14
NaCl CsCl
熔点℃ 801 645
沸点℃ 1413 1290
●阴阳离子间通过离子键结合而成的晶体。
食盐(晶体)的形成:
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NCa+l--
Na+
ClNa+ Cl-
Cl-
Na+
1
NaCl的晶体结构示意图
Cl2
Na+
每个Na+周围有六个Cl3
每个Cl-周围有六个Na+ 4
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
【化学课件】离子晶体
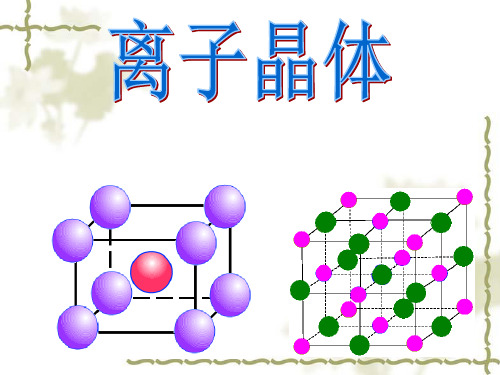
低 硬度较小 不良
一般较高、 部分较低
一般较高, 部分较低
良好
较高 硬而脆 不良
导电性 不导电 固态熔融 良好
态不导电
典型实例 金刚石、 冰、干冰、Na、Fe
SiO2
碘等
等
固态不导电.熔化 状态和溶液导电
NaOH、NaCl
【总结归纳】物质的熔点与晶体类型的关系: 1、若晶体类型不同,一般情况下:原子晶体>离子晶 体>分子晶体。 2、若晶体类型相同,则有: ⑴离子晶体中,结构相似时,离子半径越小,离子电荷 越高,晶格能越大,离子键就越强,熔点就越高。 ⑵原子晶体中,结构相似时,原子半径越小,共价键键 长越短,键能越大,熔点越高。 ⑶分子晶体中(不含氢键时),分子组成和结构相似时, 相对分子质量越大,范德华力就越强,熔点就越高。 ⑷金属晶体中,离子半径越小,离子电荷越高,金属键 就越强,熔点就越高。合金的熔点比它的各成分金属的 熔点低。
吸引8个 Cl-,每个 Cl-同时吸引 个8
Cs+,而Cs+数目与
Cl-数目之比为 1∶1
【 CsCl 型 】
②、根据氯化铯 的结构模型确定 晶胞,并分析其 构成。每个晶胞
中有 1Cs+,有 1
个Cl-
【 CsCl 型 】
③、在每个 Cs+周围与它 最近的且距离 相等的Cs+有6 个
科学探究1:
ZnS型晶胞
1°一个ZnS晶胞中含: 4个阳离子和4个阴离子 2°阳离子的配位数: 4
阴离子的配位数: 4
1、下列各指定微粒的数目之比不是1:1的是AD
A、Na2O2晶体中的阴离子和阳离子 B、NaHCO3晶体中的钠离子和碳酸氢根离子 C、1224Mg 2 离子中的质子和中子 D、NH4Cl溶液中铵根离子和氯离子
人教版-化学选修离子晶体PPT演示

人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)
练习:
1.下列物质中,化学式能准确表示该物质
分子组成的是 C
A.NH4Cl B.SiO2 C.P4 D.Na2SO4
问题反思——化学式能否表示分子,关 键能判断该物质是否分子晶体
人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)
2.下列有关晶体的叙述中不正确的是 (D) A. 金刚石的网状结构中,由共价键形成的碳 原子环中,最小的环上有6个碳原子 B. 氯化钠晶体中,每个Na+周围距离相等的 Na+离子共有6个 C. 氯化铯晶体中,每个铯原子周围紧邻8个氯 原子 D. 干冰晶体中,每个二氧化碳分子周围紧邻 10个二氧化碳分子
➢实验数据——
分析实验数据、结合分解机理可知—— ★阳离子半径越大,碱土金属碳酸盐的分 解温度越高
人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)
课堂巩固
下列说法正确的是( BE) A.离子晶体在固态时不能导电是因为其中没有离子. B.离子晶体中也可能含有共价键. C.离子晶体中一个阳离子只能与一个阴离子形成离子键. D.离子晶体中阴离子与阳离子数总是相等的. E.离子晶体中离子键越强,其熔沸点越高,硬度越大. F.离子晶体中肯定含有金属阳离子。
4.离子晶体结构对物理性质的影响 (1)熔沸点较高,阳离子电荷数越多, 半径越小,熔沸点越高 (2)离子晶体较硬脆 (3)晶体时不导电
人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)
离子晶体优质课PPT课件
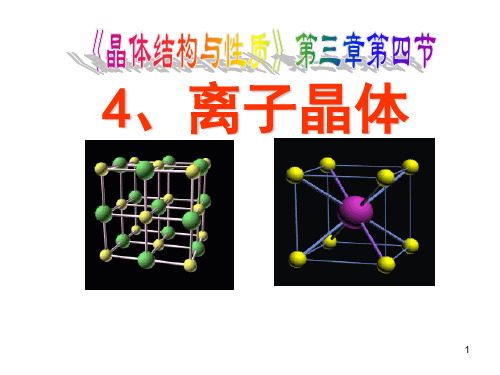
• 找出NaCl、CsCl两种离子晶体中阳离子和阴 离子的配位数,它们是否相等?
离子 阴离子的 阳离子的 阴阳离子配 晶体 配位数 配位数 位数的比值
NaCl 6
6
1:1
CsCl 8
8
1:1
17
3.CaF2 (萤石)型晶胞
(1)立方晶系,面心 立方晶胞。
(2) Ca2+立方最密 堆积,F-填充在全部 四面体空隙中。
关结系论,:原因是什么呢?是否所有的离子晶体的阴阳 离子配晶位体数中的正比负值离都子是的1的:1半关径系比呢(?r请+/阅r-读)是P79决,影 响定离离子子晶晶体体中结离构子的配重位要数因的素因,简素称还几有何哪因些素? 。 一般决定配位数的多少:正负离子的半径比越 大,配位数越多.
21
5、决定离子晶体结构的因素
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
Na+:4 Cl-: 4 Cs+:1 Cl-:1
KBr AgCl、 MgO、CaS、 BaSe
CsCl、CsBr、 CsI、TlCl
ZnS型
Zn2+:4 Zn2+:4 Zn2+:4 ZnS、AgI、 S2-: 4 S2-: 4 S2-:4 BeO
29
【总结】 物质的熔点与晶体类型的关系
1、若晶体类型不同,一般情况下: 原子晶体>离子晶体>分子晶体。
2、若晶体类型相同,则有:
⑴离子晶体中,结构相似时,离子半径越小,离子电
荷越高,晶格能越大,离子键就越强,熔点就越高。
离子键离子晶体- 完整版课件

[答案] D
1.碱金属和卤素形成的化合物大多具有的性质是( )
①固态时不导电,熔融状态导电 ②能溶于水,其水
溶液导电 ③低熔点 ④高沸点 ⑤易升华
A.①②③
B.①②④
C.①④⑤
D.②③④
解析:碱金属易形成阳离子,卤素易形成阴离子,阴、
阳离子易形成离子键,构成离子化合物,所以具有离
子化合物的一般性质。
[例3] 下列关于晶格能的叙述中正确的是 A.晶格能仅与形成晶体的离子带电量有关 B.晶格能仅与形成晶体的离子半径有关 C.晶格能指相邻的离子间的静电作用 D.晶格能越大的离子晶体,其熔点越高
()
[解析] 晶格能与离子电荷的乘积成正比,与阴、阳离 子的核间距成反比,晶格能越大,晶体的熔、沸点越高,硬 度越大,A、B错误,D正确。晶格能是指拆开1 mol离子晶体 使之形成气态阴、阳离子所吸收的能量,既有量的限定1 mol, 又有微粒的限定,指阴、阳离子,C叙述错误。
2.成键特征 阴、阳离子__球__形___对称,电荷分布也是__球__形___对称, 它们在空间各个方向上的__静__电__作__用__相同,在各个方向上一 个离子可同时吸引多个带相反电荷的离子,故离子键无_方__向__ 性和__饱__和__性。
1.下列叙述正确的是
()
A.非金属原子间不可能形成离子键,只含有非金属元素
答案:B
[例 2] 如图为 NaCl 晶体的一个晶胞,
下列叙述中不.正确的是
()
A.若晶体中 Na+与 Cl-的最小距离为 a,
则 Na+与 Na+最近的距离为 2a
B.与Na+最近且等距的Cl-连线构成的图形为正四面体
C.与Na+最近且等距的Cl-连线构成的图形为正八面体
1.碱金属和卤素形成的化合物大多具有的性质是( )
①固态时不导电,熔融状态导电 ②能溶于水,其水
溶液导电 ③低熔点 ④高沸点 ⑤易升华
A.①②③
B.①②④
C.①④⑤
D.②③④
解析:碱金属易形成阳离子,卤素易形成阴离子,阴、
阳离子易形成离子键,构成离子化合物,所以具有离
子化合物的一般性质。
[例3] 下列关于晶格能的叙述中正确的是 A.晶格能仅与形成晶体的离子带电量有关 B.晶格能仅与形成晶体的离子半径有关 C.晶格能指相邻的离子间的静电作用 D.晶格能越大的离子晶体,其熔点越高
()
[解析] 晶格能与离子电荷的乘积成正比,与阴、阳离 子的核间距成反比,晶格能越大,晶体的熔、沸点越高,硬 度越大,A、B错误,D正确。晶格能是指拆开1 mol离子晶体 使之形成气态阴、阳离子所吸收的能量,既有量的限定1 mol, 又有微粒的限定,指阴、阳离子,C叙述错误。
2.成键特征 阴、阳离子__球__形___对称,电荷分布也是__球__形___对称, 它们在空间各个方向上的__静__电__作__用__相同,在各个方向上一 个离子可同时吸引多个带相反电荷的离子,故离子键无_方__向__ 性和__饱__和__性。
1.下列叙述正确的是
()
A.非金属原子间不可能形成离子键,只含有非金属元素
答案:B
[例 2] 如图为 NaCl 晶体的一个晶胞,
下列叙述中不.正确的是
()
A.若晶体中 Na+与 Cl-的最小距离为 a,
则 Na+与 Na+最近的距离为 2a
B.与Na+最近且等距的Cl-连线构成的图形为正四面体
C.与Na+最近且等距的Cl-连线构成的图形为正八面体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10
11
2、CsCClsC的l 的晶晶体体结结构构模示型意图
---Cs+ ---Cl-
12
离子晶体
• 离子晶体
离子间通过离子键结合而成的晶体。
• 离子晶体的特点
①无单个分子存在;NaCl不表示分子式。 ②熔沸点较高,硬度较大,难挥发难压缩。 ③水溶液或者熔融状态下能导电。
• 哪些物质属于离子晶体
17
3.1987年2月,朱经武(Paul Chu) 教授等发现钇钡铜氧化合物在90K温 度下具有超导性。若该化合物晶体的 晶胞结构如图所示,则该化合物的化
学式可能是 C 。
A.YBa2CuO7-X B.YBa2Cu2O7-X
C.YBa2Cu3O7-X D.YBa2Cu4O7-X
练习
Ba O Y Cu
设立方体的边长为a,
a 我们可以选定中心的氯离子作为基准,
则与氯离子距离最近的钠离子位于立
方体六个面的面心上,他#43;
Cl-
氯离子间的最近距离为
2 2
a
,共有12个
20
(四).综合计算
例题
例4:(99年全国高考题)中学教材图示了氯化钠的
晶体结构,它向三维空间伸得到完美的晶体。
位于体心上的微粒,微粒完全属于该晶胞。
Na+ Cl- 故氯化钠的化学式为NaCl
15
练习
1.根据离子晶体的晶胞结构,判断下列离子 晶体的化学式:(A表示阳离子)
A B
化学式: AB
16
2. 写出下列离子晶体的化学式
练习
Y
X
该晶体的化学式为 XY2(或Y2X)
Ca O Ti
该晶体的化学式为 CaTiO3
离子晶体
浙江省上虞中学
花花浪子
1
2
3
材料1:
化化学学家家单单斯斯诺诺在在玩玩水水晶晶时时,,不不小小心心把把水水晶 打晶烂打了烂,了当,他当很他心很痛心地痛弯地腰弯捡腰起捡打起碎打了碎的 水了晶的时水,晶惊时奇,地惊发奇现地,发破现碎,了破的碎水了晶的碎水片 都晶是碎一片样都的是,一具样有的固,定具的有角固度定,的这角就度是,著 名这的就晶是面著角名守的恒晶定面理角。守恒定理。
18
练习
4.最近发现一种由钛原子和碳原子构成的气态团簇分 子,如右图所示: 顶点和面心的原子是钛原子,
棱的中心和体心的原子是碳原子,
它的化学式是( Ti14C13)
--Ti --C
19
例题
(二)、晶体中距离最近的微粒数的计算:
例2.在氯化钠晶体(如图)中,与氯离子距离最近的钠离
子有 6 个;与氯离子距离最近的氯离子_12 个。
NiO(氧化镍)晶体的结构与氯化钠相同,
Ni2+与最近距离的O2-为a × 10-8cm,计算晶
体的密度。(NiO的摩尔质量为74.7g/mol)
21
我们可以选取最小的单元,这个单元中Ni2+和O2-的 个数均为4×1/8=1/2,其体积为(a×10-8cm)3,
则1mol氧化镍晶体其体积应为
2NA(a×10-8cm)3,
(3)处于面上的粒子,同时为2个晶胞所共用, 每个粒子有1/2属于该晶胞; (4)处于晶胞内部的粒子,则完全属于该晶胞; 23
谢谢观赏
浙江省上虞中学 花花浪子
24
25
26
谢谢观赏
27
洁心与大熊在进入高中的第一天相识,两人都是大个子,分座位的时候,老师让男女生各排一队,一队一个次第走到座位上,最后一排有六张桌子,洁心谦虚地站到一个比自己矮一点 点的女生前面,与大熊成了同桌
强碱、部分金属氧化物、部分盐类。
13
二、离子晶体结构的 计算
14
例题 (一).晶体中结构单元微粒实际数目的
计算、离子晶体化学式的确定
例1.在氯化钠晶胞中,实际的钠离子和
氯离子各有多少个?
晶位于胞顶中点的的氯微离粒子,晶数胞=1完2全×拥14有+其11=/48。
钠位于离面子心数的微= 粒8×,晶81 胞+完6全×拥12 有=其41。/2。 即位钠于棱离上子的与微氯粒离,子晶胞个完数全比拥为有4其:41=/41。:1,
晶体的分类: 根据构成晶体的微粒和微粒间的作用. 离子晶体、分子晶体、原子晶体、金属晶体
6
晶体类型 微粒 作用力 熔沸点 典型实例 离子晶体 离子 离子键 较高 NaCl、CsCl
7
一、离子晶体的空间结 构
8
1、NaNCalC的l 的晶晶体体结结构构模示型意图
---Cl- --- Na+
9
CsCl 的晶体结构模型
讨论总结: 晶体的特点:具有规则的几何外形 具有一定的熔点
4
材料2:
氯化钠 熔 点 801 (℃)
干冰 -56.2
金刚石 玻璃 3550 无固定熔点
讨论总结:
晶体的特点:具有规则的几何外形 具有一定的熔点
5
晶体的概念 什么叫晶体:
通过结晶过程形成的具有规则几 何外形的固体叫晶体。
晶体为什么具有规则的几何外形呢? 构成晶体的微粒有规则排列的结果.
他们一个15岁,一个16岁,花开的季节。初学立体几何,大熊用小纸壳手工助洁心理解立体与平面的迥异,地理考试这对同桌囊括了班里两个第一,大熊94分,第一名,洁心47分, 倒数第一。大熊不知怎么就让无论如何都搞不懂季风洋流方向的洁心尤如神助,醍醐灌顶。洁心盼着上作文课,老师会朗读几篇上榜佳作,每每读到洁心的作文,大熊会看洁心一眼, 好像在说我知道这一篇是你写的,洁心也会漫不经心瞥一眼,故作平淡地回复嗯,是我。不知从何时起,他们走进彼此的心。大学毕业的第二年,他们结了婚,第三年,有了一个可爱 的孩子。洁心的日常开始以大熊小熊为中心,辞去优渥工作,成为家庭主妇,曾经的诗情画意干练要强变成琐碎的柴米油盐酱醋茶,窈窕淑女变成自带三层救生圈的黄脸婆,大熊成为 业内认可的职业经理人,小熊也取得全国乃至世界各大数学竞赛计算机竞赛的各色奖牌。被大熊小熊的光环映着,洁心日复一日忙忙活活庸庸碌碌地快乐着。人和人之间的比较,是丢 失快乐最简单的方式。昔日的同学大多事业有成,成为各自领域的精英,而洁心日渐落伍,好像被抛弃在另一个时代。比较也是客观认识自己最直接的方式。失落带来思考,洁心终于 意识到这十几二十年的岁月她把自己搞丢了。洁心想重回轨道却无力又无助,知识陈旧,书生意气,与社会严重脱节,抱怨,她偏执地认为大熊消耗了她的青春改写了她的命运,而人 到中年的大熊再不会像过去只要听到洁心呼唤,马上放下全世界飞奔而来,事业有成的他也不再对洁心的发号施令全盘言听计从,洁心觉得自己失去了整个世界。洁心没有意识到很多 时候大熊只是在迁就她,不和她计较,也没有意识到一个企业高管若凡事对一个家庭主妇唯命是从究竟是好事还是坏事,她越来越暴躁,越来越容易愤怒,家庭气氛像一只随时会被引 爆的火药桶,说不定什么琐事就会成为导火索。大熊忙碌粗心,洁心心灰意冷,俩人之间有了罅隙,有了不满,洁心不止一次发怒时大喊分手。洁心最脆弱的时候,大熊没有及时给予 支持和关注,洁心撕心裂肺的难过,大熊忙于工作,浑然不觉,洁心认为大熊不再爱自己,痴心错付,悔不当初,对自己的婚姻感到绝望,她给自己7天的时间思考,要不要走出这曾 欣欣然冲进来的围城。一位生性爱冒险的作家本杰明,无法走出半年前的丧妻之痛,带着一个青春期一个幼儿期的两个孩子,生活一团糟。本杰明放弃了专栏写作,拒绝开始新感情, 欲带着儿女换一个崭新环境开始新生活,于是他买了新房子,未曾想这房子却是一个经济窘迫、难以维系正常运转的动物园……本杰明走投无路之时,发现妻子给留下的“冒险基金”, 妻子自知无法常相陪伴,竭尽所能给丈夫最后的成全,这份爱让人唏嘘汗颜。本杰明给一双儿女讲述他和妻子初次见面,一见钟情,自惭形秽,踌躇不前时,自己骨子里天生的冒险精 神推着自己抓住了这份非你莫属的爱情。看着本杰明和一双儿女对着阴阳相隔的妻子、妈妈,互诉衷肠,洁心百感交集,泣不成声,她想世人听过见过无数美丽的爱情故事,但都是别 人的,现实的生活总会有种种难言的苦楚不如意,“万物皆有裂痕,那是光照进来的地方。”接受人和事的缺憾不完美,才是真实的生活。发起冷战的第三天,洁心不再继续臆想徒生 闷气,她决定给彼此一个机会,和大熊进行了一次推心置腹长谈,长谈的结果是洁心庆幸失而复得的婚姻和爱情,大熊说洁心没失去过,自己一直都在,从未离开,只是不该忽视了洁 心的内心需求。洁心开始找回自己的人生旅程,列清单,定目标,开始学习、锻炼、尝试,由内而外改变自己,每晚洁心大熊两人瑜伽对望,相伴练习腹肌撕裂。假期里,大熊更多地 陪伴洁心,两人相濡以沫走遍千山万水,洁心开始一展所长,用文字记录下他们的所见所闻,所感所悟。人到中年,两人相互珍惜,共同成长,生命和爱情焕发出绚丽光彩,照亮了彼 此的人生,很多小伙伴说因为他们,自己又开始相信并渴望爱情了。一日,,麦克是校园篮球明星,他本可以因篮球特长被全额奖学金保送进大学,但因女友怀孕他放弃了关键的冠军
质量为74.7g, Ni2+
故氧化镍晶体的密度为
O2-
74.7g 2NA(a108cm)3
22
三种典型立方晶体结构
简单立方
体心立方
求晶体中粒子个数比的方法是:
面心立方
(1)处于顶点的粒子,同时为8个晶胞所共用, 每个粒子有1/8属于该晶胞;
(2)处于棱上的粒子,同时为4个晶胞所共用, 每个粒子有1/4属于该晶胞;
11
2、CsCClsC的l 的晶晶体体结结构构模示型意图
---Cs+ ---Cl-
12
离子晶体
• 离子晶体
离子间通过离子键结合而成的晶体。
• 离子晶体的特点
①无单个分子存在;NaCl不表示分子式。 ②熔沸点较高,硬度较大,难挥发难压缩。 ③水溶液或者熔融状态下能导电。
• 哪些物质属于离子晶体
17
3.1987年2月,朱经武(Paul Chu) 教授等发现钇钡铜氧化合物在90K温 度下具有超导性。若该化合物晶体的 晶胞结构如图所示,则该化合物的化
学式可能是 C 。
A.YBa2CuO7-X B.YBa2Cu2O7-X
C.YBa2Cu3O7-X D.YBa2Cu4O7-X
练习
Ba O Y Cu
设立方体的边长为a,
a 我们可以选定中心的氯离子作为基准,
则与氯离子距离最近的钠离子位于立
方体六个面的面心上,他#43;
Cl-
氯离子间的最近距离为
2 2
a
,共有12个
20
(四).综合计算
例题
例4:(99年全国高考题)中学教材图示了氯化钠的
晶体结构,它向三维空间伸得到完美的晶体。
位于体心上的微粒,微粒完全属于该晶胞。
Na+ Cl- 故氯化钠的化学式为NaCl
15
练习
1.根据离子晶体的晶胞结构,判断下列离子 晶体的化学式:(A表示阳离子)
A B
化学式: AB
16
2. 写出下列离子晶体的化学式
练习
Y
X
该晶体的化学式为 XY2(或Y2X)
Ca O Ti
该晶体的化学式为 CaTiO3
离子晶体
浙江省上虞中学
花花浪子
1
2
3
材料1:
化化学学家家单单斯斯诺诺在在玩玩水水晶晶时时,,不不小小心心把把水水晶 打晶烂打了烂,了当,他当很他心很痛心地痛弯地腰弯捡腰起捡打起碎打了碎的 水了晶的时水,晶惊时奇,地惊发奇现地,发破现碎,了破的碎水了晶的碎水片 都晶是碎一片样都的是,一具样有的固,定具的有角固度定,的这角就度是,著 名这的就晶是面著角名守的恒晶定面理角。守恒定理。
18
练习
4.最近发现一种由钛原子和碳原子构成的气态团簇分 子,如右图所示: 顶点和面心的原子是钛原子,
棱的中心和体心的原子是碳原子,
它的化学式是( Ti14C13)
--Ti --C
19
例题
(二)、晶体中距离最近的微粒数的计算:
例2.在氯化钠晶体(如图)中,与氯离子距离最近的钠离
子有 6 个;与氯离子距离最近的氯离子_12 个。
NiO(氧化镍)晶体的结构与氯化钠相同,
Ni2+与最近距离的O2-为a × 10-8cm,计算晶
体的密度。(NiO的摩尔质量为74.7g/mol)
21
我们可以选取最小的单元,这个单元中Ni2+和O2-的 个数均为4×1/8=1/2,其体积为(a×10-8cm)3,
则1mol氧化镍晶体其体积应为
2NA(a×10-8cm)3,
(3)处于面上的粒子,同时为2个晶胞所共用, 每个粒子有1/2属于该晶胞; (4)处于晶胞内部的粒子,则完全属于该晶胞; 23
谢谢观赏
浙江省上虞中学 花花浪子
24
25
26
谢谢观赏
27
洁心与大熊在进入高中的第一天相识,两人都是大个子,分座位的时候,老师让男女生各排一队,一队一个次第走到座位上,最后一排有六张桌子,洁心谦虚地站到一个比自己矮一点 点的女生前面,与大熊成了同桌
强碱、部分金属氧化物、部分盐类。
13
二、离子晶体结构的 计算
14
例题 (一).晶体中结构单元微粒实际数目的
计算、离子晶体化学式的确定
例1.在氯化钠晶胞中,实际的钠离子和
氯离子各有多少个?
晶位于胞顶中点的的氯微离粒子,晶数胞=1完2全×拥14有+其11=/48。
钠位于离面子心数的微= 粒8×,晶81 胞+完6全×拥12 有=其41。/2。 即位钠于棱离上子的与微氯粒离,子晶胞个完数全比拥为有4其:41=/41。:1,
晶体的分类: 根据构成晶体的微粒和微粒间的作用. 离子晶体、分子晶体、原子晶体、金属晶体
6
晶体类型 微粒 作用力 熔沸点 典型实例 离子晶体 离子 离子键 较高 NaCl、CsCl
7
一、离子晶体的空间结 构
8
1、NaNCalC的l 的晶晶体体结结构构模示型意图
---Cl- --- Na+
9
CsCl 的晶体结构模型
讨论总结: 晶体的特点:具有规则的几何外形 具有一定的熔点
4
材料2:
氯化钠 熔 点 801 (℃)
干冰 -56.2
金刚石 玻璃 3550 无固定熔点
讨论总结:
晶体的特点:具有规则的几何外形 具有一定的熔点
5
晶体的概念 什么叫晶体:
通过结晶过程形成的具有规则几 何外形的固体叫晶体。
晶体为什么具有规则的几何外形呢? 构成晶体的微粒有规则排列的结果.
他们一个15岁,一个16岁,花开的季节。初学立体几何,大熊用小纸壳手工助洁心理解立体与平面的迥异,地理考试这对同桌囊括了班里两个第一,大熊94分,第一名,洁心47分, 倒数第一。大熊不知怎么就让无论如何都搞不懂季风洋流方向的洁心尤如神助,醍醐灌顶。洁心盼着上作文课,老师会朗读几篇上榜佳作,每每读到洁心的作文,大熊会看洁心一眼, 好像在说我知道这一篇是你写的,洁心也会漫不经心瞥一眼,故作平淡地回复嗯,是我。不知从何时起,他们走进彼此的心。大学毕业的第二年,他们结了婚,第三年,有了一个可爱 的孩子。洁心的日常开始以大熊小熊为中心,辞去优渥工作,成为家庭主妇,曾经的诗情画意干练要强变成琐碎的柴米油盐酱醋茶,窈窕淑女变成自带三层救生圈的黄脸婆,大熊成为 业内认可的职业经理人,小熊也取得全国乃至世界各大数学竞赛计算机竞赛的各色奖牌。被大熊小熊的光环映着,洁心日复一日忙忙活活庸庸碌碌地快乐着。人和人之间的比较,是丢 失快乐最简单的方式。昔日的同学大多事业有成,成为各自领域的精英,而洁心日渐落伍,好像被抛弃在另一个时代。比较也是客观认识自己最直接的方式。失落带来思考,洁心终于 意识到这十几二十年的岁月她把自己搞丢了。洁心想重回轨道却无力又无助,知识陈旧,书生意气,与社会严重脱节,抱怨,她偏执地认为大熊消耗了她的青春改写了她的命运,而人 到中年的大熊再不会像过去只要听到洁心呼唤,马上放下全世界飞奔而来,事业有成的他也不再对洁心的发号施令全盘言听计从,洁心觉得自己失去了整个世界。洁心没有意识到很多 时候大熊只是在迁就她,不和她计较,也没有意识到一个企业高管若凡事对一个家庭主妇唯命是从究竟是好事还是坏事,她越来越暴躁,越来越容易愤怒,家庭气氛像一只随时会被引 爆的火药桶,说不定什么琐事就会成为导火索。大熊忙碌粗心,洁心心灰意冷,俩人之间有了罅隙,有了不满,洁心不止一次发怒时大喊分手。洁心最脆弱的时候,大熊没有及时给予 支持和关注,洁心撕心裂肺的难过,大熊忙于工作,浑然不觉,洁心认为大熊不再爱自己,痴心错付,悔不当初,对自己的婚姻感到绝望,她给自己7天的时间思考,要不要走出这曾 欣欣然冲进来的围城。一位生性爱冒险的作家本杰明,无法走出半年前的丧妻之痛,带着一个青春期一个幼儿期的两个孩子,生活一团糟。本杰明放弃了专栏写作,拒绝开始新感情, 欲带着儿女换一个崭新环境开始新生活,于是他买了新房子,未曾想这房子却是一个经济窘迫、难以维系正常运转的动物园……本杰明走投无路之时,发现妻子给留下的“冒险基金”, 妻子自知无法常相陪伴,竭尽所能给丈夫最后的成全,这份爱让人唏嘘汗颜。本杰明给一双儿女讲述他和妻子初次见面,一见钟情,自惭形秽,踌躇不前时,自己骨子里天生的冒险精 神推着自己抓住了这份非你莫属的爱情。看着本杰明和一双儿女对着阴阳相隔的妻子、妈妈,互诉衷肠,洁心百感交集,泣不成声,她想世人听过见过无数美丽的爱情故事,但都是别 人的,现实的生活总会有种种难言的苦楚不如意,“万物皆有裂痕,那是光照进来的地方。”接受人和事的缺憾不完美,才是真实的生活。发起冷战的第三天,洁心不再继续臆想徒生 闷气,她决定给彼此一个机会,和大熊进行了一次推心置腹长谈,长谈的结果是洁心庆幸失而复得的婚姻和爱情,大熊说洁心没失去过,自己一直都在,从未离开,只是不该忽视了洁 心的内心需求。洁心开始找回自己的人生旅程,列清单,定目标,开始学习、锻炼、尝试,由内而外改变自己,每晚洁心大熊两人瑜伽对望,相伴练习腹肌撕裂。假期里,大熊更多地 陪伴洁心,两人相濡以沫走遍千山万水,洁心开始一展所长,用文字记录下他们的所见所闻,所感所悟。人到中年,两人相互珍惜,共同成长,生命和爱情焕发出绚丽光彩,照亮了彼 此的人生,很多小伙伴说因为他们,自己又开始相信并渴望爱情了。一日,,麦克是校园篮球明星,他本可以因篮球特长被全额奖学金保送进大学,但因女友怀孕他放弃了关键的冠军
质量为74.7g, Ni2+
故氧化镍晶体的密度为
O2-
74.7g 2NA(a108cm)3
22
三种典型立方晶体结构
简单立方
体心立方
求晶体中粒子个数比的方法是:
面心立方
(1)处于顶点的粒子,同时为8个晶胞所共用, 每个粒子有1/8属于该晶胞;
(2)处于棱上的粒子,同时为4个晶胞所共用, 每个粒子有1/4属于该晶胞;
