离子晶体 选修三课件
人教版高中化学选修三 3.4 离子晶体 课堂课件

一、离子晶体
1、定义 离子间通过离子键结合而成的晶体 微粒:离子 作用力:离子键
2、常见的离子晶体 强碱、部分金属氧化物、大部分盐类
3、离子晶体中的离子配位数 (C.N.) 离子周围最邻近的异电性离子的数目
2Na + Cl2 == 2NaCl
Na
+11
+17
Cl
Na+
+11
、几种典型离子晶体的结构
分析思考: 1、Na+配位数? Cl-配位数?
66
NaCl晶体中阴、阳离子配位数
分析思考: 2、NaCl晶体中每个Cl-周围最近且 等距离的Cl-有几个?每个Na+周围
最近且等距离的Na+有几个 12
4、几种典型离子晶体的结构
分析思考:
1、Cs+配位数?8
Cl-配位数? 8
C.液溴的汽化和钠的熔化
D.HCl和NaCl溶于水
3、下面图像是从NaCl或CsCl晶体结构
图中分割出来的部分结构图,试判断
属于NaCl晶体结构的是( C
)
(1)
(2)
(3)
A.①和③ C.①和④
(4)
B.②和③ D.只有①
二、晶格能
1、定义: 气态离子形成1mol离子晶体时释放的能量 常取正值,单位:kJ/mol
AB型离子晶体的晶格能
NaF NaCl NaBr
离子
电荷 1 1
1
晶格能
kJ/mol 923 786 747
NaI MgO CaO SrO BaO
1 222 2 704 3791 3401 3223 3054
2、影响晶格能大小的因素 ⑴ 离子的电荷数 相同类型的离子晶体,离子电荷越大, 晶格能越大 ⑵ 离子的核间距 离子电荷数相同的同类型的离子晶体, 离子核间距越小,晶格能越大
【选修三】3-4离子晶体(新人教版精品)

【选修三】3-4离子晶体(新人教版精品)第四节 离子晶体第1课时【知识与技能】 1、通过复习钠与氯形成氯化钠的过程,使学生理解离子键的概念、形成过程和特点。
2、理解离子晶体的概念、构成及物理性质特征,掌握常见的离子晶体的类型及有关晶胞的计算。
【过程与方法】 1、 复习离子的特征,氯化钠的形成过程,并在此基础上分析离子键的成键微粒和成键性质,培养学生知识迁移的能力和归纳总结的能力。
2、 在学习本节的过程中,可与物理学中静电力的计算相结合,晶体的计算与数学的立体几何、物理学的密度计算相结合。
【情感态度与价值观】 通过本节的学习,进一步认识晶体,并深入了解晶体的内部特征。
[板书计划] 第四节 离子晶体 一、离子晶体:由阳离子和阴离子通过离子键结合而成的晶体。
1、几何因素:晶体中正负离子的半径比(r +/r -)。
2、电荷因素:正负离子的电荷比。
3、键性因素:离子键的纯粹程度。
4、离子晶体特点:硬度较大、难于压缩、较高的熔点和沸点。
二、晶格能 1、定义:气态离子形成l 摩离子晶体释放的能量,通常取正值。
2、规律:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
【教案设计】 【问题引入】 1、钠原子与氯原子是如何结合成氯化钠的?你能用电子式表示氯化钠的形成过程吗? 2、根据元素的金属性和非金属性差异,你知道哪些(1)NaF NaCl NaBr NaI988℃801℃747℃660℃(2)NaF CaF2 CaO988℃1360℃2614℃(提示:Ca2+半径略大于Na+半径)【讲解】从离子键的实质是静电引力出发, 影响 F 大小的因素有: 离子的电荷数q 和离子之间的距离r (与离子半径的大小相关)1) 离子电荷数的影响:电荷高,晶格能大,离子晶体的熔沸点高、硬度大。
NaClMgO晶格能(KJ.mol-1)786 3791 熔点(℃)801 2852 摩氏硬度 2.5 6.5 2) 离子半径的影响:半径大, 导致离子间距大, 晶格能小,离子晶体的熔沸点低、硬度小。
离子晶体ppt推荐人教版高中化学选修三
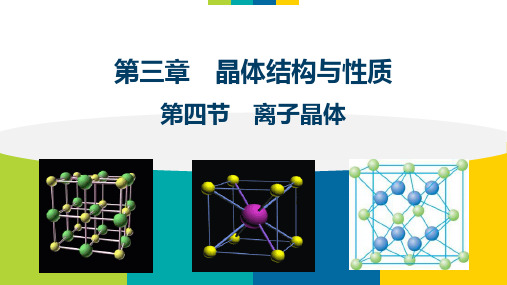
(3)CaF2晶体
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
④Ca2+的配位数: 8
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
二、典型的离子晶胞
(3)CaF2晶体
④F-的配位数: 4
Ca2+
F-
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
③在每个Cl-周围距离相等且 最近的Cs+共有 8 个;
④与Cs+ 最近且等距离的Cs+有 6 个,与Cl-最近 等距离的Cl-有 6 个
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
二、典型的离子晶胞
(3)CaF2晶体
科学探究 1.找出NaCl、CsCl两种离子晶体中阳离 子和阴离子的配位数,它们是否相等?
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
二、典型的离子晶胞
NaCl
CsCl
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
CaF2
ZnS
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
离子晶体p p t 推荐人教版高中化学选修三(精品系列P P T )
1.下列性质中,可以证明某化合物内一定 存在离子键的是( D ) A.晶体可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电 2. 离子晶体不可能具有的性质是( B ) A. 较高的熔、沸点 B. 良好的导电性 C. 溶于极性溶剂 D. 坚硬而易粉碎
2019年《离子晶体》课件_新人教版选修3精品教育.ppt
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
Na+:4 Cl-: 4 Cs+:1 Cl-:1
离子晶体 NaCl CsCl
阴离子的配位数
6 8
阳离子的配位数
6 8
科学探究:
你认为是什么因素决定了离子晶体中离子
的配位数?根据表3—5、表3—6分析影响 离子晶体中离子配位数的因素。
配位数 半径比 空间构型
4
0.2~0.4
ZnS
6
0.4~0.7
NaCl
8
0.7~1.0
CsCl
决定离子晶体结构的因素
KBr AgCl、 MgO、CaS、 BaSe
CsCl、CsBr、 CsI、TlCl
ZnS型
Zn2+:4 Zn2+:4 Zn2+:4 ZnS、AgI、 S2-: 4 S2-: 4 S2-:4 BeO
AB2 CaF2 型
Ca2+:8 Ca2+:8 Ca2+:4 F-: 4 F-: 4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
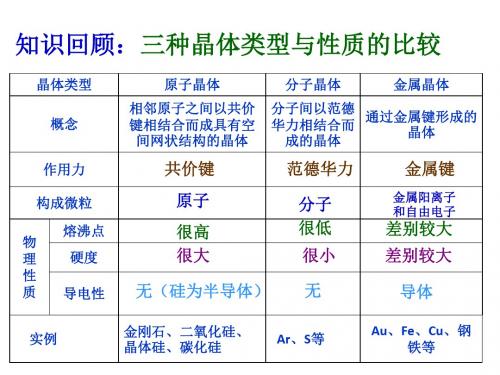
知识回顾:三种晶体类型与性质的比较
晶体类型
概念
作用力
构成微粒 熔沸点
物 理 硬度 性 质 导电性
原子晶体
相邻原子之间以共价 键相结合而成具有空
间网状结构的晶体
分子晶体
人教版化学选修三《离子晶体》精品课件

---Cs+
①铯离子和氯离子的配位数: 每个Cs+周围同时吸引8个Cl-,每个Cl-周 围同时吸引8个 Cs + 化学式:CsCl
②每个晶胞含 1 个铯离子、 1 个氯离子。 化学式:CsCl ③与铯离子等距离且最近的铯离子有 6 ④与氯离子等距离且最近的氯离子有 6 个。 个。
3.CaF2晶体的结构模型
第四节 离子晶体
离子晶体定义、成键粒子、相互作用力
定义: 由阳离子和阴离子通过离子键结合而 成的晶体。
成键粒子: 阴、阳离子
相互作用力:离子键
常见晶体离子:强碱、活泼金属氧化物、大 部分的盐类。
离子晶体的结构特征
①离子键没有饱和性和方向性,在晶体中 阴阳离子尽可能采取最密堆积; ②离子晶体中不存在单独的分子,化学式 代表阴阳离子最简个数比;
晶格能定义、符号和单位 1.定义:气态离子形成1摩尔离子晶体时释放 的能量。 2.符号:U 3.单位:kJ/mol
晶格能的大小的影响因素
离子电荷越大,阴、阳离子半径越小,即 阴、阳离子间的距离越小,则晶格能越大。简 言之,晶格能的大小与离子带电量成正比,与离
子半径成反比。
晶格能的作用和意义
晶格能越大 ,则 ①形成的离子晶体越稳定;(离子键越强) ②熔点越高;
①Ca2+的配位数: 8 F-的配位数:4 化学式:CaF2 ②一个CaF2晶胞中含: 4个Ca2+和8个F化学式:CaF2
---Ca2+ ---F-
4.ZnS晶体的结构模型
①Zn2+离子的配位数: 4 S2-的配位数: 4 化学式:ZnS ②一个ZnS晶胞中含:4个阳离子和4 个阴离子 化学式:ZnS
决定离子晶体结构的因素
《离子晶体》高二上册化学选修三PPT课件

(2)在氯化铯晶体中,每个Cs+周围与之最接近且距离相等的Cl-共有 ;这几 个Cl-在空间构成的几何构型为 。
(3)在每个Cl-周围距离相等且最近的Cs+共有 ;这几个Cs+ 在空间构成的几何构型
。
(3)CaF2型晶胞
1、一个CaF2晶胞中含: 4个Ca2+和8个F¯
2、Ca2+的配位数: 8
F-的配位数: 4
3.下列物质中,化学式能准确表示该物质分子组成的是( C )
A.NH4Cl B.SiO2 C.P4 D.Na2SO4
问题反思——化学式能否表示分子,关键能判断该物质是否分子晶体
4:下列热化学方程式中,能直接表示出氯化钠晶格能的是___B___
A、 Na (s) + 1/2Cl2 (g) = NaCl(s); △H
△H =△H1 +△H2+△H3 +△H4 +△H5
高中生物选修三
谢谢观看
晶体机构与性质
CRYSTAL STRUCTURE AND PROPERTIES
老师:
授课时间:20XX
交流与讨论
NaCl CsCl
熔点℃ 801 645
沸点℃ 1413 1290
为什么NaCl的熔沸点比CsCl高?
结论: 对于组成和结构相似的物质,阴、阳离子半径越小,离子键越强,
熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。
(二)离子晶体的晶格能
1.概念:气态离子形成1摩尔离子晶体释放的能量,通常取正值。或指拆开1mol离子晶 体使之形成气态阴离子和气态阳离子所吸收的能量 2.影响晶格能大小因素 离子晶体中阴阳离子半径越小,所带电荷越多,离子键越强,晶格能越大 3.晶格能的作用: (1)晶格能越大,离子晶体越稳定,离子晶体的熔沸点越高,硬度越大。 (2)岩浆晶出规则与晶格能的关系
人教版化学选修三第三节离子晶体PPT课件

科学探究: 人教版化学选修三第三章第三节离子晶体(共52张PPT)
NaCl和CsCl的结构特点:
配位数:
一个离子周围最邻近的异电性离子的数目!
氯化钠晶体中,阴阳离 子的个数比是多少?
人教版化学选修三第三章第三节离子 晶体(共 52张PP T)
各种离子晶体:
【复习回忆】:
下列物质中哪些是离子化合物?哪些是 只含离子键的离子化合物? Na2O NH4Cl O2 Na2SO4 NaCl CsCl
C离a子F2化合物:
Na2O NH4Cl Na2SO4 NaCl CsCl CaF2
只含离子键的离子化合物:
Na2O NaCl CsCl CaF2
熔点:
3.活泼金属氧化物、过氧化物、
碳化物(CaC2)及氢化物(NaH)氮 化物(Mg3N2)等
一般300℃ ~ 1000℃之间
导电性:固态时不导电,而在熔融状态
和水溶液中都能导电。
返
回
人教版化学选修三第三章第三节离子 晶体(共 52张PP T)
考考你: 人教版化学选修三第三章第三节离子晶体(共52张PPT)
Cl-
Na+:1+1/4×12=4
Cl-:1/8×8+1/2×6=4
属于AB型晶体
Na+
人教版化学选修三第三章第三节离子 晶体(共 52张PP T)
NaCl 的晶体结构模型
人教版化学选修三第三章第三节离子 晶体(共 52张PP T)
---Cl- --- Na+
人教版化学选修三第三章第三节离子 晶体(共 52张PP T)
7.决定晶体结构的因素: (1).几何因素,即晶体中阴阳离子的半径 比;
人教版高中化学选修3课件:3.4离子晶体(27张) (共27张PPT)
人教版选修三第三章第四节
二、晶胞类型
2、 CsCl 型晶胞
人教版选修三第三章第四节
CsCl的晶体结构示意图
二、晶胞类型
2、 CsCl 型晶胞
人教版选修三第三章第四节
(1)铯离子和氯离子的位置:
铯离子:体心 氯离子:顶点;或者反之。
(2)每个晶胞含铯离子、氯离子的个数
铯离子:1个 ;氯离子:1个
原子晶体中,结构相似时,原 子半径越小,共价键键长越短, 键能越大,熔点越高。
2
离子晶体中,结构相似时,离 子半径越小,离子电荷越高,
晶格能越大,离子键就越强, 1
熔点就越高。
分子晶体中(不含氢键时),分子
3 组成和结构相似时,相对分子质量
越大,范德华力就越强,熔点就越 高。
4
金属晶体中,原子半径越小, 价电子越多,金属键就越强, 熔点就越高。合金的熔点比它 的各成分金属的熔点低。
阴阳离子
离子键
⑴、特征:无方向性和饱和性 ⑵、影响离子键强弱的因素: 阴、阳离子半径越小,电荷数越多,离子键越强
一、离子晶体
人教版选修三第三章第四节
4、常见的离子晶体
强碱、活泼金属氧化物、绝大部分盐。
5、离子晶体中的配位数
指一个离子周围最邻近的异电性离子的数目
一、离子晶体
6、离子晶体的特性
大多数离子晶体易溶于极性溶 剂水,难溶于非极性溶剂
距离最近 每个晶 配位数 且相等的 胞含有
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
人教版高中化学选修三离子晶体(共21张PPT)
人教版高中化学选修三 3.4离子晶体(共21张PPT)
问题4:观察CsCl晶胞
①Cs+的配位数:__8____ Cl-的配位数:__8____
配位数:均为8 ②与每个Cl- 距离最近且相等的Cl- 有6 个;与 每个Cs+距离最近且相等的Cs+有 6 个。 ③根据氯化铯的结构模型确定晶胞,并分析其构成。 每个晶胞中有1___Cs+,有_1__个Cl-. Cs+数目与Cl-数目之为 1 :1 化学式为 CsCl 。
-
+
Na+ 吸引6个Cl-
配位数:均为6
②这几个Cl- 或Na+ 所构成的 空间几何构型为?正八面体
③与每个Cl- 距离最近且相等 的Cl- 有12个;与每个Na+距离 最近且相等的Na+有 12个。 ④根据氯化钠的结构模型确 定晶胞,并分析其构成。每 个晶胞中有 4 Na+,有 4 个 Cl-。Na+数目与Cl-数目之为 1 :1 化学式为NaCl 。 离子晶体的化学式代表什么含义? 阴、阳离子个数比
答案: ①晶格能越大,形成的晶体越稳定,而且熔点 越高,硬度越大 ②离子半径越小,所带电荷越多,晶格能越大
人教版高中化学选修三 3.4离子晶体(共21张PPT)
小结:晶格能 人教版高中化学选修三 3.4离子晶体(共21张PPT) 1、定义:气态离子形成1摩离子晶体时释放的能量。 单位 kJ/mol 一般取正值。 2、晶格能的大小与阴、阳离子所带电荷的乘积 成正比,与阴、阳离子间的距离成反比。 简言之,晶格能的大小与离子带电量成正比,与离 子半径成反比. 类比库仑定律 3、晶格能越大:形成的离子晶体越 稳定;(离 子键越 强 ),熔点越 高;硬度越 大 。
高中化学选修3课件-3.4 离子晶体1-人教版

2、常见晶胞类型
(1)NaCl型晶胞
离子晶体中离子的配位数(缩写为C.N.):是指一个离子 周围最邻近的异电性离子的数目。
【小组活动1】观察NaCl晶胞,按以下要求填空。
1.钠离子和氯离子的位置: Na+:___体___心__和__棱___中__点____
Cl- :____面__心__和___顶__点__;____ 或反之。 2.每个晶胞含钠离子、氯离子的个数:
【课堂小结】
【复习】离子键 一、离子晶体 1、定义:由阳离子和阴离子通过离子键结合
而成的晶体。
2、常见晶胞类型
(1)NaCl型晶胞 (2)氯化铯型晶胞 (3)CaF2型晶胞
课堂练习
1.下列物质中,属于离子晶体,并且含有共
价键的是( D )
A.CaCl2
B.MgO
C.N2
D.NH4Cl
2.下列离子晶体的叙述中,正确的是( D )
_面__心____, 8个F-在大立方体内F-
构成一个 小__立__方__体__。
Ca2+
2.每个晶胞含Ca2+ 、 F-的个数:
Ca2+:_4_个_____F- :___8_个____ 3. CaF2晶体中阴、阳离子配位数: Ca2+配位数:__8___F- 配位数:__4___
4.每个F-周围与距离最近的Ca2+在空间构成的 几何构型为__正__四__面__体____。
6.每个Na+周围距离最近的Cl-在空间构成的 几何构型为___正__八__面__体_______。
(2)氯化铯型晶胞
【小组活动2】观察CsCl晶胞,按以下要求填空。
1.铯离子和氯离子的位置: Cs+:_____顶__点____________
人教版化学选修3离子晶体PPT(45页)

1.CsCl的沸点是1290°C,NaCl的沸点达到 1413°C,为什么? 2.外力敲击金属时,金属通常不容易断裂, 敲击食盐晶体时,容易破碎,原因是什么? 3.NaOH晶体是否可以导电? 4.阅读82页科学视野
4.离子晶体结构对物理性质的影响
(1)熔沸点较高,阳离子电荷数越多, 半径越小,熔沸点越高 (2)离子晶体较硬脆 (3)晶体时不导电
A
B
C
D
晶体
硫化钾
干冰
金刚石
碘
组成晶体的微粒
阴阳离子
晶体微粒间存在的作用力 离子键
分子 共价键
原子 共价键
பைடு நூலகம்
分子 范德华力
• 2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( C )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2 C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO • 3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
c. 含氧酸盐(包括铵盐) d.大多数碱
人教版化学选修3离子晶体PPT(45页)
晶体 氯化钠 干冰 金刚石
熔点 (℃)
801
▪ 思考:
-56.2 3550
➢为什么氯化钠的性质与干冰、金 刚石的不同?
人教版化学选修3离子晶体PPT(45页)
人教版化学选修3离子晶体PPT(45页)
各种离子晶体
人教版化学选修3离子晶体PPT(45页)
是 A.Li<Na<K<Ru
( A)
B.F2<Cl2<Br2<I2 C.金刚石>晶体硅>碳化硅
D.NaCl>KCl>CsCl
人教版化学选修三第三章第四节《离子晶体》16pptppt

铯离子:6个 ;氯离子:8个
(3)CaF2型晶胞
1、一个CaF2晶胞中含: 4个Ca2+和8个F-
①Ca2+的配位数:8 ②F-的配位数:4
(4)ZnS型晶胞
1、一个ZnS晶胞中含: 4个阳离子和4个阴离子 ①阳离子的配位数:4 ②阴离子的配位数:4
科学探究:
• 你认为是什么因素决定了离子晶体中离子
19、心脏太软,容易被柿子夹住。头脑太好了,很容易被缺乏内心看到。最初的善意帮助将成为最后的恶意后果。 18、我不在乎是风,雨还是晴天。我只知道,如果是您,无论何时何地,即使我押注自己一生的运气,我也会如期到达。 3、如果不是你的,不要保留它;如果让您感到不舒服,请不要停止。如果人在寒冷中行走,他的心脏会保持温暖;如果不可避免地聚集在一 起,他将独自享受世界的欣喜。不要回顾过去,不要回顾未来。这就是你应该拥有的生活。
24、永远不要打破生活中的四件事:信任,关系,诺言和内心,因为一旦破裂,就不会发出声音,但这是非常痛苦的。 4、您必须感谢自己不断前进的道路,也许您的梦想没有实现,也许生活不如您所愿,但请不要放弃,您必须记住,您渴望的美好事物会迟到 ,但这不会不存在。
3、如果不是你的,不要保留它;如果让您感到不舒服,请不要停止。如果人在寒冷中行走,他的心脏会保持温暖;如果不可避免地聚集在一 起,他将独自享受世界的欣喜。不要回顾过去,不要回顾未来。这就是你应该拥有的生活。
人教版高中化学选修3 3.4离子晶体 课件精选课件

第四节 离子晶体
问题展示
1.离子晶体的概念、构成离子晶体的微 粒、微粒间的作用力和配位数是什么 ?
2.氯化钠、氯化铯、氟化钙配位数空间 构型?
3.离子晶体物理性质 4.晶格能的概念的理解? 5.如何比较离子晶体的熔沸点高低?
一、离子晶体
1、离子晶体
概念:由阳离子和阴离子通过离子键 结合而成的晶体叫做离子晶体
NaCl CsCl
立方面 心堆积
立方体 心堆积
6:6(0.414-0.732) 8:8 (0.732-1.0)
布置任务
做完一遍过83-86页习题
向你的美好的希冀和追求撒开网吧,九百九十九次落空了,还有一千次呢人若软弱就是自己最大的敌人游手好闲会使人心智生锈。故天将降大任于斯人也,必先苦其心 乏其身,行拂乱其所为,所以动心忍性,增益其所不能。让生活的句号圈住的人,是无法前时半步的。少一点预设的期待,那份对人的关怀会更自在。榕树因为扎根于 越长越茂盛。稗子享受着禾苗一样的待遇,结出的却不是谷穗。进取乾用汗水谱烈军属着奋斗和希望之歌。患难可以试验一个人的品格,非常的境遇方可以显出非常的 角度来看它。机会只对进取有为的人开放,庸人永远无法光顾。困苦能孕育灵魂和精神的力量骄傲,是断了引线的风筝,稍纵即逝;自卑,是剪了双翼的飞鸟,难上青 圆规的两只脚都动,永远也画不出一个圆。有困难是坏事也是好事,困难会逼着人想办法,困难环境能锻炼出人才来。只存在於蠢人的字典里。青,取之于蓝而青于蓝 ,然后知松柏之后凋也。积极的人在每一次忧患中都看到一个机会,而消极的人则在每个机会都看到某种忧患。一个能从别人的观念来看事情,能了解别人心灵活动的 。志当存高远。绳锯木断,水滴石穿让我们将事前的忧虑,换为事前的思考和计划吧!锲而舍之,朽木不折;锲而不舍,金石可镂。没有天生的信心,只有不断培养的 上下而求索天行健,君子以自强不息。会当凌绝顶,一览众山小。丈夫志四海,万里犹比邻。也,而不可夺赤。信言不美,美言不信。善者不辩,辩者不善。知者不博 ,和其光,同其尘,是谓“玄同”。故不可得而亲,不可得而疏;不可得而利,不可得而害;不可得而贵,不可得而贱。故为天下贵。天下之至柔,驰骋天下之至坚。 有益。知者不言,言者不知。更多老子名言敬请关注习古堂国学网的相关文章。柔弱胜刚强。鱼不可脱於渊,国之利器不可以示人。善为士者,不武;善战者,不怒; 为之下。是谓不争之德,是谓用人之力,是谓配天古之极是以圣人后其身而身先,外其身而身存无为而无不为。取天下常以无事,及其有事,不足以取天下。合抱之木 累土;千里之行,始於足下。多言数穷,不如守中。天下莫柔弱於水,而攻坚强者莫之能胜,以其无以易之。天长地久。天地所以能长且久者,以其不自生,故能长生 其身而身存。非以其无故能成其私。譬道之在天下,犹川谷之於江海。江海之所以能为百谷王者,以其善下之,故能为百谷王。是以圣人欲上民,必以言下之;欲先民 而民不重,处前而民不害。是以天下乐推而不厌。以其不争,故天下莫能与之争。是以圣人抱一为天下式。不自见,故明;不自是,故彰;不自伐,故有功;不自矜, 与之争。故道大,天大,地大,人亦大。域中有四大,而人居其一焉修之於身,其德乃真;修之於家,其德乃余;修之於乡,其德乃长;修之於邦,其德乃丰;修之於 ,以家观家,以乡观乡,以邦观邦,以天下观天下。吾何以知天下然哉?以此。慈故能勇;俭故能广;不敢为天下先,故能成器长。今舍慈且勇;舍俭且广;舍後且先 天将救之,以慈卫之。道生一,一生二,二生三,三生万物。知人者智,自知者明。胜人者有力,自胜者强。知足者富。强行者有志。一个实现梦想的人,就是一个成 己完全投入于权力和仇恨中,你怎么能期望他还有梦梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远得不到宁静,直到这些梦想成为事实。落叶——树叶撒 弯腰拾起;与其肩负苦涩的回忆,不如走向明天,淋浴春雨梦想绝不是梦,两者之间的差别通常都有一段非常值得人们深思的距离。一个人要实现自己的梦想,最重要 气和行动。一个人如果已经把自己完全投入于权力和仇恨中,你怎么能期望他还有梦?如果一个人不知道他要驶向哪个码头,那么任何风都不会是顺风。最初的梦想紧 由让一切都曾失去过。谁不曾迷茫?谁有不曾坠落呢?安逸的日子谁不想有呢?如果骄傲没被现实大海冷冷拍下,如果梦想不曾坠落悬崖千钧一发,又怎会懂得要多努 执著的人拥有隐形翅膀?现在的一切都是为将来的梦想编织翅膀,让梦想在现实中展翅高飞。很多时候,我们富了口袋,但穷了脑袋;我们有梦想,但缺少了思想。、 低微,但是不可以没有梦想。只要梦想一天,只要梦想存在一天,就可以改变自己的处境乐理知识和乐器为我的音乐梦想插上了一双希望的翅膀。长大以后,我要站在 的风采,为大家带来欢乐。没有一颗心会因为追求梦想而受伤,当你真心想要某样东西时,整个宇宙都会联合起来帮你完成。青年时准备好材料,想造一座通向月亮的 庙宇。活到中年,终于决定搭一个棚。一个人有钱没钱不一定,但如果这个人没有了梦想,这个人穷定了。梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远 为事实。如果失去梦想,人类将会怎样?不要怀有渺小的梦想,它们无法打动人心。最初所拥有的只是梦想,以及毫无根据的自信而已。但是,所有的一切就从这里出 幸福,有时梦想破灭也是一种幸福。人生最苦痛的是梦醒了无路可走。做梦的人是幸福的;倘没有看出可以走的路,最要紧的是不要去惊醒他。在每一个想你的日子里 却更难。想你,已成为我的习惯。努力向上吧,星星就躲藏在你的灵魂深处;做一个悠远的梦吧,每个梦想都会超越你的目标。要想成就伟业,除了梦想,必须行动。 排,实际上人们每天在安排着自己的一切活动家都是梦想家。悲观的人,先被自己打败,然后才被生活打败;乐观的人,先战胜自己,然后才战胜生活。梦想一旦被付 是人生最快乐的时光,但这种快乐往往完全是因为它充满着希望,而不是因为得到了什么或逃避了什么。你的生活深度取决于你对年幼者的呵护,对年长者的同情,对 强者的包容。因为生命中总有一天你会发现其中每一个角色你都扮演过。事实上是,哪个男孩女孩没有做过上天入地、移山倒海的梦啊,只不过在生活面前,很多人慢 以他们沦落为失去梦想的人;而有些人,无论生活多么艰难,从来没有放弃��
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.表示:符号为U 单位是KJ/mol ,取正值
3、影响晶格能大小因素 离子晶体中阴阳离子半径越小,所带电荷越多, 离子键越强,晶格能越大
4 晶格能的作用:
(1)晶格能越大,离子晶体越稳定,离 子晶体的熔沸点越高,硬度越大。 (2)岩浆晶出规则与晶格能的关系
★晶格能高的晶体熔点较高,更容易在岩 浆冷却过程中冷却下来,从而先结晶
例:下列热化学方程式中,能直接表示出氯 B 化钠晶格能的是______ A、 Na (s) + 1/2Cl2 (g) = NaCl(s); △H B、Na+(g) + Cl- (g) = NaCl(s); △H1 C、Na (s)= Na (g) ; △H2 D 、Na (g) -e- = Na+ (g) ; △H3 E、1/2Cl2(g)=Cl(g); △H4 F、Cl(g) + e- =Cl-(g); △H5 写出△H1与△H 、△H2、△H3、△H4、 △H5之间的关系式_____
4 2°阳离子的配位数: 4 阴离子的配位数:
科学探究:
找出NaCl、CsCl两种离子晶体中阳离子和 阴离子的配位数,它们是否相等?
离子晶体 NaCl CsCl 阴离子的配位数 阳离子的配位数
6
6
8
8
科学探究:
你认为是什么因素决定了离子晶体中离子 的配位数?根据表3—5、表3—6分析影响 离子晶体中离子配位数的因素。
配位数 半径比
4
0.2~0.4
6
0.4~0.7
8
0.7~1.0
空间构型
ZnS
NaCl
CsCl
6、决定离子晶体结构的因素
(1)几何因素
晶体中正负离子的半径比
(2)电荷因素
晶体中正负离子的电荷比
(3)键性因素
离子键的纯粹因素
1、几何因素
配位数与 r +/ r- 之比相关: 0.225 —— 0.414 4 配位 0.414 —— 0.732 6 配位 0.732 —— 1.000 8 配位
(2)氯化铯晶体
氯化铯晶体中 氯离子和铯离 子分别处于晶 胞的什么位置?
铯离子
氯离子
氯离子位于顶点, 铯离子位于体心。
CsCl晶体中离子的配位数
(1)每个晶胞含铯离子、 氯离子的个数? (2)在氯化铯晶体中,每 个Cs+周围与之最接近且距离 相等的Cl-共有 ;这几个 Cl-在空间构成的几何构型 为 。 (3)在每个Cl-周围距离相等且最 近的Cs+共有 ;这几个Cs+ 在 空间构成的几何构型 。
NaCl:95/181=0.525 CsCl:169/181=0.933
2、电荷因素
由正负离子的电荷比影响 离子晶体的配位数的因素, 称为电荷因素。 例:CaF2的晶体中,Ca2+ 1:2 和F-的个数之比____,电 荷数之比_____,Ca2+配位 2:1 数是_____,F-的配位数 8 是_______。 4
第四节 离子晶体
第 一 课 时
水 晶 雪花
常见晶体
氯 化 钠 干冰
金刚石
明矾
1.NaCl晶体是典型的离子化合物,其中 存在哪些微粒?试写出NaCl的电子式.
2.上述离子是通过怎样的相互作用结合 成晶体的呢?
知识回顾:离子键
1、 使阴、阳离子结合成离子化合物的静电作用 称 为离子键。 2、成键的微粒: 阴、阳离子 3、成键的本质:阴阳离子间的静电作用
(3)CaF2型晶胞
1°一个CaF2晶胞中含:
4个Ca2+和8个F¯
2°Ca2+的配位数:8 F-的配位数:4
Ca
F
晶胞上面心 图示为CaF2晶胞的1/8, 观察点为上左前方
8 Ca2+配位数是_____,F-的配位数是 4 _______。
(4)ZnS型晶胞
1°一个ZnS晶胞中含: 4个阳离子和4个阴离子
6、影响离子键强弱的因素:
离子半径和 离子电荷
Q1Q2 FK 2 r
同种类型的离子晶体,通常离子半 径越 小、离子带电荷越 多 ,离子键就 越 强。离子键越强,破坏它所需能量 就越 大 。熔点就越 高 。
7、离子键的特征
没有方向性: 阴阳离子是球形对称的,电荷的分布也是 球形对称的,它们在空间各个方向上的静电 作用相同,都可以和带不同电荷的离子发生 作用 没有饱和性: 在静电作用能达到的范围内,只要空间条 件允许,一个离子可以多个离子发生作用
重晶石
BaSO4
明矾 KAl(SO4)2· 2O 12H
莹石
CaF2
胆矾 CuSO4· 2O 5H
一、离子晶体
1、定义: 由阳离子和阴离子通过离子键 结合而成的晶体。
2、成键粒子: 阴、阳离子 3、相互作用力: 离子键 4、常见的离子晶体:强碱、活泼金属氧化 物、大部分的盐类。
阅读课本P79最后一段(即科学 视野之前的一段),结合氯化钠晶体 的结构,你认为离子晶体物理性质有 何特点?
思考:氯化钠晶体中钠离子和氯离子分别处 于晶胞的什么位置? 顶点和面心是钠离子 棱上和体心是氯离子
NaCl晶体中离子的配位数
3 3 6 1 2 1 5 4 6 2
5
4
这几个Na+在空间 构成的几何构型 为 正八面体 。
每个Cl- 周围 与之最接近且 距离相等的Na+ 6 共有 个。
CsCl晶体的结构
21参照下表中物质的熔点,回答有关问题:
物质 NaF NaCl 801 SiCl4 NaBr 755 SiBr4 NaI 651 SiI4 12.05 NaCl 801 SiCl4 KCl 776 RbCl 715 CsCl 646 PbCl4 熔点℃ 995 物质 SiF4
GeCl4 SnCl4
△H =△H1 +△H2+△H3 +△H4 +△H5
练习
1、下表列出了有关晶体的知识,其中错误的是( B
A 晶体 组成晶体的微粒 晶体微粒间存在的作用力 硫化钾 阴阳离子 离子键 B 干冰 分子 共价键 C 金刚石 原子 共价键 D 碘 分子 范德华力
)
2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是 ( ) A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2 C C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
熔点℃ -90.2 -70.4 5.2
-70.4 -49.5 -36.2 -15.0
① 钠的卤化物及碱金属的氯化物的熔点高低取决于其 ______________________,在这种情况下,____________越大, ________________越弱,故熔点依次降低。 ② 硅的卤化物及硅、锗、锡、铅的氯化物的熔点高低取决于其 _______________, ___________________越大, ___________________越大,故熔点依次升高。 ③ 钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由 ______________。
CaF2的晶胞
熔点℃
沸点℃
NaCl
CsCl
801
645
1413
1290
为什么NaCl的熔沸点比CsCl高?
结论:
对于组成和结构相似的物质, 阴、阳离子半径越小,离子键越强, 熔沸点较高,晶体越稳定。 离子键的强弱在一定程度上可以 用离子晶体的晶格能来衡量。
(二)、离子晶体的晶格能
1.概念:气态离子形成1摩尔离子晶体 释放的能量,通常取正值。或指拆开1mol离子
5.如图所示是某些晶体的结构,它们分别是NaCl、CsCl、 干冰、金刚石、石墨结构中的某一部分。
⑴ 其中代表金刚石的是(填编号字母,下同)_____,其中每个 碳原子与____个碳原子最接近且距离相等。金刚石属于____晶体。 ⑵ 其中代表石墨的是_______,其中每个正六边形占有的碳原子 数平均为______个。 ⑶ 其中代表NaCl的是______。⑷ 代表CsCl的是___,它属于___ 晶体,每个Cs+与__个Cl—紧邻。 ⑸ 代表干冰的是_________,它属于______晶体,每个CO2分子 与______个CO2分子紧邻。 ⑹ 上述五种物质熔点由高到低的顺序_____________________的是 A.NH4Cl B.SiO2 C.P4 D.Na2SO4 问题反思——化学式能否表示分子,关 键能判断该物质是否分子晶体
4.下列有关晶体的叙述中不正确的是 ( ) A.金刚石的网状结构中,由共价键形成的碳 原子环中,最小的环上有6个碳原子 B. 氯化钠晶体中,每个Na+周围距离相等的 Na+离子共有6个 C.氯化铯晶体中,每个铯原子周围紧邻8个氯 原子 D.干冰晶体中,每个二氧化碳分子周围紧邻 12个二氧化碳分子
4、成键的条件: 活泼金属元素的原子和活 泼的非金属元素的原子
5.常见的离子化合物
哪些物质中含有离子键?
思考
1、活泼的金属元素(IA、IIA)和活泼的非金 属元素(VIA、VIIA)形成的化合物。 2、活泼的金属元素和酸根离子(或氢氧根离子) 形成的化合物 3、铵根和酸根离子(或活泼非金属元素离子) 形成的盐。 4、从物质类别的角度来说,离子化合物通常包 括________、___________和________________。 强碱 大多数盐 活泼金属氧化物
5. 离子晶体物理性质的特点:
(1) 熔沸点 较高 , 难挥发难压缩。 离子电荷越多,核间距离越小,熔沸点升高。 (2) 硬度 较大 。 (3) 水溶性 一般易溶于水,而难溶于非极性溶剂。 (4) 导电性 固态不导电,水溶液或者熔融状态下能导电。
5、晶胞类型:
(1) 氯化钠晶体
