第5章固溶体
第4章:固溶体

第4章,固溶体(Solid Solution)掺杂通常不改变(被掺杂)材料的结构类型。
因此掺杂即“固溶”(固溶体——原子水平均匀分散的固态溶液。
掺杂有间隙掺杂(间隙固溶体)和取代掺杂(代位固溶体),有原子掺杂(原子固溶体)和离子掺杂(离子固溶体)。
本章重点讨论形成固溶体的条件及规律。
“固溶体”科学,尚处于“经验总结”的发展阶段。
因此,对于相关“结论”/“总结”,不能绝对化。
杂质原子导入引起晶格畸变,一定区域内的原子拉或压应力,系统能量增加。
当能量增加到一定程度,主体结构不再稳定,这就是固溶极限。
“15%规律”的不严格性:掺杂导致晶格畸变和能量升高,从而限制了极限掺杂量。
晶格畸变和能量升高,不但与尺寸差(ΔR)有关,同时与掺杂原子或离子的性质有关(例如可变形性),以及主结构的键合力(材料的理论弹性模量E)有关。
材料的E 越大,掺杂原子的尺寸限制就越严格,这时ΔR可能降低到8~10%。
相反,若主体结构较为开放,E较小,ΔR可能增大到21%。
一般而言:ΔR<15%:形成连续固溶体(必要条件,而非充要条件);15%~30%:形成有限固溶体;ΔR>30%,固溶度很低或不能形成固溶体。
b) 电负性因素:掺杂原子和主结构原子的Pauling 电负性差别越大,元素周期表中距离越远,元素间易形成化合物(ΔE > 0.4),而不易形成固溶体。
另一较普遍的规律:当掺杂原子在体系中可以多种状态存在是,它的固溶度将发生改变。
物种越稳定,固溶度越小。
例如,Fe-C固溶体中,碳可有两种形态——FeC3或石墨,石墨远比FeC3稳定,因此,FeC3在Fe中的固溶度远大于C。
二元合金体系:掺杂金属原子的价电子数与主体金属 原子的价电子数差别越大,固溶度越低。
例如:Zn (二价)、Ga(三价)、Ge(四价)、As(五价)在 一价金属(Cu、Ag、Au)中的固溶度分别为38.5 at%、 19.5 at%、11.8 at%、7 at%。
第五章 相平衡

b.同一相内物质间有浓度限制条件R′
5.3 相律
相律
例如:合成氨时系统内有N2,H2,NH3 N2+3H2=2NH3
Kp p p p
2 NH 3 3 N2 H 2
C= S-R C =S-R-R´ 5.3 相律
相律
C = S - R - R'
注意: (1)R---表示独立的化学平衡数。有时系统中可以 存在很多化学平衡,但是独立的并不多。
5.3 相律
相律
自由度(degree of freedom) 系统内独立可变因素的数目称为自由度,用字母f 表示。独立可变因素包括压力、温度和浓度等。
独立可变因素是指在一定范围内这些可变因素变 化时,不会引起相的改变,既不会使原有相消失, 也不会增加新的相。
5.3 相律
相律
相律(phase rule)
Φmin=1
fmin=0
(3)可求系统中最多相数Φ
max
5.3 相律
相律
例题(P336,习题4):已知Na2CO3(s)和 H2O(l)可以生成三种水合物: Na2CO3· H2O(s), Na2CO3· 7H2O(s)和 Na2CO3· 10H2O(s),试求: (1) 在大气压力下,与Na2CO3水溶液和冰 平衡共存的水合盐的最大值; (2) 在298K时,与水蒸气平衡共存的水合 盐的最大值。
单组分系统的两相平衡
解:
p2 vap H m 1 1 (1) ln p1 R T1 T2 p2 34170J m ol1 1 1 ln 1 1 10.02kPa 8.314J m ol K 293K 303K p2 15.91kPa
5.1 引言
物理化学第五章2

2、 等压T-x-y图( 沸点组成图 )
T x y
( yA )
p
等温p x
p
T4 T3 T2
T : 纯B物质的沸点 T : 纯A物质的沸点
A
B A
T1
B
x1
x2 xA
x3
x4
p xA yA p
T x y
气相线
A
T
TB
液相线
p
B
TA
xA
A
( yA )
T
B
T
A
T
B
T
A
l
完全互溶双液系
两个纯液体组分可以按任意比例相互混合 成均一液相的体系,称为完全互溶双液系(或 液体混合物)。
理想的完全互溶双液系
若混合溶液中任一组分在全部浓度范围内, 其蒸气压与液相组成的关系都符合Raoult定律, 则这样的双液系称为理想的完全互溶双液系(或 理想的液体混合物)。
B A
A A A B
说明1 液相线是直线,
p pA pB p ( p p ) xA
B B A
B
A
B
p p 气相线不是直线, p pA ( p pA ) yA
p
气相线
液相线
?
说明2
p p
A
B
yB pB p xB yA pA p xA
答案:A
三、杠杆规则
1、物系点与相点? 2、杠杆规则的内容? 3、杠杆规则推导的依据? 4、杠杆规则在相图中的应用?
三、杠杆规则 1、物系点与相点
物系点: 相图中表示体系总状态(总组 成、温度和压力)的点称为物系点。
第五章 固溶体半导体材料

李斌斌
5.1 固溶体的概念
5.2 SiGe固溶体 5.3 应用 Nhomakorabea
5.1 固溶体
凡在固体条件下,一种组分(溶剂)内“溶解” 了其它组分(溶质)而形成的单一、均匀的晶态 固体称为固溶体。
固溶体半导体材料是某些元素半导体或者化合物 半导体相互溶解而形成的一种具有半导体性质的 固态溶液材料,又称为混晶半导体或者合金半导 体。
SiGe合金是目前较为成熟的一种高温热电材料, 适用于制造由放射线同位素供热的温差发电器, 并已得到实际应用。
1977年旅行者号太空探测器首次采用SiGe合金作 为温差发电材料; 在此后美国NASA的空间计划中,SiGe差不多完 全取代PbTe材料。
其它内容
见教材
赝晶生长--共度生长
临界厚度---应力没有释放
产生位错和形成表面起伏是释放SiGe失配应 力的两种方式。
当Ge组分较低时(x<0.2),通过产生位错 来释放失配引起的应力; 当Ge组分介于0.2~0.6之间时将会导致形成 台阶,诱导生成均匀的3D岛; 当Ge组分大于0.6时,遵循SK模式三维生长, 利于形成表面起伏来释放失配引起的应力。 可以用来生长高组分表面起伏的多量子阱
电学性质--禁带宽度
Eg ( x) a bx cx
2 2
1.115 0.43x 0.0206 x (0 x 0.85)
Eg ( x) 2.01 1.27 x(0.85 x 1)
带隙和温度的关系
E
Si g
1.206 2.7310 T
4
固溶体

固溶体
掺杂、溶解
M gVO M g O A l2 O 3 2 ' 2
A l O
O
A l M gO 2x
x
3x(x0~2) 2
原子(离子)尺度
与主相Al2O3相同 均匀单相
2019/6/6
3
固溶体、化合物、机械混合物
形成方式 反应式
化学组成 混合尺度
结构 相组成
化合物 化学反应
M g O A l2 O 3 A lM g 2 O 4 AlMg2O4
原子(离子)尺度 AB2O4型结构-新相
单相
2019/6/6
4
固溶体、化合物、机械混合物
形成方式 反应式
化学组成 混合尺度
结构 相组成
机械混合物 简单的机械混合 MgOAl2O3 均匀混合
MgOAl2O3
晶体颗粒态 MgO结构+Al2O3结构 两相(或多相),有界面
r1 r2 r1
<15%
形成连续固溶体
15%~30% 形成有限固溶体
>30%
不能形成固溶体
如:MgO-CoO固溶体,溶质-溶剂晶体可
按任意比例无限互溶
(MgXCo1-X)O,X=0~1, (rMg2+= 0.08nm; rCo2+=0.074nm)
结构相同 半径相似
【电例负】性半相径近差别大电:价M相gO同-CaO系SS----有限
Z r
i
O
2019/6/6
20
小结:期在不等价置换固溶体中,可能出现的四种 “组分缺陷”
高价置换低价
阳离子出现空位 阴离子进入间隙 低价置换高价
C2 a K C C C lK l V a K 2 C C C2 a K C C C lK lC a li C C
第5章 材料的形变和再结晶4

steel or, lead. Platinum and white gold are, at present, the most popular materials.
White gold(白金) is an alloy of gold (i.e., it is gold and silver or palladium(钯). This is where the concept of Karat (开,克拉) comes in. Karat is a measure of the purity of the material.
2. 晶粒越细,塑韧性提高
细晶粒材料中,应力集中小,裂纹不易萌生; 晶界多,裂纹不易传播,在断裂过程中可吸收较 多能量,表现出高韧性。
晶界在塑性变形中的作用
协调作用:协调相邻晶粒变形
障碍作用:阻碍滑移的进行 促进作用:高温变形时两相邻晶粒沿晶界滑动 起裂作用:晶界阻碍滑移晶界应力集中
Strength or elongation
Cu
回答:为什么钻戒不用纯金而是用白金作为托 架的问题?
利用合金固溶强化理论,白金的硬度显然比纯金的高 ,以保证钻石不会从戒指中脱落。
4)屈服现象与应变时效
①屈服现象
上屈服点:试样开始屈服时对应的应力
下屈服点:载荷首次降低的最低载荷 屈服伸长:试样在此恒定应力下的伸长
拉伸试验时, p 接近于恒定。
m'
塑形变性前,ρm很低,v很大,τ 很大;这就是上屈服点 高的原因。
3. 弥散强化 4. 加工硬化
6. 应变时效
7. 柯氏气团 8. 形变织构
Questions?
1. 为什么工程上很少用纯金属?
固溶体的分类

则化学式为:Ca2yZr1-yO2 x、y为待定参数,可根据实际掺入量确定。
3、 举例
以添加了0.15molCaO的ZrO2固溶体为例。 (1)置换式固溶体:化学式 CaxZr1-xO2-x 即Ca0.15Zr0.85O1.85。ZrO2属立方晶系,萤石结 构,Z=4,晶胞中有Ca2+、Zr4+、O2-三种质点。
2、活 化 晶 格
形成固溶体后,晶格结构有一定畸变, 处于高能量的活化状态,有利于进行化学 反应。如,Al2O3熔点高(2050℃),不利 于烧结,若加入TiO2,可使烧结温度下降 到1600℃,这是因为Al2O3与TiO2形成固溶 体,Ti4+置换Al3+后, 带正电,为平 衡电价,产生了正离子空位,加快扩散, 有利于烧结进行。
第二节
置换型固溶体
(一)形成置换固溶体的影响因素
1、离子尺寸因素 2、离子的电价因素 3、晶体的结构因素 4、电负性因素
第三节 间隙型固溶体
形成间隙型固溶体的条件
间隙式固溶体的固溶度仍然取决于离子尺寸、离 子价、电负性,结构等因素。
1、 杂质质点大小
即添加的原子愈小,易形成固溶体,反之亦然。
第四章
第一节
固
溶
体
固溶体的分类
按杂质原子在固溶体中的位置分类
固溶体的分类1
置换型固溶体:杂质原子 进入晶体中正常格点位置 所生成的固溶体。 间隙型固溶体:杂质原 子进入溶剂晶格中的间隙 位置所生成的固溶体。
第一节
固溶体的分类
按杂质原子在晶体中的溶解度分类
固溶体的分类2
无限型固溶体:溶质和溶 剂两种晶体可以按任意比 例无限制地相互固溶。 有限型固溶体:溶质只 能以一定的溶解限量溶 入到溶剂中 。
材料科学基础-第五章 材料的相结构及相图

相律在相图中的应用
C
2 二元系
P 1 2
3 1
f 2 1 0
3 2 1 0
含义
单相合金,成分和温度都可变 两相平衡,成分、相对量和温度 等因素中只有一个独立变量 三相平衡,三相的成分、相对 量及温度都确定 单相合金其中两个组元的含量 及温度三个因素均可变 两相平衡,两相的成分、数量 及温度中有两个独立变量 三相平衡,所有变量中只有 一个是独立变量 四相平衡所有因素都确定不变
结构简单的具有极高的硬度及熔点,是合金工具钢和硬 质合金的重要组成相。
I. 间隙化合物
间隙化合物和间隙固溶体的异同点
相同点: 非金属原子以间隙的方式进入晶格。
不同点: 间隙化合物:间隙化合物中的金属组元大多与自 身原来的结构类型不同 间隙固溶体:间隙固溶体中的金属组元仍保持自 身的晶格结构
I. 尺寸因素
II. 晶体结构因素 组元间晶体结构相同时,固溶度一般都较大,而且有可 能形成无限固溶体。若不同只能形成有限固溶体。
III. 电负性差因素
两元素间电负性差越小,越易形成固溶体,且形成的 固溶体的溶解度越大;随两元素间电负性差增大,固 溶度减小。
1)电负性差值ΔX<0.4~0.5时,有利于形成固溶体 2)ΔX>0.4~0.5,倾向于形成稳定的化合物
Mg2Si
Mg—Si相图
(2)电子化合物
由ⅠB族或过渡金属元素与ⅡB,ⅢB,ⅣB族元素 形成的金属化合物。 不遵守化合价规律,晶格类型随化合物电子浓度 而变化。 电子浓度为3/2时: 呈体心立方结构(b相); 电子浓度为21/13时:呈复杂立方结构(g相); 电子浓度为21/12时。呈密排六方结构(e相);
NaCl型 CaF2型 闪锌矿型 硫锌矿型 (面心立方) (面心立方) (立方ZnS) (六方ZnS)
第五章_脱溶沉淀
6.4.2 低碳钢的时效 所谓低碳钢的时效,是指间隙原子碳、氮在αFe中的脱溶所引起的性能变化。
氮原子偏聚区 → 过渡相α ''− Fe16 N 2 → 平衡相γ ' − Fe4 N
Fe-N过饱和固溶体脱溶时N原子偏聚区的TEM像
6.4.3回火
含碳量在0.23%以上 的马氏体存在沉淀过程。
碳钢马氏体的沉淀贯序:
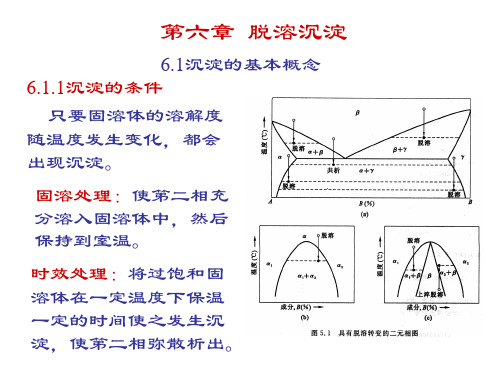
第六章 脱溶沉淀
6.1沉淀的基本概念 6.1.1沉淀的条件 只要固溶体的溶解度 随温度发生变化,都会 出现沉淀。 固溶处理:使第二相充 分溶入固溶体中,然后 保持到室温。 时效处理:将过饱和固 溶体在一定温度下保温 一定的时间使之发生沉 淀,使第二相弥散析出。
6.1.2沉淀的分类 1.连续沉淀和不连续沉淀 ①连续沉淀:以孤立小颗 粒或薄片在母相中形成。 ②不连续沉淀:在晶界形 核逐步向晶内发展、长大。
dr 2 D γ V B C αβ ( ∞ ) 1 1 = − (6.40) dt kTr r r
2 D γ V B C αβ ( ∞ ) 1 1 dr = − (6.40) 的几点讨论: dt kTr r r
dr (1) r < r时, < 0,半径小于 r的粒子溶解; dt dr ( 2 ) r > r时, > 0,半径大于 r的粒子长大; dt dr ( 3 ) r = 2 r时, 为极大值,即 r = 2 r的粒子长大最快; dt ( 4 ) 粗化过程中,小粒子溶 解,大粒子长大; (5 (5)升温加快粗化过程。
体积分数一定,粒子半径越 f—粒子的体积百分数。 大,强化效果越大。
6.6.2位错绕过颗粒机制(Orowan理论) 强化增量:
Gbf 2r ∆τ = ln( ) (6.44) r r0
《无机非金属材料科学基础》第5章 熔体和非晶态固体

目录
• 第一节 • 第二节 • 第三节 • 第四节 • 第五节 • 第六节
熔体的结构 玻璃的通性 玻璃的结构 非晶态固体的形成 常见玻璃类型与实例 玻璃的性质
5.1 熔体的结构
• 对熔体结构的一般认识:
1. 晶体与液体的体积密度相近。
当晶体熔化为液体时体积变化较小,一般不超过10% (相当于质点间平均距离增加3%左右);而当液体气化时, 体积要增大数百倍至数千倍(例如水增大1240倍)。
V、Q
过冷液体
a
b
玻璃
e
c
快
f
冷慢 h
冷
d
晶
体
Tg1 Tg2 TM
T
物质体积与内能 随温度变化示意图
玻璃性质随温度的变化
5.3 玻璃的结构
玻璃的性质不但与化学组成有关,与它 的结构一也密切相关,研究玻璃的结构有助 于进一步了解玻璃的性质和特点。玻璃结构 是指玻璃中质点在空间的几何配置、有序程 度及它们彼此间的结合状态。由于玻璃结构 的复杂性,至今尚未提出一个统一和完善的 玻璃结构理论。目前最主要的、广为接受的 玻璃结构学说是微晶学说和无规则网络学说。
第二,微晶的化学成分还没有得到合理的确定。
• 网络学说:
优点:强调了玻璃中离子与多面体相互间排列的均匀 性、连续性及无序性等方面结构特征。这可以说明玻 璃的各向同性、内部性质的均匀性与随成分改变时玻 璃性质变化的连续性等基本特性。如玻璃的各向同性 可以看着是由于形成网络的多面体(如硅氧四面体) 的取向不规则性导致的。而玻璃之所以没有固定的熔 点是由于多面体的取向不同,结构中的键角大小不一, 因此加热时弱键先断裂然后强键才断裂,结构被连续 破坏。宏观上表现出玻璃的逐渐软化,物理化学性质 表现出渐变性。
材料热力学 第5章 相变热力学

5.4 析出相表面张力效应
5.4.1 表面张力与附加压力
附加压力:
5.4,2 表面张力与溶解度 多数的情况下附加压人的影响是作用在第二相粒子上,如果α基体上分布着球 形的第二相β,那么α是处于常压下.而β在此基础上还要受到附加压力的作用, 如下式所示:
第5章 相变热力学
5.1 无扩散相变
特点:相变无成分变化
T0线就是各温度下母相与转变产物柑的摩尔自由能相等的各点成分的连线, 或称无扩散相交驱动力为o的成分与温度关系曲线。
冷却时所发生的无扩散切变相变的开始温度称作马氏体点。 马氏体点比To线温度低得多:马氏体相变阻力大,需要驱动力大
由于存在磁性:
5.2 固溶体的分解 5.2.1 固溶体自由能曲线的分析
固溶体稳定 固溶体失稳分解
若忽略成分的3次方以上各项:
可分为:稳定区; 失稳区:
亚稳区:
但生成相自由能低,发生形核 生长。
若自由能曲线如下图所示
△Gm﹥0,相变不发生
若自由能曲 线如图
形核驱动力:
5.3 第二相析出
第5章结构缺陷及固溶1

材料科学基础
2. 肖特基缺陷
材料科学基础
晶格位置 = 表面(晶界)位置 + 内部空位
材料科学基础
M M g g O O V M '' g V O M S g O S
0VM '' gVO
材料科学基础
[VM '' ]g[VO ]KS
OO2'eVO 1 2O2
材料科学基础
在无机材料中,发生缺陷反应时以质点取 代(置换)的情况为常见
取代类别 取代情况
缺陷
带电性
高价取代低价 正离子空位或负离子填隙 正离子取代
低价取代高价 正离子填隙或负离子空位
负电 正电
高价取代低价 负离子空位或正离子填隙 负离子取代
低价取代高价 负离子填隙或正离子空位
材料科学基础
(1)点缺陷 由于各种原因使晶体内部质点有规则的
周期性排列遭到破坏,引起质点间势场畸变 ,产生晶体结构不完整性,但其尺度仅仅局 限在1个或若干个原子级大小的范围内,这 种缺陷就称为点缺陷。零维缺陷。
材料科学基础
(2)线缺陷 如果晶体内部质点排列的规律性在某
一方向上达到一定的尺度范围遭到破坏, 就称为线缺陷,也称位错。一维缺陷。
生原因等不同角度进行分类,不同分类方
法可能产生重叠交叉。
材料科学基础
1. 按照位置和成分分类 空位 填隙质点 杂质缺陷
材料科学基础
1)空位: 正常结点没有被原子或离子所占据,成为
空结点,称为空位或空穴
M+ X M+ X
M+ X M+ X
第五章固溶体

A、B形成固溶体,A和B之间以原子尺度混合成为单相均匀晶态物质。机械混合物A、B是A和B以颗粒态混合,A和B分别保持本身原有的结构和性能,A、BA和B形成化合物AmBn,A:B≡m:n有固定的比例。
固溶体中由于杂质原子占据正常格点的位置,破坏了基质晶体中质点排列的有序性,引起晶体内周期性势场的畸变,这也是一种点缺陷范围的晶体结构缺陷。
又如Fe2O3和A12O3两者的半径差为18。4%,虽然它们都有刚玉型结构,但它们也只能形成有限置换型固溶体。但是在复杂构造的柘榴子石Ca3Al2(SiO4)3和Ca3Fe2(SiO4)3中,它们的晶胞比刚玉晶胞大八倍,对离子半径差的宽容性就提高,因而在柘榴子石中Fe3+和Al3+能连续置换.
(3)离子电价的影响
固溶体中由于杂质原子占据正常格点的位置破坏了基质晶体中质点排列的有序性引起晶体内周期性势场的畸变这也是一种点缺陷范围的晶体结构缺固溶体在无机固体材料中所占比重很大人们常常采用固溶原理来制造各种新型的无机材料
第二章 固溶体
一种组分(溶剂)内“A物质溶解在B物质中形成的,一般将原组分BAl2O3晶体中溶入Cr2O3为例,A12O3为溶剂:Cr3+溶解在A12O3中以后,并不破坏Al2O3原有晶体结构。但少量Cr3+(约0.5wt%~2wt%)的溶入,由于Cr3+能产生受激辐射,就会使原来没有激光性能的白宝石(α-Al2O3)变为有激光性能的红宝石。
(二置换型固溶体
在天然矿物方镁石(MgO)中常常含有相当数量的NiO或FeO,Ni2+和Fe2+离子置换晶体中Mg2+离子,生成连续固溶体。固溶体组成可以写成(Mg1-xNix)O,x=O~1.能生成连续固溶体的实例还有:Al2O3—Cr2O3;ThO4-UO2;PbZrO3-PbTiO3等。除此以外,还有很多二元系统可以形成有限置换型固溶体。例如MgO—A12O3;MgO-CaO;ZrO4-CaO等等.
第5章固溶体

结论:
具有近似半径的离子较容易互相取代,成分 在大范围内变化的固溶体可以在任何温度下 形成,具有稳定性;
离子半径差别在 15%-20%,固溶体可在高温 下形成; 离子半径差别大于30%,固溶体不能形成。
12
离子尺寸因素
系统 MgO-NiO NiO-CaO 离子 Mg2+ Ni2+ 半径 /nm 6.6 7.0 7.0 10.0 6.6 2.7 2.7 10.0 半径差 (R1-R2)/R1 固溶情况 /nm /% 0.4 3.0 3.9 7.3
6
固溶体的分类
2.
按杂质原子/离子在晶体中溶解度划分:
A 无限固溶体(连续固溶体或完全互溶 固溶体) B 有限固溶体(不连续固溶体或部分互 溶固溶体)
7
无限固溶体:溶质和溶剂两种晶体可以按任 意比例无限制的相互溶解,即溶质的溶解度 可达100%。
(NixMg1-x)O x=0-1
8
如果杂质原子在固溶体中的溶解度是有
LiF 和 CaO
晶体结构实际上与离子尺寸、离子价是密切联系的。
16
5.4 填隙型固溶体
定义:外来杂质原子/离子进入晶格的间隙位 置形成的固溶体。 填隙型固溶体在金属中比较常见,而在无机 非金属材料中比较少见,该固溶体的生成, 通常会导致基质晶体晶格常数增大,当增大 到一定程度时,导致固溶体不稳定或分解, 因此填隙型固溶体只能生成有限固溶体。
17
18
储氢合金
重要的填隙型固溶体:储氢合金 稀土金属与氢气反应生成稀土氢化物 REH2 ,这种
氢化物加热到1000C以上才会分解。而在稀土金属
无机材料科学基础第五章固溶体

将外来组元引入晶体结构,占据主晶相质点位置一部分或间隙位置一部分,仍保持一个晶相,这种晶体称为固溶体(即溶质溶解在溶剂中形成固溶体),也称为固体溶液。
固溶体的分类
置换型固溶体
间隙型固溶体
形成固溶体后对晶体性质的影响
固溶体的研究方法
第五章 固溶体
A
根据外来组元在主晶相中所处位置 ,可分为置换固溶体和间隙固溶体。
在金属氧化物中,主要发生在金属离子位置上的置换,如:MgO-CaO,MgO-CoO,PbZrO3-PbTiO3,Al2O3-Cr2O3等。
C3S的固溶体C54S16MA2.相当于18个Si中有两个被置换。
间隙式固溶体,亦称填隙式固溶体,其溶质原子位于点阵的间隙中。
01
金属和非金属元素H、B、C、N等形成的固溶体都是间隙式的。如:在Fe-C系的α固溶体中,碳原子就位于铁原子的BCC点阵的八面体间隙中。
3、固溶强化
实际应用:铂、铑单独做热电偶材料使用,熔点为1450℃,而将铂铑合金做其中的一根热电偶,铂做另一根热电偶,熔点为1700℃,若两根热电偶都用铂铑合金而只是铂铑比例不同,熔点达2000℃以上。
4、形成固溶体后对材料物理性质的影响 固溶体的电学、热学、磁学等物理性质也随成分而连续变化,但一般都不是线性关系。固溶体的强度与硬度往往高于各组元,而塑性则较低。
主要是氧化镁杂质的存在,阻碍了晶界的移动速度,使气体容易消除,从而得到透明氧化铝陶瓷。
另外,氧化铝掺杂其他一些氧化物可制的相应颜色的各类宝石制品。
详见P79页。
透明Al2O3 陶瓷
”
A
B
C
固溶体类型的大略估计
固溶体类型的实验判别
固溶体组成的确定
五、固溶体的研究方法
物理化学答案——第五章-相平衡[1]
![物理化学答案——第五章-相平衡[1]](https://img.taocdn.com/s3/m/0243f86d58fafab069dc0265.png)
第五章 相平衡一、基本公式和内容提要基本公式1. 克劳修斯—克拉贝龙方程m mH dp dT T V ∆=∆相相(克拉贝龙方程,适用于任何纯物质的两相平衡) 2ln m H d p dT RT∆=相(克劳修斯—克拉贝龙方程,适用与其中一相为气相,且服从理想气体状态方程的两相间平衡)2.特鲁顿(Trouton)规则1188vap mvap m bH S J mol k T --∆=∆≈⋅⋅(T b 为该液体的正常沸点)3.相律 f+Φ=C+n C=S-R-R ′f+Φ=C+2 (最普遍形式)f* +Φ=C+1 (若温度和压力有一个固定,f * 称为“条件自由度”)*4. Ehrenfest 方程2112()p p C C dp dT TV αα-=-(C p ,α为各相的恒压热容,膨胀系数) 基本概念1. 相:体系中物理性质和化学性质完全均匀的部分,用Φ表示。
相的数目叫相数。
2. 独立组分数C =S -R -R ′,S 为物种数,R 为独立化学反应计量式数目,R ′ 为同一相中独立的浓度限制条件数。
3. 自由度:指相平衡体系中相数保持不变时,所具有独立可变的强度变量数,用字母 f 表示。
单组分体系相图相图是用几何图形来描述多相平衡系统宏观状态与 T 、p 、X B (组成)的关系。
单组分体系,因 C =1 ,故相律表达式为 f =3-Φ。
显然 f 最小为零,Φ 最多应为 3 ,因相数最少为 1 ,故自由度数最多为 2 。
在单组分相图中,(如图5-1,水的相图)有单相的面、两相平衡线和三相平衡的点,自由度分别为 f =2、f =1、f =0。
两相平衡线的斜率可由克拉贝龙方程求得。
图5-1二组分体系相图根据相律表达式f=C-Φ+2=4-Φ,可知f最小为零,则Φ最多为 4 ,而相数最少为 1 ,故自由度最多为 3 。
为能在平面上显示二组分系统的状态,往往固定温度或压力,绘制压力-组成(p-x、y)图或温度-组成(T-x、y)图,故此时相律表达式为f*=3-Φ,自然f*最小为 0 ,Φ最多为 3,所以在二组分平面图上最多出现三相共存。
材料科学基础第五章 材料的相结构及相图

SCHOOL OF CHEMISTRY AND MATERIAL SCIENCE OF GUIZHOU NORMAL UNIVERSITY
贵州师范大学 2)尺寸因素
化学与材料科学学院
溶质原子溶入溶剂晶格会引起晶格点阵畸变,使晶体能量升高。 晶格畸变能
能量越高,晶格越不稳定。
单位体积畸变能的大小与溶质原子溶入的数量及溶质原子的相对尺寸有关:
SCHOOL OF CHEMISTRY AND MATERIAL SCIENCE OF GUIZHOU NORMAL UNIVERSITY
贵州师范大学
化学与材料科学学院
1)晶体结构因素
溶质与溶剂的晶格结构相同→固溶度大。 例如:具有面心立方结构的Mn、Co、Ni、Cu,在γ-Fe中 固溶度较大,而在α-Fe中固溶度较小。 溶质与溶剂的晶格结构相同是形成无限固溶体的必要条件。
贵州师范大学
化学与材料科学学院
1)无限固溶体
无限固溶体都是置换固溶体? 2)有限固溶体 间隙固溶体只能是有限固溶体?
SCHOOL OF CHEMISTRY AND MATERIAL SCIENCE OF GUIZHOU NORMAL UNIVERSITY
贵州师范大学
化学与材料科学学院
按溶质原子分布分类 1)有序固溶体 2)无序固溶体
贵州师范大学
化学与材料科学学院
基本概念
组元:组成材料的最基本的、独立的物质,简称元。
金属元素:Cu、Al、Fe 非金属元素:C、N、O 化合物: Al2O3, MgO, Na2O, SiO2 单一组元组成:纯金属、 Al2O3晶体等 材料: 二元合金 多组元组成,含合金 三元合金
组元:
纯元素
合金:指由两种或两种以上的金属或金属与非金属 经熔炼或其它方法制成的具有金属特性的物质。
第五章__铁碳相图习题参考答案

第五章铁碳相图习题参考答案一、解释下列名词答:1、铁素体:碳溶入α-Fe中形成的间隙固溶体。
奥氏体:碳溶入γ-Fe中形成的间隙固溶体。
渗碳体:铁与碳形成的具有复杂晶体结构的金属化合物。
珠光体:铁素体和渗碳体组成的机械混合物。
莱氏体:由奥氏体和渗碳体组成的机械混合物。
2、Fe3CⅠ:由液相中直接析出来的渗碳体称为一次渗碳体。
Fe3CⅡ:从A中析出的Fe3C称为二次渗碳体。
Fe3CⅢ:从铁素体中析出的Fe3C称为三次渗碳体。
共析Fe3C:经共析反应生成的渗碳体即珠光体中的渗碳体称为共析渗碳体。
共晶Fe3C:经共晶反应生成的渗碳体即莱氏体中的渗碳体称为共晶渗碳体。
3、钢:含碳量大于0.00218%,小于2.11%的铁碳合金。
白口铸铁:含碳量大于2.11%的铁碳合金。
二、填空题1、常温平衡状态下,铁碳合金基本相有铁素体(F)、渗碳体(Fe3C)等两个。
2、Fe-Fe3C相图有4个单相区,各相区的相分别是液相(L)、δ相、铁素体(F)、奥氏体(A)。
3、Fe-Fe3C 相图有三条水平线,即HJB、ECF和PSK线,它们代表的反应分别是包晶反应、共晶反应和共析反应。
4、工业纯铁的含碳量为≤0.0218%,室温平衡组织为F+ Fe3CⅢ。
5、共晶白口铁的含碳量为4.3%,室温平衡组织P占40.37%,Fe3C共晶占47.82%,Fe3CⅡ占11.81%。
6、一钢试样,在室温平衡组织中,珠光体占60%,铁素体占40%,该钢的含碳量为0.4707。
7、钢的组织特点是高温组织为奥氏体(A),具有良好的塑、韧性,因而适于热加工成形。
8、白口铸铁的特点是液态结晶都有共晶转变,室温平衡组织中都有莱氏体,因而适于通过铸造成形。
三、简答题1、为什么γ-Fe 和α- Fe 的比容不同?一块质量一定的铁发生(γ-Fe →α-Fe )转变时,其体积如何变化?答:因为γ-Fe和α- Fe原子排列的紧密程度不同,γ-Fe的致密度为74%,α- Fe的致密度为68%,因此一块质量一定的铁发生(γ-Fe →α-Fe )转变时体积将发生膨胀。
【材料成型原理--铸造】第5章 单相合金的凝固

该式为液相只有扩散时的“成分过冷”判据。
9/22
二、“成分过冷”的过冷度
Tc=TL(x’) -T(x’) • 将固液界面前方的平衡液相温度(理论凝固温度)分
布直线曲T线(xT’)L(x的’)的表表达达式式代、入固上液式界,面可前以方导的出实“际成温分度过分冷”布 的过冷度表达式。
10/22
第二节 “成分过冷”对单相合金 凝固过程的影响
与 影
区叫“成分过冷区”。
7/22
2、必须具备的条件
• (1)固液界面溶质再分 配引起成分富集;
• (2)固液界面前方液相 的实际温度梯度必须达 到一定的值。即:
GL
dTL (x' ) dx'
x' 0
8/22
GL mLC0 (1 k0 )
v
DL k0
• 式中:
• v为凝固速度;
• mL为液相线斜率,mL0; • C0为合金浓度; • k0为溶质分配系数; • DL为液相溶质扩散系数。
d2
ቤተ መጻሕፍቲ ባይዱ
A2
TS'
1 3
GL
1
3
v
1 3
A2为常数,TS’为非平衡凝固温度范围。
21/22
谢谢!
22/22
18/22
四、宽成分过冷区的自由树枝晶(等轴晶)生长— —内生生长
当界面前方成分过冷 区进一步加宽时(G4), 成分过冷的极大值大于非 均质生核所需过冷度,于 是在柱状枝晶生长的同时, 界面前方液体将发生新的 自由形核过程,并长成树 枝晶,称为自由树枝晶或 等轴晶。
19/22
• 外生生长:平面生长、胞 状生长和柱状树枝晶生长 都属于一种晶体自型壁生 核,由外向内单向延伸的 生长方式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
宝石名称 淡红宝石 红宝石 紫罗兰宝石
基体 Al2O3 Al2O3 Al2O3
Al2O3 黄玉宝石 Mg(AlO2) 海蓝宝石 桔红钛宝石 2 TiO2 蓝钛宝石 TiO2
2.固溶体的电性能 PbTiO3 PbZrO3
PZT
29
思考题
1.为什么PZT用一般的烧结方法达不到
透明,而PLZT可以?
Ni2+ Ca2+ MgO-BeO Mg2+ Be2+ BeO-CaO Be2+ Ca2+
BaO-BeO
Ba2+ Be2+
13.6 2.7
10.9
13
离子尺寸因素
在相互取代的两种离子半径相差较大的体系 中,通常较大的离子比较容易被取代。
Na2SiO3-Li2SiO3体系
Na2SiO3中:50%的Na+可被Li+取代 Li2SiO3中:10%的Li+可被Na+取代
5
固溶体的分类
B 填隙型固溶体:溶质原子半径较小的 H、C、B、N等进入金属晶格的间隙。
6
固溶体的分类
2.
按杂质原子/离子在晶体中溶解度划分:
A 无限固溶体(连续固溶体或完全互溶 固溶体) B 有限固溶体(不连续固溶体或部分互 溶固溶体)
固溶体的性质
纯的Al2O3单晶是无色透明的,称为白宝石。 通过加入不同添加剂形成固溶体,可以形成 不同颜色的宝石。 Cr3+使Al2O3变成红色的原因:
红宝石强烈吸收 可见光中的篮紫 光,因而呈现红 色。
27
固溶体的性质
人造宝石
颜色 淡红色 红色 紫色 金黄色 蓝色 桔红色 蓝色 着色剂(%) Cr2O3 0.01-0.05 Cr2O3 1-3 TiO2 0.5 Cr2O3 0.1 Fe2O3 1.5 NiO 0.5 Cr2O3 0.01-0.05 CoO 0.01-0.05 Cr2O3 0.05 28 氧不足
22
3.传感器和控制器 贮氢合金生成氢化物后,氢达到一定平 衡压,在温度升高时,合金压力也随之升高。 根据这一原理,只要将一小型贮氢器上的压 力表盘改为温度指示盘,经校正后即可制成 温度指示器。这种温度计体积小,不怕震动, 温度测量准确,这种温度传感器还可改制成 火警报警器。
23
4.高性能充电电池—镍氢电池的负
极材料
5、氢同位素的分离
24
终端用户
氢能社会构想再生能
源制氢 电厂 加氢站
天然气制氢
燃料电池工厂
CO2处理
25
5.5 固溶体的性质
1.固溶体的光性能 利用加入杂质离子可以对晶体的的光学性能 进行调节或改变。 例: PZT 除了采用热等静压烧结之外,是无 法获得透明的烧结体的。在 PZT 中加入少量 La2O3 ,生成所谓的 PLZT , PLZT 可用热压 烧结或在高 PbO 气氛下通氧烧结形成透明烧 结体。 26
20
储氢合金的应用
储氢合金可在低压力下储存,除非外部加热, 否则不会放出氢气。因此,用储氢合金储存 氢安全可靠。 储氢合金还可以用于提纯和回收氢气,它可 将氢气提纯到很高的纯度。例如,采用储氢 合金,可以以很低的成本获得纯度高于 99.9999% 的超纯氢。
21
2.蓄热、热泵
,而放氢时又吸收 同量热,而且在吸放氢气的反应热很大,因 而可用于化学蓄热和化学热泵。
固 溶 体
主讲教师:闫尔云
1
5.1 固溶体的定义
定义:固溶体是指在固态条件下一种组元(组 分) “溶解”了其他组元而形成的单相晶态固
体。
一般把固溶体中含量较高的组元称为主晶体、
基质或溶剂,其他组元称为溶质。
2
固溶体和化合物的区别
固溶体是一种或多种原子(分子)部分取代 原有结构中的原子(分子)而不改变原有结
LiF 和 CaO
晶体结构实际上与离子尺寸、离子价是密切联系的。
16
5.4 填隙型固溶体
定义:外来杂质原子/离子进入晶格的间隙位 置形成的固溶体。 填隙型固溶体在金属中比较常见,而在无机 非金属材料中比较少见,该固溶体的生成, 通常会导致基质晶体晶格常数增大,当增大 到一定程度时,导致固溶体不稳定或分解, 因此填隙型固溶体只能生成有限固溶体。
2.形成一个简单的取代固溶体,需要满
足那些要求?
30
更复杂的固溶体机理-变价取代
31
离子补偿机制
1.产生阳离子空位 例如:NaCl中溶解少量CaCl2 2.产生填隙阴离子 例如: CaF2溶解少量YF3
32
33
11
结论:
具有近似半径的离子较容易互相取代,成分 在大范围内变化的固溶体可以在任何温度下 形成,具有稳定性;
离子半径差别在 15%-20%,固溶体可在高温 下形成; 离子半径差别大于30%,固溶体不能形成。
12
离子尺寸因素
系统 MgO-NiO NiO-CaO 离子 Mg2+ Ni2+ 半径 /nm 6.6 7.0 7.0 10.0 6.6 2.7 2.7 10.0 半径差 (R1-R2)/R1 固溶情况 /nm /% 0.4 3.0 3.9 7.3
构的同相晶体;
化合物则是由两种或两种以上不同元素的原
子或离子以固定组分形成宏观上均质的物质。
3
固溶体与机械混合物的区别
机械混合物:多相体系,各物相保持各
自的结构和性质;
固溶体:均匀的单相,其结构与掺杂物
无关,性质与基质晶体有着显著的不同。
4
5.2 固溶体的分类
1. 按杂质在固溶体中的位置 A 取代 ( 置换 ) 型固溶体:杂质原子或离子直 接代替母体结构中带相同电性的原子或离子。
17
18
储氢合金
重要的填隙型固溶体:储氢合金 稀土金属与氢气反应生成稀土氢化物 REH2 ,这种
氢化物加热到1000C以上才会分解。而在稀土金属
中加入另一种吸氢量小或根本不吸氢的金属元素形
成合金后,在较低温度下也可吸放氢气,通常将这
种合金称为储氢合金。
19
储氢合金的应用
1.氢气的贮存和提纯 稀土系储氢合金可以储存大量的氢气。1984年, 日本川崎重工业株式会社用储氢合金制造了世界上 第一个最大的储氢装置,这个装置是用一种含镧铈 混合稀土元素的镍钛合金制成的,能储存 175 标准 立方米体积的氢气,储氢量相当于 25 个 150 个大气 压力的高压氢气瓶。但这个储氢装置的重量比25个 高压氢气瓶的重量要轻30%,体积只有0.4立方米, 是高压氢气瓶的1/7。
14
离子价因素
只有当离子价或离子价总和相同时,才可能 生成无限固溶体,这是生成无限固溶体的必 要条件。 Ca2++Al3+=Na++Si4+
离子价总和相同:斜长石Ca1-xNaxAl2-xSixO4 CaAl2O4+Na2SiO3
类似的置换在铝硅酸盐矿物中是非常普遍的。
15
晶体结构因素
晶体结构相同是生成无限固溶体的必要条件,结构 不同最多只能生成有限固溶体。
7
无限固溶体:溶质和溶剂两种晶体可以按任 意比例无限制的相互溶解,即溶质的溶解度 可达100%。
(NixMg1-x)O x=0-1
8
如果杂质原子在固溶体中的溶解度是有
限的,存在一个溶解度极限,这样的固 溶体就称为有限固溶体。 MgO-CaO体系 Mg2+半径0.027 nm Ca2+半径0.1 nm
9
5.3 取代型固溶体
从热力学的观点,杂质原子进入晶格将引起 熵增并导致体系自由能下降。因此当T>0K时, 任何外来杂质均有一定的溶解度。 影响取代型固溶体溶解度的因素以及影响程 度,至今仍不能严格的定量计算,但已有若 干经验定律可供参考。
10
离子尺寸因素
15%规则:当原子(离子)半径之差大于15% 时,形成的固溶体的固溶度通常是有限的。 15%的计算方法:(R1-R2)/R1 (R1>R2) Al2O3-Cr2O3 Al3+:0.53 Å Cr3+:0.62 Å 按Al3+:(0.62-0.53)/0.53=16.7% 按Cr3+:(0.62-0.53)/0.62=14.5% Al2O3-Cr2O3生成连续型固溶体。
