YY-T1182-2010核酸扩增检测用试剂(盒)
核酸提取试剂盒国标

核酸提取试剂盒国标1. 简介核酸提取试剂盒是一种用于从生物样本中提取核酸(包括DNA和RNA)的试剂盒。
它在医学、生命科学研究、法医学等领域具有广泛的应用,可以用于分析基因组、检测病原体、进行遗传性疾病筛查等。
核酸提取试剂盒国标是对核酸提取试剂盒的相关技术规范和质量要求进行统一制定的标准。
它旨在确保核酸提取试剂盒的质量稳定,使不同厂家生产的产品能够具有相同的标准,以便用户能够获得可靠、准确和重复性好的实验结果。
2. 国标制定背景核酸提取试剂盒作为一种常见的实验工具,在实验室中被广泛使用。
然而,由于不同厂家生产的产品存在差异,导致实验结果可能会出现偏差。
为了解决这个问题,制定核酸提取试剂盒国标成为必要。
制定国标可以统一各个厂家的产品质量要求,规范产品的生产工艺和质量控制流程,提高核酸提取试剂盒的质量稳定性和可靠性。
此外,国标还可以帮助用户选择合适的试剂盒,并提供标准操作流程,以确保实验结果的准确性和可重复性。
3. 国标内容核酸提取试剂盒国标主要包括以下内容:3.1 产品分类与命名根据不同的核酸提取方法和应用领域,将核酸提取试剂盒分为不同的分类,并对每个分类进行命名规范。
例如,可以根据核酸来源将其分为DNA提取试剂盒和RNA提取试剂盒;或者根据应用领域将其分为医学用途和科研用途等。
3.2 技术规范对核酸提取试剂盒的技术规范进行详细说明,包括但不限于以下方面: - 样本处理:要求对不同类型的样本(如血液、组织、细胞等)进行适当处理,以保证样本中核酸的完整性和纯度。
- 提取原理:介绍核酸提取的基本原理和方法,以及各个步骤的操作要点。
- 试剂配方:对试剂盒中各种试剂的成分和浓度进行规定,确保产品质量的稳定性和一致性。
- 实验步骤:提供标准的实验操作步骤,包括样本处理、溶解、洗涤、洗脱等过程,并给出相应的注意事项和操作要点。
3.3 质量控制对核酸提取试剂盒的质量控制要求进行明确,包括但不限于以下方面: - 质量检测方法:规定核酸提取试剂盒的质量检测方法,如纯度检测、完整性检测等。
丙型肝炎病毒核酸定量检测性能验证及评价

丙型肝炎病毒核酸定量检测性能验证及评价郭杰; 曲沛; 李韦杰; 周宇; 郭晶晶; 焦炳欣; 王雅杰【期刊名称】《《传染病信息》》【年(卷),期】2019(032)005【总页数】5页(P394-398)【关键词】HCVRNA; 定量检测; 实时荧光定量PCR; 性能验证【作者】郭杰; 曲沛; 李韦杰; 周宇; 郭晶晶; 焦炳欣; 王雅杰【作者单位】100015 首都医科大学附属北京地坛医院检验科【正文语种】中文【中图分类】R248.4研究认为HCV是引起90%~95%输血后肝炎的主要病原体[1-4]。
据WHO统计,全球约有2亿人感染HCV,并面临发生肝硬化和/或肝癌的风险[5]。
目前,血清HCV RNA定量检测是实验室诊断丙型肝炎的金标准。
及时准确的检测对于HCV感染者的诊断和预后具有至关重要的意义。
其中HCV RNA商品试剂盒分析性能评价是保证检验结果准确可靠的重要依据之一。
根据中华人民共和国卫生行业标准《临床实验室对商品定量试剂盒分析性能的验证(WS/T 420-2013)》[6]规定,当我国食品药品监督管理局批准的检验方法或试剂盒进行了重要修改时,应对厂家制定的各项主要分析性能指标进行验证,依据《美国临床实验室改进修正法规88》要求,临床实验室可只对下列3项主要分析性能进行验证:正确度、精密度和线性(测量区间)。
北京地坛医院所采用的丙型肝炎病毒核酸定量检测试剂盒自18012511批号开始,检出限由250 IU/ml改为50 IU/ml,为验证在当前实验条件下该试剂盒检出限是否达到厂家制定的分析指标,我们对该试剂盒的性能进行了符合补充验证。
1 材料与方法1.1 标本收集首都医科大学附属北京地坛医院检验科不同浓度的临床血清(血浆)标本共30例,标本浓度尽量涵盖线性范围,于-20℃冰箱保存。
1.2 仪器与试剂实时荧光定量扩增仪(美国,罗氏cobas® Z480)。
丙型肝炎病毒核酸定量检测试剂盒(上海科华,批号18012511)。
核酸扩增检测用试剂

YY/T 1182-2010核酸扩增检测用试剂(盒)1范围本标准规定了核酸扩增检测试剂(盒)【以下简称“试剂(盒)”】的术语和定义、命名和分类、技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。
本标准适用于核酸扩增检测试剂(盒)的质量控制。
核酸扩增检测试剂(盒)应包括核酸提取、核酸扩增及产物分析试剂组份,如核酸扩增检测试剂(盒)内不含有核酸提取组份,应由生产企业说明或指定提取试剂(盒)。
本标准不适用于基因分型、基因芯片和病毒基因分型/突变检测用试剂(盒)及血源筛查的试剂(盒)。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 21415-2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性3术语和定义以下术语和定义适用于本文件。
3.1 聚合酶链反应polymerase chain reaction,PCR聚合酶链反应或多聚酶链反应是一种对特定的DNA或RNA片段在体外进行快速扩增的方法,由变性-退火-延伸三个基本反应步骤构成。
3.2 PCR杂交(膜上、板上)PCR hybridization具有一定同源序列的两条核酸单链(DNA或RNA)可以通过氢键的方式,按碱基互补配对原则相结合,探针结合于特定核酸序列或PCR产物的杂交过程可以在液相中进行,也可以将其中一个固定在固相载体上进行。
3.3 PCR 电泳 PCR electrophoresis根据PCR产物分子质量和所带电荷的不同在电场中进行分离的技术。
3.4实时荧光PCR real-time polymerase chain reaction,PCR在PCR过程中利用荧光染料释放的荧光定量的变化直接反映出PCR扩增产物量的变化,荧光信号变量与扩增产物变量成正比,并通过对荧光的采集和分析以达到对原始模板量进行分析的PCR。
YYT 1182-2010 核酸扩增检测用试剂(盒

YY/T 1182-2010 核酸扩增检测用试剂(盒)核酸扩增检测用试剂(盒)1范围本标准规定了核酸扩增检测试剂(盒)【以下简称“试剂(盒)”】的术语和定义、命名和分类、技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。
本标准适用于核酸扩增检测试剂(盒)的质量控制。
核酸扩增检测试剂(盒)应包括核酸提取、核酸扩增及产物分析试剂组份,如核酸扩增检测试剂(盒)内不含有核酸提取组份,应由生产企业说明或指定提取试剂(盒)。
本标准不适用于基因分型、基因芯片和病毒基因分型/突变检测用试剂(盒)及血源筛查的试剂(盒)。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T21415-2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性3术语和定义以下术语和定义适用于本文件。
3.1 聚合酶链反应polymerase chain reaction,PCR聚合酶链反应或多聚酶链反应是一种对特定的DNA或RNA片段在体外进行快速扩增的方法,由变性-退火-延伸三个基本反应步骤构成。
3.2 PCR杂交(膜上、板上)PCR hybridization具有一定同源序列的两条核酸单链(DNA或RNA)可以通过氢键的方式,按碱基互补配对原则相结合,探针结合于特定核酸序列或PCR产物的杂交过程可以在液相中进行,也可以将其中一个固定在固相载体上进行。
3.3 PCR 电泳 PCR electrophoresis根据PCR产物分子质量和所带电荷的不同在电场中进行分离的技术。
3.4 实时荧光PCR real-time polymerase chain reaction,PCR在PCR过程中利用荧光染料释放的荧光定量的变化直接反映出PCR扩增产物量的变化,荧光信号变量与扩增产物变量成正比,并通过对荧光的采集和分析以达到对原始模板量进行分析的PCR。
[VIP专享]核酸扩增检测用试剂(盒)
![[VIP专享]核酸扩增检测用试剂(盒)](https://img.taocdn.com/s3/m/29f5779279563c1ec5da71e2.png)
YY/T 1182-2010核酸扩增检测用试剂(盒)1范围本标准规定了核酸扩增检测试剂(盒)【以下简称“试剂(盒)”】的术语和定义、命名和分类、技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。
本标准适用于核酸扩增检测试剂(盒)的质量控制。
核酸扩增检测试剂(盒)应包括核酸提取、核酸扩增及产物分析试剂组份,如核酸扩增检测试剂(盒)内不含有核酸提取组份,应由生产企业说明或指定提取试剂(盒)。
本标准不适用于基因分型、基因芯片和病毒基因分型/突变检测用试剂(盒)及血源筛查的试剂(盒)。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 21415-2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性3术语和定义以下术语和定义适用于本文件。
3.1 聚合酶链反应polymerase chain reaction,PCR聚合酶链反应或多聚酶链反应是一种对特定的DNA或RNA片段在体外进行快速扩增的方法,由变性-退火-延伸三个基本反应步骤构成。
3.2 PCR杂交(膜上、板上)PCR hybridization具有一定同源序列的两条核酸单链(DNA或RNA)可以通过氢键的方式,按碱基互补配对原则相结合,探针结合于特定核酸序列或PCR产物的杂交过程可以在液相中进行,也可以将其中一个固定在固相载体上进行。
3.3 PCR 电泳 PCR electrophoresis根据PCR产物分子质量和所带电荷的不同在电场中进行分离的技术。
3.4实时荧光PCR real-time polymerase chain reaction,PCR在PCR过程中利用荧光染料释放的荧光定量的变化直接反映出PCR扩增产物量的变化,荧光信号变量与扩增产物变量成正比,并通过对荧光的采集和分析以达到对原始模板量进行分析的PCR。
hbv-dna全自动检测系统的性能验证

附表中国体外诊断网

52.
YY/T 1170-2009
碱性蛋白胨水培养基
53.
YY/T 1171-2009
改良罗氏基础培养基
54.
YY/T 1172-2010
医学实验室质量管理术语
55.
YY/T 1173-2010
聚合酶链反应分析仪
56.
YY/T 1174-2010
半自动化学发光免疫分析仪
57.
YY/T 1175-2010
61.
YY/T 1179-2010
糖类抗原CA50定量试剂(盒)(化学发光免疫分析法)
62.
YY/T 1180-2010
人类白细胞抗原(HLA)基因分型试剂盒(SSP法)
63.
YY/T 1181-2010
免疫组织化学试剂盒
64.
YY/T 1182-2010
核酸扩增检测用试剂(盒)
65.
YY/T 1183-2010
116.
YY/T 1234-2014
碱性磷酸酶测定试剂(盒)(NPP底物-AMP缓冲液法)
117.
YY/T 1235-2014
风疹病毒IgG/IgM抗体检测试剂(盒)
118.
YY/T 1236-2014
巨细胞病毒IgG/IgM抗体检测试剂(盒)
119.
YY/T 1237-2014
弓形虫IgG抗体检测试剂(盒)(酶联免疫法)
143.
YY/T 1260-2015
戊型肝炎病毒IgM抗体检测试剂盒(酶联免疫吸附法)
144.
YY/T 1261-2015
HER2基因检测试剂盒(荧光原位杂交法)
145.
YY/T 1262-2015
高敏HBV-DNA实时荧光定量PCR检测试剂性能评价

高敏 HBV-DNA 实时荧光定量 PCR 检测试剂性能评价【摘要】目的评估实时荧光定量 PCR 法检测乙型肝炎病毒(HBV-DNA)核酸检测试剂的分析性能及结果的临床应用价值。
方法采用咸宁市中心医院收集的高浓度阳性患者标本和国家卫生部临检中心和湖北省临检中心的室间质控样品,对乙型肝炎病毒(HBV-DNA)检测试剂的精密度,正确度,检测限,分析测量范围等性能参数进行性能验证和评估。
结果高浓度(105IU/mL)和低浓度(103IU/mL)的精密度CV均≤5% ,正确度的检测结果符合国家卫生健康委临床检验中心和湖北省临床检验的室间质评要求。
检测下限( 功能灵敏度) 可达到 30I U/ ml,且重复间的 CV 值≤20% ;在在30IU/mL≤HBV DNA≤1.0×108IU/mL,分析测量范围线性关系良好(线性关系系数 R2 = 0. 99)。
结论定量项目检测正式用于检测临床前必须对检测系统的分析性能做充分的评估。
通过实验室验证HBV-DNA实时荧光定量PCR检测试剂可以满足目前乙肝的筛查和临床疗效监测的需求,并且检测过程经济简便,适用于临床的常规检测。
【关键词】乙型肝炎病毒(HBV-DNA);核酸检测;性能验证【关键词】乙型肝炎病毒(HBV-DNA);核酸检测;性能验证中国HBV感染者约9000万例,居于全球之冠[1]。
HBV-DNA检测对乙型肝炎的诊断、治疗过程监测及预后判断都起到重要的指导作用,检测系统性能决定检测结果质量,影响着临床诊断、治疗和预后[2]。
目前各国医学实验室相关法规已将检验方法和检测系统性能验证纳入实验室的管理要求和技术要求的范围内[3]。
传统以检测血清感染标志物来判定HBV感染,无法对患者HBV感染复制作出判断。
乙型肝炎病毒核酸DNA定量检测技术便于对患者体内HBV复制及传染性有更直接的了解。
HBV-DNA阳性作为HBV复制的最可靠指标,也是反映乙肝的感染状态和治疗效果的重要指标,临床上通过直接检测病毒的数量水平真实地反映病毒的感染情况,从而对HBV进行准确诊断、有效治疗、精确预后及新药研制等方面具有重大意义。
核酸扩增检测用试剂(盒)

YY/T 1182-2010核酸扩增检测用试剂(盒)1范围本标准规定了核酸扩增检测试剂(盒)【以下简称“试剂(盒)”】的术语和定义、命名和分类、技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。
本标准适用于核酸扩增检测试剂(盒)的质量控制。
核酸扩增检测试剂(盒)应包括核酸提取、核酸扩增及产物分析试剂组份,如核酸扩增检测试剂(盒)内不含有核酸提取组份,应由生产企业说明或指定提取试剂(盒)。
本标准不适用于基因分型、基因芯片和病毒基因分型/突变检测用试剂(盒)及血源筛查的试剂(盒)。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 21415-2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性3术语和定义以下术语和定义适用于本文件。
3.1 聚合酶链反应polymerase chain reaction,PCR聚合酶链反应或多聚酶链反应是一种对特定的DNA或RNA片段在体外进行快速扩增的方法,由变性-退火-延伸三个基本反应步骤构成。
3.2 PCR杂交(膜上、板上)PCR hybridization具有一定同源序列的两条核酸单链(DNA或RNA)可以通过氢键的方式,按碱基互补配对原则相结合,探针结合于特定核酸序列或PCR产物的杂交过程可以在液相中进行,也可以将其中一个固定在固相载体上进行。
3.3 PCR 电泳 PCR electrophoresis根据PCR产物分子质量和所带电荷的不同在电场中进行分离的技术。
3.4实时荧光PCR real-time polymerase chain reaction,PCR在PCR过程中利用荧光染料释放的荧光定量的变化直接反映出PCR扩增产物量的变化,荧光信号变量与扩增产物变量成正比,并通过对荧光的采集和分析以达到对原始模板量进行分析的PCR。
乙肝超敏性能验证方案的沟通与确立

精密度:
(1)批内:至少高、低2个浓度水平的样本各重复10次
(2)批间:至少2个浓度,每天2批(间隔至少2小时),每批2个浓 度样本,每个标本重复2次,总天数一般为20天 批内应满足《中华人民共和国医药行业标准YY/T 1182-2010核酸扩 增检测用试剂盒》中5.7精密度定量试剂应符合检测浓度对数值的 变异系数(CV%)≤5% 准确度:
乙肝超敏试剂性能验证
1.为何需要性能验证?
把据告诉客户安心地使用产品
了解客户的真正需求
使客户切身感受到我们的服务
2.性能验证怎么做?
性能验 证的基 本准则
2.1性能验证具体内容
1
精密度
常用
参数
2
准确度
3
检测限/定量限
4
线性范围
2.2参数的标准做法和依据
2.3其他相关参数
(1)特异性——交叉反应及干扰物
交叉反应
选用核酸序列具有同源性、易引起相同或相似的临床症状的样本 干扰物:
我们可以提供一份在中检所做的抗干扰能力的研究报告
(2)方法学比对 与罗氏结果对比
(3)不确定度:
(4)稳定性 一般分为效期稳定性和热稳定性,我们已经过热稳定性试验,37℃3 天,可提供客户质检报告
(1)取高值样本应接近线性范围上限,按一定比例至少稀释 5个浓 度以上,低值标本应接近线性范围下限,每个浓度样本重复检测 3次
(2)可使用标本:混合人血清、对盐水透析过的混合人血清、商品质 控品或校准品、水溶液 (3)计算每一浓度对数值和 Ct均值,以浓度的对数值为 Y,Ct值均 值为X,进行线性拟合,计算相关系数γ,线性相关系数≥0.98 检测限/定量限 企业声称值浓度值样本25次检测,至少22次检测 符合企业声称值,检测限阳性检出率≥95%
YY-T 1182-2010 核酸扩增检测用试剂(盒)

YY/T 1182-2010核酸扩增检测用试剂(盒)1范围本标准规定了核酸扩增检测试剂(盒)【以下简称“试剂(盒)”】的术语和定义、命名和分类、技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。
本标准适用于核酸扩增检测试剂(盒)的质量控制。
核酸扩增检测试剂(盒)应包括核酸提取、核酸扩增及产物分析试剂组份,如核酸扩增检测试剂(盒)内不含有核酸提取组份,应由生产企业说明或指定提取试剂(盒)。
本标准不适用于基因分型、基因芯片和病毒基因分型/突变检测用试剂(盒)及血源筛查的试剂(盒)。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 21415-2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性3术语和定义以下术语和定义适用于本文件。
3.1 聚合酶链反应polymerase chain reaction,PCR聚合酶链反应或多聚酶链反应是一种对特定的DNA或RNA片段在体外进行快速扩增的方法,由变性-退火-延伸三个基本反应步骤构成。
3.2 PCR杂交(膜上、板上)PCR hybridization具有一定同源序列的两条核酸单链(DNA或RNA)可以通过氢键的方式,按碱基互补配对原则相结合,探针结合于特定核酸序列或PCR产物的杂交过程可以在液相中进行,也可以将其中一个固定在固相载体上进行。
3.3 PCR 电泳 PCR electrophoresis根据PCR产物分子质量和所带电荷的不同在电场中进行分离的技术。
3.4实时荧光PCR real-time polymerase chain reaction,PCR在PCR过程中利用荧光染料释放的荧光定量的变化直接反映出PCR扩增产物量的变化,荧光信号变量与扩增产物变量成正比,并通过对荧光的采集和分析以达到对原始模板量进行分析的PCR。
新冠核酸PCR实验室仪器以及耗材清单
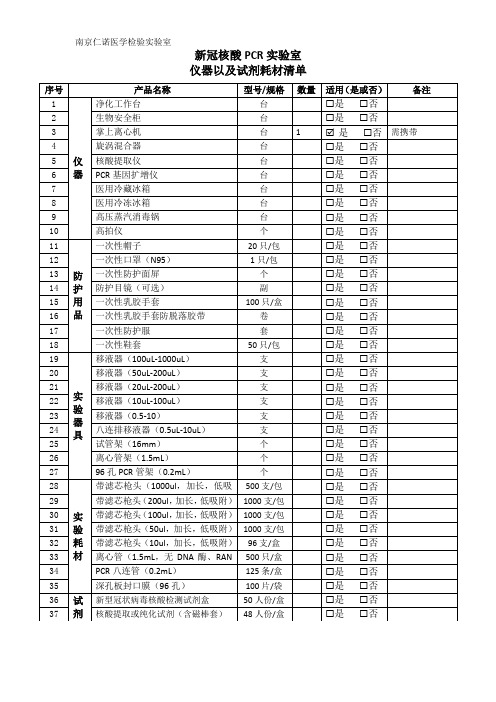
新冠核酸 PCR 实验室 仪器以及试剂耗材清单
序号
1
2
3
4
5仪
6器
7
8
9
10
11
12
13 防 14 护
15 用 16 品
17
18
19
20
21
22 实
23
验 器
24 具
25
26
27
28
29
30 实
31 验
32 耗 33 材
34
35
36 试
37 剂
产品名称
型号/规格
净化工作台
台
生物安全柜
带滤芯枪头(100ul,加长,低吸附) 1000 支/包
带滤芯枪头(50ul,加长,低吸附) 1000 支/包
带滤芯枪头(10ul,加长,低吸附) 96 支/盒
离心管(1.5mL,无 DNA 酶、RAN 500 只/盒
酶 PC)R 八连管(0.2mL)
125 条/盒
深孔板封口膜(96 孔)
100 片/袋
46
医疗垃圾袋(60cmX70)
47
医疗废物封口扎带(含吊牌)
48
蒸汽灭菌化学指示卡
49
蒸汽灭菌生物指示剂(3M)
38
一次性采样拭子
39 其 40 他 41 用 42 品
43
一次性病毒采样管 实验试剂配制表 实验流程图 签字笔 记号笔
型号/规格 数量 适用(是或否) 备注
瓶
是 否
瓶
是 否
瓶
是 否
个 300 抽/包
台
掌上离心机
台
旋涡混合器
台
核酸提取仪
乙型肝炎病毒磁珠法核酸提取的临床检验方法学验证

2019年12月上影像学及诊断检验乙型肝炎病毒磁珠法核酸提取的临床检验方法学验证李萍,张志斌*无锡市中医医院中心实验室,江苏 无锡 214071【摘要】目的:验证乙型肝炎病毒磁珠法核酸提取试剂盒性能,评价在其临床工作中的应用价值。
方法:参考国家医药行业标准(YY /T 1182-2010)对该项目的线性范围、精密度、准确度、定量下限、检测下限验证。
结果:(1)用直线回归对数据进行统计,得直线回归Y=aX+b,Y=1.0189X-0.0893,R^2=0.9986。
(2)高浓度样本和低浓度样本的批内精密度变异系数CV为0.58%和1.41%,批间精密度CV为3.06%和4.93%。
(3)利用康彻思坦HBV DNA血清标准物质作为准确度评价的样本S2和S4,其测定结果2.88E6和4.52E4与靶值及可接受限进行比对,在NCCL可接受限要求范围内。
(4)根据线性结果测定的E2数值用小牛血清将其稀释至理论值为100IU/mL的样本,检测20次,对定量结果对数值进行CV计算,为4.56%。
(5)根据线性结果测定的E2数值用小牛血清将其稀释至理论值为15IU/mL的样本,检测24次,阳性率100%。
结论:磁珠法乙型肝炎病毒核酸提取试剂盒具有良好的线性范围,相关指标均符合检测标准,可满足临床测试要求。
【关键词】乙型肝炎病毒核酸;磁珠法;煮沸法[中图分类号] R512.62 [文献标识码] A [文章编号] 2096-5249(2019)23-0196-02HBV DNA定量检测可以直观地反映乙肝病毒感染情况,在临床诊断和治疗中具有较为重要的参考价值和指导意义[1]。
近年来各版慢性乙型肝炎防治指南中均推荐采用高敏HBV DNA结果判断治疗终点,高敏HBV DNA试剂应用越来越广泛。
目前,无锡市各大医院开展的HBV DNA检测多为低敏方法,核酸提取多采用煮沸裂解法,该方法操作简便,是一种经典的核酸提取方法,但只是通过对样本煮沸、裂解、高速富集DNA等步骤以释放核酸,虽然煮沸裂解法提取效率比直接加热法、苯酚法和碱裂解法都高,但因煮沸裂解法提取的血清HBV DNA效率不高、产物不纯、临界值样本的提取结果较不稳定,在临床样本中较易产生假阴性 [2-4]。
杭州优思达生物技术 CJ 恒温扩增核酸试纸条检测试剂盒 说明书

空肠弯曲菌恒温扩增核酸试纸条检测试剂盒说明书【产品名称】空肠弯曲菌恒温扩增核酸试纸条检测试剂盒【英文名称】Campylobacter jejuni(CJ)Isothermal Amplification Diagnostic Kit 【包装规格】单管单人份,20人份/盒。
【预期用途】用于空肠弯曲菌的快速检测和筛查。
仅供科研。
【检验原理】本试剂盒将DNA 扩增、核酸杂交和核酸试纸条检测三种技术有机地融为一体,在反应中加入两对空肠弯曲菌的特异性引物和一对特异性探针,一次性完成DNA 扩增及杂交过程,然后用一次性核酸检测装置(3号)对空肠弯曲菌进行定性检测。
由于待测样本的扩增(PCR 管盖和石蜡油双重保护)和检测过程均在物理封闭条件下完成,所以本试剂盒具有防止实验室扩增物交叉污染,防止假阳性的效果。
【试剂盒组成】 1 试剂盒A*不带标签,反应管中包括除样本外的所有试剂。
上覆矿物油,以防止扩增中产生气溶胶,防止假阳性。
2 试剂盒B【储运条件及有效期】1.运输条件:试剂盒A 需要-20℃冷冻运输,运输过程中,试剂盒A 在-20℃-0℃内保存时间不超过五天;试剂盒B 可以常温运输。
2.储存条件:试剂盒A 在-20℃保存;试剂盒B 在2℃-30℃干燥保存。
3.有效期:有效期12个月【仪器要求】恒温装置如:水浴锅、金属浴、各种型号PCR 仪等。
【操作步骤】1 样本处理及DNA 提取未提供 2 恒温扩增2.1 根据需要确定所需反应液的管数,然后从试剂盒中取出反应管并做上标记; 2.2 待反应液解冻后,以>4000rpm 的转速离心3-5秒;2.3 在任何样本被加入之前,首先在一管反应液中直接加入10ul ddH 2O,用移液器吹打混匀,作为阴性对照; 2.4 在其余标记好的反应管中,依次加入6ul ddH 2O 和4ul 处理好的样本或阳性对照(试剂盒中提供),并 用移液器吹打混匀(阳性对照应在阴性对照和所有样品之后被加入); 2.5 将加好样的反应液以>4000rpm 的转速再离心3-5秒;2.6 将反应管放置恒温仪上,60℃温浴60min (在温浴过程中和温浴结束后不得打开反应管盖)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YY/T 1182-2010核酸扩增检测用试剂(盒)1围本标准规定了核酸扩增检测试剂(盒)【以下简称“试剂(盒)”】的术语和定义、命名和分类、技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。
本标准适用于核酸扩增检测试剂(盒)的质量控制。
核酸扩增检测试剂(盒)应包括核酸提取、核酸扩增及产物分析试剂组份,如核酸扩增检测试剂(盒)不含有核酸提取组份,应由生产企业说明或指定提取试剂(盒)。
本标准不适用于基因分型、基因芯片和病毒基因分型/突变检测用试剂(盒)及血源筛查的试剂(盒)。
2规性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 21415-2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性3术语和定义以下术语和定义适用于本文件。
3.1 聚合酶链反应polymerase chain reaction,PCR聚合酶链反应或多聚酶链反应是一种对特定的DNA或RNA片段在体外进行快速扩增的方法,由变性-退火-延伸三个基本反应步骤构成。
3.2 PCR杂交(膜上、板上)PCR hybridization具有一定同源序列的两条核酸单链(DNA或RNA)可以通过氢键的方式,按碱基互补配对原则相结合,探针结合于特定核酸序列或PCR产物的杂交过程可以在液相中进行,也可以将其中一个固定在固相载体上进行。
3.3 PCR 电泳 PCR electrophoresis根据PCR产物分子质量和所带电荷的不同在电场中进行分离的技术。
3.4实时荧光PCR real-time polymerase chain reaction,PCR在PCR过程中利用荧光染料释放的荧光定量的变化直接反映出PCR扩增产物量的变化,荧光信号变量与扩增产物变量成正比,并通过对荧光的采集和分析以达到对原始模板量进行分析的PCR。
注:在每个循环中检测扩增产物是否可被检测。
3.5测量系统的线性 linearity of a measuring system给出的测量结果与样品中被测量的值直接成比例的能力。
注1:对与体外诊断医疗器械,线性相关于测量结果在一给定测量围经校正或线性化以后的测量示值。
注2:线性通过测量包含被测量已知配方或其间相对关系(不必绝对知道)的样本来评估。
当测量结果相对被测量绝对或相对数值作图时,所画曲线对直线的符合程度及线性度的量度。
3.6样本线性 linearity of series diluted samples对高浓度样本进行系列稀释,得到的检测浓度对数值与稀释比例之间相关。
3.7分析特异性 analytical specificity测量程序只测量被测量的能力。
3.8测量精密度 precision of measurement在规定条件下,相互独立的测量结果间的一致程度。
注1:测量精密度不能用于被测量有关的数字值表示,在指定目的下只能以“足够”或“不足”进行描述。
注2:精密度的程度通常与精密度相反的测量不精密度统计量表示,如标准差和变异系数。
注3:给定测量程序的“精密度”可以根据特定的精密度条件进行分类。
“重复性”与基本不变的条件有关,常称为“序列精密度”或“批精密度”。
“重现性”与条件改变有关,如:时间、不同实验室、操作者和测量系统(包括不同校准和试剂批号)。
3.9计量学溯源性 metrological traceability通过一条具有规定不确定度的不间断的比较链,使测量结果或测量标准的值能够与规定的参考标准,通常是与国家标准或国际标准联系起来的特性。
注1:通过校准传递方案确定的(参考)测量程序实现每一步比较。
注2:溯源性有几种类型。
本标准使用术语“计量学溯源性”。
3.10检测限 detection limit,limit of detection样品中以一定概率可被申明与零有差异的被测量的最低值。
注1:也被描述为“最低检测限”(minimum detectable concentration)(或剂量或值)。
注2:有时被不正确地指作分析灵敏度。
注3:本标准中的最低检测限为区别于零的不低于95%可信区间的最低浓度。
3.11定量限 limit of quantitation给定分析程序能定量检测分析物的最小浓度或量。
3.12阈值循环数Ct(Cp)cycle threshold,crossing point实时监测扩增过程中,反应管的荧光信号到达指数扩增时经历的循环周期数。
主要的计算方式是以扩增过程前3到15个循环的荧光值的10倍标准差为阈值,当荧光值超过阈值时的循环数则为阈值循环数(Ct)。
3.13基因型 genotype一个有机体的遗传组成,即明确界定具体等位基因位点的基因组。
3.14标internal control在同一反应管中与靶序列共同扩增的一段非靶序列分子,其目的是鉴别仪器故障、试剂因素、聚合酶活性因素或样本中存在抑制物等造成的结果不理想的原因。
4命名和分类4.1命名***核酸(DNA或RNA)扩增检测试剂(盒)(方法学)。
4.2分类可按如下方式分类:a)根据核酸扩增检测分析采用的方法学原理分为:实时荧光PCR试剂(盒)、RT-PCR试剂(盒)、PCR杂交检测试剂(盒)、PCR-电泳法检测试剂(盒)等。
b)根据对试验结果的判定可分为:定量和定性。
5技术要求5.1外观外观应满足以下条件:a)试剂(盒)应符合生产企业规定的外观要求;b)试剂(盒)应组份完全,包装外观清洁、无泄漏、无破损;标志、标签字迹清楚。
5.2溯源性生产企业应根据GB/T 21415-2008及有关规定提供所用核酸标准品的来源、溯源的赋值过程和相应要求,以及测量不确定度等容。
5.3 测量系统的线性5.3.1样本线性线性相关系数︱r︱≧0.980。
5.3.2试剂(盒)系列标准品线性试剂(盒)标准品应不少于4个浓度,宜包含线性围上限和下限,线性相关系数︱r︱≧0.980。
5.4准确度5.4.1定性试剂对阳性参考品进行测定,检测结果应为阳性。
5.4.2定量试剂准确度应符合如下要求之一:a)检测国家标准品(或参考品)/国际标准品(或参考品),绝对偏差不超过±0.5个对数数量级;b)回收试验:回收率在85%~115%围。
5.5分析特异性分析特异性应满足以下要求:a)检测一定数量的不含被测物的样本,结果应为阴性;b)检测可能引起非特异反应的样本,如与被测物种属相近、感染部位相同或感染症状相似的其他样本,结果应为阴性。
5.6亚型检测能力检测生产企业规定试剂检测围国常见亚型,应能检出。
注:只有当分析物具有不同亚型时应满足此项要求。
5.7 精密度5.7.1 定性试剂批精密度应符合Ct值的变异系数(CV,%)≦5%5.7.2定量试剂批精密度应符合检测浓度对数值的变异系数(CV,%)≦5%。
5.8 检测限/定量限5.8.1定性试剂检测限应符合生产企业声称的值。
5.8.2定量试剂定量限应符合生产企业声称的值。
适用时,检测限应符合生产企业声称的值。
5.9 干扰物质对血液样本,检测含有生产企业规定浓度的干扰物质如血红素及其代谢产物、脂血等样本,及含过量EDTA抗凝剂的样本,应符合生产企业规定的要求。
5.10稳定性可选用以下方法进行验证:a)效期稳定性:生产企业应规定产品的有效期。
取到效期后的样品检测测量线性、准确度、分析特异性、亚型检测能力、精密度、检测限/定量限、干扰物质,应分别符合5.3、5.4、5.5、5.6、5.7、5.8、5.9的要求。
b)热稳定性试验:测量线性、准确度、分析特异性、亚型检测能力、精密度、检测限/定量限、干扰物质,应分别符合 5.3、5.4、5.5、5.6、5.7、5.8、5.9的要求。
注1:热稳定性不能用于推导产品有效期,除非是采用基于大量的稳定性研究数据建立的推导公式。
注2:根据产品特性可选择a),b)方法的任意组合,但所选用方法宜能验证产品的稳定性,以保证有效期产品性能符合标准要求。
6试验方法6.1外观在自然光下目视检查外观,结果应符合5.1的要求。
6.2溯源性生产企业提供的溯源性资料应符合5.2的要求。
6.3测量系统的线性6.3.1样本线性在生产企业规定的线性围,取接近线性围上限的高值样本按一定比例(例:5倍或10倍)稀释为至少5种浓度,其中低值浓度样本需接近线性围的下限。
按试剂(盒)说明书进行操作,将每一浓度样本重复检测3孔,计算每一浓度的对数值和Ct均值,以浓度的对数值为Y,Ct均值为X,进行线性拟合,计算其线性相关系数r,结果应符合5.3.1的要求。
6.3.2试剂(盒)系列标准品线性按试剂(盒)说明书进行操作,试剂(盒)中每一标准品重复检测3孔,计算每一标准品的标示浓度的对数值与Ct值的均值,以浓度的对数值为Y, Ct均值为X,进行线性拟合,计算其线性相关系数r,结果应符合5.3.2的要求。
6.4准确度6.4.1定性试剂对阳性参考品进行测定,检测结果应符合5.4.1的要求。
6.4.2定量试剂建议按如下优先顺序,采用下列方法之一测试定量试剂(盒)的准确度,应符合5.4.2的要求。
a)绝对偏差用试剂盒对参考物质或有证参考物质(CRM)和相应的参考测量程序按照符合GB/T 21415-2008规定的溯源顺序进行测试,重复测定3次,取测试结果均值(M),按公式(1)计算绝对偏差(B),结果应符合5.4.2a)的要求。
或用有参考方法定值的高、中、低3个浓度的样本(可参照EP6-A的要求适当添加被测物,以获得高浓度的样品)对试剂(盒)进行测试,每个浓度样品重复测定3次,分别取测试结果均值,按公式(1)计算绝对偏差,结果应符合5.4.2a)的要求。
B=M-T (1)式中:B-绝对偏差;M-测试结果均值;T-参考物质标示值,或各浓度人血清定值。
b)回收试验在样品中加入一定体积标准溶液(标准溶液体积与样本体积比应不大于1:20,或其体积比不会产生基质的变化,加入标准溶液后样品总浓度必须在试剂(盒)测定线性围),重复测定3次,取平均值,按公式(2)计算回收率,结果应符合5.4.2b)的要求。
R=c×(V0+V)-c×V×100% (2)V×cs式中:R-回收率;V-加入标准溶液的体积;V-样品的体积c-样品加入标准溶液后的测定浓度c-样品的测定浓度cs-标准溶液的浓度6.5分析特异性检测可能引起非特异反应的样本,如与被测物种属相近、感染部位相同或感染症状相似的其他样本,结果应符合5.5的要求。
6.6亚型检测能力检测生产企业规定实际检测围国常见亚型样本,样本个数应至少一个亚型有一个样本,检测结果应符合5.6的要求。
