尼妥珠单抗 nimotuzumab—2020版各系统肿瘤的药物临床应用指导原则
尼妥珠单抗注射液说明书--泰欣生

尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热 4.28% (发热,最高39℃)- 4.28%用药缓解,未影响治疗血压下降、头晕 2.86%(最低80/50毫米汞柱)- 2.86%休息后缓解,未影响治疗恶心 1.43%- 1.43%自行缓解,未影响治疗皮疹 1.43%- 1.43%自行缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100~400 mg/次,用药1~6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20~75岁),男性57例,女性32例,共89例。
肿瘤靶向治疗药——尼妥珠单抗介绍PPT课件

印尼 Clinical Trials anti EGFR Antibody And Ganglioside Vaccines
巴西 New fermentation technologies and culture media Clinical trials anti RGF Antibody and Ganglioside Vaccines
尼妥珠单抗下调A431细胞株VEGF表达
Int. Journal Of Cancer 101:567-575, 2002
尼妥珠单抗的体外研究
抑制细胞周期 :G1 期
Control
Nimotuzumab
流式细胞仪分析显示尼妥珠单抗处理A431细胞株后,S期细胞下降,并有G1期阻滞
Int. Journal Of Cancer 101:567-575, 2002
Heregulins
NRG2 NRG3 Heregulins Betacellulin
TK
ErbB-1 HER1 EGFR
TK
ErbB-2 HER2 neu
ErbB-3 HER3
TK
ErbB-4 HER4
尼妥珠单抗的靶向分子-EGFR
-EGFR:
-癌基因c-erbB1的表达 产物
-I 型受体酪氨酸激酶跨 膜糖蛋白,分子量
头颈部肿瘤 (SCCHN)
肿瘤类型 结直肠癌 头颈部癌 肺癌 (NSCLC) 乳腺癌 卵巢癌 肾癌
% 72–89 95–100 40–80 14–91 35–70 50–90
Cunningham et al. N Engl J Med 2004;351:337–345; Grandis et al. Cancer 1996;78:1284–1292; Salomon et al. Crit Rev Oncol Hematol
泰欣生(尼妥珠单抗注射液)说明书

泰欣生(尼妥珠单抗注射液)说明书【泰欣生药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumablnjection汉语拼音:NiTuoZhuDanKangZhusheye【泰欣生成份】每支10mL含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【泰欣生性状】外观澄清、无色无味,无不溶物的液体。
【泰欣生适应症】泰欣生与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用泰欣生前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用泰欣生。
检验操作应由熟练掌握EGFR检测试剂盒检测技术的实验室完成。
检验中的某些失误,如使用较差的组织样本、未能严格遵从操作规程、使用不当的对照等均可能导致不可靠的结果。
【泰欣生规格】13.5毫升西林瓶装量10毫升(±0.5毫升),尼妥珠单抗浓度为5mg/mL,每支含50毫克。
【泰欣生用法用量】100mg尼妥珠单抗稀释于250ml生理盐水中,前臂静脉输液给药,进药过程在60分钟以上。
次给药时间为放射治疗的天,于放疗前完成,以后每周一次,共8次。
患者同时接受标准的鼻咽癌放射治疗。
【泰欣生不良反应】该药物的不良反应主要表现为发热、血压下降、恶心、头晕、皮疹。
在70例晚期鼻咽癌患者中进行的Ⅱ期临床试验中发现,用药后发热的发生率为4.28%,体温39℃,对症处理后缓解,不影响治疗;血压下降,头晕发生率2.86%,达80/50mmHg,休息后缓解,不影响治疗;恶心发生率为1.43%,轻度,可自行缓解,不影响治疗;头晕发生率2.86%,时有头晕,可自行缓解,不影响治疗;皮疹发生率1.43%,轻度,可自行缓解,不影响治疗。
在古巴和加拿大进行的临床试验发现该药常见的不良反应有发热、寒颤、恶心、呕吐、发冷、贫血、血压降低。
不常见的不良反应有肌肉痛、运动语言障碍、口干、潮红、下肢无力、嗜睡、丧失方向感、肌酐水平升高、白细胞减少、血尿、胸痛、口腔绀紫。
药物说明书drins-尼妥珠单抗-百泰

对本品或其任一组份过敏者禁用。
【注意事项】
本品应在具有同类药品使用经验的临床医师指导下使用,并具备相应抢救措施。 冻融后抗体的大部分活性丧失,故本品在储存和运输过程中严禁冷冻。本品稀释于生理盐水后,在2℃-8℃可保持稳定12小时,在室温下可保持稳定8小时。如稀释后储存超过上述时间,不宜使用。 应由熟练掌握EGFR检测技术的专职人员进行EGFR表达水平的检验。检验中若出现组织样本质量较差、操作不规范、对照使用不当等情况,均可导致结果偏差。
尼妥珠单抗注射液
说明书来源: 百泰生物药业有限公司
【药品名称】
通用名称:尼妥珠单抗注射液 英文名称:NimotuzumabInjection 商品名称:泰欣生
【成份】
每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】
本品为无色澄明液体。
【适应症】
试用于与放疗联合治疗表皮生长因子受体 (EGFR) 表达阳性的III/IV期鼻咽癌。
【规格】
50mg/瓶(10mL)。
【用法用量】
将两瓶 (100mg) 尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。在给药过程中及给药结束后1小时内,需密切监测患者的状况。首次给药应在放射治疗的第一天,并在放射治疗开始前完成。之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【老年用药】
在70例接受尼妥珠单抗注射液联合放射治疗的患者中,4例(5.7%)年龄在65岁或以上。尚未确定老年患者使用本品安全性和疗效方面的特殊性。
【药物相互作用】
尚缺乏本品与其它药物相互作用的数据。
尼妥珠单抗联合同步放化疗对局部晚期头颈部鳞状细胞癌的疗效评价

DOI:10.19368/ki.2096-1782.2023.06.069尼妥珠单抗联合同步放化疗对局部晚期头颈部鳞状细胞癌的疗效评价吕晓伟1,邓丹2,刘方丽11.菏泽市牡丹人民医院,山东菏泽274000;2.曹县人民医院,山东菏泽274400[摘要]目的分析在局部晚期头颈部鳞状细胞癌患者的治疗中实施尼妥珠单抗联合同步放化疗治疗的效果。
方法选择2021年5月—2022年4月期间来菏泽市牡丹人民医院接受治疗的局部晚期头颈部鳞状细胞癌患者60例作为研究样本,经双盲法分为研究组与参照组,各30例,参照组接受放化疗治疗,研究组在放化疗基础上联合尼妥珠单抗治疗,比较患者治疗前后血清肿瘤标志物水平、治疗效果、不良反应发生率。
结果治疗前,两组患者的血清肿瘤标志物水平对比,差异无统计学意义(P>0.05);治疗后,研究组比参照组低,差异有统计学意义(t=10.194、5.519、5.920,P<0.05);研究组的治疗效果(100.00%)比参照组(80.00%)高,差异有统计学意义(χ2=4.630,P<0.05);研究组的不良反应发生率(23.33%)与参照组(26.67%)比较,差异无统计学意义(P>0.05)。
结论在局部晚期头颈部鳞状细胞癌患者的治疗中实施尼妥珠单抗联合同步放化疗的治疗效果显著,能改善患者的血清肿瘤标志物,值得推广。
[关键词]尼妥珠单抗;同步放化疗;局部晚期;头颈部;鳞状细胞癌[中图分类号]R59 [文献标识码]A [文章编号]2096-1782(2023)03(b)-0069-04Efficacy Evaluation of Nimotuzumab Combined with Concurrent Chemo⁃radiotherapy in Locally Advanced Squamous Cell Carcinoma of the Head and NeckLYU Xiaowei1, DENG Dan2, LIU Fangli11.Mudan People's Hospital of Heze, Heze, Shandong Province, 274000 China;2.Caoxian People's Hospital, Heze, Shandong Province, 274400 China[Abstract] Objective To analyze the effect of nimotuzumab combined with concurrent chemoradiotherapy in the treat⁃ment of patients with locally advanced squamous cell carcinoma of the head and neck. Methods A total of 60 patients with locally advanced squamous cell carcinoma of the head and neck who were treated at Mudan People's Hospital of Heze from May 2021 to April 2022 were selected as research samples. They were divided into research group and ref⁃erence group by double-blind method, 30 cases in each group. The reference group received radiotherapy and chemo⁃therapy, and the study group received nimotuzumab on the basis of radiotherapy and chemotherapy. Serum tumor marker levels, therapeutic effects, and incidence of adverse reactions were compared before and after treatment. Results Before treatment, there was no statistically significant difference in serum tumor markers between two groups (P> 0.05). After treatment, the study group was lower than the reference group, and the difference was statistically signifi⁃cant (t=10.194, 5.519, 5.920, P<0.05). The therapeutic effect of the study group (100.00%) was higher than that of the control group (80.00%), and the difference was statistically significant (χ2=4.630, P<0.05). There was no statistically significant difference in the incidence of adverse reactions between the study group (23.33%) and the reference group (26.67%) (P>0.05). Conclusion Nimotuzumab combined with concurrent chemoradiotherapy has a significant thera⁃[作者简介] 吕晓伟(1986-),女,本科,主治医师,研究方向为肺癌、食管癌等多种恶性肿瘤的综合治疗。
尼妥珠单抗治疗15例非小细胞肺癌临床疗效及不良反应的回顾性分析

尼妥珠单抗治疗15例非小细胞肺癌临床疗效及不良反应的回顾性分析倪军;斯晓燕;王汉萍;张力【摘要】Objective To retrospectively analyze the therapeutic efficacy and adverse events of nimotuzumab in advanced non-small cell lung cancer (NSCLC). Method Nimotuzumab was administrated to 15 cases of stage IV NSCLC, including 9 cases of adenocarcinoma and 8 cases of squamous cell carcinoma. All patients were confirmed by either histopathology or cytopathology, and were treated by nimotzumab (nimotuzumab 400 mg, i.v., qw). The ef-ficacy was evaluated after six weeks of treatment according to RECIST standards. For adverse events, the NCI-CTC 3.0 was applied. Result There were 11 cases that were qualified for efficacy evaluation and 15 cases for safety evaluation. Among the 11 cases included in efficacy evaluation, there were 8 cases achieving SD and 3 cases of PD. The disease control rate was 72.2% (8/11). The safety evaluation results showed that the incidence of skin rash relat-ed to nimotuzumab was low, and which was in no association with clinical benefit. All adverse events related with nimotuzumab were mild. Conclusion Nimotuzumab combined with chemotherapy or radiotherapy for patients with NSCLC increases disease control rate and has a better safety profile.%目的:回顾性分析尼妥珠单抗治疗晚期非小细胞肺癌(NSCLC)的临床疗效及不良反应。
尼妥珠单抗注射液说明书--泰欣生
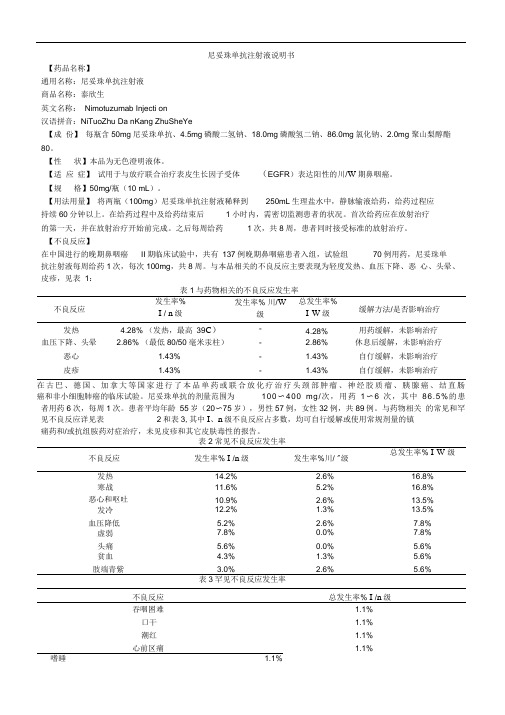
尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injecti on汉语拼音:NiTuoZhu Da nKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg 聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的川/W期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1与药物相关的不良反应发生率不良反应发生率%I / n级发生率% 川/W级总发生率%I-W级缓解方法/是否影响治疗发热 4.28% (发热,最高39C)- 4.28%用药缓解,未影响治疗血压下降、头晕 2.86% (最低80/50毫米汞柱)- 2.86%休息后缓解,未影响治疗恶心 1.43%- 1.43%自仃缓解,未影响治疗皮疹 1.43%- 1.43%自仃缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100〜400 mg/次,用药1〜6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20〜75岁),男性57例,女性32例,共89例。
尼妥珠单抗治疗大肠癌1例报告

尼妥珠单抗治疗大肠癌1例报告
郭翔宇;孙涛;于绍芬;姜翠
【期刊名称】《癌症进展》
【年(卷),期】2010(008)001
【摘要】近年来,我国大肠癌发病率呈逐年上升趋势,随着对其发病机制研究的
不断深入,也为临床大肠癌的诊治提供了更多依据,使治疗方案的制定逐渐趋于个体化。
目前,国内大肠癌的分子靶向治疗临床应用广泛,与传统放化疗方法结合使用的疗效也得到更多专家认可。
作为以表皮生长因子受体(epidermal growth factor receptor,EGFR)为靶点的人源化单抗药物,尼妥珠单抗(nimotuzumab)于2009年被《NCCN头颈部肿瘤临床实践(中国版)》推荐,【总页数】2页(P100-101)
【作者】郭翔宇;孙涛;于绍芬;姜翠
【作者单位】辽宁省肿瘤医院内一科,沈阳110000;辽宁省肿瘤医院内一科,沈阳110000;辽宁省肿瘤医院内一科,沈阳110000;辽宁省肿瘤医院内一科,沈阳110000
【正文语种】中文
【相关文献】
1.尼妥珠单抗联合GP方案治疗晚期肺鳞癌脑转移完全缓解1例报告 [J], 赵静;王
华庆;钱正子;任旭升;张馨允
2.尼妥珠单抗靶向治疗联合TC化疗方案治疗晚期非小细胞肺癌患者的效果观察[J], 李山岭;王杰;陈素芳;王振兴
3.尼妥珠单抗降低BRCA1蛋白表达提高大肠癌SW480细胞对伊立替康敏感性的研究 [J], 孙晓东
4.尼妥珠单抗联合化疗一线治疗晚期大肠癌的临床研究 [J], 陈望花;王文玲;张若荣;董洪敏;王刚;李小凯
5.尼妥珠单抗靶向治疗联合常规化疗方案治疗晚期非小细胞肺癌临床研究 [J], 王学森
因版权原因,仅展示原文概要,查看原文内容请购买。
泰欣生说明书

规格50mg/瓶(10mL)瓶ﻫ【泰欣生功效】尼妥珠单抗注射液;泰欣生(尼妥珠单抗注射液)治疗鼻咽癌及其他肿瘤的单抗药。
ﻫ【简述】泰欣生(尼妥珠单抗注射液)与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌.使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品.本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显著,不良反应轻微。
ﻫ【泰欣生药理作用】ﻫ【泰欣生临床疗效】ﻫ【泰欣生不良反应】ﻫ【其它】【商品名】泰欣生【通用名】尼妥珠单抗注射液【英文名】Nimotuzumab Injection【汉语拼音】Nituozhudankang Zhusheyeﻫ【成份】每支10ml含50mg尼妥珠单抗(人源化抗人表皮生长因子受体单克隆抗体)、4。
5mg磷酸二氢钠、18。
0mg磷酸氢二钠、86。
0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体.ﻫ【适应证】本品与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品.本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显著,不良反应轻微。
ﻫ【用法用量】ﻫ100或200mg泰欣生(尼妥珠单抗)稀释于250ml生理盐水中静脉滴注,输液进药过程在60分钟以上,每周1次,共8次,患者同时接受标准的放、化疗ﻫ【药理作用】泰欣生(尼妥珠单抗)能够竞争性抑制内源性配体与EGFR的结合,阻断由EGFR介导的下游信号传导通路和细胞学效应,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,抑制肿瘤血管生成,抑制肿瘤细胞浸润和转移,增强放、化疗疗效。
ﻫ药理研究:EGFR是分子量为170KD的跨膜糖蛋白,其胞内区具有特殊的酪氨酸激酶活性。
尼妥珠单抗可在体内或体外培养细胞中阻断EGF与其受体EGFR的结合,并对EGFR过度表达的肿瘤具有有效的抗血管生成、抗增殖和促凋亡作用。
《奥妥珠单抗临床用药指导原则中国专家共识》要点

《奥妥珠单抗临床用药指导原则中国专家共识》要点《奥妥珠单抗临床用药指导原则中国专家共识》是中国专家根据临床实践和研究成果制定的针对奥妥珠单抗药物的用药指导原则。
奥妥珠单抗是一种全人源的单克隆抗体药物,已经广泛应用于多种疾病的治疗。
本文将介绍该专家共识的要点。
一、奥妥珠单抗的适应症:根据专家共识,奥妥珠单抗适用于治疗非小细胞肺癌、黑色素瘤、头颈部鳞癌、膀胱尿路上皮肿瘤、胃癌、食管癌、肾癌、卵巢癌、白血病、淋巴瘤等多种恶性肿瘤。
二、用药剂量和给药方案:根据患者的体表面积或体重、药物的代谢和排泄性质等因素,确定奥妥珠单抗的剂量和给药方案。
专家共识指出,根据具体疾病类型和治疗方案,奥妥珠单抗可以作为单药治疗或联合其他化疗药物使用。
三、用药的监测和安全性评估:在进行奥妥珠单抗治疗期间,应定期进行临床和实验室检查,监测患者的疗效和不良反应。
常见的不良反应有感染、白细胞减少、血小板减少、肌酸酐清除率降低等,应及时采取相应的干预措施。
四、特殊人群的用药:对于特殊人群如老年患者、儿童、孕妇、肝肾功能不全患者等,奥妥珠单抗的用药原则也有所不同。
专家共识中对于不同特殊人群的用药给出了相应的建议。
五、药物相互作用:奥妥珠单抗与其他药物同时使用时可能会发生药物相互作用,影响药物的药动学和药效学。
专家共识中列举了与奥妥珠单抗有潜在相互作用的药物,提醒医生在开药时要考虑这些因素。
六、临床应用指导:专家共识中对于奥妥珠单抗在各种恶性肿瘤的临床应用给出了详细的指导,包括治疗方案的选择、疗程、疗效评估等方面的建议。
七、用药的费用和经济性评估:奥妥珠单抗作为一种高价药物,其费用会成为患者和医生考虑的因素之一、专家共识中提供了奥妥珠单抗的用药费用评估,并提醒患者和医生应充分考虑其经济性。
综上所述,《奥妥珠单抗临床用药指导原则中国专家共识》提供了奥妥珠单抗的临床应用指导,并对其剂量、给药方案、不良反应、特殊人群、药物相互作用、费用等方面给出了详细的建议。
贝伐珠单抗、尼妥珠单抗、曲妥珠单抗、信迪利单抗、特瑞普利单抗等常用单抗类靶向药物适应症及用药建议

贝伐珠单抗、尼妥珠单抗、曲妥珠单抗、帕妥珠单抗、西妥昔单抗、阿替利珠单抗、利妥昔单抗、曲妥珠单抗、信迪利单抗、度伐利尤单抗、纳武利尤单抗、特瑞普利单抗等常用单抗类靶向药物适应症及用药建议贝伐珠单抗靶向VEGF医保适应证:转移性结直肠癌:联合化疗方案时,5mg/kg体重,每两周给药一次(5 mg/kg/q2w)或7.5mg/kg体重,每3周给药一次(7.5mg/kg/q3w);非小细胞肺癌:推荐剂量为15mg/kg体重,每3周给药一次(15 mg/kg/q3w);肝细胞癌:与阿替利珠单抗联合使用1200mg后,静脉输注贝伐珠单抗15 mg/kg,q3w;复发性胶质母细胞瘤:静脉输注推荐剂量为10mg/kg体重,每两周给药一次(10mg/kg/q2w);其他六大适应症:复发性卵巢上皮癌、输卵管癌或原发性腹膜癌:初次手术切除后的III/IV期疾病:贝伐珠单抗推荐剂量为一次15 mg/kg,每3周1次(15mg/kg/q3w),与「紫杉醇+卡铂」化疗方案合用最多6周期,随后单独使用贝伐珠单抗15mg/kg/q3w;难治性、复发性或转移性宫颈癌:与「紫杉醇+顺铂」或「紫杉醇+托泊替康」方案联用,推荐剂量为15 mg/kg,q3w;转移性肾癌:双周方案:10mg/kg;3周方案:7.5mg/kg;晚期转移性乳腺癌:双周方案:10mg/kg;3周方案:15mg/kg;放射性脑损伤:贝伐珠单抗推荐剂量为5mg/kg,每2周1次(5mg/kg/q2w),共4个疗程;或贝伐珠单抗7.5mg/kg静脉滴注1次,每3周1次,根据病情使用2~4个疗程;胸腔积液、腹腔积液:推荐剂量为300mg固定剂量,每2周1次。
尼妥珠单抗靶向EGFR适应症:表皮生长因子受体 (EGFR) 表达阳性的亚/IV期头颈部鳞癌和鼻咽癌;晚期神经胶质瘤;胰腺癌。
用药建议:第一次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1 次,共8 周,患者同时接受标准的放射治疗。
西妥昔单抗 —2020版各系统肿瘤的药物临床应用指导原则

九、西妥昔单抗 cetuximab制剂与规格:注射液:100mg(20ml)/瓶适应证:用于治疗表达EGFR、RAS基因野生型的转移性结直肠癌,与伊立替康联合用于经含伊立替康治疗失败后的患者。
合理用药要点:1.用药前必须使用经过验证的方法检测RAS基因状态,RAS基因野生型是接受西妥昔单抗治疗的先决条件,本品不用于治疗RAS基因突变型或RAS状态不明的患者。
2.转化性治疗:结直肠癌患者合并肝转移和/或肺转移,潜在可切除,可选择西妥昔单抗联合化疗(RAS野生型)。
3.姑息治疗:转移性结直肠癌患者(RAS野生型)一、二线治疗,尤其是左半肠癌患者,可选择西妥昔单抗+化疗。
对一、二线治疗中没有使用西妥昔单抗的患者(RAS野生型),可选择西妥昔单抗联合伊立替康化疗。
4.如果初始使用西妥昔单抗治疗,在二线或者随后的治疗中均不应再使用西妥昔单抗治疗。
5.本品常可引起不同程度的皮肤毒性反应,主要表现为痤疮样皮疹,此类患者用药期间应注意避光。
轻至中度皮肤毒性反应无需调整剂量,发生重度皮肤毒性反应者,应酌情减量。
6.严重的输液反应发生率为3%,致死率低于0.1%。
其中90%发生于第一次使用时,以突发性气道梗阻、荨麻疹和低血压为特征。
首次滴注本品之前,患者必须接受抗组胺药物和糖皮质激素类药物的治疗,建议在随后每次使用本品之前都对患者进行这种治疗。
7.仅对肝肾功能正常的患者(血清肌酐≤正常值上限的1.5倍,转氨酶≤正常值上限的5倍,胆红素≤正常值上限的1.5倍)进行过本品的相关研究。
8.本品应储存在2~8℃,禁止冷冻,开启后应立即使用。
※9.与FOLFOX联合用于一线治疗RAS基因野生型、表达EGFR基因的转移性结直肠癌(已有Ⅲ期临床结果,正在申报中国适应证)。
※10.与FOLFIRI联合用于一线治疗RAS基因野生型、表达EGFR的转移性结直肠癌(美国FDA已批准的适应证)。
尼妥珠单抗注射液说明书--泰欣生

尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg 聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热 4.28% (发热,最高39℃)- 4.28% 用药缓解,未影响治疗血压下降、头晕 2.86%(最低80/50毫米汞柱)- 2.86% 休息后缓解,未影响治疗恶心 1.43% - 1.43% 自行缓解,未影响治疗皮疹 1.43% - 1.43% 自行缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100~400 mg/次,用药1~6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20~75岁),男性57例,女性32例,共89例。
纳武利尤单抗 nivolumab—2020年版各系统肿瘤的药物临床应用指导原则

七、纳武利尤单抗 nivolumab
制剂与规格:注射液:40mg(4ml)/瓶、100mg(10ml)/瓶
适应证:本品联合伊匹单抗适用于IMDC评分为中高危的晚期肾细胞癌患者的一线治疗。
合理用药要点:
1.纳武利尤单抗联合伊匹单抗用于IMDC评分为中高危的晚期肾细胞癌的一线治疗基于CheckMate 214研究。
该治疗方法已获得美国FDA和欧洲药品管理局获批,推荐临床剂量是纳武利尤单抗3mg/kg 每次持续至少60分钟+伊匹单抗1mg/mg 每次持续至少30分钟,每3周1次,连续4次后,改为纳武利尤单抗3mg/kg 每2周1次,每次持续至少60分钟。
但该适应症尚未获得中国NMPA批准,已经获得2019版CSCO肾癌诊疗指南的推荐,可在与患者充分沟通的情况下考虑使用。
2.国际转移性肾细胞癌数据库联盟(IMDC)评分内容包括:贫血(低于正常值下限)、中性粒细胞升高(高于正常值上限)、血小板升高(高于正常值上限)、KPS评分<80、一线治疗距诊断时间<1年、高钙血症。
每项为1分。
总分
0分为低危人群,1-2分为中危人群,≥3分为高危人群。
3.因部分患者使用免疫治疗可能会出现假性进展(治疗最初数月内肿瘤出现短暂性增大或出现新的小病灶,随后。
尼妥珠单抗临床试验研究进展

尼妥珠单抗临床试验研究进展
乔鑫;徐靖源;张彦文
【期刊名称】《药品评价》
【年(卷),期】2011(008)022
【摘要】尼妥珠单抗(Nimotuzumab.h-R3)是我国第一个表皮生长因子受体为靶
点的人源化单克隆抗体药物,能够竞争性结合表皮生长因子受体,抑制肿瘤细胞增殖、促进细胞凋亡、抑制肿瘤血管生成.临床试验显示,其对于多种上皮源肿瘤具有良好
的疗效.疾病控制率高,不良反应轻微,患者生存获益显著.
【总页数】6页(P16-21)
【作者】乔鑫;徐靖源;张彦文
【作者单位】天津医科大学药学院,天津300070;天津医科大学药学院,天津300070;天津医科大学药学院,天津300070;天津医科大学继续教育学院,天津300203
【正文语种】中文
【中图分类】R945
【相关文献】
1.尼妥珠单抗治疗高分级胶质瘤研究进展 [J], 包婺安;胡福军
2.尼妥珠单抗联合术后同步放化疗治疗华人恶性胶质瘤的Ⅰ期临床试验 [J], 李文斌;陈静;赵艳杰;康勋;陈怡东;邱晓光
3.尼妥珠单抗放疗增敏作用研究进展 [J], 陈静(综述);冯林春(审校)
4.尼妥珠单抗放疗增敏作用研究进展 [J], 陈静(综述);冯林春(审校);
5.抗结核药品临床试验疗效评价指标的研究进展 [J], 段鸿飞;初乃惠
因版权原因,仅展示原文概要,查看原文内容请购买。
尼妥珠单抗联合同步放化疗治疗局部晚期宫颈癌患者的临床疗效

尼妥珠单抗联合同步放化疗治疗局部晚期宫颈癌患者的临床疗效潘美红;黄行志;欧阳芊;徐勋【期刊名称】《癌症进展》【年(卷),期】2024(22)7【摘要】目的探讨尼妥珠单抗联合同步放化疗治疗局部晚期宫颈癌患者的临床疗效。
方法根据治疗方法的不同将72例局部晚期宫颈癌患者分为对照组(n=30,同步放化疗)和观察组(n=42,尼妥珠单抗联合同步放化疗)。
比较两组患者的临床疗效、T淋巴细胞亚群(CD4^(+)、CD8^(+))水平、肿瘤标志物[肿瘤特异性生长因子(TSGF)、糖类抗原125(CA125)、鳞状细胞癌抗原(SCCA)]水平及不良反应发生情况。
结果观察组患者的总有效率为90.48%,明显高于对照组患者的63.33%(P﹤0.01)。
治疗后,两组患者CD4^(+)、CD8^(+)水平均低于本组治疗前,观察组患者CD4^(+)、CD8^(+)水平均高于对照组,差异均有统计学意义(P﹤0.05)。
治疗后,两组患者TSGF、CA125、SCCA水平均低于本组治疗前,观察组患者TSGF、CA125、SCCA水平均低于对照组,差异均有统计学意义(P﹤0.05)。
两组患者各不良反应发生率比较,差异均无统计学意义(P﹥0.05)。
结论尼妥珠单抗联合同步放化疗治疗局部晚期宫颈癌患者,可提高临床疗效,改善免疫功能,降低肿瘤标志物水平,且安全性较好。
【总页数】4页(P736-739)【作者】潘美红;黄行志;欧阳芊;徐勋【作者单位】萍乡市人民医院妇科【正文语种】中文【中图分类】R737.33【相关文献】1.新辅助化疗后同步放化疗联合尼妥珠单抗治疗局部晚期鼻咽癌的临床价值分析2.尼妥珠单抗联合放化疗治疗局部晚期宫颈癌的疗效及对相关肿瘤因子水平和免疫功能的影响3.尼妥珠单抗联合放化疗治疗局部晚期宫颈癌的近期疗效观察4.尼妥珠单抗与贝伐珠单抗联合同步放化疗治疗局部晚期宫颈癌的疗效及不良反应对比研究5.同步放化疗联合尼妥珠单抗治疗局部晚期鼻咽癌患者的近期疗效和毒副反应分析因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、尼妥珠单抗 nimotuzumab
制剂与规格:注射液:50mg(10ml)/瓶
适应证:与放疗联合治疗EGFR基因阳性表达的Ⅲ~Ⅳ期鼻咽癌。
合理用药要点:
1.尼妥珠单抗冻融后抗体大部分活性将丧失,故在储存
过程中严禁冷冻。
2.尼妥珠单抗配制的溶液在输液容器中2~8℃时,其
物理和化学稳定性可保持12小时,在室温下可保持8小时。
储存时间超过上述时间,不宜继续使用。
3.尼妥珠单抗与放疗联合适用于治疗EGFR基因阳性表
达的Ⅲ~Ⅳ期鼻咽癌。
4.使用尼妥珠单抗前,建议先确认肿瘤组织的EGFR基
因表达水平,针对EGFR基因中、高表达的患者推荐使用
本品。
5.免疫组化法检验EGFR基因表达,操作应由熟练掌握EGFR基因检测试剂盒检测技术的实验室完成。
检验中的某
些失误,如组织样本质量较差、操作不规范、对照使用不
当等均可影响结果。
6.治疗期间因毒性不可耐受时可在同一代药物之间替换,因疾病进展不能在同一代药物之间替换。
