第三节金属晶体
第三节金属晶体ppt课件

空间利用率:68%
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
体心立方堆积:
这种堆积晶胞是一个体心立方,
每个晶胞每个晶胞含 2 个原子,
空间利用率不高(68%),属于非 密置层堆积,配位数为 ,许
多金8属(如Na、K、Fe等)采取这
(一)几个概念 紧密堆积:微粒之间的作用力使微粒间尽
可能的相互接近,使它们占有最小的空间。
配位数:在晶体中与某一微粒等距离且紧 密相邻的微粒的数目。
空间利用率:晶体的空间被微粒占满的体积 百分数,用它来表示紧密堆积的程度。
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
金属原子的堆积方式
二维空间
非密置层
三维空间
密置层
三维空间
简 单 立 方 堆 积
体六 心方 立最 方密 堆堆 积积
面 心 立 方 最 密
堆
积
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
完成下表:
成键微粒 实质
金属键
金属阳离子 自由电子 静电作用
离子键 阴、阳离子 静电作用
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
3.金属结晶的结构条件

第三节金属结晶的结构条件金属的结晶是晶核的形成和长大的过程,而晶核是由晶胚生成的,那么,晶胚又什么呢?它是怎样转变成品核的呢这些问题都涉及到液态金展的结构条件因此了解液态金属的结构对于深入理解结晶时的形核和长大过程十分重要液态固态气态金属结构的比较:●由于液体具有良好的流动性,所以人们曾经认为,液态金属的结构与气体相似,是以单原子状态存在的,并进行着无规则的热运动。
●但是大量的实验结果表明,液态金属的结构与固态相似,而与气态金属根本不同。
⏹例如,金属熔化时的体积增加很小()%5~3,说明固态金属与液态金属%的原子间距相差不大;⏹液态金属的配位数比固态金属的有所降低,但变化不大,而气态金属的配位数却是零;⏹金属熔化时的熵值较室温时的熵值有显著增加,这意味着其原子排列的有序程度受到很大的破坏。
●液态金属结构的X射线研究结果表明,在液态金属的近邻原子之间具有某种与晶体结构类似的规律性,这种规律性不像晶体那样延伸至远距离。
液态金属的短程有序和晶体的长程有序:在液体中的微小范围内,存在着紧密接触规则排列的原子集团,称为近程有序,但在大范围内原子是无序分布的,而在晶体中大范围内的原子却是呈有序排列的,称之为远程有序。
应当指出,液态金属中近程规则排列的原子集团并不是固定不动、一成不变的,而是处于不断地变化之中● 由于液态金属原子的热运动很激烈,而且原子间距较大,结合较弱,所以液态金属原子在其平衡位置停留的时间很短,很容易改变自己的位置,● 这就使近程有序的原子集团只能维持短暂的时间即被破坏而消失,与此同时,在其它地方又会出现新的近程有序的原子集团。
● 前一瞬间属于这个近程有序原子集团的原子,下一瞬间可能属于另一个近程有序的原子集团。
● 液态金属中的这种近程有序的原子集团就是这样处于瞬间出现,瞬间消失,此起彼伏,变化不定的状态之中,仿佛在液态金属中不断涌现出一些极微小的固态结构一样。
● 这种不断变化着的短程有序原子集团称为结构起伏,或称为相起伏。
高中化学 第三章 第三节 金属晶体教案 新人教版选修3-新人教版高二选修3化学教案

第三节金属晶体[核心素养发展目标] 1.宏观辨识与微观探析:能辨识常见的金属晶体,能从微观角度分析金属晶体中的构成微粒及微粒间的相互作用。
2.证据推理与模型认知:能利用金属晶体的通性推导晶体类型,从而理解金属晶体中各微粒之间的作用,理解金属晶体的堆积模型,并能用均摊法分析其晶胞结构。
一、金属键和金属晶体1.金属键(1)概念:金属阳离子与自由电子之间的强烈的相互作用。
(2)实质:金属原子脱落下来的价电子形成遍布整块晶体的“电子气〞,被所有原子所共用,从而把所有的金属原子维系在一起,形成一种“巨分子〞。
(3)特征:金属键没有方向性和饱和性。
2.金属晶体(1)金属晶体通过金属阳离子与自由电子之间的较强作用形成的晶体,叫做金属晶体。
(2)用电子气理论解释金属的性质(1)金属单质和合金都属于金属晶体。
(2)金属晶体中含有金属阳离子,但没有阴离子。
(3)金属导电的微粒是自由电子,电解质溶液导电的微粒是自由移动的阳离子和阴离子;前者导电过程中不生成新物质,为物理变化,后者导电过程中有新物质生成,为化学变化。
因而,二者导电的本质不同。
例1以下关于金属键的表达中,不正确的选项是( )A.金属键是金属阳离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,其实质与离子键类似,也是一种电性作用B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性C.金属键是带异性电荷的金属阳离子和自由电子间的相互作用,故金属键无饱和性和方向性D.构成金属键的自由电子在整个金属内部的三维空间中做自由运动[考点] 金属键和金属晶体[题点] 金属键的理解答案 B解析从基本构成微粒的性质看,金属键与离子键的实质类似,都属于电性作用,特征都是无方向性和饱和性;自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,从这个角度看,金属键与共价键有类似之处,但两者又有明显的不同,如金属键无方向性和饱和性。
《第三章 第三节 金属晶体与离子晶体》教学设计

《金属晶体与离子晶体》教学设计方案(第一课时)一、教学目标1. 理解金属晶体和离子晶体的基本观点。
2. 掌握金属键和离子键的形成原理。
3. 能够区分金属晶体和离子晶体,并能够应用所学知识诠释生活中的实例。
二、教学重难点1. 金属键和离子键的形成。
2. 离子晶体的结构和性质。
3. 金属晶体的电子结构和物理性质。
三、教学准备1. 准备PPT课件,包括图片、图表和相关案例。
2. 准备金属晶体和离子晶体的实物样品,如水晶、金属钠等。
3. 准备实验器械,如试管、烧杯等,用于演示金属晶体的导电性实验。
4. 准备一些习题,用于教室练习和测试。
四、教学过程:(一)导入新课1. 回顾金属钠、镁、铝等金属的物理性质,如颜色、状态、光泽、密度等。
2. 引出金属的分类问题,强调金属晶体与离子晶体在结构上的差别。
(二)讲授新课1. 金属晶体的结构(1)介绍金属键观点,强调金属阳离子与自由电子之间的强烈互相作用。
(2)展示不同金属晶体的结构模型,让学生观察并分析其特点。
(3)通过实验展示金属晶体的导电、导热、延展性等性质。
2. 离子晶体的结构(1)介绍离子键观点,强调阴阳离子之间的强烈互相作用。
(2)展示不同离子晶体的结构模型,让学生观察并分析其特点。
(3)通过实验展示离子晶体的一些性质,如硬度、脆性等。
3. 金属晶体与离子晶体的比较(1)比较金属键与离子键的异同点。
(2)分析金属晶体与离子晶体在物理性质上的差别。
4. 离子晶体性质实验(1)展示钠、镁、铝等金属阳离子的水解过程,说明由此引起的化学性质特点。
(2)演示不同类型离子晶体的熔点、沸点等物理性质的比较实验,帮助学生理解晶体类型对物质性质的影响。
(三)小组讨论组织学生分组讨论以下问题:1. 金属晶体与离子晶体在结构上的主要区别是什么?2. 影响金属晶体与离子晶体物理性质的主要因素是什么?3. 如何根据晶体的结构预计物质的性质?(四)教室小结1. 总结金属晶体与离子晶体的结构特点。
选修3物质结构与性质课件第03章晶体结构与性质第3节 金属晶体

资料 金属之最
熔点最低的金属是-------- 汞 [-38.87℃]
熔点最高的金属是-------- 钨 [3410℃]
密度最小的金属是-------- 锂 [0.53g/cm3]
密度最大的金属是-------- 锇 [22.57g/cm3]
硬度最小的金属是-------- 铯 [0.2]
硬度最大的金属是-------- 铬 [9.0] 延性最好的金属是-------- 铂[铂丝直径:50100 mm] 展性最好的金属是-------- 金[金箔厚: 1001m00m] 最活泼的金属是---------- 铯 最稳定的金属是---------- 金
[2016·全国卷Ⅱ,37(3)节选]单质铜及镍都是由______键形成的晶体。
晶体熔、沸点高低的比较 [2017·全国卷Ⅰ,35(2)节选]K和Cr属于同一周期,且核外最外层电子构型相同, 但 金 属 K 的 熔 点 、 沸 点 等 都 比 金 属 Cr 低 , 原 因 是 __K__的__原__子__半__径__较__大__且__价__电___子__数__较__少__,__金__属__键__较__弱__________________。
【小结】:三种晶体类型与性质的比较
晶体类型 概念
作用力
原子晶体
分子晶体
相邻原子之间以共价 分子间以分子 键相结合而成具有空 间作用力相结 间网状结构的晶体 合而成的晶体
共价键
范德华力
构成微粒
熔沸点 物 理 硬度 性 质 导电性
原子 很高 很大
无(硅为半导体)
分子 很低 很小
无
金属晶体
通过金属键 形成的晶体
a
aa
a
a=2r
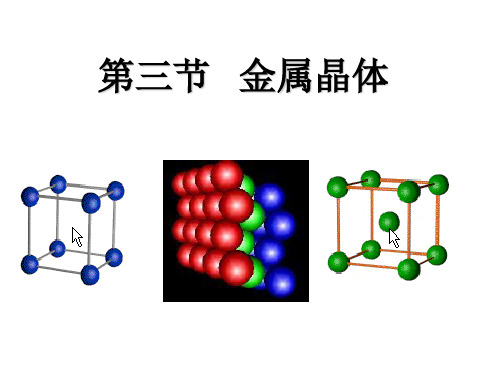
晶胞中平均分配的原子数:1 配位数:6 空间利用率:52% 空间利用率太低!
第三节:金属晶体

③每个原子与8个原子紧密接触,即配位 数为8
④每个晶胞平均有二个原子,晶胞边长a 和原子半径r间的关系为 ,其空间利用 率为68.02%
镁型
铜型
第二层 对第一层来讲最紧密的堆积方
式是将球对准1,3,5 位。 (
4,6 位,其情形是一样的 )
1 6 5 4
或对准 2,
1
3 6 5
2
3 4
A
关键是第三层,对第一、二层来说,第三层 可以有两种最紧密的堆积方式。
晶体类型 晶体粒子 粒子间作用力 熔沸点 硬度
分子晶体
原子晶体
离子晶体
溶解性
延展性 导电性 典型实例
•
•
•
• •
Cl—占据立方体的___个顶点和__个面心,Na+ 占据______和12个______;(或二离子交换), 并交错排列。 2、每个晶胞含__个钠离子:__个氯离子。不存 在单个的NaCl分子,该离子晶体中阴、阳离子 的个数比为____________。 3、与Na+等距离且最近的Cl¯有____个, 与Cl— 等距离且最近的Na+有____个,即阴、阳离子 配位数均为___。 与Na+等距离且最近的Na+ 有___个。 Na+等距离且最近的Cl¯构成 体
③每个原子与12个原子紧密接触,即配位数 为12 ④其空间利用率为74%
堆积 模型 简单 立方 钾型 (bcp)
采纳这种堆 空间利用 配位数 积的典型代 率 表 52% 6
Po (钋)
晶胞
K、Na、Fe
68% 74%
8 12
镁型 Mg、Zn、Ti (hcp)
铜型 Cu, Ag, Au (ccp)
金属晶体与离子晶体(2)高二化学(人教版2019选择性必修2)

0 -200
SiF4
SiCl4 SiBr4 SiI4
根据所学和实验图像推测: TiF4是离子化合物,熔点较高 TiCl4 、 TiBr4、TiI4是共价化合物
知识梳理
推测是否正确?为什么由金属 元素和非金属元素组成的化合 物可能是共价化合物呢?
知识梳理
事实上,纯粹的典型晶体是不多的,大多数离子晶体中的化学键具有一定的共 价键成分。
晶体类型
石墨晶体中,既有共价键 ,又有ቤተ መጻሕፍቲ ባይዱ金属键 和范德华力,属于 混合型晶体。
混合型晶体
物理性质 导电性
知识梳理
导热性
润滑性
典例精讲
请同学们回顾所学内容,判断下列问题的对与错
问题1 问题2
问题3
问题4 问题5 问题6 问题7
纯粹的典型晶体是没有的( ) 离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子 键成分的百分数越小( ) 在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅 限于晶体微观空间的一个个分子中( ) 石墨的二维结构内,每个碳原子的配位数为3( ) 石墨的导电只能沿石墨平面的方向进行( ) 石墨晶体层与层之间距离较大,所以石墨的熔点不高( ) 四类晶体都有过渡型( )
800
NaI
600
400
200
0 -200
SiF4
SiCl4 SiBr4 SiI4
根据硅的卤化物(SiX4)的组成能判断其 的晶体类型吗?分子晶体?共价晶体?
分子晶体熔化时需克服分子间作用力或氢 键,熔点较低;共价晶体需克服共价键, 熔点较高;由图可知:SiX4为分子晶体。
知识梳理
过渡晶体
探究一
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
第三章 第三节 金属晶体第二课时习题

第三节第二课时金属晶体的原子堆积模型1.下列金属晶体的配位数为8的是()。
A.PoB.FeC.MgD.Au2.下列金属的密堆积方式与对应晶胞正确的是()。
A.Na面心立方B.Mg六方C.Cu六方D.Au体心立方3.已知某金属(如碱金属)晶体中原子堆积方式如图所示,则该堆积方式是()。
A.简单立方堆积B.体心立方堆积C.六方最密堆积D.面心立方最密堆积4.下列晶体的熔点按照由低到高的顺序排列的是()。
A.Li、Na、KB.Na、Mg、AlC.Na、Rb、CaD.铁、铁铝合金5.金属晶体中金属原子有三种常见的堆积方式:六方堆积、面心立方堆积和体心立方堆积,如图(a)(b)(c)分别代表这三种晶胞的结构,其晶胞内金属原子个数比为()。
A.3∶2∶1B.11∶8∶4C.9∶8∶4D.21∶14∶96.铁有多种同素异形体,如图是δ、γ、α三种晶体的转化关系。
下列说法正确的是()。
δ-Feγ-Feα-FeA.三种晶体的构成粒子相同,故性质相同B.γ-Fe晶体中与每个铁原子距离最近且相等的铁原子有6个C.α-Fe晶体中与每个铁原子距离最近且相等的铁原子有6个D.将铁加热到1500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同7.某金属晶体的部分结构示意图如图所示,则该金属原子的堆积方式为()。
A.六方最密堆积B.面心立方最密堆积C.简单立方堆积D.体心立方堆积8.金属晶体的面心立方最密堆积形成的晶胞示意图如图所示,在密堆积中处于同一密置层上的原子组合是()。
A.④⑤⑥⑩B.②③④⑤⑥⑦C.①④⑤⑥⑧D.①②⑧⑤9.现有如下物质:四氯化硅、氖、硼、钨、锑,将物质名称和晶体类型填在表格中。
编号信息物质名称晶体类型(1) 熔点:120.5 ℃,沸点:271.5 ℃,易水解(2) 熔点:630.74 ℃,沸点:1750 ℃,导电(3) 由分子间作用力结合而成,熔点很低,化学性质稳定(4)由共价键结合成空间网状结构的晶体,熔点:2300 ℃,沸点:2550 ℃,硬度大(5) 熔点:3410 ℃,沸点:5927 ℃,硬度大,能导电10.如图为金属铜的一个晶胞,请回答下列问题: (1)该晶胞“实际”拥有的铜原子数是 个。
第三节金属晶体

第三节金属晶体在广东省某一山区的村寨里,前些年连续出生的净是女孩,人们急了,照这样下去,这个地区岂不变成女儿国了吗?有的人求神拜佛,也无济于事。
有位风水老者说道:“地质队在后龙山寻矿,把龙脉破坏了,这是风水的报应啊!〞于是,迷信的村民千方百计地找到了原来在此地探矿的地质队,闹着要他们赔“风水〞。
地质队又回到了这个山寨,进展了深化的调查,终于找到了原因。
原来是在探矿的时候,钻机把地下含铍的泉水引了出来,扩散了铍的污染,使饮用水的铍含量大为进步,长时间饮用这种水,就会导致生女而不生男。
经过治理,情况得到了好转,在“女儿国〞里又生出男孩了。
卫星、飞船、飞机、大炮和生活用品都离不开金属,为什么金属具有优良的导电、导热、延展性?构成金属的粒子是什么?金属晶体内部的作用力是什么?一、金属键与金属晶体1.金属键:2.金属晶体,(1)概念:原子间以__金属键____结合形成的晶体。
(2)用电子气理论解释金属的性质:二、金属晶体原子的堆积模型1.二维空间模型:(1)非密置层。
配位数为__4____,如下图:(2)密置层。
配位数为__6____,如下图:2.三维空间模型:(1)非密置层在三维空间堆积。
①简单立方堆积。
相邻非密置层原子的原子核在__同一条直线上____的堆积,只有金属__钋(Po)____采用这种堆积方式,其空间利用率太低。
②体心立方堆积。
将上层金属原子填入__下层的金属原子形成的凹穴____中,并使非密置层的原子稍稍别离。
其空间的利用率比简单立方堆积__高____,属于该堆积方式的主要有碱金属等。
(2)密置层在三维空间堆积。
①六方最密堆积。
如下图,按__ABABABAB____……的方式堆积。
②面心立方最密堆积。
如下图,按__ABCABCABC____……的方式堆积。
三、混合晶体——石墨晶体1.构造特点——层状构造:(1)同层内,碳原子采用__sp2____杂化,以__共价键____相结合形成__正六边形____平面网状构造。
第三节 金属晶体

第三章第三节金属晶体第1课时教学目标:1、理解金属键的概念和电子气理论2、初步学会用电子气理论解释金属的物理性质教学难点:金属键和电子气理论教学重点:金属具有共同物理性质的解释。
教学过程:【引入】大家都知道晶体有固定的几何外形、有确定的熔点,水、干冰等都属于分子晶体,靠范分子间作用力结合在一起;金刚石、金刚砂等都是原子晶体,靠共价键相互结合,那么我们所熟悉的铁、铝等金属是不是晶体呢?它们又是靠什么作用结合在一起的呢?【板书】一、金属键1、金属晶体中金属阳离子和自由电子之间的相互做用叫做金属键。
【讲解】金属原子的电离能低,容易失去电子而形成阳离子和自由电子,阳离子整体共同吸引遍布整个晶体的自由电子而结合在一起。
这种金属离子与自由电子之间的较强作用就叫做金属键。
自由电子可以在整个晶体中流动,被所以原子所共用,所以金属键可看成是由许多原子共用许多电子的一种特殊形式的共价键,这种键既没有方向性也没有饱和性。
【强调】金属晶体是以金属键为基本作用力的晶体。
【板书】2、电子气理论及其对金属通性的解释(1).电子气理论【讲解】描述金属键本质的最简单的是理论叫做“电子气理论”。
它把金属键形象地描绘成从金属原子上“脱落”下来的大量自由电子形成可与气体相比拟的带负电的“电子气”,金属原子则“浸泡”在“电子气”的“海洋”之中。
(2).金属通性的解释【展示金属实物】展示的金属实物有金属导线(铜或铝)、铁丝、镀铜金属片等,并将铁丝随意弯曲,引导观察铜的金属光泽。
叙述金属的应用包括电工架设金属高压电线,家用铁锅炒菜,锻压机把钢锭压成钢板等。
【教师引导】从上述金属的应用来看,金属有哪些共同的物理性质呢?【学生分组讨论】请一位同学归纳,其他同学补充。
【板书】金属共同的物理性质容易导电、导热、有延展性、有金属光泽等。
⑴金属导电性的解释在金属晶体中,充满着带负电的“电子气”,这些电子气的运动是没有一定方向的,但在外加电场的条件下电子气就会发生定向移动,因而形成电流,所以金属容易导电。
人教版选修三第三章 第三节 金属晶体

第三章第三节金属晶体一、选择题(每小题只有一个选项符合题意,3分×10)1、下列有关金属晶体的说法中正确的是()A.常温下都是晶体B.最外层电子数少于3个的都是金属C.任何状态下都有延展性D.都能导电、传热2、金属Mg晶体中含有的粒子是( )A.Mg原子B.只有Mg2+C.Mg原子和Mg2+D.Mg2+与自由电子3、下列有关化学键、氢键和范德华力的叙述中,不正确的是()A.金属键是金属离子与“电子气”之间的较强作用,金属键无方向性和饱和性B.共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性C.范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大D.氢键不是化学键,而是分子间的一种作用力,所以氢键只存在于分子与分子之间4、关于晶体的下列说法正确的是()A、在晶体中只要有阴离子就一定有阳离子B、在晶体中只要有阳离子就一定有阴离子C、原子晶体的熔点一定比金属晶体的高D、分子晶体的熔点一定比金属晶体的低5、金属的下列性质中,与自由电子无关的是( )A.密度大小B.容易导电C.延展性好D.易导热6、金属晶体的熔沸点之间的差距是由于()A.金属键的强弱不同B.金属的化合价的不同C.金属的晶体中电子数的多少不同D.金属的阳离子的半径大小不同7、下列物质的熔沸点依次升高的是()A.K、Na、Mg、Al B.Li、Na、Rb、CsC.Al、Mg、Na、K D.C、K、Mg、Al8、金属具有延展性的原因是( )A.金属原子半径都较大,价电子较少B.金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用C.金属中大量自由电子受外力作用时,运动速度加快D.自由电子受外力作用时能迅速传递能量9、金属晶体堆积密度大,原子配位数高,能充分利用空间的原因是()A.金属原子的价电子数少B.金属晶体中有自由电子C.金属原子的原子半径大D.金属键没有饱和性和方向性10、石墨晶体中不存在的化学作用力是()A.共价键B.氢键C.金属键D.范德华力二、选择题(每小题有一至两个选项符合题意,4分×7)11、下列说法不正确的是( )A.金属单质的熔点一定比非金属单质高B.离子晶体中不一定含有金属元素C.在含有阳离子的晶体中,一定含有阴离子D.含有金属元素的离子不一定是阳离子12、下列有关金属晶体的说法中不正确的是()A.金属晶体是一种“巨分子”B.“电子气”为所有原子所共有C.简单立方堆积的空间利用率最低D.钾型堆积的空间利用率最高13、下列叙述正确的是()A、同主族金属的原子半径越大,熔点越高B、稀有气体的原子序数越大沸点越高C、晶体中存在离子的一定是离子晶体D、金属晶体中的自由电子属于整个晶体共有14、下列何种物质的导电性是由自由电子的运动所决定的()A 熔融的食盐B 饱和食盐水C 石墨D 铜15、石墨是层状晶体,每一层内,碳原子排成正六边形,许多个正六边形排列成平面状结构,如果将每对相邻原子间的化学键看成一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数的比是()A 2︰3B 1︰3C 1︰1D 1︰216、下列叙述中,可以肯定是一种主族金属元素的是()A.原子最外层有3个电子的一种金属B.熔点低于100℃的一种金属C.次外电子层上有8个电子的一种金属D.除最外层,原子的其他电子层电子数目均达饱和的一种金属A.只要含有金属阳离子的晶体就一定是离子晶体B.在共价化合物分子中各原子都形成8电子结构C.同族元素的氧化物可形成不同类型的晶体D.金属晶体的熔点不一定比分子晶体的高三、填空题(共42分)18、(6分)(1)金属导电是____________________的结果.(2)金属导热是____________________的结果.(3)金属抽成丝或压成薄板是金属受到外力作用,紧密堆积的原子(离子)层发生了________________,而金属离子和自由电子之间的____________________没有改变.19、(14分)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。
金属晶体堆积方式
密置堆:第三层球放在第二层球的空隙上有两种方式
A B C A
重复ABC的堆积叫A1堆积,重复单位⃒ABC⃒。
A B A
重复AB的堆积叫A3堆积,重复单位⃒AB⃒。
3、六方最密堆积 A3堆积: 抽出六方晶胞,又叫六方最密堆积(hexagonal
closest packing)简写为hcp 。
A B A
第三节 金属晶体
1、简单立方堆积 -配位数:6
每个晶胞包含一个原子 空间利用率52%
1
4
2361 Nhomakorabea4
2
3
5
2、钾型(体心立方堆积) -配位数:8
每个晶胞包含2个原子 空间利用率68%
5
6
8
7
1
2
4
3
密堆积原理:原子、离子、分子的排布总是 趋向于配位数高,空间利用率大的紧密堆 积结构方式,最紧密的堆积往往是最稳定 的结构。
分数坐标: 配位数:12 空间利用率74% 晶胞内含有2个球。
4、面心立方最密堆积
A1堆积:
抽出立方面心晶胞,又叫面心立方最密堆积 (cubic closest packing)简写为ccp 。
z
A
B
C
y
x
A
配位数12 空间利用率74% 晶胞内含有4个球。
天祝 天同 有学 个们 好学 心习 情进 。步
2023高中化学第三章晶体结构与性质第三节金属晶体与离子晶体测试新人教版选择性必修

第三节金属晶体与离子晶体【基础巩固】1.(2022·广东潮州)下列晶体分类中正确的一组是( )选项离子晶体共价晶体分子晶体A NaOH Ar SO2B H2SO4石墨S8C CH3COONa 水晶苯D Ba(OH)2金刚石玻璃解析:NaOH属于离子晶体,Ar属于分子晶体,SO2属于分子晶体,A项错误;石墨属于混合型晶体,H2SO4、S8属于分子晶体,B项错误;CH3COONa属于离子晶体,水晶(SiO2)属于共价晶体,苯属于分子晶体,C项正确;Ba(OH)2属于离子晶体,金刚石属于共价晶体,玻璃属于玻璃态物质,不属于晶体,D项错误。
答案:C2.(2022·广东东莞)铁有α、γ、δ三种晶体结构,在一定条件下可以相互转化。
晶胞结构如图所示,晶胞中距离最近的铁原子均相切。
下列说法错误的是( ) α铁γ铁δ铁A.铁的导电性、导热性、延展性都可以用电子气理论来解释B.α铁、γ铁、δ铁的晶胞中铁原子个数比为1∶4∶2C.α铁、γ铁、δ铁的晶胞边长之比为1∶∶解析:电子气理论指出金属阳离子“浸泡”在电子气中,可以解释铁的导电性,导热性和延展性,A项正确。
α铁为简单立方,γ铁为面心立方,δ铁为体心立方,故晶胞中铁原子个数之比为1∶4∶2,B项正确。
α铁中一条边上的原子相互接触,边长即为铁原子距离a,而γ铁中面对角线上的原子相互接触,则边长为a,而δ铁中体对角线上原子相互接触,边长为,C项错误;γ铁中平均一个铁原子占据体积为=a3,δ铁中平均一个铁原子占据体积为=a3,故γ铁在一定条件下转化为δ铁后密度变小, D项正确。
答案:C3.(2022·广东东莞)下列关于晶体结构和性质的叙述中都正确的一组是( )①I3+的空间结构为V形,中心原子的杂化方式为sp3②金属阳离子只能存在于离子晶体中③因为NH3分子间存在氢键,所以NH3极易液化,用作制冷剂④因金属性K>Na>Mg,所以熔点:KCl>NaCl>MgCl2⑤干冰晶体中,每个二氧化碳分子周围等距且紧邻的二氧化碳分子有12个⑥因为1 mol Si晶体中含有2 mol Si—Si,所以1 mol SiC晶体中也含有2 mol Si—C⑦CH3Cl和CCl4均为正四面体构型的非极性分子⑧H2O比H2S稳定是因为水分子间存在氢键A.①③⑤B.①③⑤⑥C.④⑥⑦⑧D.②③④⑥⑧解析:①将中一个碘原子看成中心原子,另两个是与中心原子结合的原子,中心原子的价层电子对数为2+=4,所以中心原子的杂化方式为sp3,正确;②金属晶体是由金属阳离子和自由电子构成的,所以金属阳离子可能还存在于金属晶体中,错误;③氨分子间存在氢键,使分子间作用力增大,所以NH3极易液化,液氨汽化吸收大量的热,用作制冷剂,正确;④离子晶体的熔点与离子键的强弱有关,与金属性无关,离子半径越小,电荷数越多,晶格能越大,离子晶体的熔点越高,所以熔点:KCl<NaCl<MgCl2,错误;⑤干冰晶胞结构如图所示,每个CO2分子周围等距且紧邻的CO2分子个数为3×8÷2=12,正确;⑥SiC晶体中每个Si原子形成4个Si—C,1 mol SiC晶体中含有1 mol Si原子,所以含有4 mol Si—C,错误;⑦CCl4含有C—Cl极性键,空间结构为正四面体形,结构对称且正负电荷的中心重合,为非极性分子,CH3Cl是四面体构型,但不是正四面体形,结构不对称,为极性分子,错误;⑧H2O比H2S稳定,是因为共价键键能前者大于后者,氢键影响的是熔沸点,错误。
人教版高中化学选修3课件-金属晶体

知识点二
金属晶体的结构
1.金属晶体的原子堆积模型
2.晶胞中原子的空间利用率的计算方法 (1)以面心立方晶胞为例,求晶胞中原子的空间利用率
图乙是面心立方晶胞的结构剖面图,晶胞的面对角线为金 属原子半径的 4 倍。设金属原子的半径为 R,则晶胞的面对角线 为 4R,晶胞立方体的体积为(2 2R)3。每个面心立方晶胞中实际 含有 4 个金属原子,4 个金属原子的体积为 4×43πR3,因此晶胞 中原子的空间利用率为42×432πRR33×100%=74%。
Hale Waihona Puke ①该晶胞“实际”拥有的铜原子是____4____个。
②该晶胞称为_____C___(填序号)。
A.立方晶胞
B.体心立方晶胞
C.面心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为 a cm, Cu 的相对原子质量为 64, 金属铜的密度为 ρ g·cm-3,则阿伏加德罗常数为___ρ2_·5a_63__m_o_l_-_1(用
1金属晶体在受外力作用下,各层之间发生相对滑动,但 金属键并没有被破坏。
2金属晶体中只有金属阳离子,无阴离子。 3原子晶体的熔点不一定都比金属晶体的高,如金属钨的 熔点就高于一般的原子晶体。 4分子晶体的熔点不一定都比金属晶体的低,如汞常温下 是液体,熔点很低。
1.晶体中有阳离子,一定有阴离子吗?反之, 晶体中有阴离子,一定有阳离子吗?
(4)颜色/光泽——自由电子吸收所有频率光释放一定频率光 由于金属原子以最紧密堆积状态排列,内部存在自由电子, 所以当光辐射到它的表面上时,自由电子可以吸收所有频率的 光,然后很快释放出各种频率的光,这就使得绝大多数金属呈 现银灰色以至银白色光泽,金属能反射照射到其表面的光而具 有光泽。而金属在粉末状态时,金属的晶面取向杂乱,晶格排 列不规则,吸收可见光后辐射不出去,所以金属粉末常呈暗灰 色或黑色。
高中化学选修三第三章 第三节 金属晶体

金属晶体的原子堆积模型
1.二维空间模型 堆积方式 非密置层 密置层
图示
配位数
4 __
6 __
2.三维空间模型 (1)简单立方堆积:按非密置层 (填“密置层”或“非密 置层”)方式堆积而成,其空间利用率52%,配位数为 6 , 晶胞构成:一个立方体,每个晶胞含有 1 个原子,如Po。
(2)体心立方堆积:按非密置层 (填“密置层”或“非密置 层”)方式堆积而成,配位数为 8 ,空间利用率为68%。晶胞 构成:体心立方,每个晶胞含有 2 个原子,如碱金属。
(3)已知下列金属晶体:Ti、Po、K、Fe、Ag、Mg、Zn、Au 其堆积 方式为: Po ①简单立方堆积的是________________ ; K、Fe ②体心立方堆积的是________________ ; Mg、Zn、Ti ③六方最密堆积的是________________ ; Ag、Au 解析 ④面心立方最密堆积的是________________ 。
[特别提醒] 温度越高,金属的导电能力越弱。
1.判断正误(正确的打“√”,错误的打“×”)。 (1)常温下,金属单质都以金属晶体的形式存在 ( × )
(2)金属阳离子与自由电子之间的强烈作用,在一定外力 作用下,不因形变而消失 (3)钙的熔、沸点低于钾 (4)温度越高,金属的导电性越好 (√ ) (× ) ( × )
)
解析:金属原子的半径越小,价电子数目越多,金属键就 越强,即金属阳离子与自由电子间的作用越强。Na、Mg、 Al 均位于第三周期,原子半径逐渐减小,价电子数目逐渐 增多,所以金属键逐渐增强,其中铝的金属键最强,钠的 金属键最弱,而钾和钠位于同一主族,且钾的半径比钠大, 钾的金属键比钠弱。 答案:C
金属键与金属晶体
第三节 金属晶体3-3

74%
12
自主探究
精要解读
实验探究
【例2】►
有四种不同堆积方式的金属晶体的晶胞如图所示,
( )。
有关说法正确的是
A.①为简单立方堆积,②为镁型,③为钾型,④为铜型 B.每个晶胞含有的原子数分别为:①1个,②2个,③2
个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12 D.空间利用率的大小关系为:①<②<③<④
影响金属键的因素
金属元素原子半径越小,单位体积内自由移动电子数目越 1. 大,金属键越强。金属单质硬度的大小,熔、沸点的高低
与金属键的强弱有关。金属键越强,金属晶体的熔、沸点
越高,硬度越大。 2. 一般来说,金属的原子半径越小,价电子数越多,则金属 键越强。如对Na、Mg、Al而言,由于价电子数:Al>Mg >Na,原子半径:Na>Mg>Al,故金属键由强到弱为: Al>Mg>Na,故熔点:Na<Mg<Al(97.81 ℃<645 ℃< 660.4 ℃),硬度:Na<Mg<Al。
A.镁的硬度小于铝
B.镁的熔、沸点低于钙 C.镁的硬度大于钾 D.钙的熔、沸点高于钾
自主探究
精要解读
实验探究
解析
答案
B
自主探究
精要解读
实验探究
本题考查金属键强弱的判断,解题的关键是明确金
属键的强弱与金属物理性质的关系。一般情况下(同
类型的金属晶体),金属晶体的熔点由金属阳离子的 半径、所带的电荷数共同决定。
自主探究 精要解读 实验探究
不一定,如稀有气体晶体中只有分子间作用力而无
化学键。分子晶体熔化时只破坏分子间用力,不破坏共价
1.知道金属键的含义。
2.能用金属键理论解释金属的物理性质。 3.能列举金属晶体的基本堆积模型。 4.了解金属晶体性质的一般特点。 5.理解金属晶体的类型与性质的关系。
第三节金属晶体结构ppt课件

=4
则:
16
V球 =
πr3 3
C B
B
C CC C A
A BBB B C
立方F
8个顶角
n1
=
8×
1 8
=1
6个面心
n2
=
6×
1 2
=3
⑵立方面心晶胞的体积
V晶 = a3
c
C B
B
C CC C A
b a A BBB B C
立方F
每层采取最紧 密堆积
a
A
B
a
D
C
(100)晶面
∵⊿ABC是直角三角形。根据勾股定律得有:
……
第4层 A 第2层 C 第2层 B 第1层 A
A1型最紧密堆积
2.A1型堆积的晶胞类型
根据晶胞划分的规则,我们可从金属的 A1 型最紧密堆积中抽取出立方 面心晶胞。
第4层 A 第2层 C 第2层 B 第1层 A
抽取出
A1型最紧密堆积
BCCC A
B
CC
A BB B堆积 C C堆积
B 堆积和 C 堆积——(111)晶面 c
b a
3.立方面心晶胞的正八面体空隙
立方面心晶胞
立方面心晶胞内 的正八面体空隙
3个晶胞共有的正八面 体空隙
即,立方面心晶胞有两种八
面体空隙。
3个晶胞共用 顶点
⑴6各面心“点”构成的晶
晶胞1、3的 面心
胞内八面体空隙。 ⑵3个晶胞共同拥有的八面
体空隙(共用1条棱边) 。
二、A3型最紧密堆积及其晶胞
The A3 type is most close to pile up and its crystal lattice
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)导电性 在外加电场的作用下,金属晶体中 的自由电子 定向移动 而形成电流,呈 作 现良好的导电性。 (3)导热性 电子气中的自由电子在运动时经常与金 属原子发生碰撞,形成能量传递,呈现出 良好的导热性。
(1)金属晶体中的自由电子是否 思考 专属于某个金属离子? (2)晶体中有阳离子,就一定有阴离子吗? 有阴离子,就一定有阳离子吗? (1)自由电子几乎均匀地分布在整个晶 体中,被许多金属离子共有。 (2)不一定,如金属晶体,只有阳离子, 无阴离子。但有阴离子则一定有阳离子。
晶体类型 原子晶体 分子晶体 金属晶体 通过金属键形 成的晶体
概念 作用力
构成微粒 物 熔沸点 理 硬度 性 质 导电性
相邻原子之间以共 价键相结合而成具 有空间网状结构的 晶体
分子间以 范德华力 相结合而 成的晶体
共价键 原子 很高 很大
无(硅为半 导体)
范德华力 金属键 金属阳离子 分子 和自由电子 很低 差别较大 很小 差别较大 无 导体
【思考】试判断钠、镁、铝三种金属熔沸 点和硬度的大小。 同周期元素,从左到右,价电子数依 次增多,原子(离子)半径依次减小,则 单质中所形成金属键依次增强,故钠、镁、 铝三种金属熔沸点和硬度的大小顺序是: 钠<镁<铝。
资料
金属之最
熔点最低的金属是-----汞 [-38.87℃] 熔点最高的金属是-----钨 [3410℃] 密度最小的金属是-----锂 [0.53g/cm3] 密度最大的金属是----- 锇 [22.57g/cm3] 硬度最小的金属是----- 铯 [0.2] 硬度最大的金属是-----铬 [9.0] 1 延性最好的金属是-----铂[铂丝直径:5000 mm] 1 展性最好的金属是-----金[金箔厚:10000 mm] 最活泼的金属是-------铯
,上下层各3
。 )
3、镁型 [六方密堆积]
配位数:12 74% 空间占有率: 每个晶胞含原子数: 2
第二种是将第三 层的球对准第一层的 2,4,6位,不同于 AB 两层的位置,这 是C层。
1 6 5 4
1
6 5
2 3
4
2
3 6
1
2 3
5
4
第四层再排 A,于 是形成 ABC ABC 三 层一个周期。 得到面 心立方堆积。
▲
不同的金属在某些性质方面,如密度、 硬度、熔点等又表现出很大差别。这与 金属原子本身、晶体中原子的排列方式 等因素有关。
4、金属晶体结构具有金属光泽和颜色 • 由于自由电子可吸收所有频率的光,然后 很快释放出各种频率的光,因此绝大多数 金属具有银白色或钢灰色光泽。而某些金 属(如铜、金、铯、铅等)由于较易吸收 某些频率的光而呈现较为特殊的颜色。
一般情况下,金属晶体熔点由金属键强弱 决定 金属阳离子半径越小,所带电荷越多, 自由电子越多,金属键越强,熔点就相应 越高,硬度也越大.如:
熔点:Al>Mg>Na
【思考】已知碱金属元素的熔沸点随原 子序数的增大而递减,试用金属键理论加 以解释。 同主族元素价电子数相同(阳离子所 带电荷数相同),从上到下,原子(离子) 半径依次增大,则单质中所形成金属键依 次减弱,故碱金属元素的熔沸点随原子序 数的增大而递减。
石墨是层状结构的混合型晶体
1.结合金属晶体的结构和性质,回答以 下问题: (1)已知下列金属晶体:Na、Po、K、 Fe、Cu、Mg、Zn、Au,其堆积方式为: ①简单立方堆积的是____; Po ②体心立方堆积的是_____________; Na、K、Fe ③六方最密堆积的是_______; Mg、Zn
④面心立方最密堆积的是________。 Cu、Au (2)根据下列叙述,判断一定为金属晶体 的是________。 C A.由分子间作用力形成,熔点很低 B.由共价键结合形成网状晶体,熔点 很高 C.固体有良好的导电性、传热性和延 展性
基础知识梳理 一、金属键 1.描述金属键本质的最简单理论是电 子气理论。 2.电子气理论把金属键描述为金属原 子脱落下来的价电子形成遍布整块晶体的“ 电子气”,被所有原子共用,从而把所 有 金属原子 维系在一起。 3.成键微粒是金属阳离子 和自由电子 。
二、金属晶体 1.在金属晶体中,原子间以金属键 相 结合。 2.金属晶体的性质:优良的 导电性、 导热性 和 延展性。 3.用电子气理论解释金属的性质 (1)延展性 当金属受到外力作用时,晶体中的各原 子层就会发生相对滑动 ,但排列方式不变, 金属键 金属离子与自由电子形成的 没有破 坏,所以金属有良好的延展性。
配位数:6 空间占有率: 52% 每个晶胞含原子数: 1
2、体心立方堆积-----钾型
( IA,VB,VIB)
非密置层的另一种堆积是将上层金属 原子填入下层的金属原子形成的凹穴中
金属晶体的堆积方式
配位数:8
每个晶胞含原子数: 2
空间占有率:68%
空间利用率计算
例1:计算体心立方晶胞中金属原子的空 间利用率。
采纳这 种堆积 的典型 代表 Po(钋) 空间利 用率 配位 数
晶胞
52%
6
非密 体心 置层 立方 Na、K、 Fe 堆积 (bcp)
68%
8
金属晶体的四种堆积模型对比
堆积模型
六方最 密堆积 (hcp)
采纳这种 堆积的典 型代表
空间 利用 率 74%
配 位 数 12
晶胞
Mg、Zn、Ti
密 置 层
面心立 方最密 堆积 (ccp或 fcc)
Cu、Ag、 Au
74%
12
四、石墨——混合晶体 1.结构特点——层状结构 (1)同层内,碳原子采用 sp2 杂化, 以共价键 相结合形成 正六边形 平面网 状结构。所有碳原子的2p轨道相互平行且 相互重叠,使p电子可在整个碳原子平面中 运动。 (2)层与层之间以 范德华力 相结合。
2.晶体类型 石墨晶体中,既有共价键 ,又 有金属键,还有 范德华力 ,属 混合晶体 于 。
金属晶体的熔点变化的规律
(1)金属晶体熔点变化差别较大。 (这是因为金属晶体紧密堆积方式不同。) (2)影响熔点因素-金属键强弱 阳离子半径、 离子所带电荷数。 阳离子所带电荷多、半径小 -金属键强,熔沸点高。 如: Li ﹥ ﹥k﹥Rb ﹥ Na Cs
Na < Mg < Al
影响金属键强弱的因素:
空间利用率
= 晶胞含有原子的体积 / 晶胞体积
100% 4 3 4 3 3 2 r 2 ( a) 3 3 4 100 % 68% = 3 3 a a
= 0 % 68%
思考:密置层的堆积方式有哪些?
第二层对第一层来讲最紧密的堆积方式是将球对 准1,3,5 位。(或对准 2,4,6 位,其情形是 一样的 )
配位数=6 (b)密置层
思考与交流
金属晶体可以看成金属原子在三维空 间中堆积而成.那么,非密置层在三维空间 里堆积有几种方式?请比较不同方式堆积 时金属晶体的配位数、原子的空间利用率、 晶胞的区别。
晶胞的形状是什么? 含几个原子?
相邻非密置层原 子的原子核在同 一直线上的堆积
即:
1、简单立方堆积 [ Po ]
晶体类型
导电时的状态
离子晶体
水溶液或 熔融状态下
金属晶体
晶体状态
导电粒子
自由移动的离子 自由电子
2、金属晶体结构与金属导热性的关系 【讨论2】金属为什么易导热? 自由电子在运动时经常与金属离子碰撞, 引起两者能量的交换。当金属某部分受热时, 那个区域里的自由电子能量增加,运动速度 加快,通过碰撞,把能量传给金属离子。金 属容易导热,是由于自由电子运动时与金属 离子碰撞把能量从温度高的部分传到温度低 的部分,从而使整块金属达到相同的温度。
Au、Fe、Cu、 钢铁等
实例Leabharlann 金刚石、二氧化硅、 Ar、S等 晶体硅、碳化硅
【小结】晶体的类型和性质 填课本83页表格
晶体类型 离子晶体 分子晶体 分子
范德华力
原子晶体 金属晶体 原子 共价键 很大 很高
金属离子 自由电子
构成的 阴、阳离子 粒子 作用力 离子键 硬度 熔沸点 导电性
略硬而脆 较高
金属样品
Ti
一、金属的结构
1、金属键的定义:金属离子和自由电子 之间的强烈的相互作用,叫金属键。 (1)金属键的成键微粒是金属阳离子和 自由电子。 (2)金属键存在于金属 单质和合金中。 (3)金属键没有方向性 也没有饱和性。
2、金属晶体的定义:通过金属离子与 自由电子之间的较强的相互作用形成的 晶体。 (1)在晶体中,不存在 单个分子 (2)金属阳离子被自由 电子所包围。
金属晶体
金属原子
自由电子
金属晶体中不存在中性原子和阴离
3、电子气理论:经典的金属键理论叫做 “电子气理论”。它把金属键形象地描绘 成从金属原子上“脱落”下来的大量自由 电子形成可与气体相比拟的带负电的“电 子气”,金属原子则“浸泡”在“电子气” 的“海洋”之中。 二、金属共同的物理性质 容易导电、导热、有延展性、有金属光泽 等。 思考1:金属为什么有这些共同的性质呢?
3.下列叙述正确的是( B) A.任何晶体中,若含有阳离子也一定含 有阴离子 B.原子晶体中只含有共价键 C.离子晶体中只含有离子键,不含有共 价键 D.分子晶体中只存在分子间作用力,不 含有其他作用力 4.为什么碱金属单质的熔沸点从上到下逐 渐降低,而卤素单质的熔沸点从上到下 却升高?
知识回顾:三种晶体类型与性质的比较
• 当金属成粉末状时,金属晶体的晶面取向 杂乱、晶格排列不规则,吸收可见光后辐 射不出去,所以成黑色。
【小结】金属晶体的结构与性质的关系
性质
粒子
导电性
导热性
自由电子 与金属离 子碰撞传 递热量
延展性 晶体中各 原子层相 对滑动仍 保持相互 作用
