高考化学二轮复习专项测试十考点一水的电离和水的离子积常数(2)
高考化学冲刺-《水的电离平衡,水的离子积常数,弱酸弱碱的电离平衡》

高考化学冲刺-《水与弱酸弱碱的电离平衡》例1.(影响水的电离平衡的因素,重点掌握pH的计算)1.1.某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。
下列对该溶液的叙述不正确的是()A.该温度高于25℃B.由水电离出来的H+的浓度为1×10-10 mol·L-1C.加入NaHSO4晶体抑制水的电离D.取该溶液加水稀释100倍,溶液中的c(OH-)减小1.2.在某温度时,测得0.01mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数K w=______________。
(2)在此温度下,将pH=a的NaOH溶液V a L与pH=b的硫酸V b L混合。
①若所得混合液为中性,且a=12,b=2,则V a∶V b=___________。
②若所得混合液为中性,且a+b=12,则V a∶V b=______________。
例2.(影响弱酸弱碱电离平衡的因素,重点掌握溶液的稀释规律)2.1.H2S水溶液中存在电离平衡H2S H++HS-和HS-H++S2-。
下列说法正确的是()A.加水,平衡向右移动,溶液中H+浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略溶液体积变化),溶液中所有离子浓度都减小2.2.常温下,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。
下列说法正确的是()A.同浓度的NaA与NaB溶液中,c(A-)小于c(B-)B.a点溶液的导电性大于b点溶液C.a点的c(HA)大于b点的c(HB)D.HA的酸性强于HB2.3.A.B.①稀释到原来的100倍,pH与②相同C.①与③混合,若溶液pH=7,则溶液中c(NH+4)>c(Cl-)D.②与④等体积混合,混合溶液的pH>7变式训练:1.1909年,丹麦生理学家索仑生提出用pH表示水溶液的酸度:pH=-lg[H+],后来又定义pOH=-lg[OH-],pK W=-lgK W。
(名师整理)最新高考化学专题复习热点题型《水的电离及离子积》难点精练课件

第二节 水的电离和溶液的 pH
[课标要求] 1.认识水的电离,了解水的离子积常数。 2.认识溶液的酸碱性及 pH,掌握检测 pH 的方法。能进行溶液 pH 的简单
计算。 3.了解酸碱中和滴定实验原理及其应用。了解溶液 pH 的调控在工农业生产
和科学研究中的重要应用。
考点(一) 水的电离及离子积
1.水的电离 (1)水是极弱的电解质,水的电离方程式为 H2O+H2O
H3O++OH- 或简
写为 H2O H++OH-。 (2)25 ℃时,纯水中 c(H+)=c(OH-)= 1×10-7 mol·L-1;任何水溶液中,由
水电离出的 c(H+)与 c(OH-)都相等。
2.水的离子积常数
3.影响水的电离平衡的因素
平衡 溶液中 溶液中
溶液的 水的电
项目
pH
移动 c(H+) c(OH-)
酸碱性 离程度
升高温度 右移 增大 增大 减小 中性 增大
加入 加酸 左移 增大 减小 减小 酸性 减小
酸碱 加碱 左移 减小 增大 增大 碱性 减小
加入 Na2C 右移 减小 增大 增大 碱性 增大 O3
盐 NH4Cl 右移 增大 减小 减小 酸性 增大
加入金属 Na 右移 减小 增大 增大 碱性 增大
4.溶液中水电离出 c(H+)H2O 和 c(H-)H2O 的计算示例 (1)25 ℃、pH=3 的盐酸中 c(H+)H2O = 1×10-11 mol·L-1。 (2)25 ℃、pH=13 的 NaOH 溶液中 c(OH-)= 1×10-1 mol·L-1,c(H+)H2O = 1×10-13 mol·L-1。 (3)25 ℃、pH=3 的 NH4Cl 溶液中 c(H+)= 1×10-3 mol·L-1,c(H+)H2O = 1×10-3 mol·L-1。
水的电离与水的离子积常数

水的电离与水的离子积常数1.水的电离(1)水是极弱的电解质,其电离过程吸热(填“吸热”或“放热”)。
水的电离平衡常数的表达式为K=c(H+)·c(OH-)c(H2O)。
(2)影响水的电离平衡的因素①温度:温度升高,水的电离平衡向正方向移动,c(H+)和c(OH-)均增大(填“增大”“减小”或“不变”)。
②加酸或碱会抑制(填“促进”或“抑制”)水的电离。
③加能水解的盐,可与水电离出的H+或OH-结合,使水的电离平衡正向移动。
2.水的离子积(1)表达式:K w=c(H+)·c(OH-)。
(2)影响因素:一定温度时,K w是个常数,K w只与温度有关,温度越高,K w越大。
25 ℃时,K w=1×10-14,100 ℃时,K w=1×10-12。
(3)适用范围:K w不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
(1)在蒸馏水中滴加浓H2SO4,K w不变(×)错因:浓硫酸滴入水中放热,溶液温度升高,K w变大。
(2)温度一定时,在纯水中通入少量SO2,水的电离平衡不移动,K w不变(×)错因:二氧化硫与水反应生成的亚硫酸抑制水的电离。
(3)室温下,0.1 mol·L-1的HCl溶液与0.1 mol·L-1的NaOH溶液中水的电离程度相等(√)(4)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同(×)错因:CH3COONH4溶液中的醋酸根离子和铵根离子均能水解,促进水的电离。
1.填写外界条件对水的电离平衡的具体影响体系变化条件平衡移动方向K w水的电离程度c(OH-) c(H+)HCl 逆不变减小减小增大NaOH 逆不变减小增大减小可水解Na2CO3正不变增大增大减小的盐NH4Cl 正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小2.如何计算水电离的c(H+)或c(OH-)(1)任何情况下水电离产生的c(H+)和c(OH-)总是相等的。
江苏省启东市高考化学水溶液中的离子平衡水的电离和溶液的酸碱性水的电离(2)练习(new)

C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小
D.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同
9.在25℃时,纯水的电离度为a1,pH=11的氨水中水的电离度为a2,pH=3的盐酸中水的电离度为a3。若将上述氨水与盐酸等体积混合,所得溶液中水的电离度为a4,则下列关系式正确的是()
A.<1×10-14B.>1×10-14C.=1×10-14D.无法确定
7.纯水在10℃和50℃的H+浓度,前者与后者的关系是( )
A.前者大B.后者大C.相等D.不能确定
8.
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是( )
A.pH=1和pH=2的盐酸,c(H+)之比为1∶2
D.该溶液中水电离出的c(H+)是同温下pH为3的硫酸中水电离出的c(H+)的100倍
2.下列物质溶于水后,能使水的电离程度增大的是( )
A.NO2B.Ba(OH)2C.Cl2D.CH3COONa
3.水是最宝贵的资源之一.下列选项中表述正确的是( )
A.4℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
This article is collected and compiled by my colleagues and I in our busy schedule. We proofread the content carefully before the release of this article, but it is inevitable that there will be some unsatisfactory points. If there are omissions, please correct them. I hope this article can solve your doubts and arouse your thinking. Part of the text by the user's care and support, thank you here! I hope to make progress and grow with you in the future.
考点10 水的电离和溶液的pH-(原卷版)-2024-2025学年高二化学核心考点归纳与分层测试(

考点10 水的电离和溶液的pH【核心考点梳理】一、水的电离 1.水的电离水是一种极弱的电解质,电离方程式为H 2O +H 2O H 3O ++OH -,也可简写为H 2OH ++OH -。
2.水的离子积常数(1)水的电离常数:K 电离=c H +·c OH-c H 2O 。
(2)水的离子积常数K w =c (H +)·c (OH -)。
随着温度的升高,水的离子积增大。
在室温下,纯水中的c (H +)=c (OH -)=10-7 mol·L -1,K w =1.0×10-14。
(3)适用范围K w 不仅适用于纯水,也适用于稀的电解质溶液。
二、溶液的酸碱性与pH1.比较常温时下列情况中,c (H +)和c (OH -)的值或变化趋势(选填“增大”或“减小”“1×10-7 mol·L -1”“相等”)体系纯水 向纯水中加入少量盐酸向纯水中加入少量氢氧化钠溶液c (H +)1×10-7 mol·L-1增大减小c (OH -)1×10-7 mol·L-1减小 增大c (H +)和c (OH -)的大小比较相等c (H +)>c (OH -)c (H +)<c (OH -)+-c (H +)与c (OH -)的关系 c (H +)的范围(25 ℃)/(mol·L -1)中性溶液 c (OH -)=c (H +) c (H +)=1.0×10-7 酸性溶液 c (OH -)<c (H +) c (H +)>1.0×10-7 碱性溶液c (OH -)>c (H +)c (H +)<1.0×10-7pH =7的溶液不一定显中性,如100 ℃时pH =7的溶液呈碱性。
3.溶液的酸碱性与pH (1)pH(2)溶液的酸碱性与pH的关系(常温下)(3)溶液酸碱性的测定方法℃酸碱指示剂法该法只能测其酸碱性,即pH的大致范围,不能测出具体数值,常见的酸碱指示剂的变色范围(pH):℃利用pH试纸测定。
考点22 溶液中的四大常数-高考化学二轮复习专题练(通用版) (解析版)

考点22 溶液中的四大常数1.水的离子积常数(1)水的离子积常数的含义。
H 2OH ++OH -,表达式:25 ℃时,K W =c (H +)·c (OH -) = 1.0×10-14。
(2)对K W 的理解。
①K W 适用于纯水、稀的电解质(酸、碱、盐)水溶液。
②恒温时,K W 不变;升温时,电离程度增大(因为电离一般吸热),K W 增大。
2.电离平衡常数(K a 、K b )(1)电离平衡常数的含义。
如对于HAH ++A -,K a =c (H +)·c (A -)c (HA );BOHB ++OH -,K b =c (B +)·c (OH -)c (BOH )。
(2)K 值大小的意义。
相同温度下,K 值越小表明电离程度越小,对应酸的酸性或碱的碱性越弱 (3)影响K 值大小的外因。
同一电解质,K 值只与温度有关,一般情况下,温度越高,K 值越大;此外对于多元弱酸来说,其K a 1≫K a 2≫K a 3。
3.水解平衡常数(K h )(1)水解平衡常数的含义。
考点导航一轮回顾:强基固本专题08 水溶液中的离子平衡A -+H 2OHA +OH -,达到平衡时有K h =c (OH -)·c (HA )c (A -)=K WK a 。
同理,强酸弱碱盐水解平衡常数与弱碱电离平衡常数K b 的关系为K h =K WK b。
(2)影响K h 的因素。
K h 值的大小是由发生水解的离子的性质与温度共同决定的;温度一定时,离子水解能力越强,K h 值越大;温度升高时,K h 值增大;对于多元弱酸阴离子或多元弱碱阳离子来说,其K h1≫K h2≫K h3。
4.溶度积常数(K sp )(1)溶度积常数K sp 的表达式。
对于组成为A m B n 的电解质,饱和溶液中存在平衡A m B n (s)m A n +(aq)+n B m -(aq),K sp=c m (A n +)·c n (B m -)。
2024届高考化学一轮复习教案(人教版)第七单元 水溶液中的离子反应与平衡 第2讲

第2讲水的电离和溶液的pH复习目标1.了解水的电离特点和离子积常数(K w )的含义、影响因素。
2.了解溶液pH 的含义及其测定方法,能进行与pH 有关的简单计算。
3.了解酸碱中和滴定实验原理及其应用。
考点一水的电离与水的离子积常数1.水的电离水是极弱的电解质,其电离过程01吸热。
电离方程式为022H 2OH 3O++OH -,简写为03H 2O H ++OH -。
2.水的离子积常数(1)表达式:K w =01c (H +)·c (OH -)。
(2)影响因素:K w 只与02温度有关,03温度不变,K w 不变。
04温度越高,K w 越05大。
25℃时,K w 约为061×10-14。
(3)适用范围:在任何水溶液中均存在H +和OH -,K w 不仅适用于纯水,也适用于07稀的电解质溶液。
3.影响水的电离平衡的因素因素电离平衡溶液中c (H +)溶液中c (OH -)pH溶液的酸碱性K w加酸左移01增大02减小03减小04酸性05不变加碱左移06减07增大08增大09碱性10不变小升高温度右移11增大12增大13减小14中性15增大加醋酸钠右移16减小17增大18增大19碱性20不变加氯化铵右移21增大22减小23减小24酸性25不变加入金属Na右移26减小27增大28增大29碱性30不变请指出下列各说法的错因(1)向纯水中加入少量NaHSO4固体,c(H+)增大,K w增大。
错因:K w只与温度有关,温度不变,K w不变。
(2)在蒸馏水中滴加浓H2SO4,K w不变。
错因:水中加入浓H2SO4时放热,温度升高,K w增大。
(3)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同。
错因:NaCl对水的电离无影响,CH3COONH4是弱酸弱碱盐,促进水的电离。
(4)c(H+)c(OH-)=1012的溶液中:Na+、OH-、ClO-、NO-3可以大量共存。
错因:c(H+)>c(OH-)为酸性溶液,OH-、ClO-都不能大量存在。
高三总复习水的电离共29页文档

列各组离子肯定能共存的是(D)
A、Cu2+ NO3- SO42- Fe3+
B、Cl- S2-
Na+ K+
C、SO32- NH4+ K+ Mg2+
D、Cl-
Na+ NO3- SO42-
返回 分析
分析: (1)排除有颜色的离子( Cu2+ Fe3+ )组A (2)水电离的C(H+)=1×10-12 mol/l的溶液 可能是酸或碱,排除在酸性或碱性条件下不能 共存的离子组B、S2-和H+不能共存
=
1×10-14 1×10-5 mol/l
= 1×10-9 mol/l
思考
返回
例一
例二
例三
例四
思考题:在常温下,由水电 离产生的C(H+)=1×10-9 mol/l 的溶液,则该溶液的酸碱性如 何?
答:可能是酸性也可能是碱性
例一
例二
2、(1)常温下, 某溶液中由水电离产 生 的 C ( H+ ) =10-6 mol/l , 则 此 溶 液 有 可能是( D )
mol/l
返 回 分析
内容提要
例题
总结
习题
例一
例二
4、(1)加热稀 NaOH溶液(忽略溶 液的蒸发),则 NaOH 溶 液 的 PH 加 热前与加热后相比 ( A)
A、前者大
C、相等
例三
例四
(2)加热稀 H2SO4溶液(忽略溶 液的蒸发),则 H2SO4 溶 液 的 PH 加 热前与加热后相比 (C)
加入NaCl: NaCl = Na+ + Cl-
Na+和Cl-不与水电离生成的 H+ 和 OH-反应
2021年高考化学专题练习:水的电离和水的离子积常数(2)

2021年高考化学专题练习:水的电离和水的离子积常数(2)1、下列说法正确的是( )A.水的电离方程式为H2O H++OH-B.升高温度,水的电离程度增大C.NaOH溶液中不存在H+D.HCl溶液中不存在OH-2、常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.②③ B.①② C.①④ D.③④3、下列操作会使H2O的电离平衡向正方向移动,且溶液呈酸性的是( ) A.将纯水加热到95 ℃时, 7pH<B.向水中加少量NaHSO4C.向水中加少量Na2CO3D.向水中加少量FeCl34、常温下,在pH=9的NaOH溶液和CH3COONa溶液中,设由水电离出的OH-浓度分别为M mol·L-1和N mol·L-1,则M和N的关系为( )A.M>NB.M=10-4NC.N=10-4MD.M=N5、已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++24SO-。
某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2mol·L-1。
下列对该溶液的叙述不正确的是( )A.该温度高于25℃B.由水电离出来的H+的浓度为1×10-10mol·L-1C.加入NaHSO4晶体抑制了水的电离D.取该溶液加水稀释100倍,溶液中的c(OH-)减小6、已知常温下0.1mol/L的CH3COOH溶液中c(H+)=1.32×10-3mol/L,则常温下该CH3COOH溶液中的水的离子积常数KW的数值为( )A.1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-157、25℃时,水的电离可达到平衡:H2O H++OH-ΔH>0。
2019年高考化学考点一遍过考点44 水的电离 含解析

一、水的电离1.水的电离平衡水是一种极弱的电解质,能发生微弱的电离:H 2O+H2O H3O+ + OH−,可简写为H 2O H++OH−。
2.水的离子积常数(1)概念:在一定温度下,c(H+)与c(OH−)的乘积是一个常数,称为水的离子积常数,简称水的离子积。
(2)表达式:水的离子积用K w表示。
实验测得,25 ℃时,1 L水中只有 1.0×10−7 mol H2O电离。
所以该温度时的纯水中c(H+)=c(OH−)=1.0×10−7 mol·L−1,K w=c(H+)·c(OH−)=1.0×10−14,室温下K w一般也取这个值。
(3)影响因素:K w只与温度有关。
温度升高,K w增大。
注意事项(1)水的离子积不仅适用于纯水,也适用于稀的电解质水溶液。
(2)在室温时,任何物质的水溶液,K w=10−14。
K w与溶液的酸碱性无关,只与温度有关。
(3)K w的重要应用在于溶液中c(H+)和c(OH−)的换算。
(4)外界条件改变,水的电离平衡发生移动,但任何时候水电离出的c(H+)和c(OH−)总是相等的。
二、水的电离平衡的影响因素和有关计算1.外界因素对水电离的影响加入碱,如2.水电离出的c(H+)或c(OH−)的计算(25 ℃时)(1)中性溶液c(OH−)=c(H+)=10−7 mol·L−1(2)酸溶液酸溶液中,H+来源于酸的电离和水的电离,而OH−只来源于水的电离。
(3)碱溶液碱溶液中,OH−来源于碱的电离和水的电离,而H+只来源于水的电离。
(4)盐溶液水解呈酸性或碱性的盐溶液中,H+和OH−均来源于水的电离。
考向一水电离平衡的影响因素典例125 ℃时,水的电离达到平衡:H2O H++OH−ΔH>0,下列叙述正确的是A.向水中加入稀氨水,平衡逆向移动,c(OH−)降低B.向水中加入少量固体硫酸氢钠,c(H+)增大,K W不变C.向水中加入少量盐酸,平衡逆向移动,c(OH−)增大D.将水加热,K W增大,pH不变,呈中性【答案】B1.25 ℃时,相同物质的量浓度的下列溶液:①Na2SO4②HCl③Ba(OH)2④AlCl3,其中水的电离程度按由大到小顺序排列的一组是A.④>③>②>①B.②>③>①>④C.④>①>②>③D.③>②>①>④水电离平衡移动的判断(1)促进水的电离(2)抑制水的电离考向二水电离出的c(H+)或c(OH−)的计算典例1某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。
高考化学总复习 智能考点 归类总结(教材精讲+典型例题+跟踪训练):水的电离和溶液的pH(含方法提示和解析

智能考点 水的电离和溶液的 pHⅠ.课标要求1.知道水的离子积常数,能进行溶液pH 的简单计算。
2.初步掌握测定溶液pH 的方法,知道溶液pH 的调控在工农业生产和科学研究中的重要应用。
Ⅱ.考纲要求1.了解水的电离及离子积常数;2.了解溶液pH 的定义。
了解测定溶液pH 的方法,能进行pH 的简单计算。
Ⅲ.教材精讲1. 水的电离及离子积常数⑴水的电离平衡:水是极弱的电解质,能发生自电离: H 2O 2+H 2O 2H 3O ++HO 2-简写为 H 2OH ++OH -(正反应为吸热反应)其电离平衡常数:Ka = O][H ]][OH [H 2-⑵水的离子积常数:Kw=[H +][OH -]250C 时Kw =1.0×10-14mol 2·L -2,水的离子积与温度有关,温度升高Kw 增大。
如1000C 时Kw =1.0×10-12mol 2·L -2.⑶无论是纯水还是酸、碱,盐等电解质的稀溶液,水的离子积为该温度下的Kw 。
2. 影响水的电离平衡的因素⑴酸和碱:酸或碱的加入都会电离出 H +或OH -,均使水的电离逆向移动,从而抑制水的电离。
⑵温度:由于水的电离吸热,若升高温度,将促进水的电离, [H +]与[OH -]同时同等程度的增加,pH 变小,但[ H +]与[OH -]始终相等,故仍呈中性。
⑶能水解的盐:不管水解后溶液呈什么性,均促进水的电离,使水的电离程度增大。
⑷其它因素:如向水中加入活泼金属,由于活泼金属与水电离出来的 H +直接作用,使[ H +]减少,因而促进了水的电离平衡正向移动。
3.溶液的酸碱性和pH 的关系 ⑴ pH 的计算: pH=-lg[H +] ⑵酸碱性和pH 的关系:在室温下,中性溶液:[H +]=[OH -]=1.0×10-7mol · L -1, pH =7 酸性溶液: [H +]>[OH -] , [H +]>1.0×10-7mol ·L -1, pH <7 碱性溶液: [H +]<[OH -] , [H +]<1.0×10-7mol ·L -1, pH >7 ⑶pH 的测定方法:①酸碱指示剂:粗略地测溶液pH 范围 ②pH 试纸:精略地测定溶液酸碱性强弱 ③pH 计: 精确地测定溶液酸碱性强弱4.酸混合、碱混合、酸碱混合的溶液pH 计算: ①酸混合:直接算 [ H +],再求pH 。
2023年高考化学总复习:水的电离平衡(附答案解析)

2023年高考化学总复习:水的电离平衡
基础过关练
题组一水的电离和水的离子积常数
1.关于水的离子积常数,下列说法不正确的是()
A.100℃水中,c(H+)·c(OH-)=1×10-14
B.纯水中,25℃时,c(H+)·c(OH-)=1×10-14
C.25℃时,任何以水为溶剂的稀溶液中c(H+)·c(OH-)=1×10-14
D.K
W
值随温度升高而增大
2.纯水在25℃和80℃时的H+浓度,前后两个量的大小关系为
()
A.大于
B.等于
C.小于
D.不能确定
3.下列说法正确的是()
A.水是极弱的电解质,它能微弱电离出H+,所以严格地说纯水呈微酸性
B.向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低
C.25℃纯水中c
平(
OH-)×c平(H+)=K W,稀酸、稀碱溶液中K W=c平(OH-)×c平(H+)≠10-14
D.H
2
O H++OH-是吸热过程,所以温度升高,平衡向电离方向移动,K
W
随之增大
题组二外界条件对水的电离平衡的影响
4.向纯水中加入少量NaHSO
4
固体,在温度不变时,溶液中() A. (H+) (OH-)增大
第1页共13页。
2020届高考化学二轮复习专项测试:专题十考点一水的电离和水的离子积常数(1)Word版含答案

2020届高考化学二轮复习专项测试专题十 考点一 水的电离和水的离子积常数(1)1、下列操作中,能使电离平衡H 2O H ++OH -正向移动且溶液呈酸性的是( )A.向水中加入NaHSO 4溶液B.向水中加入Al 2(SO 4)3溶液C.向水中加入Na 2CO 3溶液D.将水加热到100℃,使水的pH=62、向水中分别加入下列溶液,对水的电离平衡不产生影响的是( ) A. 4KHSO 溶液 B. 3KHCO 溶液 C. KHS 溶液 D. KI 溶液3、将① +H 、② Cl -、③ 3Al +、④ K +、⑤ 2S -、⑥ OH -、⑦ 3NO -、⑧ 4NH +分别加入2H O 中,基本上不影响水的电离平衡的是( ) A.① ③ ⑤ ⑦ ⑧B.② ④ ⑦C.① ⑥D.② ④ ⑥ ⑧4、水的电离过程为H 2O H ++OH -,在不同温度下其离子积常数为1414W W (25) 1.010,(35) 2.110o o K C K C --=⨯=⨯。
则下列关于纯水的叙述正确的是( )A. ()c H +随着温度升高而降低 B.在35℃时, ()()c H c OH +->C.25℃时水的电离程度大于35℃时水的电离程度D.水的电离是吸热的5、25C ︒时,水的电离达到平衡:2H OH OH +-+;ΔH>0,下列叙述正确的是( )A .向水中加入稀氨水,平衡逆向移动,c(OH )-降低B .向水中加入少量固体硫酸氢钠,c(H )+增大,W K 不变C .向水中通入HCl 气体,平衡逆向移动,溶液导电能力减弱D .将水加热,pH 不变,W K 增大6、水的电离平衡曲线如下图所示。
下列说法正确的是( )A .图中对应点的温度关系为:a >bB .水的电离常数K W 大小关系为:b >dC .温度不变,加入少量NaOH 可使溶液从c 点变到a 点D .b 点对应温度下,将pH=2的H 2SO 4与pH=10的NaOH 溶液等体积混合后,溶液显酸性 7、如图表示水中+(H )c 和-(OH )c 的关系。
水的电离和溶液的酸碱性

水的电离和溶液的酸碱性一.水的电离及离子积常数1.水的电离平衡:水是极弱的电解质,能发生自电离:H2O H++OH-〔正反响为吸热反响〕2.水的离子积常数:Kw= c(H+)c(OH-)250C 时Kw =1.0×10-14 mol2·L-2,水的离子积与温度有关,温度升高Kw增大。
如1000C 时Kw =1.0×10-12 mol2·L-2 .3.无论是纯水还是酸、碱,盐等电解质的稀溶液,水的离子积为该温度下的Kw。
1、25 ℃时,水中存在电离平衡:H2O H++OH-ΔH>0。
以下表达正确的选项是〔 B 〕A.将水加热,K w增大,pH不变B.向水中参加少量NaHSO4固体,c(H+)增大,K w不变C.向水中参加少量NaOH固体,平衡逆向移动,c(OH-)降低D.向水中参加少量NH4Cl固体,平衡正向移动,c(OH-)增大2、25 ℃时,一样物质的量浓度的以下溶液:①NaCl②NaOH ③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是〔 C 〕A.④>③>②>① B.②>③>①>④C.④>①>②>③ D.③>②>①>④3、由水电离出的c(OH-)=1×10-13mol/L的无色溶液中,一定能大量共存的离子组是〔 C 〕A.Cl-、AlO-2、Na+、K+B.Fe3+、NO-3、K+、H+C.NO-3、Ba2+、K+、Cl-D.Al3+、SO2-4、NH+4、Cl-4、95 ℃时水的离子积K W=1×10-12,25 ℃时K W=1×10-14,答复以下问题:〔1〕95 ℃时水的电离常数K(95 ℃)________25 ℃时水的电离常数(填“>〞、“=〞或“<〞)。
〔2〕95 ℃纯水中c(H+)________c(OH-)(填“>〞、“=〞或“<〞)。
2021年高考化学专题练习:水的电离和水的离子积常数(2)

2021年高考化学专题练习:水的电离和水的离子积常数(2)1、下列说法正确的是( )A.水的电离方程式为H2O H++OH-B.升高温度,水的电离程度增大C.NaOH溶液中不存在H+D.HCl溶液中不存在OH-2、常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.②③ B.①② C.①④ D.③④3、下列操作会使H2O的电离平衡向正方向移动,且溶液呈酸性的是( ) A.将纯水加热到95 ℃时, 7pH<B.向水中加少量NaHSO4C.向水中加少量Na2CO3D.向水中加少量FeCl34、常温下,在pH=9的NaOH溶液和CH3COONa溶液中,设由水电离出的OH-浓度分别为M mol·L-1和N mol·L-1,则M和N的关系为( )A.M>NB.M=10-4NC.N=10-4MD.M=N5、已知NaHSO4在水中的电离方程式为NaHSO4=Na++H++24SO-。
某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2mol·L-1。
下列对该溶液的叙述不正确的是( )A.该温度高于25℃B.由水电离出来的H+的浓度为1×10-10mol·L-1C.加入NaHSO4晶体抑制了水的电离D.取该溶液加水稀释100倍,溶液中的c(OH-)减小6、已知常温下0.1mol/L的CH3COOH溶液中c(H+)=1.32×10-3mol/L,则常温下该CH3COOH溶液中的水的离子积常数KW的数值为( )A.1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-157、25℃时,水的电离可达到平衡:H2O H++OH-ΔH>0。
高中化学(4)最易错考点系列考点9 水的电离与离子积常数 含解析

考点九水的电离与离子积常数【考点定位】本考点考查水的电离与离子积常数,理解水的电离平衡及影响因素,明确温度对离子积常数的影响,并能准确判断水的电离平衡移动方向.【精确解读】1.电离平衡和电离程度水是极弱的电解质,能微弱电离H2O+H2O H3O++OH—,通常简写为H2O H++OH-;△H>0 25℃时,纯水中c(H+)=c(OH—)=1×10-7mol/L2.影响水的电离平衡的因素(1)温度:温度越高,电离程度越大c(H+)和c(OH—)同时增大,K w增大,但c(H+)和c(OH—)始终保持相等,仍显中性.纯水由25℃升到100℃,c(H+)和c(OH-)从1×10-7mol/L增大到1×10-6mol/L(pH变为6).(2)同离子效应:加入与弱电解质具有相同离子的电解质时,使电离平衡向逆反应方向移动.(3)化学反应:①酸、碱向纯水中加酸、碱平衡向左移动,水的电离程度变小,但K w不变;②加入易水解的盐由于盐的离子结合H+或OH—而促进水的电离,使水的电离程度增大.温度不变时,K w不变.3.水的离子积常数(1)定义:在一定温度时,c(H+)与c(OH—)的乘积是一个常数,称为水的离子积常数,简称水的离子积.K w=c(H+)•c(OH-),25℃时,K w=1×10-14(2)离子积常数的影响因素①K w只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,K w增大.25℃时K w=1×10-14,100℃时K w约为1×10-12.②水的离子积不仅适用于纯水,也适用于其他稀溶液.不论是纯水还是稀酸、碱、盐溶液,只要温度不变,K w就不变.【特别提醒】:水的离子积不仅适用于纯水,还适用于稀的电解质溶液。
【精细剖析】1.影响水的电离平衡的因素可归纳如下:(1)水溶液呈酸性的酸式盐(如NaHSO4,NaH2PO4,NaHSO3,NH4HSO4等),会抑制水的电离;①强碱强酸的酸式盐:如NaHSO4,在其水溶液中发生完全电离,因此溶液呈酸性,会抑制水的电离;②强酸弱碱的酸式盐:强酸和弱碱生成的盐:如NH4HSO4,溶液呈酸性.(溶液显酸性是由于HSO4-的电离,HSO4—电离程度远远大于NH4+水解,并一定程度上抑制NH4+水解;(2)水溶液呈碱性的酸式盐(如NaHCO3,NaHPO4,NaHS等),因电离趋势小于水解趋势,溶液呈碱性,会促进水的电离。
水的电离与水的离子积常数.docx
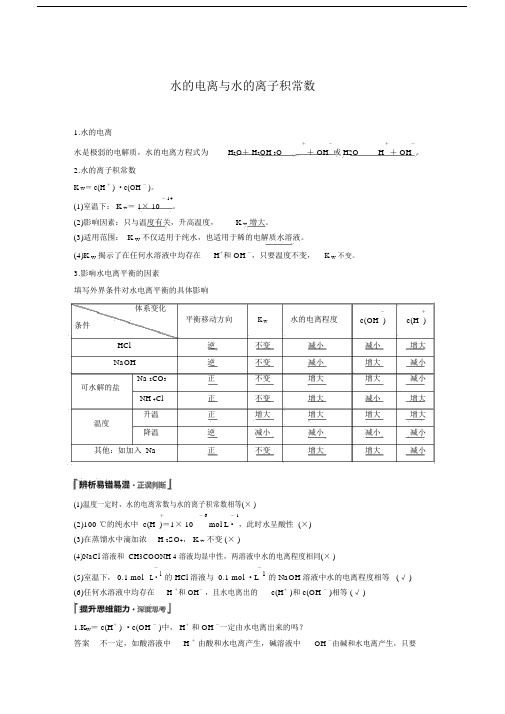
水的电离与水的离子积常数1.水的电离水是极弱的电解质,水的电离方程式为+-或 H2O+-。
H2O+ H2OH 3O+ OH H+ OH2.水的离子积常数K w= c(H + ) ·c(OH - )。
(1)室温下: K w= 1× 10- 14。
(2)影响因素:只与温度有关,升高温度,K w增大。
(3)适用范围: K w不仅适用于纯水,也适用于稀的电解质水溶液。
(4)K w揭示了在任何水溶液中均存在H+和 OH -,只要温度不变,K w不变。
3.影响水电离平衡的因素填写外界条件对水电离平衡的具体影响体系变化平衡移动方向K w-+水的电离程度条件c(OH )c(H ) HCl逆不变减小减小增大NaOH逆不变减小增大减小Na 2CO3正不变增大增大减小可水解的盐NH 4Cl正不变增大减小增大升温正增大增大增大增大温度降温逆减小减小减小减小其他:如加入 Na正不变增大增大减小(1)温度一定时,水的电离常数与水的离子积常数相等(× )+- 6- 1(2)100 ℃的纯水中 c(H )=1× 10mol L·,此时水呈酸性 (×)(3)在蒸馏水中滴加浓H 2SO4, K w不变 (× )(4)NaCl 溶液和 CH3COONH 4溶液均显中性,两溶液中水的电离程度相同(× )(5)室温下, 0.1 mol--1的 NaOH 溶液中水的电离程度相等 (√ ) L·1的 HCl 溶液与 0.1 mol ·L(6)任何水溶液中均存在H +和 OH-,且水电离出的c(H+ )和 c(OH - )相等 (√ )1.K w= c(H+ ) ·c(OH - )中, H+和 OH -一定由水电离出来的吗?答案不一定,如酸溶液中H +由酸和水电离产生,碱溶液中OH -由碱和水电离产生,只要是水溶液必定有H + 和 OH -,当溶液浓度不大时,总有K w = c(H +) ·c(OH -)2.25 ℃, pH = 3 的某溶液中, H 2O 电离出的 +浓度为多少?H答案 (1) 若为水解呈酸性的盐溶液,促进水的电离,由水电离出的c +- 3- 1水 (H)= 1× 10 mol L ·。
XX届高考化学总复习第八章水

3.下列说法正确的是
( )。
A.在蒸馏水中滴加浓H2SO4,KW不变 B.25 ℃与60 ℃时,水的pH相等
(2013·天津,5A) (2012·福建,10B)
C.25 ℃时NH4Cl溶液的KW小于100 ℃NaCl溶液的KW (2011·天津,5A)
D.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、
0的H2SO4溶液、②0.05 mol·L-1的Ba(OH)2溶液、③pH
=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离
的水的物质的量之比是
( )。
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
D.1∶10∶104∶109
XX届高考化学总复习第八章水
( )。
(2)相同浓度的CH3COOH和NaOH溶液等体积混合( )。
(3)相同浓度NH3·H2O和HCl溶液等体积混合
( )。
XX届高考化学总复习第八章水
(4)pH=2的HCl和pH=12的NaOH溶液等体积混合( )。 (5)pH=3的HCl和pH=10的NaOH溶液等体积混合( )。 (6)pH=3的HCl和pH=12的NaOH溶液等体积混合( )。 (7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合
XX届高考化学总复习第八章水
探究思考
1.pH=7的溶液一定是中性溶液吗?
提示 pH=7的溶液,不一定是中性溶液,因为温度不同
,水的离子积不同,如100 ℃时,pH=6的溶液为中性溶液
,pH=7时为碱性溶液。
2.判断下列溶液在常温下的酸、碱性(在括号中填“酸性”、“
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020届高考化学二轮复习专项测试专题十 考点一 水的电离和水的离子积常数(2)1、纯净的水呈中性,这是因为( ) A .纯水中c(H +)= c(OH -) B .纯水pH=7C .纯水的离子积K W =1.0×10-14D .纯水中无H +也无OH -2、如果25℃时K w =1×10-14,100℃时K w =1×10-12,这说明( )A. 100℃时水的电离常数较大B. 前者c (H +)较后者大 C. 水的电离过程是一个放热过程D. Kw 和温度无直接关系3、能促进水的电离,并使溶液中c(H +)>c(OH -)的操作是( )(1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl(4) 向水中加入明矾晶体 (5)向水中加入NaHCO 3固体 (6)向水中加KHSO 4固体 A. (4)B. (1)(4)(6)C. (1)(3)(6)D. (4)(6) 4、下列有关水的电离的叙述中正确的是( ) A. ()2H Ol ()()H aq OH aq +-+ 0H ∆<B.纯液态水中,一定存在 W K H OH +-⎡⎤⎡⎤=⎣⎦⎣⎦C.纯液态水中,一定存在 1422110H OH mol L +---⎡⎤⎡⎤=⨯⋅⎣⎦⎣⎦ D.25℃, 711?10H mol L +--⎡⎤=⨯⋅⎣⎦的液体一定是纯水 5、已知水的电离方程式:H 2O H ++OH -,下列叙述中正确的是( )A.升高温度,K W 增大,pH 不变B.向水中加入少量硫酸,c (H +)增大,K W 不变C.向水中加入氨水,平衡向逆反应方向移动,c (OH -)降低D.向水中加入少量固体CH 3COONa,平衡向逆反应方向移动,c (H +)降低 6、将纯水加热至较高温度,下列叙述正确的是( )A.水的离子积变大、pH 变小、呈酸性B.水的离子积不变、pH 不变、呈中性C.水的离子积变小、pH 变大、呈碱性D.水的离子积变大、pH 变小、呈中性7、某温度下,有pH 相同的H 2SO 4溶液和Al 2(SO 4)3溶液,在H 2SO 4溶液中由水电离出的H +浓度为10-amol ·L -1,在Al 2(SO 4)3溶液中由水电离的H +浓度为10-bmol ·L -1,则此温度下的K w 为( ) A.1×10-14B.1×10-2aC.1×10-(7+a)D.1×10-(a+b)8、某温度下,重水(2D O )的离子积常数为151.610-⨯,用定义pH —样来规定pD,则+pD lg[(D )]c =-。
该温度下,下列叙述正确的是( )A.纯净的重水(2D O )中,pD=7B.1L 溶解有0.01mol DCl 的重水溶液,其pD=12C.纯净的重水中,+-(D )(OD )c c =D.1L 溶解有0.01mol NaOD 的重水溶液,其pD=129、水的电离平衡曲线如图所示,若以A 点表示25℃时水的电离达平衡时的离子浓度,B 点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )A .纯水中25℃时的c (H +)比100℃时的c (H +)大B .100℃时溶液中由水电离产生的c (H +)=1×10-11mol/L ,则该溶液的pH 可能是11或3C .将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1D .25℃时,某Na 2SO 4 溶液中c (24SO -)=5×10-4mol/L ,则溶液中c (Na +):c (OH -)为104:110、下列关于水的离子积常数的叙述中,正确的是( )A.因为水的离子积常数的表达式是K W =[H +][OH -],所以K W 随着溶液中H +浓度或OH -浓度的变化而变化B.水的离子积常数K W 与水的电离常数K 是同一个物理量C.水的离子积常数仅仅是温度的函数,随着温度的变化而变化D.水的离子积常数K W 与水的电离常数K 是两个没有任何关系的物理量11、99℃时,向pH=6的蒸馏水中加入NaHSO 4晶体,保持温度不变,测得溶液的pH=2,下列叙述中不正确的是( )A.此时水的离子积K W =1×10-14B.水电离出的c(H +)=1×10-10mol ·L-1C.水的电离程度随温度升高而增大D.c(Na +)=c(24SO -)12、用AG 表示溶液的酸度,其表达式为+-lg[(H )/(OH )]AG c c =。
室温下,用0.1-1mol L ⋅的盐酸滴定10mL0.1-1mol L MOH ⋅溶液,滴定曲线如图所示。
下列说法正确的是( )A.25℃时,溶液的pH 与AG 的换算公式为AG=2(7+pH)B.C 点溶液的溶质是MCl,MCl 是强酸弱碱盐,溶液显酸性C.溶液中由水电离的+(H )c :C 点>D 点D.B 点时,溶液中:-+-+(MOH)(Cl )(M )(OH )(H )c c c c c >>>> 13、在水的电离平衡中,c(H +)和c(OH -)的关系如图所示:1.A 点水的离子积常数为1×10-14,B 点水的离子积常数为__________,造成水的离子积常数变化的原因__________2.100℃时,若向水中滴加盐酸,__________(填“能”或“不能”)使体系处于点状态,原因是__________3.100℃时,若盐酸中c(H +)=5×10-4mol ·L -1,则由水电离产生的c(H +)__________14、常温时向浓度为0.1mol/L 体积为V L 的氨水中逐滴加入一定浓度的盐酸,用pH 计测得溶液的pH 随盐酸的加入量而降低的滴定曲线,d 点两种溶液恰好完全反应.根据图象回答下列问题:(1)比较b、c、d三点时的溶液中,水电离的c(OH﹣)由大到小的顺序为_________________.(2)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有________.a.+432(NH)(NH H O)cc⋅b.(H)(OH)cc+-c.+432(NH)(OH)(NH H O)c cc-⋅⋅d.32+4(NH H O)(H)(NH)c cc+⋅⋅(3)该温度时氨水的电离平衡常数K=______________.15、下表是不同温度下水的离子积数据:温度 / ℃25 t1t2水的离子积常数1×10-14α1×10-12试回答下列问题:1.若 25<t1<t2,则α__________1×10-14( 填“>”“<”或“=”)2.25℃下,某 HCl溶液中c(HCl)=1×10-4mol·L-1,则该溶液的pH=__________, 此时由水电离出的c(H+)=__________3.t2℃下,将 pH=11的氢氧化钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则 V1:V2=__________。
4.常温下,pH=2的盐酸和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1__________α2(填“大于”“小于”“等于”或“无法确定”)。
答案以及解析1答案及解析: 答案:A 解析:2答案及解析: 答案:A 解析:3答案及解析: 答案:A 解析:4答案及解析: 答案:B解析:A. 2H O 在电离时吸收能量,则()2H O l ()()H aq OH aq +-+ 0H ∆>。
C.25℃的纯液态水中,一定存在 1422110H OH mol L +---⎡⎤⎡⎤=⨯⋅⎣⎦⎣⎦。
D.如NaCl 在水中电离为Na +和Cl -,它们不影响水的电离,则25℃时 711?10H mol L +--⎡⎤=⨯⋅⎣⎦的液体不一定是纯水。
5答案及解析: 答案:B解析:A.不正确,升高温度,K W 增大,pH 变小 B.正确,K W 受温度影响。
C.不正确,向水中加入氨水,平衡逆向移动,但氨水电离出OH -,c(OH -)增加。
D.不正确,向水中加入少量固体CH 3COONa,CH 3COO -与H +结合,水电离平衡正向移动,c(H +)降低。
6答案及解析: 答案:D解析:水的电离是吸热过程,将纯水加热至较高温度,促进了水的电离,生成的氢离子和氢氧根离子浓度增大,pH 减小,水的离子积增大,水的离子积只随温度的改变而改变;电离出的氢离子和氢氧根离子相等,所以水仍是中性,综上所述,选D 。
7答案及解析: 答案:D 解析:8答案及解析: 答案:C解析:+-18-1(D )L 410mol L c -=⋅=⨯⋅,所以pD>7,A 项错误;-10.01mol(DCl)0.01mol L 1Lc ==⋅,则+-1(D )0.01mol L c =⋅,所以pD=2,B 项错误;纯净的重水显中性,故+-(D )(OD )c c =,C 项正确;--10.01mol(OD )(NaOD)0.01mol L 1Lc c ===⋅,则15+-113-11.610(D )mol L 1.610mol L 0.01c --⨯=⋅=⨯⋅,则pD>12,D 项错误。
9答案及解析: 答案:D 解析:10答案及解析: 答案:C解析:水的离子积常数K W =K ·[H 2O],一定温度下K 和[H 2O]都是定值,所以仅仅是温度的函数,B 、D 项错误,C 项正确。
水的离子积常数的表达式是K W =[H +][OH -],只要温度一定,K W 就不变,溶液中H +浓度变大,OH -浓度就变小,反之亦然,A 项错误。
11答案及解析: 答案:A解析:99℃时,蒸馏水的pH=6,说明K w =1×10-12,因此温度升高水的电离程度增大。
NaHSO 4=Na ++H ++24SO -,pH=2,说明c(H +)=0.01mol/L,且都是NaHSO 4电离的,所以水电离出的c (H +)=1×10-10mol ·L -1。
所以不正确的是A 。
12答案及解析: 答案:C解析:-w +(OH )(H )K c c =,所以2++W W(H )AG lg 2lg (H )lg 214c c K pH K ==-=-+,A 错误;用0.1-1mol L ⋅的盐酸滴定10mL0.1-1mol L ⋅MOH 溶液,由题图可知,滴定开始前+-+-8AG 8,AG lg[(H )/(OH )],(H )/(OH )10c c c c -=-==,由于+-14(H )(OH )10c c -⨯=,则-3-1(OH )10mol L c =⋅,说明MOH 为弱碱。
