5.临床评价资料(第一类医疗器械备案-防护眼罩、医用隔离眼罩)
第一类医疗器械备案清单

第一类医疗器械备案清单第一类医疗器械是指用于人体预防、诊断、治疗或者对疾病起作用,但不对人体构成器质性结构性改变的器械。
这类器械的备案管理是指在相关主管部门的监管下,对其进行备案登记,以确保其安全有效地使用。
下面是一些常见的第一类医疗器械备案清单:1.血压计:血压计是一种测量人体血压值的器械,常见的有听诊型血压计、半自动血压计和全自动血压计等。
2.心电图机:心电图机是一种用于检测人体心电活动的器械,通过记录心脏电位变化来评估心脏健康状况。
3.眼底相机:眼底相机是一种用于拍摄人眼底图像的器械,可以帮助医生检测眼部疾病,如青光眼、视网膜病变等。
4.糖尿病血糖仪:糖尿病血糖仪是一种用于测量血糖水平的器械,患者可以通过采集血液样本,用血糖仪进行测量并得到结果。
5.荧光显微镜:荧光显微镜是一种用于观察细胞和组织结构的器械,通过荧光染料或荧光标记物来增强显微镜图像。
6.输液泵:输液泵是一种用于精确输液的器械,通过控制液体流速和输液量,以确保药物或液体的准确输送。
7.器官透视机:器官透视机是一种用于放射性医学诊断的器械,通过透视的方式观察人体内部器官的形态和功能。
8.细菌培养箱:细菌培养箱是一种用于培养和繁殖细菌的器械,常用于微生物学实验室和临床实验。
9.电子胃镜:电子胃镜是一种用于内窥镜下检查胃部疾病的器械,通过引入光源和摄像机,医生可以观察到胃内的病变。
10.高频电刀:高频电刀是一种用于手术切割和止血的器械,通过高频电流产生高温切割组织并同时止血。
以上是一些常见的第一类医疗器械备案清单,备案登记可以确保医疗器械的安全使用和市场监管。
但需要注意的是,具体的备案要求和程序可能因不同地区、不同国家法规而有所不同,相关生产企业和经销商应根据实际情况进行备案登记。
第一类医疗器械备案常识

第一类医疗器械备案常识一、问:什么是医疗器械?答:医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:(一)疾病的诊断、预防、监护、治疗或者缓解;(二)损伤的诊断、监护、治疗、缓解或者功能补偿;(三)生理结构或者生理过程的检验、替代、调节或者支持;(四)生命的支持或者维持;(五)妊娠控制;(六)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
二、问:医疗器械产品如何区分一类、二类、三类?答:国家对医疗器械按照风险程度实行分类管理。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。
比如手术刀、棉签、医用X射线胶片等。
第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。
比如超声洁牙机、一次性使用医用口罩、红外额温计等。
第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
比如X射线计算机断层成像系统(CT)、医用磁共振成像系统(MRI)、血管支架等。
三、问:什么是第一类医疗器械备案?答:第一类医疗器械备案是指药品监督管理部门对医疗器械备案人(以下简称备案人)提交的第一类医疗器械备案资料存档备查。
四、问:第一类医疗器械备案的范围包括哪些?答:实行备案的包括第一类医疗器械产品目录和相应体外诊断试剂分类子目录中的第一类医疗器械。
五、问:第一类医疗器械备案资料向哪些部门提交?答:境内第一类医疗器械备案,备案人向设区的市级药品监督管理部门提交备案资料。
进口第一类医疗器械备案,备案人向国家药监局提交备案资料。
香港、澳门、台湾地区医疗器械的备案,参照进口医疗器械办理。
六、问:第一类医疗器械需要编制产品技术要求吗?答:备案人应当编制拟备案医疗器械的产品技术要求。
一类医疗器械资源汇总(汇总)

一类医疗器械资源汇总(汇总)一、概述一类医疗器械是指在正常使用情况下,对人体体表或者局部组织仅有轻微风险的医疗器械。
在我国,一类医疗器械的注册、生产、经营、使用等活动受到国家药品监督管理局的严格监管。
为了更好地了解一类医疗器械的资源情况,我们对我国一类医疗器械的资源进行了全面汇总,以期为相关行业和从业人员提供参考。
二、一类医疗器械分类根据《医疗器械监督管理条例》及其实施细则,一类医疗器械分为以下几类:1. 无菌医疗器械:如一次性注射器、输液器、手术器械等。
2. 非无菌医疗器械:如血压计、体温计、医用脱脂棉等。
3. 眼科光学器具:如隐形眼镜、角膜接触镜等。
4. 医用高分子材料及制品:如输液袋、引流管、医用敷料等。
5. 牙科材料:如义齿、正畸器材等。
6. 临床检验分析仪器:如尿液分析仪、血糖仪等。
7. 其他:如助听器、按摩器材等。
三、一类医疗器械资源分布1. 注册资源:截至2023年底,我国一类医疗器械注册证数量达到数万个,涵盖了各种类型的一类医疗器械。
2. 生产企业:我国一类医疗器械生产企业分布在全国各地,其中广东、江苏、浙江、山东等省份的企业数量较多。
这些企业涵盖了各类一类医疗器械的生产,能够满足市场需求。
3. 经营企业:一类医疗器械的经营企业包括批发和零售企业。
批发企业主要分布在北京、上海、广东等地区,零售企业则遍布全国各地。
4. 使用单位:一类医疗器械的使用单位包括各级医疗机构、家庭和个人。
医疗机构中,一类医疗器械的使用主要集中在基层医疗卫生机构和民营医院。
5. 科研资源:我国一类医疗器械的科研资源主要集中在高等院校、科研院所和部分企业。
这些单位在医疗器械的研发、技术创新和人才培养方面具有较强实力。
四、一类医疗器械产业发展趋势1. 政策支持:近年来,国家加大对医疗器械产业的支持力度,出台了一系列政策措施,为一类医疗器械产业的发展创造了良好环境。
2. 创新能力提升:随着科研投入的加大,我国一类医疗器械的创新能力逐步提升,新产品、新技术不断涌现。
护目镜(防护眼罩)产品风险分析报告

第1 页共7 页产品风险分析报告产品名称:医用隔离眼罩********有限公司2020年2月一、产品预期用途/预期目的和与安全性有关的特征的判定按照《YY/T0316-2003 医疗器械风险管理对医疗器械的应用》第4.2条的要求及附录A中有关医疗器械定性和定量特征的判定的提示清单,列出“医用隔离眼罩”产品的所有可能影响其安全性的定性和定量特征的问题,并判定如下:A.2.1 什么是预期用途/预期目的和怎样使用医疗器械?——预期用途:该产品适用于医疗单位医务人员、临床病人或易感染人群对眼部防唾沫飞溅防血液、体液、分泌物喷溅等防感染保护性用途。
——怎样使用:由使用者按照产品使用说明书在正常室内外环境下佩戴使用。
A.2.2 医疗器械是否预期和患者或其他人员接触?——是。
A.2.3 在医疗器械中包含有何种材料和/或组分或与其共同使用、或与医疗器械接触?——包含有下列材料:聚碳酸脂镜片、乙烯镜框、条纶A.2.4 是否有能量给予患者或从患者身上获取?——无。
A.2.5 是否有物质提供给患者或从患者身上提取?——无。
A.2.6 是否由医疗器械处理生物材料然后再次使用?——否。
A.2.7 医疗器械是否以无菌形式提供或准备由使用者灭菌,或用其他微生物控制方法灭菌?—是。
A.2.8 医疗器械是否预期由用户进行常规清洁和消毒?——是。
由用户按使用说明书的规定方法定期对产品进行清洁、清洗和消毒。
A.2.9 医疗器械是否预期改善患者的环境?——否。
A.2.10 医疗器械是否进行测量?——是,按技术要求测量。
A.2.11 医疗器械是否进行分析处理?——否。
A.2.12 医疗器械是否预期和医药或其它医疗技术联合使用?——否。
A.2.13 是否有不希望的能量或物质输出?——无。
A.2.14 医疗器械是否对环境影响敏感?——否。
A.2.15 医疗器械是否影响环境?——否。
A.2.16 医疗器械是否有基本消耗品或附件?——无。
A.2.17 是否需要维护和校准?——否A.2.18 医疗器械是否有软件?——无。
第一类医疗器械产品目录

第一类医疗器械产品目录
医用敷料:包括敷料、创可贴、手术创口敷料等。
医用纱布和绷带:包括纱布、绷带、绷带夹等。
医用胶带和固定器材:包括医用胶带、绷带固定器材等。
医用手套:包括一次性医用手套、手术手套等。
医用消毒产品:包括消毒液、酒精棉球、消毒片等。
医用冷热敷产品:包括冷敷贴、热敷贴、冷热袋等。
医用器械清洗消毒设备:包括器械清洗机、消毒柜等。
医用外科手术器械:包括手术刀、剪刀、钳子、针线等。
医用诊断设备:包括血压计、体温计、血糖仪、心电图机等。
此外,还有一些特殊用途的第一类医疗器械产品,如眼罩、耳塞、眼药水等。
同时,常见的体外诊断试剂,如血糖仪、尿常规试纸、乙型肝炎病毒试剂盒等,也可能包含在第一类医疗器械产品目录中。
请注意,具体的第一类医疗器械产品目录可能因地区和国家而异,因此建议查阅当地的相关法规和标准以获取准确的信息。
一类医疗器械备案整理版

一类医疗器械备案整理版医疗器械备案是指根据相关法律法规和政府部门的要求,将医疗器械产品的生产、经营、使用等信息进行登记备案的行为。
医疗器械备案是确保医疗器械产品质量与安全的重要措施,同时也是保护消费者权益的必要手段。
根据医疗器械管理条例的规定,医疗器械备案分为两类:一类医疗器械备案和二类医疗器械备案。
一类医疗器械备案主要是指一些低风险的医疗器械,例如普通口罩、医用棉签、体温计等。
以下是一类医疗器械备案的整理版:1.普通口罩:普通口罩是一类医疗器械,用于阻挡飞沫、呼吸道分泌物等对呼吸道的物理性防护。
在备案时需要提供厂家名称、产品名称、产品型号、主要技术指标等信息。
2.医用棉签:医用棉签是一类常见的医疗器械,用于擦拭伤口、清洁器械等。
在备案时需要提供厂家名称、产品名称、产品规格、主要材料、灭菌方式等信息。
3.体温计:体温计是一类常用的医疗器械,用于测量人体的体温。
在备案时需要提供厂家名称、产品名称、产品型号、测量范围、精度等信息。
4.医用胶布:医用胶布是一类贴合肌肤的医疗器械,用于固定伤口敷料、固定导管等。
在备案时需要提供厂家名称、产品名称、产品规格、主要材料、适用范围等信息。
5.医用消毒棉球:医用消毒棉球是一类用于消毒的医疗器械,用于擦拭皮肤、消毒伤口等。
在备案时需要提供厂家名称、产品名称、产品规格、主要材料、灭菌方式等信息。
以上只是一类医疗器械备案中的几个例子,一类医疗器械备案还包括各类医用敷料、医用冷敷贴、一次性使用注射器等。
这些产品通常具有较低的风险,但也需要进行备案,以确保其质量安全和合法经营。
医疗器械备案的目的是加强医疗器械的监管,保障公众的健康和安全。
通过备案,可以确保医疗器械产品符合国家标准和技术规范的要求,提高产品的质量和安全性。
同时,备案也方便了政府监管部门对医疗器械市场的监管,加强对不合法经营和不合格产品的打击,保护消费者的权益。
总之,一类医疗器械备案是保障医疗器械产品质量和安全的重要环节,通过备案可以确保医疗器械的质量合格,提升公众健康水平。
医疗器械产品技术要求(防护眼罩)

医疗器械产品技术要求医疗器械产品技术要求编号:防护眼罩1.0产品型号/规格及其划分说明:1.1产品型号:封闭型透明眼罩型号: (150MM*72MM)1.2产品规格:不规则单镜片水平基准长度×垂直高度:150mm×72mm,厚度2mm;松紧带长度*宽度*厚度400mm*15mm*1.5mm1.3产品标志:产品标记分别由品牌代号(YY)、产品名称代号(YZ)、结构代号(T)和规格(150*72MM)四部分组成。
如下所示:**—**—** (150mm*72mm)结构代号:透明型结构用“T”标记;产品名称代号:用“YZ”表示,是“眼罩”的汉语拼音首写字母;品牌代号:用“YY”表示,是“公司”汉语拼音首写字母。
1.4产品材料:聚碳酸脂镜片、乙烯镜框、涤纶松紧带。
2.0性能指标:GB/T191-2008 包装储运图示标志;GB/T 3923.1-2013 纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测定条样法GB/T 16886.10-2017 医疗器械生物学评价第10部分:刺激与皮肤致敏试验GB/14866-2006 个人用眼护具技术要求GB/T2828.1-2012计数抽样检验程序第1部分:按接收质量限(AQL)检查的逐批检查及抽样计划;GB/T2829-2002周期检验计数抽样程序及表(适用于对过程稳定性的检验);GB/T 9969-2008工业产品使用说明书总则;YY0466-2009医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求。
3.0检验方法:3.1 要求:3.1.1 产品外观:各配件表面应平整、洁净、无破损,要求表面光滑、无毛刺、无锐角,松紧带无抽丝起球,配戴后无引起眼面部不舒适感和影响正常视力的其他表面缺陷;3.1.2 外形尺寸:应符合1.2的规定,正负偏差为±0.5mm;3.1.3 视野:单镜片组成的眼面护具最小下方视野为67°。
常用医疗器械分类实例(第一类、第二类)

医疗器械分类之邯郸勺丸创作第一类是指,通过常规办理足以包管其平安性、有效性的医疗器械. 第二类是指,对其平安性、有效性应当加以控制的医疗器械.第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其平安性、有效性必须严格控制的医疗器械.实例第一类1.医用冷敷贴、医用降温贴、医用退热贴2.医用冰袋、医用冰垫、医用冰帽、医用冷敷头带、医用冷敷眼罩3.脱脂棉球、消毒刷(擦拭器)、棉签、棉片(止血海绵属第二类)4.弹性创可贴、防水创可贴、棉布创可贴、透气创可贴、橡皮膏、创口贴5.纱布、绷带类包扎用品:弹力绷带、纱布绷带、无纺布绷带6.石膏绷带(粉状型)、石膏绷带(粘胶型)7.胶带类包扎固定敷料:透气胶贴(非织造布胶带)、透气胶带、弹性胶带、网纹易撕胶带捆扎式压力用品:卡扣式止血带、压力绷带、乳腺压力绷带、疝气带8.急救毯刷手衣、洗手衣医用导管夹9.检查手套、检查指套、卫生帽、护士帽10.医用检查垫、妇科检查垫、医用护理垫(看护垫)(电动防褥疮床垫属二类)11.引流袋、吸液袋、负压引流器、负压引流(吸引)接管、集尿袋、尿套(流产吸引器、负压吸引器属二类)12.刮痧治疗器具拔罐治疗器具(电动拔罐器属二类)13.手术、诊疗用床、台(电动多功效病床、电动综合手术台、治疗手术床、电动间隙牵引床、耳鼻喉科检查治疗台、综合治疗台属二类)14.手术灯(无影灯属二类)15.病人转运装置:病人推车、病人推床、担架、救护车担架16.吸氧装置:墙式氧气吸入器、手提式氧气吸入器、供氧系统氧气吸入器(医用制氧机、手提式氧气产生器属二类)17.压舌板遮眼板额戴反光镜18.听诊器(无电能)视力表灯、视力表灯箱、视力表19.打诊锤、脑打诊锤、叩诊锤20.手术刀、手术刀片、备皮刀、拆线剪、纱布绷带剪21.医用射线防护用品医用X射线胶片超声耦合剂、医用超声耦合剂22.医用透视荧光屏影像板23.侧开式阴道扩张器、双翼阴道扩张器、双翼阴道检查扩张器、双翼阴道手术扩张器(一次性使用阴道扩张器及润滑液属第二类)第二类24.体温计、血压计(各类类型)、电子血压脉搏仪、动态血压监护仪25.声、光、电、磁刺激器针灸针26.磁疗机、磁感应电疗机、低频电磁综合治疗机、特定电磁波治疗机、磁疗器具27.止血海绵避孕套、避孕帽无菌医用手套28.医用阴道洗涤器、医用阴道冲洗器29.真空采血管、采血针、激光彩血机30.医用缝合针(不带线)、自动尿液阐发仪及试纸、一次性使用导尿管不成吸收缝合线(带针/不带针)31.助听器、输液泵、注射泵32.心电诊断仪器、脑电诊断仪器、肌电诊断仪器、其他生物电诊断仪器33.诊断用纤维内窥镜(上消化道镜、结肠镜、大肠镜、支气管镜)、不雅察用硬管内窥镜(喉镜、鼻镜、膀胱镜、子宫镜、直肠镜、羊水镜)34.多功效超声监护仪、超声母亲/胎儿综合监护仪、超声产科监护仪、胎儿监护仪35.病人监护仪(监护参数含心电、血氧饱和度、无创血压、脉搏、体温、呼吸、呼吸末二氧化碳)麻醉气体监护仪、呼吸功效监护仪、睡眠评价系统、临蓐监护仪36.流产吸引器、负压吸引器。
一类医疗器械产品汇总

标题:一类医疗器械产品汇总一、概述医疗器械是用于预防、诊断、治疗、缓解疾病或者改变生理结构、过程的设备、器具、物品等。
按照风险程度,医疗器械分为三类,其中一类医疗器械风险较低,实行常规管理可以保证其安全、有效。
本文将对一类医疗器械产品进行汇总,以帮助读者更好地了解和选择一类医疗器械产品。
二、一类医疗器械产品分类一类医疗器械产品包括多种类型,根据其用途和功能,大致可以分为以下几类:1. 一次性使用医疗器械:如一次性注射器、输液器、采血管、手术器械等。
2. 消毒产品:如消毒液、消毒剂、消毒湿巾等。
3. 检验试剂:如血糖试纸、尿检试纸、生化试剂等。
4. 康复辅助器械:如拐杖、轮椅、助行器等。
5. 日常护理用品:如体温计、血压计、按摩器、理疗仪等。
6. 骨科器材:如石膏、夹板、外固定支架等。
7. 敷料:如纱布、绷带、创可贴等。
8. 麻醉器械:如局部麻醉器械、气管插管等。
三、一类医疗器械产品特点1. 风险低:一类医疗器械产品相对于二类和三类医疗器械,其风险程度较低,对人体的潜在危害较小。
2. 常规管理:由于风险较低,一类医疗器械产品实行常规管理,不需要进行严格的审批和监管。
3. 便捷性:一类医疗器械产品使用方便,操作简单,便于患者或医护人员使用。
4. 一次性使用:部分一类医疗器械产品为一次性使用,避免了交叉感染的风险。
5. 经济实惠:一类医疗器械产品价格相对较低,患者负担较轻。
四、一类医疗器械产品选购建议1. 选择正规渠道购买:购买一类医疗器械产品时,应选择正规渠道,如药店、医疗器械专卖店等,避免购买假冒伪劣产品。
2. 关注产品注册信息:购买时应查看产品注册证号、生产日期、保质期等信息,确保产品合法、安全。
3. 了解产品功能和使用方法:购买前应充分了解产品的功能、适用范围和使用方法,确保正确使用。
4. 注意产品包装和标识:购买时应检查产品包装是否完好,标识是否清晰,避免购买过期或损坏的产品。
5. 保留购买凭证:购买时应保留购物小票或发票,以便在出现问题时进行维权。
2024第一类医疗器械产品目录

2024第一类医疗器械产品目录2024年第一类医疗器械产品目录(备案制)是中国国家药监局发布的一份包含各类医疗器械产品的目录,用于管理和监督医疗器械市场。
本文将对该目录进行详细介绍。
首先,第一类医疗器械是指使用于人体皮肤或者黏膜表面,不贯通体腔,无创伤性的医疗器械产品。
它们被广泛应用于医疗和日常保健领域,如创可贴、口罩、一次性手套等。
这些产品多数属于低风险产品,但仍然需要严格管理和监督,以确保其质量和安全性能。
目录中包含了各类不同的第一类医疗器械产品。
其中,最常见的是敷料类产品,如创可贴、伤口敷料、防水敷料等。
这些产品主要用于创伤的包扎和保护,以促进伤口的愈合。
此外,还有一次性手术和检查用品,如手术帽、手术衣、一次性注射器、一次性手套等。
这些产品主要用于医院和诊所,用于医疗操作和病患护理。
此外,还有口腔护理用品,如牙刷、牙膏、漱口水等。
这些产品用于日常口腔保健,预防龋齿和口腔疾病的发生。
另外,目录中还包含了一些特殊用途的第一类医疗器械产品,如眼罩、耳塞、眼药水等。
备案制是指厂商在向国家药监局备案后,就可以正式销售和推广该医疗器械产品。
备案要求厂商提供与该产品相关的技术资料和质量证明文件,以证明产品的质量和性能符合规定。
备案后,厂商需要定期向药监局提交产品销售和安全监测的报告,以保证产品的质量和安全性能。
备案制的实施对医疗器械市场起到了积极的作用。
一方面,它提高了医疗器械产品的质量和安全性能,因为厂商需要提供相应的质量证明文件和技术资料。
另一方面,备案制也增加了管理和监督的难度,对于那些不合规的厂商和产品,可以进行及时的追踪和处理。
综上所述,2024年第一类医疗器械产品目录(备案制)是中国药监局发布的一份重要文件,用于管理和监督医疗器械市场。
该目录包含了各类第一类医疗器械产品,对其进行备案制管理。
备案制提高了产品的质量和安全性能,同时也增加了管理和监督的难度。
这一制度有助于保障医疗器械市场的稳定和有序发展。
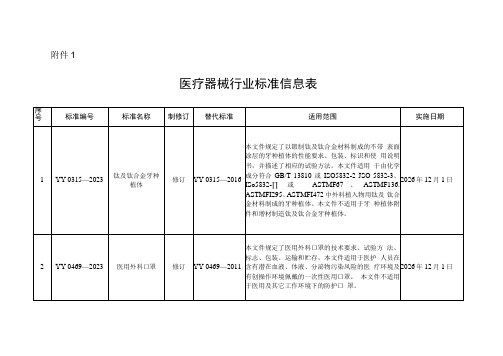
2023医疗器械行业标准信息表
——
序号
标准编号
标准名称
制修订
替代标准
适用范围
实施日期
5
YY/T0003—2023
手动病床
修订
YY/T0003—
1990
本文件规定了手动病床的要求、试验方法和说明 书。本文件适用于手动病床。该产品预期用于身高 等于或大于146cm,质量等于或大于40kg,体重 指数(BMl)等于或大于17的患者。
2026年12月1日
序号
标准编号
标准名称
制修订
替代标准
适用范围
实施日期
3
YY0793.2—2023
血液透析和相关 治疗用液体的制 备和质量管理第2部分:血液透 析和相关治疗用 水
修订
YY0572—2015
本文件规定了制备透析浓缩液、透析用液体(用于 血液透析、血液透析滤过或血液滤过)所用水的最 低要求。本文件适用于制备透析浓缩液、透析用液 体(用于血液透析、血液透析滤过或血液滤过)所 用水。本文件不涉及水处理设备的使用,及水经处 理后与浓缩物混合制成最终透析液的操作。这些 操作由透析专业人员负责。本文件不适用于透析 液再生系统。
2025年12月1日
6
YY/T0127.4—
2023
口腔医疗器械生 物学评价第4部 分:骨植入试验
修订
YY/T0127.4—
2009
本文件描述了 口腔医疗器械的骨植入试验方法。 本文件适用于评价组织对拟长期或持久与口腔骨 组织接触的口腔医疗器械的生物学反应。
2024年12月1日
7
YY/T0127.19—
2025年12月1日
13
YY/T1928—2023
预期用于磁共振 环境的医用电气 设备的术语和 分类
第一类医疗器械备案,眼药水产品技术要求(模板)

第一类医疗器械备案,眼药水产品技术要求(模板)第一类医疗器械备案眼药水产品技术要求 (模板)一、器械备案概述1.1 根据《中华人民共和国医疗器械监督管理条例》的规定,眼药水产品属于第一类医疗器械,需要进行备案管理。
二、产品技术要求2.1 外观要求:眼药水产品的外观应清晰透明,无悬浮物、沉淀物等杂质。
包装应正规,完整无损,无泄漏、脱盖等现象。
2.2 成分要求:眼药水产品的成分应符合相关法律法规和标准的规定。
成分应清晰标注于产品包装上。
2.3 质量要求:眼药水产品的质量应符合相关标准的规定。
需要提供质量控制文件,确保产品质量的可追溯性。
2.4 有效期要求:眼药水产品需标明有效期,并符合相关要求。
包装上应有明确的使用方法和储存条件提示。
2.5 禁忌和注意事项:包装上应清晰标注禁忌事项和注意事项。
需提供完整的使用说明书和说明书翻译。
三、备案程序3.1 准备备案材料:需提交完整的眼药水产品备案申请表格。
提供产品相关的技术文件,如质量控制文件、成分分析报告等。
提交产品的包装样品和相关标签。
3.2 提交备案申请:将准备好的备案材料提交至___或指定的地方药品监管部门。
3.3 审核和备案:相关部门将对备案材料进行审核。
审核通过后,会给予备案号并在官方网站上公示。
四、附则4.1 随着法律法规和标准的更新,产品技术要求可能会有所调整。
4.2 本模板仅为示例,具体备案要求以相关法律法规和标准为准。
以上为眼药水产品技术要求的备案模板,供参考使用。
具体备案要求请遵循相关法律法规和标准的要求进行操作。
请注意:此文档中的内容仅供参考,具体的法律规定以中国相关法律法规的最新版本为准。
一类医疗器械备案临床评价资料要求模板

一类医疗器械备案临床评价资料要求模板一、临床评价概述1.1评价目的1.2评价范围1.3评价方法1.4评价标准二、研究设计与方法2.1研究设计2.2受试对象选择和分组2.3盲法2.4数据收集和处理2.5统计学分析方法三、临床评价结果3.1受试对象基本情况3.2主要评价指标结果3.3副作用和不良事件3.4安全性评价结果3.5效果评价结果3.6综合评价结果四、讨论与分析4.1结果解释4.2结果比较与分析4.3可靠性与稳定性4.4与其他类似产品的比较4.5临床应用前景五、结论5.1主要结论5.2局限性和建议七、附件7.1试验方案7.2受试者知情同意书7.3其他相关材料以上是关于一类医疗器械备案临床评价资料要求的模板,下面对各个部分进行详细说明。
一、临床评价概述在这一部分中,需要明确评价的目的、范围、方法和标准,以便读者能够清楚了解临床评价的背景和目的。
二、研究设计与方法这一部分需要详细描述评价所采用的研究设计和方法,包括受试对象的选择和分组、采用的盲法、数据的收集和处理方法以及统计学分析方法等。
三、临床评价结果在这一部分中,需要提供受试对象的基本情况,并详细呈现主要评价指标的结果。
同时还需要记录副作用和不良事件的发生情况,并进行安全性和效果的评价。
四、讨论与分析在这一部分中,需要对评价结果进行解释,并进行结果的比较和分析。
还需要对评价的可靠性和稳定性进行讨论,并与其他类似产品进行比较。
最后需要对临床应用前景进行评述。
五、结论在这一部分中,需要总结出评价的主要结论,并指出评价的局限性,并提出相关的建议。
列出本临床评价报告所引用的相关文献。
七、附件在这一部分中,需要附上试验方案、受试者知情同意书和其他相关材料,以方便读者查阅和核实信息。
以上是一类医疗器械备案临床评价资料要求的基本模板,可以根据具体情况进行适当调整和完善。
对于不同的医疗器械,可能需要在各个部分中增加一些特定的内容。
医用防护眼罩(护目镜)检验报告
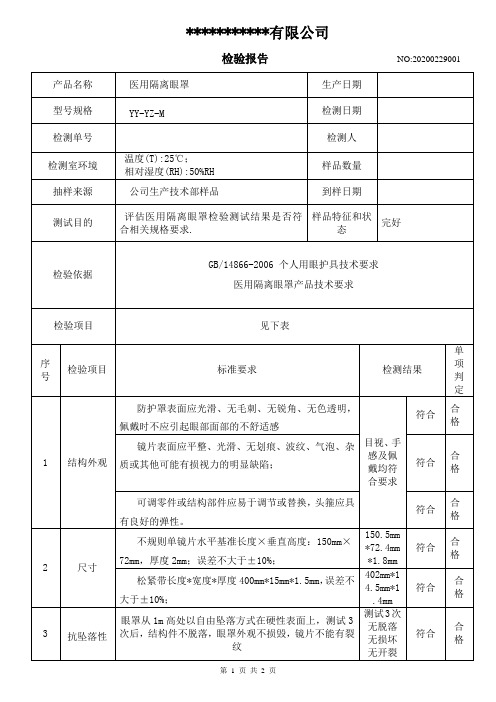
感及佩 戴均符
符合
合 格
合要求
可调零件或结构部件应易于调节或替换,头箍应具 有良好的弹性。
符合
合 格
2
尺寸
不规则单镜片水平基准长度×垂直高度:150mm× 72mm,厚度 2mm;误差不大于±10%;
150.5mm *72.4mm *1.8mm
符合
合 格
松紧带长度*宽度*厚度 400mm*15mm*1.5mm,误差不
产品名称 型号规格 检测单号 检测室环境 抽样来源 测试目的
***********有限公司
检验报告
NO:20200229001
医用隔离眼罩
生产日期
YY-YZ-M
检测日期
温度(T):25℃; 相对湿度(RH):50%RH
公司生产技术部样品
检测人 样品数量 到样日期
评估医用隔离眼罩检验测试结果是否符 合相关规格要求.
c)防护罩破损:经钢球冲击后,其分离成几个部分,
或其不再具有装夹镜片的能力,则可认为其破损。
5 耐热性
Hale Waihona Puke 把眼罩浸入温度为 67℃±2℃的水中 3min 后取出,再
立即放入 4℃以下的水中冷却 1min,取出后目力检测眼 无变形
符合
合 格
罩应无变形。
6
视力清晰 度试验
在房间合适位置张贴国际视力表,选 5 名受试者,先测 试并记录其双眼视力值 Li0;再按照使用说明佩戴好眼 罩,同等条件下再记录受试者的双眼视力值 Li1;5 名受
和 6.2.2.2 进行钢球冲击试验,试验结束后不应发生下
列缺陷:
a)镜片破损:如镜片碎裂为二片或二片以上,或者 跌落后
4
抗冲击性
医疗器械临床评价报告

医疗器械临床评价报告产品名称:一次性医用口罩型号规格:生产厂商:XXX公司临床评价类别:列入《免于进行临床试验的医疗器械目录》产品的临床对比评价临床评价负责人:XXX公司2020年03月29日一、临床评价概述目前已经研究和生产出各种各样及不同用途的口罩。
一次性使用医用口罩尤其在医护领域、科研领域及市场需求广泛,具有较好的发展前景。
一次性使用医用口罩是现代医疗实践中最常用的医疗器材之一。
目前国内外已有多个同类产品注册上市并广泛应用多年,其临床上的安全性、有效性早已得到确认。
为进一步确认本公司产品的临床性能,就产品临床使用的安全性、有效性与豁免目录内所述内容和目录中已获境内注册的医疗器械进行对比评价。
本报告依据CFDA于2015年5月19号发布的《医疗器械临床评价技术指导原则》中第5章列入《免于进行临床试验的医疗器械目录》产品的临床评价要求以及2014年5月发布的《医用口罩产品注册技术审查指导原则》的要求进行编写。
二、与《免于进行临床试验的第二类医疗器械目录》所述内容的对比根据国家药监局《关于公布新增和修订的免于进行临床试验医疗器械目录的通告》(2019年第91号)和2014年5月发布的《医用口罩产品注册技术审查指导原则》的规定,医用口罩(非外科用)为免于进行临床试验的医疗器械,管理类别为Ⅱ类,类别代号为:14。
主要对比情况见下表1:申报产品以非无菌形式提供,产品微生物限度符合YY/T 0693-2013中对于非灭菌口罩的微生物指标要求,使用形式差异不对产品临床安全和有效使用带来不利影响。
对比结果:通过一次性医用口罩(非无菌)与《免于进行临床试验的医疗器械目录(修订)》内的“医用口罩”所述内容的对比,可以看出两者描述具有等同性,一次性医用口罩(非无菌)确为免于进行临床试验的第二类医疗器械。
三、对照产品选择及对比情况选择东莞欣意医疗保健制品厂生产的Ⅱ类医疗器械——一次性使用医用口罩产品作为对照产品。
对照产品注册证书为:粤械注准20172640651(见附件1)。
第一类医疗器械备案,创可贴的临床评价资料(模板)

第一类医疗器械备案,创可贴的临床评价资料(模板)第一类医疗器械备案,创可贴的临床评价资料(模板)1. 引言本文档旨在提供第一类医疗器械备案时,创可贴的临床评价资料的模板。
该模板可用作参考,以确保评价资料的完整性和准确性。
2. 通用信息- 医疗器械名称:- 创可贴型号/规格:- 制造商:- 适用范围:- 产品简介:3. 临床评价请提供以下临床评价信息:3.1. 临床试验设计- 试验类型:- 试验目的:- 试验方法:- 试验对象选择标准:- 试验组与对照组分配方法:3.2. 试验结果请提供试验结果的主要数据和发现,包括但不限于以下几个方面:- 试验指标:- 主要结果及统计分析:- 不良事件及处理方法:- 试验总结结论:3.3. 安全性评价请提供创可贴的安全性评价信息,包括但不限于以下几个方面:- 使用过程中可能出现的风险:- 预防及控制措施:- 安全性评价结论:3.4. 有效性评价请提供创可贴的有效性评价信息,包括但不限于以下几个方面:- 疗效评价指标:- 有效性主要结果及统计分析:- 有效性评价结论:4. 结论根据以上临床评价资料,可以得出以下结论:- 对于创可贴的临床评价结果:- 安全性评价结论:- 有效性评价结论:5. 参考文献请列出参考文献清单,确保所有引用内容均可确认。
以上是第一类医疗器械备案,创可贴的临床评价资料的模板,旨在提供详细、准确的评价信息。
根据具体情况,可以在模板的基础上进行修改和补充。
医疗器械分类目录第一类医疗器械

医疗器械分类目录第一类医疗器械随着科技的不断发展,医疗器械在医疗行业中扮演着至关重要的角色。
医疗器械的种类繁多,为了更好地管理和监管这些器械,我国编制了医疗器械分类目录。
这个目录将不同类型的医疗器械进行了系统的分类,今天我们就来了解一下医疗器械分类目录的第一类医疗器械。
第一类医疗器械是指对人体表面(黏膜)进行预防、检查、诊断、治疗或者缓解疾病的医疗器械。
这类器械一般与患者直接接触,以非创伤性的方式起作用。
在医疗器械分类目录中,第一类医疗器械还可以根据其风险分为三类:低风险、中风险和高风险。
在第一类医疗器械中,低风险的器械主要包括一些常见的家用医疗器械,例如血糖仪、血压计、体温计等。
这些器械一般被患者用于日常的健康监测和疾病管理,使用方法也相对简单,风险较低。
中风险的第一类医疗器械则涵盖了一些更加复杂的设备,例如骨密度仪、心电图机等。
这些器械需由专业人员进行操作,具有一定的风险性,但在操作正确的情况下,对患者是安全的。
而高风险的第一类医疗器械则更加复杂、高端。
这些器械往往能够进行更加精确和复杂的医疗操作,例如体外循环机、呼吸机等。
这类设备需要专业的医务人员进行操作,不当的使用可能对患者的生命安全带来风险。
医疗器械的分类目录对于医疗器械的管理和监管起到了重要的作用。
通过对器械进行分类,能够更好地控制和监督不同风险级别的器械的生产和使用。
这不仅能够提高患者的安全性,也有助于医生和临床医学工作者更好地选择和使用合适的医疗器械。
另外,医疗器械的分类目录还可用作行业的标准化和规范化。
不同类型的器械需要满足一系列的技术要求、安全要求和质量控制要求,这些要求在不同类型的医疗器械中可能有所不同。
通过分类目录的制定,可以使得医疗器械的生产商和销售商对于不同类型的器械有更明确的规范和标准。
然而,医疗器械分类目录的制定也面临着一些挑战和问题。
首先,不同国家和地区对医疗器械的分类标准可能有所不同,这会对国际贸易和合作带来一定的困扰。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床评价资料
1.产品预期用途及说明
该产品适用于医务人员的检查、诊断或治疗中防止血液、唾液或药水对人体的伤害。
使用前请选择正确型号眼镜。
2.产品预期使用环境
医用隔离眼罩,通常在室温条件下使用。
使用的方法及注意事项如下:
使用前请详细阅读使用说明书,当产品出现断裂破损等异常情况严禁使用。
本产品为一次性使用产品,用后请进行安全处理。
3.产品适用人群
用于医疗机构中检查治疗时起防护作用。
4.产品禁忌症
1、在使用本产品前,请仔细阅读使用说明,应在使用期内使用;
2、该产品为一次性使用,禁止重复使用,包装破损禁止使用。
5. 已上市同类产品临床使用情况的说明
同类产品对比说明
6. 同类产品不良事件情况说明
对市面上已常见的防护眼罩出现不可防雾,一段时间就会出现雾气,不能起到很好的防护作用。
本公司承诺:按如下要求提交了医用隔离眼罩的临床评价资料。
国家食品药品监督管理总局《关于第一类医疗器械备案有关事项的公告》(2014年第26号公告)中,关于“临床评价资料”的相关要求。
*************有限公司
2020-02-17。
