培养基优化
培养基优化设计

课程设计说明书课程名称:新编生物工艺学设计题目: 培养基优化设计院系:生物与食品工程学院学生姓名:学号:2专业班级:08生物技术指导教师:关现军2011 年6月3 日课程设计任务书目录1.摘要················································页码2.关键字··············································页码3.设计背景············································页码3.1培养基简介···········································页码3.2培养基优化设计的重用意义····························页码4 设计方案·················································页码 4.1原材料制备···········································页码 4.2菌种的选择···········································页码 4.3营养因子的比例设·····································页码4.4理化条件控制············································页码4.5总工艺流程列叙········································页码5 预期结果················································页码6 方案实施时可能出现的问题与对策·······························页码7 设计感受·················································页码7.1 关于本方案···················································页码 7.2 关于自我·····················································页码8参考文献··················································页码.1 摘要以改良MRS发酵培养基为墓础,选择玉米浆、牛肉膏、乳糖、番茄汁、际蛋白陈等7个营养因子增菌培养乳酸菌进行优化。
细胞培养技术中的培养基组分优化方法

细胞培养技术中的培养基组分优化方法细胞培养是一种广泛应用于生物医学研究、生物制药和组织工程等领域的关键技术。
在细胞培养过程中,培养基是支持和满足细胞生长和繁殖需要的关键因素。
培养基的组分优化可以显著提高细胞培养的效率和质量,为相关研究和应用提供坚实的基础。
细胞培养基的组分主要包括营养物质、生长因子、激素、血清、缓冲剂、抗生素等。
在培养基组分优化方法中,首先需要对细胞类型进行充分了解。
不同的细胞对培养基成分的要求是不同的,因此需要根据细胞类型的特点,进行适当的调整和改进。
营养物质是细胞生长和代谢所需的基本成分,包括氨基酸、葡萄糖、维生素等。
优化营养物质组分的方法可以通过浓度调整、组分替换等方式进行。
例如,对于某些特定细胞类型,可以增加特殊氨基酸的含量,以满足其特殊代谢需求。
此外,营养物质的来源也可以选择天然或者合成的成分,根据需求进行调整和选择,以提高细胞培养的效果。
生长因子是调节细胞增殖和分化的关键因素,常见的生长因子包括表皮生长因子(EGF)、基质细胞生长因子(bFGF)、血小板源性生长因子(PDGF)等。
优化生长因子组分的方法包括浓度调整、组分替换、添加新的生长因子等。
根据细胞类型的特点和研究需要,合理选择和调整生长因子的组分和浓度,可以促进细胞的生长和分化,提高细胞培养效果。
激素在细胞培养中具有重要的生物学功能,可以影响细胞的生长、分化、代谢等过程。
常见的激素包括胰岛素、甲状腺激素、泛素等。
优化激素组分的方法包括浓度调整、替代激素的选择等。
通过合理调整激素组分和浓度,可以提高细胞培养的效率和质量,满足研究和应用的需求。
血清是细胞培养中最常用的培养基成分之一,可以提供细胞所需的营养物质、生长因子等。
然而,血清的组分复杂、批次变异大,且存在潜在的生物安全风险。
优化血清的组分可以通过血清的浓度调整、替代或者血清的成分分析和优化等方式进行。
例如,可以使用无血清培养基或者人血清替代传统的胎牛血清,以降低对血清的依赖性,提高培养基组分的一致性和可控性。
培养基优化毕业设计

培养基优化毕业设计一、引言在生物科学领域的研究中,培养基扮演着非常重要的角色。
培养基是提供营养物质和环境条件的基质,用于维持细胞、组织或微生物的生长和繁殖。
优化培养基对于毕业设计的顺利进行具有重要意义。
本文将就培养基优化在毕业设计中的应用进行讨论。
二、培养基的组成2.1 基本组分培养基的基本组分主要包括碳源、氮源、矿质盐、生长因子等。
其中,碳源和氮源是细胞生长和代谢的基础。
合适的矿质盐和生长因子可以提供细胞所需的微量元素和必需物质。
2.2 pH值的调控培养基的pH值对于细胞的生长和代谢活动至关重要。
不同的微生物和细胞系对于pH值的要求有所不同。
因此,在培养基优化中,合理调节pH值是必要的。
2.3 温度和气氛条件温度和气氛条件对于细胞的生长和代谢也具有重要影响。
不同的细胞类型和微生物需要在适宜的温度和气氛条件下进行培养。
因此,毕业设计中的培养基优化也需要考虑到这些因素。
三、培养基优化的方法3.1 组件优化通过调整培养基中碳源、氮源、矿质盐等组分的比例,可以优化培养基的配方,使其适合特定的细胞或微生物的生长要求。
优化组分比例可以提高培养基的效果,促进细胞的生长和代谢。
3.2 pH值调节方法pH值的调节可以通过添加缓冲液或调整培养基中酸碱度的组分来实现。
对于不同的细胞和微生物,选择合适的pH调节方法非常重要。
可通过试错法或在文献中查阅相关资料来确定适宜的pH范围。
3.3 温度和气氛条件的控制温度和气氛条件的控制可以通过使用恒温箱、调节培养基中的气体组分等方法来实现。
合适的温度和气氛条件可以提供适宜的环境,促进细胞的增殖和代谢。
3.4 使用特定培养基根据不同细胞类型和微生物的特点,选择特定的培养基也是一种有效的优化方法。
有些细胞和微生物对某些特殊组分有特殊需求,使用特定培养基可以更好地满足它们的生长要求。
四、优化培养基的意义优化培养基对于毕业设计具有重要意义:1.提高实验效果:优化培养基可以为实验提供更适宜的环境,促进细胞的生长和代谢,从而提高实验的效果。
酵母菌发酵培养基优化要点

❖ 本实验以菌体生物量为指标,用四因素三水 平的正交试验确定酵母菌的最优培养基。
实验步骤
一、培养基的配制
1.将葡萄糖、蔗糖、酵母提取粉、KH2PO4作为培养基的主要 影响因素,每一因素设定3个水平,进行四因素三水平的正交 试验,试验设计如表1
因素水平 A葡萄糖 /%
1
1.0
2
2.0
3
3.0
表1 正交试验表设计
(X1+X2+X3)/3 (X4+X5+X6)/3 (X7+X8+X9)/3
K最大- K最小
B
1 2 3 1 2 3 1 2 3
(X1+X4+X7)/3 (X2+X5+X8)/3 (X3+X6+X9)/3
K最大- K最小
C
1 2 3 3 1 2 2 3 1
(X1+X5+X9)/3 (X2+X6+X7)/3 (X3+X4+X8)/3
1(1.0)
1(0)
1(1.0)
2(1)
1(1.0)
3(2)
2(2.0)
1(0)
2(2.0)
2(1)
2(2.0)
3(2)
3(3.0)
1(0)
3(3.0)
2(1)
3(3.0)
3(2)
C酵母提 取粉/%
1(0.5) 2(1) 3(1.5) 2(1) 3(1.5) 1(0.5) 3(1.5) 1(0.5) 2(1)
C酵母提取 D KH2PO4
粉/%
/%
1(0.5)
1(0.5)
2(1)
2(1)
3(1.5)
培养基优化经验

比如,我在实验中目前遇到的几个问题:1、我做完单因素,就在想是做PB?还是最陡爬坡?还是两个都要做呢??毕竟我快毕业了,时间紧张阿2、我现在准备做PB,突然发现很多文献上都出现了在实验中还要加几个空白项,知道主要是用于误差分析的,但我就想问下,是不是必须设置空白项呢?如果必须设,那么要设几个呢?我看大部分是设了4个的;还有就是,空白项是没有设定+1、-1的水平值,那么在实验中该如何具体操作呢,我采用的是SARS软件进行设计,那么实验设计好后遇到空白项的+1、-1该怎么弄呢?什么都不加么??还有空白项安排的位置有影响么?3、我做的是培养基优化,目前共有8种因素准备做PB,那么做完了PB,确定了显著因素,该如何设计最陡爬坡呢?是不是也需要相关软件来进行试验设计的呢?第一,你的是8个因素,直接做RSM,不可取,建议先用PB筛选主效应因素。
至于SA,并不是每个PB后都必须的,要看你的实验结果,也就是预测和实验区域的吻合情况了。
第二,8个因素,做12runs的PB,刚好有四个空列。
空列,也就是虚拟的,可以权当不存在,它只是在分析中用来估算误差的。
第三,先做好PB。
至于SA,用手算就可以了。
呵呵,很简单的。
看样子你看了很多文献,里面都应该有计算公式的。
哈哈,我这里到时有一些试验数据。
PB设计如果用SAS(应该这样写是对的哦)就会出现上面说的空白项现象。
建议使用minitab、JMP等,这些都不会出现空白项的。
PB设计是筛选重要影响因子的,从众多因子挑出重要的,舍弃不重要的(统计学上说,就是有显著影响的因素)。
因此,在逻辑上是有必要进行的。
如果还有什么问题继续提问。
高低水平的设置没有定式,无需过分遵从1.25倍这个定式。
总体上说,如果一个水平范围内,因素较为显著,可适当缩小范围(具体范围应该合理,举例说,但不一定合理:如果以菌体量最大为望目值时,温度是一个显著性影响因素(p<0.05),现研究范围为37-38℃;那你在缩小范围为37.5-37.9℃,这个就没有必要了。
培养基的选择-整理

培养基的选择和优化(初稿)一、培养基的概念:culture medium是人们提供微生物生长繁殖和生物合成各种代谢产物需要的多种营养物质的混合物。
其成分和配比对微生物的生长、发育、代谢产物的合成,甚至对于发酵工业的生产工艺都有很大的影响。
二、用途和分类:用途:筛选菌种、保藏菌种、检验杂菌、培养种子、发酵生产。
分类:1.按成分不同:天然:用化学成分还不清楚或化学成分不恒定的天然有机物配制。
例:牛肉膏蛋白胨培养基、麦芽汁培养基。
合成:化学成分完全了解的物质配制而成的培养基。
例:查氏培养基、高氏 1号培养基复合(半合成培养基):天然成分+化学试剂2.按物理状态:固体:加入一定量的凝固剂,琼脂含量1.5%--3.0%,常用来微生物的分离、鉴定、活菌计数及菌种保藏。
半固体:琼脂0.3%--0.5%,观察运动特征,分类鉴定液体:不加任何凝固剂,大规模生产及在实验室进行微生物的基础理论和应用方面的研究。
3.按实验目的:基础:适合大多数微生物生长的培养基,如牛肉膏蛋白胨培养基加富:在基础培养基中加入某些特殊营养物质制成的一类培养基。
如高糖培养基选择:在培养基中加入相应的特殊营养物质或化学物质,抑制不需要的微生物的生长,有利于所需微生物的生长。
如麦康凯培养基鉴别:用于鉴别不同微生物的培养基,微生物产生某种代谢产物,与培养基中的化学物质发生化学反应,产生明显的特征变化,如EMB培养基三、成分来源:(人工配制的、适合微生物生长、繁殖或产生代谢产物的营养基质,是微生物学研究和微生物发酵生产的基础。
任何培养基都应具备微生物所需要的六大营养要素,且其间的比例合适。
)营养: 有机体吸取和利用营养物质的过程。
营养物质: 微生物为了生存就必须从环境中吸取各种物质以合成细胞物质、提供能量以及在新陈代谢中起调节作用。
这些物质就称为营养物质。
微生物的营养物质:水、碳源、氮源、无机盐、生长因子。
1、水:维持细胞的膨压和作为生化反应的溶剂。
培养基设计与优化

培养基的设计与优化原料:碳源,氮源十大元素: 碳, 氢, 氧, 氮, 磷, 钾, 硫, 钙, 镁微量元素: 硼, 锰, 锌, 钼, 钴, 碘, 铜, 等生长因子、前体和产物促进剂生长因子从广义上讲,凡是微生物生长不可缺少的微量的有机物质,如氨基酸、嘌呤、嘧啶、维生素等均称生长因子。
如以糖质原料为碳源的谷氨酸生产菌均为生物素缺陷型,以生物素为生长因子,生长因子对发酵的调控起到重要的作用。
有机氮源是这些生长因子的重要来源,多数有机氮源含有较多的B簇维生素和微量元素及一些微生物生长不可缺少的生长因子。
前体前体指某些化合物加入到发酵培养基中,能直接为微生物在生物合成过程中合成到产物物分子中去,而其自身的结构并没有多大变化,但是产物的产量却因加入前体而有较大的提高。
产物促进剂指那些非细胞生长所必须的营养物,又非前体,但加入后却能提高产量的添加剂。
其提高产量的机制还不完全清楚,其原因可能是多方面的,主要包括:有些促进剂本身是酶的诱导物;有些促进剂是表面活性剂,可改善细胞的透性,改善细胞与氧的接触从而促进酶的分泌与生产,也有人认为表面活性剂对酶的表面失活有保护作用;有些促进剂的作用是沉淀或螯合有害的重金属离子。
水对于发酵工厂来说,恒定的水源是至关重要的,因为在不同水源中存在的各种因素对微生物发酵代谢影响甚大。
水源质量的主要考虑参数包括pH值、溶解氧、可溶性固体、污染程度以及矿物质组成和含量。
培养基的设计与优化目前还不能完全从生化反应的基本原理来推断和计算出适合某一菌种的培养基配方,只能用生物化学、细胞生物学、微生物学等的基本理论,参照前人所使用的较适合某一类菌种的经验配方,再结合所用菌种和产品的特性,采用摇瓶、玻璃罐等小型发酵设备,按照一定的实验设计和实验方法选择出较为适合的培养基。
培养基设计的基本步骤是:1.根据前人的经验和培养基成分确定时一些必须考虑的问题,初步确定可能的培养基成分.2.通过单因子实验最终确定出最为适宜的培养基成分。
培养基优化方法

方法一:LB培养基、平板保存的工程菌HB101/pJJ-rhIFNα2B、Amp、酵母提取物、蛋白胨、10×SAE、100×MgCl2、100×TES、Tris、HCl10×SAE配方(1L):KH2PO410g、K2HPO4·3H2O52.4g、NH4Cl10g、K2SO426g100L【步骤】种子制备:1、取100mLLB培养基加入到一无菌的500ml三角形中,同时加入100μl100mg/ml的Amp。
2、接种甘油管保存的工程菌HB101/pJJ/rhIFNα-2b100μl,使工程菌分散于培养液中。
3、盖好试管,在摇床上以220rpm的速度,于37℃培养至对数中期(约5小时)上罐准备:1、配置500ml10×SAE2、配置发酵培养基(3L)称取胰蛋白胨30g,酵母提取物90g,加入2.64L去离子水,搅拌溶解后加入300ml 10×SAE、30ml100×MgCl2、30ml100×TES。
3、将培养基加入到5L发酵罐,插入pH、溶氧电极和温度探头,装上空气过滤膜,包扎好后放入灭菌锅中,同时放入一瓶250ml30%磷酸(调pH用),于1.05kg/cm2高压下蒸汽灭菌30min。
4、待灭菌结束后,将发酵罐放在冷却底座上,开启发酵罐控制系统,联接好冷凝水、空气线路。
5、控制pH=7.4,在转速650r/m、通气量3L/min 定D.O.为100%于自动控制发酵罐上37℃发酵22小时。
6、当培养基温度冷却到37℃后,接入制备好的种子7、从接种完时刻起,每两小时取适当量样品,其中取1ml用于测菌体浓度(A600nm);另取1ml加入到一称过重ep管中,12000rpm离心,小心取出900μl上清用作测菌体浓度的空白,甩干后再次称重,计算菌体湿重,按每8.3mg菌体湿重加入300μL水重悬菌体,冻于-20℃备用。
微生物发酵培养基的优化方法

微生物发酵培养基的优化方法微生物发酵培养基是指为微生物提供合适的生长环境、碳源、氮源以及其他必需营养物质的复杂液体或固体介质。
优化培养基是通过调整培养基成分来提高微生物的生长速度和产物产量,保证产物质量和生产效率。
本文将介绍一些优化微生物发酵培养基的方法。
1.确定微生物的需求不同的微生物对培养基的成分有着不同的要求,包括碳源、氮源、矿物质以及其他生长因子等。
因此,首先需要明确所需微生物对营养物质的需求,有助于指导后续优化工作。
2.碳源优化3.氮源优化氮源对微生物生长和代谢至关重要,可以通过改变氮源种类和浓度来优化培养基。
常用的氮源包括氨基酸、尿素、硝酸盐等。
可以试验不同的氮源和浓度,根据微生物生长状况和产物产量来确定最佳氮源。
4.矿物质优化5.添加生长因子一些微生物需要特定的生长因子才能生长和产生产物,如一些维生素、辅酶等。
了解微生物所需的生长因子并添加到培养基中,可以提高微生物的生长速度和产物产量。
6.调整pH值和温度微生物对pH值和温度的要求较为敏感,因此需要优化培养基的pH值和温度来提供最适宜的生长条件。
通过试验不同pH值和温度对微生物的影响,选择最佳的pH值和温度来优化培养基。
7.添加表面活性剂表面活性剂可以增强微生物与培养基之间的接触,促进培养基中的气液传质。
添加适量的表面活性剂,可以提高微生物的生长速率和产物产量。
8.优化培养条件除了调整培养基的成分外,优化微生物发酵培养基还需要考虑一些培养条件,如培养基的搅拌速度、培养温度、空气进气率等。
通过优化这些培养条件,可以提高微生物的生长速度和产物产量。
综上所述,优化微生物发酵培养基是一个复杂而繁琐的过程,需要根据具体微生物的要求和反应机制来选择合适的调整方法。
通过调整培养基成分、添加生长因子、调整pH值和温度、添加表面活性剂以及优化培养条件等方法,可以提高微生物的生长速率和产物产量,保证产品质量和生产效率。
关于大肠杆菌培养基的优化实验

由图表可看出,当温度为42摄氏度,PH为9时,实验数据较其他相差较大,为可疑数据。
平均值为0.1872标准差S=0.398478
偏差为0.7128
2S=0.796956>0.7128
根据拉伊达准则,当显著性水平等于0.05时,0.9这一可疑值不能舍去
关于大肠杆菌培养基的优化实验
一、实验目的:研究培养基中适宜的PH值,温度及含水量最佳配比,学会处理实验中的各种误差,掌握发酵培养基的配制方法。
二、
(1)实验单元:培养基,无菌移液器,恒温箱,玻璃棒,大肠杆菌,灭菌箱,营养液等。
(2)实验效应:发酵液中的OD值。
(3)实验因素:温度,PH值,含水量等。
(4)测定各摇瓶中的OD值并分析比较。
四、实验结果
假设当温度为38摄氏度,PH值为8时,大肠杆菌的生长速度最快。
大肠杆菌的生长速度与设定温度的最佳温度成正比例函数态分布,与PH值呈正态函数分布。
下表为实验数据:
PH温度
8
15
38
42
50
6
0.0000
0.0060
0.0100
0.0078
0.0027
7
所以F>F0.05(4,4),两方差有显著差异性
T=0.9044df=3
T0.0025(3)=3.182
t>t0.0025(3)两平均值间有显著差异,存在系统误差
(2)关于随机误差——F检验法
F=3947.7 F>1df2=4 df4=4
所以采用单侧检验法
查F表得F0.025(4,4)=9.60
F>F0.025(4,4)则方差2比方差4有显著增大
培养基优化实验方案

培养基优化实验方案嘿,咱来说说培养基优化实验方案哈。
有一次啊,我在实验室里做实验,就碰到了要优化培养基的事儿。
咱就从这事儿说起吧。
首先呢,咱得确定实验目的。
咱为啥要优化培养基呢?是想让培养的细胞长得更好呢,还是想提高某种物质的产量呢?我那次啊,就是想让细胞长得更快更壮。
所以我的目标就是找到一种最适合细胞生长的培养基配方。
然后呢,咱得收集一些资料。
看看别人都用了啥方法优化培养基,有啥成功的经验可以借鉴。
我就上网查了好多资料,还去图书馆借了几本相关的书。
这一查一看啊,还真学到了不少东西。
接下来,咱就可以开始做实验了。
我先准备了几种不同的培养基配方,有基础的,有添加了各种营养物质的。
然后把细胞接种到这些培养基里,放在培养箱里培养。
我记得我那时候可紧张了,就像在照顾一群小宝贝一样。
每天都要去看看它们长得怎么样了。
在培养的过程中,咱得观察记录。
看看细胞的生长情况,长得快不快啊,形态好不好啊。
我就拿着显微镜,一个一个地看。
有时候看到细胞长得特别好,我就高兴得不得了;有时候看到细胞长得不好,我就愁得直挠头。
等实验做完了,咱就得分析数据了。
看看哪种培养基配方最好。
我就把我记录的数据都整理出来,做了一些图表。
这一分析啊,就发现了一些规律。
比如说,某种营养物质多一点,细胞就长得好一点;某种营养物质少一点,细胞就长得差一点。
最后,咱就可以根据分析的结果,确定最优的培养基配方了。
我那次啊,经过一番努力,终于找到了一种特别好的培养基配方。
细胞在这种培养基里长得可欢了。
总之啊,培养基优化实验可不是一件容易的事儿,但是只要咱认真去做,肯定能找到最适合的培养基配方。
植物细胞与组织培养技术的优化与创新

植物细胞与组织培养技术的优化与创新植物细胞与组织培养技术是一种通过体外培养植物细胞或组织的方法,为科学家研究植物生长发育、遗传变异以及种子繁殖提供了便利。
随着科技的不断进步,植物细胞与组织培养技术也在不断地优化与创新。
本文将探讨植物细胞与组织培养技术的优化与创新,并介绍一些相关的应用。
一、培养基的优化培养基是植物细胞与组织培养的基础,其成分和配方的优化对于培养结果的影响至关重要。
近年来,随着对植物生长调控机制的研究深入,一些生长因子和植物激素的加入成为培养基优化的热门方向。
例如,添加生长因子如细胞分裂素和生长素可以促进植物细胞的分裂和伸长,从而提高培养效果。
此外,调节培养基的pH值、添加适量的营养物质等也可以有效提高培养基的质量。
二、外植体的选择和准备在植物细胞与组织培养中,外植体的选择和准备对于培养效果具有重要影响。
外植体是从植物组织中分离出来的初始材料,在培养中作为种子输入系统的移植物的主要来源。
为了提高培养效果,科学家们通过优化外植体的选择和准备流程来提高培养效率。
例如,选择生长健康、无病害的外植体,并通过适当的消毒等处理减少外植体的污染,可以显著提高培养的成功率。
三、生物体外胚胎发育技术生物体外胚胎发育技术是植物组织培养技术中的一项重要创新。
它通过体外培养,将植物胚胎发育过程模拟于实验室中,从而实现植物的无性繁殖。
这项技术的应用在植物育种和植物繁殖中具有广泛的前景。
通过优化培养条件和培养基的配方,可以实现植物大量繁殖和育种的需要,提高植物的产量和品质。
四、基因转化技术的应用基因转化技术是将外源基因导入到植物细胞中,使其表达出新的特性,从而对植物进行改造的一种技术手段。
这种技术的应用在植物品种改良和农田物种改进方面具有重要意义。
通过优化载体构建、转化方法等关键环节,可以提高转化效率和基因稳定性,为植物种质资源的改良提供了有效的手段。
总结起来,植物细胞与组织培养技术的优化和创新对于植物繁殖、育种以及基因改良具有重要意义。
培养基配方开发和优化方法

培养基配方开发和优化方法培养基配方开发和优化方法是微生物学和细胞生物学研究中至关重要的一环。
培养基是用于培养和繁殖微生物或细胞的营养物质组合,对于研究的准确性和可重复性具有重要影响。
本文将介绍一些常用的培养基配方开发和优化方法,以帮助研究者设计出适合不同研究对象的培养基。
培养基的配方开发需要根据研究对象的特性和需求进行考虑。
不同的微生物和细胞对于营养物质的需求有所差异,因此需要根据其代谢途径和营养需求来确定培养基中各种营养成分的含量和种类。
例如,一些微生物对碳源的需求较高,可以选择葡萄糖或琼脂糖作为碳源,而一些细胞则需要特定的氨基酸或维生素补充。
因此,了解研究对象的特性是培养基配方开发的第一步。
优化培养基的方法是通过调整培养基中各种营养成分的浓度和比例,以提高微生物或细胞的生长和产物产量。
优化培养基的首要目标是满足研究对象的生长需求,同时最大程度地提高生物产物的产量。
一般来说,优化培养基可以从以下几个方面入手。
可以通过响应面法进行培养基优化。
响应面法是一种统计实验设计方法,可以通过设计一系列实验来确定培养条件对生物生长和产物产量的影响。
通过分析实验数据,可以建立生长和产量与培养条件之间的数学模型,并找到最佳的培养条件。
这种方法可以高效地优化培养基,提高生物产量。
可以通过逐步优化的方法来改善培养基。
逐步优化是指逐步调整培养基中的某个成分,观察其对生物生长和产量的影响,并根据实验结果进行进一步优化。
例如,可以逐步增加某种营养成分的浓度,观察生物生长和产量的变化,然后根据结果进行调整。
这种方法比较简单易行,适用于初步优化培养基的情况。
还可以利用统计学方法进行培养基优化。
统计学方法可以通过分析大量的实验数据,找到生物生长和产量与培养条件之间的关系,并建立预测模型。
通过使用这些模型,可以预测不同培养条件下的生物生长和产量,并进一步优化培养基。
统计学方法可以较全面地考虑各种因素的影响,是一种较为可靠的培养基优化方法。
培养基优化毕业设计

培养基优化毕业设计一、前言培养基优化是生物学、生物工程学等领域中一个非常重要的研究方向,其对于细胞培养、微生物发酵等方面具有重要意义。
本篇文章将从以下几个方面进行讲解:什么是培养基优化,为什么需要进行培养基优化,如何进行培养基优化以及一些常见的优化方法和技巧。
二、什么是培养基优化培养基是指用于细胞、微生物等生物体在体外或体内繁殖和生长的营养液。
在生命科学研究领域中,适合的培养基可以提高细胞或微生物的活力和产量,并且可以保证实验结果的可靠性和准确性。
因此,对于不同类型的细胞或微生物来说,需要使用不同的适宜的培养基。
而培养基优化则是指通过调整营养成分、添加辅助因素等手段来改善原有的培养基配方,使得其更加适合特定类型细胞或微生物在实验条件下进行繁殖和生长。
三、为什么需要进行培养基优化1.提高细胞或微生物的生长速度和产量不同类型的细胞或微生物对于营养成分的需求有所不同。
通过优化培养基,可以使得其更加适合特定类型细胞或微生物在实验条件下进行繁殖和生长,从而提高其生长速度和产量。
2.保证实验结果的可靠性和准确性在科学研究中,实验结果的可靠性和准确性是非常重要的。
而培养基作为细胞或微生物在体外繁殖和生长所需要的营养液,其质量和配方对于实验结果具有非常重要的影响。
通过优化培养基,可以保证实验结果的可靠性和准确性。
3.降低成本优化培养基可以降低成本,因为通过调整营养成分、添加辅助因素等手段来改善原有的培养基配方,可以使得使用更少的培养基来达到相同或更好的效果。
四、如何进行培养基优化1.确定目标在进行培养基优化之前,需要明确优化目标。
例如提高细胞或微生物的产量、改善细胞或微生物的生长速度等。
2.确定优化方案根据目标确定优化方案,可以从以下几个方面入手:(1) 营养成分的调整:根据细胞或微生物对于营养成分的需求,调整培养基中各种营养成分的浓度和比例。
(2) 添加辅助因素:例如添加激素、维生素等辅助因素来促进细胞或微生物的生长和繁殖。
培养基优化方法

方法一:LB培养基、平板保存的工程菌HB101/pJJ-rhIFNα2B、Amp、酵母提取物、蛋白胨、10×SAE、100×MgCl2、100×TES、Tris、HCl10×SAE配方(1L):KH2PO410g、K2HPO4·3H2O52.4g、NH4Cl10g、K2SO426g100L【步骤】种子制备:1、取100mLLB培养基加入到一无菌的500ml三角形中,同时加入100μl100mg/ml的Amp。
2、接种甘油管保存的工程菌HB101/pJJ/rhIFNα-2b100μl,使工程菌分散于培养液中。
3、盖好试管,在摇床上以220rpm的速度,于37℃培养至对数中期(约5小时)上罐准备:1、配置500ml10×SAE2、配置发酵培养基(3L)称取胰蛋白胨30g,酵母提取物90g,加入2.64L去离子水,搅拌溶解后加入300ml 10×SAE、30ml100×MgCl2、30ml100×TES。
3、将培养基加入到5L发酵罐,插入pH、溶氧电极和温度探头,装上空气过滤膜,包扎好后放入灭菌锅中,同时放入一瓶250ml30%磷酸(调pH用),于1.05kg/cm2高压下蒸汽灭菌30min。
4、待灭菌结束后,将发酵罐放在冷却底座上,开启发酵罐控制系统,联接好冷凝水、空气线路。
5、控制pH=7.4,在转速650r/m、通气量3L/min 定D.O.为100%于自动控制发酵罐上37℃发酵22小时。
6、当培养基温度冷却到37℃后,接入制备好的种子7、从接种完时刻起,每两小时取适当量样品,其中取1ml用于测菌体浓度(A600nm);另取1ml加入到一称过重ep管中,12000rpm离心,小心取出900μl上清用作测菌体浓度的空白,甩干后再次称重,计算菌体湿重,按每8.3mg菌体湿重加入300μL水重悬菌体,冻于-20℃备用。
《发酵工艺》项目3:培养基配制与优化

例:地衣牙孢杆菌生产α-淀粉酶
碳源对生长和产酶的影响
碳源 葡萄糖 蔗糖 糊精 淀粉
细胞量 4.2 4.02 3.06 3.09
α-淀粉酶 0 0
38.2 40.2
油和脂肪
油和脂肪也能被许多微生物作为碳源和能源
在脂肪酶的作用下,油或脂肪被水解为甘油和脂 肪酸,在溶解氧的参与下,进一步氧化成CO2和H2O, 并释放出大量的能量。
绳状青霉QM424 产气杆菌QMB1591
米曲霉 泡盛曲霉
酶活力增加倍数 20 16 10 4 4 6 20 1.5
2.87 2.50
曲霉、橘青霉、枯草杆菌、假丝 酵母
2~4
筋状拟内胞霉
1.2
真菌
4.4
绿色毛霉
2
二、培养基类型及选择
• 根据营养物质的不同来源分 • 根据培养基的物理形状 • 发酵生产中的培养基类型
2、氮源
氮源主要用于构成菌体细胞物质(氨基酸,蛋 白质、核酸等)和含氮代谢物。常用的氮源可分为 两大类:有机氮源和无机氮源。
无机氮源
种类:氨盐、硝酸盐和氨水
特点:微生物对它们的吸收快,所以也称之谓迅速利 用的氮源。但无机氮源的迅速利用常会引起pH的变 化如:
(NH4)2SO4 → 2NH3 + 2H2SO4 NaNO3 + 4H2 → NH3 + 2H2O + NaOH
大豆酒精提取物(2%) 植酸质(0.01%~0.3%)
聚乙烯醇 苯乙醇(0.05%)
醋酸+纤维素
一些酶生产的促进剂
酶 纤维素酶
蔗糖酶 β-葡聚糖酶 木聚糖酶
淀粉酶 脂酶 右旋糖酐酶 普鲁兰酶 蛋白酶 脂肪酶
蛋白酶
1发酵培养基的优化方法与策略

1发酵培养基的优化方法与策略发酵培养基的优化是提高微生物发酵产物产量和质量的重要手段之一、优化发酵培养基的方法与策略主要包括以下几个方面。
1.组件选择和浓度优化:优化发酵培养基的首要任务是选择合适的营养成分。
首先,根据发酵微生物的需求特点选择对其生长和代谢有促进作用的营养需求物质,如碳源、氮源、矿质盐和辅助因子等。
其次,通过合理配比研究每个组分的最佳浓度,避免过高或过低的浓度对微生物生长和代谢产物产量的负面影响。
2.抗泡沫和抗氧化剂的添加:在发酵过程中,泡沫和氧气的存在会影响微生物的生长和产物的产量。
添加抗泡沫剂可以有效地控制泡沫的产生和积聚,改善发酵液的混合和气体传质效果。
而添加抗氧化剂可以减少氧气对微生物的氧化损伤,提高微生物对氧气的利用效率。
3.pH值和温度的调节:微生物的生长和代谢活动受到环境条件的影响较大,因此优化发酵培养基时需要合理调节pH值和温度。
适当的pH值和温度可以提供良好的生长环境,促进微生物发酵活动。
对于一些需要特殊pH值和温度条件的微生物,可以在培养基中添加缓冲剂和调节剂,用于调节pH值和温度。
4.发酵条件的控制:发酵过程中,控制发酵条件是优化发酵培养基的关键之一、控制发酵过程中的搅拌速度、通气量和温度、pH值等操作参数,可以有效地提高发酵效果和产物的产量。
此外,还可以通过适时添加激素和生长因子等来调节微生物的代谢途径和产物的产量。
5.采用统计学方法进行优化:为了确保优化发酵培养基的可靠性和准确性,通常需要采用统计学方法建立数学模型来描述微生物的生长和代谢规律。
通过设计合适的实验方案和合理的数据采集,应用响应面法、负荷图法、主成分分析等方法,对关键因素进行优化和预测,从而提高发酵培养基的效果。
总之,发酵培养基的优化是一个复杂的过程,需要结合微生物的特点和发酵过程中的各种因素进行综合考虑与调控。
通过合理选择和配比培养基组分、添加合适的辅助剂、调节发酵条件和采用统计学优化方法,可以最大限度地提高微生物的发酵产量和质量。
微生物(酵母)的培养基优化
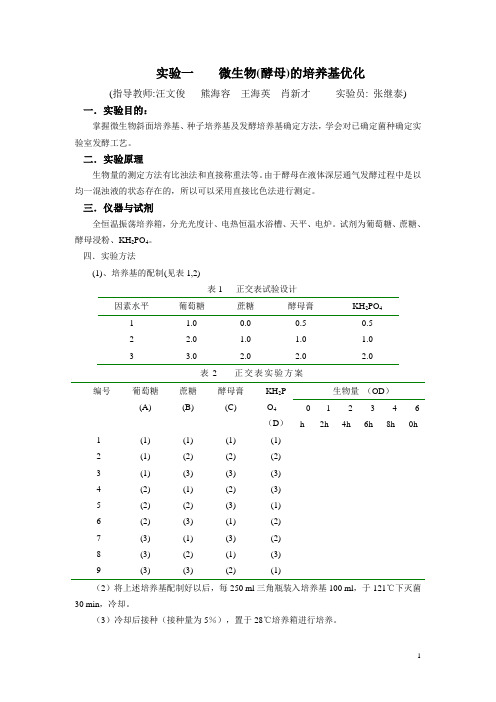
实验一微生物(酵母)的培养基优化(指导教师:汪文俊熊海容王海英肖新才实验员: 张继泰) 一.实验目的:掌握微生物斜面培养基、种子培养基及发酵培养基确定方法,学会对已确定菌种确定实验室发酵工艺。
二.实验原理生物量的测定方法有比浊法和直接称重法等。
由于酵母在液体深层通气发酵过程中是以均一混浊液的状态存在的,所以可以采用直接比色法进行测定。
三.仪器与试剂全恒温振荡培养箱,分光光度计、电热恒温水浴槽、天平、电炉。
试剂为葡萄糖、蔗糖、酵母浸粉、KH2PO4。
四.实验方法(1)、培养基的配制(见表1,2)表1 正交表试验设计因素水平葡萄糖蔗糖酵母膏KH2PO41 1.0 0.0 0.5 0.52 2.0 1.0 1.0 1.03 3.0 2.0 2.0 2.0表2 正交表实验方案编号葡萄糖(A) 蔗糖(B)酵母膏(C)KH2PO4(D)生物量(OD)h12h24h36h48h60h1 (1) (1) (1) (1)2 (1) (2) (2) (2)3 (1) (3) (3) (3)4 (2) (1) (2) (3)5 (2) (2) (3) (1)6 (2) (3) (1) (2)7 (3) (1) (3) (2)8 (3) (2) (1) (3)9 (3) (3) (2) (1)(2)将上述培养基配制好以后,每250 ml三角瓶装入培养基100 ml,于121℃下灭菌30 min,冷却。
(3)冷却后接种(接种量为5%),置于28℃培养箱进行培养。
(4)测OD值:将接种0 h、12 h、24 h、36 h、48 h、60 h不同时间的菌悬液摇均匀后于560nm波长、1cm比色皿中测定0D值。
比色测定时,用以未接种的培养基作空白对照,并将0D值填入表中,最终确定最佳培养基的组成及发酵时间。
五.思考题(1)比浊计数在生产实践中有何应用价值?(2)本实验为什么采用560nm波长测定酵母菌悬液的光密度?如果你在实验中需要测定大肠杆菌生长的OD值,你将如何选择波长?实验二紫外线的诱变育种(指导教师:汪文俊熊海容王海英肖新才实验员: 张继泰) 一.目的要求通过实验,观察紫外线对枯草芽孢杆菌的诱变效应,并学习物理因素诱变育种的方法。
培养基优化毕业设计

培养基优化毕业设计
题目:培养基优化对细胞生长的影响研究
摘要:
本研究旨在探究不同培养基对细胞生长的影响,以及对培养基的优化方案。
选取细胞作为研究对象,采用不同培养基(包括基础培养基、添加剂培养基和改良培养基)培养细胞,比较其生长曲线和生长速率。
同时,针对不同培养基的不同成分,分别进行单因素实验和正交实验,寻找影响细胞生长的最优参数组合。
结果显示,添加剂培养基对细胞生长有显著的促进作用,而改良培养基在小规模培养中表现良好。
在优化方案中,发现培养基中葡萄糖和氨基酸浓度、CO2浓度和温度等因素对细胞生
长有显著的影响,并进行了相应的参数调节。
本研究对于细胞培养技术的进一步完善具有重要意义,为工业生产和生物医学领域的应用提供了理论基础和实用方案。
关键词:培养基优化,细胞生长,添加剂培养基,改良培养基,正交实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Abstract
•This indicates that the mycelial biomass may supply other intracellular or mycelial-bound enzymes, or factors necessary for the catalytic cycle of the enzymes. It also implies that this fungus implements different strategies to degrade dyes with diverse chemical structures.
• The addition of copper stimulated laccase and glyoxal oxidase production, but this response was influenced by the medium N-concentration, with improvement higher at low N-levels. /The medium that supported the highest ligninolytic production (22.75 U/ml laccase, 0.34 U/ml manganese peroxidase, and 0.20 U/ml glyoxal oxidase)also showed the greatest ability to decolorize the dyes.Only glyoxal oxidase activity limited biodecoloration efficiency, suggesting the involvement of peroxidases in the process./The addition of 1hydroxybenzotriazole (a known laccase mediator) to the ligninolytic fluids increased both their range and rate of decolorization.The cell-free supernatant did not decolorize xylidine,poly R-478, azure B, and malachite green as efficiently as the whole broth, but results were similar in the case of indigo carmine and remazol brilliant blue R./
Introduction
•Enzyme overproduction can be achieved by media engineering. Traditional methods of optimization have involved changing one independent variable while fixing the others at a certain level. This single-dimensional search is laborious, time-consuming, and incapable of reaching a true optimum due to interactions among variables. Response surface methodology (RSM), first described by Box and Wilson , is an experimental strategy for seeking the optimum conditions for a multivariable system. Although this methodology has been widely applied in food science, e.g. in sensory analysis,and in pharmacology to assess drug interaction, it has not been well exploited to optimize fermentative enzyme production by microorganisms
• Purified laccases, LiPs, and MnPs are able to decolorize dyes of different chemical structure
•The white-rot fungus Trametes trogii has received little research attention although it is an outstanding laccase producer , and its ability to degrade high-priority pollutants, such as polychlorinated biphenyls, polyaromatic dyes, and polycyclic aromatic compounds, has been demonstrated recently
lignin peroxidases (LiP, EC 1.11.1.14), and manganese peroxidases (MnP, EC 1.11.1.13), which function together with H2O2-producing oxidases and secondary metabolites.Introduction
•White-rot fungi, a group of lignin-degrading basidiomycetes,have
ran锰ebocin过elsiittv酶氧yeer化tdeooc物dsoeenlgesricdatiedvreealbe木ignlen质z化iyan素mt酶tie过esnds氧tyiuosetnetmfooarcnothneexsiitrsrtabincioegrlloeumflaleardcnicaaotsnieossnp(epEcoiC漆ftie1cn.酶1at0nia.d3l..2T)h, eir
Materials and methods
•In this study we investigated the ability of a strain of T. trogii to decolorize a range of synthetic textile dyes,and the role of ligninolytic enzymes in the decolorization process. Response surface optimization techniques were applied to maximize enzyme production and decolorization efficiency.
Optimization of a culture medium for ligninolytic enzyme production and synthetic dye decolorization using response surface methodology
响应面法优化木质素水解酶生产及合成染 料脱色培养基
•漆酶是一种含铜多酚氧化酶(polyphenol oxidases,PPO), 它通过获得O2催化邻对苯二酚、多酚、对苯二胺、抗坏血酸 等物质的氧化,使之生成相应的苯醌和水。漆酶、过氧化物 酶和酪氨酸酶共同组成了酚类的氧化酶群,广泛存在于自然 界中。
目录
contents
01 Introduction
Abstract
• A Box-Wilson central composite design was applied to optimize copper, veratryl alcohol and Lasparagine concentrations for Trametes trogii (BAFC 212) ligninolytic enzyme production in submerged fermentation. Decolorization of different dyes (xylidine,malachite green, and anthraquinone blue) by the ligninolytic fluids from the cultures was compared.
•To test the growth tolerance of the fungus towards the presence of different dyes, T. trogii was inoculated on plates containing malt extract (12.5 g/l) and agar (20 g/l),supplemented with different concentrations of anthraquinone blue,malachite green and xylidine (25–1000 mg/l). The inoculum consisted of a 0.25-cm2 agar plug of a 5-day-old culture grown on MEA. A control plate with no dye added was also inoculated.Uninoculated plates served as controls for abiotic decoloration.The plates were incubated at 28 C. Growth was followed by measuring the radial extension of the mycelium. A decolorized zone appeared when the fungus degraded the dye. Growth rates (mm/day) were
