第十三章有机合成基础_有机化学及实验
有机合成基础知识

有机合成基础知识嘿,朋友们!今天咱来聊聊有机合成基础知识,这可真是个有趣又神奇的领域啊!你想想看,就好像我们是一群神奇的魔法师,能把各种不同的原子和分子组合在一起,创造出全新的化合物。
这多有意思呀!有机合成就像是搭积木,只不过我们用的不是木头积木,而是那些小小的原子。
我们要知道每个原子的脾气和特点,知道它们喜欢和谁在一起,不喜欢和谁在一起。
比如说碳原子,那可是有机世界的大明星,它特别喜欢和其他原子手牵手,组成各种各样的结构。
再说说反应条件吧,这就像是给我们的魔法施加合适的咒语。
温度啦、压力啦、催化剂啦,这些都能决定我们的魔法能不能成功。
有时候就差那么一点点条件不对,整个实验就可能失败。
这是不是跟我们做饭有点像?火候掌握不好,菜的味道就不一样啦。
还有那些反应类型,加成反应、取代反应、消除反应等等,每一种都有它独特的魅力。
加成反应就像是给分子加上一些新的装饰,让它变得更漂亮;取代反应呢,则像是给分子换一身新衣服,让它有了新的模样。
在有机合成的世界里,我们要时刻保持警惕,因为稍有不慎就可能出岔子。
就像走在一条小路上,得小心翼翼地避开那些陷阱和绊脚石。
但别害怕失败呀,失败是成功之母嘛!每次失败都是一次学习的机会,让我们能变得更厉害。
有机合成可不只是在实验室里玩玩哦,它和我们的生活息息相关呢!我们吃的药、用的化妆品、穿的衣服,很多都是通过有机合成得来的。
没有有机合成,我们的生活可就没那么丰富多彩啦!你说,有机合成是不是超级神奇?它就像一个充满奥秘的宝藏,等着我们去探索和发现。
让我们一起在这个神奇的世界里尽情遨游吧,说不定哪天我们也能创造出一个伟大的化合物呢!总之,有机合成基础知识是打开有机世界大门的钥匙,掌握了它,我们就能在有机的海洋里畅游啦!原创不易,请尊重原创,谢谢!。
2020版高三化学大一轮复习__第十三章 有机化学基础_选修_ _课时作业 (2)

解析:有机物的合成,常采用逆推法,要生成 1,2-丙二醇, 则需要通过 1,2-二氯丙烷的水解反应,要生成 1,2-二氯丙烷,则 需要利用丙烯和氯气的加成反应,而丙烯的生成,可利用 2-氯丙 烷的消去反应,所以依次经过的反应类型为消去反应―→加成反 应―→取代反应。
7.(2019·山东滕州一中月考)下列关于甲、乙、丙、丁四种有机
解析:分析 C 与 G 反应产物的结构简式,结合流程可得, D(C2H2)为乙炔,与 Br2 加成生成 E(C2H2Br2),E 的结构简式为
;根据已知②可知,E 与 HCN 发生取代反应生成 F,F
)、
b
的说法正确的是( C )
A.a、b、c 的分子式均为 C8H8
B.a、b、c 均能与溴水发生反应
C.a、b、c 中只有 a 的所有原子会处于同一平面
D.a、b、c 的一氯代物中,b 有 1 种,a为 C8H8,c 的分子式为 C8H10,A 项 错误;a、c 分子中均含有碳碳双键,能与溴水发生加成反应,b 中不含不饱和键,不能与溴水发生反应,B 项错误;b、c 中均含 有饱和碳原子,所有原子不能处于同一平面,C 项正确;c 的一 氯代物有 7 种,D 项错误。
解析:Q 中两个甲基上有 6 个等效氢原子,苯环上有 2 个等 效氢原子,峰面积之比应为 3∶1,A 项错误;Q 中苯环上的卤 素原子无法发生消去反应,P 中与卤素原子相连的碳原子的邻位 碳原子上缺少氢原子,无法发生消去反应,B 项错误;在适当条 件下,卤素原子均可被 OH 取代,C 项正确;Q 中苯环上的氢原 子、甲基上的氢原子均可被氯原子取代,其一氯代物有 2 种,D 项错误。
物说法正确的是( B )
A.四种物质中分别加入氯水,均有红棕色液体生成 B.四种物质中加入 NaOH 溶液共热,然后加入稀硝酸至溶液 呈酸性,再滴入 AgNO3 溶液,均有沉淀生成 C.四种物质中加入 NaOH 的醇溶液共热,然后加入稀硝酸至 溶液呈酸性,再滴入 AgNO3 溶液,均有沉淀生成 D.乙发生消去反应得到两种烯烃
大学有机化学第十三章羧酸

CH3-C CH-COOH CH3
4
3
2
1
3-甲基-2-丁烯酸
取代酸
CH
CHCOOH
3-苯基丙烯酸(肉桂酸) ( -苯基丙烯酸)
◆ 羧酸的物理性质
O R C
=
O
H O
H H H
R C
=
O
H O O
O H
O H
=
C R
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。
O CH3C OH + NH3
CH3COOH + NH3
O
CH3C O.NH4 200℃CH C NH 3 2
CH3COONH4 Δ CH3CONH2 + H2O
-+
O
二元酸的二铵盐受热则发生分子内脱水兼脱氨,
生成五元或六元环状酰亚胺。
C H2C O O NH 4 C H2C O O NH 4
O
300℃
回流
ClCH2COOH
Cl2 , P
一氯乙酸
Cl2CHCOOH
回流
Cl2 , P Cl3CCOOH
二氯乙酸
回流
三氯乙酸
α-卤代酸是一种重要的取代酸,它可以发生与卤代烃相 似的亲核取代或消去反应,从而转变成其它的取代酸。
如:
CH3COOH Br2 ,P BrCH2COOH NaCN NCCH2COOH α-氰基乙酸
b.p: 羧酸 > M 相同的醇。
IR谱:
OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶剂的稀溶液)。 C=O伸缩振动——脂肪族羧酸:1700~1725cm-1 芳香族羧酸:1680~1700cm-1
《有机化学》第13章 杂环化合物和生物碱

4-甲基嘧啶
4-甲基噻唑
⑶ 连有取代基的杂环化合物命名时,也可将杂环作为取代基,以侧链为母体来命名。
4-嘧啶磺酸
β-吲哚乙酸(3-吲哚乙酸)
2-苯并咪唑甲酸乙酯
⑷ 为区别杂环化合物的互变异构体,需标明杂环上与杂原子相连的氢原子所在的位 置,并在名称前面加上标位的阿拉伯数字和大写H的斜体字。
2023/6/13
⑴ 卤代反应
在室温条件下,吡咯、呋喃和噻吩能与氯或溴发生激烈反应,得到多卤代物。将反应 物用溶剂稀释并在低温下进行反应时,可以得到一氯代物或一溴代物。碘化反应需要 在催化剂存在下进行。例如:
2023/6/13
6
(2)硝化反应
在低温条件下,吡咯、呋喃和噻吩能与比较缓和的硝化剂硝酸乙酰酯(CH3COONO2) 发生硝化反应,主要生成α-硝基化合物。例如:
3. 颜色反应
生物碱能与一些试剂发生颜色反应,比如钒酸铵的浓硫酸溶液、浓硝酸、浓硫酸、 甲醛、氨水等,利用此性质可鉴别生物碱。比如莨菪碱遇1%钒酸铵的浓硫酸溶液显 红色,可待因遇甲醛-浓硫酸试剂显紫红色等。
二、重要的生物碱 1. 烟碱 又叫尼古丁,主要以苹果酸盐及柠檬酸盐的形式存在于烟草中。其结构式
2023/6/13
13
血红素是卟啉环与Fe2+形成的配合物;叶绿素是卟啉环与Mg2+形成的配合物,它们的 结构式如下:
血红素在体内与蛋白质结合形成血红蛋白,存在于红细胞中,是人和其他哺乳动物 体内运输氧气的物质。叶绿素是植物进行光合作用不可缺少的物质。
2023/6/13
14
二、呋喃衍生物
呋喃甲醛是最常见的呋喃衍生物,又称为糠醛,它是一种无色液体,沸点为161.7℃, 在空气中易氧化变黑,是一种良好的溶剂。 糠醛是合成药物的重要原料,通过硝化可制得一系列呋喃类抗菌药物,如治疗泌尿 系统感染的药物呋喃坦丁、治疗血吸虫病的药物呋喃丙胺等。
第十三章第四讲 生命中的基础有机化学物质合成有机高分子化合物

考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
②蛋白质的性质
水解:在_____________的作用下最终水解生成_________。 两性:蛋白质分子中含有未缩合的—NH2和—COOH,因此具有 两性。 盐析: 向蛋白质溶液中加入某些浓的无机盐(如______________________等)溶
考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
②葡萄糖的化学性质:
新制Cu(OH)2 还原性—能发生银镜反应,能与______________ 悬浊液反应
| 加成反应—与H2发生加成反应生成己六醇 | 发酵成醇—C6H12O6(葡萄糖) → 2C2H5OH+2CO2 | 生理氧化—C6H12O6(葡萄糖)+6O2→6CO2+6H2O
第十三章 有机化学基础
第四讲 生命中的基础有机化学物质 合成有机高分子化合物
考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
1.油脂 (1)油脂的组成
油脂是油和脂肪的统称,都是高级脂肪酸和甘油形成的酯,属于
C、H、O 三种元素。 酯类化合物,含____________
(2)结构特点 结构通式:
与NaOH溶液反应的化学方程式:
______________________________________________________
考点突破 实验探究 高考演练 课时训练
考点一 糖类
油脂
蛋白质
b.成肽反应
氨基 氨基酸在酸或碱存在的条件下加热,通过一分子的_____ 与另一分子
羧基 间脱去一分子水,缩合形成含肽键的化合物叫做成肽反 的________
有机化学:第十三章羧酸及其衍生物

2. 酸酐的生成
用P2O5作脱水剂制备酸酐
O CH3 C OH O O P2O5 CH3 C O O C CH3
+
HO
C CH3
+
H2O
用低沸点酸酐作脱水剂制备较高沸点的酸酐
O 2 COOH + (CH3CO)2O
(
C
) 2O + 2 CH COOH
3
能形成五元、六元环酸酐的二元羧酸可直接加热制备酸酐
羧酸与PX3 、PCl5(X=Cl、Br)、SOCl2反应
3CH3COOH + PCl3
3 CH3 COCl + H3PO3
COOH+PCl5
(CH3)2CHCH2COOH + SOCl 2
COCl + POCl3+ HCl
(CH3)2CHCH2COCl
+
SO2
+ HCl
注:HX不能与羧酸反应生成酰卤 。 应用:酰卤的反应活性比较高,广泛应于药物合成中 。
( 2)编号:从羧基碳原子开始用阿拉伯数字编号,按所含碳原
子数目称为某酸,取代基名称及位次写在某酸之前。
( 3)简单的酸酸,常用希腊字母表明取代基的位置,从羧基相 邻碳原子开始编号为 ,依次为 、 、 等,将编号写在取代基 名称前面。
CH3CH2CHCH2COOH CH3
-甲基戊酸(3-甲基戊酸)
第十三章
羧酸及其衍生物 主要内容
1、掌握羧酸和取代羧酸的结构、命名和化学性质 2、掌握羧酸衍生物的结构、分类及命名和化学性质
3、熟悉羧酸和取代羧酸的物理性质
4、掌握羟基酸、酮酸的命名及主要化学性质。
羧酸:
有机化学第十三章 取代羧酸
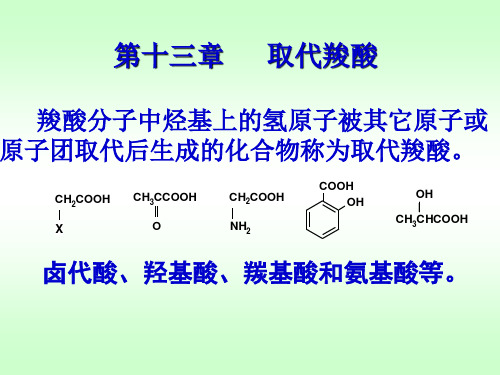
C HO 浓NaOH CH2OH COOH ’ COOH C anniz z aro 反 应 COOH + COOH
三
丙酮酸: 最简单的α -酮酸
CH3
O C COOH
CH3 CH3
O 浓 H2SO4 CO + CH3 COOH(脱羰) C COOH O 稀 H2SO4 CO + CH CHO (脱羧) 2 3 C COOH
OH O C6H5C=CHCCH 3 90.0%
2 乙酰乙酸乙酯的分解反应 稀OH-
O O CH3C-CH 2-COC 2H5
浓OH-
O CH3CCH3
酮式分解
O CH3C-OH + 其余 酸式分解
3 α-H的活性:被取代
O O CH3C-CH2-COC 2H5
RONa
O Na+ O CH3C-CH--COC 2H5
稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( “醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
有机合成课件

2、逆向合成分析法(逆推法)
目标化合物
中间体
中间体
基础原料
三、有机合成遵循的原则
1)起始原料要廉价、易得、低毒、低污染 2)尽量选择步骤最少的合成路线——保证较高的产率。 3)满足“绿色化学”的要求。 4)操作简单、条件温和、能耗低、易实现 5)尊重客观事实,按一定顺序反应。
原料 顺 中间产物 顺 产品
①卤代烃碱性水解、②烯烃水化、
③醛类加氢(还原)、④酯的水解
加深练习:
只用乙醇一种有机物(无机物可以任选),
合成: COOCH2
COOCH2
请同学们说出其过程
CH3CH2OH
HOOC HOOC
CH2 CH2
O HC HC
O
②
COOCH2 COOCH2
Cl Cl CH2CH2
①
HOCH2 HOCH2
逆
逆
【学以致用——解决问题 二】
O
O
C— OC2H5 C— OC2H5
O
C— OH
4
C— OH
O +CH3CH2OH
CH2
2
CH2
3 1
H2C— OH H2C— OH
H2C— Cl H2C— Cl
产率计算——多步反应一次计算
CH3 H2C= C—COOH
93.0% A 81.7% B
CH3 HSCH2CHCO N
1-丙醇 ①
丙烯 ② A
③
议
甘油 ④ 1,2,3-三氯丙烷
(提示:CH2=CHCH3+Cl2 500℃ CH2=CHCH2Cl+HCl )
请你写出反应①③④各步的化学方程式及反应类型。
展
评
有机化学课件第十三章 羧酸衍生物

四、与格氏试剂的反应
RCOX + R'MgX RCOR' 1) R'MgX 2)H2O OH R C R' R'
13.3 羧酸酯 13.3.1 羧酸酯的物理性质 1、 沸点比相应的醇低; 2、 在水中的溶解度较小; 3、有芳香气味。 13.3.2 羧酸酯的化学性质 一、酯的水解、醇解和氨解
RCO2R' + H2O 水解 酯化 RCOOH + R'OH
RCH2CO2Et EtOH EtONa RCH2 O C CH CO2Et R
练习
H C
CO2Et
H C _
O CO2Et + H C+
CHO O CH2CO2Et H C OEt
O Ph C HC CO2Et
O Ph C + +
_ HC
CO2Et
CH3 O Ph C OEt
CH3 CH3CH2 CO2Et
CO2Et CO2Et
Na EtOH
CH2OH CH2OH
2、酮醇缩合反应(非质子性溶剂)
O R C OR' Na, 二甲苯 R R CH OH C O
历程
O R C O R C OR' OR' O-Na+ Na. R C
Na.
. .
OR' R R OR'
O-Na+ C C OR' OR'
R
C
O-Na+ R R C C
CH3COCH2CO2Et 1)OH-,H2O 1)EtONa RCOX CH3COCHCO2Et COCH3
2)H3O+
有机化学第十三章羧酸衍生物

C3H7 C OH H
这是用二元酸酯合成大环化合物很好的方 法。
2019/9/30
CO3OCH Na
(C 2 )8H CO3O二 C 甲 苯 H
HAc
CO
(C 2 )8HCO
3、酸酐的还原 酸酐的活性不如酰卤, 但酸酐可以被LiAlH4 、NaBH4还原成醇。
4、酰胺的还原 酰胺在LiAlH4 作用下 还原成伯胺。
L
(1)与 酰 基 相 连 的 原 子 的 电 负 性 都 比 碳 大 , 故 有I效 应 (2)L和 碳 相 连 的 原 子 上 有 未 共 用 电 子 对 , 故 具 有 +C (3) 当 +C> I时 , 反 应 活 性 将 降 低
Pπ共 20轭 19/9体 /30系
当 +C< I时 , 反 应 活 性 将 增 大
酯在酸催化下进行的水解为可逆水解:
H +
C H 3C O O C 2H 5 +H 2O
C H 3C O O H+C 2H 5O H
酯在碱催化下进行的水解为不可逆水解:
C H 3C O O C 2H 5 +H 2ON aO HC H 3C O O N a+C 2H 5O H
因此,在碱性下水解反应更为彻底,其 碱性水解称为皂化,即为工业上制造肥皂的 原理。
R C OH R
从产物的结构看,格氏试剂与酯作用是 合成具有两个相同烃基的叔醇的最有效方法。 例如:
COCH3
1)乙醚 +2CH3M gX2)3O H +
CH3 C OH CH3
2019/9/30
当使用HCOOR与RMgX作用,可以制备 结构对称的仲醇。例如
有机化学课后习题答案第13章
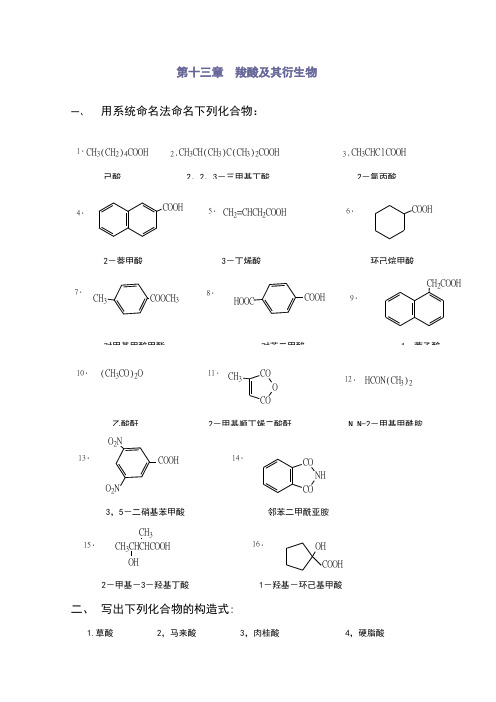
第十三章 羧酸及其衍生物一、 用系统命名法命名下列化合物:1.CH 3(CH 2)4COOH2.CH 3CH(CH 3)C(CH 3)2COOH3.CH 3CHClCOOH4.COOH5.CH 2=CHCH 2COOH6.COOH7.CH 3COOCH 38.HOOCCOOH9.CH 2COOH10.(CH 3CO)2O11.COO CO CH 312.HCON(CH 3)213.COOHO 2NO 2N14.CO NH3,5-二硝基苯甲酸 邻苯二甲酰亚胺15.CH 3CHCHCOOH CH 3OH16.OH COOH2-甲基-3-羟基丁酸 1-羟基-环己基甲酸二、 写出下列化合物的构造式:1.草酸 2,马来酸 3,肉桂酸 4,硬脂酸HOOCCOOHC C H H COOH COOHCH=CHCOOHCH 3(CH 2)16COOH5.α-甲基丙烯酸甲酯 6,邻苯二甲酸酐 7,乙酰苯胺 8,过氧化苯甲酰胺CH 2=C CH 3COOCH 3CO O CONHCOCH3CO C O OO NHC O H 2NCOOC 2H 5CNH C NHO OH 2N CNH 2NHCOO COnCH 2CH O C OCH 3[]n三、写出分子式为C 5H 6O 4的不饱和二元酸的所有异构体(包括顺反异构)的结构式,并指出那些容易生成酸酐:解:有三种异构体:2-戊烯-1,5-二酸;2-甲基-顺丁烯二酸;2-甲基-反丁烯二酸。
其中2-甲基-顺丁烯二酸易于生成酸酐。
CC H COOHCOOH C C H COOHCH 3HOOCCH 3HOOC CH=CHCH 2COOH2-戊烯-1,5-二酸; 2-甲基-顺丁烯二酸; 2-甲基-反丁烯二酸四、比较下列各组化合物的酸性强度:1,醋酸, 丙二酸, 草酸, 苯酚, 甲酸CH 3COOH ,HOOCCOOH HOOCCH 2COOH ,,OH ,HCOOHHOOCCOOHHOOCCH 2COOHHCOOHOHCH 3COOH>>>>2.C 6H 5OH ,CH 3COOH ,F 3CCOOH ,ClCH 2COOH ,C 2H 5OHF 3CCOOHClCH 2COOH CH 3COOH C 6H 5OHC 2H 5OH>>>>3.NO 2COOHCOOHNO 2COOHOHOHNO 2COOHCOOH NO 2COOH OHOH>>>>五、用化学方法区别下列化合物:1.乙醇,乙醛,乙酸2.甲酸,乙酸,丙二酸3.草酸,马来酸,丁二酸4,COOHCOOHCH 2OHOH2-羟基苯甲酸 苯甲酸 苯甲醇5.乙酰氯,乙酸酐,氯乙烷六、写出异丁酸和下列试剂作用的主要产物:1.Br 2/PCH 3CH 3CHCOOH Br /PCH 3CCOOH BrCH 32.LiAlH 4/H 2OCH 3CHCOOH CH 3LiAlH /H 2OCH 3CH 3CHCH 2OH 3.SOCl 2CH 3CH 3CHCOOH2CH 3CH 3CHCOCl4.(CH 3CO)2O/CH 3CH 3CHCOOH (CH 3CO)2O/CH 3CHCO)2CH 3(O +CH 3COOH5.PBr 3CH 3CH 3CHCOOH PBr (CH 3)2CHCOBr6.CH 3CH 2OH/H 2SO 4CH 3CH 3CHCOOH CH 3CH 2OH/H 2SO 4(CH 3)2CHCOOC 2H 57.NH 3/CH 3CH 3CHCOOHNH/(CH 3)2CHCONH 2七、分离下列混合物:CH 3CH 2COCH 2CH 3,CH 3CH 2CH 2CHO ,CH 3CH 2CH 2CH 2OH ,CH 3CH 2CH 2COOHCH 3CH 2CH 2COOH CH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3NaOHaqCH 2CH 2COONaCH 3CH 2CH 2COOHCH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO CH 3CH 2COCH 2CH 3CH 3CH 2CH 2CHSO 3NaOHH +,H OCH 3CH 2CH 2CHOCH 3CH 2COCH 2CH 3NH 23NHOHCH 3CH 2CCH 2CH 3NNHOHHClCH 3CH 2COCH 2CH 3CH 3CH 2CH 2CH 2OH八、写出下列化合物加热后生成的主要产物:1, 1,2-甲基-2-羟基丙酸2, 2,β-羟基丁酸3, 3,β-甲基-γ-羟基戊酸 4, 4,δ-羟基戊酸5, 5,乙二酸九、完成下列各反应式(写出主要产物或主要试剂)1.CH 3CH 2CN (A)H 2O,H +CH 3CH 2COOHCH 3CH 2COCl(B)SOCl2(G)H 2,Pd/BaSO 4CH 3CH 2CHO2CONH 2P 2O 5(C)NH 3NaOBr,NaOH CH 3CH 2NH 22.C=O1.C 2H 5MgBr 2H 3O OH C 2H 5PBr 31.Mg,(C H )2O 2CO 2,H 3OC 2H 5COOH3.ClC ClO2NH 3H 2NC NH 2OH 2N CNH 2OH 2NC ONHC NH 2O4.C=O24OH CNH O +OH COOHOO OC O C十、完成下列转变:1.CH 3CH 2COOH CH 3CH 2CH 2COOHCH 3CH 2COOH CH 3CH 2CH 2OHPBr CH 3CH 2CH 2BrCH 3CH 2CH 2CN H O +CH 3CH 2CH 2COOH2.CH 3CH 2CH 2COH CH 3CH 2COOHCH 3CH 2CH 2COOH 2CH 3CH 2CHCOOHCl-OHCH 3CH 2CHCOOHOHKMnO ,H +CH 3CH 2COOH3.2CH 2COOHCH 2COOHC=CH 2+HBrROORCH 2Br25)OCH 2MgBr122,H 3O4.CH 3COCH 2CH 2CBr(CH 3)2CH 3COCH 2CH 2C(CH 3)2COOHCH 3COCH 2CH 2CBr(CH 3)222+CH 3CCH 2CH 2CBr(CH 3)2O OMg,(C 2H 5)OOOCH 3C CH 3CH 2CH 2CMgBrCH 3122.H 3OCH 3COCH 2CH 2C(CH 3)2COOH十一、试写出下列反应的主要产物:6.(R )-2-溴丙酸 + (S)-2-丁醇 H +/⊿C 2H 5HCH 3OO CBr H CH 3H +HCH 3OHCH 3CH 2+CH 3H COOHBr7.CH 3CH 2COONa+CH 3CH 2CH 2COClCH 3CH 2CH 2CO O CCH 2CHCH 3O 8.CH 2CH 2C CO O+2C 2H 5OHC 2H 5OC O CH 2CH 2COC 2H 5O9.CH 3CONH 2+NaOBr-OHCH 3NH 210.CNCONH 2+P 2O 5十二、预测下列化合物在碱性条件下水解反应的速度顺序。
有机化学-第十三章

3.命名
取代基位号及名称加上母环的名称即为杂环化合物的 名称,例如:
课堂练习
1、命名下列杂环化合物: (1)
Br
(2)
CH3
N
O
NO2
2 – 硝基 – 4 –溴呋喃
3 – 甲基吡啶
杂环化合物的结构与芳香性
一、五元单杂环化合物的结构和芳香性
五元单杂环如呋喃、噻吩、吡咯,在结构上,都符 合 Huckel 的关于芳香性的规则,即环上原子共平面,彼 此以 σ 键相连接,四个碳原子各有一个电子在 p 轨道 上,杂原子有两个电子在 p 轨道上,这些 p 轨道都垂直 于σ 键所在的平面,相互重叠形成大 π 键——闭和的 共轭体系,π 电子数目为4n+2。结构如图所示:
亲电取代反应主要发生在 α 位上
二、定位规律
对五元杂环的亲电取代反应环上取代基有一定的定位 作用,以噻吩为例,说明如下: (1)当 α 位上有邻对位定位基(x)时,亲电试剂(E)主 要进入 5 位,3 位次之:
(2)当 α 位上有间定位基(Y)时,则 E 主要进入 4 位,少量进入 5 位:
近年发现不少天然存在的呋喃或氢化呋喃衍生物,具 有明显的生物活性或药用价值。例如,从重斑病感染的薯 类植物块根中分离的苦味成为含多种呋喃衍生物,如3-呋 喃甲酸,巴他酸(bacatic acid),番薯酮等
二、α-呋喃甲醛
1.来源与制备 呋喃甲醛最初是从米糠中得来,故俗称糠醛,因为这 些农副产品中都含有戊聚糖,在稀酸作用下水解成戊醛糖 ,再进一步脱水环化,得到糠醛:
4)综上所述,它们的芳香性由强到弱的顺序为:
二、六元单杂环化合物的结构和芳香性
吡啶具有六元单杂环的典型结构和苯的结构很相似, 是苯中的一个碳原子被氮原子代替,氮原子以 sp2 杂化 轨道和两个相邻碳原子的 sp2 杂化轨道形成两个 σ 键 。环上每个原子均有一个 p 轨道垂直于环的平面,组成 闭合的6电子大 π 轨道,因此,吡啶环也有芳香性。吡 啶的结构如图所示:
有机化学第13章 含氮化合物

CH2CN H2
Ni
6.霍夫曼降解反应
CH2CH2NH2
NaOCl,OHRCONH2
或NaOBr,OH-
RNH2
CH3(CH2)4CONH2 Br2+NaOH
CH3(CH2)4NH2
三、胺的物理性质
低级和中级脂肪胺为无色气体或液体,高级脂肪胺为固体, 芳香胺为高沸点的液体或固体。低级胺具有氨的气味或鱼腥味, 高级胺没有气味,芳香胺有特殊气味,并有较大的毒性。
根据分子中烃基的结构,可把胺分为脂肪胺和芳香胺 。例如:
铵盐(NH4)+X-分子中的四个氢原子被四个烃基取代 后的化合物,成为季铵盐,如[N(CH3)4+]I-。
根据分子中氨基的数目,可把胺分为一元胺、二元 胺和多元胺等。例如:
2.胺的命名法 构造简单的胺一般用衍生命名法命名,此时把氨看
作母体,烃基看作取代基。命名时省去“基”字。
2.硝基化合物的命名 硝基化合物命名与卤代烃相同,即以烃为母体,硝基为
取代基。如:CH3NO2(硝基甲烷)、CH3CH2CH2NO2 (硝基丙烷)、硝基苯等。
CH3CHCH3
NO 2
2-硝基丙烷
O2N
OH NO 2
NO 2
HOOC
NO 2
对硝基苯甲酸
O2N
CH 3 NO 2
NO 2
O2N
NO 2
NO 2
第二节 胺
一、胺的分类和命名 1.胺的分类 氨分子中的一个或几个氢原子被烃基取代物称为胺。氨
中一个、两个或三个氢原子被烃基取代生成的化合物分别称 为伯胺、仲胺和叔胺。也被称为一级胺、二级胺和三级胺。
注意: 伯、仲、叔胺的含义和醇、卤代烃等的伯、仲、叔含义不同
有机化学及实验教学大纲

化学,应用化学,化工,制药类各专业有机化学及实验教学大纲(试用)讲课学时:80 学时;实验学时:64学时大连理工大学化工学院化学系有机化学教研室2 0 0 9 年7 月有机化学教学大纲本大纲参考教育部化学与化工学科教学指导委员会于2006年拟订的化学专业《化学教学基本要求》制订。
讲课学时80。
章次目录第1章结构与性能概论4学时第10章醛酮醌6学时第2章分类及命名5学时第11章羧酸及其衍生物5学时第3章同分异构现象5学时第12章有机含氮化合物6学时第4章结构的表征 4 学时第13章杂环化合物5学时第5章饱和烃4学时第14章糖3学时第6章不饱和烃7学时第15章氨基酸蛋白质核酸2学时第7章芳香烃5学时第16章生物碱类脂萜及甾族化合物0学时第7章卤代烃6学时第17章有机合成基础4学时第9章醇酚醚5学时第18章绿色有机合成2学时教材:高占先主编有机化学第二版(国家精品教材—2008年)高等教育出版社2007年第1章结构与性能概论(4节4学时)纲目注释1.1 有机化合物和有机化学1 有机化合物与有机化学讲述定义,一般特性2 有机化学发展史讲述定义,发展史,有机化学与其它学科、国民经济关系1.2 分子结构1 学习方法2构造及构造式路易斯式、短线式、缩简式、键线式3共价键的形成甲键理论(杂化轨道,单、双、三键),分子轨道理论4 共价键的基本属性键长、键角、键能、键的极性、键的极化性5共振论简介简介共振论概念、用途,共振结构式书写规则,6 键的极性在链上的传递------诱导效应给电子基、拉电子基及其相对强度1.3 反应、试剂与反应控制1 有机反应中共价键断裂方式与反应类型反应过程共价键电子得失,均裂、异裂,共价键形成2 有机反应中间体的概念碳正离子、碳负离子、碳自由基的活泼性、构型3 试剂的分类亲电试剂、亲核试剂及其相对强度,亲电与亲核的相对性1.4 酸碱的概念和反应溶剂1酸碱理论共轭酸碱对,强度,酸碱的相对强度包括lewis酸碱与亲电、亲核试剂的关系2 溶剂的分类与溶剂化作用以界电常数、是否能形成氢键分类溶剂化作用,对化学反应的影响第2章分类及命名(5节5学时)2.1 分类方法和命名方法重点以碳架、官能团分类1 分类方法2 命名用介词8个介词的用法,基的命名,正、异、新,伯、仲、叔、季用法3普通命名法重点是普通命名法4俗名和简称2.2系统命名法重点三个规则2.3 烃的命名重点脂肪饱和链烃命名1开链烃命名,2 环烃命名,2.4烃衍生物的命名官能团做取代基、在链端、中间、任意位置四类1 烃衍生物命名(卤烃、硝基烃、氨基烃),2烃衍生物命名(含氧化合物),2.5 混合官能团化合物的命名运用三个规则第3章同分异构现象(5节5学时)3.1 构造异构和构象异构现象1 构造异构碳链异构、官能团位置异构、官能团异构、互变异构2链烷烃的构象重点乙烷、丁烷的构象3小环烷烃的结构及不稳定性重点环己烷、取代环己烷的构象3.2 几何异构现象1含双键化合物的几何异构顺/反、E/Z标记方法2含碳环化合物的顺反异构顺/反标记方法3.3 含手性中心化合物的对映异构现象1分子的手性与旋光性,手性概念、旋广度、比旋光度2手性分子的判断与表示,三种方法,重点费歇尔式,R/S、D/L标记3含两个手性碳分子异构现象,4含多个手性碳分子异构现象,3.4 非手性中心化合物的对映异构现象和构象对映体异构现象1含手型轴和手型面分子异构现象,1,2-丙二烯类,螺苯类2环状手性化合物,3.5 化合物的旋光性与对映体的拆分及合成1外消旋体的拆分分子结构决定旋光性重点化学拆分2不对称合成的概念第4章结构的表征(4节4学时)4.1 研究结构的基本程序4.2 红外光谱鉴定官能团4.3 核磁共振谱鉴定相邻碳原子及其相连的氢原子数目4.4 紫外光谱和质谱鉴定共轭体系、确定分子结构及相当分子质量第5章饱和烃(3节4学时)5.1 结构及链烷烃的物理性质给出各种骨架烷烃包括特殊的立方烷1同系列概念,同系列概念;2烷烃的物理性质,正构烷烃的物理常数变化规律5.2 烷烃的化学性质1 烷烃卤代反应氯代反应机理,卤代反应规律,碳自由基稳定性规律2卤代反应机理3 氧化反应4 裂解及异构反应5.3 环烷烃的性质1小环烃加成反应,不对称取代小环烷烃加成反应规律2环烷烃的氧化反应,3稠环烷烃及饱和烃来源。
化学史第十三章现代有机化学和高分子化学的发展

第十三章现代有机化学和高分子化学的发展人类利用有机化合物最初来自生物有机体,除了从天然产物提取一些有机物质外,进而还通过农产品的综合利用,生产某些有机制品。
例如用粮食、薯类发酵制酒精就是一个例子。
其后,煤又成为有机化学工业原料的重要来源。
因为随着钢铁工业的发展,炼焦工业随着兴起,从炼焦副产物煤焦油可以提取多种芳烃,于是在十九世纪中叶,煤焦油化学便发展起来,关于这一时期的有机化学,我们已在第九章中作了介绍。
焦炭进而又可以做成电石,二十世纪初,因为电力工业有了大发展并日益强大,于是又崛起了电石化学。
在现代有机化学工业中,电石是一种非常重要的原料。
早在1839年,美国人黑尔(Hare)曾将氰化汞与石灰混合,用电弧加热,所得产物遇水时产生出一种气体,这便是最早获得的电石和乙炔。
1862年,维勒将碳和锌钙合金一起加热,也制得了电石,并鉴定了电石遇水所产生的气体就是乙炔。
1892年,美国人威尔逊(T.L.Willson,1860——1915)发明了以廉价的石灰和煤为原料在电炉中加热制取电石的方法,美国并于1895年建立了世界上第一个电石工厂。
工业制造电石要在高温电炉中进行,这就需要有相当雄厚的电力资源。
十九世纪末,电力工业发展到一个新水平,从而使电石工业有了兴起与迅速发展的可能。
在电石工业发展的初期,电石仅用于制取照明用的乙炔。
以后虽出现一些电石和乙炔的新用途,例如电石可用来制造碳氮化钙,进而制造氨肥;乙炔的高温火焰可用于切割、焊接金属等,但应用仍有限,因此,美国在电石生产工业化后的初期,电石生产曾一度过剩。
到本世纪二十年代,随着合成氨工业出现,虽然用电石生产化肥的方法也逐渐被淘汰了,但这时由于人们已探索到乙炔可以制造醋酸、乙醇等多种基本化工原料,并实现了工业化,这样电石——乙炔的原料路线便开始形成,电石化学成了有机合成工业的基础之一,随之也出现了电石工业的大发展。
乙炔是一种性质活泼、分子结构简单的化合物。
高中化学复习-第十三章 第44讲高分子化合物 有机合成与推断

重难突破
课后作业
(5)酯基官能团只能通过酯化反应得到。( × ) 错因: 反应
,也能得到酯。
故知重温
重难突破
课后作业
2.教材改编题
(据人教选修五 P116 T2)聚碳酸酯
的透光率良
好,可制作车、船、飞机的挡风玻璃,以及眼镜镜片、光盘、唱片等。原来
合成聚碳酸酯的一种原料是用有毒的光气(又称碳酰氯 COCl2),现在改用绿
的取代。
②“――N△i→”或“催――化△→剂”为 □51 不饱和键 加氢反应的条件,包括
“ □52
、 □53 —C≡C— 、□54
”与 H2 的加成。
故知重温
重难突破
课后作业
③“浓―H―△2S→O4”是 a.醇
c.醇分子间脱水生成 □57 醚
□55 消去 H2O
的反应。
生成 □56 烯 烃;b.酯化反应;
小分子物质以 □11 加成 反应形式生成高分子化合物的反应,如合成
有机玻璃的方程式为:
故知重温
重难突破
课后作业
②缩聚反应
单体分子间 □13 缩合 脱去小分子(如 H2O、HX 等)生成高分子化合物的
反应。如乙二酸与乙二醇发生缩聚反应,其化学方程式为: nHOCH2—CH2OH+nHOOC—COOH催化剂
④“NaO―H△―醇→溶液”是卤代烃消去 □58 HX 生成 □59 不饱和
有机
物的反应条件。
⑤“NaO―H△―水→溶液”是 a.卤代烃 □60 水解 生成 □61 醇 ;b.酯类 □62 水解 反应的条件。
故知重温
重难突破
课后作业
⑥“稀―H―△2S→O4”是 a.酯类
□65 水解 。
□63 水解 ;b.糖类 □64 水解 ;c.油脂的酸性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NH2 霍夫曼彻底甲基化 Br2
Br
Br
NMe2 Me2NH -HBr
NMe OH
NMe O 颠茄酮
鲁宾逊的工作(1915年) CH2CHO + CH2CHO NH2CH3 + CH2COOH C O CH2COOH pH = 5
NMe O
1
颠茄酮
13 有机合成基础
魏尔泰思德的工作(1911年) O NMe 假石榴碱 NMe2 1)MeI 2)Ag2O 3) Br2 Br 1)Me2NH 2)MeI 3)Ag2O 4) H2 NMe OH -H2O NMe 1)MeI 2)Ag2O
+
CHCH 2CH2Br CH3
合成:
Br CH3CHCH 3
1) Mg,Et2O 2)
O
CH3
CHCH 2CH2OH CH3 CH3
PBr3
CH3
1) Mg,Et2O 2)CH3CO2Et
CH3
CHCH 2CH2CCH 2CH2CHCH 3 CH3 OH CH3
6
13.1 逆向合成分析
13.1.1切断的选择方法
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
1、考察取代基间的相互关系,寻找能实现正确定位的途径。 例如:
O a b b Br O Cl
O + a
Br
b法切断是错误: 异丙基是邻对位定位基, 乙酰基是间位定位基,异 丙基与乙酰基处于对位。
+ Cl
O
合成
+ Br CH3CHCH 3 AlCl3
H2N OH CO2H O2N OH CO2H OH H2N CO2H O2N O2N H2N OH CO2H OH CO2H OH CO2H
O
1) CH3CCH3 2) H2O
OH CH3CCH2CH2CH2CH3 CH3
一个环和一条链之间的连接处常常是个支化点,通常是切断处。例如:
O O
+
BrMg
O
合成:
CH3CH CH2 1) NBS 2) Mg BrMgCH2CH CH2
O 1) 2) H2O , CuI CH2CH CH2
5
13.1 逆向合成分析
CH(CH 3)2 CH3COCl AlCl3
CH(CH 3)2
COCH3
8
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
2、在定位规则许可下,最先切断最具吸电子性基团(即这个基团最后引入)。
例如:
O2N
NO2 OCH3 OCH3 + OCH3 Cl
合成:
CH3 (CH3)2SO4 OH CH3 (CH3)3CCl OCH3 AlCl3 CH3 HNO3 OCH3 C(CH3)3 O2N CH3 NO2 OCH3 C(CH3)3
13 有机合成基础
有机合成的目的:证明分子结构;为工业提供具有各种性能的分子;为理论工作提 供具有各种特殊性能的分子。
魏尔泰思德的工作(1901年) O 1) 肟 2) 还原 霍夫曼彻底甲基化 Br2 Br Br 喹啉 HBr NMe2 Me2NH 1) H2 2) Br 3) + NMe2 BrBr 1) KOH 2) NMe 1) HBr
CH3
NO2
合成:
CH3 KMnO4,H
CO2H HNO3 H2SO4
CO2H
NO2
10
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
4、许多基团,特别是一般方法难导入的基团(如-CN,-F,-I等)可通过重氮盐导入。
CO2H CN Cl FGI NH2 Cl NH2 NO2
例如:
Cl FGI
13.1.1 切断的选择方法
3、利用目标分子的对称性进行切断,使之切断为简单易得的原料。
对称炔烃:
合成: 对称醇:
OH
Br
HC CH NaNH 2 NaC CNa CH3CH2CH2CH2Br
+ NaC CNa
CH3CH2CH2CH2C CCH 2CH2CH2CH3
CH3CO2Et +
MgBr
O OH MgBr
O CH3CH CH2 H2O CH2 NBS Mg BrCH2CH CH2 BrMgCH2CH CH2 CH2 CHCCH 3 CuI
O CHCH 2CH2CH2C CH3
4
13.1 逆向合成分析
13.1.1 切断的选择方法
2、在支化点处进行切断。
OH O
+
BrMg
合成:
CH3CH2CH2CH2Br Mg CH3CH2CH2CH2MgBr
+NMe 2 OH
Br
瑞普的工作(1948年) Ni(CN) 2 4 HC CH 50℃,15atm
2应;合成设计和策略。
13.1 逆向合成分析 (Retrosynthetic Analysis)
TM 目标分子
特定目标分子(Target Molecule)的合成设计过程: 第一步:对整个分子的结构特征和已知的理化 性质进行收集、考察; 第二步:逆向合成(Retrosynthesis);
合成:
HNO3
NO2
NHCOCH 3
NH2 Cl
1) Fe,HCl 2) (CH3CO)2O
1) Cl2 2)H3O
CN Cl
CO2H Cl
1) NaNO2,HCl 2)KCN,CuCN
H3O
11
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
5、在芳环上引入 -NO2(或-NH2),在定位作用下或占据某一位置后,导入其它基团, 然后通过重氮盐可将-NO2(或-NH2)除去。 例如:
9
13.1 逆向合成分析
13.1.2 芳环上取代基切断顺序
3、官能团转化可能会改变基团的定位效应。
CO2H CH3 FGI CH3
例如:
合成:
Cl CH3
Cl2 FeCl3
Cl CH3
KMnO4,H
CO2H
Cl
CO2H CO2H
Cl
间硝基苯甲酸中-NO2 与 -CO2H为间位关系,故甲苯先氧化,后硝化。
环状对称醚可切断为对称二醇,对称二醇可切断为对称酯。
例如:
Ph Ph O
Ph Ph
Ph Ph OHHO
Ph Ph
EtO2C
CO2Et + PhMgBr
合成:
Br2 FeBr3
Br
Mg
MgBr
1) EtO2CCH2CH2CO2Et 2) H2O
Ph Ph OHHO
Ph Ph
H
Ph Ph O
Ph Ph
7
D E F G H I J 原料 A B C 合成子
第三步:选择最好的路线进行合成,增加试剂和反 应条件。
3
13.1 逆向合成分析
13.1.1 切断的选择方法
1、 在接近分子的中央处进行切断,使其断裂成合理的两部分 将分子切断成简单易得的原料,可采用下列两种方法:
O O
+
O 试 剂 为 试 剂 为 BrMg
