红磷和白磷的化学式
制备白磷的简易方法

制备白磷的简易方法白磷是一种常见的无机化合物,化学式为P4,通常以棒状或粉末的形式存在。
它具有非常高的活性,易燃且剧毒,因此制备白磷需要遵循严格的安全操作程序。
白磷的制备方法有多种,以下是其中一种简易方法的详细步骤:材料准备:1.一定量的红磷(化学式为P),可以从市场上购买到。
2.透明的玻璃釜和涡流式加热器。
3.水。
步骤1:准备工作1.将玻璃釜与涡流式加热器清洗干净,并确保无任何杂质。
2.清洗红磷,去除表面附着的其他物质。
步骤2:制备白磷1.将清洗好的红磷放入玻璃釜中。
2.将玻璃釜与涡流式加热器连接好。
3.打开涡流式加热器,加热玻璃釜中的红磷。
步骤3:升华红磷1.当红磷开始加热时,它会开始升华,即从固体转变为气体。
2.注意观察玻璃釜中产生的升华红磷的物态变化。
步骤4:冷凝白磷1.在玻璃釜的顶部设置冷凝装置,如冷凝管。
2.通过冷凝装置,将升华红磷冷却并转变为液体。
3.冷却后的红磷液体会进一步转变为白磷。
4.理论上,白磷会凝固成为白色的固体。
步骤5:收集白磷1.定期检查冷凝装置,确保收集到足够的白磷。
2.将收集到的白磷存储在安全的容器中,远离火源和其他易燃物。
请注意,制备白磷时必须非常小心,因为白磷具有剧毒和易燃的特性。
在操作过程中,必须遵循以下安全指导:1.确保操作环境通风良好,并佩戴化学防护手套、护目镜和防护衣。
2.避免与白磷接触皮肤,因为它会引起严重的化学烧伤。
3.注意火源,白磷会自燃,因此不要让其接触到明火。
4.在操作结束后,彻底清理和处理所有产生的废料和污染物。
总结:制备白磷是一项复杂且危险的操作,需要经验丰富的化学人员和专门的实验室设备。
上述方法仅供了解和了解白磷制备的基本步骤,并不适用于个人家庭实验室。
如果有制备白磷的需求,应寻求专业机构的支持和指导。
常见物质的化学名(俗名)及化学式
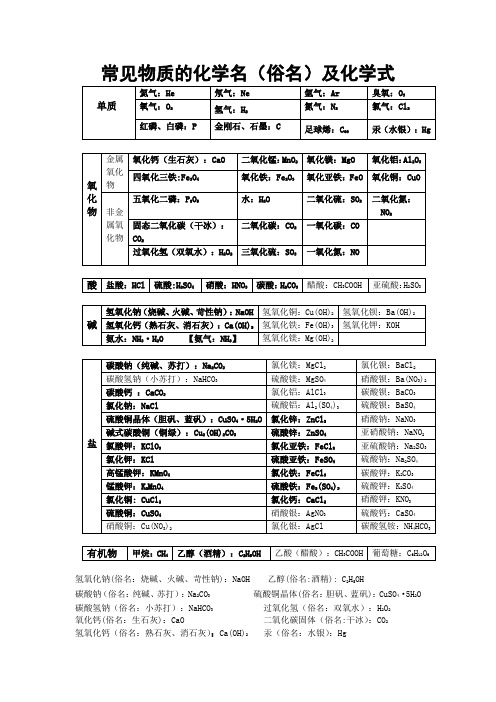
碱
氢氧化钠(烧碱、火碱、苛性钠):NaOH
氢氧化铜:Cu(OH)2
氢氧化钡:Ba(OH)2
氢氧化钙(熟石灰、消石灰):Ca(OH)2
氢氧化铁:Fe(OH)3
氢氧化钾:KOH
氨水:NH3·H2O【氨气:NH3】
氢氧化镁:Mg(OH)2
盐
碳酸钠(纯碱、苏打):Na2CO3
氯化镁:MgCl2
氧化亚铁:FeO
氧化铜:CuO
非金属氧化物
五氧化二磷:P化氮:NO2
固态二氧化碳(干冰):CO2
二氧化碳:CO2
一氧化碳:CO
过氧化氢(双氧水):H2O2
三氧化硫:SO3
一氧化氮:NO
酸
盐酸:HCl
硫酸:H2SO4
硝酸:HNO3
碳酸:H2CO3
醋酸:CH3COOH
硝酸钾:KNO3
硫酸铜:CuSO4
硝酸银:AgNO3
硫酸钙:CaSO4
硝酸铜:Cu(NO3)2
氯化银:AgCl
碳酸氢铵:NH4HCO3
有机物
甲烷:CH4
乙醇(酒精):C2H5OH
乙酸(醋酸):CH3COOH
葡萄糖:C6H12O6
氢氧化钠(俗名:烧碱、火碱、苛性钠):NaOH乙醇(俗名:酒精):C2H5OH
氯化钡:BaCl2
碳酸氢钠(小苏打):NaHCO3
硫酸镁:MgSO4
硝酸钡:Ba(NO3)2
碳酸钙:CaCO3
氯化铝:AlCl3
碳酸钡:BaCO3
氯化钠:NaCl
硫酸铝:Al2(SO4)3
硫酸钡:BaSO4
硫酸铜晶体(胆矾、蓝矾):CuSO4·5H2O
氯化锌:ZnCl2
红磷和白磷结构

红磷和白磷结构红磷和白磷是两种常见的磷的同素异形体,它们在结构和性质上有着显著的差异。
本文将分别介绍红磷和白磷的结构,并探讨它们的性质与应用。
一、红磷的结构红磷是一种由P4分子构成的固体物质,分子式为P4。
每个P4分子由四个磷原子通过共用电子对形成四边形结构,四个磷原子通过共用三对电子,形成了P-P键。
红磷的分子中有两种磷原子,一种是内磷原子,另一种是外磷原子。
内磷原子由三条共用键与其他三个磷原子相连,而外磷原子只与一个磷原子相连。
这种结构使得红磷的分子呈现出一种链状结构。
红磷的链状结构使得它具有一些特殊的性质。
首先,红磷是一种不导电的物质,因为链状结构限制了电子的运动。
其次,红磷在空气中不容易燃烧,因为链状结构使得红磷的分子之间的接触面积较小,不利于氧气与红磷分子的反应。
此外,红磷还具有一定的毒性,对人体和环境有一定的危害。
二、白磷的结构白磷是一种由P4分子构成的固体物质,分子式为P4。
与红磷不同的是,白磷的P4分子呈现出一种立方体结构。
每个P4分子由四个磷原子通过共用电子对形成四面体结构,四个磷原子通过共用三对电子,形成了P-P键。
白磷的分子中的四个磷原子相互之间的键长相等,分子中不存在内磷原子和外磷原子的区别。
白磷的立方体结构使得它具有一些特殊的性质。
首先,白磷是一种有毒的物质,可以通过吸入、接触或摄入进入人体,对人体的呼吸系统、肝脏、肾脏等造成损害。
其次,白磷在空气中极易燃烧,甚至可以与空气中的氧气直接反应。
当白磷遇到火源或高温时,会迅速燃烧,并释放出大量的烟雾和有毒气体。
三、红磷和白磷的性质与应用红磷和白磷的结构差异导致它们具有不同的性质和应用。
红磷由于不导电和不易燃烧的特性,常被用作阻燃剂,添加在塑料、橡胶、涂料等材料中,以提高材料的阻燃性能。
此外,红磷还可以用于制备农药、杀虫剂等化学制品。
白磷由于易燃和有毒的特性,应用范围相对较窄。
它可以用于制备磷酸盐肥料、磷酸盐化学品等。
此外,白磷还可以用于制备光电材料、军事炸药等。
红磷和白磷

红磷和白磷红磷和白磷:特性、应用和安全性评估引言红磷和白磷是两种常见的磷的同素异形体,它们在化学特性、应用领域和安全性方面存在差异。
本文将介绍红磷和白磷的特性、应用以及安全性评估。
一、红磷的特性红磷是一种橘红色或深红色的非金属元素,它的分子式为P4,在常温下呈固态。
红磷具有不溶于水的特性,并且在空气中相对稳定。
与白磷相比,红磷的熔点较高,这使得红磷在高温环境中具有很好的稳定性。
红磷具有多种同素异形体,其中最常见的是α-红磷。
α-红磷是一个由直角三角形构成的二维层状结构,这种结构的稳定性使得红磷在制备化合物时具有广泛的应用价值。
二、白磷的特性白磷是磷的另一种同素异形体,它在室温下呈固态。
白磷呈半透明或黄褐色,具有刺激性的气味。
与红磷不同,白磷高度反应性,易于燃烧。
白磷可以与空气中的氧气反应,产生氧化磷的白烟,因此白磷需要在水中储存或与其他物质混合以防止自燃。
白磷具有简单的分子结构,由四个磷原子组成的P4分子。
这种分子结构使得白磷在一定温度下能够转变为红磷,这个温度被称为转变温度。
因此,白磷可以通过加热并冷却来转变为红磷。
三、红磷和白磷的应用1. 红磷的应用红磷在很多工业和科学领域中都有广泛的应用。
例如,它被用作阻燃剂,可以防止塑料、纺织品和其他易燃材料的燃烧。
红磷也用于制备农药、杀虫剂和导热材料。
此外,红磷还可以用于生产火柴和磷酸,以及在光伏材料和电子器件中作为半导体材料。
2. 白磷的应用白磷的应用相对较少,主要是由于其高度反应性和易燃性。
尽管如此,白磷仍然具有一些特殊的应用。
例如,它被用作光发光剂,在荧光灯和LED中产生明亮的光。
此外,白磷还用于制备一些军事爆炸性物质,如炸药。
四、红磷和白磷的安全性评估1. 红磷的安全性评估红磷相对较为安全,不易燃烧,也不会与空气中的氧气反应。
但是,红磷在一些特定条件下仍有一定的危险性。
例如,当红磷粉末被细粉尘包裹时,它可能会在空气中自燃。
此外,红磷也有刺激性和腐蚀性,应在使用时注意避免直接接触皮肤和眼睛。
红磷与白磷有什么区别

红磷与白磷有什么区别?红磷(赤磷)为磷单质,与白磷互为同素异形体。
1、构成。
白磷分子是由四个磷原子构成的正四面体,键角为60°,每mol 白磷有1.5molP白磷-P键,化学式为P4。
红磷像这种只知道组成元素还不清楚构成的分子的原子数目的单质的化学式一律用元素符号表示。
于是红磷的化学式就写作P。
可确定两者的结构不同2、物理性质(颜色、气味、着火点)白磷为白色蜡状固体,遇光会逐渐变为淡黄色晶体(所以又称为黄磷),有大蒜的气味,有毒。
着火点很低,能自燃,在空气中发光。
红磷:紫红或略带棕色的无定形粉末,有光泽。
加热升华,但在43千帕压强下加热至590℃可熔融。
汽化后再凝华则得白磷。
有毒无气味,燃烧时产生白烟,烟有毒。
化学活动性比白磷差,不发磷光在常温下稳定,难与氧反应。
3、用途在工业上用白磷制备高纯度的磷酸。
利用白磷易燃产生烟(P2O5)和雾(P2O5与水蒸气形成H3PO4),在军事上常用来制烟幕弹。
还可用白磷制造红磷、三硫化四磷、有机磷酸酯、燃烧弹、杀鼠剂等。
红磷主要用于火柴盒的皮赞同白磷是以四个磷原子为顶点正三角椎型结构,所以白磷可以写成P4而红磷的结构比较复杂,至今仍无定论,有说法认为红磷是一种网状结构白磷和红磷可以发生相互转化白磷隔空加热到260摄氏度可以转化为红磷,红磷隔空加热到416摄氏度升华后再凝华可以得到白磷。
红磷红磷(赤磷)为磷单质,与白磷互为同素异形体。
紫红或略带棕色的无定形粉末,有光泽。
密度2.34克/厘米3,加热升华,但在43千帕压强下加热至590℃可熔融。
气化后再冷凝则得白磷。
难溶于水和CS2,乙醚、氨等,略溶于无水乙醇,有毒无气味,燃烧时产生白烟,烟有毒。
化学活动性比白磷差,不发磷光在常温下稳定,难与氧反应。
以还原性为主,200℃以上着火(约260℃)。
与卤素、硫反应时皆为还原剂。
用于生产安全火柴、有机磷农药、制磷青铜等。
1.物质的理化常数:国标编号41001CAS号7723-14-0中文名称红磷英文名称Phosphorus red别名赤磷分子式P4 外观与性状紫红色无定形粉末,无臭,具有金属光泽,暗处不发光分子量123.90 蒸汽压4357kPa(590℃)熔点590℃(4357kPa) 溶解性不溶于水、二硫化碳,微溶于无水乙醇,溶于碱液密度相对密度(水=1)2.20;相对密度(空气=1)4.77 稳定性稳定危险标记8(易燃固体) 主要用途用于制造火柴、农药,及用于有机合成2.对环境的影响:该物质对环境有害。
初三化学中红磷实验知识点(大全)

初三化学中红磷实验知识点(大全)初三化学中红磷实验知识点1、什么是红磷红磷是磷的一种同素异形体,因呈红色而得名。
红磷和白磷都是由磷元素组成,但是构成它们分子的原子排列不同。
2、红磷的化学式是什么白磷的分子式为P4,而红磷的结构更为复杂,一般用P来作为红磷的化学式。
3、红磷的性质1.物理性质外观与性状:紫红色无定形粉末,无臭,具有金属光泽,在暗处不发磷光,无臭。
不溶于水也不溶于二硫化碳以及乙醇等有机溶剂。
熔点(℃): 590(4357kPa)相对密度(水=1):2.20相对蒸汽密度( 空气=1): 4.77饱和蒸汽压(kPa):4357(590℃)引燃温度(℃):240溶解性:微溶于水,略溶于乙醇、碱液,不溶于二硫化碳爆炸下限%(V/V):48~64mg/m³2.化学性质稳定性,易燃,无毒,遇氯酸钾、高锰酸钾、过氧化物和其他氧化剂时可引起爆炸。
4、红磷的作用1.用于制造火柴、农药,及用于有机合成。
2.磷有黄磷和赤磷之分。
农药生产上采用黄磷(亦称白磷),它是制备一切含磷农药中间体的起始原料,与硫反应得到五硫化二磷,与氯反应得到三氯化磷,进而可得一系列其他含磷中间体。
此外,黄磷主要用于生产磷酸,少量用于生产赤磷和五氧化二磷,军事上用于制造燃烧弹、信号弹等,也用于生产磷铁合金以及医药、有机原料等行业。
3.用于制备半导体化合物及用作半导体材料掺杂剂。
本品可用于阻燃聚烃类、聚苯乙烯、聚酯、尼龙、聚碳酸酯、聚甲醛、环氧树脂、不饱和树脂、橡胶、纺织品等。
而对聚对苯二甲酸乙二醇酯、聚碳酸酯以及酚醛树脂等含氧高聚物的阻燃尤为有效。
与其他磷系阻燃剂相比,相同质量的红磷能产生更多的磷酸,磷酸即可覆盖于被阻燃材料表面,又可在材料表面加速脱水碳化,形成液膜和碳层可将外部的氧,挥发性可燃物和热与内部的高聚物基质隔开而使燃烧中断。
由于红磷在达到同样的阻燃要求时用量较小,而且红磷的熔点高,溶解性差,因而以红磷阻燃的高聚物的某些物理性能比用一般阻燃剂制得的同类高聚物要好。
白磷和红磷结构式

白磷和红磷结构式简介白磷和红磷是两种常见的磷的同素异形体。
它们在结构上有所不同,导致了它们的物理和化学性质差异很大。
本文将详细介绍白磷和红磷的结构式、性质以及在实际应用中的重要性。
白磷的结构式白磷的结构式为P4,其中含有四个磷原子。
白磷是一种无色透明、具有香味的固体。
它的分子式显示了四个磷原子以棱柱状结合在一起。
每个磷原子都与其他三个磷原子通过共价键相连,形成一个立体的结构。
白磷的结构可以用下面的式子表示:P4白磷的性质由于白磷的分子结构特殊,它具有许多独特的性质。
以下是白磷的一些主要性质:1.高活性:白磷在空气中极其活泼,容易与氧气反应生成氧化物。
因此,在空气中存放白磷会自燃。
2.低熔点:白磷的熔点相对较低,约为44.1摄氏度。
这使得白磷在常温下就可以熔化,并且可以以液体形式存在。
3.毒性:白磷对人体有较高毒性,接触白磷可以引起严重的化学灼伤。
由于其毒性,白磷在军事使用中用作燃烧弹和烟雾弹的成分。
红磷的结构式红磷的结构式为Pn。
红磷是白磷经过高温处理或加压转变得到的。
它的分子式显示了磷原子形成了一种不规则的链状结构。
红磷的结构可以用下面的式子表示:Pn红磷的性质红磷与白磷相比有着截然不同的性质。
以下是红磷的一些主要性质:1.低活性:相对于白磷,红磷在空气中不活泼。
它不容易被氧化,因此在常温下相对稳定。
2.非毒性:相比于白磷,红磷对人体的毒性较低。
它可以安全使用,并且在一些实际应用中具有重要作用。
3.用途广泛:红磷广泛用于生产火柴、化肥和农药等领域。
由于其低活性和较低的毒性,红磷在工业和农业中得到广泛应用。
白磷和红磷的比较白磷和红磷之间的区别不仅体现在它们的结构上,还反映在它们的性质和用途上。
下面是它们的比较:性质白磷红磷活性高低熔点44.1°C 高于红磷毒性高低用途军事、医药、研究等火柴、化肥、农药等从表中可以看出,白磷和红磷在活性、熔点、毒性和用途等方面存在很大差异。
白磷的应用由于白磷具有高活性和毒性,它在一些特殊领域得到应用。
白磷和红磷结构式

白磷和红磷结构式
白磷和红磷都是元素磷的同素异形体,它们的结构式可以用分子式P4表示。
不同的是,它们的形态、物理性质和化学性质都有所不同。
白磷是一种黄白色、透明或半透明的、略微有光泽的固体,密度为1.82g/cm³,熔点为44.15℃,沸点为280℃。
它是一种高度活泼的元素,容易与氧、硫、卤素等元素反应,是一种很强的氧化剂。
因此,白磷在空气中易被氧化而发生自燃,放出大量的热和烟雾,并散发出刺激性气味,对人体和环境都有很大的危害。
白磷的结构是分子式P4,其中四个磷原子通过共价键相互连接,形成一个四面体结构。
每个磷原子周围都有三个非共面的磷原子,形成了一个棱柱形的结构。
红磷是一种暗红色或紫红色的固体,密度为2.34g/cm³,熔点为597℃,沸点为约2800℃。
红磷在空气中不易被氧化,稳定性较高,不易自燃。
它是一种惰性的物质,需要较高的温度才能与其他物质反应,如在浓硫酸中加热后可生成白磷。
红磷的结构也是P4,但与白磷不同的是,磷原子的结构由棱柱形变为了环形结构。
四个磷原子通过共价键相互连接,形成一个稳定的六角环,环中的磷原子周围还分别连接了一个磷原子,形成了一个带有两端异构体结构的分子。
由于环形结构的稳定性比较高,所以红磷不容易发生自燃反应。
红磷和白磷的结构

红磷和白磷的结构
红磷和白磷是两种常见的磷元素的同素异形体,它们的结构和性质有很大的差异。
1. 白磷的结构:
白磷是一种分子结构,其分子式为P4。
白磷由四个磷原子组成,形成一个四面体结构。
在空气中,白磷会发生自发氧化反应而变成红磷。
白磷通常具有透明到黄色的外观,并且在常温下呈现为蜡状固体。
2. 红磷的结构:
红磷的结构与白磷截然不同。
红磷由聚合的磷链组成,链中的磷原子以共价键连接。
红磷的分子式可以表示为(P)n,其中n 代表链的长度。
红磷呈现为暗红色或棕色的粉末状物质,比白磷在空气中更稳定,不易自燃。
总的来说,红磷和白磷的结构差异在于白磷是分子结构,而红磷是聚合物结构。
红磷更加稳定,不会自燃,因此更常用于实际应用中。
白磷的化学式是什么

白磷的化学式是什么
白磷是一种磷的单质,化学式为P4。
外观为白色或浅黄色半透明性固体。
质软,冷时性脆,见光色变深。
暴露空气中在暗处产生绿色磷光和白烟。
白磷能直接与卤素、硫、金属等起作用,与硝酸生成磷酸,与氢氧化钠或氢氧化钾生成磷化氢及次磷酸钠或磷酸钾。
扩展资料
白磷与红磷是同素异形体,白磷分子是由四个磷原子构成的正四面体,键角为60°,每mol白磷有6molP-P键,有剧毒,它不溶于水,易溶于CS2。
化学式为P4。
而红磷的.化学式为P,红磷难溶于水和CS2。
化学九年级上册化学式总结

化学九年级上册化学式总结一、单质的化学式。
1. 金属单质。
- 铁:Fe。
- 铜:Cu。
- 铝:Al。
- 镁:Mg。
- 锌:Zn。
- 银:Ag。
- 金:Au等。
2. 固态非金属单质。
- 碳(石墨、金刚石):C。
- 磷(白磷、红磷):P。
- 硫:S。
3. 稀有气体单质。
- 氦气:He。
- 氖气:Ne。
- 氩气:Ar。
4. 气态非金属单质(双原子分子)- 氢气:H₂。
- 氧气:O₂。
- 氮气:N₂。
- 氯气:Cl₂。
二、化合物的化学式。
1. 氧化物。
- 水:H₂O。
- 二氧化碳:CO₂。
- 一氧化碳:CO。
- 二氧化硫:SO₂。
- 三氧化硫:SO₃。
- 五氧化二磷:P₂O₅。
- 氧化镁:MgO。
- 氧化铜:CuO。
- 氧化铁(三氧化二铁):Fe₂O₃(铁锈的主要成分)- 四氧化三铁:Fe₃O₄(磁铁矿的主要成分)- 氧化铝:Al₂O₃。
- 二氧化锰:MnO₂。
2. 酸。
- 盐酸:HCl(氯化氢气体的水溶液)- 硝酸:HNO₃。
- 碳酸:H₂CO₃。
3. 碱。
- 氢氧化钠:NaOH(俗称烧碱、火碱、苛性钠)- 氢氧化钙:Ca(OH)₂(俗称熟石灰、消石灰,其水溶液俗称石灰水)- 氢氧化钾:KOH。
- 氢氧化镁:Mg(OH)₂。
- 氢氧化铝:Al(OH)₃。
- 氢氧化铁:Fe(OH)₃(红褐色沉淀)- 氢氧化铜:Cu(OH)₂(蓝色沉淀)4. 盐。
- 氯化钠:NaCl(俗称食盐)- 碳酸钠:Na₂CO₃(俗称纯碱、苏打)- 碳酸氢钠:NaHCO₃(俗称小苏打)- 碳酸钙:CaCO₃(大理石、石灰石的主要成分)- 硫酸铜:CuSO₄(硫酸铜晶体为CuSO₄·5H₂O,俗称胆矾、蓝矾)- 氯化铁:FeCl₃。
- 氯化亚铁:FeCl₂。
- 硫酸亚铁:FeSO₄。
- 氯化钾:KCl。
- 硫酸锌:ZnSO₄。
- 硝酸银:AgNO₃。
红磷与白磷有什么区别

红磷与白磷有什么区别?红磷(赤磷)为磷单质,与白磷互为同素异形体。
一、组成。
白磷分子是由四个磷原子组成的正四面体,键角为60°,每mol 白磷有白磷-P键,化学式为P4。
红磷像这种只明白组成元素还不清楚组成的分子的原子数量的单质的化学式一概用元素符号表示。
于是红磷的化学式就写作P。
可确信二者的结构不同二、物理性质(颜色、气味、着火点)白磷为白色蜡状固体,遇光会慢慢变成淡黄色晶体(因此又称为黄磷),有大蒜的气味,有毒。
着火点很低,能自燃,在空气中发光。
红磷:紫红或略带棕色的无定形粉末,有光泽。
加热升华,但在43千帕压强下加热至590℃可熔融。
汽化后再凝华那么得白磷。
有毒无气味,燃烧时产生白烟,烟有毒。
化学活动性比白磷差,不发磷光在常温下稳固,难与氧反映。
3、用途在工业上用白磷制备高纯度的磷酸。
利用白磷易燃产生烟(P2O5)和雾(P2O5与水蒸气形成H3PO4),在军事上经常使用来制烟幕弹。
还可用白磷制造红磷、三硫化四磷、有机磷酸酯、燃烧弹、杀鼠剂等。
红磷要紧用于火柴盒的皮赞同白磷是以四个磷原子为极点正三角椎型结构,因此白磷能够写成P4而红磷的结构比较复杂,至今仍无定论,有说法以为红磷是一种网状结构白磷和红磷能够发生彼此转化白磷隔空加热到260摄氏度能够转化为红磷,红磷隔空加热到416摄氏度升华后再凝华能够取得白磷。
红磷红磷(赤磷)为磷单质,与白磷互为同素异形体。
紫红或略带棕色的无定形粉末,有光泽。
密度克/厘米3,加热升华,但在43千帕压强下加热至590℃可熔融。
气化后再冷凝那么得白磷。
难溶于水和CS2,乙醚、氨等,略溶于无水乙醇,有毒无气味,燃烧时产生白烟,烟有毒。
化学活动性比白磷差,不发磷光在常温下稳固,难与氧反映。
以还原性为主,200℃以上着火(约260℃)。
与卤素、硫反映时皆为还原剂。
用于生产平安火柴、有机磷农药、制磷青铜等。
1.物质的理化常数:国标编号 41001CAS号 7723-14-0中文名称红磷英文名称 Phosphorus red别名赤磷分子式 P4 外观与性状紫红色无定形粉末,无臭,具有金属光泽,暗处不发光分子量蒸汽压 4357kPa(590℃)熔点 590℃(4357kPa) 溶解性不溶于水、二硫化碳,微溶于无水乙醇,溶于碱液密度相对密度(水=1);相对密度(空气=1) 稳固性稳固危险标记 8(易燃固体) 要紧用途用于制造火柴、农药,及用于有机合成2.对环境的阻碍:该物质对环境有害。
红磷的化学式

红磷的化学式
红磷,也叫作白磷,是一种非金属元素,化学符号为P,原子序数为15,其化学式为P4。
红磷是存在于大自然中的一种元素,属于化学周期表第五族元素。
红磷具有较高的化学活性,能够与许多其他元素发生反应,常被用于制备消防安全设备、化学肥料、小型爆炸物品等。
红磷分子中包含四个P原子,这些原子之间通过共价键连接在一起,形成一个六面体结构。
每个P原子周围都有三个其他P原子,在共价键的连接下形成一个三维结构,因此红磷是一种多晶体。
红磷的颜色通常呈灰色或白色,但在白天可以呈现出微光,甚至会发光。
红磷分为红磷和白磷两种,其中红磷是不活性的,而白磷则具有极强的反应性。
红磷的熔点在600摄氏度左右,比白磷的熔点要高出很多。
红磷常常被用于生产化学肥料和挥发性液体,还可作为密封和胶合剂的组成部分。
此外,在制备火药和烟雾炸药时,红磷也是重要材料之一。
红磷的主要化学性质是活泼。
红磷可以和氧气快速反应,产生氧化磷。
在比较低的温度下,红磷对水和其他一些液体具有亲和力,可以形成高度反应性的化合物。
当红磷受热时,它会产生气体,其中包括磷化氢。
磷化氢具有可燃性,app制备红磷时需要非常小心,避免引起爆炸事故。
在生物学中,磷是一种关键元素,与DNA、RNA、骨骼和其他生物分子的
形成相关。
因此,红磷在生物学领域具有广泛的应用,例如在DNA研究和医学治疗中。
总的来说,红磷是一种非常有用的化学物质,它在生产中具有广泛的应用。
然而,由于其高度反应性和易燃性,app必须始终注意安全措施,以避免意外
发生。
红磷的化学式

红磷的化学式
红磷的化学式为P。
红磷是磷的同素异形体之一,磷位于元素周期表第15位。
红磷是紫红或略带棕色的无定形粉末,有光泽。
红磷密度2.34g/cm3,加热升华,但在4300KPa压强下加热至590℃可熔融。
汽化后再凝华则得白磷。
难溶于水和CS2,乙醚、氨等,略溶于无水乙醇,无毒无气味,燃烧时产生白烟(注:白烟为五氧化二磷),烟有毒。
在416℃时红磷升华,它的蒸气冷却后变成白磷。
能燃烧与氧气生成十氧化四磷,五氧化二磷是其系数约分而来,在自然界不存在,红磷都易与卤素化合,生成三卤化磷或五卤化磷。
加热至200℃则着火燃烧生成十氧化四磷。
在有氯环境中加热时亦会燃烧。
遇氯酸钾、高锰酸钾、过氧化物和其他氧化剂时可引起爆炸。
易燃、无毒。
常温下不与卤素反应,在空气中不自燃。
不具毒性。
