过渡金属元素
第10章过渡金属元素

例:八面体配合物[Cr(NH3)2(H2O)2Br2]+
例:顺-[CoCl2(en)2]+
动植物体内含有许多具有旋光活性的有机 化合物,这类配合物对映体在生物体内的生理 功能有极大的差异。例如存在于烟草中左旋尼 古丁的毒性要比人工合成出来的右旋尼古丁毒 性大的多。旋光异构体的拆分及合成研究是目 前研究热点之一。
配合物的化学组成相同,而配体在空间的 排列位置不同而产生异构现象称为的立体异 构。立体异构又称为空间异构。立体异构又分 为几何异构和旋光(对映)异构两类。
1.几何异构
几何异构中最常见是顺反异构。 如四配位的MA2B2四边形和六配位的MA2B4 八面体中,均存在顺反异构现象。
例:平面四边形配合物[PtCl2(NH3)2]
(3)由杂化类型确定配合物空间构型(参 照下表)
杂化 类型
空间 构型
sp
直线 型
sp2
三角 形
sp3
正四 面体
dsp2
正方 形
sp3d dsp3
三角 双锥
sp3d2 d2sp3
正八 面体
(4)由杂化类型确定是内轨型还是外轨型 (只要有(n-1)d轨道参与杂化就是内轨型配合物, 否则为外轨型配合物),成单电子数为0或1等 低电子数的为低自旋配合物,成单电子数多的 (一般>2)为高自旋配合物。
3.不能解释[Cu(H2O)4]2+的正方形构形等。 4.很难满意地解释夹心型配合物,如二茂 铁、二苯铬等的结构。
10.3 配合物的晶体场理论
10.3.1 基本要点 10.3.2 晶体场中的能级分裂 10.3.3 晶体场中的d电子排布
—高自旋与低自旋 10.3.4 晶体场稳定化能 10.3.5 晶体场理论的应用
元素周期表中的过渡金属元素及其性质研究

地壳中过渡金属元素的种类和分布
地壳中过渡金属元素的开采难度和成本
地壳中过渡金属元素的应用领域和价值
地壳中过渡金属元素的丰度排名
过渡金属元素在自然界中的分布:主要存在于地壳中,如铁、铜、锌等
开采方法:根据元素性质和矿床类型选择合适的开采方法,如露天开采、地下开采等
镍的化合物:硫酸镍、氯化镍、硝酸镍等
Hale Waihona Puke 铜元素:原子序数29,位于元素周期表第四周期
铜的物理性质:红色金属,具有良好的导电性和导热性
铜的化学性质:在空气中稳定,不易氧化,但在高温下可与氧气反应生成氧化铜
铜的化合物:包括氧化铜(CuO)、硫酸铜(CuSO4)、氯化铜(CuCl2)等,具有不同的物理和化学性质
汇报人:
元素周期表中的过渡金属元素及其性质研究
目录
添加目录标题
过渡金属元素概述
过渡金属元素的物理性质
过渡金属元素的化学性质
常见过渡金属元素及其化合物
过渡金属元素在自然界中的存在和开采
添加章节标题
过渡金属元素概述
过渡金属元素位于周期表的第4、5、6周期
过渡金属元素包括铁、钴、镍、铜、锌、钼、钨、钽、铌、钌、铑、钯、银、金、铂、汞等
过渡金属元素在工业上广泛应用,如铁、铜、铝等
过渡金属元素在生物体内具有重要作用,如铁、锌等
过渡金属元素在环保领域也有广泛应用,如铬、锰等
过渡金属元素在化学实验中常用作催化剂,如镍、铂等
过渡金属元素的物理性质
过渡金属元素的原子结构:原子半径、电离能、电子亲和能等
电子排布:过渡金属元素的电子排布规律和特点
原子结构对物理性质的影响:如熔点、沸点、导电性等
元素周期表中的内过渡金属元素特性

元素周期表中的内过渡金属元素特性元素周期表是化学家们用来分类和组织化学元素的一张表格。
通过对元素周期表的研究,科学家们逐渐了解了不同元素的特性和行为。
在元素周期表中,内过渡金属元素是一类重要的元素,具有独特的特点和性质。
本文将介绍内过渡金属元素的特性,包括电子结构、化学反应和应用领域。
一、电子结构内过渡金属元素是指周期表中d区的元素,包括镧系和锕系元素。
它们的电子结构具有一定的特点,主要体现在d轨道的使用上。
内过渡金属元素的轨道层级为(n-2)f^(1-14)(n-1)d^0-10ns^0-2,其中n表示元素所在的主能级。
由于f轨道占据在d轨道之前,内过渡金属元素的电子结构复杂多样,使其具有丰富的化学行为和多种配位方式。
二、化学反应内过渡金属元素在化学反应中表现出独特的特性。
首先,内过渡金属元素的化合价较高,常见的化合价为+2和+3。
内过渡金属元素可以通过氧化还原反应改变氧化态,以适应不同环境的要求。
此外,内过渡金属元素还可以形成不同的配合物,与其他原子或离子形成稳定的配位化合物。
内过渡金属元素也具有良好的催化性能。
许多内过渡金属元素在化学反应中作为催化剂发挥重要作用。
例如,铁、铂和铑等元素被广泛应用于氢气的加氢反应和有机物的氧化反应。
内过渡金属元素的催化性能主要与其电子结构和配位方式有关。
三、应用领域内过渡金属元素具有广泛的应用领域,主要体现在以下几个方面。
1. 金属合金:内过渡金属元素具有良好的强度和耐腐蚀性,在金属合金中起到增加硬度和耐久性的作用。
例如,钛合金中的钛是一种重要的内过渡金属元素,具有轻质、高强度和耐热性的特点,被广泛应用于航空航天工业和生物医学领域。
2. 催化剂:如前所述,内过渡金属元素在化学反应中具有良好的催化性能。
它们可以提高反应速率、降低反应温度,并在合成化学、能源转化和环境保护等领域起到重要作用。
3. 发光材料:内过渡金属元素可以作为荧光粉等发光材料的组成部分。
例如,铑和镧被广泛用于制备LED、荧光灯等发光材料,具有高亮度和长寿命的特点。
过渡金属元素分解

其中:ΦA / V
Cr2O72 -/ Cr3+ MnO4- / Mn2+ FeO42- / Fe2+ NiO42- / Ni2+
1.33 1.49 1.84 1.75
(三)氧化态的稳定性
2.同一族
高稳氧 氧定化 化性性 态↗↘
Ⅵ
CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
Ⅶ
MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
低稳 氧定 化性 态
↗
与ⅢA ~ ⅤA 族规律相反!
反映过渡金属元素 5d, 6d 电子参与成键倾向↑
原因:
(1)(n-1)d 电子电离能
n ↗, (n-1)d 电子电离倾向↘ (d 电子云发散)
(2)形成 d-p 键能力:
3d < 4d < 5d
稳定性: 氧化性:
CrO42- < MoO42- < WO42-
二、氧化态
(一)同一元素,多种氧化态
原因:(n-1)d 与 ns 轨道能量相近,部分(n-1)d 电子参与成键。
例:Mn 2 ~ +7 均出现,主要+2,+3,+4,+6,+7. Fe 2 ~ +6 均出现,主要+2,+3,+6.
(二)最高氧化态
ⅢB ~ ⅦB 族:最高氧化态 == 族数
例: Sc Cr Mn
24Cr
3d54s1
不是 3d44s2
41Nb 铌
4d45s1
不是 4d35s2
42Mo
4d55s1
不是 4d45s2
元素周期表中的过渡金属和内过渡金属

其他化合物的性质
这些化合物具有独特的物理和化 学性质,如光学活性、磁有序性 和导电性等。
其他化合物的应用
在化学工业、材料科学和新能源 领域中,这些化合物具有广泛的 应用前景,如太阳能电池、磁性 材料和药物等。
06
过渡金属和内过渡金属的工业应用
在冶金工业中的应用
钢铁生产
过渡金属如铁、钴、镍等是钢铁生产中的重 要元素,可以提高钢材的强度、韧性和耐腐 蚀性。
总结词
包括铜、银、金等元素,具有稳定的价电子构型和良好的导电性。
详细描述
第一过渡系列元素位于周期表的第4至第12族,具有稳定的价电子构型,表现出良好的导电性和延展 性。这些元素在工业和日常生活中有广泛应用,如铜用于电线、管道和硬币制造,金则用于珠宝和投 资。
第二过渡系列
总结词
包括铁、钴、镍等元素,具有磁性和催化活性。
有色金属冶炼
铜、铝、锌等有色金属的冶炼过程中,过渡 金属作为杂质需要进行控制和去除。
在化学工业中的应用
催化剂
过渡金属化合物如铂、钯、铑等广泛应用于各种化学反应的催化,如加氢反应、氧化反 应等。
颜料与染料
某些过渡金属化合物具有特殊的颜色和稳定性,用于制造颜料和染料。
在其他领域的应用
磁性材料
过渡金属如铁、钴、镍等及其合金具有优异 的磁性能,用于制造磁性材料和器件。
硫化物和硒化物的性质
硫化物和硒化物的应用
在电子工业、光学材料和催化领域中 ,硫化物和硒化物具有重要应用,如 半导体材料、红外探测器和催化剂等 。
这些化合物具有不同的物理和化学性 质,如颜色、熔点、导电性和磁性等 。
其他化合物
其他化合物的种类
除了氧化物和硫化物/硒化物外, 过渡金属和内过渡金属还可以形 成多种其他类型的化合物,如卤 化物、络合物和氢化物等。
元素周期表中的过渡金属与配位化合物实验

过渡金属在元素周期表中的位置
过渡金属位于元素周期表的第4、5、6周期 过渡金属包括铁、钴、镍、铜、锌、汞等元素 过渡金属具有特殊的化学性质和物理性质 过渡金属在配位化合物实验中具有重要作用
过渡金属的电子构型与化学性质
电子构型:过渡金属元素的电子构 型通常为d或f电子构型
配位化合物:过渡金属元素容易形 成配位化合物,如Fe(CO)5、 Ni(CO)4等
配位化合物的稳定 性与反应性:对于 理解化学反应机理 具有重要意义
实验操作与注意 事项
实验材料与试剂准备
实验仪器:如烧杯、试管、 滴定管等
配 位 化 合 物 : 如 E DTA 、 DT PA 等
过渡金属:如铁、铜、镍等
实验试剂:如盐酸、硫酸、 氢氧化钠等
防护用品:如手套、口罩、 护目镜等
实验记录本:记录实验过程 和数据
实验结果在生产生活中的应用
过渡金属与配位化合物在工业生产中的应用 实验结果在环境保护中的应用 实验结果在医疗领域的应用 实验结果在材料科学中的应用
实验结果对科学研究的启示
过渡金属与配位化合物的性质和结构 实验结果的应用:如催化剂、药物、材料等领域 实验结果的理论解释:如电子结构、配位化学等 实验结果的创新性:如新化合物的发现、新反应的发现等 实验结果的局限性:如实验条件、实验方法等 实验结果的未来研究方向:如新化合内外学者正在积极开 展新型配位化合物的合成与应用研 究
添加标题
添加标题
添加标题
添加标题
应用领域:在材料科学、生物医药、 环境科学等领域具有广泛的应用前 景
挑战与机遇:面临合成难度大、应 用效果不稳定等挑战,同时也存在 巨大的市场机遇和发展空间
过渡金属在新能源领域的应用前景
元素周期表中的过渡金属

医学应用
01
02
03
药物合成
过渡金属在药物合成中发 挥重要作用,如铂、钴、 镍等金属的配合物用于治 疗癌症的药物研发。
诊断试剂
某些过渡金属离子如铁、 铜、锌等参与生物体内的 代谢过程,可作为生物标 记物用于诊断疾病。
医疗器械
一些具有特殊物理和化学 性质的过渡金属及其合金 用于制造医疗器械,如手 术刀具、植入物等。
环境治理
污水处理
过渡金属化合物在污水处理中具有重要作用 ,能够有效去除水中的重金属离子和有害物 质,保障水质安全。
大气治理
利用过渡金属化合物去除大气中的有害气体 ,如二氧化硫、氮氧化物等,有助于改善空
气质量。
谢谢您的聆听
THANKS
元素周期表中的过渡金属
CONTENTS
• 过渡金属的概述 • 过渡金属的化学性质 • 过渡金属的物理性质 • 过渡金属的应用 • 过渡金属的发现与开采 • 过渡金属的未来发展
01
过渡金属的概述
定义与特性
定义
过渡金属是元素周期表中d区和ds区 的金属元素,它们具有未填满的d电 子壳层。
特性
过渡金属具有多种氧化态,可以形成 多种复杂的化合物,具有丰富的化学 性质和物理性质。
功能材料
过渡金属化合物在磁性、光学、电学 等方面具有优异性能,可用于信息存 储、光电器件、传感器等领域。
新能源开发
燃料电池催化剂
过渡金属(如铂、钯等)具有良好的催化性能,是燃料电池中重要的催化剂,有助于提 高燃料电池的效率和稳定性。
太阳能电池
过渡金属化合物在太阳能转换方面具有潜在应用价值,能够提高太阳能电池的光电转换 效率和稳定性。
详细描述
过渡金属具有多种氧化态,这是因为它们的d电子可以轻易地参与成键,形成不 同的价态。此外,由于d电子的存在,使得相邻氧化态间的电离能差较小,这使 得过渡金属在化学反应中容易发生氧化还原反应。
元素周期表中的过渡金属

元素周期表中的过渡金属元素周期表是描述元素的分类和性质的重要工具。
其中,过渡金属是指在周期表中位于主族元素和稀土金属之间的一组元素。
它们具有一系列独特的性质和应用,对我们的日常生活和科学领域都有重要影响。
过渡金属的定义在元素周期表中,过渡金属通常被定义为具有部分填充的d轨道的元素。
它们的原子结构特点是d电子层不是满电子层,即d轨道中存在未配对或未填满的电子。
这使得过渡金属具有许多独特的性质,例如可变的氧化态、良好的导电性和热导性等。
典型的过渡金属元素过渡金属包括铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、铜(Cu)、锌(Zn)等。
它们具有共同的特征,如高熔点、高密度、良好的导电性和热导性等。
这些元素在自然界中广泛存在,且大多数用途广泛。
性质和应用过渡金属具有许多重要的物理和化学性质,为它们带来了广泛的应用。
以下是一些常见的例子:1. 催化剂:过渡金属广泛用于催化反应,例如铂(Pt)催化剂在汽车尾气净化和氢气燃料电池中起着重要作用。
2. 磁性材料:铁、钴和镍等过渡金属是制造磁性材料的重要成分。
它们被广泛应用于电子设备、电动机和磁存储介质等领域。
3. 合金:过渡金属在合金制备中起着关键作用。
例如,钢是由铁和碳以及其他过渡金属组成的合金,拥有优异的强度和耐腐蚀性能。
4. 荧光材料:某些过渡金属离子在激发条件下能够发出明亮的荧光,例如钐(Sm)和铕(Eu)等离子常用于荧光显示器和照明装置中。
5. 生物学应用:许多过渡金属离子在生物体内具有重要的生理功能,如铁在血红蛋白中的运输氧气。
过渡金属的周期性和趋势过渡金属元素在元素周期表中按照原子序数的增加排列。
它们的性质和趋势在一定程度上与原子序数的变化相吻合,但也存在一些异常现象。
1. 电子结构:过渡金属的电子结构具有一定的规律性。
它们的原子结构中的d电子数目逐渐增加,从Sc(21)到Cu(29)的元素具有各自特定的电子组态。
2. 原子半径:在过渡金属族中,原子半径从左到右逐渐减小。
过渡金属元素

2. 羰基簇合物 (分子中含有M—M键的化合物)
过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。 双核和多核羰基簇合物中羰基与金属原子的结合方式:
(1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO
与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
第7章 过渡金属元素
表7-1 过渡金属元素(d 区元素除第七周期外, 共23种)
周期\族
四
IIIB
Sc
IVB
Ti
VB
Ⅴ
VIB
Cr
VIIB
Mn Fe
VIII
Co Ni
五
六
Y
La
Zr
Hf
104Rf
Nb
Ta
105Db
Mo
W
106Sg
Tc
Re
107Bh
Ru
Os
108Hs
Rh
Ir
109Mt
Pd
Pt
110Uun
近时, 两个Re3+的dz2轨道以
“ 头碰头 ”重叠形成σ键; 两 个Re3+ 的dxz轨道、dyz轨道以
“ 肩并肩 ”重叠形成两个 d—d
π键; 而两个Re3+ 的dxy轨道以 “面对面”重叠形成δ键,说明 Re与Re之间形成四重键。
26
Re 5d56s2
-3e
Re3+ 5d4
dsp2杂化
5d4 (dsp2)0( dsp2)0( dsp2)0( dsp2)0 σ σ σ σ (3px)2 (3px)2 (3px)2 (3px)2 Cl Cl Cl Cl
过渡金属的配位数

过渡金属的配位数一、过渡金属的基本概念过渡金属,又称过渡元素,是一类在周期表中位于d区元素的统称。
它们具有不完全充满的d轨道,因此表现出较强的金属性。
过渡金属广泛应用于催化剂、磁性材料、合金等领域。
二、过渡金属的配位数定义与分类过渡金属的配位数是指一个过渡金属原子与周围配体原子形成的化学键的数量。
根据配体与过渡金属原子之间的键的复杂程度,过渡金属配位数可以分为简单配位数和复杂配位数。
1.简单配位数简单配位数指的是过渡金属原子与周围配体原子通过单一化学键相连的情况。
在这种情况下,过渡金属原子与配体原子之间的相互作用较弱,配位数较低。
2.复杂配位数复杂配位数是指过渡金属原子与周围配体原子通过多种化学键(如单键、双键、三键等)相连的情况。
在这种情况下,过渡金属原子与配体原子之间的相互作用较强,配位数较高。
三、过渡金属配位数的计算方法过渡金属配位数的计算方法主要有以下几种:1.配体电子对数法:根据配体的电子构型,计算其提供的电子对数,从而确定配位数。
2.配体原子数法:统计配体中与过渡金属原子形成化学键的原子数量,即为配位数。
3.晶体场理论法:根据晶体场理论,分析过渡金属原子在晶体中的环境,确定其配位数。
四、过渡金属配位数在实际应用中的重要性过渡金属配位数在实际应用中具有重要意义,它直接影响着过渡金属化合物的性质和功能。
例如,在催化剂领域,过渡金属配位数会影响催化剂的活性、选择性和稳定性;在磁性材料领域,过渡金属配位数会影响材料的磁性性能等。
五、常见过渡金属化合物的配位数举例1.铁(Fe)催化剂:常见的铁催化剂有Fe-EDTA(配位数6)、Fe-CN(配位数4)等。
2.钴(Co)催化剂:常见的钴催化剂有Co-PN(配位数6)、Co-BIPY (配位数6)等。
六、总结与展望过渡金属的配位数研究对于理解过渡金属化合物的性质和功能具有重要意义。
随着科学技术的不断发展,过渡金属配位数的研究将不断深入,为指导实际应用提供理论依据。
过渡金属元素介绍

8.4~8.0
8.0~3.0
颜色 无
无
黄
红棕
[H V O ] H
4- H
2 10 28
V O VO H 2 5 (s)
+ 2 (aq)
pH
3.0~2.0 H+反极化 2.0~1.0
1.0
作用
颜色
红棕
红棕
黄
要求记忆:
VO 多钒酸盐, 且聚合度↑ V O ↓ VO 3- H
4
H
H
+
2 5
2
强碱性溶液
三、钒的化合物
V 的价电子构型为:4s23d3,主要化合价 +2、+3、+4、+5最常见的是+5,存在形 式VO2+ 、 VO43-
1、钒的氧化物
VO(黑色)、V2O3(黑色)、VO2(深兰色)、V2O5(深红色)
碱性
两性
两性偏酸
V2O5制备
①、2NH4VO3==V2O5+2NH3↑+H2O↑ (△)
nbta钒的主要用途在于冶炼特种钢钒钢具有很大的强度弹性以及优良的抗磨和抗冲击的性能用于制造结构钢弹簧钢装甲钢和钢轨等是汽车和飞机的优良原料钢
本章介绍重点:
d区过渡元素中的Ti、V、Cr、 Mn、Mo、W,其它元素的性质
应与本族元素对比掌握。
第一过 渡系
第二过 渡系
第三过 渡系
ⅣB
Ti
Zr
Hf 主要矿物有
②、TiOSO4+2H2O=H2TiO3↓+H2SO4
或Ti(SO4)2+H2O=TiOSO4+H2SO4
③、H2TiO3==TiO2+H2O(煅烧)
④、TiO2+2C+2Cl2==TiCl4+CO↑(△)
过渡金属元素ppt课件

其中:ΦA / V
Cr2O72 -/ Cr3+
1.33
MnO4- / Mn2+
1.49
FeO42- / Fe2+ NiO42- / Ni2+
1.84 1.75
5
(三)氧化态的稳定性
2.同一族
高稳氧 氧定化 化性性 态↗↘
Ⅵ
CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+
Ⅶ
MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
ⅢB ⅦB Ⅷ
+3 +7 +6 最高氧化态氧化性↗ 最高氧化态稳定性↘
低氧化态稳定性↗
例 第一过渡系列:
氧化性 稳定性
Sc3+ < TiO2+ < VO2+ < Cr2O72 - < MnO4- < FeO42Sc3+ > TiO2+ > VO2+ > Cr2O72- > MnO4- > FeO42-
例:r / pm 57 La 187.7, 71 Lu 173.5
Δr
187.7 173.5 = 71 57
≈ 1 pm
9
三、原子半径:
“镧系收缩”
——从 57 Ln – 71 Lu,随着原子序数递增,增加的电子进入 (n-2) f(即 4f)轨道(4f 0 ~145d 0~16s 2);对于最外层 6s 电子而言,4f 电子位于次外层, Z*增加很小,因此
过渡金属元素
(ⅢB~ⅤⅢ族,d 区)
(n-1)d1~9 ns1~2 (例外 Pd 4d10 5s0 )
过渡金属元素

2. 羰基簇合物 (分子中含有M—M键的化合物) 过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。
双核和多核羰基簇合物中羰基与金属原子的结合方式: (1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO 与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
镧系收缩的影响:
(1)第五周期,IIIB族元素钇(Y)成为“稀土”一员 :
四 Sc 63Eu 4s76s2 39Y 4d15s2 64Gd 4f75d16s2
五Y
198.3ห้องสมุดไป่ตู้
180.3
180.1 pm
六 La-Lu 67Ho3+
39Y3+
68Er3+
89.4
89.3
88.1 pm
习惯上,把Y列入“重稀土”。
见教材p.221-222, 表8-2 –表8-4.
2. 同一副族原子半径:第四周期元素 < 五 ~ 六
15
四、第一电离能I1的变化(理解)
影响因素
Z*, I1 r , I1
1. 同一周期
左 r↘,Z*↗,I1和(I1 + I2)↗,(总趋势)
右
2. 同一副族
原子半径 r 有效核电荷 Z* 第一电离能 I1
三、原子半径
影响原子半径的因素
1. 同一周期
Z* ↗, r ↘ 同亚层:电子数↑,r↑ 主量子数n = 电子层数↑,r↑
原子序数增加,有效核电荷增加,原子半径减小。
例外: VIII 3d84s2 Ni 125 pm
IB 3d104s1 Cu 128 pm
IIB 3d104s2 Zn 133 pm
过渡金属(一)
5、原子半径从左到右逐渐减小。
2018年11月27 日11时27分
1. 电子构型 除Pd外,它们都有未充满的d轨道,最外层也仅 有1-2个电子,过渡元素通常指价电子层结构即: (n-1)d1-9ns1-2。 2. 氧化值 它们的(n-1)d和ns轨道能级的能量相差很小,d电 子也可部分或全部作为价电子参加成键。一般由+2价 直到与族数相同的氧化态(VIII例外)。 3. 单质的化学性质 IIIB族是它们中最活泼的金属,性质与碱土金属 接近。同族元素的活泼性从上到下依次减弱。
2、TiCl4:易水解,为偏钛酸及TiOCl2,在浓 HCl中生成H2[TiCl6]
3、Ti2(SO4)3:三价钛的还原性比(Sn2+)稍强 Ti2(SO4)3+Fe2(SO4)3 ⇌ 2Ti(SO4)2+2FeSO4 二价钛具有更强的还原性。
2018年11月27 日11时27分
20-3 钒分族
一、存在和发现 钒的主要矿物有:绿硫钒矿VS2或V2S5,钒铅矿 Pb5[VO4]3Cl等。 Nb和Ta因性质相似,在自然界中共生,矿物为 Fe[(Nb,Ta)O3]2如果Nb的含量多就称铌铁矿,反之为 钽铁矿。 二、单质的性质和用途 电子构型为(n-1)d3ns2价态有+V、+IV、+III、+II, V、Nb、Ta以+V价最稳定,V的+IV价也较稳定。 它们的单质容易呈钝态、都溶于硝酸和氢氟酸的 混合酸中,钽不溶于王水。
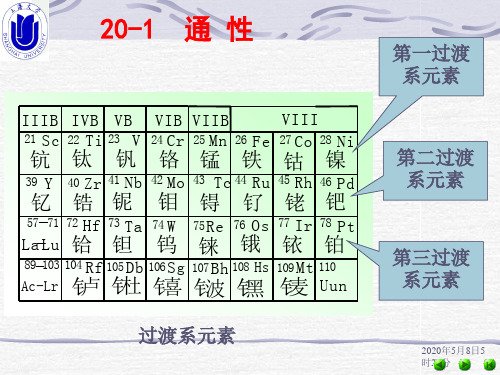
20-1
通 性
第一过渡 系元素
VIII 26 Fe 27 Co 28 Ni
过渡金属(Fe,Al,Cu)

I.铁Fe一、铁的结构和性质1.铁是26号元素,位于第四周期第Ⅷ族,属于过渡元素。
原子结构示意图:主要化合价:+2,+32.铁在金属的分类中属于黑色金属,重金属,常见金属。
纯净的铁是光亮的银白色金属,密度为7.86g/㎝3,熔沸点高,有较好的导电、传热性,能被磁铁吸引,也能被磁化。
还原铁粉为黑色粉末。
3.铁是较活泼的金属元素,在金属活动性顺序表中排在氢的前面。
①跟非金属反应:点燃点燃△3Fe+2O2 == Fe3O42Fe+3Cl2==2FeCl3Fe+S= FeSFe+I2= FeI2②跟水反应: 3Fe+4H2O==(高温)== Fe3O4+4H2③跟酸作用:Fe+2H+=Fe2++H2↑(遇冷浓硝酸、浓硫酸钝化;与氧化性酸反应不产生H2,且氧化性酸过量时生成Fe3+)④与部分盐溶液反应:Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+3.生铁与钢的比较4.炼铁和炼钢的比较①还原剂的生成C+O2CO2CO2+C2CO ②铁的还原Fe2O3+3CO2Fe+3CO2③炉渣的生成CaCO3CaO+CO2①氧化:2Fe+O22FeOFeO氧化铁水里的Si、Mn、C等。
如C+FeOFe+CO②造渣:生成的硅锰氧化物得铁水里的硫、磷跟造渣材料反应形成炉渣排出。
③脱氧,并调整Mn、Si含量2FeO+Si2Fe+SiO2CaO+SiO2CaSiO31.过渡元素位于周期表中中部从ⅢB~ⅡB族十个纵行,分属于第四周期至第七周期。
过渡元素都是金属,又叫过渡金属。
过渡金属的密度一般比较大,熔沸点较高,有较高的硬度、较好的延展性和机械加工性能,较好的导电、导热性能和耐腐蚀性能。
过渡元素的原子最外层电子数不超过两个,在化学反应中,最外层和次外层都容易失去电子,因此过渡元素有可变化合价。
所以当Fe与弱氧化剂反应时,只失去最外层上的2个电子,形成Fe2+;当Fe与强氧化剂反应时,还能进一步失去次外层上的一个电子,形成Fe3+。
元素周期表中的过渡金属元素研究

磁性材料的应用:磁存储、磁分离、磁传感等
磁性材料的制备:烧结、熔炼、气相沉积等
过渡金属元素在工业中的应用
PART 04
催化剂与催化反应
过渡金属元素作为催化剂的应用广泛
催化反应可以提高反应速率和选择性
过渡金属元素在石油化工、精细化工等领域具有重要应用
催化剂的种类和性能对催化反应有重要影响
电池材料与能源存储
过渡金属元素在岩石和矿物中的分布广泛
过渡金属元素的物理化学性质
PART 03
电子结构与能级
过渡金属元素的电子结构特点:具有未填满的d电子层
能级分裂:由于未填满的d电子层,导致能级分裂,形成一系列能级
电子排布:过渡金属元素的电子排布遵循洪特规则,具有一定的规律性
能级跃迁:过渡金属元素之间的能级跃迁是化学反应中的重要过程,影响元素的化学性质
过渡金属元素在电池材料中的应用:如钴、镍、锰等,用于制造锂离子电池、镍氢电池等。
过渡金属元素在能源存储中的应用:如钒、铬、钼等,用于制造储能材料,如钒电池、铬电池等。
过渡金属元素在太阳能电池中的应用:如铜、锌、锡等,用于制造太阳能电池,如铜铟镓硒太阳能电池、钙钛矿太阳能电池等。
过渡金属元素在燃料电池中的应用:如铂、铱等,用于制造燃料电池,如氢燃料电池、甲醇燃料电池等。
THANK YOU
汇报人:
回收与处理技术的发展趋势:高效、环保、节能、低成本
未来展望与研究方向
PART 06
新材料设计与合成
合成新材料的实验方法和技术
过渡金属元素的性质和应用
新材料设计的基本原理和方法
过渡金属元素在新材料设计中的应用前景和挑战
新型催化反应的开发与应用
应用领域:能源、环保、化工等
过渡金属元素解析
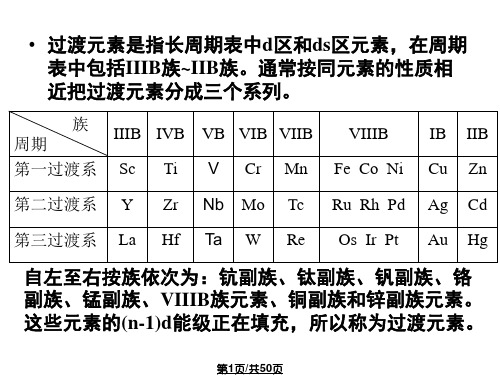
族
周期
IIIB IVB VB VIB VIIB
第一过渡系 Sc Ti V Cr Mn
VIIIB Fe Co Ni
IB IIB Cu Zn
第二过渡系 Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
离子中未配对的电子数
离子在水溶液中的颜色
0
Ag+、Zn2+、Cd2+、Hg2+、Sc3+、Ti4+(无色)
1
Cu2+(蓝色)、Ti3+(紫色)
2
Ni2Co2+(桃红色)
4
Fe2+(淡绿色)
5
Mn2+(淡红色)、 Fe3+ (浅紫色)①
① Fe3+在溶液中由于水解等原因,水溶液常呈现黄色或褐色。
族
周期
IIIB IVB VB VIB VIIB
第一过渡系 Sc Ti V Cr Mn
VIIIB Fe Co Ni
IB IIB Cu Zn
第二过渡系 Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
第三过渡系 La Hf Ta W Re Os Ir Pt Au Hg
原子结构特点:
➢随核电荷的递增,电子依次填充在次外层的d轨道上, 最外层有1~2个电子; ➢其价层电子构型为(n-1)d1~10ns1~2(Pd为4d105s0)
第三过渡系 La Hf Ta W Re Os Ir Pt Au Hg
自左至右按族依次为:钪副族、钛副族、钒副族、铬 副族、锰副族、VIIIB族元素、铜副族和锌副族元素。 这些元素的(n-1)d能级正在填充,所以称为过渡元素。
过渡金属元素半径变化规律

过渡金属元素半径变化规律过渡金属元素是元素周期表中的一类元素,其电子结构具有特殊的变化规律,使得它们在化学性质上表现出多样性。
其中,过渡金属元素的原子半径变化规律尤为重要,可以影响其化学反应性和配位化学性质。
在本文中,我们将探讨过渡金属元素的原子半径变化规律,并分析其与元素周期表位置的关系。
原子半径的定义与影响因素原子半径是原子核到最外层电子轨道边缘的距离,是描述原子大小的重要参数。
原子半径的大小受到原子核电荷数、电子层分布以及电子间的屏蔽效应等因素的影响。
在过渡金属元素中,由于电子结构的特殊性,原子半径的变化规律比较复杂。
过渡金属元素的原子半径变化规律过渡金属元素的原子半径通常随着周期和族数的变化而发生变化。
一般来说,过渡金属元素的原子半径随着周期数的增加而减小,这是因为在同一周期内,原子核的电荷数增加,而电子屏蔽效应相对稳定,导致原子半径减小。
另外,随着族数的增加,原子半径也会增加,这是由于原子核的电荷数增加,但电子屏蔽效应也相对增加,导致原子半径增大。
原子半径与配位化学性质的关系过渡金属元素的原子半径变化对其配位化学性质具有重要影响。
原子半径较小的金属离子通常表现出较高的配位数,例如,钨、镍等元素常常表现出较高的配位数,因为它们的原子半径小,能够容纳更多的配体。
反之,原子半径较大的金属离子则通常表现出较低的配位数,例如,铜、银等元素常常表现出较低的配位数,因为它们的原子半径大,不利于形成多配体配合物。
结论通过对过渡金属元素原子半径变化规律的探讨,我们可以更好地理解过渡金属元素的化学性质和配位化学行为。
原子半径的变化规律是深化对元素周期表的认识,揭示元素之间化学性质差异的重要依据之一。
进一步研究原子半径变化规律对于指导材料设计和催化剂研究具有重要意义。
以上就是关于过渡金属元素原子半径变化规律的详细介绍,希望对读者有所启发和帮助。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过渡元素的通性
一、价电子构型
通式:(n-1)d1~9 ns1~2
中性原子的原子轨道能量随原子序数的变化:n 和 l 竞争。 例外:Z = 24,41 ~ 46: “能量最低原理” 24 Cr 3d54s1 不是 3d44s2 41 Nb 铌 4d45s1 不是 4d35s2 42 Mo 4d55s1 不是 4d45s2 43 E4 d < E5 s Tc 锝 4d65s1 不是 4d55s2 44 Ru 钌 4d75s1 不是 4d65s2 45 Rh 铑 4d85s1 不是 4d75s2 46 Pd 钯 4d105s0 不是 4d85s2
(二)同一副族原子半径:第四周期元素 < 五 ~ 六
四、第一电离能I1的变化
影响电离能因素
Z* ↗,I1 ↗ r ↗,I1 ↘ (Z*、r 竞争)
(一)同一周期:
r↘,Z ↗,I1 和(I1+I2)↗,(总趋势)
*
左
右
(二)同一副族:
原子半径 r 第四周期 ^ 第五周期 ∫ 第六周期 图 7-1 第一、二、三过渡系列金属元素第一电离能变化 ^ ^ ^ 有效核电荷 Z* 第一电离能 I1 交错(基态电子构型不同)
显然 CH + ↗ 有利于缩合,形成多酸。
同多酸:同一种含氧酸分子缩合而成 如:H2Mo4O13(四钼酸) 10W12O41 ,H 杂多酸:两种不同含氧酸分子缩合而成
多酸
(十二钨酸)
如:
H3[PMo12O40] H3[P W12O40] H4[SiMo12O40] H4[Si W12O40]
十二铂磷杂多酸 十二钨磷杂多酸 十二钼硅杂多酸 十二钨硅杂多酸
m
=
n( n 2) B.M .
六、过渡元素氧化物水合物的酸碱性
(一)最高氧化态氧化物的水合物
碱 性 ↗
ⅢB ⅣB Sc(OH)3 Y(OH)3 La(OH)3
ⅤB
ⅥB
ⅦB HMnO4 HTcO4 HReO4
酸 性 ↗
酸性↗ 规律与主族相同。
(二)低氧化态氧化物水合物
M(OH)2、M(OH)3 一般呈碱性,且碱性主要取决于 Ksp: Ksp↗,碱性↗。
右
例外:
Ⅷ
ⅠB
ⅡB
(n-1)d10
Ni 125pm
(n-1)d10ns1
Cu 128pm
(n-1)d10ns2
Zn 133pm
原因:d 10 电子云球形,对核电荷 Z 屏蔽作用↑,Z* 增加少,而 ns 电子数目↑, 使电子互相作用↑,r↑
三、原子半径:
同一周期,相邻两元素原子半径平均减小值Δ 周期 Δ Z 增加的电子 σ 进入 (slater 规 则) 1 0.35 二、三(短) ns 或 np 1 (n-1)d 0.85 四、五、六 (d 区) 1 (n-2)f 镧系 →1 例:r / pm
二、氧化态
(一)同一元素,多种氧化态
原因: n-1)d 与 ns 轨道能量相近,部分(n-1)d 电子参与成键。 ( 例:Mn 2 ~ +7 均出现,主要+2,+3,+4,+6,+7. Fe 2 ~ +6 均出现,主要+2,+3,+6.
(二)最高氧化态
ⅢB ~ ⅦB 族:最高氧化态 == 族数
例:
七、形成配合物倾向:比主族 M 大得多
原因: ① (n-1)d 与 ns 能量相近,(n-1)d 电子参与成键; ② d 区 Mn+: (9 17)e 构型, (强极化力 + 大变形性) 。 与配体互相极化,使 M-L 键共价性↑。
n+
八、形式多碱、多酸倾向
(一)多碱
是较高价态 Mn+ 在一定 pH 值下多步水解通过羟桥键而形成的多核配合物: 例:[Fe(H2O)6 ]3+ 水解形成 [Fe2(H2 O)8 (OH)2 ]4+ H2O H H2O H2 O O OH2 \ / \ / Fe Fe 2 个八面体共棱 / \ / \ H2 O O OH2 H2 O H H2O pH ↗ pH ↗ 胶体溶液 Fe2 O3 ·xH2 O↓
2+
[M
2+ (aq)
由φ (M /M)值可知:
(一)与酸作用:
1.第一过渡系列:φ (M2+/M) < 0 V M + 2H+ → M2+ + H2↑ 但 Ti、V“钝化” (致密氧化膜) 。
2.第二、三过渡系列 Y、La + 非氧性酸 → H2↑ + M3+ 其余金属不可,表现出高的化学稳定性。
2.以下金属需 O2 存在才与碱反应: Mn K2 MnO4 Fe Fe2 O3 ·XH2O Pd + NaOH + O —→ PdO+H2 O 2 Mo Na2MoO4 (熔碱) W Na2 WO4 (熔碱)
3.Ru(钌)、Pt(铂)受熔融苛性碱或 Na2O2 腐蚀: Ru + 2 KOH + KClO3 K2RuO4 + KCl + H2O
64
Gd 4f75d16s2 180.1 68 Er3+ 88.1
“镧系收缩”的影响:
2.紧随镧系之后的第六周期几种元素 Hf(铪),Ta(钽)和 (钼)与同族第五周期元素原了半径相近,性质相似难以分离: Ⅲ Ⅳ Ⅴ Ⅵ 五 Y Zr Nb Mo 六 La-Lu Hf Ta W
3.同一副族(ⅣB ~ Ⅶ)第一电离能 I1 相近 第五周期 r 相近,第六周期元素 Z*↑↑, I1 相近 第六周期
●
分为三个系列。第四周期的Sc—Ni为第一过渡系列元素; 第五周期中的Y—Pd为第二过渡系列元素;第六周期中的La—Pt为 第三过渡系列元素。 习惯上把第一过渡系列元素称为轻过渡元素,把第二、第三过渡系列 称为重过渡元素。
此外:Δ Z =1 ,增加的电子填入(n-2)f 亚层 镧系 57La ~ 71Lu(15 种元素) 。 4f 2~145d 0-1 6s 2 →“内过渡元素” 89 103 锕系 Ac~ Lr 铹(15 种元素) 5f 0~146d 0~1 7s 2
其中:Φ A / V Cr2O72 -/ Cr3+ MnO4- / Mn2+ FeO42- / Fe2+ NiO42- / Ni2+
1.33 1.49 1.84 1.75
(三)氧化态的稳定性
2.同一族
高 氧 化 态 稳 定 性 ↗ 氧 化 性 ↘ Ⅵ CrO42-/Cr3+ MoO4-/M3+ WO42-/W3+ Ⅶ MnO4-/Mn2+ TcO4-/Tc+3 ReO4-/Re3+
(二)与碱作用
1.Ti V Nb Ta
φ B(H2O/H2)=== - 0.8277 V
理论上,许多 d 区金属可与碱反应置出 H2: M + H2O → M2+ + H2↑ 实际上仅有少数 d 区金属有此作用:
熔 融 + NaOH ——→ (缓慢)
↑
H2
Na2TiO3 NaVO3 NaNbO3 NaTaO3
Cr3+、Al3+、类似 Fe3+
八、形式多碱、多酸倾向
(二)多酸
由含氧酸缩合脱 H2O 例: O Cr / \ / O O O
CH
而形成“多酸”
O Cr \ O O
Cr2 O7 2-
2 个四面体共顶点
Cr2O72
Cr3 O102- Cr4 O13 2-
57
r: Δ Z*
Δ r /pm
0.65 0.15 很小
10 5 1
二 12.2,三 9.1 四 5.6, 五 6.1, 六 7.0 ―镧系收缩‖
La 187.7,
71
Lu
173.5
Δr =
187.7 173.5 ≈ 1 pm 71 57
三、原子半径:
“镧系收缩”
——从 57 Ln – 71 Lu,随着原子序数递增,增加的电子进入 (n-2) f(即 4f)轨道(4f 0 ~145d 0~16s 2);对于最外层 6s 电子而言,4f 电子位于次外层, Z*增加很小,因此 1.相邻两元素原子半径仅略为缩小 (Δ r ≈ 1pm); 2.但 57 Ln – 71 Lu 共 15 种元素,累积的原子半径缩小值Δ r 相当大,达 14.2 pm 。
φ (M2+/M)与下列 Born-Haber cycle 有关: 2+ Δ f H [M (aq) ] 2+ M(s) M a(q) + 2e
S
升华热
Δ h H (M(g) )水合热
2+
I1 + I2
M(g) ∴ ΔfH 若Δ f H
2+
M(g)2++2e
2+ (aq)
[M
] = S + ( I1 + I2 ) +Δ h H (M(g)2+) ] ↘, 则φ (M /M)↘
低稳 氧定 化性 态
↗
与ⅢA ~ ⅤA 族规律相反!
反映过渡金属元素 5d, 6d 电子参与成键倾向↑
原因:
(1) (n-1)d 电子电离能 n ↗, (n-1)d 电子电离倾向↘ (d 电子云发散)
(2)形成 d-p 键能力: 3d < 4d < 5d 稳定性: CrO42- < MoO42- < WO42氧化性: > > 系 列: 一 二 三
对比主族元素:恰好相反。 ⅢA ⅣA ⅤA 第六周期 Tl (Ⅲ) Pb(Ⅳ) Bi(Ⅴ) 强氧化性 (低稳定性) (6s2 惰性电子对效应)
