2005年全国高中化学竞赛(安徽赛区)试题及答案
2005年全国高中学生化学竞赛实验试题.pptx
pH 为 5~ 6, 加热煮沸约 5~ 10分钟, 使溶液中产生深褐色沉 淀, 待溶液体积约 80 mL~ 100 mL, 立即趁热抽滤, 用 少 量 热 水淋洗 (滤液若发黄, 则需再加 N aC lO 重 复 上 述 操 作 )。滤 渣弃去, 滤液倒入蒸发皿中加热蒸发浓缩至稀稠状后, 熄火, 取下蒸发皿置于石棉板上, 冷却, 抽 滤 。晶体用 15 mL 丙酮 洗涤。洗涤后的晶体放入培养皿中, 置于通风橱内, 晾 干 30 分钟。
热抽滤?
( 4)估算 MgSO4• 7H2 O的理论产量。
附录 0. 02 m ol• L - 1 EDTA标准溶液标定的实验说明
准确称取 0. 26~ 0. 39克的锌粒于 150 mL 的 小 烧 杯 中 , 盖上表面皿, 沿烧杯嘴尖处滴加 6 mo l• L- 1H C l 6 mL, 待锌 粒完全溶解, 定 量 转 移 至 250 mL 容量瓶中, 用 水 稀 释 至 刻 度, 摇匀。
2005年全国高中学生化学竞赛实验试题
上海化学化工学会 华东理工大学命题组
从盐泥中提取七水合硫酸镁
1 实验内容
盐泥是氯碱工业中的废渣, 分 为 一 次 盐 泥 和 二 次 盐 泥
K sp [ Ca( OH ) 2 ] = 3. 7 ×10 - 6 K sp [ Fe( OH ) 3 ] = 3.0 × 10 - 39
( 上接晾第干的57页Mg) SO4• 7H 2O 产品在电子天平上称重, 记 录 产 ( 1)硝酸银浓度在 0. 5 m ol/L 以 上 , 并且选择浓度相匹
2005年全国化学竞赛初赛模拟试卷 (20)

2005年全国化学竞赛初赛模拟试卷(52)(时间:3小时满分:100分)第一题(3分)请解释下面3个现象:1.容易从V和Nb混合物中分离出V,但很难从Nb和Ta混合物中分离出Nb;2.Sc和Y的电离能比Ga和Tl高;3.周期表中第二周期的元素各自都不是该族元素的典型代表。
第二题(5分)以石墨为电极,通电电解含酚酞的KI溶液(无色)1.写出阴、阳极的电极反应和阴、阳极区溶液呈现的现象;2.观察到以上现象时停止通电,摇匀电解液,恢复成(几乎)无色,为什么?第三题(5分)化合物A、B分子式均为C8H15Cl3,经乙醇的氢氧化钠溶液处理,A得到C和D,而B得到C和E。
在热的酸性高锰酸钾处理后,C得到1 mol丁二酸同时放出气泡,D得到乙酸和丙二酸各1 mol并放出气泡,而E得到2 mol乙酸和气泡。
请给出A、B、C、D、E的结构简式。
第四题(7分)设计一种实验证明在酸性条件下,S2O82-的氧化性比MnO4-、Cr2O72-的强,MnO4-、Cr2O72-的氧化性比H2O2的强,写出相应反应的化学方程式。
第五题(11分)硫代硫酸钠晶体(Na2S2O3·5H2O)俗称海波,又名大苏打。
硫代硫酸钠溶液呈弱碱性,可溶解银的卤化物,但所得无色溶液长期放置后会产生黑色浑浊。
硫代硫酸钠具有还原性,遇酸分解为S和SO2。
由Na2SO3溶液和S粉共煮可制备硫代硫酸钠晶。
1.根据其名称,画出S2O32-的结构;2.中学教材中曾用Na2S2O3与酸的反应研究浓度对化学反应速率的影响,通过溶液出现浑浊的先后顺序判断反应速率的快慢。
请问当混合溶液后为什么不立即出现浑浊?3.S2O32-离子中,两个S原子是不等价的,请设计实验并写出其中的反应方程式(注:设计过程中不得出现S2O32-与酸的反应)。
4.在医学上,Na2S2O3可用作注射液的抗氧剂,还可以内服或静脉注射用作解毒剂。
卤素、氰化物及重金属中毒时,可用Na2S2O3解毒。
2005年全国高中学生化学竞赛决赛理论试题参考答案与评分标准

・56・化学教育2005年第4期2005年全国高中学生化学竞赛决赛理论试题参考答案与评分标准上海市化学化工学会华东理工大学命题组第1题0lIl一1x的结构式:Ho一卜NH20Ox的化学名称氨基磺酸。
(答磺酸酰胺也可。
)1—2化学方程式:2H2S04+CO(NH2)2==一H3N03S+NH4HS04+C02l一3化学方程式:H3N03S+HCl+NaN02一N2+H2S04+NaCl+H201—4化学方程式:H5106+2I一+H+—==12+103一+3H20103一+5I一+6H+===-312+3H201—5注入甲醇的作用:注入甲醇与水形成氢键后破坏了油气分子与水分子形成的包合物。
第2题2—1http://wlww.ccs.ac.cn/uploadjs/38st.doc2—2有旋光性的异构体是编号为D、E的异构体。
2—3取代速率最慢的是编号为D的异构体。
你对这种性质的理解是:对于D,当负一价阴离子取代氯时,无论从上方,还是从下方进攻中心co”时,均受到甲基空间的位阻,因此,取代的速率最慢。
第3题3—1http://www.ccs.ac.cn/uploadjs/38st.doc3—2化学式:LiCoO,。
3—3晶胞里有三个锂原子,三个钴原子和』个氧原子。
3—4电极反应方程式:Ij。
一;c。
o:+菇“++算e一堂皇“c。
o:(理想)3—5化学式:“Mn2043—6相邻“+离子之间有多个未填“+离子的八面体及四面体空隙,在电场的作用下,形成“离子通道”。
充电时,锂锰氧化物中部分Li+离子沿着“离子通道”移出晶体,晶体中锂离子的个数减少,Mn的氧化态升高。
当放电时,“+离子沿着““+离子通道”从电解质流回锂锰氧化物晶体,晶体中锂离子的个数增加,Mn的氧化态降低。
.‘.充电时,放出并“+,b+离子沿着如图3—2的箭头方向从Li+离子通道流向电解质。
第4题4一lAlY一+6F一=AlF63一+Y4一Cu—PAN+Y4一=CuY+PAN4—2还应存在Cu—PAN。
2005年全国高中学生化学竞赛决赛理论试题参考答案与评分标准

1 ( PO 2 / p ) 1 /2
- 1 /2
因为 △r Gm < 0 或 K 很大 ,所以在 298. 15 K下采用此法 制甲醛极为有利 。
(只根据 △r Hm 或 △r Sm 的正 、 负进行分析不给分 )
101325 × 0. 21 3 100 × 10
µ0
∴不是由于 Ag被氧化生成 Ag2 O 所致 。 6 - 5 以 1 mol CO 为基准进行计算 ,则 :
= - 219. 232 J ・K ・mol
-1 -1
-1
-1
△r Sm = (188 . 825 +197 . 674 - 218 . 77 = 65. 16 J ・K - 1
1 -1 × 205 . 138) J ・K 2
-3
△r Sm, 298K, ② = - 223. 28J ・K - 1 ・mol - 1 △r Gm, 773K, ① = 79. 33 kJ ・mol - 1
・56・
化 学 教 育 2005 年第 4 期
2005 年全国高中学生化学竞赛决赛理论试题
参考答案与评分标准
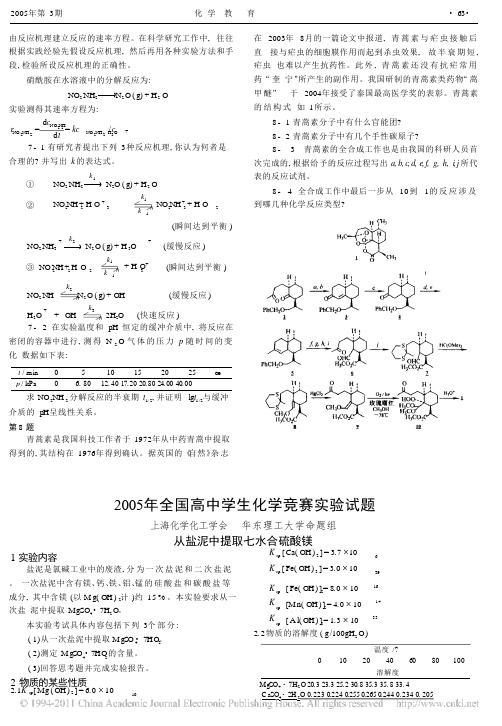
化学 奥林匹克
第 1题
O
上海市化学化工学会 华东理工大学命题组
4 - 1 4 - 2 4 - 3
A lY
-
+ 6F
-
= A lF6
ቤተ መጻሕፍቲ ባይዱ
3-
+ Y
4-
-3 -1 = [ 92. 09 - 298. 15 × 109. 64 × 10 ] kJ ・mol
化学式 : L i M n2 O4
相邻 L i + 离子之间有多个未填 L i + 离子的八面体及四面 体空隙 ,在电场的作用下 ,形成“ 离子通道 ” 。充电时 ,锂锰氧 化物中部分 L i + 离子沿着“ 离子通道 ” 移出晶体 ,晶体中锂离 子的个数减少 ,M n的氧化态升高 。 当放电时 , L i 离子沿着“L i 离子通道 ” 从电解质流回锂 锰氧化物晶体 , 晶体中锂离子的个数增加 , M n 的氧化态降 低。 ∴ 充电时 ,放出 x L i + , L i + 离子沿着如图 3 - 2 的箭头方 向从 L i 离子通道流向电解质 。 第 4题
安徽省高中化学竞赛初赛试题及答案

2004年全国中学生化学竞赛(安徽赛区)初赛试题一、本题包括25小题,每小题2分,共50分。
每小题有1个或2个选项符合题意。
若该题只有1个选项符合题意,多选或错选均不得分。
若该题有2个选项符合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
1.下列卤素互化物中,最不稳定的是(A)ClI3(B)ClF3(C)BrF3(D)ICl32.下列各结构式中,最有可能的N2OLewis结构式为(A)N=N=O —O (C)N—(D)N=O=N3.下列各金属碳化物中,与水反应能生成C3H4的是(A)Be2C (B)Na2C3(C)Mg2C3(D)A14C34.在一定温度下,某浓度的硝酸与金属锌反应,生成NO2和NO的物质的量之比为1:3 则要使1摩金属锌完全反应,需要HNO3的物质的量为(A)0.8 (B)2.4 (C)2.6 (D)2.85.在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g) A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡。
下列说法中正确的是(A)平均反应速度:乙>甲(B)平衡时nc(甲)>nc(乙)(C)平衡时C的转化率:乙>甲(D)平衡时A的物质的量甲>乙6.对手由CrO42—转化为Cr2O72—的下列各叙述中,正确的是(A)这是Lewis酸碱反应(B)这是氧化还原反应(C)加酸,该反应向右移动(D)加酸,该反应向左移动7.在水溶液中,KHSO3(aq)的电荷平衡式为(A)[H3O+]十[K+]=[OH—]+[HSO3—]+[SO32—](B) [H3O+]十[K+]=[OH—]+[HSO3—]+2[SO32—](C) [H3O+]十[K+]=[OH—]+[HSO3—]+1/2[SO32—](D) [H3O+]十2[K+]=[OH—]+[HSO3—]+2[SO32—]8.下列各组离子中,能在强碱性溶液中共存,且在滴加盐酸过程中会生成气体和沉淀的是(A)Na+、CrO2—、SO42—、CO32—(B)NH4+、A1O2—、SO42—、CO32—(C)K+、A1O2—、SO42—、HCO3—(D)K+、ZnO2—·、SO42—、CO32—9.已知Al和Ga是同族元素,且都是两性元素,并知A1(OH)3的碱性比Ga(OH)3大。
2005化学竞赛试题答案

2005化学竞赛试题答案一、选择题1. 下列元素中,属于碱土金属的是:A. 钠(Na)B. 镁(Mg)C. 铝(Al)D. 钾(K)答案:B2. 化学中的“摩尔”定义为:A. 物质的质量与相对原子质量的比值B. 物质的体积与密度的比值C. 包含6.022×10^23个粒子的任何物质的量D. 物质的重量与地球引力的比值答案:C3. 酸碱指示剂的作用原理是:A. 与酸或碱发生氧化还原反应B. 与酸或碱发生复分解反应C. 与酸或碱发生络合反应,导致颜色变化D. 与酸或碱发生酯化反应答案:C4. 以下哪种化合物是强酸?A. 醋酸(CH3COOH)B. 碳酸(H2CO3)C. 硫酸(H2SO4)D. 氢氧化钠(NaOH)答案:C5. 在标准状况下,下列气体的摩尔体积最大的是:A. 氢气(H2)B. 氧气(O2)C. 氯气(Cl2)D. 二氧化碳(CO2)答案:A二、填空题1. 请写出硫酸铜(CuSO4)溶于水后的电离方程式:______________________。
答案:CuSO4 → Cu^2+ + SO4^2-2. 请根据化学方程式计算,10克硫酸铵((NH4)2SO4)完全分解产生多少克的氨气(NH3)。
化学方程式:(NH4)2SO4 → 2NH3 + H2SO4答案:3.4g3. 请写出铁与硫酸反应生成硫酸亚铁和氢气的化学方程式,并指出反应类型。
答案:Fe + H2SO4 → FeSO4 + H2↑(置换反应)三、计算题1. 某实验室需要制备500mL 0.1M的氢氧化钠(NaOH)溶液,已知NaOH的摩尔质量为40g/mol,请计算需要多少克NaOH固体。
答案:2.0g2. 一个装有500mL 6M盐酸(HCl)的容器中,加入多少毫升的2M氢氧化钠(NaOH)溶液才能完全中和?答案:500mL四、实验设计题设计一个实验来验证硫酸铜溶液与氢氧化钠溶液的反应是否为双替换反应,并说明实验步骤及预期结果。
化学竞赛-初赛试题-2005备用

中国化学会2005年全国高中学生化学竞赛(省级赛区)备用试题(2005年10月9日9︰00-12︰00 共计3小时)题号 1 2 3 4 5 6 7 8 9 10 总计满分12 12 10 8 10 10 10 8 12 8 100得分评卷人●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
H** 相对原子质量He **Li ** Be**B**C**N**O**F**Ne**Na ** Mg**Al**Si**P**S**Cl**Ar**K ** Ca**Sc**Ti**V**Cr**Mn**Fe**Co**Ni**Cu**Zn**Ga**Ge**As**Se**Br**Kr**Rb ** Sr**Y**Zr**Nb**Mo** Tc[98]Ru**Rh**Pd**Ag**Cd**In**Sn**Sb**Te**I**Xe**Cs ** Ba** La-LuHf**Ta**W**Re**Os**Ir**Pt**Au**Hg**Tl**Pb**Bi** Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-Lr Rf Db Sg Bh Hs Mt第i题(12分)将H2O2慢慢加入到SbF5的HF溶液中得一白色固体A,A是一种盐类,其阴离子呈八面体结构。
1.A的结构简式,生成A的化学方程式。
2.A不稳定,能定量分解,B是产物之一,其中亦含有八面体结构,B的结构简式为。
3.若将H2S气体通入SbF5的HF溶液中,则得晶体C,C中仍含有八面体结构,写出C的结构简式。
生成C的化学反应方程式是。
全国高中化学竞赛(安徽赛区)初赛试题及参考标准答案

年全国高中化学竞赛(安徽赛区)初赛试题及参考答案————————————————————————————————作者:————————————————————————————————日期:22001年全国高中化学竞赛(安徽赛区)初赛试题(考试时间3小时,满分150分)注意:⒈本试卷分试题卷和答题卷两部分,所有的答案必须写在答题卷上,写在试题卷上无效......................。
⒉考生开始答题前,请先将答题卷上密封线内的项目填写完整。
⒊有关计算中,请遵循近似数计算法则。
H1.008 元素周期表He 4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra [226]Ac-La一、本题包括5小题,每小题1分,共5分。
每小题只有一个选项符合题意。
⒈下列各组离子中,能大量共存的是A.H+、Cl-、HPO42-、K+B.OH-、Zn2+、Al3+、Mn2+C.OH-、HPO42-、Na+、SO42-D.OH-、CO32-、AlO2-、Na+⒉现有X、Y、Z、W四种主族元素。
2005年中国高中化学竞赛奥林匹克(初赛)试题及答案、评分标准与细则

(4 分)
2-2 根据上图所示的 LiMO2 的尖晶石结构, 写出氧的堆积方式, 并指出 Li 和 M 占据何种空隙, 画出以氧为顶点的一个晶胞。
O: 立方面心密堆积; Li 和 M 占据八面体空隙;
(1 分)
以氧为顶点的一个晶胞表示如下:
(2 分) 2-3 锂离子在阳极与石墨形成固体混合物, 试推测并画出锂离子嵌入石墨的可能结构。
中国化学会 2005 年全国高中学生化学竞赛(省级赛区)备用试题 2005 年 10 月 9 日 共 页
3
(锂金属作阳极材料的不足, 并说明还可以用什么
物质替代石墨作阳极材料?
锂活泼, 易与电解质反应, 形成锂的枝状晶体, 导致电池被侵蚀或爆炸。 (1 分)
姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。 允许使用非编程计算器以及直尺等文具。
学校
赛场
省 市 自治区 报 名 号
第 1 题(12 分)将 H2O2 慢慢加入到 SbF5 的 HF 溶液中得一白色固体 A,A 是一种盐类,其 阴离子呈八面体结构。
1-1 A 的 结 构 简 式 [H3O2]+[SbF6]-
还可用低熔点的金属如 Si, Bi, Pb, Sn, Cd 等与锂掺杂形成金属合金, 或用电解质如液体
电解质 LiPF6, LiBF6, LiAsF6 及 LiOSO2CF3(用有机溶剂不能含水), 以及固体电解质等。 (1 分)
第 3 题(10 分)固体发光材料是一种能将激发的能量转变为可见光的固体物质。在基质中掺
(2 分 ) , 生 成 A 的 化 学 方 程 式
H2O2+HF+SbF5=[H3O2]+[SbF6]-
2005年全国高中学生化学竞赛暨(冬令营)理论试题与实验试题及参考答案

2005年全国高中学生化学竞赛决赛理论试题2005. 1. 15. 上海●竞赛时间4.5小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试题和答卷纸装入信封,放在桌面上,立即撤离考场。
●试卷和答卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定位置;用黑色墨水笔或圆珠笔答题。
不得携带任何其它纸张进入考场。
需要额外的答卷纸或草稿纸时可举手向监考老师索取。
在答卷纸页眉自填总页数和页码。
●必须在试题首页左边和每页答卷纸左边指定位置填写营号及姓名,否则按废卷论。
●允许使用非编程计算器以及直尺等文具。
不得携带铅笔盒、通讯工具入场。
第1题(8分)●白色晶体X是用浓硫酸与尿素反应产生的。
X不含结晶水,不吸潮,易溶于水,摩尔质量小于100g·mol-1, 用途广泛,如造纸、纺织、电镀、水处理和有机合成等。
野外地质人员用它来鉴定石灰岩远比用盐酸方便。
在酸性条件下,1摩尔X与过量亚硝酸钠水溶液反应,释放出1摩尔氮气,接着加入过量的BaCl2水溶液,产生1摩尔BaSO4沉淀。
1-1 写出X的结构式和化学名称。
(写不出结构式可从监考教师处得到答案,但要当场扣2分;仍应回答本题其他问题)。
1-2 写出上述制备X的化学方程式。
1-3 写出X在酸性条件下与亚硝酸钠反应的化学方程式。
●在近中性溶液中,1 mol 高碘酸与过量碘化物反应产生1 mol I2 , 将所得溶液酸化,又产生3 mol I2。
1-4 用配平的化学方程式来说明上述现象。
●油气井开采到后期一般需要注水以开采深层油气,过一段时间后往往还要再注入甲醇之类有机溶剂才能产出更多的油气。
1—5 简述注入甲醇的作用。
第2题( 6分)2-1 在答卷纸给出的空模板上画出trans-二氯∙二(2,3-丁二胺)合钴(III)离子的所有几何异构体的结构式。
(注:2,3-丁二胺又名2,3-二氨基丁烷)2-2 指出其中有旋光性的异构体。
2-3 已知其中有一种异构体的氯被其他负一价阴离子取代的速率最慢。
2005年全国高中学生化学竞赛试题及参考答案

中国化学会2005年全国高中学生化学竞赛试题1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te IHf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-LrHLi Be B C N O FNa Mg Al Si P ClS K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se BrRbCsFrSrBaRaYLa Lu-6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]HeNeArKrXeRn相对原子质量Rf Db Sg Bh Hs Mt第1题(9分)用α粒子撞击铋-209合成了砹-211。
所得样品中砹-211的浓度<10-8mol/L,砹-211同位素半衰期较长,足以用它来研究砹的化学性质。
1-1写出合成砹的核反应方程式。
1-2已知室温下用CCl4萃取I2的分配系数为c I2(CCl4)/c I2(H2O)=84,预计用CCl4萃取AtI的分配系数c AtI(CCl4)/c AtI(H2O) 84(填>, < 或=);理由是______________________。
中国化学会2005年全国高中学生化学竞赛省级赛区备用试题及答案

中国化学会2005年全国高中学生化学竞赛(省级赛区)备用试题及答案和评分标准(2005年10月9日 9:00 - 12:00共计3小时)题 号 1 2 3 4 5 6 7 8 9 10总满 分 12 12 10 8 10 10 10 8 12 8100得 分 评卷人● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(12分)将H 2O 2慢慢加入到SbF 5的HF 溶液中得一白色固体A ,A 是一种盐类,其阴离子呈八面体结构。
2005年全国高中化学竞赛决赛理论试题、参考答案、评分细则

!!"@" 给出这种理想结构 的 锂 钴 复 合 氧 化 物 的 化 学 式 %最 简 式 ’"
!!"@$ 锂离子电池必须 先 长 时 间 充 电 后 才 能 使 用" 写 出上述锂钴氧化物作为正极放电时的电极反应"
!!"@0 锂 锰 复 合 氧 化 物 是 另 一 种 锂 离 子 电 池 正 极 材 料"它的理想晶体中有!种 多 面 体)4*>$四 面 体 和 T7>#八 面体#个数比& )!#4*>$四面体相互分离#T7>#八 面 体 的 所 有氧原子全部取自 4*>$四面体"写出这种晶体的化学式" !!"@# 从图"@!获取信 息#说 明 为 什 么 锂 锰 氧 化 物 正
第#题 !!目前商品化的锂离子电池正极几乎都是锂钴复合氧化 物 #其理想结构如答卷纸的图"@&所示" !!"@& 在 答 卷 纸 的 图 "@& 上 用 粗 线 框 出 这 种 理 想 结 构的锂钴复合氧化物晶体的一个晶胞"
!!"@! 这 种 晶 体 的 一 个 晶 胞 里 有 几 个 锂 原 子$几 个 钴 原子和几个氧原子?
多的油气"
!!&(0 简述注入甲醇的作用" 第"题 !!!@& 在答卷纸给出的空模板上画出-/67I@二氯!二 %!#"@丁二胺’合 钴 %aaa’离 子 的 所 有 几 何 异 构 体 的 结 构 式 "
%注 )!#"@ 丁 二 胺 又 名 !#"@ 二 氨 基 丁 烷 ’
!!!@! 指出其中有旋光性的异构体" !!!@" 已知其中有一种异 构 体 的 氯 被 其 他 负 一 价 阴 离 子取代的速率最慢"它是哪一种?如何理解它的这种性质?
安徽化学竞赛真题答案及解析

安徽化学竞赛真题答案及解析近年来,安徽化学竞赛的相关题目备受关注。
参加竞赛的学生们都渴望能够获得一份答案及解析,以便提升自己的学习能力和竞争力。
为了帮助这些学生更好地备战竞赛,本文将对安徽化学竞赛的真题进行解析。
一、选择题1. 某元素的原子核外壳层电子数为4,其原子半径最大的可能原子数是?A. 2B. 8C. 10D. 18答案:B. 8解析:根据元素的电子排布规律,第一层能容纳2个电子,第二层能容纳8个电子,所以原子核外壳层电子数为4时,其最大可能的原子数是8。
2. 烷烃是一类只包含碳和氢元素的有机化合物,其中,判断下列说法中正确的是?A. 烷烃的分子中碳原子的电子形成sp杂化轨道B. 烷烃的分子中碳原子的电子形成sp2杂化轨道C. 烷烃的分子中碳原子的电子形成sp3杂化轨道D. 烷烃的分子中碳原子的电子形成d杂化轨道答案:C. 烷烃的分子中碳原子的电子形成sp3杂化轨道解析:烷烃的分子中碳原子的电子形成sp3杂化轨道,每个碳原子上有四个单独的sp3杂化轨道,形成单键。
因此,选项C是正确的。
二、填空题1. 以下哪个元素在元素周期表中的位置靠前?答案:锂解析:根据元素周期表的排列特点,元素的位置是按照原子序数递增的顺序排列的。
因此,锂的原子序数较小,位置靠前。
2. 氯离子Cl-在水中溶解时发生下列反应:Cl- + H2O → ?答案:HOCl + OH-解析:氯离子在水中溶解时发生电离反应,生成次氯酸和氢氧根离子。
三、解答题1. 请解释下列现象:当过量氢气与氧气在点燃后形成水时,容器外会有明亮的火焰。
解析:当过量的氢气与氧气按照化学计量比点燃时,反应迅速进行,生成大量的水。
由于水的液体形态,当氢气和氧气反应后产生的水蒸气密度较大,不易升腾,因此在反应过程中密封于反应容器内。
而容器外的氢气和氧气则继续燃烧,产生能量并散发出明亮的火焰。
四、综合题某个物质在室温下形成固体,但在高温下会熔化为液体,同时能够导电。
化学竞赛安徽试题及答案

化学竞赛安徽试题及答案一、选择题(每题2分,共20分)1. 下列物质中,属于纯净物的是:A. 空气B. 矿泉水C. 蒸馏水D. 食盐水答案:C2. 化学反应中,质量守恒定律指的是:A. 反应前后元素种类不变B. 反应前后原子种类不变C. 反应前后原子个数不变D. 反应前后物质的总质量不变答案:D3. 根据化学式H2SO4,硫酸中氢、硫、氧元素的质量比是:A. 1:16:32B. 2:64:32C. 2:32:64D. 1:8:32答案:C4. 以下哪种物质不是酸?A. 硫酸B. 醋酸C. 碳酸氢钠D. 盐酸答案:C5. 金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,排在氢后面的金属则不能。
根据这一规律,下列金属中不能与酸反应生成氢气的是:A. 铁B. 铜C. 锌D. 镁答案:B6. 以下化合物中,属于共价化合物的是:A. NaClB. H2OC. NaOHD. MgO答案:B7. 实验室中,常用来检验氨气的方法是:A. 用湿润的红色石蕊试纸B. 用湿润的蓝色石蕊试纸C. 用湿润的pH试纸D. 用湿润的酚酞试纸答案:B8. 根据化学方程式C6H12O6 + 6O2 → 6CO2 + 6H2O,葡萄糖在氧气中完全燃烧生成二氧化碳和水。
根据反应物和生成物的摩尔比,葡萄糖与氧气的摩尔比是:A. 1:6B. 1:3C. 1:1D. 1:2答案:A9. 以下物质中,属于非电解质的是:A. 硫酸B. 氯化钠C. 乙醇D. 氢氧化钠答案:C10. 根据化学方程式2H2 + O2 → 2H2O,氢气与氧气反应生成水。
该反应的化学计量数之比是:A. 2:1:2B. 1:1:1C. 1:2:2D. 2:1:1答案:A二、填空题(每空1分,共20分)1. 根据化学式Na2CO3,碳酸钠中钠、碳、氧元素的质量比是______:______:______。
答案:23:12:482. 金属铝在空气中容易形成一层致密的氧化膜,这层氧化膜的主要成分是______。
年全国高中学生化学竞赛(安徽赛区)初赛试题及参考答案(精校版)

2012年全国高中学生化学竞赛(安徽赛区)初赛试题注意:考试时间3小时,满分150分。
直接在试卷上答题,允许使用非编程计算器。
第一大题(选择题)答案写在下表中,其余题答案写在试卷上1.为了缓解石油危机,科学家正在进行“生物质油”代替柴油的试验。
所谓“生物质油”是指以光合作用产生的植物、农作物等富含纤维素、半纤维素和木质素的物质为原料,采用生物热解液化技术而产生的新能源。
下列有关说法错误的是 A 、生物质油是一种有机化合物 B 、这一类能源属于可再生能源 C 、利用生物质能就是间接利用太阳能D 、生物质油提炼技术中只要利用的是化学变化2.一块铜板被等分成两块,Cu(a)和Cu(b);锤打Cu(a),Cu(b)不动。
再由Cu(a)、Cu(b)及CuSO 4溶液组成电池:Cu(a)|CuSO 4(c mol/L)|Cu(b),测得电动势E >0,因为Cu(a)的A .ΔS >0,ΔH =0B .ΔS >0,ΔH <=0C .ΔS ><0,ΔH =0D .ΔS <0,ΔH <0一、本题包括25小题,每小题2分,共50分。
每小题有1个或2个选项符合题意,若该题只有1个选项符合题意,多选或错选均不得分。
若该题有2个选项符合题意,选对1个得1分,选对2个得2分;错选1个该题不得分。
3.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC ),RFC 是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。
下图为RFC 工作原理示意图,有关说法正确的是 A 、当有0.1mol 电子转移时,a 电极产生1.12L H 2(标准状况下)B 、b 电极上发生的电极反应是: 4H 2O+4e -=2H 2↑+4OH-C 、c 电极上进行还原反应,B 电池中的H +可以通过 隔膜进入A 池D 、d 电极上发生的电极反应是:O 2+4H ++4e -=2H 2O 4.室温下,下列各组离子在指定溶液中一定能大量共存的是A .pH=12的溶液中:AlO 2-、Na +、SO 42-、SO 32-B .水电离出的c (H +)=10﹣12mol/L 的溶液中:K +、Na +、SO 42-、AlO 2-C .能与铝反应生成氢气的溶液中:Mg 2+、Na +、Cl -、NO 3-D .c (H +)=0.10mol/L 的溶液中:CH3COO -、NH 4+、Cl -、Na +5.已知化学反应A 2(g)+B 2(g)=2AB(g)的能量变化如右图所示,下列叙述中正确的是A .每生成2分子AB 吸收bkJ 热量 B .该反应焓变为ΔH=+(a -b)kJ/molC .该反应中反应物的总能量高于生成物的总能量D .断裂1molA -A 键和1molB -B 键,放出a kJ 能量6.中学化学教材中有大量的数据教材,下面是某学生对数据的利用情况,其中错误的是 A .利用K sp 数据可判断BaCO 3与Na 2SO 4溶液能否反应 B .利用沸点数据可推测将一些液体混合物分离出来的可能性 C .利用第一电离能数据可判断同周期元素的金属性强弱 D .利用液体密度可以判断液体物质挥发的难易7.As 2S 3和HNO 3有如下反应:As 2S 3+10H -++10NO 3-→2H 3AsO 4+3S+10NO 2↑+2H 2O ,下列说法正确的是 A .生成1mol H 3AsO 4时,转移电子个数为10N AB .将该反应设计成一原电池,则NO 2应该在正极附近逸出C .该反应的氧化产物之一为SD .反应产物NO 2与11.2LO 2(标准状况)混合后用水吸收全部转化为浓HNO 3,然后与过量的碳反应,所产生的CO 2的量为0.5mol能量(kJ ·mol -1)1molA 2 1molB 22molABab8.关于下列各装置的叙述中,错误的是 A .装置①中,d 为阳极、c 为阴极 B .装置②可用于收集H 2、CO 2 C .装置③中X 若为CCl 4,可用于吸收 氨气或氯化氢,并能防倒吸D .装置④可用于干燥、收集NH3,并吸收多余的氨气9.可逆反应2A(g)+B(g) 2C(g),根据下表中的数据判断下列图像错误的是A .B .C .D .10.能正确表示下列反应的离子方程式的是A .足量的硫酸铝溶液与纯碱溶液反应:2Al 3++3CO 32-+3H 2O =2Al(OH)3↓+3CO 2↑ B .NaHS 溶液的水解方程式:HS ﹣+H 2O H 3O ++S 2﹣C .Fe(OH)3与足量的HI 溶液反应:Fe(OH)3+3H +=Fe 3++3H 2OD .向饱和亚硫酸氢钠溶液中加入足量的NaOH 溶液:Ba 2++2HSO 3-+2OH -=BaSO 3+2H 2O+SO 32-11.在室温下,向氢硫酸中通入二氧化硫气体,溶液的pH 发生变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
年全国高中化学竞赛(安徽赛区)初赛试题(考试时间3小时,满分150分)H 1.008 元素周期表He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-La注意:答案必须写在答题卷上,写在试题卷上无效......................。
一、本题包括25小题,每小题2分,共50分。
每小题有1个或2个选项符合题意。
若该题只有1个选项合题意,多选或错选均不得分。
若该题有2个选项合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
⒈我国有些煤矿的坑道中具有丰富的可燃性气体。
目前已建成利用坑道气的发电厂,这样既充分利用了能源,又保证了煤矿的安全生产,坑道中的可燃性气体是A.H2B.COC.CH4D. CH4和CO的混合气体⒉A是烷烃,B是单烯烃,B分子中的碳原子数比A分子中多。
常温下1L该混合气体充分燃烧可得到同温同压下的二氧化碳气体2.5L,则原混合气体中A和B的组合方式可能有A.2和B.3和C.4和D.5和⒊某种混合气体,可能含有N2、HCl、CO。
把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化;再通过足量的Na2O2固体,气体体积减小;最后通过灼热的铜丝,经充分反应后气体体积又减小,但还有气体剩余。
以下对混合气体组分的判断中,正确是A.一定有N2、HCl,没有COB.一定有N2,CO和HCl中至少有一种C.一定有N2、CO和HClD.一定没有N2,CO和HCl中至少有一种⒋设硫酸为二元强酸,现有0.01mol/LH2SO4溶液滴定0.01mol/L NaOH溶液,中和后加至100mL。
若滴定终点判断有误差:①多加了1滴H2SO4溶液;②少加了1滴H2SO4溶液(1滴溶液的体积约为0.05mL),则①和②两种情况下溶液中[H+]之比的值是A.10B.50C.5×103D. 104⒌下列电子排布式中,属于第121号元素的是A.[118]5g18s2B.[118]8s28p1C.[118]7d18s2D.[118]6f18s2在呈强酸性的无色溶液中,能大量共存的离子组是A.Al3+、Cu2+、SO42-、Cl-B.Na+、K+、CO32-、NO3-C.NH4+、Mg2+、SO42-、Cl-D.Ag+、Ca2+、Cl-、NO3-⒎已知在pH值为4左右的环境中,Ca2+、Fe2+几乎不水解,而Fe3+几乎完全水解。
工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。
欲除去溶液中的杂质离子,下述方法中可行的是A.加入纯Cu将Fe2+还原为FeB.向溶液中通入H2S使Fe2+沉淀C.向溶液中通入Cl2,再通入NH3,调节pH值为4左右D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4左右⒏金刚烷(C10H16)是一种重要的脂肪烷烃,其结构高度对称,如右图所示。
金刚烷能与卤素发生取代反应,其中一氯一溴金刚烷(C10H14ClBr)的同分异构体数目是A.4种B.6种C.8种D.10种⒐在配平P4+CuSO4+H2O→Cu3P+H3PO4+ H2SO4时,H2O前面的化学计量数应为A.60B.70C.85D.96⒑下列离子方程式正确的是A.等物质的量的Ba(OH)2与明矾加入足量水中3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓B.Fe(OH)3溶于氢碘酸+3H+= Fe3++3H2OFe(OH)C. H218O中投入Na2O2固体2H218O+ 2O22-=4OH-+ 18O2↑D.CuCl2溶液中加入NaHS溶液Cu 2++2HS-+2H2O=Cu(OH)2↓+2H2S↑⒒某钾(·)的石墨嵌入化合物沿c轴的投影图如图,该化合物的化学式为A.KC12B. KC10C. KC8D. KC6⒓右图是正四面体的原子簇Au n一个三角面图,根据该图,确定Au n 中的n数值为A.47B.18C.19D.20⒔下面二维平面晶体所表示的化学式为AX3的是A. B. C. D.⒕Na2SO4溶液的溶解度曲线如右图,下列说法错误的是A.A点表示Na2SO4溶液尚未达到饱和,但降温或加入Na2SO4固体都可使其饱和B. Na 2SO 4的溶解度随着温度的升高而增大C.在t ℃时给Na 2SO 4饱和溶液降温或升温,都会使其溶液变浑浊D.制取芒硝的最佳方法是在100℃时配成Na 2SO 4的饱和溶液,并降温至0℃,可析出Na 2SO 4·H 2O 晶体⒖分子中含有n 个碳碳双键的烯烃的分子量为M ,wg 该烯烃和标准状况下VL 的H 2恰好完全反应,则每摩尔该烯烃的分子中所含碳碳双键的数目为(N A 表示阿伏加德罗常数)A.MV w 4.22B.w MVN AC. w MVN A 4.22D. wM VN A 2⒗下面官能团在芳香苯环的取代反应中,不是邻、对位定位基团的是A.-R (烷基)B.-OHC. D.-NH 2⒘在20%的NaOH 溶液中,用丙酮在100℃条件下与反应得到的主要产物是A.B.C.D.⒙下面有机物中,无顺反异构体的是A.(CH 3)2C=CHCH 3B. CH 3CBr=CHC 2H 5C. CH 3CH=CHCH 3D. CH 3CH=CHC 2H 5⒚下面反应中,主要产物为.(CH 3)3C-OCH 3(甲基叔丁基醚)的是A. (CH 3)3C-ONa+CH 3IB.C. (CH 3)3CCl+KOCH3D.⒛反应的主要产物是 A. B.CH CH CH 3CH 2+O H 2H 2SO 4C.D.21.反应(CH 3)3C-OH的主要产物是 A. (CH 3)3C-C-C(CH 3)3 B. (CH 3)3CHC. (CH 3)2C=CH 2D.CH 2=CH-CH=CH 222. 下列关于2SO 2+ O22SO 3的说法中,不正确的是A. 增加O 2,有利于平衡正向移动B. 催化剂有利于平衡正向移动C. 增大压强有利于平衡正向移动D. 通入N 2有利于平衡正向移动23.下面反应中,不能合成1-丙醇的是A. CH 3CH 2COOHCH 3CH 2CH 2OH B. CH 3CH =CH 2CH 3CH 2CH 2Br CH 3CH 2CH 2OH C. CH 3CH 2BrCH 3CH 2MgBr CH 3CH 2CH 2OH D. CH 3CH =CH2 CH 3CH 2CH 2OH24. 对于反应F 2+H 2O=HOF+HF 而言,下列说法中正确的是A.由含氧酸的定义可知,HOF 是次氟酸B.在反应产物中,氟的氧化数分别为+1、-1C.在上述反应中,氟气既是氧化剂,又是还原剂D.在该反应中,水是还原剂25.现有反应:R C CH 3O 3Br 2OH -R C CBr 3O +3H 2O OH -?下面物质中是该反应的主要产物的是A.CHBr 3B.HOCBr 3C. D.二、本题包括5小题,共29分。
26. (3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。
小心地在烧杯中央滴入CuSO 4溶液。
⑴经过一段时间后,观察到的现象是(指金属圈)▲。
A.铁圈和银圈左右摇摆不定B.保持平衡状态不变C.铁圈向下倾斜D.银圈向下倾斜⑵产生上述现象的原因是 ▲ 。
27. (4分)以铜为阳极,石墨为阴极,用含3~5gNaOH 的15%NaCl 的混合溶液做电解液,外加电压为1.5V 电解时,得到一种半导体产品(产率93%以上)和一种清洁能源,则它的阳极反应式为 ① ,阴极反应式为 ② ;电解也是绿色化学中一种有效工具,试以此为例,写出绿色化学的两点特征: ③ 和 ④ 。
28. (10分)下图中E 是一种固体的非金属单质,A 、B 、D 、F 、G 、H 中都含有E 元素,A 、C 、F 、H 、G 都含有相同的阳离子,G 加入含碘的淀粉蓝色溶液,蓝色褪去。
⑴试写出A ~H 的分子式:A ▲ ;B ▲ ;C ▲ ;D ▲ ;E ▲ ;F ▲ ;G ▲ ;H ▲ 。
⑵写出G 与单质碘反应的离子方程式。
29. (5分)某溶液中可能含有下列物质中的两种:HCl 、NaOH 、NaH 2PO 4、Na 3 PO 4、H 3 PO 4和Na 2HPO 4。
⑴这六种物质两两间可能形成 ① 种互相不发生反应的组合。
⑵取某种组合溶液,滴入甲基红指示剂后为黄色(pH=6.2),再滴入酚酞指示剂后仍是黄色(酚酞无色,pH≤8.0),则此组合是 ② 和 ③ 的组合液。
⑶取另一组合溶液xmL ,以甲基橙作指示剂,用c mol/LNaOH 溶液滴定至红橙色(此时pH 约为9.6左右),又消耗V 1mL(V>V 1),试确定此组合溶液是 ④ 和 ⑤ 物质组成的。
30. (7分)我国东方Ⅱ号宇宙火箭的燃料是N 2H 2(CH 3)2,助燃剂为N 2O 4,两者发生完全燃烧时产生了巨大推力,让火箭携带卫星上天。
⑴N 2H 2(CH 3)2中N 的氧化数为 ① ,N 2O 4中N 的氧化数为 ② 。
⑵完全燃烧反应的化学方程式为 ③ 。
⑶试写出N 2O 4中N 、N 连接的一种Lewis 结构式并标出形式电荷 ④ 。
⑷N 2H 4与N 2O 4比较, ⑤ 的N -N 键长较长,其理由是 ⑥ 。
HGE A FBCDO 2 NH 3·H 2OHCl5小题,共28分。
31. (4分)将下面标数字的方框中的主要产物填在答题纸上。
