阿司匹林质量标准
阿司匹林的质量标准

石河子大学小学期制实验结课论文阿司匹林的质量标准、姓名:王义西班级:药学(3)班学号:73指导老师:李乐日期:2013年9月3日乙酰水杨酸抗炎药物的分析王义西石河子大学药学院小学期药学第三组第三实验组摘要阿司匹林,化学名为2-( 乙酰氧基) 苯甲酸,作为主要的解热镇痛抗炎药收载于《中国药典》 (2010 年版)二部,临床上主要用于治疗感冒发烧, 牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等, 是风湿、类风湿关节炎治疗的常用药物。
本品主要的副作用是引起幽门痉挛及刺激胃黏膜的胃肠道反应, 长期服用导致胃肠出血。
随着现代药学技术的发展,目前已有片剂、肠溶片、肠溶胶囊、泡腾片和栓剂等多种剂型,以阿司匹林为主药的复方制剂也层出不穷,形成了阿司匹林含量测定方法的各异性。
随着科学技术的进步,各种仪器设备、新方法也应用到了阿司匹林的鉴别、杂质检查、含量测定中,本文对其作一综述。
关键词: 阿司匹林鉴别杂质检查含量测定 HPLC 紫外分光光度法TLC阿司匹林临床上主要用于治疗感冒发烧, 牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等, 是风湿、类风湿关节炎治疗的常用药物。
本文主要对阿司匹林做一综合论述,通过对阿司匹林的性状、鉴别、杂质检查、含量测定四个方面对乙酰水杨酸进行药物分析。
1 实验部分仪器与试剂仪器:紫外分光光度计(Cintra404,GBC)、电子天平(AB135-S,梅特勒-托利多仪器(上海)有限公司METTLER TOLEDO)、微孔滤膜(尺寸25mm,孔径μ,上海半岛实业有限公司净入器材厂)高效液相色谱仪、紫外检测器、自动进样器、色谱数据处理机、U V 一26 0 分光光度计、HPLC 色谱柱、超纯水器、展开槽、水浴锅、研钵、移液管(1、2、5、10ml)、吸耳球、容量瓶(25、50、100ml)、烧杯(10、100、500ml)、胶头吸管、直尺试剂:复方乙酰水杨酸片(25mg/片):阿司匹林贮备液溶液(ml)、无水乙醇、氯仿、丙酮、冰醋酸、甲醇、95%乙醇、酚酞指示液、碳酸钠试液,稀盐酸、稀硫酸、三氯化铁试液、乙醚、硫酸铁铵试液(新制)、蒸馏水性状阿司匹林为白色结晶或结晶性粉末;遇湿气即缓缓水解。
阿司匹林肠溶片成品内控标准
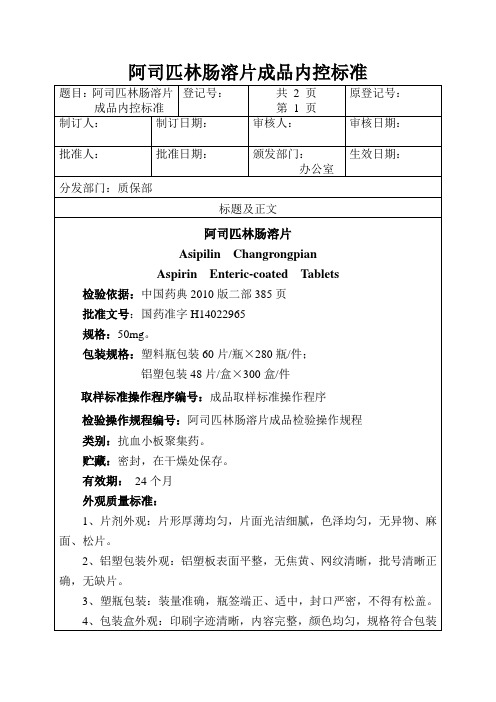
题目:阿司匹林肠溶片
成品内控标准
登记号:
共2页
第1页
原登记号:
制订人:
制订日期:
审核人:
审核日期:
批准人:
批准日生效日期:
分发部门:质保部
标题及正文
阿司匹林肠溶片
Aspirin Enteric-coated Tablets
检验依据:中国药典2010版二部385页
定性和定量的限度要求
标准项目
中国药典2010版
合格品标准
内控标准
性状
肠溶包衣片,除去包衣后显白色
肠溶包衣片,除去包衣后显白色
鉴别
1、2呈正反应
1、2呈正反应
重量差异
±7.5%
±7.5%
游离水杨酸
≤1.5%
≤1.5%
释放度
≥70%
≥70%
片剂脆碎度
<1%
<0.8%
微生物限度
符合规定
符合规定
含量
93..0%~107.0%
批准文号:国药准字H14022965
规格:50mg。
包装规格:塑料瓶包装60片/瓶×280瓶/件;
铝塑包装48片/盒×300盒/件
取样标准操作程序编号:成品取样标准操作程序
检验操作规程编号:阿司匹林肠溶片成品检验操作规程
类别:抗血小板聚集药。
贮藏:密封,在干燥处保存。
有效期:24个月
外观质量标准:
1、片剂外观:片形厚薄均匀,片面光洁细腻,色泽均匀,无异物、麻面、松片。
2、铝塑包装外观:铝塑板表面平整,无焦黄、网纹清晰,批号清晰正确,无缺片。
3、塑瓶包装:装量准确,瓶签端正、适中,封口严密,不得有松盖。
USP 35阿司匹林原料药质量标准

USP 35Official Monographs / Aspirin 2245W = weight of Sample (mg)•USP R EFERENCE S TANDARDS 〈11〉Acceptance criteria: 98.5%–101.5% on the dried basis USP Aspartic Acid RSIMPURITIES•R ESIDUE ON I GNITION 〈281〉: NMT 0.1%•C HLORIDE AND S ULFATE , Chloride 〈221〉Sample solution: Dissolve 0.7 g of Aspartic Acid in 10 mL Aspirinof diluted nitric acid, and dilute with water to 15 mL.Acceptance criteria: The Sample solution shows no more chloride than corresponds to 0.20 mL of 0.020 N hydrochloric acid (NMT 0.02%).•C HLORIDE AND S ULFATE , Sulfate 〈221〉Sample solution: Dissolve 0.8 g of Aspartic Acid in 4 mL of hydrochloric acid, and dilute with water to 15 mL.C 9H 8O 4180.16Acceptance criteria: The Sample solution shows no more Benzoic acid, 2-(acetyloxy)-.sulfate than corresponds to 0.25 mL of 0.020 N sulfuric acid Salicylic acid acetate [50-78-2].(NMT 0.03%).•I RON 〈241〉: NMT 10 ppm» Aspirin contains not less than 99.5 per cent and •H EAVY M ETALS , Method II 〈231〉: NMT 10 ppm not more than 100.5 per cent of C 9H 8O 4, calcu-•C HROMATOGRAPHIC P URITYSystem suitability solution: 10 mg each of USP Aspartic lated on the dried basis.Acid RS and glutamic acid in 2 mL of ammonia TS. Dilute Packaging and storage—Preserve in tight containers.with water to 25.0 mL.Standard solution: Transfer 5 mg of USP Aspartic Acid RS to USP Reference standards 〈11〉—a 100-mL volumetric flask, dissolve in 2 mL of 17%USP Aspirin RS ammonia solution (prepared by diluting ammonium Identification—hydroxide, 6 in 10), and dilute with water to volume.Sample solution: Transfer 0.1 g of Aspartic Acid to a 10-mL A: Heat it with water for several minutes, cool, and add 1 or volumetric flask, dissolve in 2 mL of 17% ammonia solution 2 drops of ferric chloride TS: a violet-red color is produced.(prepared by diluting ammonium hydroxide, 6 in 10), and B: Infrared Absorption 〈197K 〉.dilute with water to volume.Loss on drying 〈731〉—Dry it over silica gel for 5 hours: it Chromatographic systemloses not more than 0.5% of its weight.(See Chromatography 〈621〉, Thin-Layer Chromatography .)Readily carbonizable substances 〈271〉—Dissolve 500 mg in Mode: TLC5 mL of sulfuric acid : the solution has no more color than Adsorbent: 0.25-mm layer of chromatographic silica gel Matching Fluid Q.mixtureApplication volume: 5 µLResidue on ignition 〈281〉: not more than 0.05%.Developing solvent system: Butyl alcohol, glacial acetic Substances insoluble in sodium carbonate TS—A solution acid, and water (3:1:1)of 500 mg in 10 mL of warm sodium carbonate TS is clear.Spray reagent: 2 mg/mL of ninhydrin in a mixture of butyl Chloride 〈221〉—Boil 1.5 g with 75 mL of water for 5 minutes,alcohol and 2N acetic acid (95:5)cool, add sufficient water to restore the original volume, and System suitabilityfilter. A 25-mL portion of the filtrate shows no more chloride Sample: System suitability solutionthan corresponds to 0.10 mL of 0.020 N hydrochloric acid Suitability requirement: The chromatogram of the System (0.014%).suitability solution exhibits two clearly separated spots.Sulfate —Dissolve 6.0 g in 37 mL of acetone, and add 3 mL of Analysiswater. Titrate potentiometrically with 0.02 M lead per chlorate,Samples: System suitability solution , Standard solution , and prepared by dissolving 9.20 g of lead per chlorate in water to Sample solutionmake 1000 mL of solution, using a pH meter capable of a mini-Proceed as directed in the chapter, except dr y the plate at mum reproducibility of ±0.1 mV (see pH 〈791〉) and equipped 80° for 30 min, spray with Spray reagent , and heat at 80°with an electrode system consisting of a lead-specific electrode for 30 min. Examine the plate under white light.and a silver–silver chloride reference glass-sleeved electrodeAcceptance criteria: No secondar y spot from the Sample containing a solution of tetraethylammonium per chlorate in gla-solution is larger or more intense than the principal spot cial acetic acid (1 in 44) (see Titrimetry 〈541〉): not more than from the Standard solution .1.25 mL of 0.02 M lead per chlorate is consumed (0.04%).Individual impurities: NMT 0.5%[NOTE —After use, rinse the lead-specific electrode with water,Total impurities: NMT2.0%drain the reference electrode, flush with water, rinse with meth-anol, and allow to dr y.]SPECIFIC TESTS•O PTICAL R OTATION , Specific Rotation 〈781S 〉Heavy metals—Dissolve 2g in 25 mL of acetone, and add 1Sample solution: 80 mg/mL in 6N hydrochloric acid mL of water. Add 1.2 mL of thioacetamide–glycerin base TSAcceptance criteria: +24.0° to +26.0°, at 20°and 2 mL of pH 3.5 Acetate Buffer (see Heavy Metals 〈231〉), and •L OSS ON D RYING 〈731〉: Dry a sample at 105° for 3 h: it loses allow to stand for 5 minutes: any color produced is not darker NMT 0.5% of its weight.than that of a control made with 25 mL of acetone and 2 mL of Standard Lead Solution (see Heavy Metals 〈231〉), treated in ADDITIONAL REQUIREMENTSthe same manner. The limit is 10 µg per g.•P ACKAGING AND S TORAGE : Preserve in well-closed containers,Limit of free salicylic acid—Dissolve 2.5 g in sufficient alco-and store protected from light.hol to make 25.0 mL. T o each of two matched color-compari-son tubes add 48 mL of water and 1 mL of a freshly prepared,diluted ferric ammonium sulfate solution (prepared by adding 1mL of 1N hydrochloric acid to 2 mL of ferric ammonium sul-fate TS and diluting with water to 100 mL). Into one tube pipet 1 mL of a standard solution of salicylic acid in water, containing 0.10 mg of salicylic acid per mL. Into the second tube pipet 1mL of the 1 in 10 solution of Aspirin. Mix the contents of each tube: after 30 seconds, the color in the second tube is not2246Aspirin / Official MonographsUSP 35more intense than that in the tube containing the salicylic acid Standard preparation—Prepare a solution in Diluting solution (0.1%).having known concentrations of about 0.4 mg of USP Aspirin RS and 0.01 mg of USP Salicylic Acid RS per mL.Assay—Place about 1.5 g of Aspirin, accurately weighed, in a flask, add 50.0 mL of 0.5 N sodium hydroxide VS, and boil the Assay preparation—Weigh and finely powder not fewer than mixture gently for 10 minutes. Add phenolphthalein TS, and 10 Boluses. Transfer an accurately weighed portion of the pow-titrate the excess sodium hydroxide with 0.5 N sulfuric acid VS.der, equivalent to about 400 mg of aspirin, to a 100-mL volu-Perform a blank determination (see Residual Titrations under Ti-metric flask, dilute with Diluting solution to volume, and stir by trimetry 〈541〉). Each mL of 0.5 N sodium hydroxide is equiva-mechanical means for about 15 minutes. Pass a portion of this lent to 45.04 mg of C 9H 8O 4.solution through a filter having a 0.5-µm or finer porosity, and use the filtrate as the Assay preparation .Chromatographic system (see Chromatography 〈621〉)—The liquid chromatograph is equipped with a 254-nm detector and a 4.6-mm × 25-cm column that contains 5-µm packing L1. The Aspirin Bolusesflow rate is about 1 mL per minute. Chromatograph the Stan-dard preparation , and record the peak responses as directed for » Aspirin Boluses contain not less than 90.0 per-Procedure: the relative retention times are about 0.6 for salicylic acid and 1.0 for aspirin, and the relative standard deviation of cent and not more than 110.0 per cent of the the aspirin peak response for replicate injections is not more labeled amount of aspirin (C 9H 8O 4).than 2.0%.Packaging and storage—Preserve in tight containers.Procedure—Separately inject equal volumes (about 20 µL) of the Standard preparation and the Assay preparation into the Labeling—Label Boluses to indicate that they are for veterinar y chromatograph, record the chromatograms, and measure the use only.responses for the major peaks. Calculate the quantity, in mg, of USP Reference standards 〈11〉—aspirin (C 9H 8O 4) in the portion of Boluses taken by the formula:USP Aspirin RS1000C (r U /r S )USP Salicylic Acid RS Identification—in which C is the concentration, in mg per mL, of USP Aspirin A: Crush 1 Bolus, boil a portion of the powder, equivalent to RS in the Standard preparation; and r U and r S are the aspirin about 300 mg of aspirin, with 50 mL of water, cool, and add a peak responses obtained from the Assay preparation and the drop of ferric chloride TS: a violet-red color is produced.Standard preparation, respectively.B: The retention time of the aspirin peak in the chromato-gram of the Assay preparation corresponds to that in the chro-matogram of the Standard preparation, as obtained in the Assay .Dissolution 〈711〉—Aspirin CapsulesMedium: 0.5 M phosphate buffer, pH 7.4; 900 mL.Apparatus 2: 75 rpm.» Aspirin Capsules contain not less than 93.0 per-Time: 45 minutes.cent and not more than 107.0 per cent of the Diluting solution—Prepare a mixture of acetonitrile and for-labeled amount of aspirin (C 9H 8O 4).mic acid (99:1).NOTE —Capsules that are enteric-coated or the Procedure—Determine the amount of aspirin (C 9H 8O 4) dis-contents of which are enteric-coated meet the solved by employing UV absorption at the wavelength of the isosbestic point of aspirin and salicylic acid at 265±2 nm on requirements for Aspirin Delayed-Release Capsules .filtered portions of the solution under test, suitably diluted with Packaging and storage—Preserve in tight containers.Diluting solution, if necessar y, in comparison with a Standard solution having a known concentration of USP Aspirin RS in the USP Reference standards 〈11〉—same Medium . [NOTE —Prepare the Standard solution at the time USP Aspirin RS of use.]Identification—Tolerances—Not less than 80% (Q) of the labeled amount of C 9H 8O 4 is dissolved in 45 minutes.A: Heat about 100 mg of the Capsule contents with 10 mL of water for several minutes, cool, and add 1 drop of ferric Uniformity of dosage units 〈905〉: meet the requirements.chloride TS: a violet-red color is produced.Limit of salicylic acid—Using the chromatograms of the B: Shake a quantity of the contents of Capsules, equivalent Standard preparation and the Assay preparation, obtained as di-to about 500 mg of aspirin, with 10 mL of alcohol for several rected in the Assay, calculate the per centage of salicylic acid minutes. Centrifuge the mixture. Pour off the clear supernatant (C 7H 6O 3) in the portion of Boluses taken by the formula:and evaporate it to dr yness. Dry the residue in vacuum at 60°for 1 hour: the residue responds to Identification test B under 100,000(C /W A )(r U /r S )Aspirin .in which C is the concentration, in mg per mL, of USP Salicylic Dissolution 〈711〉—Acid RS in the Standard preparation; W A is the quantity, in mg,Medium: 0.05 M acetate buffer, prepared by mixing 2.99of aspirin (C 9H 8O 4) in the portion of Boluses taken, as deter-g of sodium acetate trihydrate and 1.66 mL of glacial acetic mined in the Assay; and r U and r S are the salicylic acid peakacid with water to obtain 1000 mL of solution having a pH of responses obtained from the Assay preparation and the Standard 4.50 ± 0.05; 500 mL.preparation, respectively: not more than 0.3% is found.Apparatus 1: 100 rpm.Assay—Time: 30 minutes.Mobile phase—Dissolve 2g of sodium 1-heptanesulfonate in Procedure—Determine the amount of C 9H 8O 4 dissolved from a mixture of 850 mL of water and 150 mL of acetonitrile, and UV absorbances at the wavelength of the isosbestic point of adjust with glacial acetic acid to a pH of 3.4. Make any neces-aspirin and salicylic acid at 265±2 nm of filtered portions of sary adjustments (see System Suitability under Chromatography the solution under test, suitably diluted with Medium, if neces-〈621〉).sary, in comparison with a Standard solution having a known Diluting solution—Prepare a mixture of acetonitrile and for-concentration of USP Aspirin RS in the same Medium. [NOTE —mic acid (99:1).。
阿司匹林的纯度检测及含量测定

阿司匹林的纯度检测及含量测定阿司匹林,作为一种常见的药物,在医药领域发挥着重要作用。
无论是用于缓解疼痛、退热,还是在心血管疾病的预防和治疗中,其纯度和含量的准确测定都至关重要。
这不仅关系到药物的疗效,还直接影响着患者的健康和安全。
要了解阿司匹林的纯度检测及含量测定,首先得清楚阿司匹林的化学性质。
阿司匹林的化学名称为乙酰水杨酸,其分子结构包含一个乙酰基和一个水杨酸基团。
纯度检测的方法多种多样。
其中,色谱法是一种常用且有效的手段。
高效液相色谱法(HPLC)可以精确地分离和检测阿司匹林中的杂质。
在进行 HPLC 分析时,样品会被注入到色谱柱中,不同的成分会在流动相的带动下以不同的速度通过色谱柱,从而实现分离。
通过与标准品的对比,可以判断样品中是否存在杂质以及杂质的种类和含量。
另一种常用的纯度检测方法是红外光谱法。
阿司匹林具有特定的红外吸收峰,通过对样品红外光谱的分析,可以与标准图谱进行对比,从而判断其纯度。
如果样品的红外光谱与标准图谱存在差异,就可能表明存在杂质。
而对于阿司匹林的含量测定,容量分析法是经典的方法之一。
比如酸碱滴定法,利用阿司匹林分子中的羧基能与碱发生中和反应的性质。
首先将阿司匹林溶解在适当的溶剂中,然后用已知浓度的碱溶液进行滴定,通过消耗碱溶液的体积来计算阿司匹林的含量。
此外,还有紫外分光光度法也常用于阿司匹林的含量测定。
阿司匹林在特定波长下具有一定的吸光度,通过测量样品在该波长下的吸光度,并与标准曲线对比,就可以计算出阿司匹林的含量。
在进行纯度检测和含量测定的实验过程中,有许多需要注意的事项。
首先是样品的处理,要确保样品充分溶解并且不发生分解或变质。
其次,实验所使用的试剂和仪器都需要经过严格的校准和验证,以保证实验结果的准确性。
在实际应用中,阿司匹林的纯度和含量测定对于药品生产企业来说意义重大。
在生产过程中,通过定期对产品进行检测,可以及时发现问题,调整生产工艺,确保产品质量符合标准。
阿司匹林含量测定

阿司匹林含量测定摘要:阿司匹林是一种常见的非甾体解热镇痛药,现在也用于心血管疾病的治疗,由于其历史悠久,所以至今已经有许多对于阿司匹林含量的测定,例如酸碱滴定法,紫外分光光度法,高效液相色谱法等。
2010版中中国药典中主要记载的方法主要有直接滴定法和高效液相色谱法。
关键词:阿司匹林,含量,体内,体外正文:一. 阿司匹林原料药的含量测定:1. 体外:1.1 直接滴定法:取阿司匹林原料药约0.4g,精密称定,加入中性乙醇(对酚酞指示液显中性) 酚酞指示剂,用氢氧化钠滴定液(0.1mol/L)20ml振摇,完全溶解后,加3滴直接滴定。
氢氧化钠滴定液(0.1mol/L)的滴定度T为18.02mg/ml,即每1ml的氢氧化钠滴定液(0.1mol/L)相当于18.02mg的C9H8O4。
滴定至溶液从无色变成淡粉红色即为滴定终点。
记录滴定液的消耗量V。
含量(%)=(V*T/W)*100%= (V*18.02/(0.4*1000))*100%1.2 水解后剩余滴定法:[1]取阿司匹林原料药约1.5g,精密称定,加氢氧化钠滴定液(0.5mol/L)50.0ml混合,缓缓煮沸10分钟,放冷,加酚酞指示剂,用硫酸滴定液(0.25mol/L)滴定,并将滴定结果用空白试验校正。
每1ml的氢氧化钠滴定液(0.5mol/L)相当于45.04mg的C9H8O4。
含量(%)=(V0—V)*F*T/W*100%=(V0—V)*F*18.02/(0.4*1000)*100% (V0为空白实验消耗的硫酸滴定液的体积(ml);V为样品测定时消耗硫酸滴定液的体积(ml);W为阿司匹林样品的取样量(g);F 为硫酸滴定液的浓度的校正因素;T为氢氧化钠滴定液的滴定度。
)1.3 HPLC法测定阿司匹林原料药含量以C18柱(150mm*4.6mm,5µm)为色谱柱,0.2%庚烷磺酸钠—乙腈(85:15)(用冰醋酸调PH至3.4)为流动相;检测波长为280nm;柱温30?;流速;1.0ml/min ;理论塔板数按阿司匹林峰计算应不低于3000。
阿司匹林泡腾片质量检测标准分析概要

【鉴别】
(1)取本品内容物适量(约相当于阿司匹林0.lg),加水10ml ,煮沸,放冷,加三氣化铁试液1滴,即显紫堇色。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的 保留时间应与对照品溶液主峰的保留时间一致。
【检查】 游离水杨酸 临用新制。取含量测定项下细粉适量(约相当于阿司 匹林0.lg),精密称定,置100ml量瓶中,加1%冰醋酸的甲醇溶液振 摇使阿司匹林溶解并稀释至刻度,摇勻,滤膜滤过,取续滤液作为 供试品溶液;取水杨酸对照品约15mg,精密称定,置50ml量瓶中, 加1%冰醋酸的甲醇溶液溶解并稀释至刻度,摇匀,精密量取lml置 10ml量瓶中,用1%冰醋酸的甲酵溶液稀释至刻度,摇匀,作为对照 品溶液;照阿司匹林游离水杨酸项下的方法测定(照高效液相色谱 法(通则0512)试验。用十八烷基硅烷键合硅胶为填充剂;以乙腈四氢呋喃-冰醋酸-水(20:5:5:70)为流动相;检测波长为303nm。理 论板数按水杨酸峰计算不低于5000,阿司匹林峰与水杨酸峰的分离 度应符合要求,立即精密量取对照品溶液与供试品溶液各10μl分 别注入液相色谱仪,记录色谱图)。供试品溶液色谱图中如有与水 杨酸峰保留时间一致的色谱峰,按外标法以峰面积计算,不得过阿 司匹林标示量的3.0% 。
药物分析/典型药物分析
阿司匹林泡腾片质量检测标准分析
制作人:石磊
阿司匹林泡腾片 Asipilin Paotengpian Aspirin Effervescent Tablets
本品含阿司匹林(C9H8O4 ) 应为标示量的90在的小黄点。
其他 除脆碎度外,应符合片剂项下有关的各项规定(通则0101)。
阿司匹林肠溶片质量研究

阿司匹林肠溶片质量研究钟胜佳;陈婷【摘要】目的 :分析阿司匹林肠溶片的质量.方法 :采用HPLC方法检测阿司匹林肠溶片中的含量,以摇篮法检测不同溶出介质中阿司匹林肠溶片的释放情况.结果 :阿司匹林浓度进样量在3.43~58.54μg之间,范围中和峰面积具有较好的线性关系,平均回收率相对较高.阿司匹林肠溶片在pH1.0溶液1.5h、pH7.5磷酸盐缓冲溶液中1.5h未能够溶出,在pH6.8磷酸盐缓冲液中得到释放,1.5h累积释放度高达80%.结论 :阿司匹林肠溶片含量与释放度检测方式比较简单,且准确率相对较高,可以作为质量控制的标准,为患者的临床治疗活动奠定良好基础.【期刊名称】《数理医药学杂志》【年(卷),期】2019(032)004【总页数】2页(P594-595)【关键词】阿司匹林肠溶片;药品质量;检测【作者】钟胜佳;陈婷【作者单位】湖南省益阳市食品药品检验所益阳413000;湖南省益阳市食品药品检验所益阳413000;桃江县人民医院【正文语种】中文【中图分类】R917阿司匹林肠溶片作为非甾体类抗炎药物,能够达到降低肿瘤发生率的目的,其临床实践应用价值较高,也能够预防出血性脑卒中患者症状的发生率,对患者生活质量的提升能够产生重要影响。
文章采用HPLC方法检测阿司匹林肠溶片中的含量,以摇篮法检测不同溶出介质中阿司匹林肠溶片的释放情况,明确药品质量发展现状,对后续阿司匹林肠溶片药品质量控制工作的持续开展奠定良好的基础。
1 仪器与方法1.1 使用仪器应用安捷伦1100高效液相色谱仪进行检测,岛津UV-2550紫外分光光度仪,梅特丽1/100000电子天平,ZR-8G智能溶出实验仪器。
阿司匹林对照品来自于中国食品药品检定研究院,国药准字H13022944,包装规格:0.3g;阿司匹林肠溶片来自于拜耳医药有效公司,生产批号为bj16340,规格为0.1g。
甲醇为色谱纯,盐酸、乙醇等试剂均为分析纯。
1.2 方法应用pH为1.0的盐酸溶液,pH为6.8的磷酸盐缓冲溶液以及pH为7.5的磷酸盐缓冲溶液,在全波长扫描下,明确阿司匹林的吸收波长[1]。
阿司匹林的质量检测手段和含量测定方法

阿司匹林的质量检测手段和含量测定方法阿司匹林,化学名为2-(乙酰氧基)苯甲酸,作为主要的解热镇痛抗炎药收载于《中国药典》(2010年版)二部,临床上主要用于治疗感冒发烧,牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等,是风湿、类风湿关节炎治疗的常用药物。
本品主要的副作用是引起幽门痉挛及刺激胃黏膜的胃肠道反应,长期服用导致胃肠出血。
随着现代药学技术的发展,目前已有片剂、肠溶片、肠溶胶囊、泡腾片和栓剂等多种剂型,以阿司匹林为主药的复方制剂也层出不穷,形成了阿司匹林含量测定方法的各异性。
随着科学技术的进步,各种仪器设备、新方法也应用到了阿司匹林的质量检测中,本文对其作一综述。
1国内外药典中阿司匹林原料药的质量检测1.1鉴别1) 《中国药典》(2010年版)二部采用阿司匹林加水煮沸、水解生成的水杨酸能与三氯化铁试液生成紫堇色络合物进行鉴别。
美、英、日药典也用类似方法鉴别。
2) 《中国药典》(2010年版)二部采用阿司匹林加碳酸钠试液煮沸、水解生成水杨酸钠。
放冷后,加过量的稀硫酸析出水杨酸的白色沉淀并释放醋酸。
BP (1993年)用氢氧化钠代替碳酸钠,按上述操作生成的水杨酸经水洗、干燥后测定熔点。
JP规定在滤除水杨酸沉淀后,再加乙醇和硫酸,加热产生乙酸乙酯的香味。
3)红外光谱法鉴别。
1.2检查《中国药典》(2010年版)二部规定阿司匹林应检查溶液的澄清度、游离水杨酸、易炭化物、炽灼残渣和重金属。
水杨酸是从原料带来的杂质或水解产生的杂质,加稀硫酸铁铵指示液显色后,用比色法检查,《中国药典》规定其限量为0.1%。
BP(1993年)规定水杨酸的限量为0.05%。
除上述检查项目外,BP(1993年)还检查有关物质,以控制酚类杂质的限量。
酚类是可能存在于水杨酸中的杂质。
BP在水杨酸的检查中未检查酚类,故在此处检查。
USP还根据国情检查氯化物(限量为0.014%)、硫酸盐(限量为0.04%)和有机挥发性杂质。
阿司匹林肠溶片

阿司匹林肠溶片的质量检查姓名: @@@@@@@@@班级: @@@@@@@@@2学号:@@@@@@阿司匹林肠溶片质量标准[摘要] 目的:掌握阿司匹林肠溶片质量检查的方法步骤。
方法:通过两步滴定法、紫外分光光度法、薄层色谱法及高效液相色谱这四种方法来建立阿司匹林肠溶片的质量标准。
[关键词]两步滴定法紫外分光光度法薄层色谱法高效液相色谱法乙酰水杨酸[1](Asprin),俗名阿司匹林,又称醋柳酸。
分子量为180.16,白色针状或板状结晶或结晶性粉末,无臭,微带酸味。
mp:135-138度,在干燥空气中稳定,遇潮则缓慢水解成水杨酸和醋酸,微溶于水,溶于乙醇,乙醚,氯仿,也溶于碱溶液,同时分解。
可由水杨酸和醋酸作用制得。
具有解热镇痛及溶血作用。
为了探究复方乙酰水杨酸片的质量标准,我分别通过两步滴定法,紫外分光光度法,薄层色谱法及高效液相色谱法进行了考察,并对方法学的部分内容进行了验证。
分子结构式为:C9H8O4 分子相对质量:180.16<B 分子结构式:1仪器与试剂1.1试剂阿司匹林肠溶片;阿司匹林对照品;水杨酸对照品;95%乙醇(分析纯,天津市富宇精细化工有限公司,批号:090403);酚酞试剂;硫酸(分析纯,乌鲁木齐天岳化学试剂有限公司,批号:070128);中性乙醇(自制);甲醇(分析纯,天津市光复科技有限公司,批号:090112);0.1mol/L氢氧化钠溶液(自制);冰醋酸(分析纯,天津市富宇精细化工有限公司,批号:081213);1.2仪器容量瓶;高效液相仪器(苏制05000111号);滤纸有机膜(上海兴亚净化材料厂,规格Ø50mm,孔径 0.22μm,批号:080905);针头滤品(孔径 0.22μm,规格Ø13mm,上海兴亚净化材料厂,批号:080805);紫外分光光度仪(上海棱光技术有限公司,沪制00000208);石英比色皿(宜兴市晶科光学仪器有限公司);硅胶板(规格50*150mm,厚度 0.20-0.25mm,青岛海洋化工厂分厂,批号:080902);展开槽;紫外线分析仪(ZF-I型三用紫外分析仪,上海顾材电光仪器厂,批号:031230);电子天平(BS110S Max110g d=0.1㎎,北京赛多利斯天平有限公司,量制京字00000249号);2【鉴别】(1)取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴.即显紫堇色。
阿司匹林测量测定总结

阿司匹林测量测定总结阿司匹林是一种常用的非处方药,常用于缓解头痛、发烧、关节疼痛等症状。
除此之外,阿司匹林还被广泛用于心脏疾病的预防和治疗。
阿司匹林测量测定是一种常见的分析化学方法,用于确定阿司匹林中活性成分的含量。
阿司匹林的化学名为乙酰水杨酸,其化学结构中包含一个酯键和一个酰基。
阿司匹林的药效主要来自乙酰水杨酸,它具有镇痛、退热、抗炎和抗血小板聚集的作用。
因此,测定阿司匹林中乙酰水杨酸的含量对于评估药物的质量和安全性非常重要。
阿司匹林测量测定常用的方法有高效液相色谱法(HPLC)、紫外-可见光谱法(UV-Vis)和滴定法等。
其中,HPLC是应用最广泛、最常见的方法之一。
HPLC法通过将阿司匹林样品溶解在适当的溶剂中,并通过固定相分离柱将样品中的乙酰水杨酸分离出来。
通过检测分离出的乙酰水杨酸的峰面积或峰高,可以计算出阿司匹林中乙酰水杨酸的含量。
UV-Vis法是另一种常用的测定阿司匹林中乙酰水杨酸含量的方法。
该方法是基于乙酰水杨酸在紫外-可见光谱范围内的吸收特性。
通过测量样品在特定波长下的吸光度,并与标准曲线进行比较,可以计算出样品中乙酰水杨酸的含量。
滴定法是一种简单而常用的测定阿司匹林中乙酰水杨酸含量的方法。
该方法通过将阿司匹林样品与一种已知浓度的碱(如氢氧化钠)进行反应,使阿司匹林中的乙酰水杨酸转化为水杨酸。
当溶液中所有的乙酰水杨酸转化为水杨酸时,通过滴定法计算出所需的碱滴定液的体积,从而得出阿司匹林中乙酰水杨酸的含量。
阿司匹林测量测定的结果可以用来评估药物的质量和安全性。
根据不同的药物标准,阿司匹林中乙酰水杨酸的含量应在一定的范围内。
如果测定结果偏离了标准范围,可能会影响药物的疗效和安全性。
因此,阿司匹林测量测定在药物生产和质量控制过程中起着重要的作用。
阿司匹林测量测定是一种常见的分析化学方法,用于确定阿司匹林中乙酰水杨酸的含量。
常用的测定方法包括HPLC法、UV-Vis法和滴定法等。
测定结果可以用来评估药物的质量和安全性。
阿司匹林质量标准

阿司匹林C9H8O4 180.16本品为2-(乙酰氧基)苯甲酸。
含C9H8O4。
不得少于99.5%。
【性状】本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠试液或碳酸钠试液中溶解,但同时分解。
【鉴别】(1)取本品约0.1g加水l0ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0.5g,加碳酸钠试液l0ml,煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品0.50g,加微温至约45℃的碳酸钠试液l0ml溶解后,溶液应澄清。
游离水杨酸取本品0.l0g,加乙醇lml溶解后,加冷水适量使成50ml,立即加新制的稀硫酸铁铵溶液[取盐酸溶液(9→100)lml,加硫酸铁铵指示液2ml后,再加水适量使成100ml]1ml,摇匀,30秒钟内如显色,与对照液(精密称取水杨酸0.1g,加水溶解后,加冰醋酸lml,摇匀,再加水使成1000ml,摇匀,精密量取lml,加乙醇lml、水48m1与上述新制的稀硫酸铁镀溶液lml,摇匀)比拟,不得更深(0.1%)。
易炭化物取本品0.5g,依法检查(附录61页),与对照液(取比色用氯化钻液0.25m1、比色用重铬酸钾液0.25m1、比色用硫酸铜液0.40ml,加水使成5ml)比拟,不得更深。
4.操作方法 4.1取内径、色泽一致的具塞比色管两支,编号为甲管、乙管。
4.2甲管中加该药品项下规定的对照溶液5ml。
4.3乙管中加无色的硫酸[含H2SO4应为94.5%~95.5%〔g/g〕]5ml。
4.4取规定量的供试品〔如为固体,应先研成细粉〕分次缓缓参加乙管中,振摇使溶解。
4.5除另有规定外,静置15分钟,将甲乙两管同置白色衬板前,平视观察,比拟颜色深浅。
江西普丽尔药业—易炭化物检查操作规程第 2 页共2页 5.考前须知 5.1比色管应枯燥、洁净,如乙管中加硫酸后,在参加供试品之前已显色,应重新洗涤比色管,枯燥后再使用。
阿司匹林的质量标准

石河子大学小学期制实验结课论文建立不同种类阿司匹林的质量标准姓名:班级:学号:指导老师:日期:建立不同种类阿司匹林片剂的质量标准王维卢海利胡宇飞张明周(石河子大学药学院07级二班832000 )【摘要】目的:建立不同种类阿司匹林片剂的质量标准方法:用两步滴定法、紫外分光光度法、高效液相色谱法测定阿司匹林的含量。
结果结论【关键词】两步滴定;紫外分光光度法;HPLC;阿司匹林;含量测定;阿司匹林是临床上常用的解热、镇痛药物,为非甾体类抗炎药,临床可用于抗血栓也可用于治疗不稳定性心绞痛的病症。
本实验采用两步滴定法、紫外可见分光光度法、高效液相色谱法测定阿司匹林的含量该方法简便、准确、重复性好、回收率高、适用于该制剂的质量控制1仪器与试剂UV-S53型紫外分光光度仪( 上海校光技术有公司);BS124S电子分析天平(北京塞多利斯仪器系统有限公司);HP1100 高效液相色谱仪;阿司匹林片(山东新华制药有限公司,070528);试药阿司匹林对照品;硫酸液(自制,0.05mol/L);氢氧化钠液(自制,0.1mol/L)乙腈为色谱纯,其他试剂均为分析纯。
2 方法与结果2.1阿司匹林片的外观性状检查本品应为白色片状;片剂表面应色泽均匀、光洁,无杂斑,无异物。
2.2杂质检查用目视比色法测定:取相当于乙酰水杨酸0.1g的样品,精密称定,置具塞三角瓶中,加氯仿20ml。
超声处理15min,滤过,蒸干,残渣用乙醇溶解,并定至5ml。
过滤,滤液作为供试品溶液。
取5ml乙醇液,置50mL纳氏比色管中,用水稀释至50ml,加新制的稀硫酸铁铵溶液(取1 mol/L盐酸1 Ml,加硫酸铁铵溶液2ml后,再加水适量使成100 mL)1ml,摇匀,在30s内显色,与对照液(精密称取水杨酸0.1g加水溶解后加冰醋酸1ml摇匀,加水成100ml,精密量取1ml,加醇5ml,加水稀释至50ml,再加新制的稀硫酸铁铵溶液1ml)比较颜色,不得更深。
阿司匹林原料药的含量测定

1 T 0.1 180 .2 18 .02 1
即每1ml滴定液相当于18.02mg 的C9H8O4。
五、百分含量的计算
F=滴定液实际浓度/滴定液标准浓度
V×T×F ×10 -3 ×100% 阿司匹林的百分含量=
W样
式中 V ——消耗滴定液的体积,ml; T ——滴定度,mg/ml; F ——校正系数; W样 ——样品的取样量,g。
原理:阿司匹林具有游离羧基,具有酸性,以标准 碱滴定液直接滴定。
COOH OCOCH3 中性乙醇 NaOH 20℃以下
COONa H2O OCOCH3
操作步骤: 取本品0.4g 醇20ml溶解后
精密称定
于锥形瓶中
加中性乙
用氢
加酚酞指示液3滴
氧化钠滴定液(0.1mol/l)滴定。
终点控制:采用碱滴酸,在酸中加入无色酚酞,当 最后一滴氢氧化钠滴入,溶液变成稳定的红色而且 半分钟内不变色,即滴定终点。 中性乙醇:溶解供试品,防止酯水解。
阿司匹林原料药的含量 测定
生化制药技术1201班
第三大组
目录
一、实训目的
二、试剂及仪器 三、药典上阿司匹林的质量标准 四、含量测定的原理及方法——酸碱滴定法 的原理及操作步骤 五、百分含量的计算
一、实训目的
1、掌握酸碱滴定法测定的原理和方法 2、了解测定阿司匹林含量的操作 3、掌握阿司匹林的含钠滴定液(0.1mol/L)、中性乙醇、 酚酞指示液 电子天平、量筒、锥形瓶、玻璃棒等一些 基本仪器
三、药典上阿司匹林的质量标准
《中国药典》(2010年版)第二部 P384 阿司匹林按干燥品计算不得少于99.5%。
四、原理及方法——直接酸碱滴 定法的原理及操作步骤
阿司匹林质量标准

阿司匹林C9H8O4 180.16本品为2-(乙酰氧基)苯甲酸。
含C9H8O4。
不得少于99.5%。
【性状】本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠试液或碳酸钠试液中溶解,但同时分解。
【鉴别】(1)取本品约0.1g加水l0ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0.5g,加碳酸钠试液l0ml,煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品0.50g,加微温至约45℃的碳酸钠试液l0ml溶解后,溶液应澄清。
游离水杨酸取本品0.l0g,加乙醇lml溶解后,加冷水适量使成50ml,立即加新制的稀硫酸铁铵溶液[取盐酸溶液(9→100)lml,加硫酸铁铵指示液2ml后,再加水适量使成100ml]1ml,摇匀,30秒钟内如显色,与对照液(精密称取水杨酸0.1g,加水溶解后,加冰醋酸lml,摇匀,再加水使成1000ml,摇匀,精密量取lml,加乙醇lml、水48m1与上述新制的稀硫酸铁镀溶液lml,摇匀)比较,不得更深(0.1%)。
易炭化物取本品0.5g,依法检查(附录61页),与对照液(取比色用氯化钻液0.25m1、比色用重铬酸钾液0.25m1、比色用硫酸铜液0.40ml,加水使成5ml)比较,不得更深。
4.操作方法 4.1取内径、色泽一致的具塞比色管两支,编号为甲管、乙管。
4.2甲管中加该药品项下规定的对照溶液5ml。
4.3乙管中加无色的硫酸[含H2SO4应为94.5%~95.5%(g/g)]5ml。
4.4取规定量的供试品(如为固体,应先研成细粉)分次缓缓加入乙管中,振摇使溶解。
4.5除另有规定外,静置15分钟,将甲乙两管同置白色衬板前,平视观察,比较颜色深浅。
江西普丽尔药业有限公司—易炭化物检查操作规程第 2 页共2页 5.注意事项 5.1比色管应干燥、洁净,如乙管中加硫酸后,在加入供试品之前已显色,应重新洗涤比色管,干燥后再使用。
学习情境一阿司匹林的质量检验

2、英国药典:BP (British Pharmacopoeia) 现行版为2005年版 BP(2005)
3、日本药局方: JP
(Japanese
Pharmacopoeia)
现行版为第 十四改正本(2000年)
4、欧洲药典: Ph.Eup(European Pharmacopoeia) 由欧洲药典委员会编制、出版,为27个 成员国及欧共体所认可. 最新版为第五版
人用药品注册技术规范的国际协调会 ICH
International Conference on Harmonisation of Registration of Pharmaceuticals for Human Use
由欧洲联盟、日本和美国三方的药品管理部门 和生产部门组成。 ICH的目的:寻求解决三方国家之间存在的不统 一的规定和认识,通过协调逐步取得一致,为药 品研究开发、审批上市制定一个统一的国际性指 导标准,以便更好地利用人、动物和材料资源, 减少浪费、避免重复,加快新药在世界范围内开 发使用.
5G
GLP 《药品非临床研究管理规范》 GCP 《药品临床试验管理规范》 GMP 《药品生产质量管理规范》 GSP 《药品经营质量管理规范》 GAP 《中药材生产质量管理规范》
《药品非临床研究管理规范》
(Good Laboratory Practice) GLP 科研单位研制安全有效药物必须按 照GLP规定开展工作.严格控制药物研 制的质量,确保实验数据的准确可靠.
2 药典主要内容
药典的内容一般分为凡例、正文、附录和
索引四部分。
凡例是解释和执行药典必须了解和遵循的法则.
解释和说明《中国药典》概念,正确进行质量
检验提供指导原则.将正文、附录及质量检定有
阿司匹林市场相关政策法规和标准解读

阿司匹林市场相关政策法规和标准解读阿司匹林是一种非处方药物,常用于缓解轻度至中度疼痛、退烧和减轻炎症等症状。
在不同国家和地区,阿司匹林的市场相关政策法规和标准可能会有所不同。
以下是对阿司匹林市场相关政策法规和标准的一些解读,供参考。
1. 适应症和规格要求:阿司匹林主要适用于治疗轻度至中度疼痛、退烧和减轻炎症等症状。
不同国家和地区对于阿司匹林的规格要求可能有所差异,例如剂型、含量、包装等。
相关政策法规会对阿司匹林的适应症和规格要求进行明确规定。
2. 注册与批准:阿司匹林作为药品需要经过注册和批准才能在市场上销售。
不同国家和地区的注册和批准程序可能有所不同,但一般需要提交相关药物研究和临床试验的数据,证明其安全性和有效性。
3. 质量标准:阿司匹林的质量标准是保证其安全有效的基础。
相关政策法规会对阿司匹林的质量标准进行规定,包括药物的理化性质、纯度、稳定性等。
此外,也会规定相关检验方法和标准,以确保药品质量的可靠性。
4. 生产和质量控制:阿司匹林的生产和质量控制需要符合相关的政策法规和标准。
包括生产设备和生产环境的要求、原材料的选择和采购管理、生产流程的控制和监管、药品质量的抽检和监测等。
相关政策法规还可能对生产记录和药品追溯体系提出要求。
5. 标签和说明书:阿司匹林的标签和说明书是传递药品相关信息的重要载体。
相关政策法规会对阿司匹林的标签和说明书进行规定,包括药品的名称、成分、适应症、用法用量、不良反应、禁忌症、储存条件等。
此外,也会要求药品说明书的使用语言和格式符合要求,方便患者和医生阅读和理解。
6. 不良反应和药物安全监测:阿司匹林的不良反应和药物安全监测是保证药品安全使用的重要环节。
相关政策法规会要求生产企业建立药物不良反应监测和报告制度,并配合监管部门的药物安全监测工作。
7. 市场监管和处罚:阿司匹林市场相关政策法规和标准还包括市场监管和处罚措施。
政府监管部门会进行市场的日常监管,对不符合规定的阿司匹林产品进行处罚,如责令停产、罚款等。
阿司匹林肠溶片

阿司匹林肠溶片的质量检查姓名: @@@@@@@@@班级: @@@@@@@@@2学号:@@@@@@阿司匹林肠溶片质量标准[摘要] 目的:掌握阿司匹林肠溶片质量检查的方法步骤。
方法:通过两步滴定法、紫外分光光度法、薄层色谱法及高效液相色谱这四种方法来建立阿司匹林肠溶片的质量标准。
[关键词]两步滴定法紫外分光光度法薄层色谱法高效液相色谱法乙酰水杨酸[1](Asprin),俗名阿司匹林,又称醋柳酸。
分子量为180.16,白色针状或板状结晶或结晶性粉末,无臭,微带酸味。
mp:135-138度,在干燥空气中稳定,遇潮则缓慢水解成水杨酸和醋酸,微溶于水,溶于乙醇,乙醚,氯仿,也溶于碱溶液,同时分解。
可由水杨酸和醋酸作用制得。
具有解热镇痛及溶血作用。
为了探究复方乙酰水杨酸片的质量标准,我分别通过两步滴定法,紫外分光光度法,薄层色谱法及高效液相色谱法进行了考察,并对方法学的部分内容进行了验证。
分子结构式为:C9H8O4 分子相对质量:180.16<B 分子结构式:1仪器与试剂1.1试剂阿司匹林肠溶片;阿司匹林对照品;水杨酸对照品;95%乙醇(分析纯,天津市富宇精细化工有限公司,批号:090403);酚酞试剂;硫酸(分析纯,乌鲁木齐天岳化学试剂有限公司,批号:070128);中性乙醇(自制);甲醇(分析纯,天津市光复科技有限公司,批号:090112);0.1mol/L氢氧化钠溶液(自制);冰醋酸(分析纯,天津市富宇精细化工有限公司,批号:081213);1.2仪器容量瓶;高效液相仪器(苏制05000111号);滤纸有机膜(上海兴亚净化材料厂,规格Ø50mm,孔径 0.22μm,批号:080905);针头滤品(孔径 0.22μm,规格Ø13mm,上海兴亚净化材料厂,批号:080805);紫外分光光度仪(上海棱光技术有限公司,沪制00000208);石英比色皿(宜兴市晶科光学仪器有限公司);硅胶板(规格50*150mm,厚度 0.20-0.25mm,青岛海洋化工厂分厂,批号:080902);展开槽;紫外线分析仪(ZF-I型三用紫外分析仪,上海顾材电光仪器厂,批号:031230);电子天平(BS110S Max110g d=0.1㎎,北京赛多利斯天平有限公司,量制京字00000249号);2【鉴别】(1)取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴.即显紫堇色。
阿司匹林的质量标准

石河子大学小学期制实验结课论文阿司匹林的质量标准、姓名:王义西班级:药学(3)班学号:指导老师:李乐日期:2013年9月3日乙酰水杨酸抗炎药物的分析王义西石河子大学药学院小学期药学第三组第三实验组摘要阿司匹林,化学名为2-( 乙酰氧基) 苯甲酸,作为主要的解热镇痛抗炎药收载于《中国药典》(2010 年版)二部,临床上主要用于治疗感冒发烧, 牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等, 是风湿、类风湿关节炎治疗的常用药物。
本品主要的副作用是引起幽门痉挛及刺激胃黏膜的胃肠道反应, 长期服用导致胃肠出血。
随着现代药学技术的发展,目前已有片剂、肠溶片、肠溶胶囊、泡腾片和栓剂等多种剂型,以阿司匹林为主药的复方制剂也层出不穷,形成了阿司匹林含量测定方法的各异性。
随着科学技术的进步,各种仪器设备、新方法也应用到了阿司匹林的鉴别、杂质检查、含量测定中,本文对其作一综述。
关键词: 阿司匹林鉴别杂质检查含量测定 HPLC 紫外分光光度法 TLC 阿司匹林临床上主要用于治疗感冒发烧, 牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等, 是风湿、类风湿关节炎治疗的常用药物。
本文主要对阿司匹林做一综合论述,通过对阿司匹林的性状、鉴别、杂质检查、含量测定四个方面对乙酰水杨酸进行药物分析。
1 实验部分1.1仪器与试剂仪器:紫外分光光度计(Cintra404,GBC)、电子天平(A B135-S,梅特勒-托利多仪器(上海)有限公司METTLER TOLEDO)、微孔滤膜(尺寸25mm,孔径0.8μ,上海半岛实业有限公司净入器材厂)高效液相色谱仪、紫外检测器、自动进样器、色谱数据处理机、U V 一26 0 分光光度计、HPLC 色谱柱、超纯水器、展开槽、水浴锅、研钵、移液管(1、2、5、10ml)、吸耳球、容量瓶(25、50、100ml)、烧杯(10、100、500ml)、胶头吸管、直尺试剂:复方乙酰水杨酸片(25mg/片):阿司匹林贮备液溶液(1.5368m g/ml)、无水乙醇、氯仿、丙酮、冰醋酸、甲醇、95%乙醇、酚酞指示液、碳酸钠试液,稀盐酸、稀硫酸、三氯化铁试液、乙醚、硫酸铁铵试液(新制)、蒸馏水1.2 性状阿司匹林为白色结晶或结晶性粉末;遇湿气即缓缓水解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿司匹林C9H8O4 180.16本品为2-(乙酰氧基)苯甲酸。
含C9H8O4。
不得少于99.5%。
【性状】本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠试液或碳酸钠试液中溶解,但同时分解。
【鉴别】(1)取本品约0.1g加水l0ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0.5g,加碳酸钠试液l0ml,煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品0.50g,加微温至约45℃的碳酸钠试液l0ml溶解后,溶液应澄清。
游离水杨酸取本品0.l0g,加乙醇lml溶解后,加冷水适量使成50ml,立即加新制的稀硫酸铁铵溶液[取盐酸溶液(9→100)lml,加硫酸铁铵指示液2ml后,再加水适量使成100ml]1ml,摇匀,30秒钟内如显色,与对照液(精密称取水杨酸0.1g,加水溶解后,加冰醋酸lml,摇匀,再加水使成1000ml,摇匀,精密量取lml,加乙醇lml、水48m1与上述新制的稀硫酸铁镀溶液lml,摇匀)比较,不得更深(0.1%)。
易炭化物取本品0.5g,依法检查(附录61页),与对照液(取比色用氯化钻液0.25m1、比色用重铬酸钾液0.25m1、比色用硫酸铜液0.40ml,加水使成5ml)比较,不得更深。
4.操作方法 4.1取内径、色泽一致的具塞比色管两支,编号为甲管、乙管。
4.2甲管中加该药品项下规定的对照溶液5ml。
4.3乙管中加无色的硫酸[含H2SO4应为94.5%~95.5%(g/g)]5ml。
4.4取规定量的供试品(如为固体,应先研成细粉)分次缓缓加入乙管中,振摇使溶解。
4.5除另有规定外,静置15分钟,将甲乙两管同置白色衬板前,平视观察,比较颜色深浅。
江西普丽尔药业有限公司—易炭化物检查操作规程第 2 页共2页 5.注意事项 5.1比色管应干燥、洁净,如乙管中加硫酸后,在加入供试品之前已显色,应重新洗涤比色管,干燥后再使用。
5.2乙管必须先加硫酸而后再加供试品,以防供试品粘结在管底,不易溶解完全。
5.3必须分次向乙管缓缓加入供试品,边加边振摇,使溶解完全,避免因一次加入量过多而导致供试品结成团,被硫酸炭化液包裹后溶解很困难。
5.4如药典规定需加热才能溶解时,可取供试品与硫酸混合均匀,加热溶解后,放冷至室温,再移置比色管中;加热条件,应严格按药典规定。
5.5易炭化物与硫酸呈现的颜色,与硫酸浓度、温度和放置时间有关,操作中应对实验条件严格控制。
6.结果判定乙管中所显颜色如浅于甲管,判为符合规定;乙管中所显颜色如深于甲管,则判为不符合规定。
判定有困难时,可交换甲、乙管位置观察。
【干燥失重】取本品,置五氧化二磷为干燥剂的干燥器中,在60 摄氏度减压干燥至恒重,减失重量不得过0.5%。
(附录59页)——————————方法3. 范围:适用于所有用干燥失重测定法(一部)测定的供试品。
4. 责任:检验员、质量控制科主任、质量管理部经理对本规程负责。
5. 正文:5.1. 取供试品,混合均匀(如为较大的结晶,应先迅速捣碎使成 2mm以下的小粒),取约 1g 或各品种项下规定的重量,置与供试品相同条件下干燥至恒重的扁形称量瓶中,精密称定,除另有规定外,在 105℃干燥至恒重。
由减失的重量和取样量计算供试品的干燥失重。
5.2. 供试品干燥时,应平铺在扁形称量瓶中,厚度不可超过 5mm,如为疏松物质,厚度不可超过 10mm。
放入烘箱或干燥器进行干燥时,应将瓶盖取下,置称量瓶旁,或将瓶盖半开进行干燥;取出时,须将称量瓶盖好。
置烘箱内干燥的供试品,应在干燥后取出置干燥器中放冷,然后称定重量。
5.3. 供试品如未达规定的干燥温度即融化时,除另有规定外,应先将供试品在低于熔点 5~10℃的温度下干燥至大部分水分除去后,再按规定条件干燥。
5.4. 当用减压干燥器(通常为室温)或恒温减压干燥器(温度应按各品种项下的规定设置)时,除另有规定外,压力应在 2.67kPa(20mmHg)以下。
干燥器中常用的干燥剂为五氧化二磷、无水氯化钙或硅胶;恒温减压干燥器中常用的干燥剂为五氧化二磷。
干燥剂应及时更换炽灼残渣不得过0.1%(附录71页)。
方法 4.2 称取供试品取供试品1.0~2.0g或各该药品项下规定的重量,置已炽灼至恒重的坩埚内,精密称定。
4.3 炭化将盛有供试品的坩埚斜置电炉或煤气灯上缓缓灼烧(避免供试品骤然膨胀或燃烧而逸出),炽灼至供试品全部炭化呈黑色,并不再冒烟,放冷至室温(以上操作在通风柜内进行)。
4.4 灰化除另有规定外,滴加硫酸0.5~1 ml,使炭化物全部湿润,继续在电炉上加热至硫酸蒸气除尽,白烟完全消失(以上操作应在通风柜内进行)。
将坩埚移置高温内,盖子斜盖于坩埚上,在700~800℃炽灼60分钟,使供试品完全灰化。
4.5 恒重按操作方法4.1自“停止加热,待高温炉温度冷却至约300℃,取出坩埚。
”起,依法操作,直至恒重。
5. 注意事项5.1 炭化与灰化的前一阶段操作应在通风柜内进行。
供试品放入高温炉前必须完全炭化并除尽硫酸蒸汽。
必要时,高温炉应加装排气管道。
5.2 供试品的取用量,除另有规定外,一般为1.0~2.0g(炽灼残渣限度为0.1~0.2%)。
如有限度较高的品种,可调整供试品的取用量,使炽灼残渣的量在1~2mg。
5.3 坩埚宜预先编码标记,盖子与坩埚应编码一致。
从高温炉取出时间的温度、先后次序、在干燥器内的放冷时间以及称量顺序,均应前后一致;同一干燥器内同时放置坩埚最好不超过4个,否则不易达到恒重。
5.4 坩埚放冷后,干燥器内形成负压,应小心开启干燥器,以免吹散干燥器内的轻质残渣。
5.5 炽灼残渣如需留作重金属检查,则炽灼温度必须控制在500~600度重金属取本品1.0g,加乙醇23m1溶解后,加醋酸盐缓冲液(pH3.5)2m1,依法检查(附录66页,第一法),含重金属不得过百万分之十。
方法 5.1.1. 本法所指的重金属系指在规定实验条件下能与硫代乙酰胺或硫化钠作用显色的金属杂质。
5.2. 标准铅溶液的制备。
5.2.1. 称取硝酸铅0.1599g,置1000ml量瓶中,加硝酸5ml与水50ml溶解后,用水稀释至刻度,摇匀,作为贮备液。
5.2.2. 精密量取贮备液10ml,置100ml量瓶中,加水稀释至刻度,摇匀,即得(每1ml相当于10μg的Pb)。
本液仅供当日使用。
5.2.3. 配制与贮存用的玻璃容器均不得含铅。
5.3. 第一法。
5.3.1. 除另有规定外,取25ml纳氏比色管三支,甲管中加标准铅溶液一定量与醋酸盐缓冲液(pH3.5)2ml后,加水或各品种项下规定的溶剂稀释成25ml,乙管中加入按各品种项下规定的方法制成的供试品溶液25ml;丙管中加入与乙管相同量的供试品,加配制供试品溶液的溶剂适量使溶解,再加与甲管相同量的标准铅溶液与醋酸盐缓冲液(pH3.5)2ml后,用溶剂稀释成25ml;若供试品溶液带颜色,可在甲管中滴加少量的稀焦糖溶液或其他无干扰的有色溶液,使之与乙管、丙管一致;再在甲、乙、丙三管中分别加硫代乙酰胺试液各2ml,摇匀,放置2分钟,同置白纸上,自上向下透视,当丙管中显出的颜色不浅于甲管时,乙管中显出的颜色与甲管比较,不得更深。
如丙管中显出的颜色浅于甲管,应取样按第二法重新检查。
5.3.2. 如在甲管中滴加稀焦糖溶液或其他无干扰的有色溶液,仍不能使颜色一致时,应取样按第二法检查。
5.3.3. 供试品如含高铁盐影响重金属检查时,可取甲、乙、丙三管中加入相同量的维生素C 0.5~1.0g,再照上述方法检查。
5.3.4. 配制供试品溶液时,如使用的盐酸超过1ml,氨试液超过2ml,或加入其他试剂进行处理者,除另有规定外,甲管溶液应取同样同量的试剂置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液一定量,再用水或各品种项下规定的溶剂稀释成25ml。
5.4. 第二法。
5.4.1. 除另有规定外,当须改用第二法检查时,取各品种项下规定量的供试品,按炽灼残渣检查法(附录Ⅸ J)进行炽灼处理,然后取遗留的残渣;或直接取炽灼残渣项下遗留的残渣;如供试品为溶液,则取各品种项下规定量的溶液,蒸发至干,再按上述方法处理后取遗留的残渣,加硝酸 0.5ml,蒸干,至氧化氮蒸气除尽后(或取供试品一定量,缓缓炽灼至完全炭化,放冷,加硫酸 0.5~1ml,使恰湿润,用低温加热至硫酸除尽后,加硝酸 0.5ml,蒸干,至氧化氮蒸气除尽后,放冷,在 500~600℃炽灼使完全灰化)放冷,加盐酸 2ml,置水浴上蒸干后加水 15ml,滴加氨试液至对酚酞指示液显微粉红色,再加醋酸盐缓冲液(pH3.5) 2ml,微热溶液后,移置纳氏比色管中,加水稀释成 25ml,作为甲管;另取配制供试品溶液的试剂,置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml 与水 15ml,微热溶液后,移置纳氏比色管中,加标准铅溶液一定量,再用水稀释成 25ml作为乙管;再在甲、乙两管中分别加硫代乙酰胺试液各2ml,摇匀,放置2分钟,同置白纸上,自上向下透视,乙管中显出的颜色与甲管比较,不得更深。
5.5. 第三法。
5.5.1. 除另有规定外,取供试品适量,加氢氧化钠试液5ml与水20ml溶解后,置纳氏比色管中,加硫化钠试液5滴,摇匀,与一定量的标准铅溶液同样处理后的颜色比较,不得更深。
【含量测定】取本品约0.4g,精密称定,加中性乙醇(对酚酞指示液显中性)20m1溶解后,加酚酞指示液3滴,用氢氧化钠滴定液(0.lmol/L)滴定。
每lml氢氧化钠滴定液(0.lmol/L)相当于18.02mg的C9H8O4。
【类别】解热镇痛非甾体抗炎药、抗血小板凝聚药。
【贮藏】密封,在干燥处保存。
【制剂】阿司匹林片,阿司匹林肠溶液。
