QC-TS-042-01 阿司匹林质量标准
阿司匹林的质量评价实验报告

阿司匹林的质量评价实验报告一、实验目的:检验阿司匹林的质量阿司匹林是一种广泛应用于临床的非甾体类抗炎药,也是用于止痛和退烧的重要药物之一。
本实验的目的是通过定量测定法来评估维生素C片剂的质量,包括药品的含量、吸收度和纯度等。
二、实验原理阿司匹林是乙酰水杨酸的通用名称。
本实验中采用的是标准化钠氢碳酸滴定法来测定阿司匹林的药品含量。
具体的步骤如下:1. 首先称取一定量的维生素C片剂,并粉碎成粉末状。
2. 将粉末样品与适量的磷酸二氢钠溶液混合,并用稀酸酐来充分溶解样品。
3. 将样品转移到酸性介质中,并用甲酸铵作为指示剂,以0.1M硫酸溶液进行滴定。
4. 计算滴定体积并通过公式计算出维生素C样品中的阿司匹林含量。
三、实验步骤1. 准备药品和实验仪器及仪表。
2. 称取一定量的维生素C片剂,通过筛网将其研磨成细粉。
3. 取样品并将其加入到磷酸二氢钠溶液中,充分颠倒和振荡,使其充分溶解。
4. 加入稀酸酐并继续颠倒样品,以保证样品在酸性介质中完全溶解。
5. 用酸性介质对样品溶液进行滴定,并应用甲酸铵作为指示剂来计算滴定终点。
6. 重复实验并计算平均值,用公式计算出阿司匹林含量。
四、实验结果分析本实验通过滴定法对维生素C片剂的药品含量进行了定量测定,并计算出其中的阿司匹林含量。
实验结果表明,维生素C 片剂样品的平均含量为0.1068 g,阿司匹林含量为0.0857 g。
根据国家标准规定,阿司匹林的药品含量应在98-102%之间。
因此,本实验检验结果表明该样品达到了药品含量的质量标准。
五、实验结论通过定量测定法来评估阿司匹林药品的质量,本实验结果表明该维生素C片剂样品的药品含量符合国家标准,阿司匹林的质量良好。
这证明该药品的质量稳定,适合用于临床治疗。
阿司匹林的质量标准

石河子大学小学期制实验结课论文阿司匹林的质量标准、姓名:王义西班级:药学(3)班学号:73指导老师:李乐日期:2013年9月3日乙酰水杨酸抗炎药物的分析王义西石河子大学药学院小学期药学第三组第三实验组摘要阿司匹林,化学名为2-( 乙酰氧基) 苯甲酸,作为主要的解热镇痛抗炎药收载于《中国药典》 (2010 年版)二部,临床上主要用于治疗感冒发烧, 牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等, 是风湿、类风湿关节炎治疗的常用药物。
本品主要的副作用是引起幽门痉挛及刺激胃黏膜的胃肠道反应, 长期服用导致胃肠出血。
随着现代药学技术的发展,目前已有片剂、肠溶片、肠溶胶囊、泡腾片和栓剂等多种剂型,以阿司匹林为主药的复方制剂也层出不穷,形成了阿司匹林含量测定方法的各异性。
随着科学技术的进步,各种仪器设备、新方法也应用到了阿司匹林的鉴别、杂质检查、含量测定中,本文对其作一综述。
关键词: 阿司匹林鉴别杂质检查含量测定 HPLC 紫外分光光度法TLC阿司匹林临床上主要用于治疗感冒发烧, 牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等, 是风湿、类风湿关节炎治疗的常用药物。
本文主要对阿司匹林做一综合论述,通过对阿司匹林的性状、鉴别、杂质检查、含量测定四个方面对乙酰水杨酸进行药物分析。
1 实验部分仪器与试剂仪器:紫外分光光度计(Cintra404,GBC)、电子天平(AB135-S,梅特勒-托利多仪器(上海)有限公司METTLER TOLEDO)、微孔滤膜(尺寸25mm,孔径μ,上海半岛实业有限公司净入器材厂)高效液相色谱仪、紫外检测器、自动进样器、色谱数据处理机、U V 一26 0 分光光度计、HPLC 色谱柱、超纯水器、展开槽、水浴锅、研钵、移液管(1、2、5、10ml)、吸耳球、容量瓶(25、50、100ml)、烧杯(10、100、500ml)、胶头吸管、直尺试剂:复方乙酰水杨酸片(25mg/片):阿司匹林贮备液溶液(ml)、无水乙醇、氯仿、丙酮、冰醋酸、甲醇、95%乙醇、酚酞指示液、碳酸钠试液,稀盐酸、稀硫酸、三氯化铁试液、乙醚、硫酸铁铵试液(新制)、蒸馏水性状阿司匹林为白色结晶或结晶性粉末;遇湿气即缓缓水解。
阿司匹林片药品标准草案及起草说明

阿司匹林片药品标准草案及起草说明目录一、质量标准草案二、质量标准草案起草说明一、阿司匹林片药品标准草案阿司匹林片Asipilin PianAspirin Tablets本品含阿司匹林(C9H8O4)应为标示量的95. 0% ~ 105. 0%。
【性状】本品为白色片。
【鉴别】(1)取本品的细粉适量(约相当于阿司匹林0.lg),加水10ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
⑵ 在含量测定项下记录的色谱图中,供试品溶液的主峰的保留时间与对照品溶液主峰的保留时间一致。
【检查】游离水杨酸取本品细粉适量(约相当于阿司匹林0. 5g),精密称定,置100ml量瓶中,用1%冰醋酸的甲醇溶液振摇使阿司匹林溶解,并稀释至刻度,摇匀,用滤膜滤过,取续滤液作为供试品溶液(临用新制);取水杨酸对照品约15mg,精密称定,置50ml量瓶中,加1%冰醋酸的甲醇溶液溶解并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸的甲醇溶液稀释至刻度,摇匀,作为对照品溶液。
照阿司匹林游离水杨酸项下的方法测定,按外标法以峰面积计算,不得过标示量的0.3%。
溶出度取本品,照溶出度测定法(中国药典附录X C第一法),以盐酸溶液(稀盐酸24ml加水至1000ml,即得)为溶出介质,转速为每分钟100转,依法操作,经30分钟时,取溶液10ml滤过,精密量取5ml,置50ml量瓶中,加0.4%氢氧化钠溶液5ml,置水浴中煮沸5min,放冷,加稀硫酸2.5ml,并加水稀释至刻度,摇匀。
照紫外-可见光分光光度法,在303nm的波长处测定吸光度。
按吸收系数为265计算,再乘以1.304后,计算每片溶出量。
限度为标示量的80%,应符合规定。
其他应符合片剂项下有关的各项规定(中国药典附录I B)。
【含量测定】照高效液相色谱法(中国药典附录V D)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20 :5 :5 :70)为流动相;检测波长为276nm。
阿司匹林的质量检测手段和含量测定方法

阿司匹林的质量检测手段和含量测定方法阿司匹林,化学名为2-(乙酰氧基)苯甲酸,作为主要的解热镇痛抗炎药收载于《中国药典》(2010年版)二部,临床上主要用于治疗感冒发烧,牙痛、肌肉痛及神经痛等慢性疼痛,急、慢性风湿病及类风湿病等,是风湿、类风湿关节炎治疗的常用药物。
本品主要的副作用是引起幽门痉挛及刺激胃黏膜的胃肠道反应,长期服用导致胃肠出血。
随着现代药学技术的发展,目前已有片剂、肠溶片、肠溶胶囊、泡腾片和栓剂等多种剂型,以阿司匹林为主药的复方制剂也层出不穷,形成了阿司匹林含量测定方法的各异性。
随着科学技术的进步,各种仪器设备、新方法也应用到了阿司匹林的质量检测中,本文对其作一综述。
1国内外药典中阿司匹林原料药的质量检测1.1鉴别1) 《中国药典》(2010年版)二部采用阿司匹林加水煮沸、水解生成的水杨酸能与三氯化铁试液生成紫堇色络合物进行鉴别。
美、英、日药典也用类似方法鉴别。
2) 《中国药典》(2010年版)二部采用阿司匹林加碳酸钠试液煮沸、水解生成水杨酸钠。
放冷后,加过量的稀硫酸析出水杨酸的白色沉淀并释放醋酸。
BP (1993年)用氢氧化钠代替碳酸钠,按上述操作生成的水杨酸经水洗、干燥后测定熔点。
JP规定在滤除水杨酸沉淀后,再加乙醇和硫酸,加热产生乙酸乙酯的香味。
3)红外光谱法鉴别。
1.2检查《中国药典》(2010年版)二部规定阿司匹林应检查溶液的澄清度、游离水杨酸、易炭化物、炽灼残渣和重金属。
水杨酸是从原料带来的杂质或水解产生的杂质,加稀硫酸铁铵指示液显色后,用比色法检查,《中国药典》规定其限量为0.1%。
BP(1993年)规定水杨酸的限量为0.05%。
除上述检查项目外,BP(1993年)还检查有关物质,以控制酚类杂质的限量。
酚类是可能存在于水杨酸中的杂质。
BP在水杨酸的检查中未检查酚类,故在此处检查。
USP还根据国情检查氯化物(限量为0.014%)、硫酸盐(限量为0.04%)和有机挥发性杂质。
阿司匹林片药品标准草案及起草说明

阿司匹林片药品标准草案及起草说明目录一、质量标准草案二、质量标准草案起草说明一、阿司匹林片药品标准草案阿司匹林片Asipilin PianAspirin Tablets本品含阿司匹林(C9H8O4)应为标示量的95. 0% ~ 105. 0%。
【性状】本品为白色片。
【鉴别】(1)取本品的细粉适量(约相当于阿司匹林0.lg),加水10ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
⑵ 在含量测定项下记录的色谱图中,供试品溶液的主峰的保留时间与对照品溶液主峰的保留时间一致。
【检查】游离水杨酸取本品细粉适量(约相当于阿司匹林0. 5g),精密称定,置100ml量瓶中,用1%冰醋酸的甲醇溶液振摇使阿司匹林溶解,并稀释至刻度,摇匀,用滤膜滤过,取续滤液作为供试品溶液(临用新制);取水杨酸对照品约15mg,精密称定,置50ml量瓶中,加1%冰醋酸的甲醇溶液溶解并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸的甲醇溶液稀释至刻度,摇匀,作为对照品溶液。
照阿司匹林游离水杨酸项下的方法测定,按外标法以峰面积计算,不得过标示量的0.3%。
溶出度取本品,照溶出度测定法(中国药典附录X C第一法),以盐酸溶液(稀盐酸24ml加水至1000ml,即得)为溶出介质,转速为每分钟100转,依法操作,经30分钟时,取溶液10ml滤过,精密量取5ml,置50ml量瓶中,加0.4%氢氧化钠溶液5ml,置水浴中煮沸5min,放冷,加稀硫酸2.5ml,并加水稀释至刻度,摇匀。
照紫外-可见光分光光度法,在303nm的波长处测定吸光度。
按吸收系数为265计算,再乘以1.304后,计算每片溶出量。
限度为标示量的80%,应符合规定。
其他应符合片剂项下有关的各项规定(中国药典附录I B)。
【含量测定】照高效液相色谱法(中国药典附录V D)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20 :5 :5 :70)为流动相;检测波长为276nm。
阿司匹林原料药的质量检

实验阿司匹林原料药的质量检测一、实验目的1.掌握阿司匹林原料药质量检测的原理与方法。
二、实验原理1。
阿司匹林为解镇痛药,用于治疗伤风、感冒、头痛、发烧、神经痛、关节痛及风湿病等。
近年来,又证明它具有抑制血小板凝聚的作用,其治疗范围又进一步扩大到预防血栓形成,治疗心血管疾病。
2。
阿司匹林化学名为2—乙酰氧基苯甲酸,化学结构式为3。
阿司匹林为白色结晶或结晶性粉末;无臭或微带醋酸臭;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;呈弱酸性,pKa3.49,可溶解于氢氧化钠或碳酸钠溶液中,但同时分解;水解生成物水杨酸的分子中酚羟基易被氧化成醌型有色物质遇空气逐渐变为淡黄、红棕甚至深棕色其水溶液变化更快;本品水溶液与三氯化铁溶液显紫堇色;本品碳酸钠溶液加稀硫酸生成白色沉淀和醋酸臭气。
4. 合成路线如下:5. 阿司匹林中的“有关物质”系指除“游离水杨酸”外的合成原料药苯酚及其他合成副产物,如醋酸苯酯、水杨酸苯酯、水杨酸水杨酸、水杨酸酐、乙酰水杨酸苯酯、等杂质。
三、实验内容1。
鉴别(1)阿司匹林与三氯化铁的显色反应一、测定原理:本品生成的水杨酸在中性或弱酸性条件下,与三氯化铁试液生成配位化合物,在中性时呈红色,弱酸性时呈紫色。
反应式如下:二、仪器和试剂:托盘天平、烧杯(50ml)、电热套、蒸馏水、三氯化铁试液三、测定步骤:取本品约0.1g与烧杯中,加水10ml,置于电热套中煮沸至完全水解,冷却至室温,滴加三氯化铁试液一滴,显紫红色。
(2)阿司匹林的水解反应一、测定原理:本品加碳酸钠试液煮沸,水解生成水杨酸和醋酸钠。
冷却,加过量的稀硫酸,析出白色的水杨酸沉淀,并产生醋酸的臭气,反应式如下:二、仪器和试剂:天平、烧杯(50ml)、洗瓶、电热套、蒸馏水、碳酸钠试液、稀硫酸三、测定步骤 :取本品约0。
5g于烧杯中,加入碘酸钠试液10ml,在电热套上煮沸2min,冷却至室温,加入过量的稀硫酸,即有白色沉淀析出,并产生醋酸的臭气。
阿司匹林质量控制

1、性状本品为片剂,外观应完整光洁,色泽均匀,有适宜的硬度和耐磨性。
2、重量差异取供试品20片,精密称定总重,求得平均片重后,再分别精密称定每片重,与平均片中比较,按规定要求超出重量差异限度的不得多于2片,并不得有一片超出限度1倍。
3、崩解时限仪器为升降式崩解仪,介质为37℃左右的水,取供试品6片,按要求操作,各片应在15分钟内全部崩解,另取6片复试,均应该符合规定。
4、鉴别利用阿司匹林的水解反应进行鉴别实验。
取本品约0.5g,加碳酸钠试液10ml,煮沸两分钟后冷却,加入过量稀硫酸酸化后析出白色沉淀,并产生醋酸的臭气。
5、检查3.1一般杂质检查3.2特殊杂质检查3.2.1澄清度检查取本品0.50g,加热至约45℃碳酸钠试液溶解后,溶液应澄清。
3.2.2游离水杨酸采用高效液相色谱法检查阿司匹林原料药中游离水杨酸,限量0.1%。
(1)配制供试品溶液及对照品溶液a.取本品约0.1g,精密称定,置于10ml容量瓶内,加1%冰醋酸甲醇溶液适量,振摇使其溶解,并稀释至刻度。
b.取水杨酸对照品约10mg。
精密称定,置于100ml容量瓶,加冰醋酸甲醇溶液适量溶解,并稀释至刻度。
精密量取5ml,置于50ml容量瓶,1%冰醋酸甲醇溶液稀释至刻度。
(2)色谱条件及测定法十八烷基硅烷键合硅胶作为填充剂;乙腈-四氢呋喃-冰醋酸-水(20:5:5:70)为流动相;检测波长303nm。
理论板数按水杨酸峰计算不低于5000,阿司匹林峰与水杨酸峰的分离度应符合要求(R>1.5)。
立刻精密量取供试品溶液、对照品溶液各10μm,分别注入液相色谱仪,记录谱图。
供试品溶液色谱图中如有与水杨酸峰保留时间一致的色谱峰,按外标法以峰面积计算,不得超过0.1%。
3.2.3易碳化物取本品0.5g,碳化后如呈色,与对照液(比色用氯化钴液、比色用重铬酸钾各0.25ml、比色用硫酸铜液0.40ml,加水成5ml)比较,不得更深。
6、含量测定(1)硫酸滴定液的标定取在270~300℃干燥至恒重的基准无水碳酸钠约0.15g,精密称定,加水50ml使溶解,加甲基红溴甲酚绿混合指示液10滴,用本液滴至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
阿司匹林标准操作规程

阿司匹林检验操作规程起草人日期20 年月日审核人日期20 年月日批准人日期20 年月日生效日期颁发部门质量部分发部门1.目的建立阿司匹林检验标准操作规程,规范操作。
2.范围适用于阿司匹林的检查3.依据中国药典2010版二部4.职责4.1 起草:QC ,审核:QA ,批准人:质量负责人4.2 QC实施本规程。
4.3 QA监督本规程的实施。
5.内容5.1 性状本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在氯仿或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
5.2鉴别:5.2.1鉴别(1)5.2.1.1试液及仪器一般实验仪器三氯化铁试液:取三氯化铁9g,加水使溶解成100ml5.2.1.2 分析步骤取本品约0.1g,加水10ml,直火加热煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
5.2.2鉴别(2)5.2.2.1试液及仪器一般实验仪器和红外分光光度计5.2.2.2分析步骤取供试品约1mg,置玛瑙研钵中,加入干燥的溴化钾或氯化钾细粉约200mg,充分研磨混匀,移置于直径为13mm的压模中,使铺布均匀,压模与真空泵相连,抽气约2分钟后,加压,保持2-5分钟,除去真空,取出制成的供试片,用目视检查后均匀,无明显颗粒。
对空气作为背景扫描完后,立即放入供试片进行扫描,录制光谱图。
本品的红外光吸收图谱应与对照的图谱(光谱集209图)一致。
5.3.检查5.3.1溶液的澄清度5.3.1.1试液及仪器一般实验仪器碳酸钠试液:取一水合碳酸钠12.5g 或无水碳酸钠10.5g,加水使溶解成100ml,即得。
5.3.1.2分析步骤取本品0.50g,用10ml大肚移液管加温热至约45℃的碳酸钠试液10ml溶解后,溶液应澄清。
5.3.2游离水杨酸5.3.2.1试液及仪器一般实验仪器和高相液相色谱仪供试品溶液的制备取本品约100mg,精密称定,置10ml量瓶中,加1%冰醋酸甲醇溶液适量,振摇使溶解,并稀释至刻度,摇匀,即得(临用前新配)。
阿司匹林质量标准

阿司匹林C9H8O4180.16 本品为2-(乙酰氧基)苯甲酸。
含C9H8O4。
不得少于99.5%。
【性状】本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠试液或碳酸钠试液中溶解,但同时分解。
【鉴别】(1)取本品约0.1g加水l0ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0.5g,加碳酸钠试液l0ml,煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品0.50g,加微温至约45℃的碳酸钠试液l0ml溶解后,溶液应澄清。
游离水杨酸取本品0.l0g,加乙醇lml溶解后,加冷水适量使成50ml,立即加新制的稀硫酸铁铵溶液[取盐酸溶液(9→100)lml,加硫酸铁铵指示液2ml后,再加水适量使成100ml]1ml,摇匀,30秒钟内如显色,与对照液(精密称取水杨酸0.1g,加水溶解后,加冰醋酸lml,摇匀,再加水使成1000ml,摇匀,精密量取lml,加乙醇lml、水48m1与上述新制的稀硫酸铁镀溶液lml,摇匀)比较,不得更深(0.1%)。
易炭化物取本品0.5g,依法检查(附录71页),与对照液(取比色用氯化钻液0.25m1、比色用重铬酸钾液0.25m1、比色用硫酸铜液0.40ml,加水使成5ml)比较,不得更深。
炽灼残渣不得过0.1%(附录71页)。
重金属取本品1.0g,加乙醇23m1溶解后,加醋酸盐缓冲液(pH3.5)2m1,依法检查(附录66页,第一法),含重金属不得过百万分之十。
【含量测定】取本品约0.4g,精密称定,加中性乙醇(对酚酞指示液显中性)20m1溶解后,加酚酞指示液3滴,用氢氧化钠滴定液(0.lmol/L)滴定。
每lml氢氧化钠滴定液(0.lmol/L)相当于18.02mg的C9H8O4。
阿司匹林质量标准

阿司匹林C9H8O4 180.16本品为2-(乙酰氧基)苯甲酸。
含C9H8O4。
不得少于99.5%。
【性状】本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠试液或碳酸钠试液中溶解,但同时分解。
【鉴别】(1)取本品约0.1g加水l0ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0.5g,加碳酸钠试液l0ml,煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品0.50g,加微温至约45℃的碳酸钠试液l0ml溶解后,溶液应澄清。
游离水杨酸取本品0.l0g,加乙醇lml溶解后,加冷水适量使成50ml,立即加新制的稀硫酸铁铵溶液[取盐酸溶液(9→100)lml,加硫酸铁铵指示液2ml后,再加水适量使成100ml]1ml,摇匀,30秒钟内如显色,与对照液(精密称取水杨酸0.1g,加水溶解后,加冰醋酸lml,摇匀,再加水使成1000ml,摇匀,精密量取lml,加乙醇lml、水48m1与上述新制的稀硫酸铁镀溶液lml,摇匀)比较,不得更深(0.1%)。
易炭化物取本品0.5g,依法检查(附录61页),与对照液(取比色用氯化钻液0.25m1、比色用重铬酸钾液0.25m1、比色用硫酸铜液0.40ml,加水使成5ml)比较,不得更深。
4.操作方法 4.1取内径、色泽一致的具塞比色管两支,编号为甲管、乙管。
4.2甲管中加该药品项下规定的对照溶液5ml。
4.3乙管中加无色的硫酸[含H2SO4应为94.5%~95.5%(g/g)]5ml。
4.4取规定量的供试品(如为固体,应先研成细粉)分次缓缓加入乙管中,振摇使溶解。
4.5除另有规定外,静置15分钟,将甲乙两管同置白色衬板前,平视观察,比较颜色深浅。
江西普丽尔药业有限公司—易炭化物检查操作规程第 2 页共2页 5.注意事项 5.1比色管应干燥、洁净,如乙管中加硫酸后,在加入供试品之前已显色,应重新洗涤比色管,干燥后再使用。
阿司匹林质量标准

阿司匹林C9H8O4 180.16本品为2-(乙酰氧基)苯甲酸。
含C9H8O4。
不得少于99.5%。
【性状】本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠试液或碳酸钠试液中溶解,但同时分解。
【鉴别】(1)取本品约0.1g加水l0ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0.5g,加碳酸钠试液l0ml,煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品0.50g,加微温至约45℃的碳酸钠试液l0ml 溶解后,溶液应澄清。
游离水杨酸取本品0.l0g,加乙醇lml溶解后,加冷水适量使成50ml,立即加新制的稀硫酸铁铵溶液[取盐酸溶液(9→100)lml,加硫酸铁铵指示液2ml后,再加水适量使成100ml]1ml,摇匀,30秒钟内如显色,与对照液(精密称取水杨酸0.1g,加水溶解后,加冰醋酸lml,摇匀,再加水使成1000ml,摇匀,精密量取lml,加乙醇lml、水48m1与上述新制的稀硫酸铁镀溶液lml,摇匀)比较,不得更深(0.1%)。
易炭化物取本品0.5g,依法检查(附录61页),与对照液(取比色用氯化钻液0.25m1、比色用重铬酸钾液0.25m1、比色用硫酸铜液0.40ml,加水使成5ml)比较,不得更深。
4.操作方法 4.1取内径、色泽一致的具塞比色管两支,编号为甲管、乙管。
4.2甲管中加该药品项下规定的对照溶液5ml。
4.3乙管中加无色的硫酸[含H2SO4应为94.5%~95.5%(g/g)]5ml。
4.4取规定量的供试品(如为固体,应先研成细粉)分次缓缓加入乙管中,振摇使溶解。
4.5除另有规定外,静置15分钟,将甲乙两管同置白色衬板前,平视观察,比较颜色深浅。
江西普丽尔药业有限公司—易炭化物检查操作规程第 2 页共2页5.注意事项 5.1比色管应干燥、洁净,如乙管中加硫酸后,在加入供试品之前已显色,应重新洗涤比色管,干燥后再使用。
QC-TS-044-01 药材及饮片二氧化硫残留量质量标准
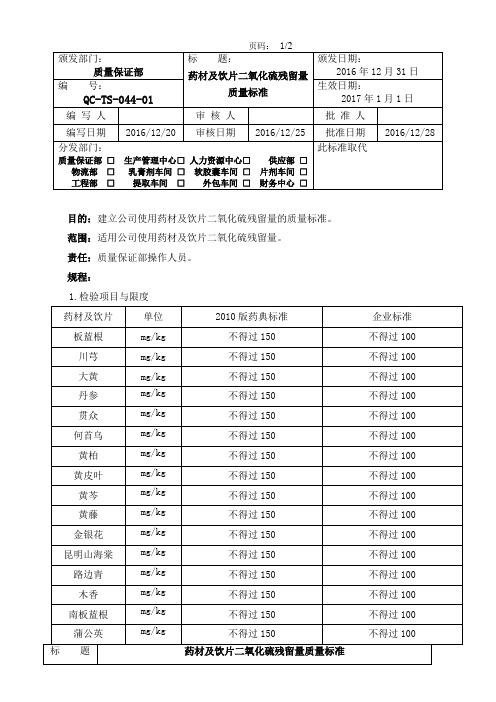
企业标准 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100
2.变更记载及原因: 版本号 01 执行日期 2017 年 1 月 1 日 变更原因/依据及详细变更内容 据《中国药典》 ( 2010 版)及《药品生产质量管理规范》 (2010 版)修订,采用新文件体系格式的新版本文件。
页码: 2/2
颁发部门
质量保证部
编
号
QC-TS-044-01
药材及饮片 蒲黄 三叉苦 三七 生姜 五灵脂 小茴香 制何首乌 延胡索 栀子 紫花地丁
单位 mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg m0 版药典标准 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150
题:
2016/12/20
生产管理中心□ 人力资源中心□ 供应部 □ 乳膏剂车间 □ 软胶囊车间 □ 片剂车间 □ 提取车间 □ 外包车间 □ 财务中心 □
目的:建立公司使用药材及饮片二氧化硫残留量的质量标准。 范围:适用公司使用药材及饮片二氧化硫残留量。 责任:质量保证部操作人员。 规程: 1.检验项目与限度 药材及饮片 板蓝根 川芎 大黄 丹参 贯众 何首乌 黄柏 黄皮叶 黄芩 黄藤 金银花 昆明山海棠 路边青 木香 南板蓝根 蒲公英 标 题 单位 mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg mg/kg 2010 版药典标准 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 不得过 150 药材及饮片二氧化硫残留量质量标准 企业标准 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100 不得过 100
阿司匹林检验
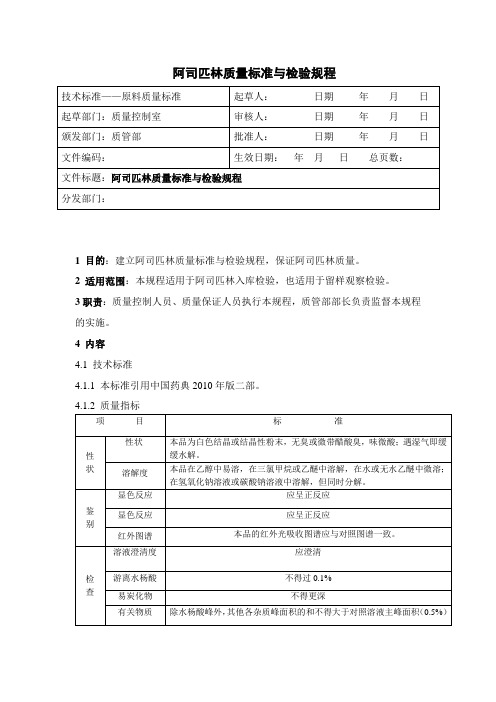
阿司匹林质量标准与检验规程1 目的:建立阿司匹林质量标准与检验规程,保证阿司匹林质量。
2 适用范围:本规程适用于阿司匹林入库检验,也适用于留样观察检验。
3职责:质量控制人员、质量保证人员执行本规程,质管部部长负责监督本规程的实施。
4 内容4.1 技术标准4.1.1 本标准引用中国药典2010年版二部。
4.1.2 质量指标4.2 准备工作仪器试剂的准备4.2.1 玻璃仪器移液管、锥形瓶、碱式滴定管4.2.2 氢氧化钠滴定液(0.1mol/L)4.2.3 乙醇(分析纯)、水杨酸对照品。
4.2.4 酚酞指示液、三氯化铁试液、碳酸钠试液。
4.3 操作4.3.1 性状本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
溶解度本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
4.3.2 鉴别4.3.2.1 取本品约0.1g,加水10ml,煮沸、放冷,加三氯化铁试液1滴。
即显紫堇色。
4.3.2.2 取本品约0.5g,加碳酸钠试液10ml。
煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
4.3.2.3 本品的红外光吸收图谱应与对照的图谱一致。
4.3.3 检查4.3.3.1 溶液的澄清度取本品0.50g,加温热至约45℃的碳酸钠试液10ml溶解后,溶液应澄清。
4.3.3.2 游离水扬酸取本品0.1g,精密称定,置10ml量瓶中,加1%冰醋酸甲醇溶液适量,振摇使溶解,并稀释至刻度,摇匀,作为供试品溶液(临用新制);取水杨酸对照品约10mg,精密称定,置100ml量瓶中,加1%冰醋酸甲醇溶液适量使溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,作为对照品溶液。
照《高效液相色谱法标准操作程序》测定,用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20︰5︰5︰70)为流动相;检测波长为303nm。
阿司匹林肠溶片

阿司匹林肠溶片的质量检查姓名: @@@@@@@@@班级: @@@@@@@@@2学号:@@@@@@阿司匹林肠溶片质量标准[摘要] 目的:掌握阿司匹林肠溶片质量检查的方法步骤。
方法:通过两步滴定法、紫外分光光度法、薄层色谱法及高效液相色谱这四种方法来建立阿司匹林肠溶片的质量标准。
[关键词]两步滴定法紫外分光光度法薄层色谱法高效液相色谱法乙酰水杨酸[1](Asprin),俗名阿司匹林,又称醋柳酸。
分子量为180.16,白色针状或板状结晶或结晶性粉末,无臭,微带酸味。
mp:135-138度,在干燥空气中稳定,遇潮则缓慢水解成水杨酸和醋酸,微溶于水,溶于乙醇,乙醚,氯仿,也溶于碱溶液,同时分解。
可由水杨酸和醋酸作用制得。
具有解热镇痛及溶血作用。
为了探究复方乙酰水杨酸片的质量标准,我分别通过两步滴定法,紫外分光光度法,薄层色谱法及高效液相色谱法进行了考察,并对方法学的部分内容进行了验证。
分子结构式为:C9H8O4 分子相对质量:180.16<B 分子结构式:1仪器与试剂1.1试剂阿司匹林肠溶片;阿司匹林对照品;水杨酸对照品;95%乙醇(分析纯,天津市富宇精细化工有限公司,批号:090403);酚酞试剂;硫酸(分析纯,乌鲁木齐天岳化学试剂有限公司,批号:070128);中性乙醇(自制);甲醇(分析纯,天津市光复科技有限公司,批号:090112);0.1mol/L氢氧化钠溶液(自制);冰醋酸(分析纯,天津市富宇精细化工有限公司,批号:081213);1.2仪器容量瓶;高效液相仪器(苏制05000111号);滤纸有机膜(上海兴亚净化材料厂,规格Ø50mm,孔径 0.22μm,批号:080905);针头滤品(孔径 0.22μm,规格Ø13mm,上海兴亚净化材料厂,批号:080805);紫外分光光度仪(上海棱光技术有限公司,沪制00000208);石英比色皿(宜兴市晶科光学仪器有限公司);硅胶板(规格50*150mm,厚度 0.20-0.25mm,青岛海洋化工厂分厂,批号:080902);展开槽;紫外线分析仪(ZF-I型三用紫外分析仪,上海顾材电光仪器厂,批号:031230);电子天平(BS110S Max110g d=0.1㎎,北京赛多利斯天平有限公司,量制京字00000249号);2【鉴别】(1)取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴.即显紫堇色。
阿司匹林检验

阿司匹林质量标准与检验规程1 目的:建立阿司匹林质量标准与检验规程,保证阿司匹林质量。
2 适用范围:本规程适用于阿司匹林入库检验,也适用于留样观察检验。
3职责:质量控制人员、质量保证人员执行本规程,质管部部长负责监督本规程的实施。
4 内容4.1 技术标准4.1.1 本标准引用中国药典2010年版二部。
4.1.2 质量指标4.2 准备工作仪器试剂的准备4.2.1 玻璃仪器移液管、锥形瓶、碱式滴定管4.2.2 氢氧化钠滴定液(0.1mol/L)4.2.3 乙醇(分析纯)、水杨酸对照品。
4.2.4 酚酞指示液、三氯化铁试液、碳酸钠试液。
4.3 操作4.3.1 性状本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
溶解度本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
4.3.2 鉴别4.3.2.1 取本品约0.1g,加水10ml,煮沸、放冷,加三氯化铁试液1滴。
即显紫堇色。
4.3.2.2 取本品约0.5g,加碳酸钠试液10ml。
煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气。
4.3.2.3 本品的红外光吸收图谱应与对照的图谱一致。
4.3.3 检查4.3.3.1 溶液的澄清度取本品0.50g,加温热至约45℃的碳酸钠试液10ml溶解后,溶液应澄清。
4.3.3.2 游离水扬酸取本品0.1g,精密称定,置10ml量瓶中,加1%冰醋酸甲醇溶液适量,振摇使溶解,并稀释至刻度,摇匀,作为供试品溶液(临用新制);取水杨酸对照品约10mg,精密称定,置100ml量瓶中,加1%冰醋酸甲醇溶液适量使溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,作为对照品溶液。
照《高效液相色谱法标准操作程序》测定,用十八烷基硅烷键合硅胶为填充剂;以乙腈-四氢呋喃-冰醋酸-水(20︰5︰5︰70)为流动相;检测波长为303nm。
阿司匹林规格标准
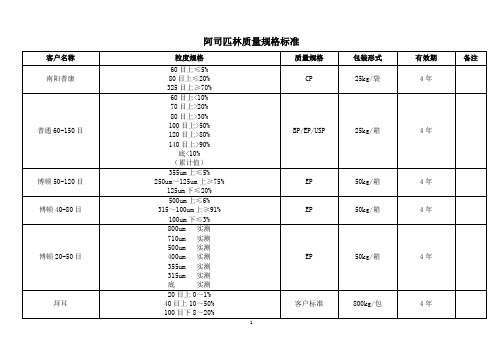
4年
马林克罗40-80
40目上≤9%
60目上实测
80目上实测
140目上≤30%
200目上≤7%
底≤6%
客户标准
50kg/桶
4年
PH.L公司
200um上≥60%
650um上≤10%
BP/EP/USP
25kg/桶
4年
威林40-80目
40目上≤9%
60目上40-55%
80目上实测
140目上≤30%
50kg/袋
4年
洛比20-60目
60目上≥84%
底实测
USP
50kg/袋
4年
60-120目
60目上≤30%
120目上≥80%
BP/EP/USP
25kg/箱
4年
塞诺飞哥伦比亚
20目上≤5%
80目上≥60%
松密度0.65-0.85g/ml
BP/EP/USP
50kg/桶
4年
60-325目
60目上≤5%
80目上≤30%
16目上<1%
40目上>35%
100目下<5%
BP/EP/USP
25kg/桶
4年
4年
博顿50-120目
355um上≤5%
250um~125um上≥75%
125um下≤20%
EP
50kg/箱
4年
博顿40-80目
500um上≤6%
315~100um上≥91%
100um下≤3%
EP
50kg/箱
4年
博顿20-50目
800um实测
710um实测
500um实测
400um实测
阿司匹林肠溶片标准操作规程

阿司匹林肠溶片检验标准操作规程1. 目的建立阿司匹林肠溶片检验标准操作规程,规范阿司匹林肠溶片检验操作。
2. 范围适用于阿司匹林肠溶片的检验。
3. 依据《中国药典》2010版二部4. 职责4.1起草:QC 审核:QA 批准人:质量负责人。
4.2QC实施本规程。
4.3 QA监督本规程的实施。
5.内容本品含阿司匹林(C9H8O4)应为标示量的93.0-107.0%。
5.1性状本品为肠溶包衣片,除去包衣后显白色。
5.2鉴别5.2.1仪器及试液一般实验仪器和高效液相色谱仪。
三氯化铁试液:三氯化铁9g,加水使溶解成100ml,即得。
5.2.2分析步骤5.2.2.1取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴,观察现象,溶液显紫堇色。
5.2.2.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3检查5.3.1游离水杨酸5.3.1.1 仪器及试液一般实验仪器、十万分之一天平和高效液相色谱仪。
1%冰醋酸甲醇溶液:取1ml冰醋酸加甲醇稀释至100ml,即得。
5.3.1.2 分析步骤除检测波长改为303nm外,照含量测定项下的色谱条件试验。
精密称取细粉适量(约相当于阿司匹林0.1g),置100ml量瓶中,用1%冰醋酸甲醇溶液振摇溶解,并稀释至刻度,摇匀,用有机相滤膜(孔径:0.45μ)滤过,立即精密量取续滤液10μl,注入液相色谱仪,记录色谱图;另取水杨酸对照品约15mg,精密称定,置50ml量瓶中,用1%冰醋酸甲醇溶液溶解,并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,同法测定。
按外标法以峰面积计算,含水杨酸不得过阿司匹林标示量的1.5%。
含量% = A样×W对/50×5/100×平均片重A对×W样/100×0.1×100% ………………公式①式中A样----样品的峰面积W对----水杨酸对照品称样量A对----水杨酸对照品的峰面积W样----样品的称样量0.1----标示量5.3.2释放度5.3.2.1试液及仪器一般实验仪器、十万分之一天平、高效液相色谱仪和ZRC-8L智能溶出度测试仪。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目的:建立阿司匹林质量标准。
范围:适用阿司匹林。
责任:质量保证部操作人员。
规程:
2. 性状本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在氯仿或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
3.类别解热镇痛非甾体抗炎药,抗血小板聚集药。
4.贮藏密封,在干燥处保存。
4.制剂
4.1阿司匹林片
4.2阿司匹林肠溶片
4.3阿司匹林肠溶胶囊
4.4 阿司匹林泡腾片
4.5阿司匹林栓
5.原辅料、包装材料取样标准操作规程:QC-OS-205-01
6.阿司匹林检验标准操作规程:QC-OS-054-01
7.贮存期:二年
8.变更记载及原因:。
