实时荧光定量 原理 taqman 探针简介
taqman荧光探针的原理

taqman荧光探针的原理TaqMan荧光探针是一种常用于实时荧光定量PCR(Polymerase Chain Reaction,聚合酶链式反应)的探针。
其原理基于PCR扩增过程中的特定核酸序列的扩增和荧光信号的检测。
TaqMan荧光探针由三个部分组成:1. 引物(primers):引物是设计用于扩增待测核酸序列的短小DNA 片段,通常有两个引物,一个用于扩增待测序列的起始位点,另一个用于扩增终止位点。
2. 探针(probe):探针是一个含有荧光染料和一个对荧光染料发出信号具有抑制作用的化学修饰的短小DNA片段。
探针的序列与待测核酸序列的中间部分完全匹配。
3. Taq DNA聚合酶(Taq DNA polymerase):Taq DNA聚合酶是一种热稳定的DNA聚合酶,能够在PCR反应中扩增DNA序列。
TaqMan荧光探针的工作原理如下:1. 引物与Taq DNA聚合酶一起作用,将待测核酸序列进行扩增。
引物会识别并结合到待测序列的起始位点和终止位点,Taq DNA聚合酶会沿着待测序列进行DNA合成,生成大量的扩增产物。
2. 在PCR反应中,TaqMan探针与待测序列中间部分的完全匹配,探针的5'端和3'端分别连接着两种不同的荧光染料(通常是荧光发射染料和荧光供体染料)。
3. 在PCR反应过程中,当Taq DNA聚合酶在扩增过程中到达探针的位置时,它会剪切探针,将发射染料和供体染料分离,导致荧光信号的释放。
4. 荧光信号可以通过实时荧光PCR仪器进行实时检测和记录。
荧光信号的强度与PCR反应中扩增产物的数量成正比,从而可以定量测量待测核酸的起始量。
TaqMan荧光探针的原理可实现高度特异性和灵敏度的实时定量PCR 分析,广泛应用于基因表达分析、病原体检测、基因突变分析等领域。
希望以上解释对您有所帮助。
如有任何进一步的问题,请随时提问。
taqman探针工作原理

taqman探针工作原理
TaqMan探针是一种常用于实时荧光定量PCR的探针。
它的工作原理基于PCR过程中的DNA合成和降解。
TaqMan探针由两个部分组成:一个荧光染料(通常是荧光标记的探针)和一个质子酶(也称为引物)。
这两个部分之间有一个特殊设计的序列,被称为探针的引物序列。
在PCR反应中,当温度升高到合适的退火温度时,Taq DNA 聚合酶会开始合成新的DNA链。
同时,TaqMan探针的引物会与待测DNA序列上的目标区域特异性结合,并被Taq DNA 聚合酶所识别。
在DNA合成过程中,Taq DNA聚合酶会解读引物的序列,并在其5'端的3'端延伸时释放出荧光染料。
当荧光染料释放后,它的荧光信号将被检测仪器记录下来。
此时,PCR反应会不断进行,荧光信号会随着PCR循环的增加而累积。
通过监测荧光信号的强度和周期数,我们可以确定样品中待测DNA的起始量。
由于TaqMan探针的设计是特异性的,只有当引物与目标DNA序列完全匹配时,才会发生荧光信号的释放。
这使得TaqMan探针在实时PCR中具有高度的特异性和准确性。
总之,TaqMan探针通过监测PCR反应中荧光信号的释放来实现DNA定量,是一种可靠、灵敏且广泛应用于分子生物学研究的技术。
taqman探针原理

taqman探针原理TaqMan探针原理。
TaqMan探针是一种用于实时荧光定量PCR(Polymerase Chain Reaction)的探针,它以其高度特异性和灵敏度而闻名。
在实时PCR中,TaqMan探针可以用来检测和定量特定DNA序列的存在,因此在分子生物学和遗传学研究中得到了广泛的应用。
TaqMan探针的原理基于PCR技术,PCR是一种能够扩增特定DNA片段的方法。
在PCR过程中,DNA片段会被不断复制,从而使得起始数量极少的DNA片段得以扩增至足够数量,以便进行后续的分析。
而TaqMan探针则在PCR的基础上,增加了一种荧光信号检测的方法,使得扩增过程可以实时监测和定量。
TaqMan探针由三部分组成,引物(primers)、探针(probe)和荧光染料。
引物是用于引导PCR反应的两个短的DNA片段,它们会结合到目标DNA序列的两端,并作为PCR反应的起始点。
探针是一段含有荧光标记和荧光信号猝灭子(quencher)的DNA片段,它设计为与目标DNA序列的中间部分互补。
在探针未被降解之前,荧光信号被猝灭子吸收,因此不会被探测到。
当PCR反应进行到一定程度时,引物会引导DNA聚合酶复制探针所在的DNA序列,当DNA聚合酶到达探针时,会降解探针,使得荧光信号被释放出来。
荧光信号的强度与PCR反应中目标DNA的数量成正比,因此可以用来实时监测PCR反应的进程。
TaqMan探针的设计需要考虑到多个因素,包括探针的长度、引物和探针的互补性、探针的荧光标记和猝灭子的选择等。
合理的探针设计可以提高PCR反应的特异性和灵敏度,因此在实际应用中需要进行严格的设计和验证。
总的来说,TaqMan探针原理是基于PCR技术的实时荧光定量PCR方法。
通过引物和探针的设计,以及荧光信号的监测,TaqMan探针可以实现对特定DNA序列的快速、特异性和定量检测。
在分子生物学研究、临床诊断和药物研发等领域,TaqMan探针都发挥着重要的作用,为科学研究和医学应用提供了强大的工具。
TaqMan探针技术原理

TaqMan探针技术原理TaqMan探针法是高度特异的定量PCR技术,其核心是利用Taq酶的3′→5′外切核酸酶活性,切断探针,产生荧光信号。
由于探针与模板是特异性结合,所以荧光信号的强弱就代表了模板的数量。
在TaqMan探针法的定量PCR反应体系中,包括一对PCR引物和一条探针。
探针只与模板特异性地结合,其结合位点在两条引物之间。
探针的5′端标记有报告基团(Reporter, R),如FAM、VIC等,3′端标记有荧光淬灭基团(Quencher, Q),如TAMRA等。
当探针完整的时候,报告基团所发射的荧光能量被淬灭基团吸收,仪器检测不到信号。
随着PCR的进行,Taq酶在链延伸过程中遇到与模板结合的探针,其3′→5′外切核酸酶活性就会将探针切断,报告基团远离淬灭基团,其能量不能被吸收,即产生荧光信号(图4)。
所以,每经过一个PCR循环,荧光信号也和目的片段一样,有一个同步指数增长的过程。
信号的强度就代表了模板DNA的拷贝数。
图4 TaqMan探针的荧光信号产生机制TaqMan探针根据其3′端标记的荧光淬灭基团的不同分为两种:普通的TaqMan 探针和TaqMan MGB探针。
MGB探针的淬灭基团采用非荧光淬灭基团(Non-Fluorescent Quencher),本身不产生荧光,可以大大降低本底信号的强度。
同时探针上还连接有MGB (Minor Groove Binder)修饰基团(图5),可以将探针的Tm值提高10°C左右。
因此为了获得同样的Tm值,MGB探针可以比普通TaqMan探针设计得更短,既降低了合成成本,也使得探针设计的成功率大为提高。
因为在模板的DNA碱基组成不理想的情况下,短的探针比长的更容易设计。
实验证明,TaqMan MGB探针对于富含A/T的模板可以区分得更为理想。
图5 TaqMan MGB探针。
taqman探针原理

taqman探针原理
Taqman探针是一种基于荧光的实时聚合酶链反应(real-time PCR)技术中常用的探针。
它通过结合于扩增DNA序列的内部区域并在聚合酶链反应过程中进行降解来测量DNA扩增的数量。
Taqman探针主要由一个与目标DNA序列互补的引物和一个含有荧光染料和淬灭染料的荧光探针构成。
在PCR反应开始时,聚合酶链反应体系中存在的引物和Taq DNA聚合酶开始扩增DNA的目标序列。
同时,Taqman探针也与目标序列的内部互补区域结合。
这个内部区域一般位于引物之间,并且特异性地结合于目标序列上。
在DNA扩增的过程中,Taq DNA聚合酶逐渐移动,并且在目标序列的内部区域进行脱氧核苷酸的合成。
这导致Taqman探针在聚合酶链反应的过程中被切割,并将荧光染料和淬灭染料分离开来。
在扩增过程中,荧光染料被释放出来,并且可以被特定荧光探针识别和检测。
一旦有荧光信号的释放,荧光探针就会与其结合,产生荧光信号的峰值。
这使得实时PCR仪器可以测量DNA扩增的数量,从而确定初始样本中目标DNA的量。
Taqman探针的优势在于其高特异性和灵敏度。
由于荧光探针是特异性地与目标序列结合,可以避免假阳性信号的产生。
此外,实时PCR技术可以在PCR反应过程中进行数据收集,使得结果可以实时监测和分析。
总而言之,Taqman探针是一种基于荧光的实时PCR技术中常
用的探针,通过结合于目标序列的内部区域并在PCR反应过
程中降解来测量DNA扩增的数量。
它具有高特异性和灵敏度,并且可以实时监测和分析扩增过程。
taqman荧光定量pcr基本原理

taqman荧光定量pcr基本原理
TaqMan荧光定量PCR是指采用荧光标记的PCR技术,它可以实现对特定序列DNA的定量分析,即可以直接测量所检测序列在模板文库中的相对浓度。
TaqMan荧光定量PCR可以说是一种双通道的实时PCR技术,最初由PE Applied Biosystems(PE)推出。
它是通过特定的标记技术,开发了FRET和TaqMan技术,结合PCR技术,以达到定量分析和监测某一特定序列DNA的目的,这种技术比以往的技术有很大的优势,更易于完成。
TaqMan荧光定量PCR的基本原理比较简单,大致可以分为以下四步:
(1)样本处理:检测序列DNA及其作为模板的原始样品将在定量PCR试剂盒中经过一系列处理,得到模板文库。
(2)探针标记:样品处理完成后,将开发出一对对应该特殊序列的5'荧光探针—特殊碱基对相对应的序列和3'分子耦合(MolecularBeacon)。
探针内部具有双螺旋结构,当处于开放状态时,荧光物质才能折射发射自己特有的颜色荧光。
(3)反应物添加:在模板文库中添加进Taq DNA 聚合酶、核酸类型的合成引物,以及缓冲液,用水调节总体浓度。
(4)加热-冷却:完成上述步骤,将反应液放入定量PCR仪,按照一定的条件,经由一系列的加热、冷却过程,Taq DNA聚合酶将碱基对引物合成,产生复制模板文库。
同时在复制过程中,反应液中复制数量也不断增加,一旦达到一定温度,则表明文库复制到足够多,荧光探针能够在反应液中爆炸,产生光谱,得以直接测定检测序列DNA的定量。
此外,TaqMan荧光定量PCR技术能够检测DNA的扩增曲线,并由此提供准确的定量结果,同时也不受PCR技术的一些影响,更易于操作。
taqman探针原理

taqman探针原理
Taqman探针是一种用于实时聚合酶链反应(real-time PCR)
的荧光标记探针。
它利用荧光共振能量转移(FRET)原理,
对靶标DNA进行定量分析。
Taqman探针包括一个发光染料(如荧光素)连在5'端,一个
荧光抑制剂(如四乙酰基二甲基氧基哌啶,BHQ1)连在3'端。
在无靶标DNA时,发光染料和荧光抑制剂保持在近距离,从
而导致荧光信号被抑制。
当探针与靶标DNA结合时,PCR扩
增过程中,3'至5'外切的Taq聚合酶会识别并切割探针。
此时,荧光染料和抑制剂分离,荧光信号显现出来。
通过实时PCR仪器的荧光探测系统,可以监测到Taqman探
针的荧光信号的增加,以推断靶标DNA的浓度。
通过测量PCR循环数与荧光信号的关系,可以获得准确的定量PCR结果。
Taqman探针的这种特点使得其在基因表达分析、突变检测、
病原体检测等领域具有广泛的应用价值。
它准确、灵敏、特异性高,成为实时PCR中最常用的探针之一。
实时荧光Taqman 探针设计的几个要点
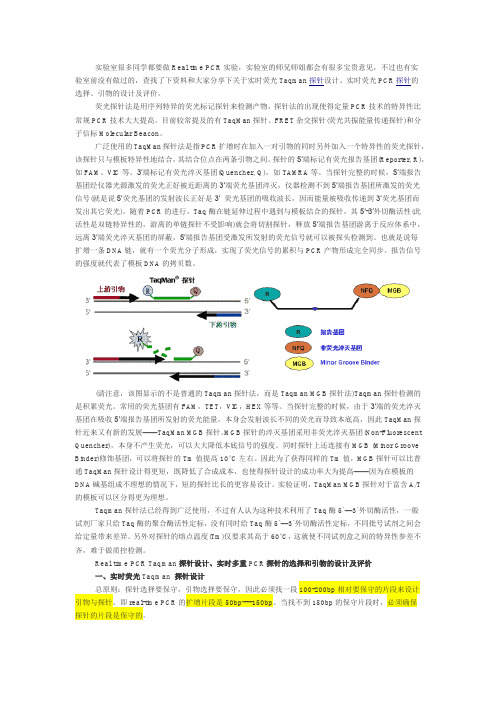
实验室很多同学都要做Real time PCR实验,实验室的师兄师姐都会有很多宝贵意见,不过也有实验室前没有做过的,查找了下资料和大家分享下关于实时荧光Taqman 探针设计、实时荧光PCR探针的选择、引物的设计及评价。
荧光探针法是用序列特异的荧光标记探针来检测产物,探针法的出现使得定量PCR技术的特异性比常规PCR技术大大提高。
目前较常提及的有TaqMan探针、FRET杂交探针(荧光共振能量传递探针)和分子信标Molecular Beacon。
广泛使用的TaqMan探针法是指PCR扩增时在加入一对引物的同时另外加入一个特异性的荧光探针,该探针只与模板特异性地结合,其结合位点在两条引物之间。
探针的5′端标记有荧光报告基团(Reporter, R),如FAM、VIC等,3′端标记有荧光淬灭基团(Quencher, Q),如TAMRA等。
当探针完整的时候,5′端报告基团经仪器光源激发的荧光正好被近距离的3′端荧光基团淬灭,仪器检测不到5′端报告基团所激发的荧光信号(就是说5’荧光基团的发射波长正好是3’ 荧光基团的吸收波长,因而能量被吸收传递到3’荧光基团而发出其它荧光)。
随着PCR的进行,Taq酶在链延伸过程中遇到与模板结合的探针,其5′-3′外切酶活性(此活性是双链特异性的,游离的单链探针不受影响)就会将切割探针,释放5′端报告基团游离于反应体系中,远离3′端荧光淬灭基团的屏蔽,5′端报告基团受激发所发射的荧光信号就可以被探头检测到。
也就是说每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
报告信号的强度就代表了模板DNA的拷贝数。
(请注意,该图显示的不是普通的Taqman探针法,而是Taqman MGB探针法)Taqman探针检测的是积累荧光。
常用的荧光基团有FAM,TET,VIC,HEX等等。
当探针完整的时候,由于3′端的荧光淬灭基团在吸收5′端报告基团所发射的荧光能量,本身会发射波长不同的荧光而导致本底高,因此TaqMan探针近来又有新的发展——TaqMan MGB探针。
QPCR定量简介

荧光定量PCR一、原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料。
原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
优点:重复性好,特异性高,灵敏性高,可多重PCR;缺点:只适合特定目标,价格较贵,本底信号较高。
2)SYBR荧光染料:SYBR荧光染料是一种可以结合在DNA双螺旋小沟区域具有绿色激发波长的燃料。
在PCR 反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
优点:引物设计方便,价格优势;缺点:特异性差,引物要求高,灵敏度差,不能进行多重定量。
二、内标在传统定量中的意义1.几种传统定量PCR方法简介:1)内参照法:在不同的PCR反应管中加入已定量的内标和引物,内标用基因工程方法合成。
上游引物用荧光标记,下游引物不标记。
在模板扩增的同时,内标也被扩增。
在PCR产物中,由于内标与靶模板的长度不同,二者的扩增产物可用电泳或高效液相分离开来,分别测定其荧光强度,以内标为对照定量待检测模板。
2)竞争法:选择由突变克隆产生的含有一个新内切位点的外源竞争性模板。
在同一反应管中,待测样品与竞争模板用同一对引物同时扩增(其中一个引物为荧光标记)。
QPCR定量简介

荧光定量PCR一、原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料。
原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
优点:重复性好,特异性高,灵敏性高,可多重PCR;缺点:只适合特定目标,价格较贵,本底信号较高。
2)SYBR荧光染料:SYBR荧光染料是一种可以结合在DNA双螺旋小沟区域具有绿色激发波长的燃料。
在PCR 反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
优点:引物设计方便,价格优势;缺点:特异性差,引物要求高,灵敏度差,不能进行多重定量。
二、内标在传统定量中的意义1.几种传统定量PCR方法简介:1)内参照法:在不同的PCR反应管中加入已定量的内标和引物,内标用基因工程方法合成。
上游引物用荧光标记,下游引物不标记。
在模板扩增的同时,内标也被扩增。
在PCR产物中,由于内标与靶模板的长度不同,二者的扩增产物可用电泳或高效液相分离开来,分别测定其荧光强度,以内标为对照定量待检测模板。
2)竞争法:选择由突变克隆产生的含有一个新内切位点的外源竞争性模板。
在同一反应管中,待测样品与竞争模板用同一对引物同时扩增(其中一个引物为荧光标记)。
Real-time_PCR_原理(非常经典的PCR文档)
Real-time PCR 原理介绍实时荧光定量PCR技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,它具有特异性更强、有效解决PCR污染问题、自动化程度高等特点,目前已得到广泛应用。
本文试就其定量原理、方法及参照问题作一介绍。
一.实时荧光定量PCR原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
1.Ct 值的定义在荧光定量PCR技术中,有一个很重要的概念 —— Ct值。
C代表Cycle,t代表threshold,Ct值的含义是:每个反应管内的荧光信号到达设定的域值时所经历的循环数(如图1所示)。
图1. Ct值的确定2.荧光域值(threshold)的设定PCR反应的前15个循环的荧光信号作为荧光本底信号,荧光域值的缺省设置是3-15个循环的荧光信号的标准偏差的10倍,即:threshold = 10 ´ SDcycle 6-153.Ct值与起始模板的关系研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系〔1〕,起始拷贝数越多,Ct值越小。
利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代Ct值(如图2所示)。
因此,只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。
图2. 荧光定量标准曲线4.荧光化学荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料〔2〕。
现将其原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
实时荧光定量PCR实验技术原理
实时荧光定量PCR实验技术原理
实时荧光定量PCR实验原理:将标记有荧光素的Taqman探针与模板DNA混合后,完成高温变性、低温复性、适温延伸的热循环,并遵循聚合酶链反应规律,与模板DNA互补配对的Taqman探针被切断,荧光素游离于反应体系中,在指定光激发下发出荧光;当循环次数的增加,被扩增的目的基因片段呈指数规律增长,通过实时检测与之对应的随扩增而变化荧光信号强度,求得Ct值(Cycle threshold,循环阈值,每个反应管内的荧光信号到达设定阈值时所经历的循环数),同时利用数个已知模板浓度的标准品作对照,即可得出待测标本目的基因的拷贝数。
实时荧光定量PCR主要事项:1.控制加量误差:使用加样器时,应定期进行校准,避免反复调档,以减少系统误差,加量的准确。
若需调档,应顺时针缓慢调动;对常用量应设专档专用。
2.标本处理:标本的处理对FQ—PCR测定核酸模板的成功提取具有决定性作用。
此过程主要为手工,在操作中要格外小心,严防交叉污染,避免吸入杂质,特别是每类标本都有各自标准化的处理程序,应严格遵循每个步骤的要求。
另外,一次性用品的选择很重要,如离心管、吸头的质量要严格要求,严格**,避免杂质及其它病原微生物成为扩增的对象而造成结果的偏差。
3.标本的适当保存:标本的保存对于核酸扩增测定的有效性极为重要。
标本采集后应立即送检,不同标本的保存方法各异。
若不能及
时检测通常在-20至-70℃的条件下保存,避免反复冻融(若冻融1次病原数量明显减少从而影响测定结果的准确性下降)。
实时荧光定量PCR-TaqMan探针法及设计原则

03
Taqman探针的合成与制备
探针的合成方法
化学合成法
通过化学反应将荧光基团和淬灭基团分别连接到DNA或RNA的5'和3'末端,形成 Taqman探针。
酶促合成法
利用DNA聚合酶将荧光基团和淬灭基团分别添加到DNA或RNA的特定位置,形成 Taqman探针。
探针的质量检测与纯化
质量检测
通过电泳、质谱和光谱分析等方法检测探针 的长度、荧光基团和淬灭基团的数量和位置 ,以及探针的纯度。
定义与原理
定义
实时荧光定量PCR-Taqman探针法是 一种基于荧光信号的实时监测技术, 用于定量分析DNA或RNA的拷贝数。
原理
通过在Taq酶催化下,利用荧光染料 标记的特异性探针与待测核酸进行特 异性结合,在PCR循环过程中实时监 测荧光信号的增强,从而实现对核酸 的定量分析。
发展历程与现状
02
Taqman探针的设计原则
探针的长度与结构
长度
通常为20-30bp,确保特异性并减少非特异性扩增。
结构
由报告基团、淬灭基团和连接臂组成,连接臂长度一般为5-6个脱氧核糖核苷酸。
探针的特异性
针对目标序列
确保探针与目标序列完全匹配,避免 交叉反应。
序列选择
选择基因特异性区域,避免基因组中 的高变区。
04
Taqman探针在实时荧光定量 PCR中的应用
样本处理与PCR反应体系建立
样本处理
确保样本质量,去除杂质和抑制剂,提 取高质量的DNA或RNA。
Taqman探针设计
根据目标基因序列设计Taqman探针, 确保探针的特异性和荧光信号的稳定
性。
引物设计
根据目标基因序列设计特异性引物, 确保引物与模板的结合效率和特异性。
实时荧光定量PCR方法简介

实时荧光定量PCR方法简介一.实时荧光定量PCR的基本原理理论上,PCR过程是按照2n(n代表PCR循环的次数)指数的方式进行模板的扩增。
但在实际的PCR反应过程中,随着反应的进行由于体系中各成分的消耗(主要是由于聚合酶活力的衰减)使得靶序列并非按指数方式扩增,而是按线性的方式增长进入平台期。
因此在起始模板量与终点的荧光信号强度间没有可靠的相关性。
如采用常规的终点检测法(利用EB染色来判断扩增产物的多少,从而间接的判断起始拷贝量),即使起始模板量相同经PCR扩增、EB染色后也完全有可能得到不同的终点荧光信号强度。
为了能准确判断样品中某基因转录产物(mRNA)的起始拷贝数,实时荧光定量PCR采用新的参数——Ct值,定量的根本原理是Ct值与样品中起始模板的拷贝数的对数成线性反比关系。
Ct值是如何得到的在实时荧光定量PCR的过程中,靶序列的扩增与荧光信号的检测同时进行,定量PCR仪全程采集荧光信号,实验结束后分析软件自动按数学算法扣除荧光本底信号并设定阈值从而得到每个样品的Ct值。
Ct值的定义Ct值中的“C”代表Cycle(循环),“t”代表检测threshhold(阈值),其含义是PCR扩增过程中荧光信号强度达到阈值所需要的循环数;也可以理解为扩增曲线与阈值线交点所对应的横坐标。
Ct值与样品中模板的对应关系Ct值与样品中起始模板的拷贝数的对数成线性反比关系(y=ax+b,x代表起始模板拷贝数的对数,y代表Ct值)。
与终点法相比利用Ct值的优势由于Ct值是反映实际PCR反应过程中扩增即将进入指数期的参数,该参数几乎不受试剂消耗等因素的影响,因此利用Ct值判断的起始模板拷贝数更加精确,重复性也更好。
传统的终点检测法是在PCR扩增经历了指数扩增期进入平台期后利用EB等染料染色来判断扩增产物的多少,从而间接的判断起始拷贝量,这种方法的精确度不高、重复性也不好。
下图中是96个复孔的实时扩增曲线(完全相同的反应体系、相同的反应protocol、相同的样品起始浓度),可以看到Ct值具有很好的重复性,而终点的荧光信号强度差异达到300个单位。
taqman探针法的基本原理

taqman探针法的基本原理在生物分子检测的神奇世界里,有个超厉害的小家伙叫 Taqman 探针法。
这可是个能帮我们窥探生命奥秘的好帮手呢!想象一下,我们的细胞里有好多好多的基因和分子,就像一个超级大的秘密花园,充满了各种神秘的信息。
而 Taqman 探针法就像是一把神奇的钥匙,能帮我们打开这个花园的大门,去发现里面的宝贝。
那这把神奇的钥匙到底是怎么工作的呢?其实啊,它的原理就像是一场精心策划的“捉迷藏”游戏。
咱们先来说说 Taqman 探针是啥。
它就像是一个带着特殊标记的小侦探。
这个小侦探长得有点特别,一头连着能发出荧光的东西,另一头呢,有一段和我们要找的目标分子(比如某个特定的基因片段)能配对结合的序列。
当我们开始检测的时候,就把这个小侦探和其他的小伙伴们一起放进一个反应体系里。
这里面还有我们要检测的那些分子,还有能让反应发生的各种东西。
然后,反应就开始啦!这个时候,有一种叫 Taq 酶的小伙伴登场了。
它就像是个勤劳的小工人,不停地干活。
在反应过程中,如果没有找到要检测的目标分子,那这个小侦探探针就好好的待着,它身上的荧光也被藏得严严实实的,咱们啥也看不到。
但是,一旦找到了目标分子,那就精彩啦!Taq 酶这个小工人就会发挥作用,它会一边往前走,一边把和目标分子结合在一起的探针给切断。
这一切断可不得了,原本被藏着的荧光就一下子跑出来啦!你看,这是不是很神奇?就好像是小侦探找到了目标,然后发出了信号告诉我们:“我找到啦!”而且哦,荧光的强度和我们要检测的目标分子的数量是有关系的。
目标分子越多,被切断的探针就越多,跑出来的荧光也就越强。
这样,我们通过检测荧光的强度,就能知道目标分子到底有多少啦!比如说,如果我们想知道一个人身体里是不是有某种病毒,就可以用 Taqman 探针法来检测。
看看病毒的基因在不在,有多少,就能知道这个人是不是生病了,病得重不重。
总之啊,Taqman 探针法就像是一个超级厉害的魔法,能让那些看不见摸不着的分子变得能被我们发现和了解。
Taqman探针

自90年代Taqman探针诞生以来,虽然荧光探针(引物)不断有新的技术出现,但是作为一种经典的定量PCR技术,Taqman探针技术仍然是许多实验研究人员进行定量检测的首选,这主要是因为相对于SYBR荧光染料,Taqman探针具有序列特异性,只结合到互补区,而且荧光信号与扩增的拷贝数具有一一对应的关系,因此特异性强灵敏度高,而且条件优化容易;而相对于杂交探针,Taqman探针只要设计一条探针,因此探针设计较便宜方便,而且也能完成基本的定量PCR要求。
当然Taqman定量方法由于还是要合成探针,也给实验操作带来了挑战。
一般Taqman定量PCR实验过程为:目的基因查找比对→探针与引物设计→探针与引物合成→配置反应体系→反应参数→重复实验,优化条件→获得曲线数据,比对标准曲线→再重复验证。
第一步:在第一步目的基因查找比对过程中可以利用NCBI genbank序列以及DNAstar等软件完成目的DNA或者RNA的查找与比对——这在分析测序报告的时候相信很多人操作过,这一步需要注意的就是要保证所分析的序列在一个contig(重叠群,即染色体的一些区域中毗邻DNA片段重叠的情况)内。
第二步:如果其它条件一致,那么这个第二步——引物探针的设计就可以说是定量PCR成败的关键了,通过各方面经验的总结有以下几个基本的原则:总体原则* 先选择好探针,然后设计引物使其尽可能的靠近探针。
* 所选序列应该高度特异,尽量选择具有最小二级结构的扩增片段——这是因为二级结构会影响反应效率,而且还会阻碍酶的扩增。
建议先进行二级结构检测,如果不能避免二级结构,那么就要相应提高退火温度。
* 扩增长度应不超过400bp,理想的最好能在100-150bp内,扩增片段越短,有效的扩增反应就越容易获得。
较短的扩增片段也容易保证分析的一致性。
* 保持GC含量在20%和80%之间,GC富含区容易产生非特异反应,从而会导致扩增效率的降低,以及出现在荧光染料分析中非特异信号。
taqman探针实时荧光定量rt-pcr法检测siv2fshiv病毒rna拷贝数方法的建立及..

第三节结果1.TaqMan探针real.timeRT-PCR方法及SYBRGreenIreal.timeRT-PCR方法测定定量曲线各个稀释度RS标准品在第一个循环结束后测到一个基础吸光值,图1-a中一直到第15个循环结束时都没有明显变化,从第15个循环开始lX107copies/pLRS标准品的吸光值增大,定量曲线开始抬头,18个循环(Ct值)后,曲线迅速上扬,至第28个循环前后达到峰值,随后进入平台期,一直到反应结束,此后的标准品的Ct值依次延迟约3个循环,但除10个拷贝Rs标准品外,各扩增曲线的斜率相同,间距相等,相互平行,阴性对照PCR级水的扩增曲线稍有起伏。
而图l-b中从第11个循环开始lX107copies/pLRS标准品的吸光值增大,15个循环后,曲线迅速上扬,至第30个循环前后达到峰值,随后同样进入平台期,至反应结束,102和10个拷贝RS标准品几乎同时在33个循环左右出现曲线,但斜率不同,阴性对照PCR级水也出现了扩增曲线,但吸光值不高(见图1)。
图1-aTaqMan探针real—timeRT-PCR测得10倍系列稀释RNA标准品的荧光定量曲线。
由左至右分别是1×107copies/I_tL、l×106copies/pL、1×l05copies//aL、l×104eopies/I.tL、1×103copies/I.tL、l×102copies/pL、1×101copies/BL,最下面一条线是PCR级水做的阴性对照。
横坐标显示的是循环数,纵坐标是荧光值。
Fig.1-aAmplificationcurveobtainedwith10一foldserialdilutionsoftheRNAstandards(RS)byreal-timeRT-PCRmethodwithTaqManprobe.Fromlefttorightarestandardsfroml×107copies/lJLto1×101copies/lxL.Asanegativecontr01.thetemplateRNAwasreplacedwithPCR-gradewater.Thex-axisshowsthenumberofPCRcyclesandthey-axisshowsthenormalizedfluorescenceintensity.b图1.bSYBRGreenIreal—timeRT-PCR测得10倍系列稀释RNA标准品的荧光定量曲线。
taqman探针原理

相当于60元/ml
T公司mix,扩PPARa定量
95℃ 5 min;(果可稳以定3性m,in最,好但5为m了in。结)
95℃ 5 s , 58℃ 10 s , 32个循环 72℃ 10s ;
72℃ 25s ; 25℃ 1s 。
纳米taq配制光探针是一种寡核苷酸探 针,荧光基团连接在探针的5’末端,而淬灭剂则在 3’末端。PCR扩增时在加入一对引物的同时加入一 个特异性的荧光探针,探针完整时,报告基团发射 的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶 的5'-3'外切酶活性将探针酶切降解,使报告荧光 基团和淬灭荧光基团分离,从而荧光监测系统可接 收到荧光信号,即每扩增一条DNA链,就有一个荧 光分子形成,实现了荧光信号的累积与PCR产物形 成完全同步。常用的荧光基团是FAM,TET,VIC, HEX。 而新型TaqMan-MGB探针使该技术既可进 行基因定量分析,又可分析基因突变(SNP),有 望成为基因诊断和个体化用药分析的首选技术平台。
实时荧光定量PCR——TaqMan探针法及设计原则
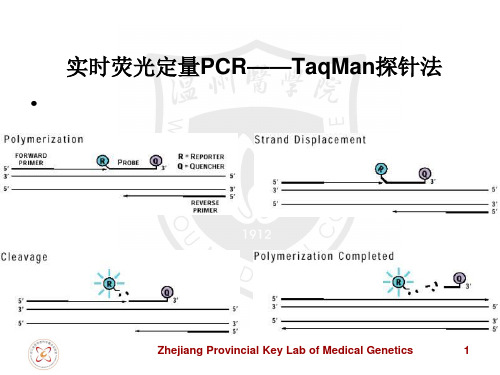
Taqman MGB 探针设计
• 探针的5’端避免出现G,即使探针水解为单个碱基,与报
告基团相相连的G碱基仍可淬灭基团的荧光信号。
• Tm值应为65-67℃。 • • 尽量缩短Taqman MGB探针,但探针长度不少于13bp。 尽量避免出现重复的碱基,尤其是G碱基,应避免出现4 个或4个以上的G重复出现。 • 原则上MGB探针只要有一个碱基突变,MGB探针就会检 测到(MGB探针将不会与目的片段杂交,不产生荧光信号)。
1
TaqMan技术引物设计原则
• 序列选取应在基因的保守区段; • 避免引物自身或与引物之间形成4个或4个以上连续配对, 避免引物自身形成环状发卡结构; • 典型的引物18到24个核苷长。引物需要足够长,保证序 列独特性,并降低序列存在于非目的序列位点的可能性。 • Tm值在55-65℃,GC含量在40%-60%; • 引物之间的TM相差避免超过2℃; • 引物的3’端避免使用碱基A,引物的3’端避免出现3个或3 个以上连续相同的碱基; • 为避免基因组的扩增,引物设计最好能跨两个外显子; • Taqman探针技术要求片段长度在50bp-150bp; • 引物末端(最后5个核苷酸)不能有超过2个的G和C。
Zhejiang Provincial Key Lab of Medical Genetics 4
尽量缩短t尽量缩短taqmanmgb探针但探针长度不少于13bpmgb探针但探针长度不少于13bzhejiangprovincialkeylabofmedicalgenetics4??尽量避免出现重复的碱基尤其是g碱基应避免出现4个或4个以上的g重复出现
实时荧光定量PCR——TaqMan探针法
实时荧光Taqman 探针设计

一、实时荧光Taqman 探针设计总原则:探针选择要保守,引物选择要保守,因此必须找一段100-200bp相对要保守的片段来设计引物与探针。
即real-time PCR的扩增片段是50bp----150bp。
当找不到150bp的保守片段时,必须确保探针的片段是保守的。
在设计探针和引物时,要同时考虑在两条链上设计引物与探针。
但要注意的是:在那条链上设计探针时,就应靠近在同一条链上设计的引物(即上游引物)。
这样,可保证在将来扩增时,即便没有完全扩增,也有荧光信号报告出来。
两者的距离最好是探针的5’端离上游引物的3’有一个碱基,但也可以重叠。
若在原序列中找不到合适的探针与引物(1主要是探针和上游引物的距离太远,而离下游引物的距离却较近时;2突变位点要求在探针的5’ 端也能检测到荧光信号,但却是在3’端),可在互补的序列中设计引物与探针。
另real-time PCR中的探针和引物的Tm值,均要高于平常PCR的引物和杂交的探针的Tm 值。
二、探针的设计探针设计的基本原则:1.保守:探针要绝对的保守,有时分型就单独依靠探针来决定。
理论上有一个碱基不配对,就可能检测不出来。
若找不到完全保守的片段,也只能选取有一个碱基不同的片段。
且这个不同的碱基最好在探针的中间,对探针与目的片段的杂交影响不大,不相同的碱基最好不要在两端,因为两端不利于探针的杂交。
且最好为A或T,而不能为G或A,因为A、T为双键,而G、A为三键。
2.探针长度Taqman探针的长度最好在25-32bp之间,且Tm值在68-72℃之间,最好为70℃,确保探针的Tm值要比引物的Tm值高出10℃,这样可保证探针在煺火时先于引物与目的片段结合。
因此探针最好是富含GC的保守片段,保证其的Tm值较高。
现在有Taqman MGB探针,在TAMER之后再标记一个MGB,可使探针的Tm值较高,即使探针片段较短,也可达到Taqman探针的Tm值要求(68-70℃)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实时荧光定量 PCR技术原理与应用
聚合酶链式反应 ( PCR) 可对特定核苷酸片断进行指数级的扩增。
在扩增反应结束之后,我们可以通过凝胶电泳的方法对扩增产物进行定性的分析,也可以通过放射性核素掺入标记后的光密度扫描来进行定量的分析。
无论定性还是定量分析,分析的都是 PCR 终产物。
但是在许多情况下,我们所感兴趣的是未经 PCR 信号放大之前的起始模板量。
例如我们想知道某一转基因动植物转基因的拷贝数或者某一特定基因在特定组织中的表达量。
在这种需求下荧光定量 PCR 技术应运而生。
所谓的实时荧光定量 PCR 就是通过对 PCR 扩增反应中每一个循环产物荧光信号的实时检测从而实现对起始模板定量及定性的分析。
在实时荧光定量 PCR 反应中,引入了一种荧光化学物质,随着 PCR 反应的进行, PCR 反应产物不断累计,荧光信号强度也等比例增加。
每经过一个循环,收集一个荧光强度信号,这样我们就可以通过荧光强度变化监测产物量的变化,从而得到一条荧光扩增曲线图 ( 如图 1) 。
图 1 实时荧光扩增曲线图
一般而言,荧光扩增曲线扩增曲线可以分成三个阶段:荧光背景信号阶段 , 荧
光信号指数扩增阶段和平台期。
在荧光背景信号阶段,扩增的荧光信号被荧光
背景信号所掩盖,我们无法判断产物量的变化。
而在平台期,扩增产物已不再
呈指数级的增加。
PCR 的终产物量与起始模板量之间没有线性关系,所以根据最终的 PCR 产物量不能计算出起始 DNA 拷贝数。
只有在荧光信号指数扩增阶段, PCR 产物量的对数值与起始模板量之间存在线性关系,我们可以选择在这个阶段进行定量分析。
为了定量和比较的方便,在实时荧光定量 PCR 技术中引入了两个非常重要的概念:荧光阈值和 CT 值。
荧光阈值是在荧光扩增曲线上人为设定的一个值,它可以设定在荧光信号指数扩增阶段任意位置上,但一般我们将荧光域值的缺省设置是 3-15 个循环的荧光信号的标准偏差的10 倍。
每个反应管内的荧光信号到达设定的域值时所经历的循环数被称为 CT 值( threshold value )(如图 2 所示)。
图 2. 荧光定量标准曲线
CT 值与起始模板的关系研究表明,每个模板的 CT 值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多, CT 值越小。
利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表 Ct 值(如图 3 所示)。
因此,只要获得未知样品的 Ct 值,即可从标准曲线上计算出该样品的起始拷贝数。
图 3 阈值线和 CT 值
荧光探针和荧光染料
实时荧光定量 PCR 的化学原理包括探针类和非探针类两种,探针类是利用与靶序列特异杂交的探针来指示扩增产物的增加,非探针类则是利用荧光染料或者特殊设计的引物来指示扩增的增加。
前者由于增加了探针的识别步骤,特异性更高,但后者则简便易行。
TaqMan 探针
TaqMan 探针是多人拥有的专利技术。
TaqMan 探针是一种寡核苷酸探针,它的荧光与目的序列的扩增相关。
它设计为与目标序列上游引物和下游引物之间的序列配对。
荧光基团连接在探针的5’ 末端,而淬灭剂则在3’ 末端。
当完整的探针与目标序列配对时,荧光基团发射的荧光因与3’ 端的淬灭剂接近而被淬灭。
但在进行延伸反应时,聚合酶的5’ 外切酶活性将探针进行酶切,使得荧光基团与淬灭剂分离。
TaqMan 探针适合于各种耐热的聚合酶,如DyNAzymeTM II DNA 聚合酶( MJ Research 公司有售)。
随着扩增循环数的增加,释放出来的荧光基团不断积累。
因此荧光强度与扩增产物的数量呈正比关系。
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。
